一种噬菌体相关的基因诱导表达系统
1.本发明涉及生物技术领域,尤其涉及噬菌体感染与基因诱导表达领域。
背景技术:
2.基因诱导表达是生物技术领域常见的一种基因控制技术。通过向细菌或者细胞培养系统中添加小分子诱导剂来解除目的基因的受抑制状态,进而激活其表达。比如在lac operon中,通过添加iptg诱导剂解除阻遏蛋白laci对lac启动子的抑制作用,从而启动lacz基因的表达。又比如在核糖开关控制的基因回路中,mrna通过折叠成特殊的二级结构来抑制自身的翻译表达。而对应的配体可以和mrna结合解开其二级结构,启动翻译。所以添加小分子配体可以诱导核糖开关控制的基因表达。
3.这些基因诱导系统虽然可以有效的控制目的基因的表达。但是小分子诱导剂可以在整个培养体系中自由扩散,对体系中所有细菌的诱导表达是同步进行的。
4.在实际应用中(例如环境检测及报告系统),实验者有时希望仅在体系中特定一部分细菌中实现目的基因的表达,且只有在噬菌体感染发生时才表达。由于难以确定培养体系中哪部分细菌被感染,什么时候被感染,此时通过人工添加小分子诱导剂等非特异性的方法难以实现这样的诱导目的。
技术实现要素:
5.为了解决上述问题,本发明一个方面提供一种噬菌体感染相关的基因诱导表达系统,所述基因诱导表达系统包括宿主菌和噬菌体;
6.其中,所述宿主菌中包含目标基因,所述噬菌体中包含调控基因;
7.所述的调控基因为能够在噬菌体感染宿主菌后表达调控因子的基因,所述的调控基因表达获得的调控因子能够特异性调控地目标基因的启动子,或者能够特异性地调控目标基因的表达或表达后的修饰。
8.在本发明的一些技术方案中,调控因子能够特异性地调控目标基因的启动子的启动,所述的调控因子不参与启动子下游基因的转录。
9.在本发明的一些技术方案中,调控因子能够特异性地调控目标基因的表达。
10.在本发明的一些技术方案中,调控因子能够特异性地调控目标基因的表达产物的修饰,使表达产物转变为活性状态。
11.在本发明的一些技术方案中,所述的调控因子为噬菌体内源性基因表达产物,或者为噬菌体外源性基因表达产物。
12.在本发明的一些技术方案中所述调控因子为直接激活目标基因的启动子的调控因子,所述调控因子直接作用于目标基因的启动子;
13.在本发明的一些优选的技术方案中,所述调控因子为σ因子的σf蛋白,调控基因为σ因子的σf基因,且目标基因的启动子采用pf1启动子;
14.在本发明的一些优选的技术方案中,所述调控因子为σ因子的σb蛋白,调控基因为
σ因子的σb基因,且目标基因的启动子采用pb1启动子。
15.在本发明的一些技术方案中,所述调控因子为间接激活目标基因的启动子的调控因子;
16.在本发明的一些优选的技术方案中,所述调控因子为pspf蛋白,调控基因为pspf基因,且目标基因的启动子采用psp启动子。
17.在本发明的一些的技术方案中,所述调控因子为通过抑制能够抑制启动子启动的物质,进而实现启动子的激活,
18.在本发明的一些优选的技术方案中,所述调控因子为piv蛋白,调控基因为giv基因,且目标基因的启动子采用包含上游的基因pspf和下游的基因pspabcde的psp启动子。
19.在本发明的一些的技术方案中,所述宿主菌中不包含与目标基因的启动子竞争调控因子的基因或蛋白。
20.本发明另一个方面提供了一种噬菌体感染相关的基因诱导表达方法,其包括采用本发明上述基因诱导表达系统,将噬菌体加入宿主菌中进行感染和复制。
21.本发明再一个方面提供了一种检测噬菌体感染的方法,其包括以下步骤:
22.1)采用本发明上述基因诱导表达系统,将噬菌体加入宿主菌中进行感染和增殖,
23.2)检测目标基因的表达水平。
24.本发明再一个方面提供了本发明所述的噬菌体感染相关的基因诱导表达系统的制备方法,其包括如下步骤:
25.i)制备宿主菌;
26.ii)制备噬菌体。
27.在本发明的技术方案中,步骤i)为将目标基因和启动目标基因的启动子克隆到宿主菌内。
28.优选地,步骤i)通过将目标基因和启动目标基因的启动子克隆到诱导表达质粒上,并将诱导表达质粒转入宿主菌内。
29.更优选地,步骤i)中还包括将宿主菌染色体上的竞争性抑制调控因子的基因敲除的步骤。
30.更优选地,步骤i)中还包括将辅助质粒转入宿主细胞的步骤。更优选地,所述的辅助质粒通过将的基因缺陷型噬菌体中缺失的基因克隆到质粒。
31.在本发明的技术方案中,步骤ii)为将调控基因克隆到噬菌体内,所述调控基因在噬菌体感染宿主菌后表达调控因子。
32.优选地,将噬菌体内的部分基因敲除,制成基因缺陷型噬菌体。
33.本发明再一个方面提供了本发明所述的噬菌体感染相关的基因诱导表达系统的用途,所述用途为噬菌体感染相关的基因诱导表达系统用于检测噬菌体感染宿主菌的时间或用于特异性识别已经被噬菌体感染的宿主菌。
34.本发明再一个方面提供了本发明所述的噬菌体感染相关的基因诱导表达系统的用途,所述用途为提供在目标细胞中表达目标蛋白的用途,所述的目标细胞为被所述噬菌体感染的细胞,所述的目标蛋白为宿主菌中的目标基因表达的蛋白。
35.在本发明的技术方案中,所述目标基因为任意希望进一步转录或表达的基因。在一个具体实施方案中为报告基因。在一个具体实施方案中,目标基因为进一步串联了报告
基因的基因。在本发明的具体技术方案中,报告基因优选为以下蛋白或多肽的基因:绿色荧光蛋白(gfp)、生物素信号传导肽、蓝色荧光蛋白(bfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)。在一个具体实施方案中,当用于检测目标基因表达时,如果目标基因为报告基因或串联了报告基因,可以通过常规方法检测报告基因表达得到的蛋白,例如光学检测手段。如果目标基因中不包含报告基因,也可以采用其他检测蛋白的手段检测目标蛋白的表达,例如rt-pcr或者western bloting等。在一个具体实施方案中,所述的目标基因为仅转录rna的基因。
36.在本发明的技术方案中,所述目标基因位于宿主菌染色体上和或宿主菌携带的质粒上。
37.在本发明的一些技术方案中,所述目标基因位于宿主菌携带的质粒上时,其宿主菌染色体上不包含目标基因的启动子的。
38.在本发明的一些技术方案中,所述目标基因位于宿主菌染色体上时,其宿主菌携带的质粒上不包含目标基因的启动子的。
39.在本发明的技术方案中,所述目标基因的启动子选自诱导型启动子,所述诱导型启动子通过调控因子进行调控启动。所述目标基因及其启动子位于宿主细胞内,优选位于宿主细胞的诱导表达质粒中。在本发明的具体方案中,所述目标基因的启动子是宿主菌的内源性启动子或外源性启动子,且所述启动子能够在宿主菌中启动。在本发明的具体方案中,所述目标基因的启动子仅在宿主细胞的诱导表达质粒中。在本发明的具体方案中,所述目标基因的启动子不存在于宿主细胞的诱导表达质粒以外的染色体中。
40.在本发明中,所述的调控因子是一种蛋白、多肽或rna。在一个具体的实施例中,所述的调控因子用于激活或抑制启动子的启动,但不参与下游基因的转录。在本发明中,所述的调控因子不参与启动子下游基因的转录和蛋白的表达。在本发明中所述的调控因子激活启动子下游基因的表达有多种表达方式,例如,直接激活目标基因的启动子,例如本发明中的方案s5、s6和s7,采用了直接表达σ因子的σb或σf,σb或σf作为调控因子直接作用于启动子pb1或pf1,并启动了启动子pb1或pf1。或者间接激活目标基因的启动子,所述间接激活目标基因的启动子是指通过激活能够激活启动子的物质,进而实现启动子的激活,例如本发明中的方案s3中,采用了先表达pspf蛋白,即一种atp水解酶,该水解酶通过水解atp提供能量,进而启动psp下游基因的表达。再或者通过抑制能够抑制启动子启动的物质,进而实现启动子的激活,例如通过表达调控因子piv蛋白,piv蛋白通过抑制抑制因子pspa蛋白,进而启动psp启动子。
41.在本发明的技术方案中,所述的调控基因为直接表达调控因子的基因。其中,“直接表达调控因子的基因”是指噬菌体感染宿主菌后在复制过程中,通过表达产生调控因子的基因。
42.在本发明优选的实施方案中,所述诱导型启动子选自psp启动子(seq id no:1)、pf1启动子(seq id no:12)、pb1启动子(seq id no:15)。
43.在本发明优选的实施方案中,所述调控因子选自σ因子的σb蛋白、σ因子的σf蛋白、pspf蛋白;其中,优选地,表达σ因子的σf蛋白的基因为seq id no:10,表达σ因子的σb蛋白的基因为seq id no:14;。
44.在本发明优选的实施方案中,目标基因的启动子为psp启动子(seq id no:1),而
调控因子选自pspf蛋白。
45.在本发明优选的实施方案中,目标基因的启动子为pf1启动子(seq id no:12),而调控因子选自σ因子的σf蛋白。
46.在本发明优选的实施方案中,目标基因的启动子为pb1启动子(seq id no:15),而调控因子选自σ因子的σb蛋白。
47.在本发明的一些技术方案中,所述的宿主菌选自能够被噬菌体感染的宿主菌。在本发明一些优选的实施例中,所述的宿主菌选自大肠杆菌、志贺氏菌书、巴斯德菌属的细菌。本发明一些优选的实施例中,所述的噬菌体选自丝状噬菌体、有尾噬菌体。在本发明一个优选的实施例中,所述的宿主菌为大肠杆菌,且大肠杆菌中包含f质粒。在本发明一个优选的实施例中,宿主菌为大肠杆菌,噬菌体为m13噬菌体、λ噬菌体。在本发明一个优选的实施例中,宿主菌选自包含f质粒的细菌,噬菌体为m13噬菌体。
48.在本发明的一些技术方案中,所述的宿主菌中包含诱导表达质粒,所述诱导表达质粒上包含目标基因以及启动目标基因的启动子。在一个优选的实施例中,当系统内的噬菌体为基因缺陷型噬菌体所述宿主菌中还携带有帮助基因缺陷型噬菌体进行感染增殖的辅助质粒,所述辅助质粒中包含基因缺陷型噬菌体进行感染增殖必须的且缺失的基因。
49.在本发明的一些技术方案中,所述的噬菌体为温和噬菌体或烈性噬菌体。
50.在本发明的一些技术方案中,所述的噬菌体为完整的噬菌体。所述完整的噬菌体指没有缺失自身基因的噬菌体。
51.在本发明的一些技术方案中,所述的噬菌体为基因缺陷型噬菌体,且所述宿主菌中还携带有帮助基因缺陷型噬菌体进行感染增殖的辅助质粒。所述基因缺陷型噬菌体中缺失的基因在辅助质粒上表达。
52.有益效果
53.1)本发明提供了一种以噬菌体感染相关的诱导表达系统,该表达系统首次以噬菌体感染作为诱导因素,诱导特异性的启动子启动下游目标基因的表达,进而实现特定宿主菌(即被噬菌体感染的)中的目标基因或信号基因的表达。本发明的方法不仅实现了目标蛋白或信号蛋白的表达,而且实现了特定宿主菌中的目标蛋白或信号蛋白的表达,使得同一培养系统中的宿主菌基于是否被噬菌体感染而进行区别。
54.2)本发明发现了在本发明的系统中,可以通过多种途径降低本底,和或增加特异性的诱导表达。例如本发明通过敲除宿主菌染色体中的调控因子竞争性位点,实现特异性诱导表达强度的增加。又例如本发明通过采用宿主菌的外源性基因作为调控基因,实现了保持低本底的同时增加特异性诱导表达效果。
附图说明
55.以下结合附图对本发明进行说明:
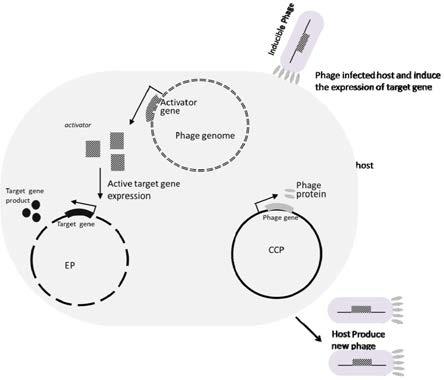
56.图1是携带调控基因的噬菌体诱导目的基因表达的示意图。
57.图2是psp operon示意图。(a)psp operon基因在染色体上的排列。(b)位于pspa与pspf之间的psp启动子示意图。(c)psp operon激活示意图。pspf为atp水解酶,为转录提供能量。pspf的活性被pspa所抑制。pspb和pspc组合成pspbc可以接收piv的信号并呈递给pspa,使其解除对pspf的抑制。ihf使dna弯曲,促进pspf和σ因子结合dna。
58.图3是实现方案s1、s2的质粒与噬菌体图谱。(a)质粒ep1_pspsfgfp图谱,(b)噬菌体ip1_spt7图谱,(c)质粒ccp1-174t7图谱,(d)质粒ep2_pspaesfgfp图谱。
59.图4是实现方案s3、s4和s5的质粒与噬菌体图谱。(a)噬菌体ip2_spt7f的图谱,(b)噬菌体ip3_spf的图谱,(c)质粒ccp2-174t7iiv图谱。(d)噬菌体ip4_spfs图谱,(e)质粒ep3_pf1sfgfp图谱。
60.图5是实现方案s6和s7的质粒与噬菌体图谱。(a)质粒ep4_pb1sfgfp图谱,(b)噬菌体ip5_spb图谱,(c)噬菌体ip6_spt7fs图谱。
61.图6是方案s1、s2、s3、s4中携带调控基因的噬菌体特异性诱导目的基因表达的荧光检测结果。
62.图7是方案s1、s2、s5、s6、s7中携带调控基因的噬菌体特异性诱导目的基因表达的荧光检测结果。
具体实施方式
63.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
64.如图1所示,本发明提供一种噬菌体相关的基因诱导表达系统,使目的基因的表达与噬菌体感染活动相互关联。其特征在于所述噬菌体ip(inducer phage)携带调控基因,在感染后可以特异性的激活诱导表达质粒ep(inducible expression plasmid)上目的基因的表达。所述噬菌体可以是完整的噬菌体(除了携带调控基因外,噬菌体没有缺失自身基因),也可以是缺失部分基因的基因缺陷型噬菌体。所述“基因缺陷型噬菌体”则是指缺失了一部分基因的噬菌体或者部分基因没有正常功能的噬菌体。所述基因缺陷型噬菌体缺失的基因或没有正常功能部分基因在宿主染色体或者辅助质粒ccp(complementary component plasmid)上表达。这种缺陷型噬菌体只能在携带辅助质粒的宿主菌中进行感染增殖,可以有效避免对实验环境造成污染。需要说明的是使用缺陷型噬菌体只是一种控制实验室污染的便利手段,而不是实现噬菌体相关的基因诱导表达的必需途径。
65.下面以缺失部分基因的m13丝状噬菌体,及其对应的宿主菌和目的基因sfgfp(绿色荧光蛋白)为例对本发明的实验设计与实验方法进行说明。并通过检测单位细菌的相对荧光强度(rfu/od
600
)来分析噬菌体对目的基因的诱导效果。需要说明的是以下内容仅是示例性的,并且其目的仅在于说明本发明的可行性,并不意在限制本发明的保护范围。本发明所述的噬菌体可以是m13噬菌体,也可以是其他任意可培养的噬菌体。另外烈性噬菌体在裂解宿主菌之前亦有完整的基因表达过程,所以烈性噬菌体也适用于本发明。本发明所述的宿主菌可以是天然宿主菌也可以是经过实验室改造后获得易感性的宿主菌。本发明的目的基因可以是sfgfp基因也可以是其他任意需要诱导表达的基因。本发明虽然使用调控基因激活目的基因表达作为展示例,但也可以根据需要使用具有阻遏功能的调控基因来抑制目的基因的表达。
66.本发明所涉及的细菌接合、基因敲除以及质粒构建是本领域的公知技术,并且确定能够获得相应的菌株、质粒和噬菌体。因此本发明的宿主菌、质粒和噬菌体具有可重复性的特征,本领域的技术人员只要按照常规方法即可得到。据此本领域的技术人员应当理解,本发明无需提供菌种保藏和构建方法也能满足充分公开条件。
67.在本发明中为了便于描述,会使用一些符号来表示相应的蛋白质,并加上“基因”一词作为前缀或后缀来表示编码该蛋白质的基因。
68.作为本发明的一个实现方法,可以直接利用大肠杆菌天然的噬菌体诱导激活的操纵子psp operon(phage shock protein operon)来控制目的基因的表达。如图2所示psp operon包含一个双向启动子,位于启动子上游的基因pspf和位于启动子下游的基因pspabcde(基因pspabcde在本发明中用于指代pspa、pspb、pspc、pspd和pspe 5个基因)。pspf为组成型表达的atp水解酶,通过为dna转录提供能量来启动下游基因的表达。pspa是一个抑制因子,能够抑制pspf的水解酶活性使下游基因的转录无法进行。这样psp operon就处于自我抑制状态,只有少量的泄露表达作为本底。m13噬菌体感染宿主菌后,基因giv会表达出piv蛋白。此时pspbc(蛋白pspb与pspc组成的复合物)识别接收piv信号后,能够解除pspa对pspf的抑制作用,使得operon下游基因得以顺利表达。此时giv充当着调控基因的角色。
69.基于psp operon的原理,本发明的一个实现方案s1(system1)将psp operon中的psp启动子(seq id no:1)克隆到诱导表达质粒ep1_pspsfgfp(seq id no:2)上控制目的基因绿色荧光蛋白基因sfgfp的表达(如图3a)。此时sfgfp也是报告基因。如图3b所示,为了构建噬菌体ip,本发明将m13噬菌体上的基因giii(gene iii表达次要衣壳蛋白piii)替换成t7rnap基因(表达t7聚合酶t7rnap),由此得到噬菌体ip1_spt7(seq id no:3)。如图3c所示,将ip1_spt7缺失的基因giii克隆到辅助质粒ccp1-174t7(seq id no:4)上并由t7启动子(seq id no:5)控制其表达。通过细菌接合实验,向大肠杆菌mg1655导入一个f质粒后可以得到一个能够被丝状噬菌体感染的宿主菌fm15,其基因型为f’proa+b+laciqδ(lacz)m15 zzf::tn10(tetr)/λ
–
ilvg
–
rfb-50rph-1attb::kanrδ(lacz)m15。fm15可以支持野生型m13噬菌体感染增殖,但是缺失部分基因的ip1_spt7不能在fm15菌中产生子代噬菌体。用辅助质粒ccp1-174t7和诱导表达质粒ep1_pspsfgfp共转化fm15菌,得到宿主菌host1。host1携带辅助质粒,可以表达基因giii,能够支持缺陷噬菌体ip1_spt7的感染增殖。如图1所示,感染发生时,噬菌体上的调控基因giv表达出piv,进而启动诱导表达质粒ep1_pspsfgfp上的绿色荧光蛋白基因sfgfp的表达。根据实验的需要和实验室条件,任何携带f质粒的大肠杆菌均可以作为宿主菌使用,而不必局限于fm15菌。
70.由于psp operon在宿主菌染色体上只有一个拷贝,pspf和pspabcde等基因的表达水平较低。诱导表达质粒ep1_pspsfgfp上的psp启动子需要和宿主染色体上的psp启动子竞争pspf和pspabcde。这会抑制ep1_pspsfgfp质粒上psp启动子的活性,降低目的基因sfgfp的表达水平和整个诱导系统的可靠性。如图6所示,通过检测被噬菌体感染的host1宿主菌绿色荧光蛋白的相对荧光强度rfu,可以分析出ep1_pspsfgfp上目的基因sfgfp的表达水平。同时通过检测宿主菌菌液在600nm处的光密度值(od
600
),可以知道其菌体的相对浓度变化。对比单位宿主菌的相对荧光强度(rfu/od
600
),可知此时的s1方案诱导表达质粒上的荧光基因基本没有被诱导表达(图6)。
71.作为s1的一个改进方案s2,如图3d所示,本发明把psp operon中的psp启动子连同pspabcde基因一起克隆到诱导表达质粒上,控制sfgfp基因的表达。得到的新诱导表达质粒为ep2_pspaesfgfp(seq id no:6)。ep2_pspaesfgfp与ccp1-174t7共转化fm15菌,得到宿主菌host2。方案s2与s1使用相同的ip1_spt7和ccp1-174t7,但s2拥有更多拷贝的pspabcde基
因,因此其诱导表达质粒ep2_pspaesfgfp对ip1_spt7的诱导具有更强的响应效果。但s2方案中ep2_pspaesfgfp的本底表达也更高。(图6)
72.如图2所示,psp operon要完成目的基因的诱导表达,需要通过噬菌体感染,表达出蛋白piv,pspbc识别piv信号,之后pspbc再解除pspa对pspf的抑制作用。如此pspf才可以开始启动psp operon下游基因的表达。整个诱导回路较长。而在基因的表达调控中,基因回路越长其响应时间也越长,相应的表达调控效率也越低。对此的一个改进方法是,去除psp operon诱导表达过程的中间步骤,直接由噬菌体携带的调控基因启动psp启动子。
73.做为s1的另一个改进方案s3,本发明将宿主菌fm15中的整个psp operon从染色体中敲除,得到fm20菌。同时将pspf基因直接作为调控基因插入噬菌体ip1_spt7基因组上,得到一个如图4a所示,可以表达调控基因pspf的新噬菌体ip2_spt7f(seq id no:7)。ep1_pspsfgfp与ccp1-174t7共转化fm20菌,得到宿主菌host3。方案s3不需要宿主host3提供psp operon的调控蛋白,由ip2_spt7f直接表达调控基因pspf,启动诱导表达质粒ep1_pspsfgfp中荧光蛋白sfgfp的表达。它不需要与宿主竞争,并且基因回路更加简洁。s3方案中的ip2_spt7f噬菌体可以较好的诱导目的基因表达,同时整个系统的目的基因本底表达水平更低,具有更好的特异性诱导表达效果。(图6)
74.方案s1,s2,s3构建缺陷噬菌体时将m13噬菌体基因giii从噬菌体基因组中敲除,并在辅助质粒ccp1-174t7中重新表达基因giii,以支持缺陷噬菌体ip1_spt7、ip2_spt7f的感染增殖。用于构建缺陷噬菌体的基因除了基因giii外,也可以是噬菌体基因组上的其它基因。
75.作为本发明的另一个实现方案s4,本发明进一步将已经缺失giii基因的ip1_spt7噬菌体的另外3个基因gii、gv和gx也一起敲除,同时将宿主菌的pspf基因作为调控基因克隆到一共敲除了4个基因的噬菌体上,得到新的缺陷噬菌体ip3_spf(seq id no:8)(图4b)。敲除的4个噬菌体基因则由辅助质粒ccp2-174t7iiv(seq id no:9)(图4c)表达,以支持噬菌体ip3_spf感染增殖。ccp2-174t7iiv与ep1_pspsfgfp共转化fm20菌,得到宿主菌host4。在ccp2-174t7iiv的帮助下,ip3_spf感染host4并表达pspf基因,从而启动ep1_pspsfgfp质粒上的sfgfp基因表达。其诱导激活效果和s3没有明显区别。(图6)
76.如图6所示,对于噬菌体携带调控基因giv或pspf,激活psp启动子并诱导目的基因表达的三个方案s1、s2和s3:s1方案没有诱导效果;s2方案在获得较强诱导效果时,系统的本底表达也很高,系统变的不严谨;改进方案s3和s4在维持较低本底表达时,具有较强的特异性诱导表达效果,整体更加严谨可靠。
77.除了宿主基因和噬菌体自身基因,噬菌体ip上携带的调控基因也可以是来自其它生物基因组的异源基因。作为本发明的另一个实现方案s5,用来源于芽孢杆菌bacillus subtilis 168菌株的σ因子σf基因替换ip3_spf噬菌体携带的pspf基因,得到一个可以表达异源σ因子σf(seq id no:10)的新噬菌体ip4_spfs(seq id no:11)(图4d)。同时用σf特异识别的启动子pf1(seq id no:12)代替ep1_pspsfgfp中的psp启动子,得到新的诱导表达质粒ep3_pf1sfgfp(seq id no:13)(图4e)。ip4_spfs与ip3_spf缺失的噬菌体基因相同,只是携带不同的调控基因,它们使用相同的辅助质粒ccp2-174t7iiv。ccp2-174t7iiv与ep3_pf1sfgfp共转化fm15菌得到宿主菌host5。ip4_spfs感染host5后,自身携带的σf基因表达,并特异性地启动ep3_pf1sfgfp上的目的基因sfgfp表达。σf具有比pspf更强的特异活性,其
诱导激活目的基因表达的能力更强,同时其对应的启动子pf1控制的目的基因在大肠杆菌中保持着极低的本底表达水平。(如图7)
78.作为本发明的另一个实现方案s6,可以使用芽孢杆菌的b.subtilis 168的σ因子σb(seq id no:14)基因替换σf基因,用启动子pb1(seq id no:15)代替pf1。得到新的噬菌体ip5_spb(seq id no:16)(图5b)和诱导表达质粒ep4_pb1sfgfp(seq id no:17)(图5a)。ccp2-174t7iiv与ep4_pb1fgfp共转化fm15菌得到host6。ip5_spb感染host6以后,可以看到与方案s5相似的sfgfp目的基因特异性诱导表达效果。(如图7)
79.作为本发明的另一个实现方案s7,用芽孢杆菌的b.subtilis 168的σ因子σf基因替换ip2_spt7f噬菌体携带的pspf基因,得到一个可以表达异源σ因子σf的新噬菌体ip6_spt7fs(seq id no:18)(图5c)。ip6_spt7fs与ip4_spfs均表达σf因子,使用共同的ep3_pf1sfgfp。其差别在于ip6_spt7fs的基因组只缺失了一个基因giii,而ip4_spfs缺失了4个基因。ccp1-174t7和ep3_pf1sfgfp共转化fm15菌得到宿主菌host7。ip6_spt7fs感染host7后,自身携带的σf基因表达,并特异性地启动ep3_pf1sfgfp上的目的基因sfgfp表达。如图7所示,在保持和方案s5相当的低本底的同时,s7方案获得了最强的特异性诱导表达效果。
80.以下通过具体的实施例来说明本发明的可行性。
81.实施例1噬菌体ip1_spt7的制备
82.1)将ccp1-174t7转化fm15菌得到的宿主菌host8制备成感受态细胞备用。
83.准备一个10cm的无抗性lb固体培养平板备用。
84.准备含0.6%(w/v)琼脂和15μg/ml四环素、50μg/ml羧苄青霉素的lb半固体培养基,50℃预热备用。
85.2)将宿主菌host8单克隆在含15μg/ml四环素、50μg/ml羧苄青霉素的lb液体培养基中过夜培养。培养条件为37℃,200rpm。
86.3)将过夜培养的宿主菌host8在37℃预热的相同培养基中稀释100倍,相同条件继续活化培养至对数期od
600
≈0.3。(使用1cm比色皿检测)
87.4)将对数期宿主菌host8继续用37℃预热的相同培养基稀释20倍,相同条件继续活化培养至对数期od
600
≈0.3。(使用1cm比色皿检测)
88.5)在活化host8同时,将6fmol通过分子克隆拼接好的ip1_spt7噬菌体基因组dna与100μl host8电转感受态细胞混匀后转入预冷的电击杯,进行电击转化。(bio-rad165-2100电穿孔仪,电压为1.8kv)
89.6)用1ml新鲜的无抗性lb液体培养基,将电击杯中的host8重悬至1.5ml离心管中。37℃,200rpm,活化培养1h.
90.7)向4ml预备好的lb半固体培养基中加入20μl活化培养的电击细菌和200μl“步骤4”中活化至对数期的宿主菌host8,混匀后涂布在预备好的固体培养平板上,制成双层平板。平板室温静置30min,待双层平板凝固后于37℃生化培养箱过夜倒置培养。
91.8)第二天可以在双层平板中看到噬菌体ip1_spt7形成的噬菌斑。
92.实施例2噬菌体ip1_spt7扩增。
93.1)将宿主菌host8单克隆在含1%(w/v)caa、0.4%(w/v)葡萄糖、15μg/ml四环素、50μg/ml羧苄青霉素的m9液体培养基中过夜培养,培养条件为37℃,200rpm。
94.2)将过夜培养的宿主菌host8在37℃预热的相同培养基中稀释100倍,相同条件继
续活化培养至对数期od
600
≈0.3。(使用1cm比色皿检测)
95.3)将对数期宿主菌host8继续用37℃预热的相同培养基稀释20倍,相同条件继续活化培养至对数期od
600
≈0.3。(使用1cm比色皿检测)
96.4)将活化好的host8在相同培养基中稀释100倍至2ml体积中。再用接种环将“实施例1”中噬菌体ip1_spt7形成的噬菌斑接种到稀释好的host8宿主菌中,之后37℃,200rpm过夜培养。
97.5)对过夜培养物,12000rpm离心收集上清。上清再用0.22μm的针孔过滤器过滤后得到ip1_spt7噬菌体储存液。噬菌体储存液保存于4℃备用。
98.实施例3噬菌体ip1_spt7滴度测定
99.1)准备8个10cm的无抗性lb固体培养平板备用(平板数量可以根据后续噬菌体稀释梯度增加或者减少)
100.准备含0.6%(w/v)琼脂和15μg/ml四环素、50μg/ml羧苄青霉素的lb半固体培养基,50℃预热备用。
101.2)使用“实施例1”中相同方法将宿主菌host8活化两轮至对数期备用。
102.3)将“实施例2”中得到的噬菌体储存液稀释10
4~11
倍共8个梯度。(具体稀释梯度可以根据实际需要进行增减,但每个梯度需要一个10cm的无抗性lb固体培养平板)
103.4)将稀释好的各梯度ip1_spt7噬菌体各取10μl与200μl对数期的host8宿主菌混合后,加入4ml预备好的lb半固体培养基,混匀后各样品分别涂布在不同固体培养平板上,制成双层平板。室温静置30min,待双层平板凝固后于37℃生化培养箱过夜倒置培养。
104.8)第二天可以在双层平板中看到噬菌体ip1_spt7形成的噬菌斑。统计各稀释梯度下噬菌斑的数量,计算噬菌体滴度。
105.实施例4ip2_spt7f、ip3_spf、ip4_spfs、ip5_spb、ip6_spt7fs噬菌体的制备、扩增与滴度测定
106.1)将ccp2-174t7iiv转化fm15菌得到的宿主菌host9。
107.2)噬菌体ip2_spt7f与ip6_spt7fs的制备、扩增与滴度测定与ip1_spt7相同。将拼接好的ip2_spt7f与ip6_spt7fs噬菌体基因组dna按实施例1、实施例2和实施例3进行操作即可。
108.3)噬菌体ip3_spf、ip4_spfs、ip5_spb的制备、扩增与滴度测定与ip1_spt7相同。但需要将实施例1、实施例2和实施例3中的宿主菌改成host9。将拼接好的噬菌体ip3_spf、ip4_spfs、ip5_spb基因组dna按更换为host9后的实施例1、实施例2和实施例3进行操作即可。
109.实施例5实现方案s1噬菌体ip1_spt7诱导ep1_pspsfgfp质粒中sfgfp基因表达效果的检测
110.1)将携带诱导表达质粒ep1_pspsfgfp与辅助质粒ccp1-174t7的宿主菌host1单克隆在含1%(w/v)caa和0.4%(w/v)葡萄糖的m9液体培养基中过夜培养。培养条件为37℃,200rpm。培养基抗性为15μg/ml四环素、50μg/ml羧苄青霉素和25μg/ml氯霉素。
111.2)将过夜培养的宿主菌host1在37℃预热的相同培养基中稀释100倍,相同条件继续活化培养至对数期od
600
=0.1~0.2。(使用1cm比色皿检测)
112.3)将对数期宿主菌host1继续用37℃预热的相同培养基稀释20倍,相同条件继续
活化培养至对数期od
600
=0.1~0.2。用相同培养基将培养物调整至od
600
=0.1。(使用1cm比色皿检测)
113.4)用相同的m9培养基将噬菌体ip1_spt7稀释至109pfu/ml。将100μl活化好的host1宿主菌和100μl稀释噬菌体ip1_spt7混匀,加入带盖的96孔黑色底透培养板中。对照组加入100μl活化好的host1宿主菌和100μl相同的m9培养基的混合物。空白组加入200μl相同的m9培养基。每组做3个重复。
114.5)将96孔培养板转移到样品台已经预热至37℃的bio-tek synergy h1多功能酶标仪中,边进行震荡培养,边进行荧光和光密度值检测。
115.6)以807cpm的速度,进行37℃条件下的,双轨道连续震荡培养。平板每震荡5min检测一次荧光与光密度值,持续3~4h。
116.荧光为激发光485nm,发射光515nm,增益75条件下的相对荧光值rfu。
117.光密度值为样品在600nm波长下的光密度值od
600
。
118.以上相对荧光值rfu和光密度值od
600
均在96孔培养板上测得。由于测量设备的差异,这些值和利用1cm比色皿获得的测量值之间会存在差异。结果如图6,7所示。
119.实施例6实现方案s2、s3、s4、s5、s6和s7噬菌体诱导ep质粒中sfgfp基因表达效果的检测
120.1)实现方案s2、s3、s4、s5、s6和s7中的噬菌体诱导ep质粒中sfgfp基因表达效果的检测与实现方案s1相同。将“实施例5”中宿主菌host1和噬菌体host1更换成各实现方案所述的噬菌体和对应的宿主菌后,既可以按照“实施例5”所述方法进行检测,噬菌体和宿主菌的选择见下表1。
121.检测结果如图6,7所示,s1方案没有诱导效果。s2方案在获得较强诱导效果时,系统的本底表达也很高,系统变的不严谨。改进方案s3,s4在维持较低本底表达时,具有较强的特异性诱导表达效果,整体更加严谨可靠。通过方案s1-s4的结果对比可知,只要能够实现足够多的调控因子作用于目标基因的启动子,且调控因子和目标基因具有特异性,则可以实现以噬菌体感染为诱发条件的,对感染噬菌体的宿主细胞中目标基因的特异性调控。方案s3和s4证实了噬菌体缺失的基因只要能够在宿主细胞中表达,即可完成噬菌体的感染复制和组装,换言之,噬菌体是完整噬菌体还是基因缺陷型噬菌体均不会对噬菌体感染引发调控基因表达调控因子,并作用于启动子产生影响。
122.使用异源σ因子作为调控基因的方案s5、s6、s7具有比s1、s2、s3更强的特异性诱导表达效果。并且方案s5、s6、s7在获得更强诱导表达效果时,能够维持和方案s3与s4一样的低本底,整体更加稳定可靠。s5、s6、s7的方案证明了,只要实现本发明的方案中,只要调控因子和启动子具有特异性,且噬菌体的感染可以引发调控因子的表达即可实现本发明的效果,而不局限于噬菌体内源性基因。现有技术中具有上述功能的调控因子和启动子对都可以用于本发明技术方案中。
123.2)以上各实现方案所述的噬菌体和对应的宿主菌如下表1所示:
124.表1实现方案与噬菌体、宿主菌列表
[0125][0126]
其中上表1中的各缩写为:
[0127]
ip1_spt7代表:m13噬菌体上的基因giii(gene iii表达次要衣壳蛋白piii)替换成t7rnap基因(表达t7聚合酶t7rnap)所得的噬菌体。
[0128]
ip2_spt7f代表:在噬菌体ip1_spt7基因组上插入调控基因pspf基因所得的噬菌体。
[0129]
ip3_spf代表:在噬菌体ip1_spt7基因组上敲除gii、gv和gx基因,并插入调控基因pspf基因所得的噬菌体。
[0130]
ip4_spfs代表:将噬菌体ip3_spf基因组上携带的pspf基因替换为芽孢杆菌bacillus subtilis 168菌株σ因子的σf基因所得的噬菌体。
[0131]
ip5_spb代表:将噬菌体ip4_spfs基因组上携带的芽孢杆菌的b.subtilis 168的σ因子σf(seq id no:14)基因替换为σb基因所得的噬菌体。
[0132]
ip6_spt7fs代表:将ip2_spt7f噬菌体携带的pspf基因替换为芽孢杆菌的b.subtilis 168的σ因子σf基因所得的噬菌体。
[0133]
ep1_pspsfgfp代表:包含psp启动子和绿色荧光蛋白基因sfgfp的诱导表达质粒,且psp启动子控制绿色荧光蛋白基因sfgfp的表达。
[0134]
ep2_pspaesfgfp代表:包含psp启动子、pspabcde基因和绿色荧光蛋白基因sfgfp的诱导表达质粒,且psp启动子和pspabcde基因一同控制绿色荧光蛋白基因sfgfp的表达。
[0135]
ep3_pf1sfgfp代表:包含σf特异识别的启动子pf1和绿色荧光蛋白基因sfgfp的诱导表达质粒,且σf特异识别的启动子pf1控制绿色荧光蛋白基因sfgfp的表达。
[0136]
ep4_pb1sfgfp代表:包含σf特异识别的启动子pb1和绿色荧光蛋白基因sfgfp的诱导表达质粒,且σf特异识别的启动子pb1控制绿色荧光蛋白基因sfgfp的表达。
[0137]
ccp1-174t7代表:包含基因giii的辅助质粒。
[0138]
ccp2-174t7iiv代表:包含基因giii、gii、gv和gx的辅助质粒。
[0139]
host1代表:携带诱导表达质粒ep1_pspsfgfp与辅助质粒ccp1-174t7,且包含f质粒的大肠杆菌。
[0140]
host2代表:携带诱导表达质粒ep2_pspaesfgfp与辅助质粒ccp1-174t7,且包含f质粒的大肠杆菌。
[0141]
host3代表:携带诱导表达质粒ep1_pspsfgfp与辅助质粒ccp1-174t7,包含f质粒且敲除宿主中psp操纵子的大肠杆菌。
[0142]
host4代表:携带诱导表达质粒ep1_pspsfgfp与辅助质粒ccp2-174t7iiv,包含f质粒且敲除宿主中psp操纵子的大肠杆菌。
[0143]
host5代表:携带诱导表达质粒ep3_pf1sfgfp与辅助质粒ccp2-174t7iiv,且包含f
质粒的大肠杆菌。
[0144]
host6代表:携带诱导表达质粒ep4_pb1fgfp与辅助质粒ccp2-174t7iiv,且包含f质粒的大肠杆菌。
[0145]
host7代表:携带诱导表达质粒ep3_pf1sfgfp与辅助质粒ccp1-174t7,且包含f质粒的大肠杆菌。
[0146]
以上表述仅用于说明各缩写所代表的噬菌体宿主菌等的组成,而并不用来限定制备方法,例如ip4_spfs噬菌体,其代表m13噬菌体上的基因giii替换成t7rnap基因,插入了调控基因芽孢杆菌bacillus subtilis 168菌株σ因子的σf基因,且敲除gii、gv和gx基因的噬菌体。而并不限定其制备方法一定采用将ip3_spf基因组上携带的pspf基因替换为芽孢杆菌bacillus subtilis 168菌株σ因子的σf基因的方法制备得到的噬菌体。
[0147]
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1