化合物作为或制备多巴胺受体拮抗剂中的应用及拮抗剂
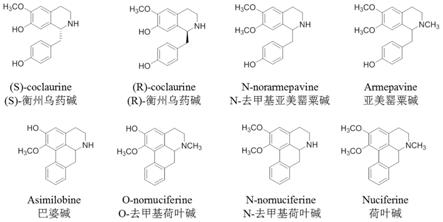
1.本发明涉及植物中靶向活性分子的发现及应用,具体地说是植物莲的干燥叶(荷叶)中,八种多巴胺受体新拮抗剂的发现及应用,所述的多巴胺受体为多巴胺i型受体(d1)和多巴胺ii型受体(d2)。所述的d1受体新天然拮抗剂为:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱;所述的d2受体新天然拮抗剂为:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱和荷叶碱。八种多巴胺新拮抗剂用于包括神经衰弱、健忘、精神分裂、运动性神经疾病、心脑血管疾病、炎症、肥胖/代谢失常等疾病中的一种或两种以上病症的治疗。
背景技术:
2.作为与情绪和运动相关的重要药物靶点,多巴胺受体(dopamine receptors)属于g蛋白偶联受体中a类视紫红质样家族1。纹状体内的多巴胺受体信号传导与一系列精神疾病和免疫相关的病理、生理过程密切相关,如精神分裂2、帕金森氏症
3-4
、注意力缺陷多动障碍5等其他疾病。多巴胺受体主要包括五个亚型(d1~d5),分为两个子类:偶联刺激型gs蛋白的d1样受体(包括d1和d5),和偶联抑制型gi蛋白的d2样受体(包括d2、d3和d4)。两个子类的受体有药理差异,如活性化合物的亲和性。d1和d2在脑内有广泛表达,是治疗精神疾病的主要目标
1,6
。多巴胺类药物(如安非他命(amphetamine)和利他灵(methylphenidate))作为中枢神经系统的激动剂,有助于控制多动和冲动,治疗药物滥用
7-8
。大多数多巴胺拮抗剂被用于精神疾病治疗(如d1特异性的sch233909,d2特异性的氟哌啶醇(haloperidol)和利培酮(risperidone)
10
)和抗癫痫药物(如d2/d3拮抗剂多潘立酮/吗丁啉(domperidone/motilium)
11
)。在过去的几十年里,肥胖逐渐对全球公共卫生构成重大威胁
12
。越来越多的研究发现肥胖与多巴胺系统,特别是与d1和d2两种受体的关系
13
。依考匹泮(ecopipam)是d1/d5拮抗剂,在临床二期和三期实验中观察到药物对给药组体重的有效控制,然而三期实验中引起的精神方面副作用使之不能继续用于体重控制
14
。根据正电子发射断层成像研究,肥胖者的多巴胺神经循环发生变化,可能会影响饮食引起的肥胖症状的发展
15
;但d2表达水平与患者自身身体质量指数(bmi)的关联依然不清晰
16
。在高脂肪饮食喂养的小鼠模型上,纹状体d2的过表达通过减少能量消耗,增加小鼠的肥胖倾向
17
。然而,因为多巴胺活动而增加饮食这一说法仍存在争议。
3.在自然界(动物、植物等)的天然产物中存在着大量有药理活性的天然药物,它们是药物开发中最主要、最有效的来源。天然产物的种类繁多,化学结构丰富,在新药研发中有不可替代的作用和地位。就多巴胺系统来说,多巴胺(dopamine,da)是人类和动物的大脑内天然存在的儿茶酚胺类神经传递物质,调节中枢神经系统的多种生理功能。常春油麻藤中提取的左旋多巴(levodopa)是da的前体药物4;该化合物本身不具备生物活性,进入血脑屏障后转化成da再发挥作用。溴隐亭(bromocriptine)是麦角生物碱,能激活多巴胺受体,用于治疗ii型糖尿病和肥胖
18-19
。自然界中发现的具有多巴胺受体活性的天然化合物帮助
我们了解多巴胺系统(特别是受体)、探索精神相关和免疫相关疾病,并为高活性、高能效的药物研发提供了结构模板。
4.荷叶(folium nelumbinis)是睡莲科植物莲(nelumbo nucifera gaertn.)的干燥叶。莲在我国有三千多年种植和药用的历史,属于传统中药,且药食同源。荷叶的药效包括降脂减肥作用
20
、抑菌作用
21
、抗氧化作用
22-23
、抑制脂肪肝
23
等。生物碱是荷叶的主要成分之一,也是最具药理活性的成分。本发明从荷叶中提取的生物碱成分中寻找新的天然多巴胺受体药物,为神经系统疾病、免疫系统疾病、代谢类疾病及心血管疾病的安全、高效的药物研发奠定基础。
5.目前,关于本发明发现的荷叶中的八种天然生物碱在表达有多巴胺i型或多巴胺ii型受体的细胞模型上的活性与拮抗功能尚未报道。
6.参考文献
7.1.rangel-barajas,c.;coronel,i.;floran,b.,dopamine receptors and neurodegeneration.aging dis 2015,6(5),349-68.
8.2.madras,b.k.,history of the discovery of the antipsychotic dopamine d2receptor:a basis for the dopamine hypothesis of schizophrenia.j hist neurosci2013,22(1),62-78.
9.3.sulzer,d.,multiple hit hypotheses for dopamine neuron loss in parkinson's disease.trends neurosci 2007,30(5),244-50.
10.4.haddad,f.;sawalha,m.;khawaja,y.;najjar,a.;karaman,r.,dopamine and levodopa prodrugs for the treatment of parkinson's disease.molecules2017,23(1).
11.5.lai,t.k.y.;su,p.;zhang,h.;liu,f.,development of a peptide targeting dopamine transporter to improve adhd-like deficits.mol brain 2018,11(1),66.
12.6.van den brink,w.j.;palic,s.;kohler,i.;de lange,e.c.m.,access to the cns:biomarker strategies for dopaminergic treatments.pharm res 2018,35(3),64.
13.7.thomas,m.;rostain,a.;prevatt,f.,adhd diagnosis and treatment in college students and young adults.adolesc med state art rev 2013,24(3),659-79.
14.8.faraone,s.v.,the pharmacology of amphetamine and methylphenidate:relevance to the neurobiology of attention-deficit/hyperactivity disorder and other psychiatric comorbidities.neurosci biobehav rev 2018,87,255-270.
15.9.stubbendorff,c.;hale,e.;cassaday,h.j.;bast,t.;stevenson,c.w.,dopamine d1-like receptors in the dorsomedial prefrontal cortex regulate contextual fear conditioning.psychopharmacology(berl)2019,236(6),1771-1782.
16.10.burry,l.;mehta,s.;perreault,m.m.;luxenberg,j.s.;siddiqi,n.;hutton,b.;fergusson,d.a.;bell,c.;rose,l.,antipsychotics for treatment of delirium in hospitalised non-icu patients.cochrane database syst rev 2018,6,cd005594.
17.11.lencz,l.,the importance of domperidone(motilium)in controlling postoperative nausea and vomiting.ther hung 1990,38(3),106-9.
18.12.bessesen,d.h.;van gaal,l.f.,progress and challenges in anti-obesity pharmacotherapy.lancet diabetes endocrinol 2018,6(3),237-248.
19.13.wang,g.j.;volkow,n.d.;logan,j.;pappas,n.r.;wong,c.t.;zhu,w.;netusil,n.;fowler,j.s.,brain dopamine and obesity.lancet 2001,357(9253),354-7.
20.14.astrup,a.;greenway,f.l.;ling,w.;pedicone,l.;lachowicz,j.;strader,c.d.;kwan,r.;ecopipam obesity study,g.,randomized controlled trials of the d1/d5 antagonist ecopipam for weight loss in obese subjects.obesity(silver spring)2007,15(7),1717-31.
21.15.baik,j.h.,dopamine signaling in food addiction:role of dopamine d2 receptors.bmb rep 2013,46(11),519-26.
22.16.benton,d.;young,h.a.,a meta-analysis of the relationship between brain dopamine receptors and obesity:a matter of changes in behavior rather than food addiction?int j obes(lond)2016,40 suppl 1,s12-21.
23.17.labouesse,m.a.;sartori,a.m.;weinmann,o.;simpson,e.h.;kellendonk,c.;weber-stadlbauer,u.,striatal dopamine 2 receptor upregulation during development predisposes to diet-induced obesity by reducing energy output in mice.proceedings of the national academy of sciences of the united states of america 2018,115(41),10493-10498.
24.18.defronzo,r.a.,bromocriptine:a sympatholytic,d2-dopamine agonist for the treatment of type 2 diabetes.diabetes care 2011,34(4),789-94.
25.19.framnes-deboer,s.n.;bakke,e.;yalamanchili,s.;peterson,h.;sandoval,d.a.;seeley,r.j.;arble,d.m.,bromocriptine improves glucose tolerance independent of circadian timing,prolactin,or the melanocortin-4 receptor.am j physiol endocrinol metab 2020,318(1),e62-e71.
26.20.kim,b.m.;cho,b.o.;jang,s.i.,anti-obesity effects of diospyros lotus leaf extract in mice with high-fat diet-induced obesity.int j mol med 2019,43(1),603-613.
27.21.techaoei,s.;jirayuthcharoenkul,c.;jarmkom,k.;dumrongphuttidecha,t.;khobjai,w.,chemical evaluation and antibacterial activity of novel bioactive compounds from endophytic fungi in nelumbo nucifera.saudi j biol sci 2020,27(11),2883-2889.
28.22.wu,m.j.;wang,l.;weng,c.y.;yen,j.h.,antioxidant activity of methanol extract of the lotus leaf(nelumbo nucifera gertn.).am j chin med 2003,31(5),687-98.
29.23.huang,b.;ban,x.q.;he,j.s.;tong,j.;tian,j.;wang,y.w.,hepatoprotective and antioxidant activity of ethanolic extracts of edible lotus(nelumbo nucifera gaertn.)leaves.food chem 2010,120(3),873-878.
技术实现要素:
30.本发明提供了八个涉及天然产物中多巴胺受体的拮抗剂,其结构如下:
[0031][0032]
本发明还提供了这几种天然化合物对多巴胺i型受体(d1)和多巴胺ii型受体(d2)的活性和功能。荷叶有降脂减肥、抑菌、抗氧化、抑制脂肪肝等作用,常被用于清热解暑、维持体重等方面。目前研究表明,d1和d2在大脑内高表达,对运动功能、学习和记忆、神经内分泌、免疫调节等有调节作用,参与治疗神经衰弱、健忘、精神分裂、运动性神经疾病、心脑血管疾病、炎症、肥胖/代谢失常等疾病。据此,本发明提到的d1和d2的新天然拮抗剂为这些疾病的药物研发提供了候选化合物。
[0033]
化合物作为或制备多巴胺拮抗剂中的应用,多巴胺受体为多巴胺i型受体(d1)或多巴胺ii型受体(d2);所述d1拮抗剂以含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱或荷叶碱;所述d2拮抗剂以含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱或荷叶碱;所述的八种生物碱化合物的结构如下所示:
[0034][0035]
所述拮抗剂还包括有药物学上可接受的载体和/或赋形剂。
[0036]
所述八种化合物(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱在d1上有拮抗活性;d1拮抗剂可作为治疗精神疾病药物、体重控制剂等中的一种或两种以上。
[0037]
所述七种化合物(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱和荷叶碱在d2上有拮抗活性;d2拮抗剂可作为典型抗精神病药物、用于改善胃肠动力、内分泌系统的调控、疼痛调节剂等中的一种或两种以上。
[0038]
所述拮抗剂对d1的拮抗作用的强弱顺序为:o-去甲基荷叶碱》(r)-衡州乌药碱》(s)-衡州乌药碱》n-去甲基亚美罂粟碱》巴婆碱》荷叶碱=亚美罂粟碱》n-去甲基荷叶碱。
[0039]
所述拮抗剂对d2的拮抗作用的强弱顺序为:o-去甲基荷叶碱》(r)-衡州乌药碱》荷叶碱》(s)-衡州乌药碱》亚美罂粟碱》n-去甲基亚美罂粟碱》巴婆碱。
[0040]
所述d1拮抗剂o-去甲基荷叶碱的拮抗活性在细胞水平的ic
50
值为2.09
±
0.65μm;(r)-衡州乌药碱的拮抗活性在细胞水平的ic
50
值为3.58
±
1.07μm;(s)-衡州乌药碱的拮抗活性在细胞水平的ic
50
值为4.00
±
0.63μm;n-去甲基亚美罂粟碱的拮抗活性在细胞水平的ic
50
值为6.92
±
2.00μm;巴婆碱的拮抗活性在细胞水平的ic
50
值为7.20
±
2.15μm;荷叶碱的拮抗活性在细胞水平的ic
50
值为21.76
±
8.74μm;亚美罂粟碱的拮抗活性在细胞水平的ic
50
值为21.79
±
6.70μm;n-去甲基荷叶碱的拮抗活性在细胞水平的ic
50
值为38.47
±
20.14μm。
[0041]
所述d2拮抗剂o-去甲基荷叶碱的拮抗活性在细胞水平的ic
50
值为0.56
±
0.11μm;(r)-衡州乌药碱的拮抗活性在细胞水平的ic
50
值为1.07
±
0.27μm;荷叶碱的拮抗活性在细胞水平的ic
50
值为1.94
±
0.79μm;(s)-衡州乌药碱的拮抗活性在细胞水平的ic
50
值为2.76
±
1.10μm;亚美罂粟碱的拮抗活性在细胞水平的ic
50
值为4.14
±
1.20μm;n-去甲基亚美罂粟碱的拮抗活性在细胞水平的ic
50
值为5.31
±
2.06μm;巴婆碱的拮抗活性在细胞水平的ic
50
值为69.95
±
11.07μm。
[0042]
所述化合物:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱,均来自天然的睡莲科植物莲的干燥叶中,由荷叶中制备获得。
[0043]
多巴胺受体拮抗剂,多巴胺受体为多巴胺i型受体(d1)或多巴胺ii型受体(d2)。
[0044]
所述d1拮抗剂含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱或荷叶碱。
[0045]
所述d2拮抗剂含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱或荷叶碱。
[0046]
化合物结构如下所示:
[0047][0048]
多巴胺受体拮抗剂在制备下属疾病药物中的应用:包括神经衰弱、健忘、精神分裂、运动性神经疾病、心脑血管疾病、炎症、肥胖/代谢失常等疾病中的一种或两种以上病症的治疗药物。
[0049]
多巴胺受体为多巴胺i型受体(d1)或多巴胺ii型受体(d2)。
[0050]
所述d1拮抗剂含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱或荷叶碱。
[0051]
所述d2拮抗剂含有下述物质中的一种或两种以上为活性成分:(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱或荷叶碱;
[0052]
化合物结构如下所示
[0053]
附图说明
[0054]
图1生物碱化合物结构和名称
[0055]
图2八种化合物在细胞上的初步筛选a-化合物预处理的hek293-d1细胞再加入
20nm da引起的rfu信号响应;b-化合物预处理的hek293-d2细胞再加入20nm da引起的rfu信号响应
[0056]
图3八种化合物在hek293-d1细胞上的活性与功能梯度稀释的化合物预处理hek293-d1细胞后,加入20nm da引起的rfu信号拟合的剂量响应曲线a-(s)-衡州乌药碱;b-(r)-衡州乌药碱;c-n-去甲基亚美罂粟碱;d-亚美罂粟碱;e-巴婆碱;f-o-去甲基荷叶碱;g-n-去甲基荷叶碱;h-荷叶碱
[0057]
图4八种化合物在hek293-d2细胞上的活性与功能梯度稀释的化合物预处理hek293-d2细胞后,加入20nm da引起的rfu信号拟合的剂量响应曲线a-(s)-衡州乌药碱;b-(r)-衡州乌药碱;c-n-去甲基亚美罂粟碱;d-亚美罂粟碱;e-巴婆碱;f-o-去甲基荷叶碱;g-n-去甲基荷叶碱;h-荷叶碱。
具体实施方式
[0058]
现结合实例,对本发明做进一步说明。实例更详细的说明本发明,但不以任何形式限制本发明。
[0059]
实施例1:来源于荷叶的生物碱在多巴胺i型受体和多巴胺ii型受体模型上的初步筛选
[0060]
材料:激动探针多巴胺(dopamine,da,货号:kb712097)购于上海思域化工科技有限公司;拮抗剂探针sch23390(货号:d054-10mg)购于sigma-aldrich公司;氟哌啶醇(haloperidol,货号:h0912)购于tci公司。表达d1和d2的细胞株为稳定转染的hek293(human embryo kidney293,人胚胎肾),即分别为hek293-d1和hek293-d2细胞株【转染过程参考文献holmen,s.l.,vanbrocklin,m.w.,eversole,r.r.,stapleton,s.r.,ginsberg,l.c.,1995.efficient lipid-mediated transfection of dna into primary rat hepatocytes.in vitro cell dev-an 31(5),347-351.】。荧光染料(calcium-6)购于molecular devices,掩蔽染料amaranth购于sigma;检测平台为flipr tetra实时荧光成像分析系统(molecular devices),检测信号为钙流荧光强度,用相对荧光单位(relative fluorescence unit,rfu)表示。待测化合物来源于荷叶的八种生物碱(图1)。
[0061]
转染细胞hek293-d1高表达d1受体。激动探针为da,选择性拮抗探针为sch23390。将处于对数生长期的hek293-d1细胞接种于用poly-d-lysine(多聚赖氨酸)涂层的96孔板中,每孔的培养基体积为100μl,接种密度为8.0
×
104个/孔。培养基采用dmem完全培养基:gibco dulbecco's modified eagle medium含有10%胎牛血清,1%青霉素/链霉素双抗,即100ml完全培养基,含有10ml胎牛血清,100μl 100x青霉素/链霉素双抗(青霉素100mg/ml,链霉素50mg/ml)。将接种好的细胞板置于细胞培养箱中37℃培养24小时,进行活性初步筛选实验。
[0062]
活性实验:将培养好的hek293-d1细胞除去培养基并于每孔中加入100μl荧光染料溶液(calcium-6),在37℃下恒温孵育1小时;除去染料溶液并于每孔加入100μl amaranth(0.5mg/ml),室温孵育5分钟。将生物碱样品(分别的八种待测化合物)(在细胞培养体系的最终浓度为100μm)、拮抗探针sch23390(在细胞培养体系的最终浓度为1μm)和空白(control,含0.1%的hbss缓冲液)分别加入a板(即待测样品板,flipr仪器标记的位置为a板),每组3个复孔;在b板(即激动剂药物板,flipr仪器标记的位置为b板)中加入da(在细胞
培养体系的最终浓度为20nm),每3个复孔。采用flipr仪器进行a板和b板的自动加样,每孔50μl,在520nm和488nm波长下进行钙流荧光信号(rfu)检测,并记录信号。参照探针分子da的rfu响应信号强度换算成百分比(rfu%=样品的rfu/探针分子的rfu
×
100%),见图2a。在图2a中,拮抗探针sch23390显著抑制da在hek293-d1细胞的rfu响应;八种生物碱,即(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱,可以显著降低da在hek293-d1细胞的rfu响应,幅度≥80%。
[0063]
转染细胞hek293-d2高表达d2受体。激动探针为da,选择性拮抗探针为氟哌啶醇(haloperidol)。将处于对数生长期的hek293-d2细胞接种于用poly-d-lysine(多聚赖氨酸)涂层的96孔板中,每孔的培养基体积为100μl,接种密度为8.0
×
104个/孔。培养基采用dmem完全培养基:gibco dulbecco's modified eagle medium含有10%胎牛血清,1%青霉素/链霉素双抗,即100ml完全培养基,含有10ml胎牛血清,100μl 100x青霉素/链霉素双抗(青霉素100mg/ml,链霉素50mg/ml)。将接种好的细胞板置于细胞培养箱中37℃培养24小时,进行活性初步筛选实验。
[0064]
活性实验:将培养好的hek293-d2细胞除去培养基并于每孔中加入100μl荧光染料溶液(calcium-6),在37℃下恒温孵育1小时;除去染料溶液并于每孔加入100μl amaranth(0.5mg/ml),室温孵育5分钟。将生物碱样品(分别的八种待测化合物)(在细胞培养体系的最终浓度为100μm)、拮抗探针sch23390(在细胞培养体系的最终浓度为1μm)和空白(control,含0.1%的hbss缓冲液)分别加入a板(即待测样品板,flipr仪器标记的位置为a板),每组3个复孔;在b板(即激动剂药物板,flipr仪器标记的位置为b板)中加入da(在细胞培养体系的最终浓度为20nm),每3个复孔。采用flipr仪器进行a板和b板的自动加样,每孔50μl,在520nm和488nm波长下进行钙流荧光信号(rfu)检测,并记录信号。参照探针分子da的rfu响应信号强度换算成百分比(rfu%=样品的rfu/探针分子的rfu
×
100%),见图2b。在图2b中,拮抗探针haloperidol显著抑制da在hek293-d2细胞的rfu响应;八种生物碱可以显著降低da在hek293-d2细胞的rfu响应,其中(s)-衡州乌药碱、(r)-衡州乌药碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱和荷叶碱,幅度≥80%;n-去甲基亚美罂粟碱和n-去甲基荷叶碱,幅度≥70%。
[0065]
综合化合物在hek293-d1和hek293-d2两个靶点的初步筛选结果,八种荷叶生物碱都具有多巴胺受体拮抗活性,作为定量分析的候选化合物。
[0066]
实施例2:活性化合物对多巴胺i型受体的功能与活性表征
[0067]
将八种生物碱,即(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱,在hek293-d1细胞上进行剂量测试,da作为hek293-d1细胞的激动剂探针分子。将处于对数生长期的hek293-d1细胞接种于用poly-d-lysine(多聚赖氨酸)涂层的96孔板中,每孔的培养基体积为100μl,接种密度为8.0
×
104个/孔。培养基采用dmem完全培养基:gibco dulbecco's modified eagle medium含有10%胎牛血清,1%青霉素/链霉素双抗,即100ml完全培养基,含有10ml胎牛血清,100μl 100x青霉素/链霉素双抗(青霉素100mg/ml,链霉素50mg/ml)。将接种好的细胞板置于细胞培养箱中37℃培养24小时,进行剂量实验。
[0068]
剂量实验:将培养好的细胞除去培养基并于每孔中加入100μl荧光染料溶液(calcium-6),在37℃下恒温孵育1小时;除去染料溶液并于每孔加入100μl amaranth
(0.5mg/ml),室温孵育5分钟。将生物碱样品梯度稀释后加入接种hek293-d1细胞的微孔板a板中,样品在细胞培养体系的最终浓度为100μm,33.33μm,11.11μm,3.70μm,1.23μm,0.41μm,0.14μm和0.05μm,每个浓度3个复孔。将在细胞培养体系内最终浓度为20nm的da加入b板,每3个复孔。采用flipr仪器进行药物板a和b的自动加样,每孔50μl。检测并记录在520nm和488nm波长下的钙流荧光(rfu)信号。
[0069]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物(s)-衡州乌药碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3a),ic
50
值为4.00
±
0.63μm。说明(s)-衡州乌药碱具有hek293-d1拮抗活性。
[0070]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物(r)-衡州乌药碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3b),ic
50
值为3.58
±
1.07μm。说明(r)-衡州乌药碱具有hek293-d1拮抗活性。
[0071]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物n-去甲基亚美罂粟碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3c),ic
50
值为6.92
±
2.00μm。说明n-去甲基亚美罂粟碱具有hek293-d1拮抗活性。
[0072]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物亚美罂粟碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3d),ic
50
值为21.79
±
6.70μm。说明亚美罂粟碱具有hek293-d1拮抗活性。
[0073]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物巴婆碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3e),ic
50
值为7.20
±
2.15μm。说明巴婆碱具有hek293-d1拮抗活性。
[0074]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物o-去甲基荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3f),ic
50
值为2.09
±
0.65μm。说明o-去甲基荷叶碱具有hek293-d1拮抗活性。
[0075]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物n-去甲基荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3g),ic
50
值为38.47
±
20.14μm。说明n-去甲基荷叶碱具有hek293-d1拮抗活性。
[0076]
在hek293-d1细胞培养体系中,加入梯度稀释的化合物荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图3h),ic
50
值为21.76
±
8.74μm。说明荷叶碱具有hek293-d1拮抗活性。
[0077]
综上,八种荷叶生物碱,即(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱,有hek293-d1拮抗活
性,其中活性最高为o-去甲基荷叶碱。
[0078]
实施例3:活性化合物对多巴胺ii型受体的功能与活性表征
[0079]
将八种生物碱,即(s)-衡州乌药碱、(r)-衡州乌药碱、n-去甲基亚美罂粟碱、亚美罂粟碱、巴婆碱、o-去甲基荷叶碱、n-去甲基荷叶碱和荷叶碱,在hek293-d2细胞上进行剂量测试,da作为hek293-d2细胞的激动剂探针分子。将处于对数生长期的hek293-d2细胞接种于用poly-d-lysine(多聚赖氨酸)涂层的96孔板中,每孔的培养基体积为100μl,接种密度为8.0
×
104个/孔。培养基采用dmem完全培养基:gibco dulbecco's modified eagle medium含有10%胎牛血清,1%青霉素/链霉素双抗,即100ml完全培养基,含有10ml胎牛血清,100μl 100x青霉素/链霉素双抗(青霉素100mg/ml,链霉素50mg/ml)。将接种好的细胞板置于细胞培养箱中37℃培养24小时,进行剂量实验。
[0080]
剂量实验:将培养好的细胞除去培养基并于每孔中加入100μl荧光染料溶液(calcium-6),在37℃下恒温孵育1小时;除去染料溶液并于每孔加入100μl amaranth(0.5mg/ml),室温孵育5分钟。将生物碱样品梯度稀释后加入接种hek293-d2细胞的微孔板a板中,样品在细胞培养体系的最终浓度为100μm,33.33μm,11.11μm,3.70μm,1.23μm,0.41μm,0.14μm和0.05μm,每个浓度3个复孔。将在细胞培养体系内最终浓度为20nm的da加入b板,每3个复孔。采用flipr仪器进行药物板a和b的自动加样,每孔50μl。检测并记录在520nm和488nm波长下的钙流荧光(rfu)信号。
[0081]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物(s)-衡州乌药碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4a),ic
50
值为2.76
±
1.10μm。说明(s)-衡州乌药碱具有hek293-d2拮抗活性。
[0082]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物(r)-衡州乌药碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4b),ic
50
值为1.07
±
0.27μm。说明(r)-衡州乌药碱具有hek293-d2拮抗活性。
[0083]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物n-去甲基亚美罂粟碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4c),ic
50
值为5.31
±
2.06μm。说明n-去甲基亚美罂粟碱具有hek293-d2拮抗活性。
[0084]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物亚美罂粟碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4d),ic
50
值为4.14
±
1.20μm。说明亚美罂粟碱具有hek293-d2拮抗活性。
[0085]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物巴婆碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4e),ic
50
值为69.95
±
11.07μm。说明巴婆碱具有hek293-d2拮抗活性。
[0086]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物o-去甲基荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用
nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4f),ic
50
值为0.56
±
0.11μm。说明o-去甲基荷叶碱具有hek293-d2拮抗活性。
[0087]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物n-去甲基荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项无法拟合得到剂量依赖的曲线(图4g)。说明n-去甲基荷叶碱不具有hek293-d2活性。
[0088]
在hek293-d2细胞培养体系中,加入梯度稀释的化合物荷叶碱,恒定浓度的激动探针da加入细胞,产生剂量依赖的rfu响应信号。在graphpad prism 6软件中用nonlinear regression的dose-response inhibition选项拟合得到剂量依赖的曲线(图4h),ic
50
值为1.94
±
0.79μm。说明荷叶碱具有hek293-d2拮抗活性。
[0089]
综上,七种荷叶生物碱,即(s)-衡州乌药碱、(r)-衡州乌药碱、o-去甲基荷叶碱和荷叶碱,有hek293-d2拮抗活性,其中活性最高为o-去甲基荷叶碱。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1