副鸡禽杆菌HA融合蛋白及其三聚体、制备的疫苗组合物、制备方法和应用与流程
副鸡禽杆菌ha融合蛋白及其三聚体、制备的疫苗组合物、制备方法和应用
技术领域
1.本发明涉及副鸡禽杆菌融合蛋白及其三聚体、制备的疫苗组合物、制备方法和应用,属于含有抗原或抗体的医药配制品领域。
背景技术:
2.副鸡禽杆菌(avibacterium paragallinarum,apg)是一种引起鸡急性上呼吸道疾病的致病菌,有a、b、c三个血清型。该病首先发现于波兰和美国,发现后,确认在其他各国经常发生。1980年以来,我国也屡有本病的报道,目前3个血清型均为主要流行血清型。感染后的呼吸道疾病俗称鸡传染性鼻炎(avian infectious coryza,ic),临床上以面部水肿、鼻窦炎、流泪为主要特征,可引起产蛋鸡的产蛋量下降,育成鸡的生长受阻、开产期推迟,肉鸡增重率下降,给养禽业造成巨大的经济损失。apg 3个血清型之间不具有交叉保护力,而且同血清型的不同分离菌株间的保护力也有较大差异。
3.副鸡禽杆菌引起的鸡传染性鼻炎是当前世界范围内严重危害家禽养殖业发展的重要疾病之一。在各种防控措施中,疫苗免疫仍为最重要的措施。目前养禽业中普遍使用全菌灭活疫苗,除对发酵培养的单位体积菌数有着较高的要求,还存在灭活不完全造成的生物安全方面的风险。
4.亚单位疫苗是近几年发展起来的一种比较切实可行的新型基因工程疫苗,副鸡禽杆菌亚单位疫苗研究尝试以ha蛋白为研究对象,然而因为分子量过大,很难在体外实现高效表达,未开发成产品,现有技术中至今未有副鸡禽杆菌亚单位疫苗上市。加上本病的发病特点是潜伏期短、传播迅速,短时间内便可波及全鸡群,因此,临床上急需开发出免疫效果好的亚单位疫苗组合物,能够有效防止该病的流行。
5.在当前产业上,全菌抗原疫苗制备过程中存在的内毒素及细菌碎片,造成的食欲下降、精神萎靡、注射部位肿块等副反应一直存在,尤其不能用于21日龄以下雏鸡,加之肉鸡出栏早,注射部位肿块不能完全吸收,因此全菌抗原疫苗不能施用于低日龄的肉雏鸡。如何解决肉雏鸡早期的副鸡禽杆菌免疫也是临床上亟需解决的问题。
技术实现要素:
6.为解决现有技术的不足,本发明提供一种副鸡禽杆菌融合蛋白、其制备的疫苗组合物,该疫苗组合物能够有效预防和/或治疗副鸡禽杆菌的感染。
7.本发明提供一种副鸡禽杆菌ha融合蛋白,其中,所述副鸡禽杆菌ha融合蛋白由从n端到c端依次排列的副鸡禽杆菌ha蛋白片段和促三聚体结构组成;所述副鸡禽杆菌ha蛋白片段为a型副鸡禽杆菌ha蛋白片段、b型副鸡禽杆菌ha蛋白片段、或c型副鸡禽杆菌ha蛋白片段,所述a型副鸡禽杆菌ha蛋白片段如seq id no.1所示,所述b型副鸡禽杆菌ha蛋白片段如seq id no.2所示、所述c型副鸡禽杆菌ha蛋白片段如seq id no.3所示。
8.本发明使用的副鸡禽杆菌ha蛋白片段具有良好的免疫原性,其制备成疫苗免疫鸡
后较对应的副鸡禽杆菌ha蛋白制备的疫苗具有更好的免疫效果。
9.作为本发明的一种实施方式,所述的副鸡禽杆菌ha融合蛋白中所述促三聚体结构为副鸡禽杆菌ha蛋白c-末端、t4噬菌体纤维蛋白c-末端(t4 phage fibritin foldon trimerization)、酵母转录激活因子gcn4(transcriptional activator gcn4)、或cmp(chicken cartilage matrix protein);所述副鸡禽杆菌ha蛋白c-末端如seq id no.4所示,所述t4噬菌体纤维蛋白c-末端如seq id no.5所示,所述酵母转录激活因子gcn4如seq id no.6所示,所述cmp如seq id no.7所示。
10.作为本发明的一种优选实施方式,所述的副鸡禽杆菌ha融合蛋白中,所述副鸡禽杆菌ha蛋白片段和所述促三聚体结构之间还具有柔性肽段,所述柔性肽段如seq id no.10或seq id no.11所示。
11.本发明所述的副鸡禽杆菌融合蛋白还可以包括柔性连接肽,所述柔性连接肽的长度为4-10个氨基酸序列。柔性连接肽能够使嵌合蛋白具有更佳的亲和力,这主要是由于柔性连接肽增加了结构功能域之间的空间,消除或减少了相邻结构功能域之间的空间物理阻碍作用,增加所述融合蛋白各结构功能域的相对独立性,同时也增加所述融合蛋白各功能区的结构稳定及生物学功能。
12.本发明还提供了一种副鸡禽杆菌ha融合蛋白三聚体,其中,任一所述副鸡禽杆菌ha融合蛋白三聚体的分子由三个所述的副鸡禽杆菌ha融合蛋白的分子三聚化而成。
13.本发明的副鸡禽杆菌ha融合蛋白三聚体,经制备为疫苗后能提供完全保护,且能对低日龄的雏鸡提供完全保护。
14.本发明还提供一种疫苗组合物,其中,所述疫苗组合物包含免疫量的所述副鸡禽杆菌ha融合蛋白三聚体,以及药学上可接受的载体。
15.本发明首次采用副鸡禽杆菌ha蛋白片段和促三聚体结构组成融合蛋白高效表达后,形成三聚体结构,制备疫苗组合物,可预防和/或治疗鸡传染性鼻炎疫情,并且含有该融合蛋白的疫苗组合物免疫动物后能使动物机体快速产生抗体,对当前流行的副鸡禽杆菌单独或混合感染有良好的预防和控制效果,生物安全性好。能提供完全保护,且能对低日龄的雏鸡提供完全保护。
16.作为本发明的一种实施方式,本发明的疫苗组合物中,所述副鸡禽杆菌ha融合蛋白三聚体为a型副鸡禽杆菌ha融合蛋白三聚体和/或b型副鸡禽杆菌ha融合蛋白三聚体和/或c型副鸡禽杆菌ha融合蛋白三聚体。
17.作为本发明的一种实施方式,本发明的疫苗组合物中,所述a型副鸡禽杆菌ha融合蛋白三聚体agp效价≥1:8,所述b型副鸡禽杆菌ha融合蛋白三聚体agp效价≥1:16,所述c型副鸡禽杆菌ha融合蛋白三聚体agp效价≥1:16。
18.作为本发明的一种优选实施方式,本发明的疫苗组合物中,所述a型副鸡禽杆菌ha融合蛋白三聚体agp效价为1:8~1:32,所述b型副鸡禽杆菌ha融合蛋白三聚体agp效价为1:16~1:32,所述c型副鸡禽杆菌ha融合蛋白三聚体agp效价为1:16~1:32。
19.所述a型副鸡禽杆菌ha融合蛋白三聚体agp效价可选自1:8、1:16、1:32。
20.所述b型副鸡禽杆菌ha融合蛋白三聚体agp效价可选自1:16、1:32。
21.所述c型副鸡禽杆菌ha融合蛋白三聚体agp效价可选自1:16、1:32。
22.作为本发明的一种更优选的实施方式,本发明的疫苗组合物中,所述a型副鸡禽杆
菌ha融合蛋白三聚体agp效价为1:8,所述b型副鸡禽杆菌ha融合蛋白三聚体agp效价为1:16,所述c型副鸡禽杆菌ha融合蛋白三聚体agp效价为1:16。
23.作为本发明的一种实施方式,本发明的疫苗组合物中,所述药学上可接受的载体为佐剂,所述佐剂选自:(1)矿物油、铝胶佐剂、皂苷、阿夫立定、dda;(2)油包水乳剂、水包油乳剂、水包油包水乳剂;或(3)丙烯酸或甲基丙烯酸的聚合物、顺丁烯二酸酐和链烯基衍生物的共聚物;以及ribi佐剂系统、block co-polymer、saf-m、单磷酰脂质a、avridine脂质-胺佐剂、大肠杆菌不耐热肠毒素、霍乱毒素、ims1314、胞壁酰二肽、isa 206、gel佐剂中的一种或几种;所述佐剂含量为5%-70%v/v。
24.作为本发明的一种优选实施方式,本发明的疫苗组合物中,皂苷为quil a、qs-21、gpi-0100;所述佐剂含量30%到70%v/v。
25.作为本发明的一种更优选实施方式,本发明的疫苗组合物中,所述佐剂含量为66%v/v。
26.本发明疫苗组合物还可以进一步将其它的试剂加入到本发明的组合物。
27.作为本发明的一种实施方式,所述的药学上可接受的载体包括药物,免疫刺激剂、抗氧化剂、表面活性剂、着色剂、挥发性油、缓冲剂、分散剂、推进剂和防腐剂;所述免疫刺激剂包括α-干扰素、β-干扰素、γ-干扰素、粒细胞巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)和白介素2(il2)。
28.优选地,免疫刺激剂包括α-干扰素、β-干扰素、γ-干扰素、粒细胞巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)和白介素2(il2)。
29.为了制备这样的组合物,可以使用本领域公知的方法。
30.作为本发明的一种实施方式,本发明的疫苗组合物中,所述疫苗组合物还包括下列抗原组成的组中的一种或多种:鸡新城疫病毒抗原、禽流感病毒抗原、传染性支气管炎病毒抗原、鸡传染性法氏囊病病毒抗原、减蛋综合征病毒抗原、禽呼肠孤病毒抗原、大肠杆菌抗原、禽腺病毒抗原、滑液囊支原体、鸡毒支原体抗原、多杀性巴氏杆菌抗原、马立克氏病毒抗原、禽脑脊髓炎病毒抗原、鸡传染性喉气管炎病毒抗原。
31.本发明的疫苗组合物可以含有多种抗原成分,本发明的副鸡禽杆菌ha融合蛋白三聚体可以和多种抗原组成联合疫苗或复和疫苗,以联合疫苗或或复合疫苗的形式免疫,以简化免疫程序。
32.作为本发明的一种优选实施方式,本发明的疫苗组合物中,所述疫苗组合物还包括下列抗原组成的组中的一种或多种:鸡新城疫病毒灭活抗原、禽流感病毒灭活抗原、鸡传染性支气管炎病毒灭活抗原、鸡传染性法氏囊病病毒亚单位抗原、禽腺病毒灭活抗原或亚单位抗原、禽减蛋综合征病毒亚单位抗原。
33.作为本发明的一种更优选实施方式,本发明的疫苗组合物中,所述鸡新城疫病毒灭活抗原为n7a株的全病毒灭活抗原,所述禽流感病毒灭活抗原为hf株的全病毒灭活抗原,所述鸡传染性支气管炎病毒灭活抗原为m41株的全病毒灭活抗原,所述鸡传染性法氏囊病病毒亚单位抗原为鸡传染性法氏囊病病毒vp2蛋白,所述禽腺病毒灭活抗原为fav-hn株的全病毒灭活抗原,所述禽腺病毒亚单位抗原为禽腺病毒penton蛋白或fiber-2蛋白,所述禽减蛋综合征病毒亚单位抗原为禽减蛋综合征病毒tfiber蛋白片段。
34.作为本发明的一种优选实施方式,本发明的疫苗组合物中,所述鸡新城疫病毒灭
活抗原含量为灭活前10
8.0
~10
9.0
eid
50
/0.1ml,所述禽流感病毒灭活抗原含量为灭活前10
6.5
~10
8.5
eid
50
/0.1ml,所述鸡传染性支气管炎病毒灭活抗原含量为灭活前10
6.0
~10
7.0
eid
50
/0.1ml,所述鸡传染性法氏囊病病毒vp2蛋白含量为agp效价1:16~1:128,所述禽腺病毒penton蛋白含量为agp效价1:2~1:16,所述禽腺病毒fiber-2蛋白含量为agp效价1:2~1:16,所述禽减蛋综合征病毒tfiber蛋白片段含量为agp效价1:8~1:32。
35.作为本发明的一种更优选实施方式,本发明的疫苗组合物中,所述鸡新城疫病毒灭活抗原含量为灭活前10
8.0
eid
50
/0.1ml,所述禽流感病毒灭活抗原含量为灭活前10
8.0
eid
50
/0.1ml,所述鸡传染性支气管炎病毒灭活抗原含量为灭活前10
6.0
eid
50
/0.1ml,所述鸡传染性法氏囊病病毒vp2蛋白含量为agp效价1:16,所述禽腺病毒penton蛋白含量为agp效价1:4,所述禽腺病毒fiber-2蛋白含量为agp效价1:4,所述禽减蛋综合征病毒tfiber蛋白片段含量为agp效价1:8。
36.本发明还提供了一种制备所述疫苗组合物的方法,其中,所述方法包括:步骤(1)分别重组、并使用ecoli.表达体系表达所述a型副鸡禽杆菌ha融合蛋白、所述b型副鸡禽杆菌ha融合蛋白、所述c型副鸡禽杆菌ha融合蛋白,所述表达的a型副鸡禽杆菌ha融合蛋白、b型副鸡禽杆菌ha融合蛋白、c型副鸡禽杆菌ha融合蛋白分别三聚化形成a型副鸡禽杆菌ha融合蛋白三聚体、b型副鸡禽杆菌ha融合蛋白三聚体、c型副鸡禽杆菌ha融合蛋白三聚体;步骤(2)将所述步骤(1)所述a型副鸡禽杆菌ha融合蛋白三聚体、所述b型副鸡禽杆菌ha融合蛋白三聚体、所述c型副鸡禽杆菌ha融合蛋白三聚体分别使用非离子表面活性剂处理除去内毒素;以及步骤(3)将所述去除内毒素的a型副鸡禽杆菌融合蛋白三聚体、b型副鸡禽杆菌ha融合蛋白三聚体、c型副鸡禽杆菌ha融合蛋白三聚体与佐剂混匀,得到所述疫苗组合物。
37.本发明的制备所述疫苗组合物的方法,使用了具有良好免疫原性抗原,同时使用内毒素去除技术降低了内毒素,使得肉雏鸡早期也能实现早期免疫,解决了临床上亟需解决的问题。
38.本发明还提供了所述的疫苗组合物在制备预防和/或治疗副鸡禽杆菌感染的药物中的应用。
39.作为本发明的一种实施方式,所述预防和/或治疗副鸡禽杆菌感染的药物为预防和/或治疗21日龄以下肉雏鸡的副鸡禽杆菌感染的药物。
具体实施方式
40.以下,对本发明的实施方式进行说明。
41.定义
42.术语“副鸡禽杆菌”(avibacterium paragallinarum,apg)是鸡传染性鼻炎的病原菌,本菌兼性厌氧,它可以引起急性呼吸道病,主要表现为鼻道和鼻窦内出现大量浆液性或粘液性分泌物、面部水肿和结膜炎。可导致产蛋率、孵化率下降,淘汰率增加,从而造成严重的经济损失。通过平板凝集试验可将副鸡禽杆菌分为a、b、c三个血清型。
43.术语“副鸡禽杆菌ha蛋白片段”即为副鸡禽杆菌血凝素蛋白部分片段,血凝素蛋白是副鸡禽杆菌抗原中的重要成分,也是副鸡禽杆菌分型的基础。
44.术语“副鸡禽杆菌ha蛋白片段的三聚体”即三个相同的副鸡禽杆菌ha蛋白片段聚合成一个蛋白片段,称之为三聚体,是一种低分子量的聚合物。
45.术语“副鸡禽杆菌ha三聚体融合蛋白”由副鸡禽杆菌ha蛋白片段和促三聚体结构组成,其中,促三聚体结构为副鸡禽杆菌ha蛋白c-末端、t4噬菌体纤维蛋白c-末端、酵母转录激活因子gcn4或cmp。
46.术语“副鸡禽杆菌ha蛋白c-末端”类似于taa(trimeric autotransporter adhesin)家族的c端膜锚定区域(membrane anchor domain),由229个氨基酸组成。
47.术语“t4噬菌体纤维蛋白c-末端”又称t4噬菌体纤维蛋白c-末端三聚化序列(t4 phage fibritin foldon trimerization sequence),由27个氨基酸组成,该结构域由3个相同亚基构成,每个亚基包含1个β-发夹结构。
48.术语“酵母转录激活因子gcn4”是通过亮氨酸拉链(leucine zipper)结构结合dna的蛋白质。
49.术语“cmp”即鸡软骨基质蛋白(chicken cartilage matrix protein)。
[0050]“agp效价”又称为“琼脂扩散试验效价(agar gel precipitation(test)titer)”,琼脂扩散试验是一种沉淀反应,抗原、抗体在含有电解质的琼脂凝胶中可以向四周自由扩散,二者相互结合,在最适比例处出现沉淀线,出现沉淀线的最高稀释比例即为效价值,即为标定的抗原或抗体含量。
[0051]“疫苗组合物”指含有副鸡禽杆菌免疫原性的药物组合物,该药物组合物可诱发、刺激或增强鸡只针对副鸡禽杆菌的免疫反应。所述疫苗组合物包括免疫量的副鸡禽杆菌免疫保护性抗原蛋白。
[0052]
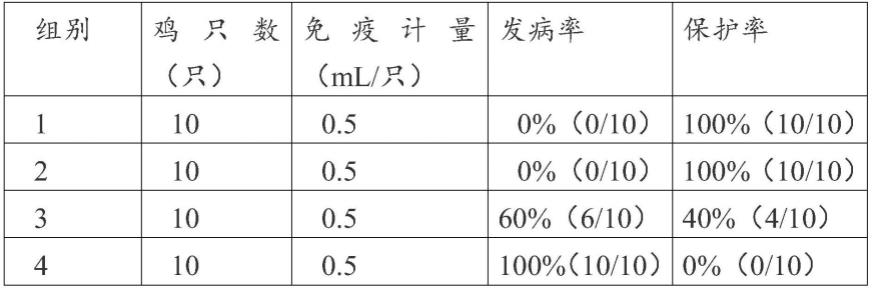
术语“免疫量”应当理解为“免疫有效量”,又称免疫保护量或产生免疫应答的有效量,为可在接受者体内有效诱导免疫应答的抗原量,该量足以预防或改善疾病的体征或症状,包括不利的健康影响或其并发症。所述免疫应答可能足以用于诊断目的或其它试验,或可能适合用于预防疾病的征兆或症状,包括由病原体引起的感染所造成的不利的健康结果或其并发症。体液免疫力或由细胞介导的免疫力或此二者均可被诱导。动物对免疫原性组合物的免疫应答可通过例如测量抗体效价、淋巴细胞增殖分析而间接评估,或在以野生型毒株攻击后通过监测征兆或症状来直接评估,而该由疫苗提供的保护性免疫力可通过测量例如受试者的临床征兆如死亡率、发病率的减少、温度数值、受试者总体生理状况及总体健康和表现来评估。所述免疫应答可包括但不限于诱导细胞性和/或体液免疫力。
[0053]
术语“药学上可接受的载体”是指在本发明疫苗组合物中除抗原之外的其它成分,不刺激机体不阻碍使用化合物的生物学活性和特性的载体或者稀释剂,优选为佐剂。
[0054]
术语“佐剂”是非特异性免疫增强剂,当与抗原一起注射或预先注入机体时,可增强机体对抗原的免疫应答或改变免疫应答类型。
[0055]
佐剂可包括铝胶佐剂;皂苷(saponin),如quil a、qs-21(cambridge biotech incorporation,cambridge ma)、gpi-0100(galenica pharmaceuticals incorporation,birmingham al);油包水乳剂;水包油乳剂;水包油包水乳剂;丙烯酸或甲基丙烯酸的聚合物;顺丁烯二酸酐和链烯基(alkenyl)衍生物的共聚物选出的化合物。术语“乳剂”可尤其基于轻液体石蜡油(european pharmacopea类型);因烯烃寡聚产生的类异戊二烯油(isoprenoid oil),如角鲨烷(squalane)或角鲨烯油(squalene oil),尤其异丁烯或葵烯;酸或醇的含线性烷基的酯,更尤其植物油、油酸乙酯、丙二醇二-(辛酸酯/葵酸酯)、甘油三-(辛酸酯/葵酸酯)或丙二醇二油酸酯;支链脂肪酸或醇的酯,尤其异硬脂酸酯。油与乳化剂
组合使用以便形成乳剂。乳化剂优选非离子表面活性剂,尤其山梨聚糖的酯、二缩甘露醇(mannide)的酯(如无水甘露醇油酸酯)、脂肪族二元醇(glycol)的酯、聚甘油(polyglycerol)的酯、丙二醇的酯以及油酸的酯、异硬脂酸的酯、蓖麻油酸的酯或羟基硬脂酸的酯,它们任选乙氧基化,还有聚氧丙烯-聚氧乙烯嵌段共聚物,尤其pluronic产品,特别是l121。参见hunter等编写的《the theory and practical application of adjuvants》(ed.by des stewart-tull,john wiley and sons,new york,1995:51-94)和todd等编写的《vaccine》(1997,15:564-570)。例如,可使用powell m和newman m编写的《vaccine design,the subunit and adiuvant approach》(plenum press,1995)第147页描述的spt乳剂及第183页描述的mf59乳剂。术语“丙烯酸或甲基丙烯酸的聚合物”优选为交联的丙烯酸或甲基丙烯酸聚合物,尤其是与糖(sugar)的聚链烯基醚或聚醇交联,这些化合物已知被称为卡波姆(carbomer,商品名carbopol)(phameuropa,1996,8(2))。本领域技术人员还可参见美国专利us2909462,其描述了这类丙烯酸聚合物,其与聚羟基化的化合物交联,所述化合物具有至少3个羟基,优选不超过8个,其中至少3个羟基的氢原子被具有至少2个碳原子的不饱和脂烃基(aliphatic radical)取代。优选的基团是那些含有2-4个碳原子的基团,例如乙烯基、烯丙基和其它烯属不饱和基团(ethylenically unsaturated group)。所述不饱和基团自身可包含其它取代基,如甲基。这些产品以卡波普的名义出售,(bf goodrich,ohio,usa)特别合适。它们与烯丙基蔗糖或与烯丙基季戊四醇(allyl pentaerythritol)交联。这其中可提及卡波普974p、934p和971p,最优选使用卡波普971p。术语“顺丁烯二酸酐和链烯基衍生物的共聚物”也可考虑顺丁烯二酸酐与乙烯的共聚物ema(monsanto),这些聚合物在水中溶解产生酸性溶液,经中和,优选中和至生理ph,以便产生佐剂溶液,能向其中掺入免疫原性、致免疫性或疫苗性组合物本身。术语“佐剂”还包括,但不限于,ribi佐剂系统(ribi incorporation)、block co-polymer(cytrx,atlanta ga)、saf-m(chiron,emeryville ca)、单磷酰脂质a(monophosphoryl lipid a)、avridine脂质-胺佐剂、大肠杆菌不耐热肠毒素(重组或其它)、霍乱毒素、ims 1314、胞壁酰二肽、gel佐剂等。优选地,所述佐剂包括铝胶佐剂、皂苷、油包水乳剂、水包油乳剂、水包油包水乳剂、丙烯酸或甲基丙烯酸的聚合物、顺丁烯二酸酐和链烯基(alkenyl)衍生物的共聚物、ribi佐剂系统、block co-polymer、saf-m、单磷酰脂质a、avridine脂质-胺佐剂、大肠杆菌不耐热肠毒素、霍乱毒素、ims 1314、胞壁酰二肽或gel佐剂中的一种或几种。
[0056]
术语“矿物油”别名石蜡油、白色油、白油,矿物油在灭活疫苗中是使用较广的佐剂,具有延缓免疫原在机体内的存留时间,使之持续缓慢释放,增强巨噬细胞的吞噬与杀菌能力。
[0057]
术语“复合疫苗”指细菌和病毒抗原制备的疫苗。例如,本发明的副鸡禽杆菌亚单位抗原可与大肠杆菌抗原组合。
[0058]
术语“联合疫苗”指病毒和病毒抗原制备的疫苗。例如,本发明的副鸡禽杆菌亚单位抗原可与新城疫病毒抗原组合。
[0059]
术语“内毒素”是革兰氏阴性细菌细胞壁中的一种成分,叫做脂多糖。脂多糖对宿主是有毒性的,当细菌死亡溶解或用人工方法破坏菌细胞后释放出来,所以叫做内毒素。
[0060]
本发明所用的术语“预防”指通过给予根据本发明的疫苗组合物抑制鸡传染性鼻炎或推迟疾病发作的所有行为。术语“治疗”指通过给予根据本发明的疫苗组合物使副鸡禽
杆菌感染引起的症状减轻或好转的所有行为。
[0061]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0062]
本发明实例中所用的样品处理液为pbs缓冲液(ph7.4,0.02mol/l),其1l体积pbs缓冲液配方示例为:na2hpo4·
12h2o 5.8g、nah2po4·
2h2o 0.59g,但不限于此配方;若无特殊说明,均用pbs缓冲液稀释。
[0063]
本发明中所用的化学试剂均为分析纯,购自国药集团。本发明所述的实验方法,若无特殊说明,均为常规方法;所述的生物材料,若无特殊说明,均可从商业途径获得。
[0064]
实施例1bl21(de3)-a-gcn4-tha表达工程菌株的构建
[0065]
1.1副鸡禽杆菌a型dna的提取
[0066]
按照病毒dna提取试剂盒说明书,取副鸡禽杆菌a型菌株hn3株(副鸡禽杆菌a型hn3株(avibacterium paragallinarum serotype a strain hn3),已于2015年01月20日保藏于中国典型培养物保藏中心(cctcc),保藏号:cctcc no:m2015051;保藏地址:中国武汉
·
武汉大学,公开于中国专利申请cn106267176a)的纯培养物,挑取若干菌落于100μl无菌双蒸水,煮沸10分钟,冰浴10分钟,12000r/min离心1分钟,取上清作为模板,进行后续实验。
[0067]
1.2a-tha蛋白片段基因扩增
[0068]
根据tha蛋白基因5’和3’末端的保守区序列合成寡聚核苷酸引物,进行pcr。上游引物tha-f如seq id no.8所示,下游引物tha-r如seq id no.9所示。
[0069]
pcr产物送invitrogen公司测序,a-tha蛋白片段氨基酸序列如seq id no.1所示。
[0070]
1.3a-tha融合蛋白表达质粒的构建
[0071]
将seq id no.6所示酵母转录激活因子gcn4基因重组至pet28a载体,并命名为pet28a-gcn4。以副鸡禽杆菌a型tha蛋白pcr产物电泳后使用dna胶回收试剂盒进行纯化,所获得的dna片段使用bamhi和xhoi双酶切后,与相同双酶切处理的pet28a-gcn4质粒进行连接,连接产物转化大肠杆菌dh5α感受态,筛选阳性克隆。使用质粒提取试剂盒提取转化子质粒并进行双酶切鉴定,酶切鉴定正确的质粒进行测序分析,将验证正确的重组质粒命名为pet28a-a-gcn4-tha。
[0072]
1.4bl21(de3)-a-gcn4-tha表达工程菌株的构建
[0073]
将测序正确的重组质粒pet28a-a-gcn4-tha转化至大肠杆菌bl21(de3)感受态中,构建表达工程菌bl21(de3)-a-gcn4-tha。从lb平板(含50μg/ml的卡那霉素)上挑取单菌落,lb液体培养基扩大培养后提取质粒,利用bamhi和xhoi限制性内切酶进行双酶切鉴定,对酶切鉴定正确的质粒进行测序分析。将酶切及测序鉴定正确的菌株保存于-70℃备用。
[0074]
实施例2bl21(de3)-a-gcn4-tha表达工程菌株蛋白表达特性研究
[0075]
2.1a-gcn4-tha蛋白的表达
[0076]
将鉴定正确的表达工程菌划线于lb平板(含50μg/ml卡那霉素)上,37℃培养14小时。挑取单个菌落,接种于3ml lb液体培养基中(含50μg/ml卡那霉素),37℃摇床(220r/min)培养14小时,按照1ml/瓶转接于含100ml lb液体培养基(含50μg/ml卡那霉素)的250ml三角瓶中,摇床(37℃,220r/min)培养4小时,降温至28℃,加入终浓度为0.2mmol/l的异丙
基硫代β-d-半乳糖苷(iptg),继续培养5小时。取培养物于4℃10000r/min离心5分钟,收集菌体,重悬于10ml无菌生理盐水中,冰水浴中超声破碎35分钟,破碎条件为:工作5秒,间歇15秒,超声功率为400瓦。破碎液于4℃,10000r/min离心10分钟后取出上清做后续检测。
[0077]
2.2表达蛋白的效价测定
[0078]
取2.1项中的菌体裂解液上清,使用a型副鸡禽杆菌阳性血清为抗体按常规方法进行agp效价测定。a-gcn4-tha蛋白的agp效价为1:256,内毒素含量为0.56
×
105eu/ml。
[0079]
2.3内毒素的去除
[0080]
1.5ml离心管中加入0.5ml待处理溶液和终浓度为1%(v/v)的曲拉通x-114(triton x-114)(5μl),涡旋振荡。样品在冰上放置5分钟,涡旋振荡冷却的样品后,离心管立即放入37℃水浴中温浴5分钟,使得产生新的两相。然后,把样品在37℃离心60s。离心过后,目的蛋白将留在上层,而含有内毒素的洗涤剂将会以油滴的性状残留在离心管底部。整个操作循环3次。经测定,a-gcn4-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0081]
2.4表达蛋白的鉴定
[0082]
sds-page和western blot结果显示a-gcn4-tha分子量为60kda左右,而非还原sds-page和western blot结果出现分子量为180kda左右的蛋白条带,表明a-gcn4-tha形成了三聚体结构,且可与兔抗apg a型阳性血清发生特异性反应。
[0083]
实施例3bl21(de3)-a-tha表达工程菌株的构建及a-tha蛋白表达
[0084]
以副鸡禽杆菌a型tha蛋白pcr产物电泳后使用dna胶回收试剂盒进行纯化,所获得的dna片段使用bamhi和xhoi双酶切后,与相同双酶切处理的pet28a质粒进行连接,连接产物转化大肠杆菌dh5α感受态,筛选阳性克隆。使用质粒提取试剂盒提取转化子质粒并进行双酶切鉴定,酶切鉴定正确的质粒进行测序分析,将验证正确的重组质粒命名为pet28a-a-tha。参照实施例1方法构建表达工程菌株bl21(de3)-a-tha,经酶切及测序鉴定正确的菌株保存于-70℃备用。
[0085]
参照实施例2方法表达tha蛋白,取菌体裂解液上清,使用a型副鸡禽杆菌阳性血清为抗体按常规方法进行agp效价测定。a-tha蛋白的agp效价为1:256,内毒素含量为0.58
×
105eu/ml。
[0086]
参照实施例2方法去除内毒素,经测定,a-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0087]
实施例4副鸡禽杆菌a型亚单位疫苗的制备
[0088]
将实施例2制备的a-gcn4-tha融合蛋白和实施例3制备的a-tha蛋白分别缓缓加入到矿物油佐剂中,同时开动电机,17500r/min搅拌5min,在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.01%。具体配比见表1。
[0089]
表1副鸡禽杆菌a型亚单位疫苗配比
[0090]
组分疫苗1疫苗2疫苗3a-gcn4-tha蛋白(agp效价)1:81:32-a-tha蛋白(agp效价)
‑‑
1:32矿物油佐剂(v/v%)66%66%66%
[0091]
实施例5副鸡禽杆菌a型亚单位疫苗效力比较
[0092]
取8周龄的spf鸡40只随机分成4组,10只/组,免疫实施例4制备的副鸡禽杆菌a型亚单位疫苗。第1~3组分别免疫疫苗1~3,第4组不免疫作为攻毒对照。各免疫组注射疫苗0.5ml/只,攻毒对照组注射pbs 0.5ml/只,免疫后28天,各免疫组连同攻毒对照组,眶下窦注射a型hn3株菌液0.2ml(含活菌数约为2.0
×
104cfu)。连续观察7日,出现面部肿胀或流鼻涕任一项症状即判为发病,攻毒保护结果见表2。
[0093]
表2副鸡禽杆菌a型亚单位疫苗效力比较结果
[0094][0095]
结果显示,针对副鸡禽杆菌a型,疫苗3不能提供有效的免疫保护,疫苗1、疫苗2可提供完全的免疫保护;攻毒对照组全部发病。表明副鸡禽杆菌a型tha蛋白在抗原含量为agp效价1:32时依然不能提供有效的免疫保护,而本发明提供的副鸡禽杆菌a型gcn4-tha融合蛋白在抗原含量为agp效价1:8时,即可提供完全的免疫保护。
[0096]
实施例6副鸡禽杆菌b型亚单位疫苗的制备
[0097]
6.1副鸡禽杆菌b型dna的提取
[0098]
按照病毒dna提取试剂盒说明书,取副鸡禽杆菌b型菌株hn5株(副鸡禽杆菌b型hn5株(avibacterium paragallinarum serotype b strain hn5),已于2017年02月22日保藏于中国典型培养物保藏中心(cctcc),保藏号:cctcc no:m2017056;保藏地址:中国武汉
·
武汉大学,公开于中国专利申请cn108624522a)的纯培养物,挑取若干菌落于100μl无菌双蒸水,煮沸10分钟,冰浴10分钟,12000r/min离心1分钟,取上清作为模板,进行后续实验。
[0099]
6.2b-tha蛋白片段基因扩增
[0100]
根据tha蛋白基因5’和3’末端的保守区序列合成寡聚核苷酸引物,上游引物tha-f如seq id no.8所示,下游引物tha-r如seq id no.9所示,进行pcr。
[0101]
pcr产物送invitrogen公司测序,b-tha蛋白片段氨基酸序列如seq id no.2所示。
[0102]
6.3b-gcn4-tha蛋白的表达
[0103]
参照实施例1方法构建bl21(de3)-b-gcn4-tha表达工程菌株,参照实施例2表达b-gcn4-tha蛋白,内毒素去除后,经测定,b-gcn4-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0104]
6.4b-gcn4-tha蛋白的鉴定
[0105]
sds-page和western blot结果显示b-gcn4-tha分子量为60kda左右,而非还原sds-page和western blot结果出现分子量为180kda左右的蛋白条带,表明b-gcn4-tha形成了三聚体结构,且可与兔抗apg b型阳性血清发生特异性反应。
[0106]
6.5bl21(de3)-b-tha表达工程菌株的构建及b-tha蛋白表达
[0107]
以副鸡禽杆菌b型tha蛋白pcr产物电泳后使用dna胶回收试剂盒进行纯化,获得
dna片段,参照实施例3方法构建bl21(de3)-b-tha表达工程菌株,,参照实施例2表达b-tha蛋白,内毒素去除后,经测定,b-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0108]
6.6副鸡禽杆菌b型亚单位疫苗的制备
[0109]
将上述制备的b-gcn4-tha融合蛋白和b-tha蛋白分别缓缓加入到矿物油佐剂中,同时开动电机,17500r/min搅拌5min,在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.01%。具体配比见表3。
[0110]
表3副鸡禽杆菌b型亚单位疫苗配比
[0111]
组分疫苗4疫苗5疫苗6b-gcn4-tha蛋白(agp效价)1:161:32-b-tha蛋白(agp效价)
‑‑
1:32矿物油佐剂(v/v%)66%66%66%
[0112]
实施例7副鸡禽杆菌b型亚单位疫苗效力比较
[0113]
取8周龄的spf鸡40只随机分成4组,10只/组,免疫实施例6制备的副鸡禽杆菌b型亚单位疫苗。第5~7组分别免疫疫苗4~6,第8组不免疫作为攻毒对照。各免疫组注射疫苗0.5ml/只,攻毒对照组注射pbs 0.5ml/只,免疫后28天,各免疫组连同攻毒对照组,眶下窦注射b型hn5株菌液0.2ml(含活菌数约为1.0
×
104cfu)。连续观察7日,出现面部肿胀或流鼻涕任一项症状即判为发病,攻毒保护结果见表4。
[0114]
表4副鸡禽杆菌b型亚单位疫苗效力比较结果
[0115][0116]
结果显示,针对副鸡禽杆菌b型,疫苗6不能提供完全的免疫保护,疫苗4、疫苗5可提供完全的免疫保护;攻毒对照组全部发病。表明副鸡禽杆菌b型tha蛋白在抗原含量为agp效价1:32时依然不能提供完全的免疫保护,而本发明提供的副鸡禽杆菌b型gcn4-tha融合蛋白在抗原含量为agp效价1:16时,即可提供完全的免疫保护。
[0117]
实施例8副鸡禽杆菌c型亚单位疫苗的制备
[0118]
8.1副鸡禽杆菌c型dna的提取
[0119]
按照病毒dna提取试剂盒说明书,取副鸡禽杆菌c型菌株hn5株(副鸡禽杆菌c型sd3株(avibacterium paragallinarum serotype c strain sd3),已于2015年01月20日保藏于中国典型培养物保藏中心(cctcc),保藏号:cctcc no:m2015052;保藏地址:中国武汉
·
武汉大学,公开于中国专利申请cn106267176a)的纯培养物,挑取若干菌落于100μl无菌双蒸水,煮沸10分钟,冰浴10分钟,12000r/min离心1分钟,取上清作为模板,进行后续实验。
[0120]
8.2c-tha蛋白片段基因扩增
[0121]
根据tha蛋白基因5’和3’末端的保守区序列合成寡聚核苷酸引物,上游引物tha-f如seq id no.8所示,下游引物tha-r如seq id no.9所示,进行pcr。
[0122]
pcr产物送invitrogen公司测序,c-tha蛋白片段氨基酸序列如seq id no.3所示。
[0123]
8.3c-gcn4-tha蛋白的表达
[0124]
参照实施例1方法构建bl21(de3)-c-gcn4-tha表达工程菌株,参照实施例2表达c-gcn4-tha蛋白,内毒素去除后,经测定,c-gcn4-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0125]
8.4c-gcn4-tha蛋白的鉴定
[0126]
sds-page和western blot结果显示c-gcn4-tha分子量为60kda左右,而非还原sds-page和western blot结果出现分子量为180kda左右的蛋白条带,表明c-gcn4-tha形成了三聚体结构,且可与兔抗apg c型阳性血清发生特异性反应。
[0127]
8.5bl21(de3)-c-tha表达工程菌株的构建及c-tha蛋白表达
[0128]
以副鸡禽杆菌c型tha蛋白pcr产物电泳后使用dna胶回收试剂盒进行纯化,获得dna片段,参照实施例3方法构建bl21(de3)-c-tha表达工程菌株,,参照实施例2表达c-tha蛋白,内毒素去除后,经测定,c-tha蛋白的agp效价为1:256,内毒素含量为0.01
×
105eu/ml。
[0129]
8.6副鸡禽杆菌c型亚单位疫苗的制备
[0130]
将上述制备的c-gcn4-tha融合蛋白和c-tha蛋白分别缓缓加入到矿物油佐剂中,同时开动电机,17500r/min搅拌5min,在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.01%。具体配比见表5。
[0131]
表5副鸡禽杆菌c型亚单位疫苗配比
[0132]
组分疫苗7疫苗8疫苗9c-gcn4-tha蛋白(agp效价)1:161:32-c-tha蛋白(agp效价)
‑‑
1:32矿物油佐剂(v/v%)66%66%66%
[0133]
实施例9副鸡禽杆菌c型亚单位疫苗效力比较
[0134]
取8周龄的spf鸡40只随机分成4组,10只/组,免疫实施例8制备的副鸡禽杆菌c型亚单位疫苗。第9~11组分别免疫疫苗7~8,第12组不免疫作为攻毒对照。各免疫组注射疫苗0.5ml/只,攻毒对照组注射pbs 0.5ml/只,免疫后28天,各免疫组连同攻毒对照组,眶下窦注射c型sd3株菌液0.2ml(含活菌数约为1.0
×
104cfu)。连续观察7日,出现面部肿胀或流鼻涕任一项症状即判为发病,攻毒保护结果见表6。
[0135]
表6副鸡禽杆菌c型亚单位疫苗效力比较结果
[0136][0137]
结果显示,针对副鸡禽杆菌c型,疫苗9不能提供有效的免疫保护,疫苗7、疫苗8可提供完全的免疫保护;攻毒对照组全部发病。表明副鸡禽杆菌c型tha蛋白在抗原含量为agp效价1:32时依然不能提供有效的免疫保护,而本发明提供的副鸡禽杆菌c型gcn4-tha融合蛋白在抗原含量为agp效价1:16时,即可提供完全的免疫保护。
[0138]
实施例10副鸡禽杆菌亚单位疫苗的制备
[0139]
将实施例2制备的a-gcn4-tha融合蛋白、实施例6制备的b-gcn4-tha融合蛋白、实施例8制备的c-gcn4-tha融合蛋白缓缓加入到矿物油佐剂中,同时开动电机,17500r/min搅拌5min,在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.01%。具体配比见表7。
[0140]
表7副鸡禽杆菌亚单位疫苗配比
[0141]
组分疫苗10疫苗11a-gcn4-tha蛋白(agp效价)1:81:32b-gcn4-tha蛋白(agp效价)1:161:32c-gcn4-tha蛋白(agp效价)1:161:32矿物油佐剂(v/v%)66%66%
[0142]
实施例11副鸡禽杆菌亚单位疫苗与进口苗对spf鸡的效力比较
[0143]
取8周龄的spf鸡120只随机分成12组,10只/组,第13组、17组、21组免疫实施例10制备的疫苗10,第14组、18组、22组免疫实施例10制备的疫苗11,第15组、19组、23组免疫进口鸡传染性鼻炎三价灭活疫苗(分别含a型w株,含量为灭活前≥6
×
108cfu/ml;含b型spross株,含量为灭活前≥6
×
108cfu/ml;含c型modesto株,含量为灭活前≥6
×
108cfu/ml),第16组、20组、24组不免疫作为攻毒对照。各免疫组注射疫苗0.5ml/只,攻毒对照组注射pbs 0.5ml/只,免疫后28天,第13组、14组、15组和16组40只鸡,眶下窦注射a型hn3株菌液0.2ml(含活菌数约为2.0
×
104cfu);第17组、18组、19组和20组40只鸡,眶下窦注射b型hn5株菌液0.2ml(含活菌数约为1.0
×
104cfu);第21组、22组、23组和24组40只鸡,眶下窦注射c型sd3株菌液0.2ml(含活菌数约为1.0
×
104cfu)。连续观察7日,攻毒保护结果见表8。
[0144]
表8副鸡禽杆菌亚单位疫苗与进口苗对spf鸡的效力比较结果
[0145][0146][0147]
结果表明,疫苗10、疫苗11、进口苗免疫组与不免疫攻毒对照组相比,免疫组与攻毒对照组保护率差异明显,疫苗10、疫苗11免疫组保护效果优于进口苗,进一步说明本发明的亚单位疫苗具有良好的免疫保护效果。
[0148]
实施例12副鸡禽杆菌亚单位疫苗对小日龄spf鸡的效力试验
[0149]
取3周龄的spf鸡60只随机分成6组,10只/组,第25组、27组、29组免疫实施例10制备的疫苗10,第26组、28组、30组不免疫作为攻毒对照。各免疫组注射疫苗0.5ml/只,对照组注射pbs 0.5ml/只,免疫后28天,第25组和26组20只鸡,眶下窦注射a型hn3株菌液0.2ml(含活菌数约为1000cfu);第27组和28组20只鸡,眶下窦注射b型hn5株菌液0.2ml(含活菌数约为500cfu);第29组和30组20只鸡,眶下窦注射c型sd3株菌液0.2ml(含活菌数约为1000cfu)。连续观察7日,攻毒保护结果见表9。
[0150]
表9副鸡禽杆菌亚单位疫苗对小日龄spf鸡的效力试验结果
[0151][0152]
结果表明,疫苗10免疫组与不免疫对照组相比,免疫组与对照组保护率差异明显,进一步说明本发明的亚单位疫苗具有良好的免疫保护效果。
[0153]
本发明的副鸡禽杆菌亚单位疫苗能对21日龄的鸡提供完全保护,从而解决了现实生产中21日龄以下肉雏鸡不能免疫保护的问题,保证了肉鸡的食品安全。
[0154]
实施例13鸡新城疫抗原的制备
[0155]
取新城疫病毒(基因ⅶ型)n7a株(newcastle disease virus(genotypeⅶ),strain n7a)(保藏于中国典型培养物保藏中心,保藏号为cctcc no:v201545,保藏日期为2015年10月19日,保藏地址为中国武汉
·
武汉大学,公开于中国专利申请cn107281479a),用灭菌生理盐水作适当稀释(10-4
或10-5
)接种10~11日龄易感鸡胚,每胚0.1ml,接种后置37℃继续孵育。选接种后48~120小时死亡和存活鸡胚,收获尿囊液,测定病毒含量,为10
8.0
eid
50
/0.1ml。加入终浓度为0.1%的甲醛溶液(v/v),放37℃灭活,其间每隔4~6h搅拌一次,灭活16h,灭活完全后备用。
[0156]
实施例14禽流感抗原的制备
[0157]
取h9亚型禽流感病毒hf株(禽流感病毒(h9亚型)hf株(avian influenza virus(subtype h9),strain hf),保藏号为cctcc no:v201941,保藏日期为2019年06月19日,保藏地址为中国武汉
·
武汉大学)毒种,用无菌生理盐水稀释至10-3
(取病毒液0.1ml加入到0.9ml无菌生理盐水中,震荡混匀后依次再稀释2次),经尿囊腔接种10日龄易感鸡胚(使用购自北京梅里亚维通实验动物技术有限公司的spf种蛋自行孵化),每胚0.1ml(含105eid
50
)。接种后密封针孔,置36~37℃继续孵育,不必翻蛋。至96小时,取出,气室向上直立,置于2~8℃冷却12~24小时。将冷却后的鸡胚收获胚液。测定病毒含量,为10
8.5
eid
50
/0.1ml。加入终浓度为0.1%的甲醛溶液(v/v),放37℃灭活,其间每隔4~6h搅拌一次,灭活24h,灭活完全后备用。
[0158]
实施例15鸡传染性支气管炎抗原的制备
[0159]
取鸡传染性支气管炎病毒m41株(购自中国兽医药品监察所),用灭菌生理盐水作适当稀释(10-2
或10-3
)接种10~11日龄易感鸡胚,每胚0.1ml,接种后置36~37℃继续孵育。选接种后24~48小时死亡和存活鸡胚,收获尿囊液,测定病毒含量,为10
6.0
eid
50
/0.1ml。加入终浓度为0.1%的甲醛溶液(v/v),放置于37℃灭活,其间每隔4~6h搅拌一次,灭活16h,灭活完全后备用。
[0160]
实施例16禽腺病毒抗原的制备
[0161]
16.1fiber-2cdna制备
[0162]
按病毒rna提取试剂盒操作从感染禽腺病毒fav-hn株(禽腺病毒,fav-hn株(fowl aviadenovirus,strain fav-hn),保藏号为:cctcc no:v201609,保藏单位为中国典型培养物保藏中心,保藏地址为中国武汉
·
武汉大学,保藏时间为2016年2月29日,公开于中国专利申请cn107523556a)中提取fadv病毒dna。根据fiber-2蛋白基因5’和3’末端的保守区序列合成寡聚核苷酸引物,上游引物fiber-2-f如seq id no.12所示,下游引物fiber-2-r如seq id no.13所示,并进行pcr扩增,并利用琼脂糖凝胶胶回收试剂盒回收,-20℃保存。
[0163]
16.2表达载体构建
[0164]
优化后fiber-2蛋白基因送由苏州金唯智生物科技有限公司进行全序列合成,并分别连接到pet28a质粒上。连接后的质粒转化大肠杆菌bl21(de3),挑取单克隆在lb液体培养基(含50μg/ml卡那霉素)中培养过夜,提取质粒后测序分析,阳性克隆即为bl21(de3)-fadv-fiber-2表达菌株。
[0165]
16.3fiber-2蛋白的制备
[0166]
将bl21(de3)-fadv-fiber-2表达菌株接种到lb液体培养基(含50μg/ml卡那霉素)中,接种量为1%(v/v),37℃振荡培养。当od600值达到0.4~0.6时,于28℃放置30分钟。加入异丙基-β-d-硫代吡喃半乳糖苷(iptg),使其终浓度为1.0mmol/l,28℃振荡培养24小时。培养结束后,收集菌体,并用pbs重悬菌体,超声破碎,离心取上清。收集fiber-2蛋白液。参照实施例2方法进行内毒素清除,经测定,内毒素含量下降为0.008
×
105eu/ml。
[0167]
实施例17副鸡禽杆菌复合疫苗的制备
[0168]
将实施例2制备的副鸡禽杆菌a-gcn4-tha融合蛋白抗原、实施例6制备的副鸡禽杆菌b-gcn4-tha融合蛋白抗原、实施例8制备的副鸡禽杆菌c-gcn4-tha融合蛋白抗原和实施例13制备的鸡新城疫抗原、实施例14制备的禽流感抗原、实施例15制备的鸡传染性支气管炎抗原、实施例16制备的禽腺病毒抗原按比例混合,加入到矿物油佐剂中,同时开动电机,17500r/min搅拌5min,在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.01%。具体配比见表10、11、12、13。
[0169]
表10副鸡禽杆菌复合疫苗配比1
[0170]
组分疫苗12疫苗13疫苗14疫苗15a-gcn4-tha蛋白(agp效价)1:81:81:81:8b-gcn4-tha蛋白(agp效价)1:161:161:161:16c-gcn4-tha蛋白(agp效价)1:161:161:161:16n7a株抗原(eid50/0.1ml)10
8.0
———hf株抗原(eid50/0.1ml)—10
8.0
——m41株抗原(eid50/0.1ml)——10
6.0
—fiber-2蛋白(agp效价)———1:4矿物油佐剂(v/v%)66%66%66%66%
[0171]
表11副鸡禽杆菌复合疫苗配比2
[0172]
组分疫苗16疫苗17疫苗18a-gcn4-tha蛋白(agp效价)1:81:81:8
b-gcn4-tha蛋白(agp效价)1:161:161:16c-gcn4-tha蛋白(agp效价)1:161:161:16n7a株抗原(eid50/0.1ml)10
8.0
10
8.0
10
8.0
hf株抗原(eid50/0.1ml)10
8.0
——m41株抗原(eid50/0.1ml)—10
6.0
—fiber-2蛋白(agp效价)——1:4矿物油佐剂(v/v%)66%66%66%
[0173]
表12副鸡禽杆菌复合疫苗配比3
[0174]
组分疫苗19疫苗20a-gcn4-tha蛋白(agp效价)1:81:8b-gcn4-tha蛋白(agp效价)1:161:16c-gcn4-tha蛋白(agp效价)1:161:16n7a株抗原(eid50/0.1ml)10
8.0
10
8.0
hf株抗原(eid50/0.1ml)10
8.0
10
8.0
m41株抗原(eid50/0.1ml)10
6.0
—fiber-2蛋白(agp效价)—1:4矿物油佐剂(v/v%)66%66%
[0175]
表13副鸡禽杆菌复合疫苗配比4
[0176][0177][0178]
实施例18副鸡禽杆菌复合疫苗免疫原性试验
[0179]
18.1副鸡禽杆菌部分免疫原性试验
[0180]
取3周龄的spf鸡330只随机分成33组,10只/组,第31组~第33组免疫实施例17制备的疫苗12,第34组~第36组免疫实施例17制备的疫苗13,第37组~第39组免疫实施例17制备的疫苗14,第40组~第42组免疫实施例17制备的疫苗15,第43组~第45组免疫实施例17制备的疫苗16,第46组~第48组免疫实施例17制备的疫苗17,第49组~第51组免疫实施例17制备的疫苗18,第52组~第54组免疫实施例17制备的疫苗19,第55组~第57组免疫实施例17制备的疫苗20,第58组~第60组免疫实施例17制备的疫苗21,第61组~第63组不免
疫作为对照。各免疫组注射疫苗0.5ml/只,对照组注射pbs 0.5ml/只,免疫后28天,第31组、第34组、第37组、第40组、第43组、第46组、第49组、第52组、第55组、第58组、第61组110只鸡,眶下窦注射a型hn3株菌液0.2ml(含活菌数约为1000cfu);第32组、第35组、第38组、第41组、第44组、第47组、第50组、第53组、第56组、第59组、第62组110只鸡,眶下窦注射b型hn5株菌液0.2ml(含活菌数约为500cfu);第33组、第36组、第39组、第42组、第45组、第48组、第51组、第54组、第57组、第60组、第63组110只鸡,眶下窦注射c型sd3株菌液0.2ml(含活菌数约为1000cfu)。连续观察7日,攻毒保护结果见表14、15、16。
[0181]
表14副鸡禽杆菌复合疫苗副鸡禽杆菌a型部分免疫原性试验结果
[0182][0183]
表15副鸡禽杆菌复合疫苗副鸡禽杆菌b型部分免疫原性试验结果
[0184][0185]
表16副鸡禽杆菌复合疫苗副鸡禽杆菌c型部分免疫原性试验结果
[0186][0187]
结果显示,疫苗12~疫苗21免疫组再免疫后28天,均可提供针对副鸡禽杆菌a型、b型、c型的免疫保护,可完全保护鸡群副鸡禽杆菌a型、b型、c型引起的传染性鼻炎。表明本发明提供的副鸡禽杆菌融合蛋白,作为抗原制备的副鸡禽杆菌复合疫苗可对鸡群提供完全保护。
[0188]
18.2新城疫病毒部分免疫原性试验
[0189]
取3周龄的spf鸡80只,分成8组,每组10只,第64组~第70组分别经颈部皮下注射免疫实施例17制备的疫苗12、疫苗16~疫苗21,20μl/只;第71组皮下注射20μl生理盐水,作为攻毒对照。所有试验鸡均隔离饲养,免疫后21日,将第64组~第70组免疫鸡,连同第71组攻毒对照鸡,采血并分离血清。检测新城疫病毒hi抗体,同时用新城疫强毒hn1101株病毒液通过肌肉注射攻击,观察14日,记录发病、死亡及保护数。结果见表17。
[0190]
表17副鸡禽杆菌复合疫苗新城疫病毒部分免疫原性试验结果
[0191][0192]
注:hi抗体测定为免疫鸡抗体的几何平均数。
[0193]
结果显示,疫苗12、疫苗16~疫苗21免疫组在免疫后21天均能产生较高的新城疫抗体,而且免疫组和对照相比,可以完全保护强毒的攻击。表明以本发明提供的n7a株新城疫病毒液,作为抗原制备的副鸡禽杆菌复合疫苗可对鸡群提供完全保护。
[0194]
18.3禽流感部分免疫原性试验
[0195]
取3周龄的spf鸡60只,分成6组,每组10只,第72组~第76组分别经颈部皮下注射免疫实施例17制备的疫苗13、疫苗16、疫苗19~疫苗21,0.3ml/只;第77组皮下注射0.3ml生理盐水,作为攻毒对照。所有试验鸡均隔离饲养,免疫后21日,将第72组~第76组免疫鸡,连同第77组对照鸡,采血并分离血清。检测h9亚型禽流感hi抗体效价,同时用hf株病毒液静脉注射攻击,每只0.2ml(含10
7.0
eid
50
)。于攻毒后5日,采集泄殖腔拭子,经处理后,尿囊腔接种10~11日龄spf鸡胚5个,孵育观察5日,无论死胚、活胚均应测定鸡胚液红细胞凝集价,每个拭子样品接种的5个鸡胚中只要有1个鸡胚液的凝集价不低于1:16(微量法),即可判为病毒分离阳性。对病毒分离阴性的样品,应盲传一次后再进行判定。免疫组应至少9只鸡病毒分离为阴性;对照组应至少4只鸡病毒分离为阳性。结果见表18。
[0196]
表18副鸡禽杆菌复合疫苗禽流感病毒部分免疫原性试验结果
[0197][0198]
注:hi抗体测定为免疫鸡抗体的几何平均数。
[0199]
结果显示,疫苗13、疫苗16、疫苗19~疫苗21在免疫后21天均能产生较高的禽流感抗体,而且免疫组和对照相比,可以完全保护强毒的攻击。表明本发明提供的h9亚型禽流感病毒液,作为抗原制备的副鸡禽杆菌复合疫苗可对鸡群提供完全保护。
[0200]
18.4鸡传染性支气管炎部分免疫原性试验
[0201]
取3周龄的spf鸡50只,分成5组,每组10只,第78组~第81组各点眼、滴鼻接种鸡传染性支气管炎活疫苗(h120株)1羽份(0.05ml)。接种后21日,连同第82组对照鸡,采血并分离血清。同时,第78组~第81组各组经颈部皮下注射免疫实施例17制备的疫苗14、疫苗17、疫苗19、疫苗21,0.3ml/只。接种后28日,连同第82组攻毒对照鸡分别采血并分离血清;第78~第81组免疫鸡在活苗首免后21日、灭活苗免后28日两次采集的血清(第82组攻毒对照鸡同样时间采集血清)测hi抗体效价。免疫组二免血清hi抗体效价几何平均值不低于首免血清hi抗体效价几何平均值的4倍,未免疫对照组血清hi抗体效价的几何平均值不高于1:8(微量法)。同时用鸡传染性支气管炎m41强毒每羽滴鼻攻毒10
3.0
eid50,作攻毒实验。结果见表19。
[0202]
表19副鸡禽杆菌复合疫苗鸡传染性支气管炎部分免疫原性试验结果
[0203][0204]
结果显示,疫苗14、疫苗17、疫苗19、疫苗21二免血清hi抗体效价几何平均值均不低于首免血清hi抗体效价几何平均值的4倍,攻毒后全部免疫鸡的气管内未分离出病毒,可以完全保护强毒的攻击。表明本发明提供的鸡传染性支气管炎病毒液,作为抗原制备的副
鸡禽杆菌复合疫苗可对鸡群提供完全保护。
[0205]
18.5禽腺病毒部分免疫原性试验
[0206]
取3周龄的spf鸡50只,分成5组,每组10只,第83组~第86组分别经颈部皮下注射免疫实施例17制备的疫苗15、疫苗18、疫苗20、疫苗21,0.3ml/只;第87组皮下注射0.3ml生理盐水,作为攻毒对照。所有试验鸡均隔离饲养,免疫后21日,用fav-hn株病毒液通过肌肉注射攻击,观察14日,记录发病、死亡及保护数。结果见表20。
[0207]
表20副鸡禽杆菌复合疫苗禽腺病毒部分免疫原性试验结果
[0208][0209]
结果显示,第87组对照组全部发病死亡,而第83组~第86组免疫组对免疫鸡均产生了较好的免疫保护效果,免疫效果良好。表明本发明提供的禽腺病毒抗原,作为抗原制备的副鸡禽杆菌复合疫苗可对鸡群提供完全保护。
[0210]
证明了本发明提供的副鸡禽杆菌复合疫苗能有效抵抗相关病原的侵袭,显示出良好的免疫原性,可有效控制我国副鸡禽杆菌相关疾病的流行。
[0211]
以上所述仅是本发明的优选实施例而已,并非对本发明做任何形式上的限制,虽然本发明已以优选实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案的范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1