RibAS、RibBS、RibGS和RibHS基因水稻中提高VB2含量应用及方法
ribas、ribbs、ribgs和ribhs基因水稻中提高vb2含量应用及方法
技术领域
1.本发明属于农作物基因工程领域,具体涉及ribas、ribbs、ribgs和ribhs基因在水稻种子中提高vb2含量的应用及方法。
背景技术:
2.维生素b2(vb2)是生物体内生化反应中多种酶的组成部分,可促进脂肪、蛋白质、碳水化合物和核酸的代谢,vb2具有维护皮肤和粘膜的生理功能,它是生命活动不可缺少的维生素。身体长期、严重缺乏vb2是导致癌症、肿瘤的根本原因;各种消化道溃疡、出血、肿块、息肉、肝硬化也都是因为缺乏vb2引起的;痔疮也是因为缺乏vb2引起的。女性的宫颈糜烂也是因为缺乏vb2引起的;通常所说的“上火”就是vb2短期、急剧缺乏症,及时、足量补充vb2,上述这些症状都会减轻直到痊愈。植物中,vb2主要存在于谷物的皮、壳当中,在谷物加工过程中约有50%都流失了。
3.稻米的蛋白和活性营养成分主要存在于种皮和胚中,而日常使用的精米则是去掉种皮和胚的胚乳(主要成分是淀粉),其营养价值大大下降。因此通过基因工程在胚乳中增加强化合成特定的营养成分和功能性物质,是功能性水稻育种的主要目标。如在胚乳中产生胡萝卜素的“黄金大米”,以及以胚乳作为生物反应器生产具有生物活性的“人血清蛋白米”等。由于现代人的饮食结构导致了人体无法从食物中获取足够的vb2,所以大多数人都处于缺乏vb2的状态。因此,如何让食物中的vb2含量得到提高也是现在研究的重点与难点。
技术实现要素:
4.本发明的目的在于提供ribas、ribbs、ribgs和ribhs基因在水稻种子中提高vb2含量的应用及方法,本发明将ribas、ribbs、ribgs和ribhs基因组合应用于水稻种子中,并使其完全表达,从而获得富含vb2的水稻新品种,其胚乳中的维生素含量与野生型水稻种子相比,提高了大约3.5倍,使其在经过精加工获得的精米中仍保留有足够的vb2。既可以直接用于食用,也可以作为生产vb2的原材料种子,对于新型功能性作物育种具有重要的指导意义和生产应用价值,另外,本发明所获得的vb2含量显著提高的水稻新品种还可以作为原始材料从而获得多种维生素含量提高的水稻新种质。
5.为了达到上述目的,本发明提供如下技术方案:
6.ribas、ribbs、ribgs和ribhs基因在水稻种子中提高vb2含量的应用,其特征在于,所述ribas基因的具体核苷酸序列如seq id no.1所示,所述ribbs基因的具体核苷酸序列如seq id no.2所示,所述ribgs基因的具体核苷酸序列如seq id no.3所示,所述ribhs基因的具体核苷酸序列如seq id no.4所示。
7.进一步,所述ribas、ribbs、ribgs和ribhs基因分别由枯草杆菌中的riba、ribb、ribg和ribh基因优化得到。
8.进一步,所述ribas、ribbs、ribgs和ribhs四基因在水稻种子中的表达顺序为
ribas-ribbs-ribgs-ribhs。
9.利用如权利要求1或2或3所述的ribas、ribbs、ribgs和ribhs基因提高水稻种子中vb2含量的方法,包括以下步骤:
10.1)将根据水稻的密码子偏好性对枯草杆菌中的riba、ribb、ribg和ribh基因序列进行优化,获得ribas、ribbs、ribgs和ribhs四个基因序列,所述ribas基因的具体核苷酸序列如seq id no.1所示,所述ribbs基因的具体核苷酸序列如seq id no.2所示,所述ribgs基因的具体核苷酸序列如seq id no.3所示,所述ribhs基因的具体核苷酸序列如seq id no.4所示;
11.2)将ribas、ribbs、ribgs和ribhs四个基因分别与水稻胚乳特异储存蛋白glub-1基因启动子和终止子融合,分别构建基因表达盒;
12.3)将步骤2)获得的4个基因表达盒元件分别连接入植物表达载体,获得含ribas、ribbs、ribgs和ribhs四基因表达盒的植物多基因转化载体;
13.4)将步骤3)中获得的植物多基因转化载体转入农杆菌,转化至水稻愈伤组织,获得胚乳中vb2含量提高的水稻。
14.优选的,步骤2)中,所述水稻胚乳特异性储存蛋白glub-1基因启动子序列如seq id no.5所示;水稻胚乳特异性储存蛋白glub-1基因终止子序列如seq id no.6所示。
15.优选地,步骤3)中,所述植物表达载体为pcambia1301。
16.优选的,步骤4)中,所述水稻为水稻中花11。
17.本发明将枯草杆菌中的riba基因、ribb基因、ribg基因和ribh基因分别进行优化,优化后的基因称为ribas基因、ribbs基因、ribgs基因和ribhs基因,再转化至水稻,使得4基因按照ribas-ribbs-ribgs-ribhs顺序进行表达,获得水稻新品种。该水稻新品种的胚乳中vb2含量,与野生型水稻种子相比,提高了大约3.5倍。
18.经过研究发现在枯草杆菌中riba基因、ribb基因、ribg基因和ribh基因是核黄素合成代谢途径中的必须基因,核黄素操纵子(rib)表达水平是影响核黄素生物合成的关键因素,所以本发明选择来源于枯草杆菌的riba、ribb、ribg和ribh进行优化合成,获得优化后的ribas基因、ribbs基因、ribgs基因和ribhs基因,使其能够在水稻种子中完整表达,以提高水稻种子胚乳中vb2含量。
19.本发明通过优化四种基因,优化原则为:
20.一、优化基因密码子,按照水稻密码子偏爱,提高基因翻译效率;
21.二、消除基因内部的常用限制性内切酶的识别位点,便于表达盒构建;
22.三、消除逆向重复序列、茎环结构和转录终止信号,使基因内部的gc/at均衡,提高rna的稳定性,其中基因内部的gc/at的比例尽量达到1:1;
23.四、使基因编码蛋白符合n端原则,以提高翻译蛋白的稳定性;
24.五、优化mrna二级结构自由能,以提高基因表达效率。在优化二级结构时避免6个或更多的连续的a+t序列,避免5个或更多的g+c序列;避免2、3位用cg和ta双寡核苷酸;同时尽可能使基因5’端的自由能δg提高达到-5.4kcal以上,使3’端的自由能降低达到-10.8kcal以下。
25.通过上述优化原则使优化后的基因能够同时在水稻种子胚乳中进行表达,提高基因的表达效率。
26.与现有技术相比,本发明具有如下有益效果:
27.本发明所获得的水中种子中,水稻种子胚乳中vb2的含量比野生型水稻种子胚乳中vb2的含量提高了大约3.5倍,也就意味着水稻种子即使在深加工之后依然有大量的vb2保留在精米中,这样通过食用精米即可及时、足量补充人体每天所需的vb2。
28.本发明所获得的水稻新品种既可以直接用于食用,也可以作为生产vb2的原材料种子,对于新型功能性作物育种具有重要的指导意义和生产应用价值,另外,本发明所获得的vb2含量显著提高的水稻新种质还可以作为原始材料从而获得多种维生素含量提高的水稻新种质。
附图说明
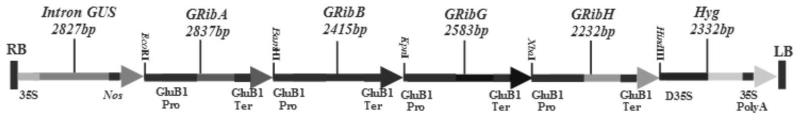
29.图1为植物多基因转化载体结构示意图。
30.图2为t1代水稻基因组dna的外源基因的pcr检测图,1、2和3为转四基因的水稻;w为野生型水稻。
31.图3为采用rt-pcr对t2代水稻授粉后20天发育种子的外源基因的表达检测图,1、2和3为转四基因的水稻;w为野生型水稻。
32.图4为转化四基因水稻种子的外观表型;ck:野生型水稻种子;株系1、2、3:转四基因的vb2含量显著提高的水稻种子。
具体实施方式
33.以下结合具体实施例对本发明作进一步说明,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规分子生物学方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
34.实施例中用到的母液及各培养基配方如下:
35.母液(stock solution)配方:
36.ms
max
母液(stock solution)(10x):nh4no
3 16.5g、kno
3 19.0g、mgso4·
7h2o 3.7g、cacl2·
2h2o 4.4g,加水定容至1000ml。
37.ms
min
母液(stock solution)(100x):ki 0.083g、h3bo
4 0.62g、mnso4·
2h2o 2.23g、znso4·
7h2o 0.86g、na2moo4·
2h2o 0.025g、cuso4·
5h2o 0.0025g、cocl2·
2h2o 0.0025g,加水定容至1000ml。
38.n6
max
母液(stock solution)(10x):kno
3 28.3g、kh2po
4 4.0g、(nh4)2·
so
4 4.63g、mgso4·
7h2o 1.85g、cacl2·
2h2o 1.66g,加水定容至1000ml。
39.n6
min
母液(stock solution)(100x):ki 0.08g、h3bo
4 0.16g、mnso4·
2h2o 0.44g、znso4·
7h2o 0.15g,加水定容到1000ml。
40.fe
2+-edta母液(100x):feso4·
7h2o 2.78g、na2edta
·
2h2o 3.73g,单独溶解,然后混合,加水定容至1000ml。
41.维生素母液(vitamin stock solution)(100x):烟酸(nicotinic acid)0.1g、维生素b6(pyridoxine hcl,vb6)0.1g、维生素b1(thiaminc hcl,vb1)0.1g、甘氨酸(glycine)0.2g、肌糖(inositol)10g,加水定容至1000ml。
42.培养基配方:
43.共培养培养基:n6
max
母液(n6
max stock solution)(10x)12.5ml,n6
min
母液(n6
min stock solution)(100x)1.25ml,fe
2+-edta母液(fe
2+-edta stock solution)(100x)2.5ml,维生素母液(vitamin stock solution)(100x)2.5ml,二氯苯氧乙酸2g/l(2,4-d)0.75ml,酶水解酪素(casein enzymatic hydrolysate)0.2g,蔗糖(sucrose)5g,琼脂粉(agarose)1.75g,加水至250ml调ph=5.6用前微波炉融化加5ml 50%葡萄糖和250μl 20g/l乙酰丁香酮。
44.选择培养基:n6
max
母液(n6
max stock solution)(10x)25ml,n6
min
母液(n6
min stock solution)(100x)2.5ml,fe
2+-edta母液(fe
2+-edta stock solution)(100x)2.5ml,维生素母液(vitamin stock solution)(100x)2.5ml,二氯苯氧乙酸2g/l(2,4-d)0.625ml,酶水解酪素(casein enzymatic hydrolysate)0.15g,蔗糖(sucrose)7.5g,琼脂粉(agarose)1.75g,加水至250ml调ph=6.0,用前融化加潮霉素和羧苄。
45.预分化培养基:ms
max
母液(ms
max stock solution)(10x)25ml,ms
min
母液(ms
min stock solution)(100x)2.5ml,fe
2+-edta母液(fe
2+-edta stock solution)(100x)2.5ml,维生素母液(vitamin stock solution)(100x)2.5ml,6-苄胺基嘌呤2g/l(6-ba)0.5ml,激动素2g/l(kt)0.5ml,吲哚乙酸1mg/ml(iaa)50μl,酶水解酪素(casein enzymatic hydrolysate)0.15g,蔗糖(sucrose)7.5g,琼脂粉(agarose)1.75g,加水至250ml调ph=5.9,用前融化加潮霉素和羧苄。
46.分化培养基:ms
max
母液(ms
max stock solution)(10x)100ml,ms
min
母液(ms
min stock solution)(100x)10ml,fe
2+-edta母液(fe
2+-edta stock solution)(100x)10ml,维生素母液(vitamin stock solution)(100x)10ml,6-苄胺基嘌呤2g/l(6-ba)2.0ml,激动素2g/l(kt)2.0ml,吲哚乙酸1mg/ml(iaa)0.2ml,萘乙酸1g/l(naa)0.2ml,酶水解酪素(casein enzymatic hydrolysate)1g,蔗糖(sucrose)30g,植物凝胶(phytagel)3g,加水至1000ml调ph=6.0,分装小瓶。
47.生根培养基:ms
max
母液(ms
max stock solution)(10x)50ml,ms
min
母液(ms
min stock solution)(100x)5ml,fe
2+-edta母液(fe
2+-edta stock solution)(100x)10ml,维生素母液(vitamin stock solution)(100x)10ml,琼脂粉(sucrose)20g,植物凝胶(phytagel)3g,加水至1000ml调ph=5.8,分装小瓶。
48.实施例1本发明的利用ribas、ribbs、ribgs和ribhs基因提高水稻种子胚乳中vb2含量的方法,包括以下步骤:
49.1.四个必需基因(ribas、ribbs、ribgs和ribhs)的优化合成
50.在枯燥杆菌的核黄素合成代谢途径中,核黄素操纵子(rib)表达水平是影响核黄素生物合成的关键因素,所以本发明选择来源于枯草杆菌的riba、ribb、ribg和ribh进行优化合成。
51.优化按照以下原则进行:(一)优化基因密码子,按照水稻密码子偏爱,提高基因翻译效率;(二)消除基因内部的常用限制性内切酶的识别位点,便于表达盒构建;(三)消除逆向重复序列、茎环结构和转录终止信号,使基因内部的gc/at均衡,提高rna的稳定性,其中基因内部的gc/at的比例尽量达到1:1;(四)使基因编码蛋白符合n端原则,以提高翻译蛋白的稳定性;(五)优化mrna二级结构自由能,以提高基因表达效率。在优化二级结构时避免6个或更多的连续的a+t序列,避免5个或更多的g+c序列;避免2、3位用cg和ta双寡核苷酸;同
时尽可能使基因5’端的自由能δg提高达到-5.4kcal以上,使3’端的自由能降低达到-10.8kcal以下。
52.以枯草杆菌(bacillus subtilis)的riba基因(genbank no.cp022391.1)为模板,根据水稻密码子偏好性,采用上述优化原则进行优化,获得seq id no.1所示dna序列ribas,克隆到质粒载体,测序确定其序列;
53.以枯草杆菌(bacillus subtilis)的ribb基因(genbank no.cp033052.1)为模板,根据水稻密码子偏好性,采用上述优化原则进行优化,获得seq id no.2所示dna序列ribbs,克隆到质粒载体,测序确定其序列;
54.以枯草杆菌(bacillus subtilis)的ribg基因(nucl acids res.2004,32,e98.和nat.protoc.2006,1,791-797)为模板,根据水稻密码子偏好性,采用上述优化原则进行优化,获得seq id no.3所示dna序列ribgs,克隆到质粒载体,测序确定其序列;
55.以枯草杆菌(bacillus subtilis)的ribh基因(nucl acids res.2004,32,e98.和nat.protoc.2006,1,791-797)为模板,根据水稻密码子偏好性,采用上述优化原则进行优化,获得seq id no.3所示dna序列ribhs,克隆到质粒载体,测序确定其序列。
56.2.构建基因表达盒
57.以水稻(oryza sativa)胚乳特异储存蛋白glub-1基因(genbank no.x54314.1)为模板,采用ptds方法(nucl acids res.2004,32,e98.和nat.protoc.2006,1,791-797)合成获得seq id no.5所示dna序列glub-1基因启动子,克隆到质粒载体,测序确定其序列;
58.以水稻(oryza sativa)胚乳特异储存蛋白glub-1gene基因(genbank no.x54314.1)为模板,采用ptds方法(nucl acids res.2004,32,e98.和nat.protoc.2006,1,791-797)合成获得seq id no.6所示dna序列glub-1基因终止子,克隆到质粒载体,测序确定其序列。
59.按照改良的“重叠延伸pcr”技术进行基因表达盒元件的拼接(appl microbiol biotechnol.2006,73(1):234-40)。
60.2.1构建ribas基因表达盒
61.根据上述化学合成的glub-1启动子、ribas基因和glub-1终止子序列设计了三对引物,相邻元件之间的引物存在20bp的重叠区,引物p1上有ecori酶切位点,引物p6上有bamhi酶切位点。
62.以上述化学合成的glub-1启动子、ribas基因和glub-1终止子的质粒为模板,分别使用引物对p1和p2、p3和p4、p5和p6进行三个元件(glub-1启动子、ribas基因和glub-1终止子)的pcr扩增。
63.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p1/p3/p5,1μl p2/p4/p6,加ddh2o至50μl;
64.反应程序为:94℃30s,54℃30s,72℃90s,共45个循环,72℃再延伸10min,通过page电泳分离并回收pcr扩增片段。
65.随后将各个扩增片段等摩尔数混合,以混合片段为模板,利用引物p1和p6进行pcr扩增,反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p1,1μl p6,加ddh2o至50μl;
66.反应程序为:94℃30s,54℃30s,72℃240s,共45个循环,72℃再延伸10min,获得
thmg1基因的表达盒,并对该表达盒进行t-vector克隆和重组质粒的核苷酸全序列测定。
67.其中,引物对p1和p2、p3和p4、p5和p6的具体序列如下:
68.p1:gaattcgatctcgatttttgaggaattttagaagttgaacagagtcaatcgaacagacag;
69.p2:agctatttgtacttgcttatggaaacttaagctaattgatgtgagttcaaagacagacca;
70.p3:ataagcaagtacaaatagctatgctgaccaacaagaccgtcatctctggttccaaggtca;
71.p4:ttaggatttgatgcaggtgacggaaccatccttcagacggttgatgtcagtggcatccag;
72.p5:tcacctgcatcaaatcctaatgtaattgagaactagtatcggcgtagagtaaaataaaac;
73.p6:ggatccgttctattcttcattaagttaataaataatgatattagttccaagttacaaata。
74.2.2构建ribbs基因表达盒:
75.根据上述化学合成的glub-1启动子、ribbs基因和glub-1终止子序列设计了三对引物,相邻元件之间的引物存在20bp的重叠区,引物p7上有bamhi酶切位点,引物p12上有kpni酶切位点。以上述化学合成的glub-1启动子、ribbs基因和glub-1终止子的质粒为模板,分别使用引物对p7和p8、p9和p10、p11和p12进行三个原件(glub-1启动子、ribbs基因和glub-1终止子)的pcr扩增。
76.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p7/p9/p11,1μl p8/p10/p12,加ddh2o至50μl;
77.反应程序为:94℃30s,54℃30s,72℃90s,共45个循环,72℃再延伸10min,采用page电泳分离并回收pcr扩增片段。
78.随后将各个扩增片段等摩尔数混合,以混合片段为模板,利用引物p7和p12进行pcr扩增,反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p7,1μl p12,加ddh2o至50μl;反应程序为:94℃30s,54℃30s,72℃180s,共45个循环,72℃再延伸10min,获得ribbs基因的表达盒,并对该表达盒进行t-vector克隆和重组质粒的核苷酸全序列测定。
79.其中,引物对p7和p8、p9和p10、p11和p12的具体序列如下:
80.p7:ggatccgatctcgatttttgaggaattttagaagttgaacagagtcaatcgaacagacag;
81.p8:agctatttgtacttgcttatggaaacttaagctaattgatgtgagttcaaagacagacca;
82.p9:ataagcaagtacaaatagctatggccatcatactcgttagggctgcctctcctggtctct;
83.p10:gatactagttctcaattacattaggtctggccatttctcaatgaacatgggagcagtagc;
84.p11:tgtaattgagaactagtatcggcgtagagtaaaataaaacaccacaagtatgacacttgg;
85.p12:ggtaccgttctattcttcattaagttaataaataatgatattagttccaagttacaaata。
86.2.3构建ribgs基因表达盒:
87.根据上述化学合成的glub-1启动子、ribgs基因和glub-1终止子序列设计了三对引物p13和p14、p15和p16、p17和p18,相邻元件之间的引物存在20bp的重叠区,引物p13上有kpni酶切位点,引物p18上xhoi有酶切位点。
88.以上述化学合成的glub-1启动子、ribgs基因和glub-1终止子的质粒为模板,分别使用进行三个元件(glub-1启动子、ribgs基因和glub-1终止子)的pcr扩增。
89.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p13,1μl p18,加ddh2o至50μl;
90.反应程序为:94℃30s,54℃30s,72℃120s,共45个循环,72℃再延伸10min,通过
page电泳分离并回收pcr扩增片段。
91.随后将各个扩增片段等摩尔数混合,以混合片段为模板,利用引物p13和p18进行pcr扩增。
92.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p13,1μl p18,加ddh2o至50μl;反应程序为:94℃30s,54℃30s,72℃240s,共45个循环,72℃再延伸10min,获得ribgs基因的表达盒,并对该表达盒进行t-vector克隆和重组质粒的核苷酸全序列测定。
93.其中,引物对p13和p14、p15和p16、p17和p18的具体序列如下:
94.p13:ggtaccgatctcgatttttgaggaattttagaagttgaacagagtcaatcgaacagacag;
95.p14:gagagcatagaggaagccatagctatttgtacttgcttatggaaacttaagctaattgat;
96.p15:atggcttcctctatgctctcttccgctactatggttgcctctccagctcaagccactatg;
97.p16:gatactagttctcaattacattagatcaggtcctccagcatcagaccagcagtagcctt;
98.p17:tgtaattgagaactagtatcggcgtagagtaaaataaaacaccacaagtatgacacttgg;
99.p18:tctagagttctattcttgattaagttaataaataatgatattagttccaagttacaaata。
100.2.4构建ribhs基因表达盒:
101.根据上述化学合成的glub-1启动子、ribhs基因和glub-1终止子序列设计了三对引物p13和p14、p15和p16、p17和p18,相邻元件之间的引物存在20bp的重叠区,引物p19上有xhoi酶切位点,引物p24上hindiii有酶切位点。
102.以上述化学合成的glub-1启动子、ribhs基因和glub-1终止子的质粒为模板,分别使用进行三个元件(glub-1启动子、ribhs基因和glub-1终止子)的pcr扩增。
103.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p13/p15/p17,1μl p14/p16/p18,加ddh2o至50μl;
104.反应程序为:94℃30s,54℃30s,72℃120s,共45个循环,72℃再延伸10min,通过page电泳分离并回收pcr扩增片段。
105.随后将各个扩增片段等摩尔数混合,以混合片段为模板,利用引物p19和p24进行pcr扩增。
106.反应体系:1μl质粒,4μl 2.5mmol/l dntps,25μl buffer,kod plus(toyobo日本)聚合酶1u,1μl p13,1μl p18,加ddh2o至50μl;反应程序为:94℃30s,54℃30s,72℃240s,共45个循环,72℃再延伸10min,获得ribhs基因的表达盒,并对该表达盒进行t-vector克隆和重组质粒的核苷酸全序列测定。
107.其中,引物对p19和p20、p21和p22、p23和p24的具体序列如下:
108.p19:ggtaccgatctcgatttttgaggaattttagaagttgaacagagtcaatcgaacagacag;
109.p20:gagagcatagaggaagccataacatcatccaaggtaatctggtcggtactggtctgagat;
110.p21:atgaacatcatccaaggtaatctggtcggtactggtctgaagatcggtatcgtcgtcggt;
111.p22:gatactagttctcaattacatgccatcgagatggccaacctgaacagatccttcgagtta;
112.p23:tgtaattgagaactagtatctgaacagatccttcgagtaaaccacaagtatgacacttgg;
113.p24:gttctattcttgattaagttaataaataatgatattagttccaagttacaaatattcgaa。
114.3.构建植物表达载体
115.将上述所获得的ribas基因表达盒重组质粒用ecori和bamhi酶切,并连接到经同
样酶切的pcambia1301载体上,获得pcambia1301-ribas重组质粒;
116.再将上述所获得的ribbs基因表达盒重组质粒采用bamhi和kpni酶切,并连接到经同样酶切的pcambia1301-ribas重组质粒上,获得pcambia1301-ribas-ribbs重组质粒;
117.然后再将所获得的ribgs基因表达盒重组质粒采用kpni和xhoi酶切,并连接到经同样酶切的pcambia1301-ribas-ribbs重组质粒上,获得三基因的pcambia1301-ribas-ribbs-ribgs重组质粒。
118.最后再将上述所获得的ribhs基因表达盒重组质粒采用kpni和hindiii酶切,并连接到经同样酶切的pcambia1301-ribas-ribbs-ribgs重组质粒上,即获得含有四基因的pcambia1301-ribas-ribbs-ribgs-ribhs重组植物表达载体(图1)。
119.4.转化至水稻
120.4.1农杆菌的准备
121.1)挑取农杆菌单菌接种于5ml lb液体培养基(利福平50μg/ml,氯霉素100μg/ml)中,28℃,250转/分钟培养20h。
122.2)取1ml菌液转接入20-30ml lb液体培养基(利福平50μg/ml,氯霉素100μg/ml)中,28℃,250转/分钟培养约12h,测od
600
≈1.5。
123.3)8000转/分钟,4℃,10min离心收集菌体,重悬于农杆菌转化渗透液(5wt%蔗糖,0.05wt%silwet l-77)并稀释至od
600
≈0.8。
124.4.2农杆菌侵染及与水稻愈伤组织的共培养
125.将预培养4天的成熟胚来源的水稻胚性愈伤组织或培养4-5d的未成熟胚来源的初生愈伤组织立即浸入准备好的农杆菌悬浮液中,侵染30min后,然后将愈伤组织在无菌滤纸上吸除多余的菌液,直接转入共培养培养基于23℃黑暗条件下培养3-4d。
126.4.3抗性愈伤组织的筛选
127.将共培养的愈伤组织转出,无菌水漂洗3-4次,然后用无菌滤纸吸干多余水分,将愈伤组织转入选择培养基上,28℃暗培养,两周继代一次。
128.4.4植株再生
129.经2-3代筛选后,选择生长旺盛的抗性愈伤组织转移到预分化培养基上进行预分化处理;暗培养5-7天后再将抗性愈伤组织转移到分化培养基(每天16h光照、8h黑暗、28℃条件下进行分化,再生的小苗剪去原有的根,在生根培养基上生根壮苗,随后移入人工气候室盆栽,即获得转基因水稻,最初几天保持湿度,后续栽培管理按照常规方法进行。
130.实施例2转基因水稻的鉴定
131.1.转化植株基因组dna pcr检测:
132.对实施例1中获得的t1代植株叶片,用sds法抽提基因组dna作为模版,用pcr扩增方法,分别检测外源基因ribas、ribbs、ribgs和ribhs,所用引物的具体序列如下:
133.ribasz:tgttccatccaatcgaagaa;
134.ribasf:ttagaagtgcagcagatgacc;
135.ribbsz:atgttcactggtatcatcgaa;
136.ribbsf:ttagaaaccgttctcggacaa;
137.ribgsz:atggaagagtactacatgaag;
138.ribgsf:ttactccttggtaggcttggc;
139.ribhsz:atgaacatcatccaaggtaat;
140.ribhsf:ttactcgaaggatctgttcag。
141.所用扩增程序:94℃30s,54℃30s,72℃120s,共45个循环,最后72℃再延伸10min,结果参见图2;
142.由图2可知,野生型(w)对照都不能扩出外源基因,转四基因的三个株系都能扩出上述4个基因,表明外源基因均完整整合进了水稻基因组中。
143.2.转基因植株t2种子的rt-pcr检测:
144.把实施例1获得的转基因植株的t2代授粉后20天呈现黄色的发育种子,液氮条件下研磨成粉,再用trizol方法抽提种子的总rna,用mmv逆转录试剂盒,oligdt引物反转录为cdna,用如下引物和扩增条件进行外源ribas、ribbs、ribgs和ribhs基因的rt-pcr检测,水稻内源actin 1基因作为内参,所用引物具体序列如下:
145.ribasz:gctgttgacctggctgaagcc;
146.ribasf:acctcgttggtgtaaccgtag;
147.ribbsz:aacgacctgaccaagggttct;
148.ribbsf:gtgacggtgtcttcggtcaga;
149.ribgsz:ctgccatacgtcaccctgaag;
150.ribgsf:cctcagggatggacaggacgg;
151.ribhsz:gatgttgcttgggttcctggt;
152.ribhsf:ccttagtaccagctctctcga。
153.扩增程序:94℃30s,54℃30s,72℃30s,共25个循环,最后72℃再延伸10min,结果参见图3。
154.由图可知,对照野生型种子不能扩出外源基因,转四基因的三个株系都能扩出上述4个基因,表明外源基因在转基因种子中均进行了正确的转录表达。
155.实施例3转基因水稻种子的外观观察和vb2含量检测
156.1、通过对转基因水稻种子的外观观察,明显可以看出转入4基因的转基因水稻种子比野生型水稻种子具有更深的颜色(图4)。
157.表明导入上述4基因的转基因水稻种子中含有更高的vb2。
158.2、转基因水稻种子vb2的提取与测定:
159.采取国标gb5009.85-201(食品安全国家标准食品中维生素b2的测定)方法进行水稻种子vb2的提取与测定。结果显示,转四基因水稻种子中含有的vb2(0.1694mg/100g dw)跟野生型水稻种子所含有的vb2(0.0484mg/100g dw)相比含量提高了约3.5倍。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1