一种细菌微生物绝对定量的探针、方法、试剂盒及其应用与流程
1.本发明涉及一种细菌微生物绝对定量的探针、方法、试剂盒及其应用,属于生物领域、发酵领域、检测领域。
背景技术:
2.传统发酵食品酿造过程中有复杂的微生物菌群参与,其中细菌是重要的功能微生物。这些微生物与最终产品的品质密切相关,在发酵过程中,细菌微生物参与一系列的底物降解和产物合成相关的生理生化反应,将原料中的可利用糖原,蛋白质等大分子转化为醇类,醛类,酸类,酯类等风味成分,赋予产品独特的风味和感官特征。因此,实时跟踪发酵过程中细菌微生物的生长变化趋势对发酵过程控制,酿造工艺优化具有重要的指导意义。
3.目前,许多方法被用来对微生物进行绝对定量,例如以磷酸脂肪酸检测(plfa),atp检测,生物量碳检测(mbc)为代表的基于生物物质标记的检测方法;以高通量测序,共聚焦显微镜,流式细胞术,荧光定量pcr为代表的基于生物基因标记的定量方法。但目前的检测方法均存在不足:基于生物物质标记的检测方法在物种分辨率较低,不能区分微生物的种类,只能测定所有微生物的总量。基于生物基因标记的定量方法一般具有较高的检测限(如荧光定量pcr的检测限可达10个微生物以内),但需要高额的仪器设备和严格的操作环境,不适用于生产采样后的及时检测。
4.g四链体/血红素模拟酶活检测的原理在于g四链体可以与血红素形成具有过氧化氢酶活性的dna模拟酶,可催化过氧化氢氧化abts生成abts+,呈现绿色的显色反应,可在波长420nm下检测特征吸光值。g四链体结构的稳定性对整个检测过程至关重要,如果设计不当,当g四链体序列与其他碱基形成二聚体时,会导致g四链体序列无法形成g四链体,以此原理为基础的定量方法在使用中会导致低估样本中目标基因的含量,降低检测方法的灵敏度和准确性。
5.目前,基于g四链体/血红素模拟酶活检测的原理有被用于微生物的特异性检测的报道;例如文献wang y,li x,xi d,wang x.visual detection of fusarium proliferatum based on asymmetric recombinase polymerase amplification and hemin/g
‑
quadruplex dnazyme.rsc advances 2019;9:37144
‑
37147.中,使用了不对称特异性引物(上游引物添加g四链体的反向序列修饰,下游不修饰),该方法只能适用于样本中特定细菌fusarium proliferatum的检测,无法实现所有细菌微生物的总量检测;此外,该文献利用该不对称特异性引物进行检测时,是在pcr体系中添加不同浓度的上下游引物(上游引物浓度低,下游引物浓度高),通过重组聚合酶扩增(rpa)扩增形成双链产物,随着pcr反应的进行,上游引物被消耗殆尽,下游引物使用新合成的双链dna为模板扩增,从而形成带有g四链体末端的单链dna,从而使用g四链体/血红素模拟酶活检测检测样本中的fusarium proliferatum。但该定量方法依然需要pcr步骤产生g四链体,而pcr过程依然需要高额pcr设备以及严格的操作环境。
技术实现要素:
6.本发明的一种用于细菌微生物绝对定量的方法、试剂盒及应用,解决了如下的至少一个技术问题:(1)现有的方法无法实现所有细菌微生物的总量检测;(2)现有定量方法在物种分辨率较低和/或检测准确性不足;(3)现有定量方法需要高额的仪器设备和/或严格的操作环境,不适用于生产采样后的及时检测;(4)现有定量方法操作繁琐等。
7.本发明的第一个目的是提供一组探针,包括信号探针和淬灭探针;信号探针序列为seq id no.1所示(gggtgggtgggtgggtactcctacgggaggcagcagtaggg)或seq id no.3所示(gggattgggattgggattgggactcctacgggaggcagcagtaggg)。
8.在一种实施方式中,淬灭探针序列为seq id no.2所示(ccctactgctgcctcccgtaggagtaccca)或seq id no.4所示(ccctactgctgcctcccgtaggagtcccaa)。
9.在一种实施方式中,信号探针序列为seq id no.1所示,淬灭探针序列为seq id no.2所示。或者信号探针序列为seq id no.3所示,淬灭探针序列为seq id no.4所示
10.本发明的第二个目的是提供细菌微生物定量方法,所述方法包括使用本发明的探针。
11.所述方法包括:待测样品中dna发生解链;加入过量信号探针(序列如seq id no.1或seq id no.3),与待测样本的目标核苷酸片段结合形成双链,使g四链体裸漏在序列之外;加入足量淬灭探针(序列如seq id no.2或seq id no.4)与未结合的信号探针形成双链,破坏g四链体结构;利用裸漏在外g四链体与血红素反应形成具有过氧化氢酶活性的g四链体/血红素模拟酶,结合过氧化氢酶的活性表征细菌微生物的生物量。
12.在一种实施方式中,所述方法为绝对定量方法,还包括:建立过氧化氢酶活性(或者与过氧化氢酶活性呈相关性的指标,比如催化过氧化氢氧化abts生成abts+后溶液在波长420nm下的吸光值)与细菌微生物的生物量的标准曲线;检测待测样品时,将检测到的过氧化氢酶活性代入标准曲线,即获得待测样品中的细菌微生物的生物量。
13.在一种实施方式中,所述方法为相对定量方法,还包括:检测多个样品,根据不同样本检测得到的过氧化氢酶活性的相对比值确定该多个不同样本中细菌微生物的生物量的相对值。
14.在一种实施方式中,所述待测样品为含有菌体、基因组或宏基因组等的样品。可选地,所述待测样品为发酵食品成品或者取自发酵食品发酵过程中的样品,或者肠道、土壤、水体等环境样本;可选地,待测样本进行离心、收集菌体等预处理后再进行后续测定。优选地,收集该样品中的菌体后不经基因组提取,直接进行dna解链处理。
15.在一种实施方式中,所述样品为发酵食品或者取自发酵食品发酵过程中的样品。
16.在一种实施方式中,所述发酵食品为以下任意一种以上:白酒、黄酒、酱油、啤酒、葡萄酒、食醋、发酵茶、传统发酵蔬菜、发酵饮料、酒精饮品、酸奶、干酪、果醋、酒酿、豆豉、乳腐、发酵米面食品等。
17.在一种实施方式中,所述待测样品中dna发生解链,是采用高温方式进行。可选地,是将待测样品在高于90℃温度下处理。可以是金属浴、水浴、烘箱、保温仪等任意一种能提供对应温度的环境。
18.在一种实施方式中,所述解链是在缓冲液中进行。可选地,所述缓冲液可以是
tris
‑
hcl缓冲液,还含有kcl、nh4cl、nacl中的任意一种或者多种。可选地,所述缓冲液为tris
‑
hcl,kcl,ph=7.9。
19.在一种实施方式中,所述过量是指,加入量高于能与待测样本的目标核苷酸片段全部结合形成双链时所需要的信号探针的量。具体用量,本领域技术人员可以结合本领域常识或具体的待测样本来确定,或者通过预实验来确定。
20.在一种实施方式中,所述过量是指,超过10
10
个拷贝的信号探针。
21.在一种实施方式中,所述信号探针与待测样本的目标核苷酸片段结合形成双链,是在50
‑
60℃温度范围下进行的。
22.在一种实施方式中,所述足量是指,加入量足以与全部未结合的信号探针形成双链时所需要的淬灭探针的量。具体用量,本领域技术人员可以结合本领域常识来确定或具体的待测样本来确定,或者通过预实验来确定。
23.在一种实施方式中,所述足量是指,信号探针的双倍量。
24.在一种实施方式中,所述加入足量淬灭探针与未结合的信号探针形成双链,是在能使淬灭探针与未结合的信号探针形成双链的温度下进行;本领域技术人员可以结合本领域常识来确定或具体的待测样本来确定。
25.在一种实施方式中,所述利用裸漏在外g四链体与血红素反应形成具有过氧化氢酶活性的g四链体/血红素模拟酶,结合过氧化氢酶的活性表征细菌微生物的生物量,是指在体系中加入血红素反应后,再加入abts和h2o2,然后通过反应物的吸光值来表征过氧化氢酶活性。
26.在一种实施方式中,所述吸光值是在波长420nm下的吸光值。
27.在一种实施方式中,所述定量方法,具体是:
28.(1)待测样品进行dna解链处理;
29.(2)加入信号探针,于55℃反应30min;
30.(3)加入淬灭探针,于55℃反应30min;
31.(4)加入血红素,于37℃反应30min;
32.(5)加入2,2
‑
连氮基
‑
双
‑
(3
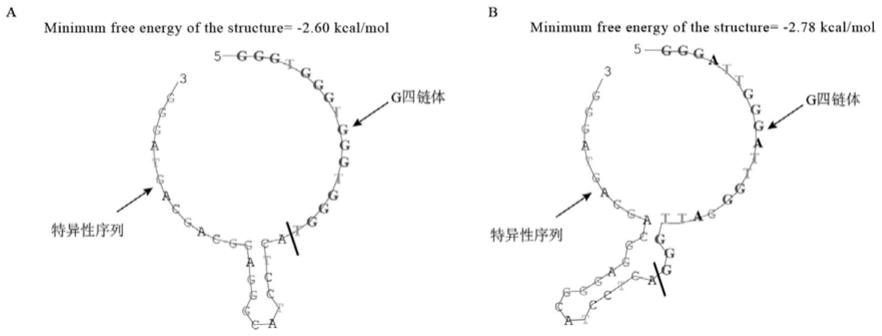
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)和h2o2,于37℃温度反应30min;
33.(6)检测反应物在波长420nm下的吸光值;
34.(7)结合吸光值对样品中细菌微生物进行定量。
35.在一种实施方式中,所述定量方法,还包括:配置不同已知细菌微生物含量的样品,测定不同样品经上述方法处理后得到的吸光值;绘制吸光值与不同细菌微生物含量的标准曲线;将待测样品经经上述方法处理后得到的吸光值代入标准曲线,即获得待测样品中细菌微生物含量。
36.本发明的第三个目的是提供一种用于细菌微生物绝对定量的检测试剂盒,含有本发明的序列如seq id no.1或seq id no.3的信号探针。
37.在一种实施方式中,所述检测试剂盒还含有序列如seq id no.2或seq id no.4的淬灭探针。
38.在一种实施方式中,所述检测试剂盒还含有如下任意一种或多种:血红素、缓冲液、2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)、h2o2。也可以不含有这
些试剂,在使用试剂盒时,有操作人员另行准备。
39.在一种实施方式中,所述检测试剂盒中,缓冲液可以是tris
‑
hcl缓冲液,还含有kcl、nh4cl、nacl中的任意一种或者多种。可选地,所述缓冲液为tris
‑
hcl,kcl,ph=7.9。
40.在一种实施方式中,所述检测试剂盒是细菌微生物绝对定量试剂盒,所述试剂盒同时包括四种试剂(试剂1,试剂2,试剂3,试剂4)和一套细菌微生物定量探针(信号探针,淬灭探针);所述的试剂1包括血红素;所述的试剂2包括缓冲液(tris
‑
hcl,kcl,ph=7.9;其中kcl可替换为nh4cl、nacl);所述的试剂3包括2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts);所述的试剂4包括h2o2。
41.在一种实施方式中,所述检测试剂盒中,试剂或探针可以是液体状态或者固体状态,使用时本领域技术人员可以常规地调整到适合的浓度。
42.本发明的第四个目的是提供所述试剂盒的使用方法。
43.在一种实施方式中,所述使用方法包括:在dna解链的待测样本中加入过量的信号探针反应一段时间,使信号探针与待测样本中的目标片段结合;然后在加入足量淬灭探针使之与未结合的信号探针的形成双链;再加入血红素,反应一段时间后加入abts和h2o2,反应一段时间,检测反应物的吸光值,结合吸光值对样品中细菌微生物进行定量。
44.在一种实施方式中,所述方法包括,将试剂和探针调整到适合使用的浓度。
45.(1)待测样品进行dna解链处理;(2)加入信号探针,于55℃反应30min;(3)加入淬灭探针,于55℃反应30min;(4)加入血红素,于37℃反应30min;(5)加入2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)和h2o2,于37℃温度反应30min;(6)检测反应物在波长420nm下的吸光值;(7)结合吸光值对样品中细菌微生物进行定量。
46.本发明的第五个目的是提供所述试剂盒在细菌微生物定量中的应用。
47.在一种实施方式中,所述应用是用于发酵食品技术领域,或者肠道、土壤、水体等环境微生物检测技术领域;可选地,所述发酵食品为以下任意一种以上:白酒、黄酒、酱油、啤酒、葡萄酒、食醋、发酵茶、传统发酵蔬菜、发酵饮料、酒精饮品、酸奶、干酪、果醋、酒酿、豆豉、乳腐、发酵米面食品等。
48.在一种实施方式中,所述应用时,待测样本可以为含有菌体、基因组或宏基因组等的样品。可选地,所述待测样品为发酵食品成品或者取自发酵食品发酵过程中的样品;可选地,待测样本进行离心、收集菌体等预处理后再进行后续测定。优选地,收集该样品中的菌体后不经基因组提取,直接进行dna解链处理。
49.有益效果:
50.本发明将g四链体与特异性性序列结合形成信号探针,信号探针与目标序列结合使得g四链体裸漏在序列之外,加入足量淬灭探针与未反应信号探针形成双链,破坏g四链体结构,通过与血红素反应形成g四链体/血红素模拟酶,表现出过氧化氢酶活性,以过氧化氢酶活性表征微生物的生物量。本发明的细菌微生物定量探针,能够实现所有细菌微生物的总量检测;进一步地,对信号探针进行优化,信号探针序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。与seq id no.3的信号序列相比,seq id no.1的信号探针中g四链体序列不与特异性序列产生额外的空间结构(图1),检测的准确性更高、最低检出限改善。
51.本发明的探针用于检测和细菌微生物定量时,不需要昂贵仪器的检测流程。还首
次提供一种用于微生物绝对定量试剂盒,可在2.5h内完成定量工作。本发明为避免使用高额设备,如pcr仪,通过信号探针和淬灭探针组合的方式实现微生物定量。本发明解决了目前的微生物定量手段均依赖较昂贵的仪器,在实际用于过程中十分受限制的问题。
52.进一步,本发明能够实现快速细菌微生物检测,样品不必须进行核酸提取,仅需要将样本中的微生物洗脱于缓冲液中,直接进行后续实验。同时,与荧光定量pcr定量结果相比,本发明所得到的定量结果无显著性差异。
53.综上,基于本发明所提供的探针及检测试剂盒,用于细菌微生物定量,具有快速、便宜、准确的特点。
附图说明
54.图1:信号探针二聚体结构。(a)seq id no.1的g四链体序列不与特异性序列自成环;(b)seq id no.3的g四链体序列与特异性序列自成环。
55.图2:探针特异性验证。
56.图3:基于基因组提取的细菌微生物定量的标准曲线。(a)以escherichia coli基因组为梯度稀释标准品;(b)以bacillus velezensis基因组为梯度稀释标准品。
57.图4:基于不提取样本基因组的细菌微生物定量的标准曲线。(a)以escherichia coli基因组为梯度稀释标准品;(b)以bacillus velezensis基因组为梯度稀释标准品。
58.图5:qpcr标准曲线。
59.图6:比较基于基因组提取的细菌微生物探针定量实验、基于不提取样本基因组的细菌微生物探针定量实验和qpcr细菌微生物定量实验;其中,(a)基于基因组提取的细菌微生物探针定量实验,(b)基于不提取样本基因组的细菌微生物探针定量实验,(c)qpcr细菌微生物定量实验。
60.图7:比较基于seq id no.1/seq id no.2的探针(a)和seq id no.3/seq id no.4探针(b)检测结果的稳定性。
具体实施方式:
61.实施例1:细菌微生物定量探针组合试剂
62.探针组合试剂;含有独立包装的信号探针试剂和淬灭探针试剂;其中,信号探针序列如seq id no.1所示或seq id no.3所示的,淬灭探针序列为seq id no.2所示(对应信号探针seq id no.1)或seq id no.4所示(对应信号探针seq id no.3)的。
63.信号探针试剂和淬灭探针试剂,为干粉或者液体状;为干粉时,可以在实验之前稀释到合适的浓度,比如,使用无菌水或者缓冲液稀释至浓度为20μm;为液体状时,浓度可以是20
‑
200μm,试剂使用前可以进行稀释,或者直接使用。
64.实施例2:细菌微生物定量试剂盒及其使用
65.细菌微生物定量试剂盒,含有独立包装的信号探针试剂和淬灭探针试剂;其中,信号探针序列如seq id no.1所示或seq id no.3所示的,淬灭探针序列为seq id no.2(对应信号探针seq id no.1)或seq id no.4所示(对应信号探针seq id no.3)。
66.该试剂盒使用时,可以与血红素、缓冲液、2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)、h2o2配合使用。
67.使用方法是:
68.(1)溶液配置。配置100nm的血红素溶液(试剂1);配置终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9(试剂2);7mm的2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)(试剂3)以及7mm的h2o2溶液(试剂4);溶剂均为无菌水。
69.(2)信号探针与样本dna形成双链。向2ml的试剂2加入4μl的样本基因组dna,于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
70.(3)淬灭探针与未结合的信号探针形成双链。淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
71.(4)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm试剂1,37℃处理30min。
72.(5)显色反应。向(4)反应结束的体系中加入终浓度为7mm的试剂(abts)和终浓度为7mm的试剂4,37℃处理30min,进行显示反应(绿色)。
73.检测反应物在波长420nm下的吸光值;结合吸光值对样品中细菌微生物进行定量。
74.当然,在进行绝对定量时,可以自行绘制吸光值与细菌微生物生物量的标准曲线,或者根据试剂盒推荐的使用方法和标准曲线直接换算得到细菌微生物的生物量。
75.实施例3:细菌微生物定量试剂盒
76.细菌微生物定量试剂盒,含有独立包装的信号探针试剂和淬灭探针试剂;其中,信号探针序列如seq id no.1所示或seq id no.3所示的,淬灭探针序列为seq id no.2(对应信号探针seq id no.1)或seq id no.4所示(对应信号探针seq id no.3)。
77.该试剂盒中还含有100nm的血红素溶液(试剂1)、tris
‑
hcl缓冲液、7mm的2,2
‑
连氮基
‑
双
‑
(3
‑
乙基苯并二氢噻唑啉
‑6‑
磺酸)二铵盐(abts)、7mm的h2o2溶液。
78.实施例4:细菌微生物定量探针、试剂盒的特异性
79.(1)选择发酵食品样本中广泛存在的36个细菌种微生物作为阳性对照,分别为lactobacillus buchneri,lactobacillus dioilvorans,lactobacillus brevis,lactobacillus crustorum,lactobacillus plantarum,lactobacillus harbinensis,lactobacillus acidiliscis,pediococcus ethanolidurans,pediococcus acidilactici,pediococcus pentosaceus,lactobacillus murinus,lactobacillus curvatus,lactobacillus casei,lactobacillus reuteri,lactobacillus panis,lactobacillus fermentum,lactobacillus johnsonii,lactobacillus delbrueckii,lactococcus lactis,weissella confusa,weissella paramesenteroides,weissella viridescens,leuconostoc citreum,leuconostoc lactis,leuconostoc mesenteroides,leuconostoc pseudomesenteroides,enterococcus italicus,enterococcus lactis,enterococcus faecalis,bacillus coagulans,bacillus licheniformis,bacillus tequilensis,bacillus subtilis,bacillus velezensis,acetobacter pasteurianus,enterococcus faecium。选择发酵食品样本中广泛存在的7个真菌种作为阴性对照,分别为aspergillus tubingensis,mucor rouxianus,schizosaccharomyces pombe,zygosaccharomyces bailii,pichia kudriavzevii,saccharomycopsis fibuligera,saccharomyces cerevisiae。
80.(2)以上微生物选择不同的培养基进行培养,其中lactobacillus buchneri,lactobacillus dioilvorans,lactobacillus brevis,lactobacillus crustorum,lactobacillus plantarum,lactobacillus harbinensis,lactobacillus acidiliscis,pediococcus ethanolidurans,pediococcus acidilactici,pediococcus pentosaceus,lactobacillus murinus,lactobacillus curvatus,lactobacillus casei,lactobacillus reuteri,lactobacillus panis,lactobacillus fermentum,lactobacillus johnsonii,lactobacillus delbrueckii,lactococcus lactis,weissella confusa,weissella paramesenteroides,weissella viridescens,leuconostoc citreum,leuconostoc lactis,leuconostoc mesenteroides,leuconostoc pseudomesenteroides使用mrs培养基,培养基配方为胰蛋白胨10.0g/l,牛肉浸膏8.0g/l,酵母提取物4.0g/l,葡萄糖18.0g/l,无水山梨醇油酸酯0.8ml/l,k2hpo
4 2.5g/l,三水合乙酸钠6.0g/l,柠檬酸三铵2.0g/l,mgso4·
7h2o 0.3g/l,mnso4·
4h2o 0.08g/l。培养条件为30℃48h。enterococcus italicus,enterococcus lactis,enterococcus faecalis,bacillus coagulans,bacillus licheniformis,bacillus tequilensis,bacillus subtilis,bacillus velezensis,acetobacter pasteurianus,enterococcus faecium,escherichia coli使用lb培养基,培养基配方为蛋白胨10.0g/l,酵母粉5g/l,氯化钠10g/l。培养条件为37℃24h。aspergillus tubingensis,mucor rouxianus,schizosaccharomyces pombe,zygosaccharomyces bailii,pichia kudriavzevii,saccharomycopsis fibuligera,saccharomyces cerevisiae使用ypd培养基,培养基配方为酵母膏10g/l,蛋白胨20g/l,葡萄糖20g/l。培养条件为:霉菌30℃下培养5天,酵母菌30℃条件下培养2天。
81.(3)单菌基因组提取。上述菌液在12000rpm条件下处理2min,收集沉淀。43种微生物纯培养物的基因组使用基因抽提试剂盒dneasy tissue kit提取。
82.(4)探针选择为细菌探针,信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
83.(4)信号探针与样本dna形成双链。分别向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl不同微生物的基因组dna,于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
84.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
85.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm试剂1(血红素),37℃处理30min。
86.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。结果如图1所示添加细菌基因组的实验组出现显色反应,添加真菌基因组的实验组和空白对照组没有出现显色反应,证明本试剂盒中检测细菌域微生物的特异性。
87.实施例5:定量方法准确性评估
88.一、对escherichia coli的定量准确性
89.(1)escherichia coli菌液根据实施例4中的培养方法获得,细菌浓度通过平板计数法测定,基因组的提取同实施例4。
90.(2)通过10倍梯度稀释escherichia coli基因组dna。
91.(3)使用细菌域的探针,以不同浓度的escherichia coli基因组dna进行显色反应。信号探针序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
92.(4)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl不同稀释度的基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
93.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
94.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
95.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照。
96.(8)通过计算吸光值与菌液浓度之间的线性关系构建标准曲线,如图3a所示,r2=0.99(x的单位是log10 cfu/ml,y的单位是od
420
,线性范围为103~107)。证明本发明所提供的试剂盒定量方法的准确性。
97.二、对bacillus velezensis的定量准确性
98.(1)bacillus velezensis菌液根据实施例4中的培养方法获得,细菌浓度通过平板计数法测定,基因组的提取同实施例4。
99.(2)通过10倍梯度稀释bacillus velezensis基因组dna。
100.(3)使用细菌域的探针,以不同浓度的bacillus velezensis基因组dna进行显色反应。信号探针序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
101.(4)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl不同稀释度的基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
102.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
103.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
104.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照。
105.(8)通过计算吸光值与菌液浓度之间的线性关系构建标准曲线,如图3b所示,r2=0.99(x的单位是lg(cfu/ml),y的单位是od
420
,线性范围为103~107)。证明本发明所提供的试剂盒定量方法的准确性。
106.实施例6:酸奶样本中细菌微生物的定量实验
107.(1)参考achilleos c,berthier f.quantitative pcr for the specific quantification of lactococcus lactis and lactobacillus paracasei and its interest for lactococcus lactis in cheese samples.food microbiology 2013;36:286
‑
295.的2.6节的方法,提取来源于市购的酸奶样本的基因组。基因组浓度为205.89ng/μl。
108.(2)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
109.(4)信号探针与样本dna形成双链。向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl酸奶宏基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
110.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
111.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm试剂1(血红素),37℃处理30min。
112.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(7mm h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.86。
113.(8)根据实施例5(一)所得的标准曲线,计算得样本中细菌微生物总量为8.22log
10 cfu/ml,根据实施例5(二)所得的标准曲线,计算得样本中细菌微生物总量为8.11log
10 cfu/ml。
114.(9)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一酸奶样本中的细菌进行定量,结果显示细菌微生物总量为8.01log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.008)。
115.实施例7:酒醅样本中细菌域微生物的绝对定量
116.(1)参考song z w,du h,zhang y,xu y.unraveling core functional microbiota in traditional solid
‑
state fermentation by high
‑
throughput amplicons and metatranscriptomics sequencing.frontiers in microbiology 2017;8:1294的materials and methods中的方法,提取来源于山东省景芝镇的酒醅样本中的宏基因组,基因组浓度为100.02ng/μl。
117.(2)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
118.(3)信号探针与样本dna形成双链。向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl酒醅宏基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
119.(4)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(3)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
120.(5)形成血红素/g四链体结构。向(4)步骤反应之后的体系中加入终浓度为100nm试剂1(血红素),37℃处理30min。
121.(6)显色反应。向(5)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.678。
122.(7)根据实施例5(一)所得的标准曲线,计算得样本中细菌微生物总量为6.42log
10 cfu/ml,根据实施例5(二)所得的标准曲线,计算得样本中细菌微生物总量为6.34log
10 cfu/ml。
123.(8)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一酒醅样本中的细菌进行定量,结果显示细菌微生物总量为6.33log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.007)。
124.实施例8:奶酪样本中细菌域微生物的绝对定量
125.(1)参考achilleos c,berthier f.quantitative pcr for the specific quantification of lactococcus lactis and lactobacillus paracasei and its interest for lactococcus lactis in cheese samples.food microbiology 2013;36:286
‑
295.的2.6节的方法,提取来源于市购的奶酪样本的宏基因组。宏基因组浓度为20.18ng/μl。
126.(2)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
127.(3)信号探针与样本dna形成双链。向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl奶酪宏基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
128.(4)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(3)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
129.(5)形成血红素/g四链体结构。向(4)步骤反应之后的体系中加入终浓度为100nm试剂1(血红素),37℃处理30min。
130.(6)显色反应。向(5)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(7mm h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.564。
131.(7)根据实施例5(一)所得的标准曲线,计算得样本中细菌微生物总量为5.29log
10 cfu/ml,根据实施例5(二)所得的标准曲线,计算得样本中细菌微生物总量为5.24log
10 cfu/ml。
132.(8)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一奶酪样本中的细菌进行定量,结果显示细菌微生物总量为5.23log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.006)。
133.实施例9:基于不提取样本基因组的细菌域微生物绝对定量方法
134.一、对escherichia coli的定量准确性
135.(1)escherichia coli菌液根据实施例4中的培养方法获得,细菌浓度通过平板计
数法测定。
136.(2)通过10倍梯度稀释(1)中的escherichia coli菌液
137.(3)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
138.(4)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl不同稀释度的菌液(不加样本菌液为空白对照)。于沸水浴中处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
139.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
140.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
141.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照。
142.(8)通过计算吸光值与菌液浓度之间的线性关系构建标准曲线,如图4a所示,r2=0.99(x的单位是log10 cfu/ml,y的单位是od
420
,线性范围为103~107)。证明本发明所提供的试剂盒定量方法的准确性
143.二、对bacillus velezensis的定量准确性
144.(1)bacillus velezensis菌液根据实施例4中的培养方法获得,细菌浓度通过平板计数法测定。
145.(2)通过10倍梯度稀释(1)中的bacillus velezensis菌液
146.(3)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
147.(4)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl不同稀释度的菌液(不加样本菌液为空白对照)。于沸水浴中处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
148.(5)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(4)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
149.(6)形成血红素/g四链体结构。向(5)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
150.(7)显色反应。向(6)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照。
151.(8)通过计算吸光值与菌液浓度之间的线性关系构建标准曲线,如图4b所示,r2=0.99(x的单位是log10 cfu/ml,y的单位是od
420
,线性范围为103~107)。证明本发明所提供的试剂盒定量方法的准确性
152.实施例10:基于不提取样本基因组的细菌域微生物绝对定量方法测定酸奶样本中
细菌微生物的含量
153.(1)样本为购买于当地超市的酸奶,样本处理方法如下:1ml样本中加入5ml磷酸缓冲液,3000
×
g离心10min收集菌体。
154.(2)洗涤。向(1)中所获得的菌体中加入5ml磷酸缓冲液,12000
×
g离心2min收集菌体,重复一次。
155.(3)菌体重悬,将向(2)中所获得的菌体中加入1ml试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9),吹吸混匀。
156.(4)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
157.(5)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl酸奶菌液(不加样本菌液为空白对照)。于沸水水浴下处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
158.(6)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(5)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
159.(7)形成血红素/g四链体结构。向(6)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
160.(8)显色反应。向(7)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.84。
161.(9)根据实施例9(一)所得的标准曲线,计算得样本中细菌微生物总量为8.28log
10 cfu/ml,根据实施例9(二)所得的标准曲线,计算得样本中细菌微生物总量为7.82log
10 cfu/ml。
162.(10)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一酸奶样本中的细菌进行定量,结果显示细菌微生物总量为8.01log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.029)。
163.实施例11:基于不提取样本基因组的细菌域微生物绝对定量方法测定酒醅样本中细菌微生物的含量
164.(1)样本来源于山东景芝镇某酒厂的发酵酒醅,样本处理方法如下:1g样本中加入5ml磷酸缓冲液,3000
×
g离心10min收集菌体。
165.(2)洗涤。向(1)中所获得的菌体中加入5ml磷酸缓冲液,12000
×
g离心2min收集菌体,重复一次。
166.(3)菌体重悬,将向(2)中所获得的菌体中加入1ml试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9),吹吸混匀。
167.(4)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
168.(5)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl酒醅菌液(不加样本菌液为空白对照)。于
沸水水浴下处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
169.(6)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(5)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
170.(7)形成血红素/g四链体结构。向(6)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
171.(8)显色反应。向(7)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.772。
172.(9)根据实施例9(一)所得的标准曲线,计算得样本中细菌微生物总量为7.60log
10 cfu/ml,根据实施例9(二)所得的标准曲线,计算得样本中细菌微生物总量为7.17log
10 cfu/ml。
173.(10)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一酒醅样本中的细菌进行定量,结果显示细菌微生物总量为7.38log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.024)。
174.实施例12:基于不提取样本基因组的细菌域微生物绝对定量方法测定奶酪样本中细菌微生物的含量
175.(1)样本为购买于当地超市的奶酪,样本处理方法如下:1g样本中加入5ml磷酸缓冲液,3000
×
g离心10min收集菌体。
176.(2)洗涤。向(1)中所获得的菌体中加入5ml磷酸缓冲液,12000
×
g离心2min收集菌体,重复一次。
177.(3)菌体重悬,将向(2)中所获得的菌体中加入1ml试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9),吹吸混匀。
178.(4)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
179.(5)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl奶酪菌液(不加样本菌液为空白对照)。于沸水水浴下处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
180.(6)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(5)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
181.(7)形成血红素/g四链体结构。向(6)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
182.(8)显色反应。向(7)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.53。
183.(9)根据实施例9(一)所得的标准曲线,计算得样本中细菌微生物总量为5.16log
10 cfu/ml,根据实施例9(二)所得的标准曲线,计算得样本中细菌微生物总量为4.84log
10 cfu/ml。
184.(10)通过荧光定量法(定量步骤和材料同实施例13(6))对对上述同一奶酪样本中
的细菌进行定量,结果显示细菌微生物总量为5.10log
10 cfu/ml,与上述方法测定的两组数据基本一致(变异系数,cv=0.033)。
185.实施例13:微生物定量检测试剂盒与荧光定量pcr检测的结果比较
186.(1)样本选择来自山东景芝某酒厂发酵终点的三个白酒酒醅样本。
187.(2)样本处理:
188.(i)提取三个样本中的总基因组,基因组浓度分别为369ng/μl、590ng/μl、321.89ng/μl。
189.(ii)1g样本中加入5ml磷酸缓冲液,3000
×
g离心10min收集菌体。向所获得的菌体中加入5ml磷酸缓冲液,12000
×
g离心2min收集菌体,重复一次。菌体重悬,将向所获得的菌体中加入1ml试剂2缓冲液,吹吸混匀。
190.(3)使用细菌域的探针进行显色反应。信号探针的序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针的序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。
191.(4)基于不提取基因组的试剂盒定量方法测定。
192.(i)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入10μl酒醅菌液(不加样本菌液为空白对照)。于沸水浴中处理20min。加入4μl 20μm的信号探针之后于55℃下反应30min。
193.(ii)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(i)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
194.(iii)形成血红素/g四链体结构。向(ii)步骤反应之后的体系中加入终浓度为100mm的试剂1(血红素),37℃处理30min。
195.(iv)显色反应。向(iii)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.732,0.781,0.78。
196.(v)根据实施例9(一)所得的标准曲线,计算得样本中细菌微生物总量为7.52
±
0.28log
10 cfu/ml。
197.(5)基于提基因组的试剂盒定量方法测定
198.(i)信号探针与样本dna形成双链。向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl酒醅宏基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。加入4μl 20μm的信号探针之后于55℃下反应30min。
199.(ii)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(i)步骤反应之后的体系中加入8μl 20μm的淬灭探针,55℃下反应30min。
200.(iii)形成血红素/g四链体结构。向(ii)步骤反应之后的体系中加入终浓度为100nm试剂1(血红素),37℃处理30min。
201.(iv)显色反应。向(5)反应结束的体系中加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光值,以不加样本dna的实验组作为空白对照,显示吸光值是0.761,0.80,0.80。
202.(v)根据实施例5(一)所得的标准曲线,计算得样本中细菌微生物总量为7.50
±
0.22log
10 cfu/ml。
203.(6)qpcr定量样本中细菌微生物含量
204.(i)escherichia coli菌液根据实施例4中的培养方法获得,细菌浓度通过平板计数法测定,基因组的提取同实施例4。
205.(ii)通过10倍梯度稀释escherichia coli基因组dna。
206.(iii)qpcr的体系为sybr green 10μl,上下游引物0.4μl,模板dna 0.5μl,无菌水补齐20μl。
207.(iv)qpcr的反应程序:预变性95℃ 5min,循环阶段:95℃ 5s,60℃ 20s;循环数40,溶解曲线从65℃升温到95℃,每5s升高0.5℃。
208.(v)使用细菌特异性引物对提取的基因组进行qpcr,引物序列下游序列为actcctacgggaggcagcagtaggg(seq id no.5),下游序列为gactachvgggtwtctaat(seq id no.6)。
209.(vi)通过10倍梯度稀释基因组dna,建立ct值与escherichia coli菌浓的标准曲线,如图6所示,r2=0.99。
210.(vii)qpcr体系和反应条件同(iii),(iv)。根据反应结束的ct值,通过所建立的标准曲线计算细菌微生物在样本中的浓度为7.52
±
0.39lg(cfu/g)。
211.(7)通过显著性差异分析,结果如图5所示,三种定量方法之间无显著性差异(p<0.05)
212.实施例14:应用两种不同序列信号探针进行检测的检出限
213.分别用不同序列的信号探针进行定量。
214.(1)escherichia coli菌液根据实施例4中的培养方法获得,细菌浓度通过平板计数法测定,浓度为8.2log10 cfu/ml基因组的提取同实施例4。
215.(2)通过10倍梯度稀释escherichia coli基因组dna,得到3.2log10 cfu/ml的dna模板。
216.(3)利用细菌信号探针序列为gggtgggtgggtgggtactcctacgggaggcagcagtaggg(seq id no.1),淬灭探针序列为ccctactgctgcctcccgtaggagtaccca(seq id no.2)。加入(2)中得到的3.2log10 cfu/mlescherichia coli基因组dna进行显色反应。
217.(4)利用细菌信号探针序列为(seq id no.3)gggattgggattgggattgggactcctacgggaggcagcagtaggg,淬灭探针序列为ccctactgctgcctcccgtaggagtcccaa(seq id no.4)。加入(2)中得到的3.2log10 cfu/ml escherichia coli基因组dna进行显色反应。
218.(5)信号探针与样本dna形成双链。将向2ml的试剂2(包括终浓度为50mm的tris
‑
hcl,终浓度为50mm的kcl,最终ph为7.9)加入4μl escherichia coli基因组dna(不加样本dna为空白对照)。于90℃下水浴处理10min。分别加入4μl 20μm的不同信号探针之后于55℃下反应30min。
219.(6)淬灭探针与未结合的信号探针形成双链,破坏g四链体结构。向(5)步骤反应之后的体系中加入分别8μl 20μm的淬灭探针,55℃下反应30min。
220.(7)形成血红素/g四链体结构。向(6)步骤反应之后的体系中加入终浓度为100nm的试剂1(血红素),37℃处理30min。
221.(8)显色反应。向(7)反应结束的体系中分别加入终浓度为7mm的试剂3(abts)和终浓度为7mm的试剂4(h2o2),37℃处理30min。利用紫外分光光度计测定在波长420nm下的吸光
值,以不加样本dna的实验组作为空白对照。
222.(9)重复(5)(6)(7)(8)步骤9次,比较检测结果的稳定性,如图7所示。基于seq id no.3的信号序列定量结果的变异系数(cv)为11.33%,基本可以实现检测;基于seq id no.1的信号序列的定量结果变异系数为0.95%,检测效果稳定。
223.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1