一种猪流行性腹泻病毒株及其灭活疫苗与干扰素联合免疫方法与流程
本发明属于病毒及免疫技术领域,具体而言,涉及一种猪流行性腹泻病毒株、灭活疫苗及其与干扰素的疫苗组合物。
背景技术:
猪流行性腹泻(porcineepifemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepifemicdiarrheavirus,pedv)感染引起的一种急性肠道疾病。pedv可感染各个年龄阶段的猪,其中一周龄以内的仔猪感染最为严重,主要表现呕吐、水样腹泻、脱水等症状,病死率达90%以上。剖检感染猪可见其空肠和回肠部分肠绒毛萎缩、脱落,肠道壁变薄、透明。一周龄以上猪只虽然感染后死亡率不高,但仍出现腹泻、脱水、消瘦等症状,饲料回报率显著降低,猪只抵抗力下降,易继发其他病原感染,给猪群健康和猪场经济效益均带来十分不利的影响。2010年冬季,我国南方猪场开始大规模爆发ped并快速蔓延至全国各地猪场。在该次疫情中,一周龄以内的仔猪死亡率高达100%,给养猪业造成了巨大的经济损失,市场猪肉供应及居民消费指数均受到严重影响。此后,pedv变异毒株不断出现,导致其感染率和死亡率居高不下,已成为危害我国养猪业健康发展的重要病原之一。
疫苗接种免疫是目前猪场主要依赖的ped防控手段。因此,快速研制出免疫原性好、保护力强、安全性高的疫苗是当前ped防治亟待解决的问题。1984年ped在我国陆续报道以后,猪场开始使用接种pedvcv777毒株制成的弱毒苗或二联灭活苗进行预防,对猪场预防猪病毒性腹泻产生了较好的保护效果。2010年疫苗接种未能产生较好的保护效果,ped再次爆发流行,猪场流行毒株不断发生变异,相比原来疫苗毒株已经发生了较大变异。对已公布的我国流行毒株的基因组序列进行分析发现,我国流行毒株基因型十分丰富,其中gii-a亚型毒株最多,gii-c亚型近几年开始频繁出现。
然而,现有的疫苗毒株如cv777和dr13等,均为gi亚型毒株,这表明现行疫苗毒株与我国流行毒株已经不太匹配。因此,利用符合我国流行趋势的毒株制备疫苗才能满足当前pedv的防控需求。
技术实现要素:
针对目前pedv经典疫苗cv777株无法对国内猪流行性腹泻提供足够的保护力,本发明的目的在于提供一种灭活疫苗pedv-ch-hb-1801株及其与猪基因工程干扰素联合免疫的方法,该流行毒株制得的疫苗及免疫方法能够对流行毒株产生较好的保护力,而且具有较大的经济效益和应用前景。
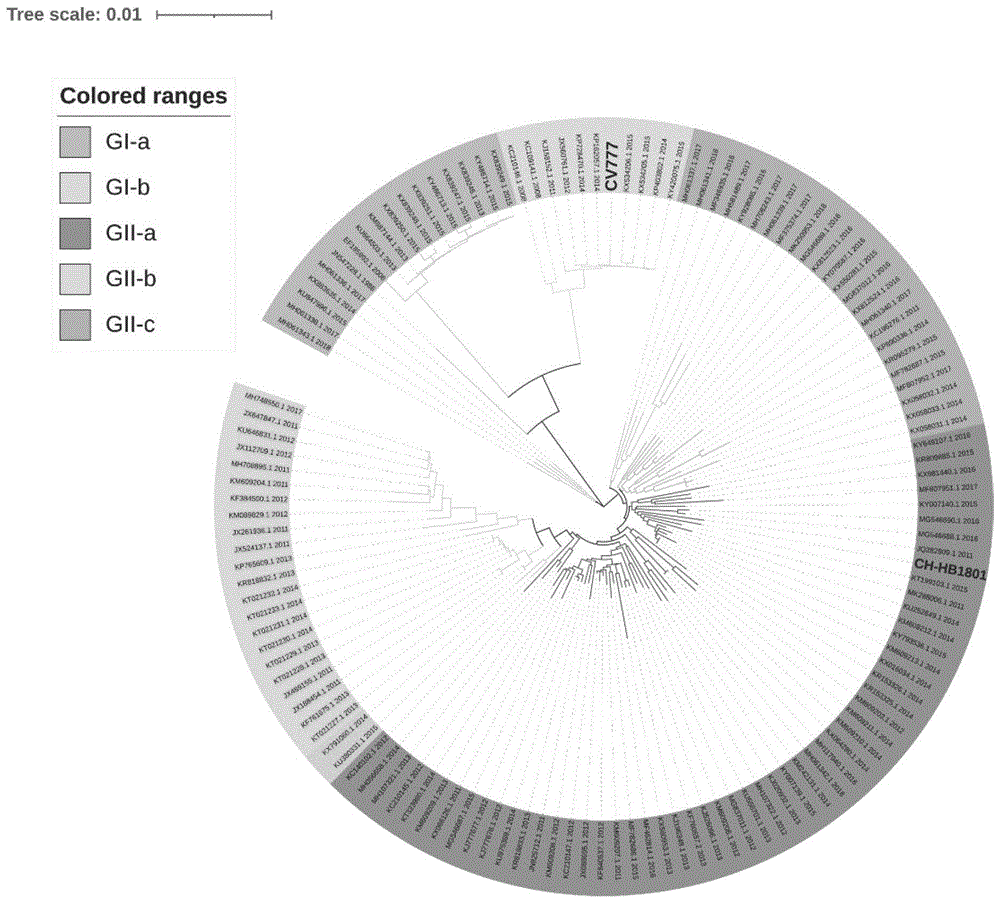
本发明人前期从湖北省某腹泻仔猪小肠样品中分离到一株疑似pedv的流行毒株,成功在vero细胞上繁殖扩增后,通过pcr、血清中和实验、动物感染回归实验进行了鉴定,结果证明该病毒为pedv病毒,命名为pedv-ch-hb-1801,随后通过高通量测序,获得了该病毒的全基因组序列,全基因组序列分析表明pedv-ch-hb-1801株与疫苗株cv777同源性仅为96.06%;其中,s蛋白的核苷酸和氨基酸同源性仅为93.76%和93.44%。全基因组进化树也表明cv777属于gi亚型,而本发明的pedv-ch-hb-1801株与多数中国分离毒株同属于gii亚型。动物感染回归实验表明,pedv-ch-hb-1801株具有较强的致病性,感染率100%,被感染动物出现小肠肠壁变薄等症状。动物免疫保护实验结果表明,pedv-ch-hb-1801株灭活疫苗能对动物体起到一定的保护作用。
本发明的第一个目的是通过以下技术方案予以实现的:一种猪流行性腹泻病毒pedv-ch-hb-1801株,其生物保藏号为cctccno:v202090。保藏单位为中国典型培养物保藏中心,保藏地址为中国武汉市武汉大学,保藏时间为2020年12月9日。
需要说明的是,序列表中:seqidno.1为猪流行性腹泻病毒pedv-ch-hb-1801株s基因coe中和表位的编码氨基酸序列;seqidno.2为猪流行性腹泻病毒pedv-ch-hb-1801株s基因ss2中和表位的编码氨基酸序列;seqidno.3为猪流行性腹泻病毒pedv-ch-hb-1801株ss6基因coe中和表位的编码氨基酸序列;seqidno.4为猪流行性腹泻病毒pedv-ch-hb-1801株s基因2c10中和表位的编码氨基酸序列。
将本发明的猪流行性腹泻病毒pedv-ch-hb-1801株制备成灭活疫苗后,对当前流行毒株引起的腹泻具有良好的保护力;同时由该毒株制备的疫苗安全性和稳定性高,对猪体无害。因此,本发明的第二个目的在于提供上述猪流行性腹泻病毒pedv-ch-hb-1801株在制备猪流行性腹泻病毒疫苗中的应用。
另外,本发明还提供一种疫苗组合物,该疫苗组合物含有有效量的上述猪流行性腹泻病毒pedv-ch-hb-1801株的抗原;所述猪流行性腹泻病毒pedv-ch-hb-1801株的抗原包括减毒全病毒抗原、灭活全病毒抗原、亚单位抗原或合成肽抗原。
进一步优选地,上述的疫苗组合物,其中所述猪流行性腹泻病毒pedv-ch-hb-1801株的抗原为所述猪流行性腹泻病毒pedv-ch-hb-1801株的灭活全病毒抗原;所述灭活全病毒抗原含量为灭活前≥107.0tcid50/ml。
进一步地,本发明提供一种猪流行性腹泻病毒灭活疫苗与猪基因工程干扰素的联合免疫方法,所述联合免疫方法为同时肌肉注射猪流行性腹泻病毒灭活疫苗组合物与猪基因工程干扰素。本发明人将该灭活疫苗添加猪基因工程干扰素联合免疫后,机体对pedv感染抵抗力明显提升。因此,本发明所述的疫苗组合物中还含有干扰素。所述的干扰素选自如下的一种或两种以上:α干扰素、β干扰素、γ干扰素,所述的干扰素选用常规商业化的猪基因工程干扰素。再进一步优选地,本发明的疫苗组合物还含有黄芪多糖,黄芪多糖的加入可以进一步提高疫苗组合物对pedv感染的抵抗力。
当上述疫苗组合物中活性成分由灭活全病毒抗原与干扰素组成时,其中的灭活全病毒抗原灭活前≥107.0tcid50/ml,干扰素稀释浓度≥50万iu/ml。当上述疫苗组合物中活性成分由灭活全病毒抗原、干扰素和黄芪多糖组成时,其中的灭活全病毒抗原灭活前≥107.0tcid50/ml,干扰素稀释浓度≥50万iu/ml,黄芪多糖浓度≥10mg/ml。
最后,本发明还提供一种制备上述疫苗组合物的方法,该方法包括如下步骤:
(1)培养增殖所述的猪流行性腹泻病毒pedv-ch-hb-1801株;
(2)灭活所述步骤(1)所述增殖的猪流行性腹泻病毒pedv-ch-hb-1801株;
(3)加入干扰素和佐剂,乳化;或者加入干扰素、黄芪多糖和佐剂,乳化。
与现有技术相比,本发明具有以下有益效果:本发明采用的中国流行性腹泻病毒ch-hb1801株属于当前国内流行的gii亚型病毒,用其制备的灭活疫苗具有良好的免疫原性和稳定性,接种猪只后,能够刺激机体产生较高水平的中和抗体。另外,本发明提供一种猪流行性腹泻病毒pedv-ch-hb-1801株灭活疫苗与猪基因工程干扰素的联合免疫方法,灭活毒株对猪只安全无副反应,灭活株制成疫苗安全有效,与猪基因工程干扰素联合免疫后,免疫原性好,可对临床流行毒株产生保护力,具有实际和广泛的应用价值。
附图说明
图1为本发明猪流行性腹泻灭活疫苗pedv-ch-hb-1801株与参考毒株构建的进化树,pedv-ch-hb-1801株属于gii亚型分支毒株,经典疫苗株cv777属于gi亚型。
图2为试验猪肠道病变情况,病变的空肠和回肠部分肠绒毛萎缩、脱落,肠道壁变薄、透明。
具体实施方式
下面通过具体实施方式对本发明作进一步详细说明。但本领域技术人员将会理解,下列实施例仅用于说明和解释本发明,而不应视为限定本发明的保护范围。另外,实施例中未注明具体技术操作步骤或条件者,均按照本领域内的一般文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1猪流行性腹泻病毒pedv-ch-hb-1801株的分离鉴定与测序分析
1.病毒的分离鉴定
取临床采集的疑似猪流行性腹泻病例水样腹泻仔猪的小肠及其内容物,经过无菌处理研磨破碎后,4℃12000rpm离心5分钟,收集上层悬液,经过0.22um无菌滤器过滤,收集滤液。提取rna,以反转录获得的cdna为模板,以seqidno.1所示引物,扩增病毒目的片段。琼脂糖凝胶电泳鉴定目的片段大小,判断是否为pedv流行毒株。
取滤液,接种于单层vero细胞中,接种比例为6孔板每孔接种500ul。同时,细胞培养液中加入适量胰酶,促进病毒吸附。将细胞培养板至于37℃5%co2培养箱中静置培养。待80%的细胞出现明显病变时,将培养板反复冻融3次,过滤收集病毒液上清;按照同样方法连续传代20代以上,直至出现明显稳定细胞病变。
取病毒悬液,提取病毒rna,以反转录获得的cdna为模板,用pcr法或荧光定量pcr法进行病原检测,检测病原有:pedv、prrsv、csfv、prv、pcv1/2、tgev、porv。结果显示,除pedv外,其他病原均为阴性。证实该分离毒株为猪流行性腹泻病毒,命名为pedv-ch-hb-1801株。对连续传代的病毒液进行连续倍比稀释,接种100ul于铺好vero细胞的96孔板中。静置培养3-4天,每天观察记录细胞病变,直至无更多病变孔出现。按照reed-muench法计算病毒tcid50,病毒tcid50应不低于107.0tcid50/ml。
2.病毒的测序分析
将提取的病毒rna经过质量和浓度检测后,送测序公司进行二代测序分析。拼接获得的序列见seqidno.2。将测序获得的序列与公布的流行毒株序列进行比对分析,结果显示:经典毒株cv777属于gi型,而pedv-ch-hb-1801属于gii型。二者全基因组核苷酸序列同源性为96.06%,其中orf1、orf3、e、m、n基因的核苷酸和氨基酸序列同源性均在95%以上,而s基因的同源性则较低。s基因的核苷酸序列同源性为93.76%,氨基酸序列同源性为93.44%。对s蛋白的突变位点进行分析发现,这些氨基酸缺失/插入主要发生在其n端,尤其是s蛋白的中和表位coe、ss2、ss6和2c10区均有突变的发生。
3.病毒的致病性及保护效力测定
选取pedv阴性母猪所产3日龄仔猪12头,人工饲喂,随机分为3组,每组4头。试验1组口服接种f3代病毒液1ml(病毒含量为107.0tcid50/ml),试验2组口服接种f30代病毒液1ml(病毒含量为107.0tcid50/ml),对照组口服接种不含病毒的dmem培养基1ml。接种完成后连续观察一周并记录试验猪临床症状。试验猪发病情况统计如表1所示。
表1各组试验猪发病情况比较
剖检观察试验猪的肠道病变情况如图2所示,可见其空肠和回肠部分肠绒毛萎缩、脱落,肠道壁变薄、透明。
pedv-ch-hb-1801株灭活苗的制备:
灭活病毒液:取抗原含量为107.0tcid50/ml的病毒液,加入终浓度为0.3%体积的甲醛,与37℃中作用24小时,期间每2-3小时充分混匀一次,灭活结束后加入终浓度为0.3%体积的硫代硫酸钠溶液,充分混匀,以中和多余的甲醛。取灭活后的病毒液,十倍稀释后接种vero细胞,培养观察48小时以上,收集细胞上清,继续接种细胞3代以上。结果显示,始终未出现细胞病变,说明病毒液灭活完全。
水相:96ml灭活病毒液与4ml4%吐温-80,充分振荡混合;
油相:94ml白油与2g2%硬脂酸铝、6ml6%司班-80充分混合,然后加热溶解至透明,高压灭菌,冷却至室温备用。
在水相中添加2000单位/ml青霉素和链霉素双抗,将2份油相置于冰浴的容器中,边低速转动边加入1份水相,用乳化机震荡以充分乳化,使其成为乳白色油乳剂疫苗。取适量乳化疫苗在3000rpm离心15min,观察有无分层,如出现分层,则应继续乳化直至不分层。分装标记并放到4℃保存备用,获得可以接种的pedv-ch-hb-1801株灭活苗。
选取pedv阴性妊娠母猪12头,分为4组,每组3头。在母猪产前40天和20天时各后海穴注射免疫一次。分组情况如表2所示。
表2试验分组
选取试验母猪所产仔猪各5头,每组15头;选取对照组母猪所产仔猪各1头;共计50头。7日龄时口服接种f3代病毒液(病毒含量为107.0tcid50/ml),接种完成后连续观察一周并记录试验猪临床症状。分组及发病情况如表3所示。
表3各组发病情况统计
表3的试验结果显示,所制备的灭活疫苗对pedv感染母猪所产仔猪具有一定的抵抗力,其中接种6ml组保护力为100%,3ml组保护力为86.6%,1ml组保护力为80%。结果说明,pedv-ch-hb-1801株可以作为一种pedv灭活疫苗的候选毒株,对临床使用具有一定的效果。
实施例2猪流行性腹泻病毒pedv-ch-hb-1801株与猪基因工程干扰素的联合免疫方法建立
按照前文所述方式,制备pedv-ch-hb-1801株灭活苗。同时,分别制备生理盐水或黄芪多糖注射液稀释的猪基因工程干扰素。黄芪多糖注射液中黄芪多糖浓度为10mg/ml。猪基因工程干扰素为α干扰素,最终稀释浓度为50万iu/ml。
选取pedv阴性妊娠母猪15头,分为5组,每组3头。在母猪产前40天和20天时各后海穴注射免疫灭活苗和猪基因工程干扰素一次。分组情况如表4所示。
表4联合免疫试验分组
选取试验母猪所产仔猪各5头,每组15头;选取对照组母猪所产仔猪各1头;共计65头。7日龄时口服接种f3代病毒液(病毒含量为107.0tcid50/ml),接种完成后连续观察一周并记录试验猪临床症状。分组及发病情况如表5所示。
表5各组发病情况比较
试验结果显示,pedv-ch-hb-1801株灭活苗与4ml干扰素联合免疫后对病毒感染抵抗力明显提高,对中、低剂量病毒(2ml和1ml病毒液)感染抵抗力可达100%。黄芪多糖稀释的干扰素效果尤为明显,对高剂量病毒(3ml病毒液)感染抵抗力也可达到100%。结果说明,pedv-ch-hb-1801株制备的灭活疫苗与猪基因工程干扰素的联合免疫能够有效提高仔猪对pedv的抵抗力,此数据可为pedv灭活疫苗的选用及免疫方式提供一定的指导意义。
序列表
<110>湖北省农业科学院畜牧兽医研究所
<120>一种猪流行性腹泻病毒株及其灭活疫苗与干扰素联合免疫方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>147
<212>prt
<213>猪流行性腹泻病毒(porcineepifemicdiarrheavirus)
<400>1
valthrleuproserpheasnasphisserphevalasnilethrval
151015
seralaserpheglyglyhisserglyalaasnleuilealaserasp
202530
thrthrileasnglypheserserphecysvalaspthrargglnphe
354045
thrileserleuphetyrasnvalthrasnsertyrglytyrvalser
505560
lysserglnaspserasncysprophethrleuglnservalasnasp
65707580
tyrleuserpheserlysphecysvalserthrserleuleualaser
859095
alacysthrileaspleupheglytyrproglupheglyserglyval
100105110
lysphethrserleutyrpheglnphethrlysglygluleuilethr
115120125
glythrprolysproleugluglyvalthraspvalserphemetthr
130135140
leuaspval
145
<210>2
<211>9
<212>prt
<213>猪流行性腹泻病毒(porcineepifemicdiarrheavirus)
<400>2
tyrserasnileglyvalcyslysser
15
<210>3
<211>9
<212>prt
<213>猪流行性腹泻病毒(porcineepifemicdiarrheavirus)
<400>3
serglnpheglyglnvallysileala
15
<210>4
<211>7
<212>prt
<213>猪流行性腹泻病毒(porcineepifemicdiarrheavirus)
<400>4
glyproargleuglnprotyr
15
- 还没有人留言评论。精彩留言会获得点赞!