一种酯肽类化合物及其制备方法和应用
1.本发明涉及生物制药技术领域,具体涉及一种从微生物代谢产物中分离得到的具有抗肿瘤和抗hiv逆转录酶活性的酯肽类化合物及其制备方法和应用。
背景技术:
2.微生物天然产物是现代抗生素与药物的重要来源,微生物产生的次级代谢产物具有各种不同的生物活性,是目前药物发现的重要宝库,如临床使用的抗肿瘤药物阿霉素就是从链霉菌的培养物中分离得到的。微生物及其代谢产物作为治疗药物、辅助药物和预防药物等对人类的生命健康做出了巨大的贡献。
3.癌症是目前危害人类生命和健康的重要疾病,每年新增癌症患者数超过1400万,已成为危害人类健康的第一杀手。目前化疗是治疗肿瘤的重要手段,经典的化疗药物有顺铂、阿霉素、紫杉醇、氟尿嘧啶等,这些药物的作用机制大都是通过诱发肿瘤的早期凋亡或细胞自噬来起到杀死癌细胞的作用,但是由于很多癌细胞对这些化疗药物不敏感、并且癌细胞容易对这些药物产生耐药性。因此,寻找有新的抗肿瘤活性化合物,进行其临床研究迫在眉睫。
4.从微生物丰富多样的次级代谢产物中挖掘新的具有抗肿瘤活性的新化合物分子,开发原创药物,具有重要的临床应用价值。如专利文献cn104804020a公开了从青霉penicillium broca的发酵产物中分离得到一种硫代二酮哌嗪类化合物,该类化合物对肿瘤细胞有选择性增殖抑制作用。如专利文献cn108658911a公开了从镰刀霉属植物内生微生物fusariumsp.hjt
‑
p
‑
5的代谢产物中提取得到一种新的呋喃萘醌类化合物fusarnaphthoquinones d,该类化合物对人肺癌细胞a549和人结肠癌细胞hct116有明显的抑制活性。
5.近来年,随着微生物来源的生理活性物质的研究,微生物药物的治疗应用范围不断扩大,如从抗菌到抗肿瘤、抗免疫排斥,以及降血脂和降血糖等,因此,深入研究微生物药物,开发更多新的具有生物活性的化合物是本领域技术人员需要解决的问题。
技术实现要素:
6.本发明的目的在于提供一种具有抗肿瘤活性的新型化合物,将其应用到抗肿瘤药物的制备当中。
7.为实现上述目的,本发明采用如下技术方案:
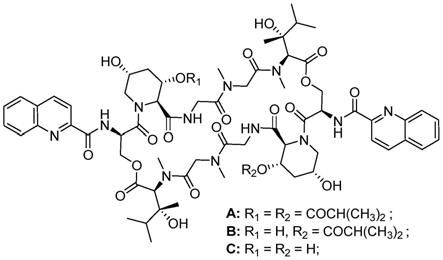
8.本发明从保藏编号为cgmcc 4.6609的江西伦茨氏菌(lentzea jiangxiensis)的发酵产物中分离得到一类具有新结构的酯肽类化合物,结构式如式(ⅰ)所示,
[0009][0010]
其中r1为h或coch(ch3)2,r2为h或coch(ch3)2。
[0011]
具体地,当r1=r2=coch(ch3)2时,化合物分子式为c
72
h
96
n
12
o
22
,将其命名为江西肽菌素a;
[0012]
当r1=h,r2=coch(ch3)2时,化合物分子式为c
68
h
90
n
12
o
21
,将其命名为江西肽菌素b;
[0013]
当r1=r2=h时,化合物分子式为c
64
h
84
n
12
o
20
,将其命名为江西肽菌素c。
[0014]
本发明还提供了上述酯肽类化合物的制备方法,包括:将保藏编号为cgmcc 4.6609的江西伦茨氏菌(lentzea jiangxiensis)接种于发酵培养基中,发酵培养,发酵产物经分离纯化制得所述酯肽类化合物。
[0015]
进一步地,所述发酵培养基为ymg培养基。具体地,所述ymg培养基成分以质量百分比计为:0.4%葡萄糖、1%麦芽提取物、0.4%酵母提取物、2%琼脂粉。
[0016]
进一步地,所述发酵培养条件为27~37℃培养10~14天。优选的,发酵温度为28~32℃。
[0017]
进一步地,所述分离纯化包括:发酵结束后将培养物浸泡于乙酸乙酯,提取液过滤后将乙酸乙酯蒸干,得到粗浸膏;粗浸膏用甲醇溶解后经葡聚糖凝胶sephadex lh20层析,收集目标馏分,再用制备型c18色谱柱进行分离纯化,得到目标产物。
[0018]
优选的,乙酸乙酯浸泡的时间为8
‑
12h。
[0019]
采用葡聚糖凝胶sephadex lh20凝胶层析时,以甲醇作为流动相洗脱,收集包含江西肽菌素的馏分(包括组分a、b、c)。
[0020]
利用制备型c18色谱柱分离时,以体积比7:3的流动相a与流动相b的混合液进行等度洗脱,流动相a为含体积比0.05%甲酸的甲醇溶液,流动相b为含体积比0.05%甲酸的水溶液,流速为4ml/min,分别收集保留时间为17.8min、31.5min和50.2min时的馏分,分别对应分子式为c
64
h
84
n
12
o
20
、c
68
h
90
n
12
o
21
、c
72
h
96
n
12
o
22
的酯肽类化合物。
[0021]
本发明研究表明,上述三个化合物均表现出明显的抗肿瘤活性和对hiv逆转录酶的抑制活性。
[0022]
因此,本发明提供了所述的酯肽类化合物制备抗肿瘤药物中的应用。
[0023]
进一步地,所述肿瘤为结肠癌。
[0024]
本发明还提供了所述的酯肽类化合物制备抗病毒药物中的应用。
[0025]
进一步地,所述病毒为hiv病毒。
[0026]
本发明具备的有益效果:
[0027]
本发明通过对江西伦茨氏菌(lentzea jiangxiensis)培养物中次级代谢产物的分析,分离并鉴定了一类具有新结构的酯肽类分子江西肽菌素。该类化合物具有强效的抗肿瘤和抗病毒的活性,具有很好的药物开发前景。
附图说明
[0028]
图1为江西肽菌素组分a、b、c分子的化学结构。
[0029]
图2为江西肽菌素组分c的单晶x
‑
ray衍射图。
具体实施方式
[0030]
下面通过具体的实施例对本发明作进一步说明,但本发明并不局限于此。
[0031]
下面实施例中菌株为江西伦茨氏菌(lentzea jiangxiensis cgmcc4.6609)购买自中国普通微生物菌种保藏中心。
[0032]
ymg培养基成分:0.4%葡萄糖、1%麦芽提取物、0.4%酵母提取物、2%琼脂粉;
[0033]
tsb液体培养基成分:3%胰酶大豆肉汤培养基干粉(购自bacto公司,产品编号为ref21185)。
[0034]
实施例1
[0035]
江西肽菌素的制备方法,步骤如下:
[0036]
1、大量发酵:将江西伦茨氏菌(lentzea jiangxiensis cgmcc 4.6609)在ymg固体培养基上划线复活,培养10天后,挑一个单菌落接种到tsb液体培养基中,在30℃、200rpm条件下,培养3天后作为种子液;再将种子液(0.5ml/皿)涂布至200皿装有ymg固体培养基的平板上,于30℃,静置发酵18天。
[0037]
2、粗浸膏的获得:将发酵后的固体培养基平板切块装入大瓶中,然后用乙酸乙酯浸泡12h后用滤纸过滤得乙酸乙酯提取液(重复操作5次);合并乙酸乙酯提取液后减压浓缩除去乙酸乙酯,获得粗浸膏;
[0038]
3、化合物的分离纯化:将粗浸膏用适量甲醇溶解后装入四个1.5ml离心管,在12000rpm条件下离心10min,取上清后通过凝胶柱层析(lh
‑
20),用甲醇洗脱,按每6min收集1管洗脱液,第5管到第9管分别经半制备反相高效液相色谱,并用ymc
‑
c18色谱柱分离,以70%(meoh+0.05%fa)与(h2o+0.05%fa)进行等度洗脱,流速为4ml/min,在240nm和300nm紫外检测波长下,制备得到三个新的化合物,分别命名为江西肽菌素c(18.1mg,t
r
=17.8min)、江西肽菌素b(22.3mg,t
r
=31.5min)和江西肽菌素a(17.7mg,t
r
=50.2min);其结构如图1所示。
[0039]
江西肽菌素a为白色不定形粉末,分子式c
72
h
96
n
12
o
22
,阳离子hresims m/z:1481.6829[m+h]
+
,1503.6662[m+na]
+
,1h和
13
c nmr数据见表1。
[0040]
江西肽菌素b为白色不定形粉末,分子式c
68
h
90
n
12
o
21
,阳离子hresims m/z:1411.6410[m+h]
+
,1433.6233[m+na]
+
,1h和
13
c nmr数据见表2。
[0041]
江西肽菌素c为白色晶体,分子式c64h84n12o20;阳离子hresims m/z:1341.6005[m+h]
+
,1363.5843[m+na]
+
,1h和
13
c nmr数据见表1。化合物c的绝对构型最终是通过其x
‑
单晶衍射(见图2)确定;另外,化合物c的单晶是通过chcl3与meoh的混合溶液(1:1)培养获得。
[0042]
表1江西肽菌素a和c的1h和
13
c nmr数据(600和150mhz,cdcl3)
[0043]
[0044]
[0045][0046]
表2江西肽菌素b的1h和
13
c nmr数据(500和125mhz,cdcl3)
[0047]
[0048][0049]
注:表1和表2信号归属是基于1h、
13
c、1h
‑1h cosy、hsqc及hmbc图谱的解析结果。氢信号多重度分别用s(单重峰)、d(二重峰)、t(三重峰)、q(四重峰)和m(多重峰)等表示。
[0050]
实施例2
[0051]
江西肽菌素的抗肿瘤细胞(人结肠癌细胞hct116)活性测定:
[0052]
1、待测样品溶液的配制:待测样品为上述实施例1中制备得到的江西肽菌素a、b和c的纯品,精确称量以上三种样品,分别溶解于二甲基亚砜(dmso)中配制成浓度为5mm的江西肽菌素a、b和c溶液。
[0053]
2、采用cck8实验进行江西肽菌素a、b和c的抗肿瘤细胞(人结肠癌细胞hct116细胞系)的活性测定。实验步骤包括:
[0054]
(1)细胞培养。用含1640+10%fbs+100x双抗的培养基培养hct116细胞。
[0055]
(2)铺板。在96孔板中接种2.8万/ml细胞悬浮液,留出周围一圈的孔加入200μl/孔的无菌pbs防止培养基水分蒸发。在潮湿的37℃培养箱中孵育24h,使细胞贴壁。(注意接下来所有操作均为贴壁,以免破坏孔底部贴壁的细胞或将气泡引入孔中)。
[0056]
(3)洗涤。将含细胞的孔中的液体吸净,加入200μl/孔pbs洗涤,2
‑
3min后吸掉pbs。
[0057]
(4)加药。加入培养基(180μl/孔),再将江西肽菌素a、b和c分别按相应浓度加入孔中,每孔20μl。在潮湿的37℃培养箱中孵育24h。
[0058]
(5)洗涤。重复步骤3。
[0059]
(6)加cck
‑
8。加入cck
‑
8:培养基为1:10配置的混合溶液,每孔110μl,在潮湿的37℃培养箱中孵育1h。
[0060]
(7)测吸光度。使用酶标仪测量450nm处的吸光度。
[0061]
ic
50
数据如表3所示:
[0062]
表3
[0063] ic
50
(mean
±
sem)江西肽菌素a1.24
±
0.32μm江西肽菌素b1.37
±
0.72μm江西肽菌素c1.49
±
0.08μm
[0064]
实施例3
[0065]
江西肽菌素的hiv逆转录酶抑制活性测定:
[0066]
1、待测样品溶液的配制:待测样品为上述实施例1中制备得到的江西肽菌素a、b和c的纯品,精确称量以上三种样品,分别溶解于二甲基亚砜(dmso)中配制成浓度为5mm的江西肽菌素a、b和c溶液。然后依次再用dmso稀释,得到浓度为1000μm、300μm、120μm、60μm、24μm、8μm、3μm、1.2μm的江西肽菌素a和b溶液,以及浓度为600μm、200μm、60μm、30μm、9μm、3μm、1.2μm、0.6μm的江西肽菌素c溶液。
[0067]
2、江西肽菌素对hiv逆转录酶体外活性抑制实验:江西肽菌素的该抑制活性测定采用购自sigma
‑
aldrich公司的hiv逆转录酶活性测定试剂盒(sigma
‑
aldrich产品货号:11468120910)进行。
[0068]
(1)试剂盒溶液配制:2ng/μl的hiv
‑
1逆转录酶用试剂盒中的裂解缓冲液稀释20倍,得到0.1ng/μl的hiv
‑
1逆转录酶;2,2'
‑
联氮
‑
双
‑3‑
乙基苯并噻唑啉
‑6‑
磺酸(abts)取一片用5ml试剂盒中的底物缓冲液溶解;20u/ml辣根过氧化物酶标记的地高辛抗体(anti
‑
dig
‑
pod)用试剂盒中的结合缓冲液稀释至200mu/ml。
[0069]
(2)hiv逆转录酶抑制活性测定:将每一种浓度的江西肽菌素a、b、c用裂解缓冲液稀释20倍,并取20μl与20μl的0.1ng/μl的hiv逆转录酶混匀,再加入20μl的rna模板
‑
引物
‑
dttp混合物,37℃孵育60min。同时设不加江西肽菌素的阴性对照以及不加江西肽菌素和hiv
‑
1逆转录酶的空白对照。逆转录反应完成后体系转入链亲和素包被的微孔板中,37℃放置60min,吸去液体,用试剂盒中的洗涤溶液洗涤5次,每次250μl。然后每孔加入200μl的200mu/ml anti
‑
dig
‑
pod,37℃放置60min,吸去液体,用试剂盒中的洗涤溶液洗涤5次,每次
250μl,然后加入200μl abts溶液,15~25℃放置10min~20min后用酶标仪读取405nm吸光度,参比波长为490nm。
[0070]
(3)数据处理:每一孔的405nm吸光度数值减去490nm吸光度数值,再减去空白对照的相应数值进行校正,得到校正的吸光度数值。实验组各孔的校正吸光度数值除以阴性对照的校正吸光度数值得到各孔的hiv
‑
1逆转录酶相对活性。在graphpad prism软件中,以江西肽菌素终浓度为横坐标,hiv
‑
1逆转录酶相对活性为纵坐标,进行非线性拟合,选择log(inhibitor)vs.response(three parameters)选项,得到ic
50
值。江西肽菌素a、b、c中每一个分子均进行独立的三次实验,由得到的三个ic
50
值计算其平均值。
[0071]
ic
50
数据如表4所示:
[0072]
表4
[0073] ic
50
(mean
±
sem)江西肽菌素a1.91
±
0.30μm江西肽菌素b0.75
±
0.17μm江西肽菌素c0.36
±
0.01μm
[0074]
应当指出,对于本领域的普通人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,如用不同培养基进行发酵,用不同的色谱分离条件进行江西肽菌素的纯化制备等。这些也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1