一种铜基金属有机框架材料固定化漆酶及其制备方法和应用与流程
1.本发明涉及环保领域,具体涉及固定化酶的制备方法与其在去除双酚a领域中的应用。
背景技术:
2.双酚a是一种典型的内分泌干扰物,广泛生产婴儿奶瓶,玩具和医疗设备,bpa在除了在地表水及地下水中被检测出来,在土壤、垃圾渗滤液、空气和食品中也陆续被检测出来。常见的处理方法有物理法、化学法以及生物法。物理法一般有吸附法和膜分离法,虽然比较快捷但是不彻底,难回用性等限制了其应用。化学法主要有光催化、电化学、fenton法等,一般来说需要耗费较多能源,且生成的中间产物可能毒性更大,造成环境的二次污染。生物酶法由于其绿色高效的特点走入了大众的视野。
3.一般而言,酶制剂都是易溶于水的,在处理污染物之后几乎是不能回收利用的,且游离的酶稳定性(温度、化学、存储)较差,进一步限制了其应用。固定化酶的概念提出来之后,很大程度上解决了这个问题。水凝胶,多孔碳材料,聚合物微球,介孔磁性材料和介孔二氧化硅等被用于固定酶,金属有机框架材料由于其具有一些优异的特质(大比表面积、可调谐的官能团、孔洞及拓扑结构等)也被用于固定酶的工作。
4.相比于异位法固定酶,原位法使用一锅合成的方式,直接将酶固定在mof上,且能够保持相对温和的环境(水环境、常温常压),对酶活的保留有一定的好处,更加绿色快捷。一种铜基mof(cu
‑
paba)其具有出色的酸耐受性,而用于降解双酚a的漆酶可以在酸性条件下发挥出其最大的活性,这样就为漆酶的固定化提供了一种可靠的材料。然而现有的固定化方法普遍存在漆酶保留活性较低的问题。根据前期文献调研,介孔二氧化硅固定漆酶保留活性为12.1%,铁基mof固定化漆酶导致活性几乎丧失,zif
‑
8固定化漆酶保留活性为12.3%、13.0%,mil
‑
53以及mg
‑
mof
‑
74固定漆酶保留活性为9.3%、14.9%。此外,现有的固定化方法还存在工艺复杂,成本较高、固定漆酶稳定性差等问题。
技术实现要素:
5.本发明的目的是提供一种可回用的处理双酚a的环保功能材料。通过原位法将漆酶固定在mof材料上,实现酶制剂的多次利用及其稳定性,降低处理污水的成本。
6.本发明的目的通过下列技术方案实现:
7.一种铜基金属有机框架材料固定化漆酶的制备方法,将醋酸铜和漆酶溶解于水中,制得a液;将对氨基苯甲酸溶液溶于乙酸缓冲液中,制得b液,然后将上述两种溶液混合,并搅拌4小时以上;离心收集固体,用水洗涤,冷冻干燥,即制得铜基金属有机框架材料固定化漆酶。
8.优选地,所述a液中醋酸铜的浓度为10~100mm,漆酶浓度为0.1~3.0mg/ml;b液中对氨基苯甲酸的浓度为5~25mm。
9.优选地,所述a液中醋酸铜的浓度为50
±
25mm,漆酶浓度为0.5
±
0.3mg/ml;b液中
对氨基苯甲酸的浓度为12.5
±
6.5mm。
10.优选地,所述a液与b液等体积混合。
11.优选地,所述的搅拌速度为200
‑
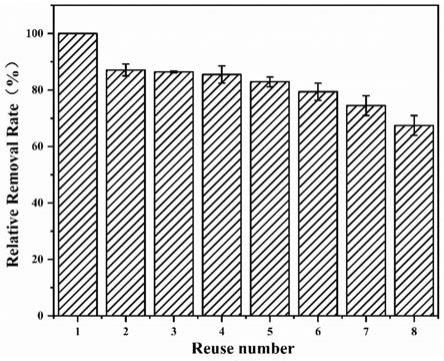
500rpm。
12.优选地,所述的搅拌时间为4
‑
12h。
13.优选地,所述搅拌8h,水洗3次。
14.优选地,所述冷冻干燥的温度为
‑
40℃,时间为12
‑
24h。
15.所述铜基金属有机框架材料固定化漆酶在降解双酚a中的应用,在降解体系中还加入abts。
16.本发明首次采用铜基mof(cu
‑
paba)固定化漆酶,使用共沉淀的方法一步合成,更加快捷绿色,使漆酶的稳定性(热、ph、有机试剂)大大提高,在降解双酚a之后可以进行8次以上的回收。本发明固定化漆酶之后可以保留41.7%的活性。
17.与现有技术相比,本发明具有如下有益效果:
18.(1)本发明产品具有很好的活性保留,在将漆酶通过原位一锅法固定化之后,其能够保留40%左右的相对活性。由于mof材料的铜离子与漆酶的活性中心(铜离子簇)协同作用,可以使得固定化漆酶与愈创木酚更亲和,k
m
值减小。
19.(2)本发明产品具有很好的稳定性,考察了固定化漆酶与游离酶的ph,温度,有机试剂稳定性,都有所提高,说明cu
‑
paba的刚性骨架对于漆酶空间结构有一定的保护作用,减少其构象改变从而失活。
20.(3)本发明产品具有很好的双酚a去除能力,在abts存在的情况下,12h双酚a去除率可以达到80%左右,abts的引入符合电子转移机制,增强体系的电子转移,使得双酚a更高效的去除率。
附图说明
21.图1为cu
‑
paba及cu
‑
paba@lac的xrd图谱。
22.图2为cu
‑
paba及cu
‑
paba@lac的tga曲线。
23.图3为游离漆酶和固定化漆酶的michaels
‑
menten图。
24.图4为游离漆酶和固定化漆酶的lineweaverv
‑
burk图。
25.图5为cu
‑
paba及cu
‑
paba@lac的温度稳定性图。
26.图6为cu
‑
paba及cu
‑
paba@lac的ph稳定性图。
27.图7为cu
‑
paba及cu
‑
paba@lac的有机试剂稳定性图。
28.图8为cu
‑
paba@lac在不同固定化酶投加量下12h双酚a的降解曲线。
29.图9为cu
‑
paba@lac在不同温度下12h双酚a的降解曲线。
30.图10为cu
‑
paba@lac在不同双酚a初始浓度下12h双酚a的降解曲线。
31.图11为不同情况下去除bpa的曲线图。
32.图12为cu
‑
paba@lac降解双酚a的回用性效果图。
具体实施方式
33.下面结合具体实施例对本发明的技术方案进行清楚、完整地描述,实施例仅是本发明的优选实施方式,不是对本发明的限定。本领域普通技术人员在没有做出创造性劳动
前提下所获得的所有其他实施例,都属于本发明保护的范围。
34.实施例1
35.cu
‑
paba@lac的合成方法:首先将乙酸铜(50mm)、漆酶(0.5mg/ml,购自sigma公司)溶解于水中;paba(12.5mm)溶于乙酸缓冲液(abs,ph=7.0,50mm)中。然后将两种溶液等体积混合并在室温下搅拌4小时以上。离心收集固体,去离子水洗涤3次。
36.实施例2
37.cu
‑
paba的合成方法:首先将乙酸铜(50mm)溶解于水中;paba(12.5mm)溶于乙酸缓冲液(abs,ph=7.0,50mm)中。然后将两种溶液混合并在室温下搅拌8小时。离心收集固体,去离子水洗涤3次。
38.从图1的xrd谱来看,cu
‑
paba和cu
‑
paba@lac生物复合材料的晶体结构没有明显差异。cu
‑
paba@lac的衍射峰强度降低,结果表明,成功负载漆酶且引入漆酶对cu
‑
paba的结构影响不大。
39.图2的tga曲线也可以证明漆酶加载的成功。从图2中可以看出,在cu
‑
paba曲线中,160℃以下的质量损失(约10%)是由于水分蒸发造成的,260℃以上结构被破坏。而cu
‑
paba@lac的tga曲线在240
‑
260℃之间出现了明显的差异,这与漆酶的损失有关。
40.实施例3:固定化酶保留活性测定
41.50mmol/l琥珀酸钠为缓冲液(ph=4.5),在10ml反应混合液中含0.04mmol愈创木酚和漆酶/固定化酶,30℃反应30min后,于465nm处测定吸光度。以游离酶活性为100%,计算固定化酶保留酶活。实施例1中所得产物测定最大保留酶活为41.7%。
42.实施例4:酶促反应动力学
43.通过改变琥珀酸钠缓冲液中愈创木酚的浓度来评价动力学参数。图3为不同愈创木酚浓度与酶促反应初速度作图,图4是由图3双倒数作图而来。k
m
值是指酶与底物之间的亲和力。因此km值越小,底物与漆酶的亲和力越高。v
max
值是指最大酶促反应速率。
44.由图3可得,随着底物浓度的增加,酶促反应速率先增加后趋于平稳。此外,与游离漆酶相比,由于传质受限,固定化漆酶的反应速率较低。
45.如图4所示,游离漆酶的k
m
为0.0024mm,而cu
‑
paba@lac显示了k
m
的减小(0.0014mm),说明固定化酶对底物的亲和力增强。固定化后vmax从1.80mm
·
min
‑1下降到0.76mm
·
min
‑1,这是由于cu
‑
paba壳层阻碍了底物与漆酶活性位点的接触。
46.实施例5:固定化酶稳定性实验
47.将cu
‑
paba以及cu
‑
paba@lac浸泡于30
‑
70℃条件下1h,测定浸泡前后的活性,并以最高活性作为100%,计算不同温度下固定化漆酶以及游离酶的相对活性。
48.如图5所示,cu
‑
paba@lac的热稳定性在30
‑
70℃均高于游离漆酶,这是由于cu
‑
paba的刚性骨架和mof与酶之间的相互作用(mof的金属离子、有机配体以及漆酶游离氨基、羧基羰基),保护漆酶的空间构象不受改变。
49.实施例6:固定化酶稳定性实验
50.将cu
‑
paba以及cu
‑
paba@lac浸泡于ph=3.5
‑
9.5(醋酸盐缓冲液及磷酸盐缓冲液)条件下1h,测定浸泡前后的活性,并以最高活性作为100%,计算不同ph下固定化漆酶以及游离酶的相对活性。
51.如图6所示,随着ph值的增加,cu
‑
paba@lac与游离漆酶表现出相同的趋势,相对活
性在浸泡1h后呈现先升高后降低的趋势,而固定化漆酶的ph稳定性明显优于游离漆酶。特别是在酸性条件下,cu
‑
paba@lac生物复合材料表现出更好的稳定性。可能是由于cu
‑
paba的配体4
‑
氨基苯甲酸的胺官能团吸引h
+
离子,从而形成更适合漆酶的酸性微环境。
52.实施例7:固定化酶稳定性实验
53.将cu
‑
paba以及cu
‑
paba@lac浸泡于不同有机试剂(甲醇、乙醇、dmf、乙腈)中1h,测定浸泡前后的活性,并以在水中活性作为100%,计算不同有机试剂环境下固定化漆酶以及游离酶的相对活性。
54.同样,如图7所示cu
‑
paba@lac比游离漆酶具有更高的有机试剂稳定性。一般来说有机溶剂吸附了漆酶的“必需水”,导致了游离漆酶的变性。在cu
‑
paba保护壳的存在下,有机试剂与漆酶接触传质受阻,从而保留了更高的活性。
55.实施例8
‑
10:双酚a降解实验
56.50ml体系中,含有abts和固定化漆酶(0.7
‑
5.6u
·
ml
‑
1)以及双酚a(10
‑
100mg
·
l
‑
1),在不同温度(15
‑
55℃)下降解12h。在特定的时间间隔,用注射器采集样品,用0.22微米膜过滤器过滤。然后用比色法(4
‑
氨基安替比林)在510nm下测定样品浓度。
57.其中所述4
‑
氨基安替比林法操作为取1ml样品稀释至25ml,加入0.5ml氯化铵缓冲溶液(ph=10.7),1ml2%4
‑
氨基安替比林溶液,1ml8%铁氰化钾溶液,摇匀,10min后于紫外分光光度计λ=510nm测试。
58.随着固定化漆酶初始投加量的增加,12h后双酚a的降解率也随之增加,最大可达到79.4%(图8)。这显然是由于初始剂量的增加增强了给定浓度(20mg
·
ml
‑1)下双酚a的降解能力。但是,增加几倍的初始投加量并没有使降解速率呈现相应的增加,这可能是由于材料的堆积导致双酚a与漆酶接触不良所致。
59.温度对降解的影响如图9所示。从15℃到55℃,去除率呈先升高后降低的趋势,35℃时去除率达到最大值(85.7%)。在25℃、35℃和45℃下,降解效率相差不大,在15℃和55℃下,降解效率较低。这可能与漆酶在低温和高温下活性下降有关。与55℃相比,15℃时反应的初始降解速率较慢,但最终降解程度较高。造成这一现象的原因是低温条件下漆酶活性受到抑制,降解速度较慢,而高温条件下漆酶活性随着时间的推移而丧失,最终降解能力受到影响。
60.图10显示了bpa浓度的影响,可以看出,在20mg
·
ml
‑1和30mg
·
ml
‑1时,cu
‑
paba@lac对双酚a的降解率最高(84.3%和84.6%)。在低浓度下(10mg
·
ml
‑1),双酚a的降解下降可能是由于驱动力低,导致双酚a与漆酶没有更好的接触。10mg
·
ml
‑1和20mg
·
ml
‑1达到降解平衡更快,无论浓度为10mg
·
ml
‑
1、20mg
·
ml
‑
1还是30mg
·
ml
‑1,12h后bpa的残留浓度(约3mg
·
ml
‑1)基本相同。这些现象与上述结论一致。随着双酚a浓度增加到50mg
·
ml
‑1和100mg
·
ml
‑1,降解率明显下降,原因是双酚a过多和中间体的产生导致漆酶活性位点被阻断。
61.图11可以看出,在只存在abts的情况下,bpa的变化不明显。测定了纯cu
‑
paba的吸附能力,12h只去除10%左右。固定化漆酶后,材料表现出更好的bpa去除性能,大约26%,说明漆酶的存在对降解bpa是有益的。当abts(终浓度为0.2mm)加入体系后,12h bpa降解率接近84.7%。
62.实施例11:为了测定cu
‑
paba@lac生物复合材料的可重复使用性,在多次降解实验
后计算bpa的去除率,初始去除率定义为100%。
63.为了评估制备的cu
‑
paba@lac的重复使用性,将一定数量的生物复合材料与bpa和abts混合,然后离心收集。如图12所示,随着循环次数的增加,bpa降解率逐渐减弱,循环8次后降解率仍能保持将近70%。这对于漆酶的回收使用以及降低处理成本有着很大的意义。
64.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1