一种苏氨酸钙产品及其生产方法与流程
本发明属于氨基酸微量元素螯合物的技术领域,具体涉及一种苏氨酸钙产品及其生产方法。
背景技术:
钙在人体代谢中发挥着极其重要的作用,是我们生命中必不可少的元素。目前常见的补钙产品有碳酸钙、柠檬酸钙、葡萄糖酸钙、甘氨酸钙、l-天门冬氨酸钙等。其中氨基酸微量元素螯合物是第三代微量元素补充剂,它是一类具有环状结构的螯合物,集氨基酸与微量元素为一体,在体内ph环境下稳定性和溶解性较好,吸收率高出无机盐三倍多,具有更高的生物学效价。具有良好的生化稳定性,在消化道中大大降低了二价金属离子间的拮抗作用。
氨基酸钙作为一种新型的钙营养强化剂,在补充钙的同时能补充所需的氨基酸,且氨基酸钙可以利用氨基酸和小肽的吸收通道,完整地通过小肠粘膜进入血浆,并转运至靶器官,避免食物中的草酸盐、磷酸盐等与钙形成不溶性物质而难以吸收,因而具有稳定性好,吸收利用率高等优点,由于其优越的性能,广泛适用于人体保健,各种畜禽,水产生物的快速养殖,在食品行业,医疗行业,农业,畜牧业有着显著而恒定的有益作用,已越来越被人们所接受。
技术实现要素:
本发明的目的在于提供一种苏氨酸钙产品的生产方法,它用苏氨酸与固体形式的钙盐为原料,合成一种氨基酸型矿物质螯合物——苏氨酸钙。本发明苏氨酸钙产品的生产工艺简单、所得产品性能稳定,且适用于工业化生产。
本发明的目的是通过以下技术方案实现的:
本发明苏氨酸钙是由l-苏氨酸和固体形式的钙盐首先按照一定的比例配制成水溶液,然后在密闭容器中进行合成反应,过滤后经由喷雾干燥或结晶制备而成。
本发明提供了一种苏氨酸钙产品的生产方法,包括以下步骤:
(1)将一定量的水投入到反应釜中,加热到40~65℃,然后按照比例投入l-苏氨酸和钙原料,搅拌混合均匀;
(2)调节溶液的ph和温度,在密闭的所述反应釜中进行合成反应若干时间;
(3)合成反应结束后,过滤,备用。
(4)采用喷雾干燥法或结晶法对滤液进行处理制备苏氨酸钙成品。
作为优选,所述钙原料包括氧化钙、氢氧化钙、硫酸钙、氯化钙或碳酸钙。进一步优选地,所述钙原料为氧化钙、碳酸钙、硫酸钙、和氯化钙中的一种。
作为优选,所述步骤(1)l-苏氨酸与所述钙原料的质量比为190~210:75~200,反应物浓度为30~80%。进一步优选地,所述反应物浓度为58~60%。所述反应物浓度是指总的反应底物与水的质量比。
作为优选,所述步骤(3)中合成反应的温度为45~90℃,ph范围为6~10,反应时间为1.5-4h。
作为优选,所述步骤(3)中过滤的滤膜孔径为0.1~0.45mm。进一步优选地,所述步骤(3)中过滤的滤膜孔径为0.45mm。
作为优选,所述步骤(4)中采用喷雾干燥法制备苏氨酸钙产品的工艺为:滤液通过雾化器雾化成10~200微米的雾状颗粒,与热空气直接接触进行热交换干燥,得到苏氨酸钙固体粉末。
作为优选,所述步骤(4)中采用喷雾干燥法的工艺条件为:进风口温度150~300℃,出风口温度50~150℃,进料速度为40~80kg/h。
作为优选,所述步骤(4)中采用结晶法制备苏氨酸钙产品的工艺为:滤液进行蒸发浓缩至有苏氨酸钙晶体析出时,停止浓缩,开始缓慢降温,待有大量结晶逐渐析出完毕后,过滤,将滤饼洗涤干燥,可得到颗粒均匀的苏氨酸钙晶体。
作为优选,所述步骤(4)中采用结晶法的工艺条件为:蒸发浓缩的温度为40~90℃、搅拌速度为10~25r/min,降温梯度为5~15℃/h。
本发明还提供上述方法制备得到的苏氨酸钙产品。
本发明制备得到的所述苏氨酸钙产品可作为食品添加剂或营养补充剂的用途,广泛用于食品、饮料、化妆品、生物医药、健康医疗等领域。
本发明相比现有技术具有以下有益效果:
本发明利用市场价格便宜,又属于人体及动物的必需氨基酸——苏氨酸及可溶性钙盐为原料,合成了苏氨酸钙螯合物,原料利用率高,损失少,流程简单易操作、节能环保,所制得的苏氨酸钙产品质量稳定、螯合率高,符合食品级要求,适合工业化生产。
本发明采用的方法制备苏氨酸钙产品,不使用任何有机溶剂,与传统需醇析得到终产品的方法相比,实现了节能环保的目的,并且终产品无醇类物质残留,更符合食品级要求。
本发明制备的苏氨酸钙产品具有良好的化学、生化稳定性,在体内溶解性好、容易被吸收、生物利用率高、无毒副作用、具有抗干扰,具有补充氨基酸和矿物质的双重作用,可作为食品添加剂或营养补充剂的用途,广泛用于食品、饮料、化妆品、生物医药、健康医疗等领域。
附图说明
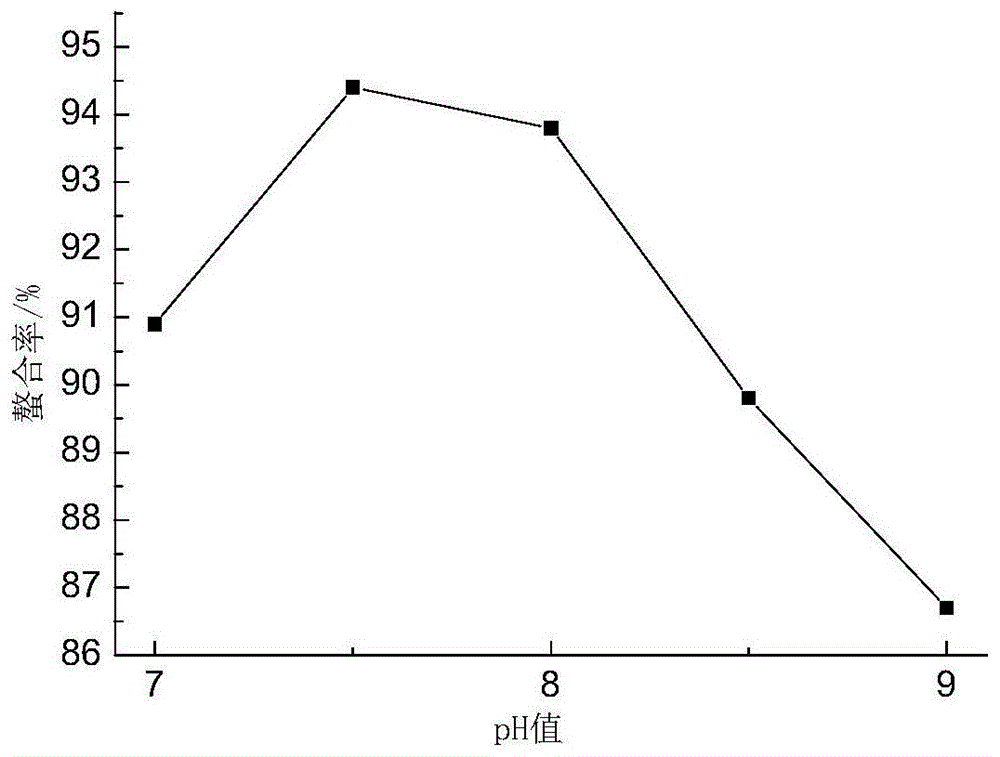
图1是ph值对苏氨酸钙螯合率的影响;
图2是反应温度对苏氨酸钙螯合率的影响;
图3是反应时间对苏氨酸钙螯合率的影响;
图4是反应物浓度对苏氨酸钙螯合率的影响;
图5是本发明中实施例1~实施例4的螯合率对比图;
图6为本发明中实施例1~实施例4的收率对比图;
图7是l-苏氨酸的红外光谱图;
图8是苏氨酸钙的红外光谱图;
图9是模拟胃部消化后不同螯合率的苏氨酸钙和碳酸钙的溶解率的比较示意图;
图10是模拟肠道消化后不同螯合率的苏氨酸钙和碳酸钙的溶解率的比较示意图;
图11是模拟肠道中不同螯合率的苏氨酸钙和碳酸钙的透析率的比较示意图。
具体实施方式
为了更好地理解本发明的内容,下面结合具体实施例作进一步说明。应理解,这些实施例仅用于对本发明进一步说明,而不用于限制本发明的范围。此外应理解,在阅读了本发明所述的内容后,该领域的技术人员对本发明作出一些非本质的改动或调整,仍属于本发明的保护范围。
实施例1
称取25kg水于反应釜中,待温度升高到50℃左右后,边搅拌边加入11.9kg苏氨酸。待苏氨酸溶液充分溶解后加入2.8kg氧化钙,控制反应物浓度为58.8%,将料液温度控制在80℃左右,调节料液ph8.5,搅拌反应3h后,采用0.45mm的膜进行过滤后于进行喷雾干燥制得苏氨酸钙干粉,所设置喷雾干燥的参数为进料速度40kg/h,转速为560r/min,进风温度为200℃,出风温度为90℃。
实施例2
称取25kg水于反应釜中,待温度升高到45℃左右后,边搅拌边加入11.9kg苏氨酸。待氨基酸溶液充分溶解后加入2.8kg氧化钙,控制反应物浓度为58.8%,将料液温度控制在85℃左右,调节料液ph8.0,搅拌反应2.5h后,采用0.45mm的膜进行过滤后于进行喷雾干燥制得苏氨酸钙干粉,所设置喷雾干燥的参数为进料速度40kg/h,转速为560r/min,进风温度为200℃,出风温度为90℃。
实施例3
称取25kg水于反应釜中,待温度升高到50℃左右后,边搅拌边加入11.9kg苏氨酸。待苏氨酸充分溶解后加入2.8kg氧化钙,控制反应物浓度为58.8%,将料液温度控制在90℃左右,调节料液ph8.5,搅拌反应2h后,采用0.45mm的膜进行过滤后进行蒸发浓缩,调节温度为60℃,搅拌速度为25r/min,降温梯度为10℃/h,浓缩至有晶体析出时,停止浓缩,开始以10℃/h缓慢降温,待有大量结晶逐渐析出完毕后,过滤,将滤饼洗涤干燥,可得到颗粒均匀的苏氨酸钙晶体。
实施例4
称取24.5kg水于反应釜中,待温度升高到50℃左右后,边搅拌边加入11.9kg苏氨酸。待苏氨酸充分溶解后加入2.8kg氧化钙,控制反应物浓度为60%,将料液温度控制在80℃左右,调节料液ph8,搅拌反应2h后,采用0.45mm0.45mm的膜进行过滤后进行蒸发浓缩,调节温度为60℃,搅拌速度为25r/min,降温梯度为10℃/h,浓缩至有晶体析出时,停止浓缩,开始以10℃/h缓慢降温,待有大量结晶逐渐析出完毕后,过滤,将滤饼洗涤干燥,可得到颗粒均匀的苏氨酸钙晶体。
实施例4制备得到苏氨酸钙晶体的鳌合率为97.1%。
试验例
试验例1
本实施例说明实验条件的筛选。
称取一定量的l-苏氨酸于蒸馏水中,水浴加热至60℃左右再加入氧化钙,并升温搅拌反应一定时间至料液变澄清。过滤,除去不溶性物质,滤清液进行蒸发浓缩至晶体析出时,停止浓缩,开始缓慢降温,待有大量结晶逐渐析出完毕后,过滤,将滤饼洗涤干燥,即得苏氨酸钙产品。影响氨基酸微量元素螯合反应的因素主要有温度、时间、ph、反应液浓度等,以螯合率为指标分别研究各因素对螯合率的影响:①调节反应温度至80℃,反应物浓度为60%,不同ph值条件下反应2h,测螯合率,分析ph值的影响。②调节溶液ph值为7.5,反应物浓度为60%,不同温度下反应2h,测螯合率,分析温度的影响。③调节溶液ph值为7.5,反应物浓度为60%,80℃条件下反应不同时间,测螯合率,分析反应时间的影响。④调节溶液温度为80℃,ph值为7.5,不同反应物浓度条件下反应2h,测定螯合率,分析反应物浓度的影响。
(1)螯合率的测定方法如下:
钙离子螯合率的测定采用edta络合滴定法。
总钙含量测定时样品的处理方法:取苏氨酸-钙反应液5ml,去离子水定容至50ml。
苏氨酸钙含量的测定时样品的处理方法:另取反应液5ml,加入3倍体积的无水乙醇,充分混合均匀后10000r/min离心15min,去上清液,将沉淀用去离子水定容至50ml。
edta络合滴定:取定容后的反应液20ml,滴加二甲酚橙指示剂,滴加质量分数为20%的六亚甲基四胺至溶液呈稳定的紫红色,再加入4ml六亚甲基四胺,用0.01mol/ledta滴定,溶液从紫红色变为黄色即为终点。
式中,c:edta溶液的浓度,mol/l;
v空白:用去离子水代替待测液所需的edta体积,ml;
v总:总钙含量测定时消耗的edta体积,ml;
v螯合:螯合钙含量测定时消耗的edta体积,ml;
结果如下:
ph值是氨基酸微量元素螯合物形成的重要因素,在ph值较低的条件下,氢离子与金属离子争夺供电子基团,不利于氨基酸微量元素螯合物的形成,在ph较高的条件下,羟基与供电子基团争夺金属离子而形成氢氧化物沉淀。由图1可知,在ph值较低时,螯合率随着ph值的升高而升高,当ph值达到7.5以后,螯合率升高的趋势不明显甚至有下降的趋势,说明此时螯合反应完全。
由图2可知,螯合率随着温度的升高而升高,说明螯合程度不断加深,当温度升高到80℃以后螯合率升高不明显,说明80℃为最佳反应温度。于80℃螯合率缓慢上升,而高于80℃螯合率却有所下降,所以当温度为80℃螯合率最大。
由图3可知,随着反应时间的延长螯合率随之增加,当反应时间超过2h后螯合率增加不明显,所以反应时间为2h螯合率最大。
反应物浓度对氨基酸微量元素螯合率有显著影响。从传质角度讲,反应物浓度是螯合反应过程中的一个重要影响因子,在一定的浓度范围内,反应物浓度小,螯合过程中液相中溶质浓度增加快,两相之间的浓度差消失较快,从而使传质推动力很快衰减;反应物浓度大时,会明显提高传质推动力,但太高的反应物浓度,容易反应不完全。结合试验结果如图3所示,可选择反应物浓度为60%为宜。
在单因素试验的基础上,选取温度(a)、ph(b)、反应物浓度(c)和时间(d)4个因素作为自变量,苏氨酸钙螯合能率(y)为响应值,进行四因素三水平响应面实验,水平编码见表1,分析结果见表2。
表1正交试验因素及水平编码
表2正交实验结果
根据表1中的r可知,影响苏氨酸钙螯合率的因素顺序为:反应温度>反应时间>反应物浓度>ph值。通过不同水平苏氨酸钙的螯合率来看,最佳组合为a2b3c2d2,用a2b3c2d2组合做进一步的实验验证,螯合率为97.1%。因此l-苏氨酸与氧化钙的最佳合成工艺为:温度80℃、ph值为8、反应物浓度为60%、反应时间为2h。
试验例2
本试验例说明实施例1~实施例4的苏氨酸钙螯合率和收率。
(1)螯合率的测定方法如下:
钙离子螯合率的测定采用edta络合滴定法。
总钙含量测定时样品的处理方法:取苏氨酸-钙反应液5ml,去离子水定容至50ml。
苏氨酸钙含量的测定时样品的处理方法:另取反应液5ml,加入3倍体积的无水乙醇,充分混合均匀后10000r/min离心15min,去上清液,将沉淀用去离子水定容至50ml。
edta络合滴定:取定容后的反应液20ml,滴加二甲酚橙指示剂,滴加质量分数为20%的六亚甲基四胺至溶液呈稳定的紫红色,再加入4ml六亚甲基四胺,用0.01mol/ledta滴定,溶液从紫红色变为黄色即为终点。
式中,c:edta溶液的浓度,mol/l;
v空白:用去离子水代替待测液所需的edta体积,ml;
v总:总钙含量测定时消耗的edta体积,ml;
v螯合:螯合钙含量测定时消耗的edta体积,ml;
由试验所测得发明实施例1~实施例4中苏氨酸钙的螯合率如图5所示,其中实施例1的螯合率为96.5%、实施例2的螯合率为95.9%、实施例3的螯合率为96.6%,实施例4的螯合率最高,为97.1%。
(2)收率的测定方法如下:
准确称取所需添加氨基酸与锌原料的质量,根据化学方法及反应原理计算出反应所得产品的理论质量,最后与实际所收取氨基酸螯合锌的质量进行比较。计算公式如下图所示:
式中,实际收量为实际所得氨基酸螯合锌的质量,单位为g;理论收量为根据化学方法及反应原理计算出反应所得氨基酸螯合锌的理论质量,单位为g。
由试验所测得发明实施例1~实施例4中苏氨酸钙的收率如图6所示,其中实施例1的收率为97.1%、实施例2的收率为96.5%、实施例3的收率为98.5%,实施例4的收率为98.1%。
试验例3
本试验例说明苏氨酸钙的结构表征。
采用nexus470智能型傅立叶变换红外光谱仪分别对最佳工艺条件下制备的苏氨酸钙(实施例4)和l-苏氨酸进行扫描分析,得到图7~图8的红外图谱。l-苏氨酸与钙离子发生螯合反应后,相应的特征峰位置发生了明显的位移。从图可以看出,l-苏氨酸在3170cm-1处的n-h键的特征吸收峰,在形成螯合物后发生明显的位移,出现在3390cm-1、3330cm-1。苏氨酸钙中的羧酸根离子1590cm-1、1420cm-1较苏氨酸中羧酸根离子的特征峰1640cm-1和1460cm-1发生了蓝移,说明羧基参与了配位反应,证明了苏氨酸钙的生成。
试验例4
本试验例说明不同螯合率的苏氨酸钙的体外模拟消化
将不同螯合率的苏氨酸钙和碳酸钙溶解在去离子水中,用1mol/l的hcl调节溶液ph值至2.0,加入一定比例的胃蛋白酶,混合均匀,37℃震荡水浴2h;反应结束后,向混合体系中加入一定比例的胰酶和胆汁提取物,调节体系ph值至7.2,将此混合物移入到透析袋中(6000da),37℃震荡水浴2h。
(1)钙离子溶解率的测定
在模拟消化过程中,在胃蛋白消化2h后和胃蛋白酶-胰酶消化4h后取上清液,利用edta络合滴定法测定其中钙离子含量,以表示不同消化阶段的钙离子溶解率。
v1:滴定上清液中钙离子所需要的edta溶液体积,ml;
v2:滴定等体积溶液中钙离子所需要的edta溶液体积,ml;
c:edta溶液的浓度,mol/l。
(2)钙离子透析率的测定
在胰酶消化后,取透析袋外的水溶液,利用edta络合滴定测定水溶液中钙离子含量,以表示透过模拟肠道的钙离子含量。
v1:滴定上清液中钙离子所需要的edta溶液体积,ml;
v2:滴定等体积溶液中钙离子所需要的edta溶液体积,ml;
c:edta溶液的浓度,mol/l。
影响膳食中钙利用率的因素有很多,人体对饮食中钙的吸收率较低,主要原因是钙与植酸在小肠中可形成不溶的复合物,由于人类肠道缺少相应的植酸酶,这种不溶的钙-植酸复合物不能被人类吸收和利用,大大降低了钙的生物利用率,利用体外模拟胃肠道消化-透析法可以评价矿物质元素的生物利用率,不同螯合率的苏氨酸钙和碳酸钙的透析率和溶解性依照wolfgor等描述的实验方法进行测定,经胃肠道消化后,两种物质的溶解率和透析率如图9~图11所示。由实验结果可知,随着螯合率的升高在胃肠道消化后溶解率呈现上升的趋势,在胃部和肠道中的最大溶解率分别为98.91%和54.42%;而碳酸钙中钙离子经胃、肠道消化后的溶解率分别为97.99%、35.84%。此外,随着螯合率的升高苏氨酸钙中钙离子的透析滤也呈现上升的趋势,最大透析率为43.14%,而碳酸钙中钙离子的透析率为23.01%,苏氨酸钙中钙离子的透析率显著高于碳酸钙中钙离子的透析率,虽然碳酸钙以溶解态存在于胃部环境中,但进入肠道环境后其溶解性显著下降,因此苏氨酸钙中的钙离子更容易进入到肠道环境中,这表明,与碳酸钙相比,苏氨酸钙的生物利用率更高,并且提高苏氨酸钙的螯合率可提高其生物利用率。
以上实施例仅用于说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对被发明进行了详细的说明,但对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而对这些修改或者替换同样落于本申请所附权利要求书所限定的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!