一种重组枯草芽孢杆菌及谷胱甘肽的制备方法与流程
1.本发明涉及生物工程领域,具体涉及一种重组枯草芽孢杆菌及谷胱甘肽的制备方法。
背景技术:
2.谷胱甘肽(γ
‑
l
‑
glutamyl
‑
cysteinyl
‑
glycine,gsh)是由l
‑
谷氨酸、l
‑
半胱氨酸和甘氨酸三种氨基酸缩合而成的一种活性三肽类化合物,广泛存在于各种生物体内。还原型的谷胱甘肽在活组织中具有许多重要的功能,谷胱甘肽能够提高人体免疫力,具有抗衰老的功效,其在老人迟缓化的细胞上所发挥的功效比年轻人大,谷胱甘肽对于治疗放射线、放射性药物所引起的白细胞减少等症状也都具有非常显著的效果。
3.目前谷胱甘肽的制备方法很多,常见的包括溶剂萃取法、化学合成法、生物发酵法和酶法。目前国内外生产谷胱甘肽主要是是采用发酵法或酶法,发酵法主要是将编码合成谷胱甘肽酶系或者双功能酶的基因克隆到细菌或酵母中,发酵培养获得谷胱甘肽,发酵法中酵母发酵法工艺较成熟。专利cn201810844388和cn201680013630分别在酵母和大肠杆菌中外源表达谷胱甘肽合成双功能酶基因,达到发酵生产谷胱甘肽的目的,但是产量很低,不适合批量化生产。并且还原性谷胱甘肽在医药保健、食品化妆品等领域有着广泛的应用,安全性至关重要,因此还需保证生产的谷胱甘肽足够安全、可靠。
技术实现要素:
4.本发明的目的是提供一种具有高产量、高得率的谷胱甘肽的制备方法。
5.为达到上述目的,本发明采用的技术方案是:
6.本发明第一方面提供一种谷胱甘肽的制备方法,采用过表达双功能谷胱甘肽合成酶基因的重组枯草芽孢杆菌基因工程菌株发酵生产所述的谷胱甘肽。
7.优选地,所述的双功能谷胱甘肽合成酶基因为来源于streptococcus thermophilus的gshfst基因,所述的基因序列如seq id no.1所示。
8.在本发明中,所述的双功能谷胱甘肽合成酶基因可通过常规基因工程手段获得。例如可以streptococcus thermophilus dna为模板通过pcr扩增分离得到,也可根据其序列通过人工合成得到。
9.优选地,采用补料分批发酵法生产所述的谷胱甘肽。
10.优选地,生产所述的谷胱甘肽时添加谷氨酸、甘氨酸、半胱氨酸。
11.优选地,添加的所述的谷氨酸、所述的甘氨酸、所述的半胱氨酸在反应体系中的初始浓度分别为80~120mm,进一步优选为90~110mm,更优选为95~105mm。
12.本发明通过高密度培养以及过表达双功能谷胱甘肽合成酶基因,将外援添加的谷氨酸、甘氨酸、半胱氨酸合成谷胱甘肽,从而达到高产量、高得率。
13.优选地,将所述的枯草芽孢杆菌基因工程菌接种至发酵培养基中进行发酵培养,在发酵培养的同时分批添加补料液,并控制发酵培养的温度为35~40℃,ph为6.5~7.5,发
酵培养至od600为45~55;然后加入诱导剂继续培养至od600为60~70,再加入谷氨酸、甘氨酸、半胱氨酸,继续培养至所述的谷胱甘肽的产量不再增加。
14.在本发明中,上述发酵培养过程中,发酵培养时间为25~35h,od600达到45~55;加入诱导剂后继续培养8~12h,od600达到60~70。
15.在本发明中,谷氨酸棒杆菌基因工程菌扩大培养方法如下所示:
16.a.平板培养:将甘油管保存的谷氨酸棒杆菌基因工程菌接种至lb培养基中,30℃培养8
‑
12h得到一级种子。
17.b.液体种子培养:将平板培养的谷氨酸棒杆菌基因工程菌(一级种子)接种至二级种子培养基中,30℃培养6
‑
13h得到二级种子培养液。在本发明中,种子培养基为lb液体培养基。
18.进一步优选地,控制所述发酵培养时的接种量为5%~20%,更优选为7%~10%。
19.在本发明中,将二级种子培养液按5%~20%的接种量接种至发酵罐中的发酵培养基中。
20.在本发明中,使用的诱导剂为iptg,iptg的浓度为1mmol/l。
21.根据一种实施方式,发酵培养的发酵培养基包括如下组分:碳源5~20g/l、氮源2~8g/l、无机盐及微量元素1.5~35g/l、可选择性地添加的生长因子5~50μg/l,其中,所述的碳源为玉米粉、玉米浆、糖蜜、蔗糖、葡萄糖、甘油、糊精中的一种或多种;所述的氮源为牛肉膏、工业蛋白胨、胰蛋白胨、酵母粉、蛋白胨、尿素中的一种或多种;所述的无机盐及微量元素为磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、氯化铵、氯化钾、氯化钠、氯化镁、碳酸钙、硫酸铵、硫酸镁、硫酸锰中的一种或多种;所述的生长因子为生物素、维生素b1、维生素b6中的一种或多种。
22.根据一种实施方式,所述的补料液的组分包括葡萄糖、酵母抽提物、蛋白胨、牛肉膏、酵母粉、胰蛋白胨、玉米浆、硫酸镁、甘油中的一种或多种,所述的补料液的浓度为400~520g/l。
23.本发明第二方面还提供一种重组枯草芽孢杆菌基因工程菌株的制备方法,包括如下步骤:
24.(1)将来源于streptococcus thermophilus的gshfst基因克隆到pht
‑
43质粒上,得到重组质粒;
25.(2)将所述的重组质粒转化谷氨酸棒杆菌,得到所述的谷氨酸棒杆菌基因工程菌。
26.在本发明中,所述的双功能谷胱甘肽合成酶基因可通过常规基因工程手段获得。
27.优选地,所述的步骤(1)的具体方法为:以质粒pet28a
‑
gshfst为模板进行dna的扩增,然后将扩增产物或质粒采用bamhi和psti进行双酶切,再与经bamhi和psti酶切处理后的所述的pht
‑
43质粒进行连接,得到所述的重组质粒。
28.在本发明中,所述的重组质粒通过电转的方法转入到枯草芽孢杆菌中。
29.本发明第三方面还提供一种重组枯草芽孢杆菌基因工程菌株,所述的枯草芽孢杆菌中过表达双功能谷胱甘肽合成酶的基因,所述的枯草芽孢杆菌为bacillus subtilis str.168。
30.优选地,所述的双功能谷胱甘肽合成酶基因为来源于streptococcus thermophilus的gshfst基因,所述的基因序列如seq id no.1所示,所述的双功能谷胱甘肽
合成酶基因可通过常规基因工程手段获得。
31.使用本发明的重组枯草芽孢杆菌,通过发酵法生产谷胱甘肽,不仅操作简单、方便,而且产量高、得率高,符合节约资源以及环境友好的生产理念,为重组枯草芽孢杆菌工业化生产谷胱甘肽提供了参考和借鉴。
32.本发明中的枯草芽孢杆菌是一种食品级微生物,安全无毒,因此以枯草芽孢杆菌为出发菌株生产谷胱甘肽更有利。
33.与现有技术相比,本发明具有以下优点:
34.使用本发明的方法制备谷胱甘肽,不仅产量高、得率高,而且操作简单、方便,同时该方法以食品级枯草芽孢杆菌作为生产菌株,更加安全、可靠,为工业化绿色生产谷胱甘肽提供了有效的参考和借鉴。
附图说明
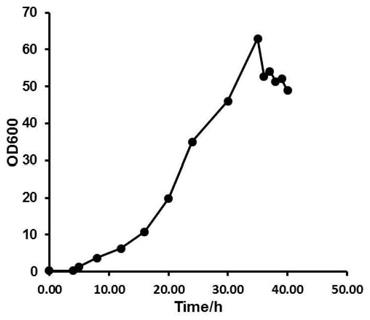
35.附图1:本发明的实施例2的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
36.附图2:本发明的实施例2的发酵液中gsh的生产曲线;
37.附图3:本发明的实施例3的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
38.附图4:本发明的实施例3的发酵液中gsh的生产曲线;
39.附图5:本发明的实施例4的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
40.附图6:本发明的实施例4的发酵液中gsh的生产曲线;
41.附图7:本发明的实施例5的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
42.附图8:本发明的实施例5的发酵液中gsh的生产曲线;
43.附图9:本发明的实施例6的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
44.附图10:本发明的实施例6的发酵液中gsh的生产曲线;
45.附图11:本发明的实施例7的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
46.附图12:本发明的实施例7的发酵液中gsh的生产曲线;
47.附图13:本发明的实施例8的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
48.附图14:本发明的实施例8的发酵液中gsh的生产曲线;
49.附图15:本发明的实施例9的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
50.附图16:本发明的实施例9的发酵液中gsh的生产曲线;
51.附图17:本发明的实施例10的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
52.附图18:本发明的实施例10的发酵液中gsh的生产曲线;
53.附图19:本发明的实施例11的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线;
54.附图20:本发明的实施例11的发酵液中gsh的生产曲线;
具体实施方式
55.下面结合具体的相关实施例,对本发明实施例中的技术方案进行清楚、完整地描述。但是所描述的实施例仅为本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域的普通技术人员在未做出创造性的劳动前提下所获得的所有其它实施例都属于本发明的保护范围。下述实施例中所使用的实验方法。如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。应理解,这些实施例仅用于
说明本发明而不用于限制本发明的范围。
56.实施例1
57.用于gsh生产的重组枯草芽孢杆菌工程菌的构建
58.选取了来源于streptococcus thermophilus(gshfst)的双功能谷胱甘肽合成酶基因(seq id no:1),以重组质粒pet28a
‑
gshfst为模板扩增出双功能谷胱甘肽合成酶的基因片段,通过bamhi和smai双酶切得到线性化质粒,在t4连接酶的作用下进行连接得到重组质粒pht
‑
st。
59.dna片段的准备:以实验室已有的重组质粒pet28a
‑
gshfst为模板进行dna的扩增。反应条件为:98℃预变性5min;98℃变性10s;60℃退火30s;72℃延伸5min,共30个循环;结束后,72℃终延伸10min。扩增得到的产物经核酸电泳跑胶验证后通过pcr purification kit试剂盒纯化,随后通过dpni消化模板质粒。最终用bamhi和smai双酶切。
60.酶切体系为:pcr产物或者pht
‑
43质粒50ul,bamhi和smai各1ul,缓冲液10ul,ddh2o38ul,总体积100ul。
61.经酶切后的pcr产物和经相同酶处理后的pht
‑
43质粒进行连接,连接体系为:酶切后的pcr产物4ul,酶切后的pht
‑
43质粒4ul,t4连接酶1ul,缓冲液1ul,连接得到重组质粒pht
‑
st。将重组质粒pht
‑
st转入到枯草芽孢杆菌bacillus subtilis str.168中得到重组菌bs
‑
st。
62.实施例2:
63.利用重组菌bs
‑
st生产gsh
64.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养11h作为一级种子。
65.(2)将一级种子转入到lb液体培养基中,30℃培养13h得到二级种子培养液。
66.(3)将二级种子培养液按10%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用玉米粉10g/l、葡萄糖2g/l、工业蛋白胨5g/l、玉米浆3g/l、尿素1g/l、碳酸钙0.5g/l、硫酸镁0.8g/l、磷酸二氢钾0.5g/l、磷酸氢二钾0.5g/l,补料液含葡萄糖500g/l、蛋白胨2g/l,培养温度37℃,培养ph 6.8,发酵30h,od600此时为46,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半胱氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
67.测试波长600nm下发酵液的吸光度,以发酵时间为横坐标,吸光度为纵坐标,绘制生产曲线,本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图1。测定发酵液中gsh的含量,并绘制gsh生产曲线,本实施例的gsh生产曲线见附图2。附图1和附图2显示,当培养至30h时,菌体od600为46,此时添加1mm的iptg进行诱导,诱导5h后od600达到63,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为21.8g/l,经计算,基于氨基酸的添加量,gsh得率为70.9%,od600降为52。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
68.实施例3:
69.利用重组菌bs
‑
st生产gsh
70.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养12h作为一级种子。
71.(2)将一级种子转入到lb液体培养基中,30℃培养10h得到二级种子培养液。
72.(3)将二级种子培养液按9.5%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用玉米粉5g/l、葡萄糖3g/l、工业蛋白胨4g/l、玉米浆3g/l、尿素0.5g/l、碳酸钙1.5g/l、硫酸镁1.5g/l、磷酸二氢钾0.4g/l、磷酸氢二钾0.4g/l,补料液含葡萄糖500g/l、蛋白胨1g/l,培养温度37℃,培养ph 6.8,发酵32h,od600此时为48,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
73.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图3,gsh生产曲线见附图4。附图3和附图4显示,培养至32h时,菌体od600为48,此时添加1mm的iptg进行诱导,诱导5h后od600达到64.3,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为20.25g/l,经计算,基于氨基酸的添加量,gsh得率为65.9%,od600降为55.2。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
74.实施例4:
75.利用重组菌bs
‑
st生产gsh
76.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养10h作为一级种子。
77.(2)将一级种子转入到lb液体培养基中,30℃培养11h得到二级种子培养液。
78.(3)将二级种子培养液按8%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用葡萄糖8g/l、牛肉膏2g/l、工业蛋白胨4g/l、玉米浆3g/l、氯化铵0.5g/l碳酸钙2g/l、硫酸镁1g/l、磷酸二氢钾0.2g/l、磷酸氢二钾0.2g/l,补料液含葡萄糖400g/l、玉米浆50g/l、蛋白胨0.5g/l,培养温度37℃,培养ph 7.4,发酵29h,od600此时为49,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
79.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图5,gsh生产曲线见附图6。附图5和附图6显示,培养至29h时,菌体od600为49,此时添加1mm的iptg进行诱导,诱导5h后od600达到64.1,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为20.95g/l,经计算,基于氨基酸的添加量,gsh得率为68.2%,od600降为57.2。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
80.实施例5:
81.利用重组菌bs
‑
st生产gsh
82.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养8h作为一级种子。
83.(2)将一级种子转入到lb液体培养基中,30℃培养12h得到二级种子培养液。
84.(3)将二级种子培养液按7.5%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用葡萄糖10g/l、牛肉膏1g/l、玉米浆0.5g/l、酵母粉2.0g/l、蛋白胨1g/l、氯化铵1g/l、碳酸钙1.5g/l、硫酸镁2g/l、磷酸二氢钾0.3g/l、磷酸氢二钠1.5g/l、硫酸锰1g/l,补料液含葡萄糖400g/l、牛肉膏1g/l、酵母粉1g/l,培养温度37℃,培养ph 7.3,发酵34h,
od600此时为48,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
85.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图7,gsh生产曲线见附图8。附图7和附图8显示,培养至34h时,菌体od600为48,此时添加1mm的iptg进行诱导,诱导5h后od600达到62.1,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为19.55g/l,经计算,基于氨基酸的添加量,gsh得率为63.6%,od600降为52.0。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
86.实施例6:
87.利用重组菌bs
‑
st生产gsh
88.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养8h作为一级种子。
89.(2)将一级种子转入到lb液体培养基中,30℃培养10h得到二级种子培养液。
90.(3)将二级种子培养液按9.5%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用葡萄糖5g/l、甘油2g/l、牛肉膏3g/l、玉米浆1g/l、酵母粉1g/l、氯化铵2g/l、碳酸钙0.5g/l、硫酸镁3g/l、磷酸二氢钾0.6g/l、磷酸氢二钠3g/l、硫酸锰2g/l,补料液含葡萄糖450g/l、胰蛋白胨1g/l,培养温度37℃,培养ph 7.5,发酵33h,od600此时为46.5,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
91.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图9,gsh生产曲线见附图10。附图9和附图10显示,培养至33h时,菌体od600为46.5,此时添加1mm的iptg进行诱导,诱导5h后od600达到64.8,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为20.99g/l,经计算,基于氨基酸的添加量,gsh得率为68.3%,od600降为56.4。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
92.实施例7:
93.利用重组菌bs
‑
st生产gsh
94.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养8.5h作为一级种子。
95.(2)将一级种子转入到lb液体培养基中,30℃培养11.5h得到二级种子培养液。
96.(3)将二级种子培养液按8.5%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用玉米浆4g/l、甘油1g/l、蔗糖3g/l、胰蛋白胨2g/l、酵母粉2g/l、氯化铵3g/l、碳酸钙15g/l、硫酸镁3g/l、氯化钠1g/l、磷酸二氢钾1g/l、磷酸氢二钾1g/l、维生素b120ug/l,补料液含葡萄糖400g/l、酵母抽提物2g/l、硫酸镁3g/l,培养温度37℃,培养ph 7.1,发酵28.2h,od600此时为47.5,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
97.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图11,gsh生产曲线见附图12。附图11和附图12显示,培养至28.2h时菌体od600为47.5此时添加1mm的iptg进行诱导,诱导5h后od600达到67.9添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的
产量为21.69g/l,经计算,基于氨基酸的添加量,gsh得率为70.6%,od600降为62.9。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
98.实施例8:
99.利用重组菌bs
‑
st生产gsh
100.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养11.5h作为一级种子。
101.(2)将一级种子转入到lb液体培养基中,30℃培养12h得到二级种子培养液。
102.(3)将二级种子培养液按7.5%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用葡萄糖6g/l、糖蜜2g/l、胰蛋白胨1g/l、酵母粉3g/l、玉米粉5g/l、硫酸铵3g/l、碳酸钙10g/l、氯化镁4g/l、氯化钾2g/l、磷酸二氢钾2g/l、磷酸氢二钠10g/l、生物素10ug/l,补料液含葡萄糖400g/l、甘油100g/l、酵母抽提物1.5g/l、硫酸镁5g/l,培养温度37℃,培养ph 7.0,发酵30h,od600此时为48.5,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
103.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图13,gsh生产曲线见附图14。附图13和附图14显示,培养至30h时,菌体od600为48.5,此时添加1mm的iptg进行诱导,诱导5h后od600达到66.4,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为21.29g/l,经计算,基于氨基酸的添加量,gsh得率为69.3%,od600降为54.2。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
104.实施例9:
105.利用重组菌bs
‑
st生产gsh
106.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养8h作为一级种子。
107.(2)将一级种子转入到lb液体培养基中,30℃培养9h得到二级种子培养液。
108.(3)将二级种子培养液按9%的接种量接种到2l的发酵罐中进行补料分批发酵,发酵培养基采用牛肉膏1g/l、玉米浆1.5g/l、糊精1g/l、葡萄糖7g/l、胰蛋白胨2g/l、酵母粉2g/l、硫酸铵2g/l、碳酸钙5g/l、硫酸镁2g/l、氯化钠1g/l、磷酸二氢钾1g/l、磷酸氢二钾2g/l、生物素20ug/l、维生素b6 20ug/l,补料液含葡萄糖450g/l、酵母抽提物1g/l、胰蛋白胨1g/l、硫酸镁5g/l,培养温度37℃,培养ph 7.2,发酵32h,od600此时为51.2,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
109.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图15,gsh生产曲线见附图16。附图15和附图16显示,培养至32h时,菌体od600为51.2,此时添加1mm的iptg进行诱导,诱导5h后od600达到69.4,添加各100mm的三种氨基酸前体开始gsh的合成,最终gsh的产量为21.76g/l,经计算,基于氨基酸的添加量,gsh得率为71.1%,od600降为60.2。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
110.实施例10:
111.利用重组菌bs
‑
st生产gsh
112.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养12h作为一级种子。
113.(2)将一级种子转入到lb液体培养基中,30℃培养6h得到二级种子培养液。
114.(3)将二级种子培养液按7%的接种量接种到7l的发酵罐中进行补料分批发酵,发酵罐初始装液量3.5l,发酵培养基及补料液配方同实施例2,培养温度37℃,培养ph 6.8,发酵28h,此时od600为50.1,向培养基中加入1mm的诱导剂iptg,继续培养,5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
115.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图17,gsh生产曲线见附图18。附图17和附图18显示,培养至28h时,菌体od600为50.1,此时添加1mm的iptg进行诱导,诱导5h后od600达到65.3,添加100mm的氨基酸前体开始gsh的合成,最终gsh的产量为20.08g/l,经计算,基于氨基酸的添加量,gsh得率为65.3%,od600降为57.8。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
116.实施例11:
117.利用重组菌bs
‑
st生产gsh
118.(1)将甘油管中保存的重组菌bs
‑
st工程菌菌种接种至lb培养基中,30℃培养11h作为一级种子。
119.(2)将一级种子转入到lb液体培养基中,30℃培养9h得到二级种子培养液。
120.(3)将二级种子培养液按9%的接种量接种到30l的发酵罐中进行补料分批发酵,发酵罐初始装液量15l,发酵培养基及补料液配方同实施例2,培养温度37℃,培养ph 6.8,发酵31h,此时od600为47.1,向培养基中加入1mm的诱导剂iptg,继续培养5h,最终添加谷氨酸、甘氨酸、半光氨酸各100mm进行gsh的合成,待gsh的产量不再增加时停止发酵。
121.本实施例的发酵液中重组枯草芽孢杆菌bs
‑
st的生长曲线见附图19,gsh生产曲线见附图20。附图9和附图20显示,培养至31h时,菌体od600为47.1,此时添加1mm的iptg进行诱导,诱导5h后od600达到62.3,添加100mm的氨基酸前体开始gsh的合成,最终gsh的产量为21.35g/l,经计算,基于氨基酸的添加量,gsh得率为69.5%,od600降为46.3。添加氨基酸前体后菌体浓度有一定的降低,可能是由于半胱氨酸对于菌体有毒害作用使得一部分菌体裂解从而造成了od600的降低。
122.上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1