RAS新抗原特异性结合蛋白及其用途的制作方法
ras新抗原特异性结合蛋白及其用途
1.关于序列表的声明
2.与本技术相关的序列表以文本格式代替纸质副本提供,并在此通过引用并入说明书。包含序列表的文本文件的名称是360056_469wo_sequence_listing.txt。该文本文件大小为653kb,创建于2020年2月17日,正在通过efs-web以电子方式提交。
背景技术:
3.ras家族蛋白是小gtpase,参与细胞内信号的传递,包括例如细胞增殖的转导。示例性ras蛋白包括kras(也称为ck-ras、cfc2、k-ras2a、k-ras2b、k-ras4a、k-ras4b、ki-ras、kras1、kras2、ns、ns3、rald、rask2、k-ras、kras原癌基因、gtpase和c-ki-ras2)、hras和nras。破坏负生长信号的ras蛋白突变可导致细胞持续增殖。kras是多种人类癌症中最常见的突变原癌基因之一,包括黑色素瘤、子宫内膜癌、甲状腺癌、胰腺癌、结直肠癌、乳腺癌、卵巢癌和肺癌,以及一些髓系白血病(如aml)。需要针对突变ras蛋白的新疗法。
附图说明
4.图1-8d涉及本公开的示例性hla-a11/kras特异性tcr。
5.图1显示了通过功能筛选(示例性hla-a11/kras特异性tcr的“排序1”)鉴定功能性hla-a11/kras特异性t细胞系。
6.图2提供了来自富集方案的示例数据,其中示例性的hla-a11/kras特异性tcr在混合突变kras肽刺激后在cd137(4-1bb)上分选。
7.图3显示本公开的示例性hla-a11/kras特异性tcr在转导的宿主细胞中是有功能的。数据显示在与载有抗原的靶细胞孵育后转导细胞的活化(nur77表达)和cd8表达。
8.图4a和4b显示示例性hla-a11/kras特异性tcr识别不同的表位。(a)原代人cd8
+
t细胞被转导以表达hla-a11/kras特异性tcr,用1μg/ml的混合kras肽刺激16小时,并使用pe-anti-cd137(4-1bb)mab和anti-cd8 450mab(赛默飞世尔)(thermofisher)标记。(b)在高尔基体抑制剂存在的情况下,用1μg/ml的单个kras肽(见表左栏)脉冲的apc刺激转导的cd8
+
t细胞4小时。然后检查细胞的ifn-γ产生。
“‑”
=没有可测量的ifn-γ。“+”=测得的ifn-γ水平低。“+++”=测得的ifn-γ水平高。
9.图5a-5d显示了示例性hla-a11/kras-g12d特异性和-g12v特异性tcr的功能表征。(a)原代cd8
+
t细胞释放的ifn-γ,这些细胞被转导以表达指定的hla-a11/kras-g12d特异性tcr,并用浓度增加的肽抗原刺激。(b)(a)中显示的tcr的功能亲合力(使用kras g12d的logec50)值。(c)原代cd8
+
t细胞释放的ifn-γ,这些细胞被转导以表达指定的hla-a11/kras-g12v特异性tcr,并用浓度增加的肽抗原刺激。(d)(c)中显示的tcr的功能亲合力(使用kras g12v的logec50)值。
10.图6a-6g显示示例性hla-a11 kras g12d突变特异性tcr对kras g12d
+
胰腺癌细胞系以及nras g12d
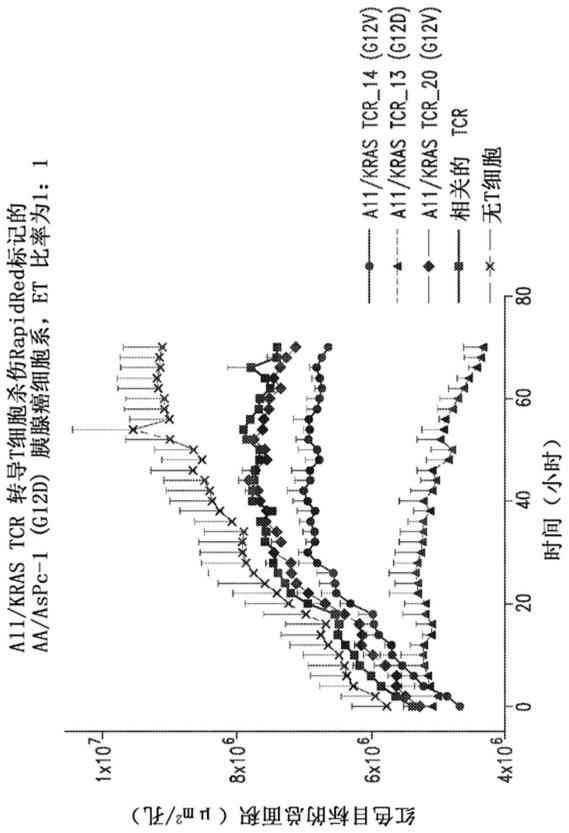
+
aml细胞系(thp-1)有反应。
11.图7a-7g显示了示例性hla-a11 kras g12v突变特异性tcr对几种癌细胞系的反应
性。tcr被证明对kras g12v
+
胰腺癌细胞系(capan-2)以及nras g12v
+
伯基特淋巴瘤细胞系(ga-10.4)有反应。
12.图8a-8d显示了kras g12d
+
(a11/721.221靶细胞加载了100ng/ml突变肽);nras g12d
+
(thp-1细胞);和nras g12v
+
(ga-10.4细胞)肿瘤系(流式细胞术效应物杀伤试验:指定比例的靶细胞),是由用本公开的示例性tcr转导的t细胞形成。
13.图9-11涉及示例性的hla-a3相容的kras突变肽和反应性t细胞系。
14.图9显示了突变的kras g12v肽(10-mer(vvvgavgvgk;seq id no:2);9-mer(vvgavgvk;seq id no:3))对hla-a*0301的预测hla结合亲和力。使用netmhc 3.4版(可在cbs.dtu.dk/services/netmhc/在线获取)测量亲和力。
15.图10显示了在3轮肽刺激后通过四聚体标记检测hla-a3/kras(g12v)特异性t细胞系。
16.图11提供了来自hla-a3/kras(g12v)特异性t细胞富集方案的示例性数据,其中细胞用肽刺激并在cd137(4-1bb)或肽:hla四聚体上评分。
17.图12-20c涉及与hla-a2相容的kras突变肽和示例性t细胞系以及对其特异的tcr。
18.图12显示了kras序列的hla-a*02:01mhc-i结合预测数据(使用iedb),该序列跨越d-或v-突变的g12位置两侧的11aa。使用netmhcpan、syfpeithi和bimas也获得了类似的结果(数据未显示)。
19.图13a和13b显示本公开的分选的示例性hla-a2/kras特异性t细胞响应肽刺激上调cd137。
20.图14a-14d显示本公开的示例性hla-a2 kras特异性t细胞特异性响应kras突变肽,并且可以识别独特的抗原序列。hla-a2 g12v和g12d特异性tcr使用已知技术进行测序。如本文所述,将tcr转导到jurkat细胞和原代t细胞中,并测试对抗原的反应性,包括通过测量扩增、cd137表达、细胞因子产生和肽脉冲靶细胞的特异性杀伤。
21.图15a-16提供了来自四聚体标记实验的数据,证实了示例性hla-a2/kras g12v特异性tcr的hla和肽特异性,以及示例性tcr的相对亲和力读数和cd8非依赖性结合。图15a和15b显示了在指定浓度的野生型hla-a2/kras(
5-14
_g12)-肽多聚体存在下表达指定hla-a2特异性tcr的t细胞的平均荧光强度(mfi)。图16提供了流式细胞术数据,显示了转导以表达指定tcr的t细胞的标记,如通过使用hla-a2(dm)/kras(514_g12v)-肽多聚体的功能测定所确定的。这种多聚体由修饰的hla-a*02:01α-3域双突变(dm)单体组装而成,不能与cd8结合。
22.图17-18c显示了hla-a2/kras g12v特异性tcr的功能亲合力等级(在用单个肽刺激4小时后通过肽剂量反应测试并用ifn-γ抗体标记)和对突变表位特异性的测定(通过用高剂量的野生型kras肽刺激t细胞并用ifn-γ抗体标记来测试)。图17显示了响应突变体与野生型肽的产生ifn-γ的t细胞的频率。图18a和18b显示了所示hla-a2/kras特异性tcr的突变kras
5-14
_g12v肽亲合力曲线。图18c显示了本公开的某些示例性hla-a2特异性tcr的kras
5-14 g12v logec
50
值。
23.图19提供了示例性hla-a2/kras特异性tcr对内源性加工和呈递肽反应性的筛选结果(通过与cfpac-1胰腺肿瘤细胞过夜孵育并用cd137/41-bb抗体标记来测试)。数据是流式细胞术图,显示与肿瘤细胞共孵育后hla-a2/kras特异性t细胞上的cd137表达。
24.图20a-20c提供了杀伤测定的结果,显示表达本公开的示例性hla-a2/kras特异性tcr的t细胞有效且特异性地杀伤cfpac-1(a2
+
和kras g12v
+
)胰腺癌细胞系。在该测定中,测量了活化的半胱天冬酶和nucred标记的肿瘤细胞重叠,其中增加的重叠面积等于细胞凋亡导致的肿瘤细胞死亡。显示的数据是a2/kras tcr的半胱天冬酶激活/杀伤曲线。每个图中都包含相同的对照组,为了便于阅读,实验组和对照组的数据显示在不同的图表上。
25.图21a-31b涉及本公开的示例性hla-a11/kras特异性tcr。
26.图21a和21b显示了用指定的hla-a11/kras特异性tcr转导的t细胞杀死具有内源性g12d突变和天然(a;panc-1细胞系)或转导(b;aspc-1细胞系)的hla-a*11:01表达的rapidred标记的胰腺肿瘤细胞系。数据来自杀伤试验。(a)使用了10:1的效应器:靶细胞比率。(b)使用了1:1的效应器:靶细胞比率。
27.图22a和22b显示了用指定的hla-a11/kras特异性tcr转导的t细胞杀死具有内源性g12v突变和转导的hla-a*11:01表达的rapidred标记的胰腺肿瘤细胞系。数据来自杀伤试验。(a)使用cfpac细胞系和10:1效应器:目标细胞比率。(b)使用capan-2细胞系和1:1效应器:目标细胞比率。
28.图23a和23b提供了来自初始筛选(hla-a11/kras特定tcr的“排序2a”)的流式细胞术数据,显示了在用1μg.ml野生型或突变型kras肽刺激过夜后,示例性hla-a11/kras特异性tcr转导的cd8
+
t细胞的cd137标记。
29.图24a-24c提供的流式细胞术数据显示在用g12d-突变体kras肽((a)kras
7-16
g12d肽;(b)kras
8-16 g12d肽;(c)用指定的tcr转导的t细胞的kras
7-16 g12dlog
10
ec50)的剂量滴定刺激4小时后,用于ifn-γ标记的示例性hla-a11/kras tcr转导、分选和扩增的cd8
+
t细胞的log
10
ec50。
30.图25a-25d显示提供的流式细胞术数据显示在用g12v-突变体kras肽((a)kras
7-16 g12v肽;(b)kras8-16 g12v肽;(c)用指定的tcr转导的t细胞的kras
7-16 g12v log
10
ec50;(d)用指定的tcr转导的t细胞的kras
8-16 g12vlog
10
ec50)的剂量滴定刺激4小时后,用于ifn-γ标记的示例性hla-a11/kras tcr转导、分选和扩增的cd8
+
t细胞的log
10
ec50。
31.图26a和26b提供了流式细胞术数据,显示了在用野生型kras肽的剂量滴定刺激4小时后示例性a11/kras tcr转导、分选和扩增的cd8
+
t细胞的ifn-γ标记。
32.图27a和27b显示通过示例性hla-a11/kras特异性tcr转导、分选和扩增的cd8
+
t细胞杀死(a)hla-a11/aspc-1(kras
7-16 g12d
+
)和(b)hla-a11/cfpac-1(kras
7/8-16
g12v
+
)。数据来自杀伤试验。
33.图28a和28b提供了来自初始筛选(hla-a11/kras特定tcr的“排序2b”)的流式细胞术数据,显示了在用1μg/ml野生型或突变型kras肽刺激过夜后,示例性hla-a11/kras特异性tcr转导的cd8
+
t细胞的cd137(标记见图左边缘)。
34.图29a-29d提供了流式细胞术数据,显示了在用标记的g12d或g12v突变体kras肽的剂量滴定刺激4小时后示例性hla-a11/kras tcr转导、分选和扩增的cd8
+
t细胞的ifn-γ标记。来自两(2)个不同cd8
+
t细胞供体的数据显示为转导的tcr 13和20。具体来说,如图所示,来自供体x或供体y的cd8
+
t细胞用指定的tcr转导。
35.图30提供了流式细胞术数据,显示了在用wt kras肽的剂量滴定刺激4小时后示例性hla-a11/kras tcr转导、分选和扩增的cd8
+
t细胞的ifn-γ标记。来自两个不同cd8
+
t细胞供体的数据显示为转导的tcr 13和20。如图所示,来自供体x或供体y的cd8
+
t细胞用指定的tcr转导。
36.图31a和31b提供了流式细胞术数据,显示了用本公开的某些示例性kras g12d特异性tcr转导的cd8
+
t细胞的hla-a11/kras
7-16
_g12d四聚体标记。
37.图32a-32d提供了来自杀伤测定的结果,显示用本公开的示例性hla-a11/kras特异性tcr转导的t细胞有效且特异性地杀伤表达kras g12d或g12v突变肽((a,b)panc-1细胞;(c)cfpac-1细胞;(d)capan-2肿瘤细胞)的hla-a11
+
肿瘤细胞。在该测定中,测量了活化的半胱天冬酶和nucred(a,b)或rapidred标记的(c,d)肿瘤细胞重叠,其中增加的重叠面积等于细胞凋亡导致的肿瘤细胞死亡。显示的数据是a11/kras tcr的半胱天冬酶激活/杀伤曲线。每张图都包含相同的对照组,对照组包括特异于wilm’s瘤1(wt1)抗原的对照tcr。
具体实施方式
38.本公开内容总体上涉及对ras新抗原特异的结合蛋白、表达该结合蛋白的修饰的免疫细胞、编码结合蛋白的多核苷酸以及相关用途。突变的ras蛋白(例如kras、nras、hras)可以产生新抗原,包括在全长kras蛋白(seq id no:1;uniprot kb p01116)的第12位或全长nras蛋白(seq id no:6;uniprot kb p01111)的第12位或全长hras蛋白(seq id no:216;uniprot kb p01112)的第12位的g
à
v突变或g
à
d突变。
39.在本公开中,提供了能够结合ras新抗原的结合蛋白。在某些方面,提供了包含tcr vα结构域和tcr vβ结构域的结合蛋白(和宿主细胞,例如免疫细胞,其包含编码本公开内容的ras特异性结合蛋白的异源多核苷酸),其中结合蛋白能够与ras肽抗原:hla复合物特异性结合,其中ras肽抗原包含seq id no:2-5或198-201中任一项所述的氨基酸序列或由其组成。在某些实施方案中,hla包括hla-a2、hla-a11或hla-a3。
40.在一些实施方案中,ras肽抗原包含或由seq id no:2-5中任一项所列的氨基酸序列组成,并且hla复合物包含hla-a*11分子或hla-a*03分子。在某些实施方案中,hla-a*11分子包括hla-a*11:01分子。在某些实施方案中,hla-a*11分子包括hla-a*11:01分子。
41.在一些实施方案中,ras肽抗原包含或由seq id nos:198-201中任一项所列的氨基酸序列组成,并且hla复合物包含hla-a*02分子。在进一步的实施方案中,hla-a*02分子包括hla-a*02:01分子。
42.本文还提供了能够特异性结合ras肽抗原(例如,在肽:hla复合物的情况下)的融合蛋白,其中ras肽抗原包含seq id no:2-5或198-201中任一项中所述的氨基酸序列或由其组成:其中融合蛋白包含:(i)可包含如本文公开的结合域(例如,ras特异性结合蛋白(例如,tcr)的)的细胞外组分;(ii)细胞内成分;(iii)位于细胞外成分和细胞内成分之间的跨膜成分。
43.在本文公开的任何实施方案中,结合蛋白(或至少融合蛋白的结合域)可以是人的、人源化的或嵌合的。在某些实施方案中,结合蛋白或融合蛋白的结合域是人的。目前公开的结合蛋白、融合蛋白和宿主细胞(例如,t细胞、nk细胞、nk-t细胞)可用于治疗与kras新
抗原相关的疾病或病症,例如癌症。前公开的结合蛋白还可以结合人nras(seq id no:6)或人hras(seq id no:216)中产生的g12v或g12d抗原,这些蛋白包含与在残基g12附近的区域中的kras相同的序列。因此,所公开的组合物可用于治疗与kras新抗原、包含g12v或g12d突变的nras新抗原、或包含g12v或g12d突变的hras新抗原或其任何组合相关的疾病或病症。
44.还提供了编码ras特异性结合蛋白或融合蛋白、包含该多核苷酸的宿主细胞和相关组合物的多核苷酸。
45.在另一方面,提供了包含seq id no:198-201中任一所述的氨基酸序列或由其组成的免疫原性多肽,以及包含其的组合物。目前公开的免疫原性多肽,例如,可用于疫苗组合物中,以用于治疗或预防与ras突变相关的疾病,用于在受试者中引发免疫应答,以及用于鉴定与ras肽抗原特异性结合的结合蛋白(例如,tcr或car)。
46.还提供了本公开的结合蛋白、多核苷酸、载体、宿主细胞、免疫原性多肽和相关组合物的方法和用途,用于治疗与本文提供的kras、nras和/或hras突变相关的疾病或病症。
47.在更详细地阐述本公开之前,提供将在本文中使用的某些术语的定义可能有助于对其的理解。本公开通篇阐述了另外的定义。
48.在本说明书中,任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数的值,以及在适当时,其分数(例如整数的十分之一和百分之一),除非另有说明。此外,除非另有说明,否则本文所述的与任何物理特征(例如聚合物亚单元、尺寸或厚度)相关的任何数字范围应理解为包括所述范围内的任何整数。如本文所用,除非另有说明,否则术语“约”是指指示范围、值或结构的
±
20%。应当理解,本文所用的术语“一(a)”和“一(an)”是指列举的组分中的“一个或多个”。替代方案(例如,“或”)的使用应理解为表示替代方案中的任一个、两者或其任何组合。如本文所用,术语“包括”、“具有”和“包含”同义使用,这些术语及其变体旨在被解释为非限制性的。
49.另外,应该理解的是本技术公开了源自本文所述结构和取代基的各种组合的单个化合物或化合物组,其公开程度与每个化合物或化合物组被单独阐述的程度相同。因此,特定结构或特定取代基的选择在本公开的范围内。
50.术语“基本上由
……
组成”不等同于“包括”,而是指权利要求的特定材料或步骤,或者不实质上影响所要求保护主题的基本特征的那些材料或步骤。例如,蛋白质结构域、区域或模块(例如,结合域、铰链区、接头模块)或蛋白质(可能有一个或多个域、区域或模块)“基本上由”特定氨基酸序列组成,当结构域、区域、模块或蛋白质的氨基酸序列包括延伸、缺失、突变或它们的组合(例如,氨基末端或羧基末端或结构域之间的氨基酸)时,它们的组合最多占结构域、区域、模块或蛋白质长度的20%(例如,最多15%、10%、8%、6%、5%、4%、3%、2%或1%)并且不会显著影响(即减少活动量不超过50%,例如不超过40%、30%、25%、20%、15%、10%、5%或1%)域、区域、模块或蛋白质(例如,结合蛋白的目标结合亲和力或亲和力)的活性。
51.如本文所用,“造血祖细胞”是可以源自造血干细胞或胎儿组织并且能够进一步分化为成熟细胞类型的细胞(例如,免疫系统细胞)。示例性造血祖细胞包括具有cd24
lo lin-cd117
+
表型的那些或在胸腺(称为祖胸腺细胞)中发现的那些。
52.如本文所用,“免疫系统细胞”是指源自骨髓中的造血干细胞的免疫系统的任何细胞,其产生两个主要谱系,髓样祖细胞(其产生髓样细胞,例如单核细胞、巨噬细胞、树突细
胞、巨核细胞和粒细胞)和淋巴祖细胞(产生淋巴样细胞,如t细胞、b细胞和自然杀伤(nk)细胞)。示例性免疫系统细胞包括cd4
+
t细胞、cd8
+
t细胞、cd4-cd8-双阴性t细胞、γδt细胞、调节性t细胞、自然杀伤细胞、自然杀伤t细胞和树突状细胞。巨噬细胞和树突状细胞可以被称为“抗原呈递细胞”或“apc”,它们是特化的细胞,当与肽复合的apc表面上的主要组织相容性复合物(mhc)受体与t细胞表面上的tcr相互作用时,它可以激活t细胞。
[0053]“t细胞”或“t淋巴细胞”是在胸腺中成熟并产生t细胞受体(tcr)的免疫系统细胞。t细胞可以是幼稚的(“t
n”;未暴露于抗原;与t
cm
(本文所述)相比,cd62l、ccr7、cd28、cd3、cd127和cd45ra表达增加,cd45ro表达减少或不表达)、记忆t细胞(tm)(有抗原经验且寿命长),其包括干细胞记忆t细胞和效应细胞(有抗原经验、细胞毒性)。tm可进一步分为中枢记忆t细胞亚群(t
cm
,表达cd62l、ccr7、cd28、cd95、cd45ro和cd127)和效应记忆t细胞(t
em
,表达cd45ro,cd62l、ccr7、cd28和cd45ra)。效应t细胞(te)是指存在抗原的cd8
+
细胞毒性t淋巴细胞,其表达cd45ra,具有与t
cm
相比,cd62l、ccr7和cd28的表达降低,并且颗粒酶和穿孔素呈阳性。辅助t细胞(th)是cd4
+
细胞,通过释放细胞因子影响其他免疫细胞的活性。cd4
+
t细胞可以激活和抑制适应性免疫反应,这两种功能中的哪一种被诱导将取决于其他细胞和信号的存在。可以使用已知技术收集t细胞,并且可以通过已知技术例如通过与抗体的亲和结合、流式细胞术或免疫磁性选择来富集或去除各种亚群或其组合。其他示例性t细胞包括调节性t细胞,例如cd4
+
cd25
+
(foxp3
+
)调节性t细胞和treg17细胞,以及tr1、th3、cd8
+
cd28-和qa-1限制性t细胞。
[0054]“t细胞受体”(tcr)是指具有可变结合域、恒定域、跨膜区和短胞质尾的免疫球蛋白超家族成员;(例如,参见janeway et al.,immunobiology:the immune systeminhealth and disease,3rd ed.,current biology publications,p.433,1997)其能够特异性结合与mhc受体结合的抗原肽。tcr可以在细胞表面或以可溶形式存在,通常由具有α和β链(也分别称为tcrα和tcrβ)或γ和δ链(也分别称为tcrγ和tcrδ)的异二聚体组成。在某些实施方案中,可以对编码本公开内容的结合蛋白例如tcr的多核苷酸进行密码子优化以增强在特定宿主细胞中的表达,例如作为免疫系统的细胞、造血干细胞、t细胞、原代t细胞、t细胞系、nk细胞或自然杀伤t细胞(scholten et al.,clin.immunol.119:135,2006)。可表达本公开内容的结合蛋白和tcr的示例性t细胞包括cd4
+
t细胞、cd8
+
t细胞及其相关亚群(例如,幼稚、中枢记忆、干细胞记忆、效应记忆)。
[0055]
与其他免疫球蛋白(例如抗体)一样,tcr链(例如,α-链、β-链)的细胞外部分包含两个免疫球蛋白结构域,一个位于n端的可变结构域(例如,α-链可变域或vα、b-链可变域或vβ;通常是基于kabat编号的氨基酸1至116(kabat et al.,"sequences ofproteins ofimmunological interest,usdept.health andhuman services,public health service national institutes ofhealth,1991,5
th ed.))和一个靠近细胞膜的恒定结构域(例如,α-链恒定域或cα,通常基于kabat的5个氨基酸117至259,β-链恒定域或cβ,通常基于kabat的氨基酸117至295)。此外,与免疫球蛋白一样,可变域包含由框架区(fr)分隔的互补决定区(cdr)(例如参见,jores et al.,proc.nat'l acad.sci.usa87:9138,1990;chothia et al.,emboj.7:3745,1988;还参见lefrancetal.,dev.comp.immunol.27:55,2003)。本公开中使用的tcr的来源可以来自各种动物物种,例如人、小鼠、大鼠、兔或其他哺乳动物。
[0056]
术语“可变区”或“可变域”是指参与免疫球蛋白超家族结合蛋白(例如,tcr)与抗原结合的免疫球蛋白超家族结合蛋白(例如,tcrα-链或β-链(或γδtcr的γ链和δ链))的域。天然tcr的α链和β链的可变域(分别为vα和vβ)通常具有相似的结构,每个域包含四个普遍保守的框架区(fr)和三个cdr。vα结构域由两个独立的dna片段编码,可变基因片段和连接基因片段(v-j);vβ结构域由三个独立的dna片段编码,即可变基因片段、多样性基因片段和连接基因片段(v-d-j)。单个vα或vβ结构域可能足以赋予抗原结合特异性。此外,可以使用来自结合抗原的tcr的vα或vβ域来分离结合特定抗原的tcr,以分别筛选互补vα或vβ域的文库。
[0057]
术语“互补决定区”和“cdr”与“高变区”或“hvr”同义,并且在本领域中已知是指免疫球蛋白(例如,tcr)可变区内的氨基酸序列,其赋予抗原特异性和/或结合亲和力并且在一级氨基酸序列中被框架区彼此分开。一般来说,每个tcrα链可变区有3个cdr(αcdr1、αcdr2、αcdr3),每个tcrβ链可变区有3个cdr(βcdr1、βcdr2、βcdr3)。在tcr中,cdr3被认为是负责识别加工抗原的主要cdr。通常,cdr1和cdr2主要或专门与mhc相互作用。
[0058]
cdr1和cdr2由tcr可变区编码序列的可变基因片段编码,而cdr3由跨越vα可变和连接片段的区域,或跨越vβ可变、多样性和连接片段的区域编码。因此,如果已知vα或vβ的可变基因片段的身份,就可以推导出它们相应的cdr1和cdr2的序列;例如,根据如本文所述的编号方案。与cdr1和cdr2相比,由于重组过程中核苷酸的添加和丢失,cdr3通常更加多样化。
[0059]
tcr可变域序列可以与编号方案(例如kabat、chothia、eu、imgt、enhanced chothia和aho)进行比对,从而允许注释等效的残基位置并使用例如anarci软件工具比较不同的分子(2016,bioinformatics 15:298-300)。编号方案提供了tcr可变域中框架区和cdr的标准化描述。在某些实施例中,根据imgt编号方案识别本公开的cdr(lefranc et al.,dev.comp.immunol.27:55,2003;imgt.org/imgtindex/v-quest.php)。
[0060]
如本文所用,术语“cd8共受体”或“cd8”是指细胞表面糖蛋白cd8,作为α-α同二聚体或α-β异二聚体。cd8共受体有助于细胞毒性t细胞(cd8
+
)的功能,并通过其细胞质酪氨酸磷酸化途径通过信号传导发挥作用(gao and jakobsen,immunol.today21:630-636,2000;cole and gao,cell.mol.immunol.1:81-88,2004)。有五(5)种已知的人类cd8β链同种型(参见uniprotkb标识符p10966)和一种已知的人类cd8α链同种型(参见uniprotkb标识符p01732)。也参见seq id no:685-692。
[0061]“cd4”是一种免疫球蛋白共受体糖蛋白,其帮助tcr与抗原呈递细胞进行交流(参见campbell&reece,biology 909(benjamin cummings,sixth ed.,2002))。cd4存在于免疫细胞(例如t辅助细胞、单核细胞、巨噬细胞和树突状细胞)的表面,并包括在细胞表面表达的四个免疫球蛋白结构域(d1至d4)。在抗原呈递过程中,cd4与tcr复合物一起被募集,以结合mhcii分子的不同区域(cd4结合mhciiβ2,而tcr复合物结合mhciiα1/β1)。不希望被理论束缚,据信靠近tcr复合物允许cd4相关激酶分子磷酸化cd3细胞质域上存在的免疫受体酪氨酸激活基序(itam)。这种活动被认为会放大由激活的tcr产生的信号,以产生或招募各种类型的免疫系统细胞(包括t辅助细胞)和免疫反应。
[0062]
在某些实施方案中,tcr存在于t细胞(或t淋巴细胞)表面并与cd3复合物结合。“cd3”是六条链的多蛋白复合物(参见abbas and lichtman,2003;janeway et al.,
p.172and 178,1999),其与t细胞中的抗原信号传导有关。在哺乳动物中,该复合物包含一cd3γ链、一cd3δ链、两条cd3ε链和一cd3ζ链的同源二聚体。cd3γ、cd3β和cd3ε链是免疫球蛋白超家族的相关细胞表面蛋白,其含有单个免疫球蛋白结构域。cd3γ、cd3β和cd3ε链的跨膜区带负电荷,据信这使得这些链能够与t细胞受体链的带正电荷区域结合。cd3γ、cd3β和cd3ε链的细胞内尾部各包含一个保守基序,称为基于免疫受体酪氨酸的激活基序或itam,而每个cd3ζ链有三个。不希望受理论束缚,据信itam对于tcr复合物的信号传递能力是重要的。本公开中使用的cd3的来源可以来自各种动物物种,包括人、小鼠、大鼠或其他哺乳动物。
[0063]
如本文所用,“tcr复合物”是指通过cd3与tcr结合形成的复合物。例如,tcr复合物可以包括一cd3γ链、一cd3β链、两条cd3ε链、一cd3ζ链的同源二聚体、一tcrα链和一tcrβ链。可选地,tcr复合物可以包括一cd3γ链、一cd3β链、两条cd3ε链、一cd3ζ链的同源二聚体、一tcrγ链和一tcrβ链。
[0064]
如本文所用,“tcr复合物的组分”是指tcr链(即tcrα、tcrβ、tcrγ或tcrδ)、cd3链(即cd3γ、cd3δ、cd3ε或cd3ζ)或由两条或更多条tcr链或cd3链形成的复合物(例如,tcrα和tcrβ的复合物,tcrγ和tcrδ的复合物,cd3ε和cd3δ的复合物,cd3γ和cd3ε的复合物,或tcrα、tcrβ、cd3γ、cd3δ和两条cd3ε链的亚tcr复合物)。
[0065]“嵌合抗原受体”(car)是指融合蛋白,其是经工程改造以包含两个或多个天然存在的氨基酸序列、结构域或基序,以非天然存在或非天然存在于宿主细胞中的方式连接在一起,当存在于细胞表面时,融合蛋白可以作为受体发挥作用。car可以包括细胞外部分,该细胞外部分包含与跨膜结构域和一个或多个细胞内信号传导结构域(可选地包含共刺激域)连接的抗原结合结构域(例如,从免疫球蛋白或免疫球蛋白样分子获得或衍生,例如从对癌抗原特异的tcr衍生或获得的tcr结合域、从抗体衍生或获得的scfv、或来自nk细胞的杀伤性免疫受体的衍生或获得的抗原结合域)(参见,例如,sadelain et al.,cancer discov.,3(4):388(2013);还参见harris and kranz,trends pharmacol.sci.,37(3):220(2016),stone et al.,cancer immunol.immunother.,63(11):1163(2014),以及walseng et al.,scientific reports7:10713(2017),其中car构建体及制造相同的方法通过引用并入本文)。与ras抗原特异性结合的本公开的car(例如,在肽:hla复合物的情况下)包含tcr vα结构域和vβ结构域。
[0066]
本公开的任何多肽,如由多核苷酸序列编码的,可以包含“信号肽”(也称为前导序列、前导肽或转运肽)。信号肽将新合成的多肽靶向细胞内外的适当位置。在定位或分泌完成期间或一旦完成,可从多肽中去除信号肽。具有信号肽的多肽在本文中称为“前蛋白”,并且去除了它们的信号肽的多肽在本文中称为“成熟”蛋白质或多肽。在本文公开的任何实施方案中,结合蛋白或融合蛋白包含或是成熟蛋白,或者是或包含前蛋白。
[0067]“接头”是指连接两个蛋白质、多肽、肽、结构域、区域或基序的氨基酸序列,并且可以提供与两个亚结合结构域的相互作用相容的间隔区功能使得所得多肽保留对靶分子的特异性结合亲和力(例如,sctcr)或保留信号活性(例如,tcr复合物)。在某些实施方案中,接头由例如约2至约35个氨基酸或约4至约20个氨基酸或约8至约15个氨基酸或约15至约25个氨基酸组成。示例性接头包括甘氨酸-丝氨酸接头(例如,seq id no:214和215)。
[0068]
如本文所用,“抗原”或“ag”是指激发免疫反应的免疫原性分子。这种免疫反应可
mhc的hla呈递来自细胞外的肽,包括例如hla-dp、hla-dm、hla-doa、hla-dob、hla-dq和hla-dr。
[0073]
抗原呈递细胞(apc)(如树突细胞、巨噬细胞、淋巴细胞或其他细胞类型)处理抗原的原则以及apc将抗原呈递给t细胞的原理,包括免疫相容(例如,共享至少一种与抗原呈递相关的mhc基因的等位基因形式)apc和t细胞之间的主要组织相容性复合体(mhc)限制性呈递,均已确立(参见,例如,murphy,janeway’simmunobiology(8
th ed.)2011garland science,ny;chapters 6,9and 16)。例如,源自胞质溶胶(例如,肿瘤抗原、细胞内病原体)的加工抗原肽的长度通常为约7个氨基酸至约11个氨基酸,并将与i类mhc(hla)分子结合,而在囊泡系统(例如细菌、病毒)中加工的肽的长度从约10个氨基酸到约25个氨基酸不等,并与ii类mhc(hla)分子结合。
[0074]
如本文所用,术语“kras特异性结合蛋白”是涉及结合kras肽抗原或nras肽抗原或nras肽抗原(或针对akras或nras或hras肽抗原:hla复合物,例如,在细胞表面上)的蛋白质或多肽,例如tcr、sctcr或car,以及涉及不结合不含kras或nras或hras肽的肽,也不结合含有此类肽的hla复合物。
[0075]
本公开的结合蛋白,例如tcr、sctcr和car,将包含对靶标特异的结合域。如本文所用,“结合域”(也称为“结合区”或“结合部分”)是涉及具有与目标(例如,kras或nras或hras肽或kras或nras或hras肽:mhc复合物)特异性地和非共价结合、结合或结合的能力的分子或其部分(例如,肽、寡肽、多肽、蛋白质)。结合域包括生物分子、分子复合物(即包含两个或多个生物分子的复合物)或其他感兴趣的目标的任何天然存在的、合成的、半合成的或重组产生的结合配偶体。示例性的结合域包括免疫球蛋白可变区或包含它们的单链构建体(例如,单链tcr(sctcr))。
[0076]
在某些实施方案中,ras特异性结合蛋白以小于约10-8
m、小于约10-9
m、小于约10-10
m、小于约10-11
m的kd结合kras(或nras或hras)肽(或kras(或nras或hras):hla复合体),小于约10-12
m,或小于约10-13
m,或以与本文提供的示例性sras特异性结合蛋白的表现出的亲和力大约相同、至少大约相同或大于等于或大约为该亲和力的亲和力结合,例如本文提供的任何ras特异性tcr,例如,如通过相同测定所测量的。在某些实施方案中,ras特异性结合蛋白包含ras特异性免疫球蛋白超家族结合蛋白或其结合部分。
[0077]
如本文所用,“特异性结合”或“特异于”是指结合蛋白(例如,tcr受体)或结合域(或其融合蛋白)以等于或大于105m-1(它等于该缔合反应的接通率[k
on
]与解离率[k
off
]的比率)的亲和力或ka(即,特定结合相互作用的平衡结合常数,单位为1/m)与靶分子的缔合或结合,同时不与样品中的任何其它分子或组分显着缔合或结合。结合蛋白或结合域(或其融合蛋白)可归类为“高亲和力”结合蛋白或结合域(或其融合蛋白)或“低亲和力”结合蛋白或结合域(或其融合蛋白)。“高亲和力”结合蛋白或结合域是指具有至少107m-1
、至少108m-1
、至少109m-1
、至少10
10
m-1
、至少10
11
m-1
,至少10
12
m-1
,或至少10
13
m-1
。“低亲和力”结合蛋白或结合域是指具有高达107m-1
、高达106m-1
、高达105m-1
的ka的那些结合蛋白或结合域。或者,亲和力可以定义为与m单位(例如,10-5
m至10-13
m)的特定结合相互作用的平衡解离常数(kd)。
[0078]
在某些实施方案中,受体或结合域可具有“增强的亲和力”,它是指与野生型(或亲本)结合域相比,与靶抗原的结合更强的选定或工程化受体或结合域。例如,增强的亲和力可能是由于靶抗原的ka(平衡缔合常数)高于野生型结合域,由于靶抗原的kd(解离常数)小
于野生型结合域的kd(解离常数),由于靶抗原的解离率(k
off
)小于野生型结合域的解离率(k
off
),或其组合。
[0079]
用于鉴定特异性结合特定靶标的本公开的结合域,以及确定结合域或融合蛋白亲和力的多种测定法是已知的,例如蛋白质印迹、elisa、分析超速离心、光谱和表面等离子共振分析((参见,例如,scatchard et al.,ann.n.y.acad.sci.51:660,1949;wilson,science 295:2103,2002;wolff et al.,cancer res.53:2560,1993;and u.s.patent nos.5,283,173,5,468,614,或等同物)。
[0080]
在某些实施方案中,单独的kras(或nras,或hras)特异性结合域(即,不含kras(或nras,或hras)特异性结合蛋白的任何其他部分)可以是可溶的并且可以以小于约10-8
m、小于约10-9
m、小于约10-10
m,小于约10-11
m,小于约10-12
m,或小于约10-13
m的kd结合至kras(或nras,或hras)(或kras(或nras,或hras)肽,或kras(或nras,或hras)肽:hla复合物)。在特定实施方案中,kras(或nras,或hras)特异性结合域包括kras(或nras,或hras)特异性sctcr(例如,单链αbtcr蛋白,例如vα-l-vb、vb-l-vα、vα-cα-l-vα或vα-l-vb-cb,其中vα和vb分别是tcrα和b可变域,cα和cb分别是tcrα和b恒定域,l是接头,例如本文所述的接头)。
[0081]
如本文所用,术语“功能亲合力”是指体外免疫细胞(例如,t细胞、nk细胞、nk-t细胞)对给定浓度的配体反应的生物学量度或活化阈值,其中生物学测量可包括细胞因子产生(例如,ifn-γ产生、il-2产生等)、细胞毒活性、活化标记物(例如,cd137、nur77)和增殖。例如,通过例如产生细胞因子、表现出细胞毒性活性或增殖在体外对低抗原剂量作出生物学(免疫学)反应的t细胞被认为具有高功能性亲和力,而较低功能性亲和力的t细胞在引发类似于高亲和力t细胞的免疫反应之前需要更高量的抗原。应当理解,功能亲合力不同于亲合力(affinity)和亲合力(avidity)。亲和力是指结合蛋白与其抗原/配体之间任何给定键的强度。一些结合蛋白是多价的,可以与多种抗原结合——在这种情况下,整体连接的强度就是亲和力。
[0082]
功能亲和力和免疫反应的有效性之间存在许多相关性。一些体外研究表明,不同的t细胞功能(例如增殖、细胞因子产生等)可以在不同的阈值下触发(参见,例如,betts et al.,j.immunol.172:6407,2004;langenkamp et al.,eur.j.immunol.32:2046,2002)。影响功能亲合力的因素包括(a)tcr对pmhc复合物的亲和力,即tcr和pmhc之间相互作用的强度(cawthonet al.,j.immunol.167:2577,2001),(b)宿主细胞上tcr的表达水平,在一些实施方案中,cd4或cd8共受体的表达水平以及(c)信号分子的分布和组成(viola and lanzavecchia,science273:104,1996),以及减弱t细胞功能和tcr信号的分子的表达水平。
[0083]
在指定的暴露时间后诱导基线和最大反应之间的半数最大反应(例如,细胞因子的产生;结合标记肽时的荧光强度:hla多聚体)所需的抗原浓度称为“半数最大有效浓度”或“ec50”。ec50值通常表示为摩尔(摩尔/升)量,但它通常转换为对数值,如下所示
–
log
10
(ec50)。例如,如果ec50等于1μm(10-6
m),则log
10
(ec50)值为
–
6。使用的另一个值是pec50,它被定义为ec50的负对数(-log10(ec50))。在上面的示例中,ec50等于1μm,其pec50值为6。在某些实施方案中,本公开的结合蛋白的功能亲合力将包括结合蛋白促进t细胞产生ifnγ的能力的量度,其可使用本领域已知和本文所述的测定法来测量。在某些实施例中,功能亲合力将包括结合蛋白在与抗原结合后激活宿主细胞(比如t细胞)的能力的量度。在某些情况下,“高功能亲合力”tcr或其结合域是指具有ec50为至少10-4
m、至少约10-5
m、或至少约10
‑6m、或至少约10-7
m的那些tcr或其结合域。
[0084]
还考虑了融合蛋白,其包含与抗体(例如,igg(1、2、3、4)、ige、igd、iga、igm及其变体)或其片段(例如,在一些实施方案中,保持与一种或多种fc受体、c1q、蛋白a、蛋白g或其任何组合的结合的片段)的恒定域连接的本公开的sctcr,并且包括免疫球蛋白重链单体和多聚体,例如fc二聚体;参见,例如,wong et al.,j.immunol.198:1supp.(2017)。包含增强、降低或消除与例如fcrn或其他fc受体的结合或通过fcrn或其他fc受体的结合的突变的变体fc多肽是已知的,并且涵盖在本公开内容中。
[0085]
在某些实施方案中,本公开的结合蛋白或融合蛋白(例如,tcr、sctcr、car)由宿主细胞(例如,通过异源表达结合蛋白或融合蛋白的t细胞、nk细胞或nk-t细胞)表达。可以通过以下方式确定这种宿主细胞对kras(或nras或hras)肽抗原或kras(或nras或hras)肽抗原:hla复合物的亲和力:例如,通过将宿主细胞暴露于肽,或肽:hla复合物(例如,组织为四聚体),或将肽呈递给宿主细胞的抗原呈递细胞(apc),任选地在肽:hla复合物中,接着测量宿主细胞的活性,例如细胞因子的产生或分泌(例如,ifn-γ;tnfα);测量宿主细胞信号或活性成分(例如,cd137(4-1bb))的表达增加;宿主细胞的增殖;或通过杀死apc(例如,使用标记铬释放分析)。
[0086]
如本文所用,“核酸”或“核酸分子”或“多核苷酸”是指脱氧核糖核酸(dna)、核糖核酸(rna)、寡核苷酸、多核苷酸、例如通过聚合酶链反应(pcr)或通过体外翻译生成的片段中任一个,并且也涉及由任何连接、断裂、核酸内切酶作用或核酸外切酶作用产生的片段。在某些实施方案中,本公开的核酸通过pcr产生。核酸可由单体组成,这些单体是天然存在的核苷酸(如脱氧核糖核苷酸和核糖核苷酸)、天然存在的核苷酸的类似物(例如,天然核苷酸的α-对映体形式)或两者的组合。修饰的核苷酸可以对糖部分或嘧啶或嘌呤碱基部分进行修饰或替换。核酸单体可通过磷酸二酯键或此类键的类似物连接。磷酸二酯键的类似物包括硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯、苯胺磷酸酯、氨基磷酸酯等。核酸分子可以是单链或双链的。
[0087]
术语“隔离”是指材料从其原始环境中移除(例如,如果是自然发生的自然环境)。例如,存在于活体动物中的天然存在的核酸或多肽不是分离的,但是,从天然系统中的一些或全部共存物质中分离出来的相同核酸或多肽是分离的。这样的核酸可以是载体的一部分和/或这样的核酸或多肽可以是组合物(例如,细胞裂解物)的一部分,并且仍然是分离的,因为这样的载体或组合物不是核酸或多肽的自然环境的一部分。术语“基因”是指参与产生多肽链的dna片段;它包括编码区之前和之后的区域(“前导和拖尾”)以及各个编码段(外显子)之间的插入序列(内含子)。
[0088]
如本文所用,术语“重组的”、“工程化的”和“修饰的”是指通过引入外源核酸分子而修饰的细胞、微生物、核酸分子、多肽、蛋白质、质粒或载体,或指通过人为干预进行基因工程改造的细胞或微生物,即通过引入异源核酸分子进行修饰,或指已被改变使得内源核酸分子或基因的表达受到控制、解除调节或组成性的细胞或微生物,可以通过基因工程引入此类改变或修饰。人类产生的遗传改变可以包括,例如,引入编码一种或多种蛋白质或酶的核酸分子(可能包括表达控制元素,例如启动子)的修饰,或细胞遗传物质的其他核酸分子添加、缺失、替换或其他功能破坏或添加。示例性修饰包括来自参考或亲本分子的异源或同源多肽的编码区或其功能片段中的那些。
[0089]
如本文所用,“突变”是指分别与参照或野生型核酸分子或多肽分子相比,核酸分子或多肽分子的序列发生变化。突变可导致多种不同类型的序列变化,包括核苷酸或氨基酸的取代、插入或缺失。在某些实施例中,突变是一个或三个密码子或氨基酸的取代,一到约5个密码子或氨基酸的缺失,或其组合。
[0090]
在本领域中,“保守替换”被认为是一种氨基酸被另一种具有相似特性的氨基酸置换。示例性保守替换是本领域众所周知的(参见,例如,wo 97/09433第10页;lehninger,biochemistry,2
nd edition;worth publishers,inc.ny,ny,pp.71-77,1975;lewin,genes iv,oxford university press,ny and cell press,cambridge,ma,p.8,1990)。
[0091]
在某些实施方案中,与参考序列相比,根据本公开的蛋白质(例如,结合蛋白、免疫原性肽)包含变体序列(例如,与本文公开的参考tcr cdr3β相比的变体tcr cdr3β)。如本文所用,“变体”氨基酸序列、肽或多肽是指与参考氨基酸序列(或肽或多肽)相比具有一或两个氨基酸取代、缺失或插入的氨基酸序列。在某些实施例中,变体氨基酸序列、肽或多肽保留与参考分子基本相同的功能性(例如,对肽:hla复合物的结合特异性和亲和力);例如,与参考tcr结合片段相比,本文公开的变体tcr片段保留50%、约60%、约70%、约80%、约90%、约95%、约99%或100%的抗原结合特异性和亲和力。
[0092]“改变的域”或“改变的蛋白质”是指与野生型基序、区域、结构域、肽、多肽或蛋白质(例如,野生型tcrα链、tcrβ链、tcrα恒定域、tcrβ恒定域)具有至少85%(例如,86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%、99.9%)的不同序列同一性的基序、区域、结构域、肽、多肽或蛋白质。
[0093]
改变的结构域或改变的蛋白质或衍生物可以包括基于相同氨基酸的所有可能密码子选择的那些和基于保守氨基酸取代的密码子选择。例如,以下六组每组都包含彼此保守替换的氨基酸:1)丙氨酸(ala;a)、丝氨酸(ser;s)、苏氨酸(thr;t);2)天冬氨酸(asp;d)、谷氨酸(glu;e);3)天冬酰胺(asn;n)、谷氨酰胺(gln;q);4)精氨酸(arg;r)、赖氨酸(lys;k);5)异亮氨酸(ile;i)、亮氨酸(l)、甲硫氨酸(met;m)、缬氨酸(val;v);和6)苯丙氨酸(phe;f)、酪氨酸(tyr;y)、色氨酸(trp;w)。(也参见wo97/09433第10页,lehninger,biochemistry,2
nd edition,worth publishers,inc.,ny,ny,pp.71-77,1975;lewin genes iv,oxford university press,ny and cell press,cambridge,ma,p.8,1990;creighton,proteins,w.h.freeman and company 1984)。此外,改变、添加或删除编码序列中的单个氨基酸或一小部分氨基酸的个别替换、缺失或添加也是“保守替换”。
[0094]
术语“构建体”是指包含重组核酸分子的任何多核苷酸。“转基因”或“转基因构建体”是指包含以自然界中未发现的排列可操作地连接的两个或更多个基因的构建体。术语“可操作地连接”(或本文中的“可操作地连接”)是指两个或更多个核酸分子在单个核酸片段上的缔合,使得一个的功能受另一个的影响。例如,当启动子可以影响编码序列的表达时,启动子与编码序列可操作地连接(即,编码序列在启动子的转录控制之下)。“无关联”是指相关的遗传元件彼此之间没有密切联系,一个的功能不影响另一个。在一些实施方案中,转基因中存在的基因与表达控制序列(例如,启动子)可操作地连接。
[0095]
构建体(例如,转基因)可以存在于载体(例如,细菌载体、病毒载体)中或可以整合到基因组中。“载体”是能够运输另一种核酸分子的核酸分子。例如,载体可以是可以包括染
色体、非染色体、半合成或合成核酸分子的质粒、粘粒、病毒、rna载体或线性或环状dna或rna分子。示例性载体是能够自主复制(附加型载体)或表达与其连接的核酸分子的那些(表达载体)。可用于本公开的组合物和方法的载体在本文中进一步描述。
[0096]
如本文所用,术语“表达”是指基于核酸分子(例如基因)的编码序列产生多肽的过程。该过程可以包括转录、转录后控制、转录后修饰、翻译、翻译后控制、翻译后修饰或其任何组合。
[0097]
在将核酸分子插入细胞的上下文中,术语“引入”是指“转染”或“转化”或“转导”,并且术语包括提及将核酸分子并入真核或原核细胞其中核酸分子可以掺入细胞的基因组(例如,染色体、质粒、质体或线粒体dna),转化为自主复制子,或瞬时表达(例如,转染的mrna)。
[0098]
如本文所用,“异源”或“外源”核酸分子、构建体序列是指非宿主细胞天然的核酸分子或核酸分子的一部分,但可以与来自宿主细胞的核酸分子或核酸分子的一部分同源。异源或外源核酸分子、构建体或序列的来源可以来自不同的属或种。在某些实施方案中,通过例如接合、转化、转染、转导、电穿孔等将异源或外源核酸分子添加(即,非内源性或原生性)到宿主细胞或宿主基因组中,其中添加的分子可以整合到宿主基因组中或作为染色体外遗传物质(例如,作为质粒或其他形式的自我复制载体)存在,并且可以以多个副本的形式存在。此外,“异源的”是指由引入宿主细胞的外源核酸分子编码的非天然酶、蛋白质或其他活性,即使宿主细胞编码同源蛋白质或活性。而且,包含“修饰”或“异源”多核苷酸或结合蛋白的细胞包括该细胞的后代,无论后代本身是否被转导、转染或以其他方式操纵或改变。
[0099]
如本文所述,可以将多于一种异源或外源核酸分子作为单独的核酸分子、作为多个单独控制的基因、作为多顺反子核酸分子、作为编码融合蛋白的单个核酸分子或其任何组合引入宿主细胞。例如,如本文所公开的,可以修饰宿主细胞以表达一种或多种异源或外源核酸分子,异源或外源核酸分子编码对ras抗原肽(例如,tcrα和tcrb)特异的所需tcr,并且任选地,如本文所公开的,还编码包含α链、β链或其部分,例如能够结合mhc的细胞外部分的cd8共受体多肽。当两个或多个外源核酸分子被引入宿主细胞时,应理解,两个或多个外源核酸分子可以作为单个核酸分子(例如,在单个向量上)在单独的载体上引入,在单个位点或多个位点整合到宿主染色体中,或其任何组合。提及的异源核酸分子或蛋白质活性的数量是指编码核酸分子的数量或蛋白质活性的数量,而不是引入宿主细胞的分离核酸分子的数量。
[0100]
如本文所用,术语“内源的”或“天然的”是指通常存在于宿主细胞中的基因、蛋白质或活性。而且,与非亲本基因、蛋白质或活性相比发生突变、过度表达、改组、复制或以其他方式改变的基因、蛋白质或活性仍被认为是该特定宿主细胞的内源性或天然的。例如,来自第一个基因(例如,启动子、翻译衰减序列)的内源性控制序列可用于改变或调节第二个天然基因或核酸分子的表达,其中第二天然基因或核酸分子的表达或调控不同于亲代细胞中的正常表达或调控。
[0101]
术语“同源”或“同源物”是指在宿主细胞、物种或菌株中发现的或衍生自宿主细胞、物种或菌株的分子或活性。例如,异源或外源核酸分子可以与原生宿主细胞基因同源,并且可以任选地具有改变的表达水平、不同的序列、改变的活性或其任何组合。
[0102]
本文所述的“序列同一性”是指在比对序列并引入缺口后,一个序列中的氨基酸残
基与另一参考多肽序列中的氨基酸残基相同的百分比,如有必要,以实现最大百分比的序列同一性,并且不考虑任何保守替换作为序列同一性的一部分。可以使用altschul et al.(1997),nucl.acids res.25:3389-3402定义的ncbi blast2.0软件生成百分比序列同一性值,其中参数设置为默认值。
[0103]
结合蛋白
[0104]
一方面,本公开提供了一种结合蛋白,其包含t细胞受体(tcr)α链可变(vα)结构域和tcrβ链可变(vβ)结构域,其中结合蛋白能够结合肽:hla复合物,其中肽包含氨基酸序列klvvvgavgv(seq id no:198)或由其组成。在某些实施方案中,hla包括hla-a*02,任选地hla-a*02:01。在任何目前公开的实施方案中,结合蛋白可由人免疫系统细胞(例如t细胞)异源表达。
[0105]
在某些实施方案中,vα结构域和/或vβ结构域各自独立地是人的、人源化的或嵌合的,并且优选地各自是人。
[0106]
目前公开的结合蛋白能够被宿主细胞(例如人类免疫细胞,例如t细胞)异源表达。此外,表目前公开的结合蛋白的表达可以赋予宿主细胞有利的特性;例如,具有对于本公开的ras抗原:hla复合物的结合特异性、改进的活性、增殖、或在存在ras抗原:hla呈递肿瘤细胞的杀伤活性或等同物。
[0107]
例如,在某些实施方案中,当结合蛋白由免疫细胞(例如,人t细胞,任选cd8
+
和/或cd4
+
t细胞、nk细胞或nk-t细胞)表达时,免疫细胞能够特异性杀伤表达肽的hla-a*02
+
肿瘤细胞,所述肽包含或由seqid no:198中所列的氨基酸序列组成。可以确定靶细胞的杀伤,例如,生物成像平台(essen bioscience)。在某些实施方案中,该平台使用活化的半胱天冬酶和标记的(例如,rapidred或nucred)肿瘤细胞信号,其中测量重叠并且增加的重叠面积等于细胞凋亡导致的肿瘤细胞死亡。杀死也可以使用4小时测定法确定,其中靶细胞加载有标记的铬(
51
cr),并在与表达本公开内容的结合蛋白的免疫细胞共孵育4小时后测量上清液中的
51
cr。在某些实施例中,可以使用效应器:靶细胞比率:1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、20:1、25:1、50:1或100:1等进行杀伤试验。
[0108]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,人类t细胞,可选的cd8
+
和/或cd4
+
t细胞、nk细胞或nk-t细胞)表达时,当存在hla-a*02
+
肿瘤细胞时,任选地进一步存在外源性ifn-γ,免疫细胞具有升高的nur77表达,其中hla-a*02
+
肿瘤细胞表达包含seq id no:198中列出的氨基酸序列或由其组成的肽,其中nur77表达与以下相比升高:(i)当参考免疫细胞存在肿瘤细胞时,不表达结合蛋白的参考免疫细胞(即,与表达结合蛋白的免疫细胞具有相同的细胞类型,并且在其他方面在表型和/或基因型上至少基本上相同或功能等效)表达nur77;和/或(ii)当不存在肿瘤细胞和/或不存在表达肽:hla复合物的抗原呈递细胞时,由表达结合蛋白的免疫细胞表达nur77,其中肽包含seq id no:198中列出的氨基酸序列或由其组成,并且其中hla任选地是hla-a*02:01。例如,nur77的表达可以使用包含与编码报告构建体的序列可操作地连接的nur77基因座的转基因表达构建体来确定;例如,dtomato(参见ahsouri和weiss,j immunol 198(2):657-668(2017))。
[0109]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,人t细胞,任选cd8
+
和/或cd4
+
t细胞、nk细胞或nk-t细胞)表达时,当存在hla-a*02
+
肿瘤细胞时,任选地进一步存在外源性ifn-γ,免疫细胞具有升高的cd137(也称为4-1bb)表达,其中,hla-a*02
+
肿瘤
细胞表达包含seq id no:198中列出的氨基酸序列或由其组成的肽,其中cd137表达与以下相比升高:(i)当参考免疫细胞存在肿瘤细胞时,不表达结合蛋白的参考免疫细胞表达cd137;和/或(ii)当不存在肿瘤细胞和/或不存在表达肽:hla复合物的抗原呈递细胞时,表达结合蛋白的免疫细胞表达cd137,其中肽包含或由seq id no:198中列出的氨基酸序列组成,并且其中hla任选地是hla-a*02:01。例如,cd137表达可以使用标记的抗cd137抗体的流式细胞术来确定。在某些实施例中,cd137在16小时测定后测量,其中免疫细胞与肽或表达肽的靶细胞共孵育或刺激。
[0110]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,人t细胞,任选cd8
+
和/或cd4
+
t细胞、nk细胞或nk-t细胞)表达时,当存在包含seq id no:198所示氨基酸序列或由其组成的肽时,当肽以至少约10-10
m、至少约10-9
m和/或至少约10-8
m的浓度存在时,免疫细胞产生ifn-γ。ifn-γ的产生可以通过例如在用肽抗原、肽:hla复合物或本文提供的肿瘤细胞刺激后使用标记的抗-ifn-γ抗体进行细胞内染色来确定。ifn-γ的产生可以在4小时测定后确定,其中免疫细胞与肽或表达肽的靶细胞共孵育或刺激。在某些实施例中,在表达结合蛋白的多个免疫细胞(例如,人t细胞、nk细胞、nk-t细胞或其任何组合)中,至少约10%、至少约15%、至少约20%或至少约25%的多个免疫细胞当存在10-9
m肽时产生ifn-γ。
[0111]
在某些实施例中,在表达结合蛋白的多个免疫细胞(例如,人t细胞,可选的cd8
+
和/或cd4
+
t细胞、nk细胞或nk-t细胞)中,当存在10-8
m肽时,至少约25%、至少约30%或至少约35%的多个免疫细胞产生ifn-γ。在某些实施方案中,当存在0.1ng/ml或更多的包含氨基酸序列klvvvgavgv(seq id no:198)或由其组成的肽时,免疫细胞或多个免疫细胞产生ifn-γ,其中可选地,与当存在10,000ng/ml的包含seq id no:1的氨基酸5-14或由其组成的肽相比,当存在1ng/ml包含氨基酸序列klvvvgavgv(seq id no:198)或由其组成的肽时,免疫细胞或多个免疫细胞产生更多的ifn-γ。
[0112]
在任何目前公开的实施例中,结合蛋白对于包含seq id no.:198中列出的氨基酸序列或由其组成的肽具有log
10
ec50,其中,seq id no:198具有小于-8.0,任选约-8.5或更小,进一步任选约-8.5、约-8.6、约-8.7、约-8.8、约-8.9、约-9、约-9.1或约-9.2。
[0113]
在任何目前公开的实施方案中:(i)结合蛋白由与免疫细胞异源的多核苷酸编码;(ii)免疫细胞包括人cd8
+
t细胞、人cd4
+
t细胞或两者;(iii)表达包含seq id no.:198所示氨基酸序列或由其组成的肽的肿瘤细胞是hla-a*02:01
+
;和/或(iv)肿瘤细胞包含cfpac-1细胞。
[0114]
在任何目前公开的实施方案中,结合蛋白能够独立于cd8或在不存在cd8的情况下结合肽:hla复合物。例如,可以通过流式细胞术确定结合蛋白与a2(dm)/-肽多聚体的结合来确定cd8非依赖性结合。这种多聚体由修饰的hla-a*02:01α3域双突变(dm)单体组装而成,其不能与cd8结合。cd8非依赖性结合也可以通过在cd8阴性细胞(例如,cd4+t细胞、jurkat细胞等)中表达结合蛋白并鉴定细胞与靶标的结合来确定。
[0115]
在某些实施例中:(i)vα结构域包含根据seq id no.:351、343、359、367、375、383、391、399、407、415、423、431、439、447、455、463或471中任一项所述的vα氨基酸序列的cdr1α、cdr2α和/或cdr3α氨基酸序列;和/或(ii)vβ结构域包含根据seq id no:354、346、362、370、378、386、394、402、410、418、426、434、442、450、458、466、474、482或490中任一项所列的vβ氨基酸序列的cdr1β、cdr2β和/或cdr3β氨基酸序列。在某些实施例中,使用imgt、eu、
kabat、chothia、aho或增强型chothia编号方案确定cdr。tcr可变域序列可以与编号方案(例如kabat、chothia、eu、imgt、enhanced chothia和aho)进行比对,从而允许注释等效的残基位置并使用例如anarci软件工具比较不同的分子(2016,bioinformatics15:298-300)。
[0116]
在进一步的实施例中,结合蛋白包含cdr1α、cdr2α、cdr3α和cdr1β、cdr2β和cdr3β氨基酸序列,其根据以下所列的vα和vβ氨基酸序列:(i)分别为seq id no:351和354;(ii)分别为seq id no:343和346;(iii)分别为seq id no:359和362;(iv)分别为seq id no:367和370;(v)分别为seq id no:375和378;(vi)分别为seq id no:383和386;(vii)分别为seq id no:391和394;(viii)分别为seq id no:399和402;(ix)分别为seq id no:407和410;(x)分别为seq id no:415和418;(xi)分别为seqid no:423和426;(xii)分别为seq id no:431和434;(xiii)分别为seq id no:439和442;(xiv)分别为seq id no:447和450;(xv)分别为seq id no:455和458;(xvi)分别为seq id no:463和466;(xvii)分别为seq id no:471和474;(xviii)分别为seq id no:479和482;或(xix)分别为seq id no:487和490。
[0117]
在某些实施方案中,本公开的结合蛋白包含:(i)seq id no:228、222、234、240、246、252、258、264、270、276、282、288、294、300、306、312、318、324、或340中任一项所示的cdr3α氨基酸序列,或其变体,其中,变体包含一个、两个或三个氨基酸取代的变体,其中任何或所有的可包含保守氨基酸取代;和/或(ii)seq id no:225、219、231、237、243、249、255、261、267、273、279、285、291、297、303、309、315、321或327,或其变体中任一项所示的cdr3β氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(iii)seq id no:226、220、232、238、244、250、256、262、268、274、280、286、292、298、304、316、322或328或其变体中任一项所示的cdr1α氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(iv)seq id no:223、217、229、235、241、247、253、259、265、271、277、283、289、295、301、307、313、319或325,或其变体中任一项所示的cdr1β氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(v)seq id no:227、221、233、239、245、251、257、263、269、275、281、287、293、299、305、311、317、323或329,或其变体中任一项所示的cdr2α氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(vi)seq id no:224、218、230、236、242、248、254、260、266、272、278、284、290、296、302、308、314、320或326,或其变体中任一项所示的cdr2β氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代。
[0118]
在进一步的实施例中,本公开内容的结合蛋白包含以下所列的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β氨基酸序列:(i)seq id no:分别为226、227、228、223、224和225;(ii)seq id no:分别为220、221、222、217、218和219;(iii)seq id no:分别为232、233、234、229、230和231;(iv)seq id no:分别为238、239、240、235、236和237;(v)seq id no:分别为244、245、246、241、242和243;(vi)seq id no:分别为250、251、252、247、248和249;(vii)seq id no:分别为256、257、258、253、254和255;(viii)seq id no:分别为262、263、264、259、260和261;(ix)seq id no:分别为268、269、270、265、266和267;(x)seq id no:分别为274、275、276、271、272和273;(xi)seq id no:分别为280、281、282、277、278和279;
(xii)seq id no:分别为286、287、288、283、284和285;(xiii)seq id no:分别为292、293、294、289、290和291;(xiv)seq id no:分别为298、299、300、295、296和297;(xv)seq id no:分别为304、305、306、301、302和303;(xvi)seq id no:分别为310、311、312、307、308和309;(xvii)seq id no:分别为316、317、318、313、314和315;(xviii)seq id no:分别为322、323、324、319、320和321;或(xix)seq id no:分别为328、329、330、325、326和327。
[0119]
在任何目前公开的实施例中,结合蛋白可包含分别与来自d_2_1.1、d_2_1.2、d_2_1.3、d_2_1.4、d_2_1.5、d_2_1.6、d_2_1.7、d_2_1.8、d_2_1.9、d_2_1.10、d_2_2.1、d_2_2.2、d_2_2.3、d_2_2.4、d_2_2.5、d_2_2.6、d_2_2.7、d_2_2.8、d_2_2.9或d_2_2.10的vβ结构域或vα结构域具有至少90%同一性的vβ结构域和/或vα结构域,前提是:(a)至少三个或四个cdr没有突变;(b)确实有突变的cdr仅具有最多两个氨基酸取代、最多五个连续的氨基酸缺失或其组合;和(c)编码的结合蛋白保留其结合肽:hla-a*02:01复合物的能力,该复合物包含根据seq id no:198-201中任一项的kras肽。在进一步的实施方案中,结合域包括:(i)来自d_2_1.1、d_2_1.2、d_2_1.3、d_2_1.4、d_2_1.5、d_2_1.6、d_2_1.7、d_2_1.8、d_2_1.9、d_2_1.10、d_2_2.1的cdr3βd_2_2.2、d_2_2.3、d_2_2.4、d_2_2.5、d_2_2.6、d_2_2.7、d_2_2.8、d_2_2.9或d_2_2.10;和/或(ii)来自d_2_1.1、d_2_1.2、d_2_1.3、d_2_1.4、d_2_1.5、d_2_1.6、d_2_1.7、d_2_1.8、d_2_1.9、d_2_1.10、d_2_2.1、d_2_2.2、d_2_2.3、d_2_2.4、d_2_2.5、d_2_2.6、d_2_2.7、d_2_2.8、d_2_2.9或d_2_2.10的cdr3α。在一些实施例中,结合域包含来自d_2_1.1、d_2_1.2、d_2_1.3、d_2_1.4、d_2_1.5、d_2_1.6、d_2_1.7、d_2_1.8、d_2_1.9、d_2_1.10、d_2_2.1、d_2_2.2、d_2_2.3、d_2_2.4、d_2_2.5、d_2_2.6、d_2_2.7、d_2_2.8、d_2_2.9或d_2_2.10的cdr1β和cdr2β、cdr1α和/或cdr2α。
[0120]
在特定实施方案中,结合域包含来自d_2_1.1、d_2_1.2、d_2_1.3、d_2_1.4、d_2_1.5、d_2_1.6、d_2_1.7、d_2_1.8、d_2_1.9、d_2_1.10、d_2_2.1、d_2_2.2、d_2_2.3、d_2_2.4、d_2_2.5、d_2_2.6、d_2_2.7、d_2_2.8、d_2_2.9或d_2_2.10的vβ域和vα域。
[0121]
在任何目前公开的实施例中:(i)vα结构域可包含与seq id no.351、343、359、367、375、383、391、399、407、415、423、431、439、447、455、463、471或479中任一项所述的氨基酸序列具有至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%)同一性的氨基酸序列或由其组成;和/或(ii)vβ结构域包含与seq id no.354、346、362、370、378、386、394、402、410、418、426、434、442、450、458、466、474、482或490中任一项所述的氨基酸序列具有至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%)同一性的氨基酸序列或由其组成。在某些实施例中,与本文提供的参考可变域氨基酸序列相比的变异限于一个或多个框架序列,并且任选地包含一个或多个保守取代或由其组成。
[0122]
在特定实施例中,vα结构域和vβ结构域包含或由以下氨基酸序列组成:(i)分别为seq id no:351和354;(ii)分别为seq id no:343和346;(iii)分别为seq id no:359和362;(iv)分别为seq id no:367和370;(v)分别为seq id no:375和378;(vi)分别为seq id no:383和386;(vii)分别为seq id no:391和394;(viii)分别为seq id no:399和402;(ix)分别为seq id no:407和410;(x)分别为seq id no:415和418;(xi)分别为seq id no:423和426;(xii)分别为seq id no:431和434;(xiii)分别为seq id no:439和442;(xiv)分别为seq id no:447和450;(xv)分别为seq id no:455和458;(xvi)分别为seq id no:463和
466;(xvii)分别为seq id no:471和474;(xviii)分别为seq id no:479和482;或(xix)分别为seq id no:487和490。
[0123]
在任何目前公开的实施例中,结合蛋白还可包含tcrα链恒定域(cα)和/或tcrβ链恒定域(cβ)。在某些实施方案中,cα包含与seqid no.:85或86中列出的氨基酸序列具有至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%)同一性的氨基酸序列或由其组成。在某些实施例中,cβ包含与seq id no:87-99中的任一列出的氨基酸序列具有至少90%同一性的氨基酸序列或由其组成。
[0124]
在一些实施例中,结合蛋白包含tcrα链和tcrβ链,其中tcrα链和tcrβ链包含与下述氨基酸序列具有至少90%同一性的氨基酸序列或由其组成:(i)分别为seq id no:350和353;(ii)分别为seq id no:342和345;(iii)分别为seq id no:358和361;(iv)分别为seq id no:366和369;(v)分别为seq id no:374和377;(vi)分别为seq id no:382和385;(vii)分别为seq id no:390和393;(viii)分别为seq id no:398和401;(ix)分别为seq id no:406和409;(x)分别为seq id no:414和417;(xi)分别为seq id no:422和425;(xii)分别为seq id no:430和433;(xiii)分别为seq id no:438和441;(xiv)分别为seq id no:446和449;(xv)分别为seq id no:454和457;(xvi)分别为seq id no:462和465;(xvii)分别为seq id no:470和473;(xviii)分别为seq id no:478和481;或(xix)分别为seq id no:486和489。
[0125]
在任何目前公开的实施方案中,结合蛋白可包含tcr、单链tcr(sctcr)或嵌合抗原受体(car)。生产工程化tcr的方法描述于,例如,bowerman et al.,mol.immunol.,46(15):3000(2009),其技术通过引用并入本文。制造car的方法是本领域已知的,并且描述于例如美国专利号6,410,319;美国专利号7,446,191;美国专利公开号2010/065818;美国专利号8,822,647;pct公开号wo 2014/031687;美国专利号7,514,537;和brentjens et al.,2007,clin.cancer res.13:5426,其技术通过引用并入本文。
[0126]
在另一方面,提供了包含t细胞受体(tcr)α链可变(vα)结构域和tcrβ链可变(vβ)结构域的结合蛋白,其中结合蛋白能够结合以下任何一种或多种:(i)肽:hla复合物,其中所述肽包含氨基酸序列vvvgavgvgk(seq id no:2)或由其组成;(ii)肽:hla复合物,其中所述肽包含氨基酸序列vvgavgvgk(seq id no:3)或由其组成;(iii)肽:hla复合物,其中所述肽包含氨基酸序列vvgadgvgk(seq id no:4)或由其组成;或者(iv)肽:hla复合物,其中所述肽包含氨基酸序列vvvgadgvgk(seq id no:5)或由其组成。
[0127]
在某些实施方案中,vα结构域和/或vβ结构域各自独立地是人的、人源化的或嵌合的,并且优选地各自是人。
[0128]
在任何当前公开的实施方案中,结合蛋白可以由免疫细胞(例如,t细胞、nk细胞、nk-t细胞等)异源表达。在某些实施方案中,免疫细胞包括人t细胞。
[0129]
在某些实施方案中,hla包括hla-a*11,任选地hla-a*11:01。
[0130]
在任何目前公开的实施方案中,当结合蛋白由免疫细胞(例如,t细胞,例如人cd8
+
和/或cd4
+
t细胞、ank细胞、nk-t细胞等)表达时,免疫细胞能够特异性(例如,仅或优先)杀死hla-a*11
+
肿瘤细胞,该肿瘤细胞在其细胞表面表达或展示包含seq id no:2-5中的任何一个或多个所列氨基酸序列或由组成的肽,其中,任选地,表达的结合蛋白由与免疫细胞异源的多核苷酸编码。在任何目前公开的实施例中,肿瘤细胞包括panc-1细胞、aspc-1细胞、
cfpac-1细胞、capan-2细胞、thp-1细胞、721.221细胞、ga-10.4细胞或其任何组合。可以确定靶细胞的杀伤,例如,生物成像平台(essen bioscience)。在某些实施方案中,该平台使用活化的半胱天冬酶和标记的(例如,rapidred或nucred)肿瘤细胞信号,其中测量重叠并且增加的重叠面积等于细胞凋亡导致的肿瘤细胞死亡。杀死也可以使用4小时测定法确定,其中靶细胞加载有标记的铬(
51
cr),并在与表达本公开内容的结合蛋白的免疫细胞共孵育4小时后测量上清液中的游离
51
cr。在某些实施例中,可以在效应器:靶细胞比率:1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、20:1、25:1、50:1或100:1等进行杀伤试验。
[0131]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,t细胞、nk细胞、nk-t细胞等)表达时,当存在以下情况时,免疫细胞的nur77和/或cd137表达升高:(i)包含seq id no:2所列氨基酸序列或由其组成的肽;(ii)包含seq id no:3所列氨基酸序列或由其组成的肽;(iii)包含seq id no:4所列氨基酸序列或由其组成的肽;(iv)包含seq id no:5所列氨基酸序列或由其组成的肽;(v)包含seq id no:2所列氨基酸序列或由其组成的肽;和包含seq id no:3所列氨基酸序列或由其组成的肽;和/或(vi)包含或由seq id no:4中列出的氨基酸序列组成的肽和包含或由seq id no:5中列出的氨基酸序列组成的肽,其中当参考免疫细胞存在肽时,与不表达结合蛋白的参考免疫细胞的nur77和/或cd137表达相比,nur77和/或cd137表达升高,和/或与表达结合蛋白的人t细胞的nur77和/或cd137表达相比,当存在包含seq id no:2或seq id no:3所示氨基酸序列或由其组成的肽时,nur77和/或cd137表达升高,并且其中(i)-(vi)中任一项的肽任选地在免疫细胞存在下由肿瘤细胞表达。
[0132]
在任何目前公开的实施例中,结合蛋白具有(i)包含seq id no:2或3中列出的氨基酸序列或由其组成的肽的log
10
ec50小于-6.5,任选约-7.0、约-7.5或约-8.0或小于-8.0,任选约-8.0、约-8.1、约-8.2、约-8.3、约-8.4、约-8.5;和/或(ii)包含seq id no:4或5中列出的氨基酸序列或由其组成的肽的log
10
ec50小于-7.0或小于-8.0,任选地约-7.5、约-7.6、约-7.7、约-7.8、约-8.0、约-8.1、约-8.2、约-8.3、约-8.4、约-8.5、约-8.6、约-8.7、约-8.8或大约-8.9。
[0133]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,t细胞、nk细胞、nk-t细胞等)表达时,当存在以下物质时:(i)包含或由seq id no:2中列出的氨基酸序列组成的肽;和/或(ii)包含或由seq id no:3中列出的氨基酸序列组成的肽;和/或(iii)包含或由seq id no:4中列出的氨基酸序列组成的肽;和/或(v)包含或由seq id no:5中列出的氨基酸序列组成的肽,当肽以至少约10-11
m、至少约10-10
m、至少约10-9
m和/或至少约10-8
m的浓度存在时,免疫细胞产生ifn-γ。
[0134]
在某些实施例中,表达结合蛋白的多个免疫细胞(例如,t细胞、nk细胞、nk-t细胞等)中,当存在10-8
m肽、10-7
m肽或10-6
m肽时,至少约50%、至少约55%、至少约60%或更多的人t细胞产生ifn-γ。在进一步的实施例中,在表达结合蛋白的多个免疫细胞中:(i)当存在10ng/ml包含seq id no:4中所述氨基酸序列或由其组成的肽时,至少约10%、15%、20%或25%的多个免疫细胞产生ifn-γ;(ii)当存在100ng/ml的包含seq id no:4中列出的氨基酸序列或由其组成的肽时,至少约25%的多个免疫细胞产生ifn-γ;(iii)当存在10ng/ml的包含seq id no:3所述的氨基酸序列或由其组成的肽时,至少约10%、15%、20%或25%的多个免疫细胞产生ifn-γ;和/或(iv)当存在100ng/ml的包含seq id no:3中列出的氨基
酸序列或由其组成肽时,至少约50%、至少约55%、至少约60%、至少约65%、至少约70%或至少约75%的多个免疫细胞生ifn-γ。
[0135]
在任何目前公开的实施例中,当结合蛋白由免疫细胞(例如,t细胞、nk细胞或nk-t细胞)表达时,当存在包含seq id no:1的氨基酸7-16或8-16或由其组成的肽时,免疫细胞不产生或基本上不产生ifn-γ。
[0136]
在任何目前公开的实施例中,(i)vα结构域可包含根据seq id no:76、62、64、68、70、72、74、78、80、82、84、502、512、522、532、542、552、562、572、582、592、602或612中任一项所述的vα氨基酸序列的cdr1α、cdr2α和/或cdr3α氨基酸序列;和/或(ii)vβ结构域可包含根据seq id no:75、61、63、65、67、69、71、73、77、79、81、83、501、511、521、531、541、551、561、571、581、591、601或611中任一项所述的vβ氨基酸序列的cdr1β、cdr2β和/或cdr3β氨基酸序列。tcr可变域序列可以与编号方案(例如kabat、chothia、eu、imgt、enhanced chothia和aho)进行比对,从而允许注释等效的残基位置并使用例如anarci软件工具比较不同的分子(2016,bioinformatics 15:298-300)。
[0137]
在某些实施例中,结合蛋白可以包含cdr1α、cdr2α、cdr3α和cdr1β、cdr2β和cdr3β氨基酸序列,其根据以下所列的vα和vβ氨基酸序列:(i)分别为seq id no:76和75;(ii)分别为seq id no:62和61;(iii)分别为seq id no:64和63;(iv)分别为seq id no:66和65;(v)分别为seq id no:68和67;(vi)分别为seq id no:70和69;(vii)分别为seq id no:72和71;(viii)分别为seq id no:74和73;(ix)分别为seq id no:78和77;(x)分别为seq id no:80和79;(xi)分别为seq id no:82和81;(xii)分别为seq id no:84和83;(xiii)分别为seq id no:522和521;(xiv)分别为seq id no:532和531;(xv)分别为seq id no:542和541;(xvi)分别为seq id no:552和551;(xvii)分别为seq id no:562和561;(xviii)分别为seq id no:572和571;(xix)分别为seq id no:582和581;(xx)分别为seq id no:592和591;(xxi)分别为seq id no:602和601;(xxii)分别为seq id no:612和611;(xxiii)分别为seq id no:502和501;(xxiv)分别为seq id no:512和511。
[0138]
在特定实施方案中,结合蛋白包含:(i)seq id no:660、27、10、618、12、624、14、15、630、19、17、636、21、642、23、648、25、654、29、666、31、672、33、678、35、684、495、505、515、525、535、545、555、565、575、585、595、或605或其变体中任一项所示的cdr3α氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何一个或所有的可包含保守氨基酸取代;和/或(ii)seq id no:659、26、9、617、11、623、13、629、18、16、635、20、641、22、647、24、653、26、659、28、665、30、671、32、677、498、508、518、528、538、548、558、568、578、588、598或608或其变体中任一项所示的cdr3β氨基酸序列,其中变体包括一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(iii)seq id no:656、614、620、626、632、638、644、650、656、662、668、674、680、493、503、513、523、533、543、553、563、573、583、593、603或其变体中任一项所示的cdr1α氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(iv)seq id no:655、613、619、625、631、637、643、649、661、667、673、679、496、506、516、526、536、546、556、566、576、586、596或606,或其变体中任一项所示的cdr1β氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代;和/或(v)seq id no:658、616、622、628、634、640、646、652、664、670、676、682、494、504、514、524、534、544、554、564、574、
584、594或604,或其变体中任一项所示的cdr2α氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有可包含保守氨基酸取代;和/或(vi)seq id no:657、615、621、627、633、639、645、651、657、663、669、675、681、497、507、517、527、537、547、557、567、587、597、或607,或其变体中任一项所示的cdr2β氨基酸序列,其中变体包含一个、两个或三个氨基酸取代,其中任何或所有的可包含保守氨基酸取代。
[0139]
在一些实施方案中,结合蛋白包含(a)seq id no:19、35、10、12、14、15、17、21、23、25、27、29、31或33,或其变体中任一项的cdr3α氨基酸序列;(b)seq id no:18、34、9、11、13、16、18、20、22、24、26、28、30或32,或其变体中任一项的cdr3β氨基酸序列;或者(c)(a)和(b)。在一些实施方案中,结合蛋白包含(a)t细胞受体(tcr)α链可变(vα)域和tcr vβ结构域,其中,该t细胞受体(tcr)α链可变(vα)域包含根据seq id no:19、35、10、12、14、15、17、21、23、25、27、29、31或33或其变体中任一项的cdr3氨基酸序列(cdr3α);或者(b)tcrvβ结构域和tcrvα结构域,其中tcrvβ结构域包含根据seq id no:18、34、9、11、13、16、18、20、22、24、26、28、30或32或其变体中任一项的cdr3氨基酸序列(cdr3β);或者(c)(a)的tcrvα结构域和(b)的tcrvβ结构域,其中编码的结合蛋白能够特异性结合kras肽:hla复合物,其中kras肽包含或由以下组成:(i)氨基酸序列vvvgavgvgk(seq id no:2)组成;或者(ii)氨基酸序列vvgavgvgk(seq id no:3);或者(iii)氨基酸序列vvgadgvgk(seq id no:4);或者(viii)氨基酸序列vvvgadgvgk(seq id no:5)。
[0140]
在进一步的实施例中,结合蛋白包含如下所列的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β氨基酸序列:(i)seq id no:分别为656、658、660或27、655、657和659或26;(ii)seq id no:分别为614、616、618或10、613、615和617或9;(iii)seq id no:分别为620、622、624或12、619、621和629或13;(iv)seq id no:分别为626、628、630或14或15、625、627和629或13;(v)seq id no:分别为632、634、636或17或19、631、633和635或18或16;(vi)seq id no:分别为638、640、642或21或17、637、639和641或20或16;(vii)seq id no:分别为644、646、648或23、643、645和647或22;(viii)seq id no:分别为650、652、654或25、649、651和653或24;(ix)seq id no:分别为662、664、666或29、661、663和665或28;(x)seq id no:分别为668、670、672或31、667、669和671或30;(xi)seq id no:分别为674、676、678或33、673、675和677或32;(xii)seq id no:分别为680、682、684或35、679、681和683或34;(xiii)分别为seq id no:493-498;(xiv)分别为seq id no:503-508;(xv)分别为seq id no:513-518;(xvi)分别为seq id no:523-528;(xvii)分别为seq id no:533-538;(xviii)分别为seq id no:543-548;(xix)分别为seq id no:553-558;(xx)分别为seq id no:563-568;(xxi)分别为seq id no:573-578;(xxii)分别为seq id no:583-588;(xxii)分别为seq id no:593-598;或(xxiv)分别为seq id no:603-608。
[0141]
在某些实施例中,(i)结合蛋白的vα结构域包含与seq id no:76、62、64、68、70、72、74、78、80、82、84、502、512、522、532、542、552、562、572、582、592、602或612中的任一个所列氨基酸序列具有至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%)同一性的氨基酸序列或由其组成;和/或(ii)vβ结构域包含与seq id no:75、61、63、65、67、69、71、73、77、79、81、83、501、511、521、531、541、551、561、571、581、591、601或611中任一项所示的氨基酸序列具有至少90%同一性的氨基酸序列或由其组成。在某些实施例中,与本文提供的参考可变域氨基酸序列相比的变异限于一个或多个框架序
列,并且任选地包含一个或多个保守取代或由其组成。在某些实施例中,结合蛋白包含与由本文表1中提供的trbv、trbd、trbj或traj基因区段中的任一个编码的氨基酸序列具有至少90%同一性的氨基酸序列。由这些基因片段编码的氨基酸序列是已知的,可以使用例如imgt数据库(imgt.org)访问。在某些实施方案中,(i)至少三个或四个cdr没有突变;(ii)确实有突变的cdr仅具有最多两个氨基酸取代、最多五个连续的氨基酸缺失或其组合;和(iii)编码的结合蛋白保留其结合肽:hla-复合物的能力,其中肽:hla-复合物包含根据seq id no:2-5中任一项的kras肽。
[0142]
在特定实施例中,vα结构域和vβ结构域包含或由以下氨基酸序列组成:(i)分别为seq id no:76和75;(ii)分别为seq id no:62和61;(iii)分别为seq id no:64和63;(iv)分别为seq id no:66和65;(v)分别为seq id no:68和67;(vi)分别为seq id no:70和69;(vii)分别为seq id no:72和71;(viii)分别为seq id no:74和73;(ix)分别为seq id no:78和77;(x)分别为seq id no:80和79;(xi)分别为seq id no:82和81;(xii)分别为seq id no:84和83;(xiii)分别为seq id no:522和521;(xiv)分别为seq id no:532和531;(xv)分别为seq id no:542和541;(xvi)分别为seq id no:552和551;(xvii)分别为seq id no:562和561;(xviii)分别为seq id no:572和571;(xix)分别为seq id no:582和581;(xx)分别为seq id no:592和591;(xxi)分别为seq id no:602和601;(xxii)分别为seq id no:612和611;(xxiii)分别为seq id no:502和501;或(xix)分别为seq id no:512和511。
[0143]
在任何目前公开的实施例中,结合蛋白还可包含tcrα链恒定域(cα)和/或tcrβ链恒定域(cβ)。在某些实施方案中,cα包含与seq id no.:85或86中列出的氨基酸序列具有至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或100%)同一性的氨基酸序列或由其组成。在某些实施例中,cβ包含与seq id no.87-99中的任一列出的氨基酸序列具有至少90%同一性的氨基酸序列或由其组成。
[0144]
在任何目前公开的实施例中,可以修改tcr恒定域以增强所需tcr链的配对。例如,由于修饰导致异源tcrα-链和异源tcrβ-链之间的宿主t细胞配对增强导致包含两条异源链tcr的优先组装,而不会异源tcr链与内源性tcr链的意外错配。(参见,例如,govers et al.,trends mol.med.16(2):77(2010),tcr修饰在此并入全文)。增强异源tcr链配对的示例性修饰包括在每个异源tcrα链和β链中引入互补的半胱氨酸残基。在一些实施例中,编码异源tcrα链的多核苷酸在氨基酸位置48(对应于全长、成熟的人类tcrα链序列)编码半胱氨酸,编码异源tcrβ链的多核苷酸在氨基酸位置57(对应于全长成熟人tcrβ链序列)编码半胱氨酸。
[0145]
在特定实施例中,结合蛋白包含tcrα链和tcrβ链,其中tcrα链和tcrβ链包含氨基酸序列,所述氨基酸序列是与以下氨基酸序列具有至少90%同一性、包含以下氨基酸序列或由其组成:(i)分别为seq id no:115和114;(ii)分别为seq id no:101和100;(iii)分别为seq id no:103和102;(iv)分别为seq id no:105和104;(v)分别为seq id no:107和106;(vi)分别为seq id no:109和108;(vii)分别为seq id no:111和110;(viii)分别为seq id no:113和112;(ix)分别为seq id no:117和116;(x)分别为seq id no:119和118;(xi)分别为seq id no:121和120;或(xii)分别为seq id no:123和122。
[0146]
在任何目前公开的实施方案中,结合蛋白可包含tcr、单链tcr(sctcr)或嵌合抗原受体(car)。
[0147]
另一方面,提供了包含tcrvα结构域和tcrvβ结构域并且与kras肽:hla复合物特异性结合的结合蛋白,其中kras肽包含seq id no:2-5中任一项所列的氨基酸序列或由其组成,并且其中所述和所述肽:hla复合物包含hla-a*03:01分子。在任何目前公开的实施方案中,结合蛋白可由人免疫系统细胞(例如t细胞)异源表达。在某些实施方案中,vα结构域和/或vβ结构域各自独立地是人的、人源化的或嵌合的,并且优选地各自是人。
[0148]
在某些实施例中,(i)vβ结构域包含来自d_3_4.3、d_3_4.6、d_3_4.9、d_3_1.7、d_3_2.10或d_3_3.6的cdr3氨基酸序列(cdr3β),和vα结构域包含来自d_3_4.3、d_3_4.6、d_3_4.9、d_3_1.7、d_3_2.10或d_3_3.6的cdr3氨基酸序列(cdr3α);和/或(ii)结合域包含vβ域和/或vα域,其中vβ域和/或vα域分别与d_3_4.3、d_3_4.6、d_3_4.9、d_3_1.7、d_3_2.10或d_3_3.6的vβ结构域或vα结构域具有至少90%的同一性,前提是:(a)至少三个或四个cdr没有突变;(b)确实有突变的cdr仅具有最多两个氨基酸取代、最多五个连续的氨基酸缺失或其组合;和(c)结合蛋白保留其结合肽:hla-a*03:01复合物的能力,该复合物包含根据seq id no:2-5中任一项的kras肽。在某些实施例中,结合域包含d_3_4.3、d_3_4.6、d_3_4.9、d_3_1.7、d_3_2.10或d_3_3.6的cdr1β,和cdr2β、cdr1α和/或cdr2α。在进一步的实施例中,结合域包括d_3_4.3、d_3_4.6、d_3_4.9、d_3_1.7、d_3_2.10或d_3_3.6的vβ域和vα域。
[0149]
多核苷酸
[0150]
在另一方面,本公开提供了编码任何一种或多种本公开的结合蛋白的分离的多核苷酸。
[0151]
在某些实施例中,所述多核苷酸包含与如下的中的任一个所列的多核苷酸序列具有至少75%(即,在75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的多核苷酸:seq id no.349、352、355、341、344、347、357、360、363、364、368、371、373、376、379、381、384、387、389、392、396、397、400、403、405、408、411、413、416、419、421、424、427、429、432、435、437、440、443、445、448、451、453、456、459、461、464、467、469、472、475、477、480、483、485、488、491、139、163、138、162、193、125、149、124、148、186、127、151、126、150、187、129、153、128、152、188、131、155、130、154、189、133、157、132、156、190、135、159、134、158、191、137、161、136、160、192、141、162、140、164、194、143、167、142、166、195、145、169、144、168、196、147、171、146、170、197、499、509、519、529、539、549、559、569、579、589、599或609或其任何组合。在某些实施方案中,多核苷酸包含具有seq id no:124-171中任一项中所列多核苷酸序列的至少75%的多核苷酸。在某些实施方案中,编码结合蛋白的多核苷酸包含(i)与seq id no:154中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:155中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(ii)与seq id no:170中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:171中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(iii)与seq id no:148中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:149中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(iv)与seq id no:150中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:151中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(v)与seq id no:152中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:153中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(vi)与seq id no:156
中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:157中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(vii)与seq id no:158中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:159中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(viii)与seq id no:160中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:161中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(ix)与seq id no:162中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:163中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(x)与seq id no:164中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:165中列出的多核苷酸序列具有至少75%同一性的多核苷酸;(xi)与seq id no:166中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:167中列出的多核苷酸序列具有至少75%同一性的多核苷酸;或者(xii)与seq id no:168中列出的多核苷酸序列具有至少75%同一性的多核苷酸,以及与seq id no:169中列出的多核苷酸序列具有至少75%同一性的多核苷酸。在一些实施例中,单个多核苷酸编码如本文所述的结合蛋白,或者,结合蛋白可以由多于一个多核苷酸编码。换言之,结合蛋白的组分或部分可由两个或更多个多核苷酸编码,其可包含在单个核酸分子中或可包含在两个或更多个核酸分子中。
[0152]
还提供了一种分离的多核苷酸,其编码seq id no:356、348、364、372、380、388、396、404、412、420、428、436、444、452、460、468、476、484、492、500、510、520、530、540、550、560、570、580、590、600或610中的任一个氨基酸序列。在某些实施方案中,多核苷酸包含与seq id no.:355、347、363、371、379、387、395、403、411、419、427、435、443、451、459、467、475、483、491、186-197、499、509、519、529、539、549、559、569、579、589、599或609中任一个所示的多核苷酸序列具有至少75%(即,在75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)同一性的多核苷酸。
[0153]
在淋巴细胞发育过程中,vα外显子由不同的可变和连接基因片段(v-j)组装而成,并且vβ外显子由不同的可变、多样性和连接基因片段(v-d-j)组装而成。tcrα染色体基因座有70-80个可变基因片段和61个连接基因片段。tcrβ染色体基因座有52个可变基因片段,每个包含一个多样性基因片段的两个独立簇,以及六个或七个连接基因片段。功能性vα和vβ基因外显子是通过可变基因片段与vα的连接基因片段、可变基因片段与多样性基因片段和vβ的连接基因片段重组而产生的。
[0154]
在某些实施方案中,编码结合蛋白的多核苷酸包含根据表1中所示的示例性结合蛋白中任一项的trbv、trbd、trbj、trav和/或traj基因区段。
[0155]
表1示例性结合蛋白的v-d-j基因使用
[0156]
[0157]
[0158]
[0159][0160]
在某些实施例中,编码vβ结构域的多核苷酸包含(i)trbv25-01基因片段、trbv12-04基因片段、trbv28-01基因片段、trbv09-01基因片段、trbv11-02基因片段、trbv07-09基因片段、trbv10-01基因片段,或trbv30-01基因片段;(ii)trbd01-01基因片段、trbd02-01基因片段或trbd02-02基因片段;和(iii)trbj02-01基因片段、trbj01-06基因片段、trbj02-03基因片段、trbj02-07基因片段、trbj02-03基因片段、trbj02-04基因片段或trbj01-05基因片段。
[0161]
在某些实施方案中,编码vα结构域的多核苷酸包含:
[0162]
(i)trav12-3基因片段、trav17基因片段、trav19基因片段、trav5基因片段、trav29dv05基因片段、trav2基因片段、trav26-1基因片段、trav1-1基因片段、trav27基因片段,或trav12-2基因片段;和(ii)traj17基因片段、traj45基因片段、traj6基因片段、traj13基因片段、traj43基因片段、traj30基因片段、traj39基因片段、traj12基因片段、traj52基因片段。
[0163]
在特定实施例中,(i)编码tcrvβ结构域的多核苷酸包含trbv25-01基因片段、trbd01-01基因片段或trbd-02-01基因片段和trbj02-01基因片段;和(ii)编码tcrvα结构
(pnscp3)-(pntcrβ);(v)(pntcrβ)-(pnscp1)-(pntcrα)-(pnscp2)-(pncd8α)-(pnscp3)-(pncd8β);(vi)(pntcrβ)-(pnscp1)-(pntcrα)-(pnscp2)-(pncd8β)-(pnscp3)-(pncd8α);(vii)(pntcrα)-(pnscp1)-(pntcrβ)-(pnscp2)-(pncd8α)-(pnscp3)-(pncd8β);(viii)(pntcrα)-(pnscp1)-(pntcrβ)-(pnscp2)-(pncd8β)-(pnscp3)-(pncd8α),其中pncd8α是编码包含cd8共受体胞外部分的多肽的多核苷酸α链,
[0169]
其中pncd8β是编码包含cd8共受体α链的胞外部分的多肽的多核苷酸,其中pntcrα是编码tcrα链的多核苷酸,其中pntcrβ是编码tcrβ链的多核苷酸,其中pnscp1、pnscp2和pnscp3各自独立地是编码自切割肽的多核苷酸,其中多核苷酸和/或编码的自切割肽任选地相同或不同。
[0170]
在某些实施方案中,本公开内容的编码多肽包含一个或多个连接氨基酸。“连接氨基酸”或“连接氨基酸残基”是指多肽的两个相邻基序、区域或结构域之间的一个或多个(例如,2至约10个)氨基酸残基,例如在结合域和相邻的恒定域之间或在tcr链和相邻的自切割肽之间。连接氨基酸可源自编码融合蛋白(例如,在构建编码融合蛋白的核酸分子期间使用限制酶位点产生的氨基酸残基)的构建体的设计,或源自例如与本公开内容的编码结合蛋白(例如,位于tcrα链和tcrβ链之间的p2a肽,其自切割可在α链、tcrβ链或两者中留下一个或多个连接氨基酸)的一个或多个结构域相邻的自切割肽的切割。
[0171]
在进一步的实施例中,结合蛋白表达为转基因构建体的一部分,其编码,和/或本公开的宿主细胞可以编码:一种或多种额外的辅助蛋白,例如安全开关蛋白;一个标签,一个选择标记;cd8共受体β链;cd8共受体α链或两者;或其任何组合。pct申请pct/us2017/053112中描述了用于编码和表达结合蛋白和辅助成分的多核苷酸和转基因构建体,多核苷酸、转基因构建体和辅助成分(例如,一种或多种安全开关蛋白、选择标记、cd8共同受体β链或cd8共同受体α链),包括核苷酸和氨基酸序列,其通过引用并入本文。将理解的是,本公开的任何或所有结合蛋白,安全开关蛋白、标签、选择标记、cd8共同受体β链或cd8共同受体α链可由单个核酸分子编码或可由多核苷酸序列编码,其中多核苷酸序列是或存在于单独的核酸分子。
[0172]
示例性安全开关蛋白包括例如截短的egf受体多肽(huegfrt),其中截短的egf受体多肽(huegfrt)没有细胞外n端配体结合域和细胞内受体酪氨酸激酶活性,但保留其天然氨基酸序列,具有i型跨膜细胞表面定位,并具有用于药物级抗egfr单克隆抗体的构象完整的结合表位抗体,西妥昔单抗(erbitux)tegf受体(tegfr;wang etal.,blood 118:1255-1263,2011);半胱天冬酶多肽(例如,icasp9;straathof et al.,blood105:4247-4254,2005;di stasi et al.,n.engl.j.med.365:1673-1683,2011;zhou and brenner,exp.hematol.pii:s0301-472x(16)30513-6.doi:10.1016/j.exphem.2016.07.011),rqr8(philip et al.,blood 124:1277-1287,2014);源自人c-myc蛋白质(myc)的10氨基酸标记(kieback et al.,proc.natl.acad.sci.usa 105:236-628,2008)和标记/安全开关多肽例如rqr(cd20
+
cd34;philip et al.,2014)。
[0173]
可用于本公开的修饰宿主细胞的其他辅助成分包括允许鉴定、分选、分离、富集或追踪细胞的标签或选择标记。例如,可以将具有所需特征(例如,抗原特异性tcr和安全开关蛋白)的标记宿主细胞与样品中的未标记细胞分选出来,并更有效地激活和扩增以包含在所需纯度的产品中。
[0174]
如本文所用,术语“选择标记”包括核酸构建体(和编码的基因产物),其赋予细胞可识别的变化,以对使用包含选择标记的多核苷酸转导的免疫细胞进行允许检测和阳性选择。rqr是一种选择标记,其包含一个主要的cd20细胞外环和两个最小的cd34结合位点。在一些实施方案中,编码rqr的多核苷酸包含编码16-氨基酸的cd34最小表位的多核苷酸。在一些实施方案中,cd34最小表位并入cd8共受体茎结构域(q8)的氨基末端位置。在进一步的实施方案中,cd34最小结合位点序列可以与cd20的靶表位组合以形成t细胞的紧密标记/自杀基因(rqr8)(philip et al.,2014,通过引用并入本文)。该构建体允许选择表达构建体的宿主细胞,例如,cd34特异性抗体与磁珠(miltenyi)结合,并利用临床接受的药物抗体利妥昔单抗,允许选择性删除表达转基因的工程t细胞(philip et al.,2014)。
[0175]
其他示例性选择标记还包括几种通常不在t细胞上表达的截短的i型跨膜蛋白:截短的低亲和力神经生长因子、截短的cd19和截短的cd34(例如,参见,di stasi et al.,n.engl.j.med.365:1673-1683,2011;mavilio et al.,blood 83:1988-1997,1994;fehse et al.,mol.ther.1:448-456,2000;各自在此完整并入本文)。cd19和cd34的有用功能是现成的miltenyi clinimacs
tm
选择系统的可用性,该系统可以针对这些标志物进行临床级分类。然而,cd19和cd34是相对较大的表面蛋白,可能会影响整合载体的载体包装能力和转录效率。也可以使用包含细胞外、非信号结构域或各种蛋白质(例如,cd19、cd34、lngfr)的表面标记。可以使用任何选择标记,并且应该是良好生产规范可接受的。在某些实施方案中,选择标记用编码感兴趣的基因产物(例如,本公开的结合蛋白,例如tcr或car)的多核苷酸表达。选择标记的其他实例包括,例如,报告基因,例如gfp、egfp、β-gal或氯霉素乙酰转移酶(cat)。在某些实施方案中,选择标记例如cd34由细胞表达并且cd34可用于选择富集或分离(例如,通过免疫磁性选择)感兴趣的转导细胞以用于本文所述的方法。如本文所用,cd34标记不同于抗cd34抗体,或例如scfv、tcr或结合cd34的其他抗原识别部分。
[0176]
在某些实施例中,选择标记包括rqr多肽、截短的低亲和力神经生长因子(tngfr)、截短的cd19(tcd19)、截短的cd34(tcd34)或其任何组合。
[0177]
关于rqr多肽,不希望受理论束缚,据信距宿主细胞表面的距离对于rqr多肽作为选择标记/安全开关起作用是重要的(philip et al.,2010(同上))。在一些实施方案中,编码的rqr多肽包含在编码的cd8共受体的β-链、α-链或两者,或任一者或两者的片段或变体中。在具体实施例中,修饰的宿主细胞包含编码icasp9的异源多核苷酸和编码重组cd8共受体蛋白的异源多核苷酸,该蛋白包含含有rqr多肽的β链并进一步包含cd8α-链。
[0178]
在一些实施方案中,编码的cd8共受体包括α-链或其片段或变体。人cd8共受体α链前体的氨基酸序列是已知的,并且提供于例如uniprotkb
–
p30433(另见uniprotkb
–
p31783;-p10732;和-p10731)。在一些实施方案中,编码的cd8共受体包括β-链或其片段或变体。人cd8共受体β链前体的氨基酸序列是已知的,例如在uniprotkb
–
p10966处提供(另见uniprotkb
–
q9uq56;-e9pd41;q8td28;和-p30434;和-p05541)。
[0179]
本公开的分离的多核苷酸可以进一步包含编码如本文公开的安全开关蛋白、选择标记、cd8共同受体β链或cd8共同受体α链的多核苷酸,或可包含编码其任何组合的多核苷酸。
[0180]
在任何目前公开的实施方案中,多核苷酸可以是密码子优化的以在宿主细胞中表达。在一些实施方案中,宿主细胞包括人免疫系统细胞,例如t细胞、nk细胞或nk-t细胞
(scholten et al.,clin.immunol.119:135,2006)。密码子优化可以使用已知的技术和工具进行,例如使用optimumgenetm工具或geneart(life technologies)。密码子优化的序列包括部分密码子优化(即,优化了一个或多个密码子以在宿主细胞中表达)的序列和完全密码子优化的序列。应当理解,在多核苷酸编码多于一种多肽(例如,tcrα链、tcrβ链、cd8共受体α链、cd8共受体β链和一种或多种自切割肽)的实施方案中,每个多肽可以独立地完全密码子优化、部分密码子优化或未密码子优化。
[0181]
载体
[0182]
在另一方面,本公开提供了一种表达载体,其包含与表达控制序列可操作地连接的如本文提供的任何多核苷酸。
[0183]
本文还提供包含本公开内容的多核苷酸或转基因构建体的载体。载体的一些例子包括质粒、病毒载体、粘粒等。一些载体可能能够在它们被引入的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体),而其他载体可以整合到宿主细胞的基因组中,或在引入宿主细胞后促进多核苷酸插入物的整合,从而与宿主基因组一起复制(例如,慢病毒载体、逆转录病毒载体)。此外,一些载体能够指导与它们有效连接的基因的表达(这些载体可以称为“表达载体”)。根据相关实施例,还应理解,如果一种或多种药剂(例如,如本文所述的编码多肽的多核苷酸)被共同施用于受试者,则每种药剂可存在于单独或相同的载体中,以及多个载体(各自含有不同的药剂或相同的药剂)可被引入细胞或细胞群或施用于受试者。
[0184]
在某些实施方案中,本公开的多核苷酸可以与载体的某些元件可操作地连接。例如,影响与其连接的编码序列的表达和加工所需的多核苷酸序列可以可操作地连接。表达控制序列可以包括适当的转录起始、终止、启动子和增强子序列;高效的rna处理信号,如剪接和聚腺苷酸化信号;稳定细胞质mrna的序列;提高翻译效率的序列(即kozak共有序列);增强蛋白质稳定性的序列;以及可能增强蛋白质分泌的序列。如果表达控制序列与感兴趣的基因和在一定距离内进行转运以控制感兴趣的基因的表达控制序列连续,则它们可以可操作地连接。
[0185]
在某些实施方案中,载体包括质粒载体或病毒载体(例如,选自慢病毒载体或γ-逆转录病毒载体的载体)。病毒载体包括逆转录病毒、腺病毒、细小病毒(例如,腺相关病毒)、冠状病毒、负链rna病毒(如正粘病毒(例如流感病毒))、弹状病毒(例如,狂犬病和水泡性口炎病毒)、副粘病毒(例如,麻疹和仙台)、正链rna病毒(如小核糖核酸病毒和甲病毒),以及双链dna病毒(包括腺病毒、疱疹病毒(例如,单纯疱疹病毒1型和2型、爱泼斯坦-巴尔病毒、巨细胞病毒)和痘病毒(例如,牛痘、鸡痘和金丝雀痘))。例如,其他病毒包括诺沃克病毒、披膜病毒、黄病毒、呼肠孤病毒、乳多空病毒、肝炎病毒和肝炎病毒。逆转录病毒的实例包括禽白血病肉瘤、哺乳动物c型、b型病毒、d型病毒、htlv-blv组、慢病毒和泡沫病毒(coffin,j.m.,retroviridae:the viruses and their replication,in fundamental virology,third edition,b.n.fields et al.,eds.,lippincott-raven publishers,philadelphia,1996)。
[0186]“逆转录病毒”是具有rna基因组的病毒,使用逆转录酶将其逆转录成dna,然后将逆转录的dna掺入宿主细胞基因组中。“逆转录病毒”是指逆转录病毒科的一个属。γ逆转录病毒的例子包括小鼠干细胞病毒、鼠白血病病毒、猫白血病病毒、猫肉瘤病毒和禽网状内皮
增生病毒。如本文的“慢病毒载体”,是指用于基因递送的基于hiv的慢病毒载体,其可以是整合的或非整合的,具有较大的包装能力,并且可以转导一系列不同的细胞类型。慢病毒载体通常在三种(包装、包膜和转移)或更多质粒瞬时转染到生产细胞后产生。与hiv一样,慢病毒载体通过病毒表面糖蛋白与细胞表面受体的相互作用进入靶细胞。进入时,病毒rna进行逆转录,这是由病毒逆转录酶复合物介导的。逆转录的产物是双链线性病毒dna,它是病毒整合到受感染细胞dna中的底物。
[0187]
在某些实施方案中,病毒载体可以是γ逆转录病毒,例如莫洛尼鼠白血病病毒(mlv)衍生的载体。在其他实施方案中,病毒载体可以是更复杂的逆转录病毒衍生载体,例如慢病毒衍生载体。hiv-1衍生载体属于这一类。其他例子包括源自hiv-2、fiv、马传染性贫血病毒、siv和maedi-visna病毒(绵羊慢病毒)的慢病毒载体。使用逆转录病毒和慢病毒载体和包装细胞通过含有tcr或car转基因的病毒颗粒来转导哺乳动物宿主细胞的方法是本领域已知的,并且之前已经描述过,例如,在:美国专利号8,119,772;walchli et al.,plos one 6:327930,2011;zhao et al.,j.immunol.174:4415,2005;engels et al.,hum.gene ther.14:1155,2003;frecha et al.,mol.ther.18:1748,2010;和verhoeyen et al.,methods mol.biol.506:97,2009。逆转录病毒和慢病毒载体构建体和表达系统也是可商购的。其他病毒载体也可用于多核苷酸递送,包括dna病毒载体,包括例如基于腺病毒的载体和基于腺相关病毒(aav)的载体;源自单纯疱疹病毒(hsv)的载体,包括扩增子载体、复制缺陷型hsv和减毒hsv((krisky et al.,gene ther.5:1517,1998))。
[0188]
开发用于基因治疗用途的其他载体也可以与本公开的组合物和方法一起使用。此类载体包括源自杆状病毒和α-病毒的载体。(jolly,d j.1999.emerging viral vectors.pp 209-40 in friedmann t.ed.the development of human gene therapy.new york:cold spring harbor lab),或质粒载体(如睡美人或其他转座子载体))。
[0189]
当病毒载体基因组包含要在宿主细胞中作为单独转录本表达的多个多核苷酸时,病毒载体还可以在允许双顺反子或多顺反子表达的两个(或多个)转录物之间包含附加序列。用于病毒载体的此类序列的实例包括内部核糖体进入位点(ires)、弗林蛋白酶切割位点、病毒2a肽或其任何组合。
[0190]
在某些实施方案中,载体能够将多核苷酸或转基因构建体递送至宿主细胞(例如,造血祖细胞或人免疫系统细胞)。在具体实施方案中,载体能够将多核苷酸或转基因构建体递送至人免疫系统细胞,例如cd4
+
t细胞、cd8
+
t细胞、cd4-cd8-双阴性t细胞、干细胞记忆t细胞、γδt细胞、自然杀伤细胞、树突细胞或其任何组合。在进一步的实施方案中,载体能够将转基因构建体递送至幼稚t细胞、中央记忆t细胞、效应记忆t细胞或其任何组合。在一些实施例中,编码本公开的多核苷酸或转基因构建体的载体可以进一步包含编码核酸酶的多核苷酸,核酸酶可用于在宿主细胞中进行染色体敲除或可用于在基因治疗替代或基因修复治疗中将治疗性多核苷酸或转基因或其部分递送至宿主细胞(例如,如本文公开的crispr-cas内切核酸酶或另一种内切核酸酶)。或者,用于染色体敲除或基因置换或基因修复疗法的核酸酶可以独立于编码本公开内容的多核苷酸或转基因构建体的载体递送至宿主细胞。
[0191]
在某些实施方案中,载体能够将多核苷酸递送至宿主细胞。在进一步的实施方案中,宿主细胞是造血祖细胞或人免疫系统细胞。在更进一步的实施例中,人免疫系统细胞是cd4
+
t细胞、cd8
+
t细胞、cd4-cd8-双阴性t细胞、γδt细胞、自然杀伤细胞、自然杀伤t细胞、巨
噬细胞、单核细胞、树突细胞或其任何组合。在更进一步的实施方案中,t细胞是幼稚t细胞、中央记忆t细胞、效应记忆t细胞或其任何组合。
[0192]
在任何目前公开的实施方案中,载体是病毒载体。在某些实施方案中,病毒载体是慢病毒载体或γ-逆转录病毒载体。
[0193]
宿主细胞
[0194]
本文还提供了编码和/或表达结合蛋白(和任选地,一种或多种辅助蛋白,例如,如本文提供的转导标记物、cd8共受体多肽等)的宿主细胞。在某些实施例中,提供了宿主细胞,其被修饰以包含本公开的多核苷酸和/或表达载体,和/或表达本公开的结合蛋白。
[0195]
可以修饰任何合适的宿主细胞以包括编码本公开内容的结合蛋白的异源多核苷酸,包括例如免疫细胞,例如t细胞、nk细胞或nk-t细胞。在一些实施方案中,修饰的免疫细胞包括cd4
+
t细胞、cd8
+
t细胞或两者。用所需核酸转染/转导t细胞的方法已被描述(例如,美国专利申请公布号us 2004/0087025)为具有使用所需靶标特异性t细胞的过继转移程序(例如,schmitt et al.,hum.gen.20:1240,2009;dossett et al.,mol.ther.17:742,2009;till et al.,blood 112:2261,2008;wang et al.,hum.gene ther.18:712,2007;kuball et al.,blood 109:2331,2007;us 2011/0243972;us 2011/0189141;leen et al.,ann.rev.immunol.25:243,2007),使得,基于本文的教导,可以考虑将这些方法适应当前公开的实施例。
[0196]
可以使用任何合适的方法来转染或转导细胞(例如,t细胞),或施用本方法的多核苷酸或组合物。将多核苷酸递送至宿主细胞的已知方法包括例如使用阳离子聚合物、类脂分子和某些商业产品(例如,in-vivo-jet pei)。其他方法包括离体转导、注射、电穿孔、deae-葡聚糖、超声加载、脂质体介导的转染、受体介导的转导、微粒轰击、转座子介导的转移等。转染或转导宿主细胞的更进一步的方法使用载体,本文进一步详细描述。
[0197]
在某些实施方案中,修饰细胞包括造血祖细胞和/或人免疫细胞。在一些实施方案中,免疫细胞包括t细胞、nk细胞、nk-t细胞、树突细胞、巨噬细胞、单核细胞或其任何组合。在进一步的实施方案中,免疫细胞包括cd4
+
t细胞、cd8
+
t细胞、cd4-cd8-双阴性t细胞、γδt细胞或其任何组合。在某些进一步的实施方案中,免疫细胞包括cd4
+
t细胞和cd8
+
t细胞。在某些更进一步的实施方案中,cd4
+
t细胞、cd8
+
t细胞或两者都包含(i)编码多肽的多核苷酸,所述多肽包含cd8共同受体α链的胞外部分,其中,任选地,所编码的多肽是或包含cd8共同受体α链;(ii)编码多肽的多核苷酸,所述多肽包含cd8共同受体β链的胞外部分,其中,任选地,所编码的多肽是或包含cd8共同受体β链;或者(iii)(i)的多核苷酸和(ii)的多核苷酸。
[0198]
在任何前述实施方案中,宿主细胞(例如,免疫细胞)可以被修饰以减少或消除一种或多种编码参与免疫信号传导或其他相关活性的多肽的内源基因的表达。示例性基因敲除包括编码pd-1、lag-3、ctla4、tim3、tigit、fasl、hla分子、tcr分子等的基因敲除。不希望被理论束缚,某些内源性表达的免疫细胞蛋白可能被接受修饰免疫细胞(例如,hla等位基因)的同种异体宿主识别为外来的,这可能导致修饰免疫细胞的消除,或可能下调修饰免疫细胞(例如,pd-1、lag-3、ctla4、fasl、tigit、tim3)的免疫活性,或可能干扰本公开的异源表达的结合蛋白的结合活性(例如,修饰的t细胞的内源性tcr结合非ras抗原,从而干扰修饰的免疫细胞结合表达ras抗原的细胞)。
[0199]
因此,减少或消除此类内源基因或蛋白质的表达或活性可以提高修饰细胞在自体
或同种异体宿主环境中的活性、耐受性或持久性,并且可以允许细胞的普遍施用(例如,对于任何接收者,无论hla类型如何)。在某些实施方案中,修饰的细胞是供体细胞(例如,同种异体的)或自体细胞。在某些实施例中,本公开内容的修饰细胞包含编码pd-1、lag-3、ctla4、tim3、tigit、fasl、hla成分(例如,编码α1巨球蛋白、α2巨球蛋白、α3巨球蛋白、β1微球蛋白或β2微球蛋白的基因)或tcr成分(例如,编码tcr可变区或tcr恒定区的基因)中的一种或多种基因的染色体基因敲除(参见,例如torikai et al.,nature sci.rep.6:21757(2016);torikai et al.,blood119(24):5697(2012);and torikai et al.,blood 122(8):1341(2013),其基因编辑技术、组合物和过继细胞疗法通过引用整体并入本文)。
[0200]
如本文所用,术语“染色体基因敲除”是指宿主细胞中的基因改变或引入抑制剂,其阻止(例如,减少、延迟、抑制或废除)宿主细胞产生功能活性内源多肽产物。导致染色体基因敲除的改变可以包括,例如,引入的无义突变(包括过早终止密码子的形成)、错义突变、基因缺失和链断裂,以及抑制宿主细胞中内源基因表达的抑制性核酸分子的异源表达。
[0201]
在某些实施例中,染色体基因敲除或基因敲入是通过对宿主细胞进行染色体编辑而制成的。可以使用例如核酸内切酶进行染色体编辑。如本文所用,“核酸内切酶”是指能够催化切割多核苷酸链内的磷酸二酯键的酶。在某些实施方案中,核酸内切酶能够切割靶基因,从而灭活或“敲除”靶基因。核酸内切酶可以是天然存在的、重组的、遗传修饰的或融合核酸内切酶。由内切核酸酶引起的核酸链断裂通常通过同源重组或非同源末端连接(nhej)的不同机制进行修复。在同源重组期间,供体核酸分子可用于供体基因“敲入”、用于靶基因“敲除”,并且任选地通过供体基因敲入或靶基因敲除事件使靶基因失活。nhej是一种容易出错的修复过程,通常会导致切割位点的dna序列发生变化,例如替换、删除或添加至少一个核苷酸。nhej可用于“敲除”目标基因。核酸内切酶的实例包括锌指核酸酶、tale-核酸酶、crispr-cas核酸酶、大范围核酸酶和megatal。
[0202]
如本文所用,“锌指核酸酶”(zfn)是指包含与非特异性dna切割结构域融合的锌指dna结合结构域的融合蛋白,例如fokl核酸内切酶。每个约30个氨基酸的锌指基序与约3个dna碱基对结合,并且可以改变某些残基的氨基酸以改变三联体序列的特异性(参见,例如desjarlais et al.,proc.natl.acad.sci.90:2256-2260,1993;wolfe et al.,j.mol.biol.285:1917-1934,1999)。多个锌指基序可串联连接以产生对所需dna序列的结合特异性,例如长度范围为约9至约18个碱基对的区域。作为背景,zfns通过催化基因组中位点特异性dna双链断裂(dsb)的形成来介导基因组编辑,同源定向修复促进了包含与dsb位点基因组同源的侧翼序列的转基因的靶向整合。或者,zfn产生的dsb可以通过非同源末端连接(nhej)修复导致靶基因敲除,这是一种容易出错的细胞修复途径,其导致在切割位点插入或删除核苷酸。在某些实施方案中,基因敲除包括使用zfn分子进行的插入、缺失、突变或其组合。
[0203]
如本文所用,“转录激活因子样效应核酸酶”(talen)是指包含tale dna结合结构域和dna切割结构域的融合蛋白,例如foki核酸内切酶。“tale dna结合域”或“tale”由一个或多个tale重复域/单元组成,每个通常具有高度保守的33-35个氨基酸序列,其中第12个和第13个氨基酸不同。tale重复结构域参与tale与目标dna序列的结合。不同的氨基酸残基,称为重复可变双残基(rvd),与特定的核苷酸识别相关。已经确定了这些tales的dna识别的自然(典型)密码,使得tale位置12和13处的hd(组氨酸-天冬氨酸)序列导致tale与胞
嘧啶(c)结合,ng(天冬酰胺-甘氨酸)与t核苷酸结合,ni(天冬酰胺-异亮氨酸)与a结合,nn(天冬酰胺-天冬酰胺)与g或a核苷酸结合,ng(天冬酰胺-甘氨酸)与t核苷酸结合。非典型(非典型)rvd也是已知的(参见,例如,美国专利公开号us 2011/0301073,该非典型rvd通过引用整体并入本文)。talen可用于指导t细胞基因组中的位点特异性双链断裂(dsb)。非同源末端连接(nhej)连接来自双链断裂两侧的dna,其中几乎没有或没有序列重叠用于退火,从而引入了敲除基因表达的错误。或者,同源定向修复可以在dsb位点引入转基因,前提是转基因中存在同源侧翼序列。在某些实施方案中,基因敲除包括插入、缺失、突变或其组合,并且使用talen分子进行。
[0204]
如本文所用,“成簇的规则间隔的短回文重复序列/cas”(crispr/cas)核酸酶系统是指系统,其采用crispr rna(crrna)引导的cas核酸酶通过碱基配对互补性识别基因组(称为原型间隔器)内的靶位点,然后如果短的、保守的原型间隔区相关基序(pam)紧跟在互补靶序列的3'端,则切割dna。根据cas核酸酶的序列和结构,crispr/cas系统分为三种类型(即i型、ii型和iii型)。i型和iii型中的crrna引导的监视复合物需要多个cas亚基。研究最多的ii型系统至少包含三个组件:rna引导的cas9核酸酶、crrna和反式作用crrna(tracrrna)。tracrrna包含双链体形成区。crrna和tracrrna形成双链体,其能够与cas9核酸酶相互作用,并通过crrna上的间隔区和pam上游的目标dna上的原型间隔区之间的watson-crick碱基配对将cas9/crrna:tracrrna复合物引导到目标dna上的特定位点。cas9核酸酶在由crrna间隔区定义的区域内切割双链断裂。nhej修复会导致插入和/或缺失,从而破坏目标基因座的表达。或者,可以通过同源定向修复在dsb位点引入具有同源侧翼序列的转基因。crrna和tracrrna可以被设计成单个向导rna(sgrna或grna)(参见,例如jinek et al.,science337:816-21,2012)。此外,可以改变或编程与靶位点互补的引导rna区域以靶向所需序列(xie et al.,plos one9:e100448,2014;美国专利申请公开号us 2014/0068797,美国专利申请公开号us 2014/0186843;美国专利号8,697,359,和pct公开号wo 2015/071474;每个都通过引用方式并入)。在某些实施方案中,基因敲除包括插入、缺失、突变或其组合,并且使用crispr/cas核酸酶系统进行。
[0205]
示例性grna序列和使用其敲除编码免疫细胞蛋白的内源基因的方法包括描述在ren et al.,clin.cancer res.23(9):2255-2266(2017)中的这些,grna、cas9dna、载体和基因敲除技术通过引用整体并入本文。
[0206]
如本文所用,“大范围核酸酶”,也称为“归巢核酸内切酶”,是指以大识别位点(约12至约40个碱基对的双链dna序列)为特征的脱氧核糖核酸内切酶。大范围核酸酶可根据序列和结构基序分为五个家族:laglidadg、giy-yig、hnh、his-cys盒和pd-(d/e)xk。示例性大范围核酸酶包括i-scei、i-ceui、pi-pspi、pi-sce、i-sceiv、i-csmi、i-pani、i-sceii、i-ppoi、i-sceiii、i-crei、i-tevi、i-tevii和i-teviii,它们的识别序列是已知的(参见,例如,美国专利申请号5,420,032和6,833,252;belfort et al.,nucleic acids res.25:3379-3388,1997;dujon et al.,gene 82:115-118,1989;perler et al.,nucleic acids res.22:1125-1127,1994;jasin,trends genet.12:224-228,1996;gimble et al.,j.mol.biol.263:163-180,1996;argast et al.,j.mol.biol.280:345-353,1998)。
[0207]
在某些实施例中,天然存在的大范围核酸酶可用于促进选自pd-1、lag3、tim3、ctla4、tigit、fasl、hla编码基因或tcr成分编码基因的靶标的位点特异性基因组修饰。在
其他实施例中,对靶基因具有新结合特异性的工程化大范围核酸酶用于位点特异性基因组修饰(参见,例如porteus et al.,nat.biotechnol.23:967-73,2005;sussman et al.,j.mol.biol.342:31-41,2004;epinat et al.,nucleic acids res.31:2952-62,2003;chevalier et al.,molec.cell 10:895-905,2002;ashworth et al.,nature 441:656-659,2006;paques et al.,curr.gene ther.7:49-66,2007;u.s.patent publication nos.us 2007/0117128;us2006/0206949;us2006/0153826;us2006/0078552;和us 2004/0002092)。在进一步的实施例中,染色体基因敲除是使用归巢核酸内切酶产生的,该核酸内切酶已被talen的模块化dna结合域修饰,以产生称为megatal的融合蛋白。megatals不仅可用于敲除一个或多个靶基因,而且当与编码目标多肽的外源供体模板组合使用时,还可引入(敲入)异源或外源多核苷酸。
[0208]
在某些实施例中,染色体基因敲除包含引入宿主细胞(例如,免疫细胞)的抑制性核酸分子,所述宿主细胞包含编码与肿瘤相关抗原特异性结合的抗原特异性受体的异源多核苷酸,其中抑制性核酸分子编码靶特异性抑制剂并且其中编码的靶特异性抑制剂抑制宿主细胞中的内源基因表达(例如,pd-1、tim3、lag3、ctla4、tigit、fasl、hla成分或tcr成分,或其任何组合)。
[0209]
在使用敲除程序或试剂后,可以通过宿主免疫细胞的dna测序直接确认染色体基因敲除。染色体基因敲除也可以从敲除后基因表达的缺失(例如,不存在基因编码的mrna或多肽产物)来推断。
[0210]
在某些实施方案中,染色体基因敲除包括选自α1巨球蛋白基因、α2巨球蛋白基因、α3巨球蛋白基因、β1微球蛋白基因或β2微球蛋白基因的hla成分基因的基因敲除。
[0211]
在某些实施方案中,染色体基因敲除包括选自tcrα可变区基因、tcrβ可变区基因、tcr恒定区基因或其组合的tcr组分基因的敲除。
[0212]
宿主细胞组合物和单位剂量
[0213]
在另一方面,本文提供了组合物和单位剂量,其包含本公开内容的修饰宿主细胞和药学上可接受的载体、稀释剂或赋形剂。
[0214]
在某些实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约85%、至少约90%,或至少约95%修饰的cd4
+
t细胞的组合物,以约1:1的比例结合(ii)包含至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约85%、至少约90%,或至少约95%修饰的cd8
+
t细胞的组合物,其中单位剂量含有减少量的或基本上不含幼稚t细胞(即,与具有相当数量的pbmc的患者样本相比,具有小于约50%、小于约40%、小于约30%、小于约20%、小于约10%、小于约5%或小于约1%的以单位剂量存在的幼稚t细胞群体)。
[0215]
在一些实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约50%修饰的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约50%的改良cd8
+
t细胞的组合物,其中宿主细胞组合物或单位剂量含有减少量的或基本上不含幼稚t细胞。在进一步的实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约60%修饰的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约60%修饰的cd8
+
t细胞的组合物,其中单位剂量含有减少量的或基本上不含幼稚t细胞。在进一步的实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约70%设计的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约70%设
计的cd8
+
t细胞的组合物,其中单位剂量含有减少量的或基本上不含幼稚t细胞。在一些实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约80%修饰的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约80%的修饰cd8
+
t细胞的组合物,其中宿主细胞组合物或单位剂量含有减少量的或基本上不含幼稚t细胞。在一些实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约85%修饰的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约85%的修饰cd8
+
t细胞的组合物,其中宿主细胞组合物或单位剂量含有减少量的或基本上不含幼稚t细胞。在一些实施例中,宿主细胞组合物或单位剂量包含(i)包含至少约90%修饰的cd4
+
t细胞的组合物,与约为1:1的比例结合(ii)包含至少约90%的修饰cd8
+
t细胞的组合物,其中宿主细胞组合物或单位剂量含有减少量的或基本上不含幼稚t细胞。
[0216]
应理解,本公开的宿主细胞组合物或单位剂量可包含本文所述的任何宿主细胞,或宿主细胞的任何组合。在某些实施例中,例如,宿主细胞组合物或单位剂量包含修饰的cd8
+
t细胞、修饰的cd4
+
t细胞或两者,其中这些t细胞被修饰以编码对ras肽:hla-a*02:01复合物特异的结合蛋白,并且进一步包含修饰的cd8
+
t细胞、修饰的cd4
+
t细胞或两者,其中这些t细胞被修饰以编码对ras肽:hla-a*11:01复合物特异的结合蛋白。此外或可选地,本公开的宿主细胞组合物或单位剂量可包含如本文所述的任何宿主细胞或宿主细胞的组合,并且可进一步包含表达对不同抗原具有特异性的结合蛋白的修饰细胞(例如,免疫细胞,如t细胞)(例如,不同的ras抗原,或来自不同蛋白质或靶标的抗原,例如,bcma、cd3、ceacam6、c-met、egfr、egfrviii、erbb2、erbb3、erbb4、epha2、igf1r、gd2、o-乙酰基gd2、o-乙酰基gd3、ghrhr、ghr、flt1、kdr、flt4、cd44v6、cd151、ca125、cea、ctla-4、gitr、btla、tgfbr2、tgfbr1、il6r、gp130、lewisa、lewisy、tnfr1、tnfr2、pd1、pd-l1、pd-l2、hvem、mage-a(例如,包括mage-a1、mage-a3和mage-a4)、间皮素、ny-eso-1、psma、rank、ror1、tnfrsf4、cd40、cd137、tweak-r、hla、与hla结合的肿瘤或病原体相关肽、与hla结合的htert肽、与hla结合的酪氨酸酶肽,结合hla的wt-1肽、ltβr、lifrβ、lrp5、muc1、osmrβ、tcrα、tcrβ、cd19、cd20、cd22、cd25、cd28、cd30、cd33、cd52、cd56、cd79a、cd79b、cd80、cd81、、cd123、cd171、cd276、b7h4、tlr7、tlr9、ptch1、wt-1、ha1-h、robo1、甲胎蛋白(afp)、frizzled、ox40、prame和ssx-2,或类似)。例如,单位剂量可包含表达特异性结合ras-hla复合物的结合蛋白的修饰cd8
+
t细胞和表达特异性结合psma抗原的结合蛋白(例如car)的修饰cd4
+
t细胞(和/或修饰的cd8
+
t细胞)。还应理解,本文公开的任何宿主细胞都可以在联合疗法中施用。
[0217]
在本文所述的任何实施方案中,宿主细胞组合物或单位剂量包含相等或大致相等数量的工程化cd45ra-cd3
+
cd8
+
和修饰的cd45ra-cd3
+
cd4
+
tm细胞。
[0218]
免疫原性肽
[0219]
在另一方面,本公开提供了一种免疫原性多肽,其包含在seqidno:198-201中的任何一个或多个中列出的氨基酸序列或由其组成。在某些实施方案中,多肽包含两个或更多个seqidno:198-201。在某些实施方案中,免疫原性多肽包含在进一步包含药学上可接受的载体、赋形剂或稀释剂的组合物中。在进一步的实施方案中,组合物包含一种或多种额外的免疫原性多肽和/或佐剂。
[0220]
用途
[0221]
在其他方面,本公开提供了治疗或预防受试者中与kras g12d突变或kras g12v或
nras g12d突变或nras g12v突变或hras g12v突变或hras g12d突变相关的疾病或病症复发的方法。此类疾病或病症包括例如癌症,例如实体癌和血液恶性肿瘤。在某些示例性实施例中,所述疾病或病症包括胰腺癌或癌,任选地胰腺导管腺癌(pdac);结直肠癌或癌;肺癌,任选非小细胞肺癌;胆道癌;子宫内膜癌或癌;宫颈癌;卵巢癌;膀胱癌;肝癌;髓性白血病,可选的髓性白血病,例如急性髓性白血病;骨髓增生异常综合征;淋巴瘤,如非霍奇金淋巴瘤;慢性粒单核细胞白血病;急性淋巴细胞白血病(all);泌尿道癌;小肠癌;乳腺癌或癌;黑色素瘤(可选皮肤黑色素瘤、肛门黑色素瘤或粘膜黑色素瘤);胶质瘤;低分化甲状腺癌;神经母细胞瘤;组织细胞和树突细胞肿瘤;1型神经纤维瘤病;横纹肌肉瘤;软组织肉瘤;膀胱癌;肉瘤;胶质母细胞瘤;鳞状细胞肺癌;间变性星形细胞瘤;慢性粒细胞白血病;弥漫性大b细胞淋巴瘤;双重打击淋巴瘤;头颈癌;头颈部鳞状细胞癌;肝细胞癌;恶性周围神经鞘瘤;套细胞淋巴瘤;骨髓增生异常/骨髓增生性肿瘤,无法分类;外周t细胞淋巴瘤;前列腺癌;伴原始细胞过多的难治性贫血-2;肾细胞癌;横纹肌瘤;神经鞘瘤;继发性aml;小细胞肺癌;治疗相关的aml;胸腺癌;甲状腺滤泡癌;恶性甲状腺肿瘤;甲状腺癌;甲状腺腺癌;尿路上皮癌;或甲状腺乳头状癌。
[0222]“治疗”或“治疗”或“改善”是指对象(例如,人类或非人类哺乳动物,例如灵长类动物、马、猫、狗、山羊、小鼠或大鼠)的疾病、病症或病况的医学管理。一般而言,以足以引起治疗或预防益处的量施用包含本公开内容的组合物(例如,包含结合蛋白、多核苷酸、载体、宿主细胞、宿主细胞组合物、单位剂量和/或免疫原性多肽)的适当剂量或治疗方案。治疗性或预防性/预防性益处包括改善临床结果;减轻或减轻与疾病相关的症状;减少症状的发生;提高生活质量;更长的无病状态;疾病程度的减轻,疾病状态的稳定;延缓疾病进展;缓解;生存;延长生存期;或其任何组合。
[0223]
如本文所用,“治疗有效量”或“有效量”,指足以产生包括改善的临床结果在内的治疗效果的组合物的量;减轻或减轻与疾病相关的症状;减少症状的发生;提高生活质量;更长的无病状态;疾病程度的减轻,疾病状态的稳定;延缓疾病进展;缓解;生存;或以统计学显着的方式延长生存期。当提及单独施用的单个活性成分或表达单一活性成分的细胞时,治疗有效量是指该成分或单独表达该成分的细胞的效果。当提及组合时,治疗有效量是指活性成分或组合的辅助活性成分与表达导致治疗效果的活性成分的细胞的组合量,无论是连续给药还是同时给药。组合也可以是表达多于一种活性成分的细胞。
[0224]
术语“药学上可接受的赋形剂或载体”或“生理学上可接受的赋形剂或载体”是指生物相容的载体,例如生理盐水,其在本文中有更详细的描述,适合施用于人或其他非人哺乳动物受试者并且通常被认为是安全的或不会引起严重的不良事件。
[0225]
如本文所用,“统计显着”是指使用学生t-test计算时的p值为0.050或更小,并表明所测量的特定事件或结果不太可能是偶然出现的。
[0226]
本发明可以治疗的对象通常是人和其他灵长类对象,例如用于兽医目的的猴子和猿。在任何前述实施例中,受试者可以是人类受试者。受试者可以是男性或女性并且可以是任何合适的年龄,包括婴儿、少年、青少年、成人和老年受试者。根据本公开的组合物可以以适合于由医学领域技术人员确定的待治疗的疾病、病症或病症的方式施用。在上述任一实施例中,如本文所述的修饰的宿主细胞、宿主细胞组合物或单位剂量经静脉内、腹膜内、瘤内、骨髓、淋巴结或脑脊液施用,以便遇到靶细胞(例如,白血病细胞)。组合物的合适剂量、
合适的持续时间和给药频率将取决于诸如患者状况等因素;疾病、病症或障碍的大小、类型和严重程度;活性成分的特定形式;和给药方法。
[0227]
如本文所用,术语“过继免疫疗法”或“过继免疫疗法”是指施用天然存在的或基因工程的、疾病或抗原特异性免疫细胞(例如,t细胞)。过继细胞免疫疗法可以是自体的(免疫细胞来自受体)、同种异体的(免疫细胞来自同一物种的供体)或同基因的(免疫细胞来自与受体基因相同的供体)。
[0228]
在一些实施例中,受试者表达包含或由seq id no:2-5和198-101中任一项所列的氨基酸序列组成的rasantigen。
[0229]
在一些实施方案中,受试者是hla-a*11:01
+
;hla-a*03:01
+
;或hla-a*02:01
+
。
[0230]
在某些实施方案中,方法包括在施用根据本公开的治疗之前确定受试者的一个或多个hla类型和/或鉴定ras抗原的存在。
[0231]
在特定实施例中,一种方法包括给予(i)当受试者表达hla-a*02:01时,包含修饰的cd8
+
和/或修饰的cd4
+
t细胞的组合物,所述修饰的cd8
+
和/或修饰的cd4
+
t细胞包含编码如本文提供的第一结合蛋白的异源多核苷酸;和/或(ii)当受试者表达hla-a*11:01时,包含修饰的cd8
+
和/或修饰的cd4
+
t细胞的组合物,所述修饰的cd8
+
和/或修饰的cd4
+
t细胞包含编码如本文提供的第二结合蛋白的异源多核苷酸。在进一步的实施方案中,如果同时施用(i)的组合物和(ii)的组合物,则(i)的组合物和(ii)的组合物包含在相同的组合物中或作为单独的组合物施用。
[0232]
在宿主细胞组合物或单位剂量的情况下,其中的细胞数量为至少一个细胞(例如,一种修饰的cd8
+
t细胞亚群(例如,可选地包含记忆和/或初始cd8
+
t细胞);一种修饰的cd4
+
t细胞亚群(例如,可选地包含记忆和/或初始cd4
+
t细胞))或更典型地大于102个细胞,例如最多104个、最多105个、最多106个、最多107个、最多108个、最多109个或超过10
10
个细胞。在某些实施例中,细胞以约104至约10
10
个细胞/m2的范围施用,优选在约105至约109个细胞/m2的范围内。在一些实施方案中,施用剂量包含高达约3.3x105个细胞/kg。在一些实施方案中,施用剂量包括高达约1
×
106个细胞/kg。在一些实施方案中,施用剂量包含高达约3.3x106个细胞/kg。在一些实施方案中,施用剂量包括高达约1
×
107个细胞/kg。在某些实施方案中,将修饰的免疫细胞以包含高达约5
×
104个细胞/kg、5
×
105个细胞/kg、5x106个细胞/kg或高达约5
×
107个细胞/kg。在某些实施例中,将修饰的免疫细胞以包含至少约5
×
104个细胞/kg、5
×
105个细胞/kg、5
×
106个细胞/kg或高达约5
×
107个细胞/kg的剂量施用于受试者。细胞的数量将取决于组合物的最终用途以及其中包含的细胞类型。例如,经修饰以含有结合蛋白的细胞将包含含有至少30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多这样的细胞的细胞群。对于本文提供的用途,细胞的体积通常为一升或更少、500毫升或更少、250毫升或更少、或100毫升或更少。在实施例中,所需细胞的密度通常大于104个细胞/ml并且通常大于107个细胞/ml,通常为108个细胞/ml或更大。细胞可以作为单次输注或在一定时间范围内多次输注施用。临床相关数量的免疫细胞可以分配到累积等于或超过106、107、108、109、10
10
或10
11
个细胞的多次输注中。在某些实施例中,单位剂量的修饰免疫细胞可以与来自同种异体供体的造血干细胞共同给药(例如,同时或同时)。在一些实施方案中,单位剂量中包含的一种或多种修饰的免疫细胞对于受试者是自体的。
[0233]
在一些实施方案中,接受修饰的免疫细胞的受试者之前已经接受过淋巴细胞清除
化疗。在进一步的实施方案中,淋巴细胞清除化疗包括环磷酰胺、氟达拉滨、抗胸腺细胞球蛋白或其组合。
[0234]
在一些实施方案中,该方法进一步包括向受试者施用如本文公开的免疫检查点分子的抑制剂。
[0235]
还考虑了药物组合物(即,组合物),其包含如本文公开的组合物(结合蛋白、多核苷酸、载体、宿主细胞、宿主细胞组合物、单位剂量和/或免疫原性多肽)和药学上可接受的载体、稀释剂或赋形剂。合适的赋形剂包括水、盐水、葡萄糖、甘油等及其组合。在实施方案中,包含本文公开的融合蛋白或宿主细胞的组合物进一步包含合适的输注介质。合适的输注介质可以是任何等渗介质制剂,通常是生理盐水、normosol r(abbott)或plasma-lyte a(baxter)、5%葡萄糖水溶液,可以使用林格乳酸盐。输注介质可以补充有人血清白蛋白或其他人血清成分。
[0236]
如医学领域的技术人员所确定的,药物组合物可以以适合于待治疗(或预防)的疾病或病症的方式施用。组合物的合适剂量和合适的给药持续时间和频率将取决于以下因素:患者的健康状况、患者的体型(即重量、质量或身体面积)、患者状况的类型和严重程度、活性成分的特定形式、和给药方法。通常,合适的剂量和治疗方案以足以提供治疗和/或预防益处的量提供组合物(如本文所述,包括改善的临床结果,例如更频繁的完全或部分缓解,或更长的无病和/或总生存期,或症状严重程度的减轻)。
[0237]
如本文所述,药物组合物的有效量是指在所需的剂量和时间段内足以实现期望的临床结果或有益治疗的量。可以在一次或多次给药中递送有效量。如果对已知或确认患有疾病或疾病状态的受试者给药,则术语“治疗量”可用于指代治疗,而“预防有效量”可用于描述将有效量施用于易感或有发展疾病或疾病状态(例如,复发)风险的受试者作为预防过程。
[0238]
本文所述的药物组合物可以存在于单位剂量或多剂量容器中,例如密封的安瓿或小瓶。这种容器可以冷冻以保持制剂的稳定性直到输注到患者体内。剂量会有所不同,但用于施用如本文所述的经修饰的免疫细胞的优选剂量为约104个细胞/平方米、约5
×
104个细胞/平方米、约105个细胞/平方米、约5
×
105个细胞/平方米、约106个细胞/平方米、约5
×
10
6个
细胞/平方米,约107细胞/平方米,约5
×
107细胞/平方米,约108细胞/平方米,约5
×
108细胞/平方米,约109细胞/平方米,约5
×
109细胞/平方米,约10
10
细胞/平方米,约5
×
10
10
个细胞/平方米,或约10
11
个细胞/平方米。在某些实施方案中,单位剂量包含约104个细胞/平方米至约10
11
个细胞/平方米的剂量的如本文所述的修饰的免疫细胞。开发用于在各种治疗方案中使用本文所述的特定组合物的合适的给药和治疗方案,包括例如肠胃外或静脉内给药或制剂。
[0239]
如果主题组合物肠胃外给药,则该组合物还可包括无菌水性或油性溶液或悬浮液。合适的无毒肠胃外可接受的稀释剂或溶剂包括水、林格氏溶液、等渗盐溶液、1,3-丁二醇、乙醇、丙二醇或与水混合的聚乙二醇。水溶液或悬浮液还可包含一种或多种缓冲剂,例如乙酸钠、柠檬酸钠、硼酸钠或酒石酸钠。当然,用于制备任何剂量单位制剂的任何材料应该是药学纯的并且在所使用的量中基本上是无毒的。此外,活性化合物可以加入缓释制剂和制剂中。如本文所用,剂量单位形式是指适合作为待治疗受试者的单位剂量的物理离散单位;每个单元可包含预定量的工程化免疫细胞或活性化合物,经计算可与适当的药物载
体结合产生所需的效果。
[0240]
通常,合适的剂量和治疗方案以足以提供益处的量提供活性分子或细胞。与未治疗的受试者相比,可以通过在治疗的受试者中建立改善的临床结果(例如,更频繁的缓解、完全或部分或更长的无病存活)来监测这种反应。对肿瘤蛋白的预先存在的免疫反应的增加通常与临床结果的改善相关。这种免疫反应通常可以使用标准的增殖、细胞毒性或细胞因子分析来评估,这些都是常规的。
[0241]
预防性使用,剂量应足以预防、延迟与疾病或病症相关的疾病的发作或减轻其严重性。根据本文所述方法施用的免疫原性组合物的预防益处可以通过进行临床前(包括体外和体内动物研究)和临床研究并通过适当的统计、生物学和临床方法和技术分析从中获得的数据来确定,所有这些都可以由本领域技术人员容易地实践。
[0242]
如本文所用,组合物的施用是指将其递送至受试者,而不管递送途径或方式。给药可以连续或间歇地进行,也可以胃肠外给药。给药可以用于治疗已经确认为具有公认病症、疾病或疾病状态的受试者,或用于治疗易患或有风险发展此类病症、疾病或疾病状态的受试者。与辅助疗法的共同给药可包括以任何顺序和以任何给药方案同时和/或顺序递送多种药剂(例如,具有一种或多种细胞因子的修饰免疫细胞;免疫抑制疗法,例如钙调神经磷酸酶抑制剂、皮质类固醇、微管抑制剂、低剂量的霉酚酸前药或其任何组合)。
[0243]
在某些实施方案中,向受试者施用多剂量的本文所述组合物,其可以以约两周至约四周的施用间隔施用。
[0244]
本公开的治疗或预防方法可以作为治疗过程或方案的一部分施用于受试者,其可包括在施用即刻公开的单位剂量、细胞或组合物之前或之后的额外治疗。例如,在某些实施方案中,接受单位剂量的修饰免疫细胞的受试者正在接受或之前接受过造血细胞移植(hct;包括清髓性和非清髓性hct)。进行hct的技术和方案是本领域已知的并且可以包括移植任何合适的供体细胞,例如源自脐带血、骨髓或外周血的细胞、造血干细胞、动员的干细胞或来自羊水的细胞。因此,在某些实施方案中,本公开的修饰的免疫细胞可以在修饰的hct疗法中与造血干细胞一起或在其之后不久施用。在一些实施方案中,hct包含供体造血细胞,其包含编码hla组分的基因的染色体敲除、编码tcr组分的基因的染色体敲除或两者。
[0245]
在进一步的实施方案中,受试者在接受组合物或hct之前先前已经接受了淋巴细胞清除化疗。在某些实施方案中,淋巴耗竭化疗包括包含环磷酰胺、氟达拉滨、抗胸腺细胞球蛋白或其组合的调理方案。
[0246]
根据本公开的方法可以进一步包括施用一种或多种另外的药剂以在联合疗法中治疗疾病或病症。例如,在某些实施方案中,联合疗法包括将本公开的组合物与(同时、同时或依次)免疫检查点抑制剂一起施用。在一些实施方案中,联合疗法包括将本公开内容的组合物与刺激性免疫检查点试剂的激动剂一起施用。在进一步的实施方案中,联合疗法包括将本公开的组合物与二级疗法一起施用,例如化学治疗剂、放射疗法、手术、抗体或其任何组合。
[0247]
如本文所用,术语“免疫抑制剂”或“免疫抑制剂”是指提供抑制信号以帮助控制或抑制免疫反应的一种或多种细胞、蛋白质、分子、化合物或复合物。例如,免疫抑制剂包括部分或完全阻断免疫刺激的那些分子;减少、阻止或延迟免疫激活;或增加、激活或上调免疫抑制。靶向(例如,使用免疫检查点抑制剂)的示例性免疫抑制剂包括pd-1、pd-l1、pd-l2、
lag3、ctla4、b7-h3、b7-h4、cd244/2b4、hvem、btla、cd160、tim3、gal9、kir、pvr1g(cd112r)、pvrl2、腺苷、a2ar、免疫抑制性细胞因子(例如,il-10、il-4、il-1ra、il-35)、ido、精氨酸酶、vista、tigit、lair1、ceacam-1、ceacam-3、ceacam-5、treg细胞或其任何组合。
[0248]
免疫抑制剂抑制剂(也称为免疫检查点抑制剂)可以是化合物、抗体、抗体片段或融合多肽(例如fc融合,如ctla4-fc或lag3-fc)、反义分子、核酶或rnai分子,或低分子量有机分子。在本文公开的任何实施例中,一种方法可以包括本公开的组合物与一种或多种以下免疫抑制组分中的任何一种的抑制剂,单独或以任何组合。
[0249]
在某些实施例中,本公开的组合物与pd-1抑制剂组合使用,例如pd-1特异性抗体或其结合片段,例如匹地珠单抗、纳武单抗、派姆单抗、medi0680(原amp-514)、amp-224、bms-936558或其任意组合。在进一步的实施例中,本公开的组合物与pd-l1特异性抗体或其结合片段组合使用,例如bms-936559、durvalumab(medi4736)、atezolizumab(rg7446)、avelumab(msb0010718c)、mpdl3280a或其任何组合。还考虑的是cemiplimab;ibi-308;nivolumab+relatlimab;bcd-100;卡瑞珠单抗;js-001;斯帕利珠单抗;替雷利珠单抗;agen-2034;bgba-333+替雷利珠单抗;cbt-501;dostarlimab;durvalumab+medi-0680;jnj-3283;盐酸帕唑帕尼+派姆单抗;匹地珠单抗;regn-1979+cemiplimab;abbv-181;adus-100+spartalizumab;ak-104;ak-105;amp-224;bat-1306;bi-754091;cc-90006;cemiplimab+regn-3767;cs-1003;gls-010;lzm-009;medi-5752;mgd-013;pf-06801591;sym-021;替雷利珠单抗+帕米帕利;xmab-20717;ak-112;alpn-202;am-0001;一种拮抗pd-1治疗阿尔茨海默病的抗体;bh-2922;bh-2941;bh-2950;bh-2954;拮抗ctla-4和pd-1治疗实体瘤的生物制剂;靶向pd-1和lag-3用于肿瘤学的双特异性单克隆抗体;blsm-101;cb-201;cb-213;cbt-103;cbt-107;细胞免疫疗法+pd-1抑制剂;cx-188;hab-21;heiscoiii-003;ikt-202;jtx-4014;mcla-134;md-402;mdx-400;mgd-019;用于肿瘤学拮抗pdcd1的单克隆抗体;一种用于肿瘤学拮抗pd-1的单克隆抗体;一种抑制pd-1用于肿瘤学的溶瘤病毒;ot-2;pd-1拮抗剂+ropeginterferon alfa-2b;pegmp-7;prs-332;rxi-762;stia-1110;tsr-075;一种针对her2和pd-1用于肿瘤学的疫苗;一种针对pd-1治疗肿瘤和自身免疫性疾病的疫苗;xmab-23104;一种用于肿瘤学抑制pd-1的反义寡核苷酸;at-16201;一种用于肿瘤学抑制pd-1的双特异性单克隆抗体;imm-1802;用于对抗实体瘤和血液肿瘤的pd-1和ctla-4的单克隆抗体;纳武单抗生物仿制药;一种重组蛋白,用于激动cd278和cd28并拮抗pd-1,用于肿瘤学;一种在自身免疫性疾病和炎症性疾病中激动pd-1的重组蛋白;sna-01;ssi-361;ybl-006;ak-103;jy-034;aur-012;bgb-108;抑制实体瘤的pd-1、gal-9和tim-3的药物;enum-244c8;enum-388d4;medi-0680;用于对抗转移性黑色素瘤和转移性肺癌的pd-1的单克隆抗体;抑制肿瘤学pd-1的单克隆抗体;靶向ctla-4和pd-1用于肿瘤学的单克隆抗体;一种用于拮抗nsclc pd-1的单克隆抗体;用于肿瘤学抑制pd-1和tim-3的单克隆抗体;抑制肿瘤学pd-1的单克隆抗体;一种抑制pd-1和vegf-a的重组蛋白,用于治疗血液系统恶性肿瘤和实体瘤;一种对抗pd-1用于肿瘤学的小分子;sym-016;inebilizumab+medi-0680;针对转移性黑色素瘤的pdl-1和ido的疫苗;抗pd-1单克隆抗体加上胶质母细胞瘤的细胞免疫疗法;一种拮抗pd-1用于肿瘤学的抗体;抑制pd-1/pd-l1治疗血液系统恶性肿瘤和细菌感染的单克隆抗体;一种用于抑制hiv pd-1的单克隆抗体;或抑制实体瘤pd-1的小分子。
[0250]
在某些实施例中,本公开的本公开的组合物与lag3抑制剂例如lag525、imp321、
imp701、9h12、bms-986016或其任意组合组合使用。
[0251]
在某些实施方案中,本公开的组合物与ctla4抑制剂组合使用。在特定实施例中,本公开的组合物与ctla4特异性抗体或其结合片段组合使用,例如ipilimumab、tremelimumab、ctla4-ig融合蛋白(例如,abatacept、belatacept)或其任何组合。
[0252]
在特定实施例中,在某些实施方案中,本公开的组合物与b7-h3特异性抗体或其结合片段组合使用,例如enoblituzumab(mga271)、376.96或两者。b7-h4抗体结合片段可以是scfv或其融合蛋白,如dangaj et al.,cancer res.73:4820,2013,还有在美国专利号9,574,000和pct专利公开号wo/201640724a1和wo 2013/025779a1中描述的那些。
[0253]
在某些实施方案中,本公开的组合物与cd244抑制剂组合使用。
[0254]
在某些实施方案中,本公开的组合物与blta、hvem、cd160或其任何组合的抑制剂组合使用。抗cd-160抗体描述于例如pct公开号wo 2010/084158中。
[0255]
在某些实施方案中,本公开细胞的组合物与tim3抑制剂组合使用。
[0256]
在某些实施方案中,本公开的组合物与gal9抑制剂组合使用。
[0257]
在某些实施方案中,本公开的组合物与腺苷信号传导抑制剂例如诱饵腺苷受体组合使用。
[0258]
在某些实施方案中,本公开的组合物与a2ar抑制剂组合使用。
[0259]
在某些实施方案中,本公开的组合物与kir抑制剂例如lirilumab(bms-986015)组合使用。
[0260]
在某些实施例中,本公开内容的组合物与抑制性细胞因子(通常为除tgfβ之外的细胞因子)或treg发育或活性的抑制剂组合使用。
[0261]
在某些实施例中,本公开的组合物与ido抑制剂组合使用,例如左旋-1-甲基色氨酸、依帕司他(incb024360;liu et al.,blood 115:3520-30,2010)、依布硒啉(terentis et al.,biochem.49:591-600,2010)、吲哚昔莫德、nlg919(mautino et al.,american association for cancer research 104th annual meeting 2013;apr 6-10,2013)、1-甲基-色氨酸(1-mt)-tira-pazamine,或其任何组合。
[0262]
在某些实施例中,本公开的组合物与精氨酸酶抑制剂组合使用,如n(omega)-硝基-l-精氨酸甲酯(l-name)、n-omega-羟基-nor-l-精氨酸(nor-noha)、l-noha、2(s)-amino-6-硼己酸(abh)、s-(2-硼乙基)-l-半胱氨酸(bec)或其任意组合。
[0263]
在某些实施例中,本公开的组合物与vista抑制剂,例如ca-170(curis,lexington,mass.)组合使用。
[0264]
在某些实施例中,本公开的组合物与tigit抑制剂例如com902(compugen,toronto,ontario canada)、cd155抑制剂例如com701(compugen)或两者组合使用。
[0265]
在某些实施例中,本公开的组合物与pvrig、pvrl2或两者的抑制剂组合使用。抗pvrig抗体描述于例如pct公开号wo 2016/134333中。抗-pvrl2抗体描述于例如pct公开号wo 2017/021526中。
[0266]
在某些实施方案中,本公开的组合物与lair1抑制剂组合使用。
[0267]
在某些实施方案中,本公开的组合物与ceacam-1、ceacam-3、ceacam-5或其任何组合的抑制剂组合使用。
[0268]
在某些实施方案中,本公开的组合物与增加刺激性免疫检查点分子的活性(即,激
动剂)的药剂组合使用。例如,本公开的组合物可以与cd137(4-1bb)激动剂(例如,urelumab)、cd134(ox-40)激动剂(例如,medi6469、medi6383或medi0562)、来那度胺、泊马度胺、cd27激动剂(例如,cdx-1127)、cd28激动剂(例如,tgn1412、cd80或cd86)、cd40激动剂(例如,cp-870,893、rhucd40l或sgn-40)、cd122激动剂(例如,il-2)、gitr激动剂(例如,pct专利公开号wo 2016/054638中描述的人源化单克隆抗体)、icos(cd278)激动剂(例如,gsk3359609、mab 88.2、jtx-2011、icos 145-1、icos 314-8或其任意组合)。在本文公开的任何实施例中,一种方法可以包括将本公开的组合物与一种或多种刺激性免疫检查点分子的激动剂一起给药,包括上述任何一种,单独或以任何组合。
[0269]
在某些实施例中,组合疗法包含本公开的组合物和包含以下一种或多种的二级疗法:对由非炎症实体瘤、放射治疗、手术、化学治疗剂、细胞因子、rnai或其任何组合表达的癌抗原具有特异性的抗体或其抗原结合片段。
[0270]
在某些实施例中,联合治疗方法包括给予本公开的组合物并进一步给予放射治疗或手术。放射疗法在本领域中是众所周知的并且包括x射线疗法,例如γ-辐射和放射性药物疗法。适合治疗受试者的特定癌症的手术和手术技术是本领域普通技术人员众所周知的。
[0271]
在某些实施方案中,联合治疗方法包括施用本公开的组合物并进一步施用化疗剂。化疗剂包括但不限于染色质功能抑制剂、拓扑异构酶抑制剂、微管抑制药、dna损伤剂、抗代谢剂(如叶酸拮抗剂、嘧啶类似物、嘌呤类似物和糖修饰类似物)、dna合成抑制剂、dna相互作用剂(如嵌入剂)和dna修复抑制剂。示例性化疗剂包括但不限于以下组:抗代谢物/抗癌剂,例如嘧啶类似物(5-氟尿嘧啶、氟尿苷、卡培他滨、吉西他滨和阿糖胞苷)和嘌呤类似物、叶酸拮抗剂和相关抑制剂(巯嘌呤、硫鸟嘌呤、喷司他丁和2-氯脱氧腺苷(克拉屈滨));抗增殖/抗有丝分裂剂,包括天然产物,如长春花生物碱(长春碱、长春新碱和长春瑞滨)、微管破坏剂如紫杉烷(紫杉醇、多西他赛)、长春新碱、长春花素、诺考达唑、埃坡霉素和navelbine、表鬼臼毒素(依托泊苷、替尼泊苷)、dna损伤剂(放线菌素、安吖啶、蒽环类药物、博来霉素、白消安、喜树碱、卡铂、苯丁酸氮芥、顺铂、环磷酰胺、胞嘧啶、更生霉素、柔红霉素、多柔比星、表柔比星、六甲基三聚氰胺奥沙利铂、异磷酰胺原、三甲氨基甲酰胺脲、紫杉醇、泰索帝、替莫唑胺、替尼泊苷、三亚乙基硫代磷酰胺和依托泊苷(vp 16));抗生素如更生霉素(放线菌素d)、柔红霉素、多柔比星(阿霉素)、伊达比星、蒽环类、米托蒽醌、博来霉素、普卡霉素(光神霉素)和丝裂霉素;酶(l-天冬酰胺酶全身代谢l-天冬酰胺并剥夺没有能力合成自己天冬酰胺的细胞);抗血小板剂;抗增殖/抗有丝分裂烷化剂,例如氮芥(氯胺酮、环磷酰胺和类似物、美法仑、苯丁酸氮芥)、乙烯亚胺和甲基三聚氰胺(六甲基三聚氰胺和噻替哌)、烷基磺酸盐-白消安、亚硝基脲(卡莫司汀(bcnu)和类似物,链脲佐菌素)、茚-达卡巴嗪(dtic);抗增殖/抗有丝分裂抗代谢物,如叶酸类似物(甲氨蝶呤);铂配位配合物(顺铂、卡铂)、丙卡巴肼、羟基脲、米托坦、氨基鲁米特;激素、激素类似物(雌激素、他莫昔芬、戈舍瑞林、比卡鲁胺、尼鲁米特)和芳香酶抑制剂(来曲唑、阿那曲唑);抗凝剂(肝素、合成肝素盐和其他凝血酶抑制剂);纤溶剂(如组织纤溶酶原激活剂、链激酶和尿激酶)、阿司匹林、双嘧达莫、噻氯匹定、氯吡格雷、阿昔单抗;抗迁移剂;抗分泌剂(breveldin);免疫抑制剂(环孢素、他克莫司(fk-506)、西罗莫司(雷帕霉素)、硫唑嘌呤、霉酚酸酯);抗血管生成化合物(tnp470、染料木黄酮)和生长因子抑制剂(血管内皮生长因子(vegf)抑制剂、成纤维细胞生
g12v或nras g12d突变或nras g12v突变或hras g12v突变或hras g12d突变相关的疾病或病症。
[0280]
还提供了任何结合蛋白、多核苷酸、表达载体、宿主细胞、宿主细胞组合物、单位剂量和免疫原性多肽,单独或以任何组合使用,用于制造用于治疗与受试者的kras g12d突变或kras g12v或nras g12d突变或nras g12v突变或hras g12v突变或hras g12d突变相关的疾病或障碍的药物。
[0281]
在某些实施方案中,疾病或病症包括癌症。在一些实施方案中,癌症是实体癌或血液恶性肿瘤。在某些示例性实施例中,所述疾病或病症选自胰腺癌或癌,任选地胰腺导管腺癌(pdac);结直肠癌或癌;肺癌,任选非小细胞肺癌;胆道癌;子宫内膜癌或癌;宫颈癌;卵巢癌;膀胱癌;肝癌;髓性白血病,可选的髓性白血病,例如急性髓性白血病;骨髓增生异常综合征;淋巴瘤,如非霍奇金淋巴瘤;慢性粒单核细胞白血病;急性淋巴细胞白血病(all);泌尿道癌;小肠癌;乳腺癌或癌;黑色素瘤(可选皮肤黑色素瘤、肛门黑色素瘤或粘膜黑色素瘤);胶质瘤;低分化甲状腺癌;神经母细胞瘤;组织细胞和树突细胞肿瘤;1型神经纤维瘤病;横纹肌肉瘤;软组织肉瘤;膀胱癌;肉瘤;胶质母细胞瘤;鳞状细胞肺癌;间变性星形细胞瘤;慢性粒细胞白血病;弥漫性大b细胞淋巴瘤;双重打击淋巴瘤;头颈癌;头颈部鳞状细胞癌;肝细胞癌;恶性周围神经鞘瘤;套细胞淋巴瘤;骨髓增生异常/骨髓增生性肿瘤,无法分类;外周t细胞淋巴瘤;前列腺癌;伴原始细胞过多的难治性贫血-2;肾细胞癌;横纹肌瘤;神经鞘瘤;继发性aml;小细胞肺癌;治疗相关的aml;胸腺癌;甲状腺滤泡癌;恶性甲状腺肿瘤;甲状腺癌;甲状腺腺癌;尿路上皮癌;或甲状腺乳头状癌。在一些实施例中,该方法包括受试者组合物的肠胃外或静脉内给药。在一些实施方案中,该方法包括向受试者施用多剂量的结合蛋白、多核苷酸、表达载体、宿主细胞、宿主细胞组合物、单位剂量和/或免疫原性多肽。
[0282]
在某些实施方案中,以约两周至约四周的施用间隔施用多个剂量。
[0283]
在某些实施方案中,组合物包含修饰的宿主细胞。在一些实施方案中,该方法包括以约104个细胞/kg至约10
11
个细胞/kg的剂量向受试者施用修饰的宿主细胞。
[0284]
在特定实施例中,一种方法包括施用:(i)一组合物,其包含修饰的cd8
+
和/或修饰的cd4
+
t细胞,其包含编码根据权利要求1-26中任一项的结合蛋白的异源多核苷酸,当受试者表达hla-a*02:01时;和/或(ii)一组合物,其包含修饰的cd8
+
和/或修饰的cd4
+
t细胞,其包含编码根据权利要求27-50中任一项的结合蛋白的异源多核苷酸,当受试者表达hla-a*11:01时,其中如果同时施用(i)的组合物和(ii)的组合物,则(i)的组合物和(ii)的组合物包含在相同的组合物中或作为单独的组合物施用。
[0285]
在某些实施方案中,其中该方法进一步包括向受试者施用细胞因子。在一些实施方案中,细胞因子包括il-2、il-15或il-21。
[0286]
在某些实施例中,受试者已经接受或正在接受免疫检查点抑制剂和/或刺激性免疫检查点试剂的激动剂。
[0287]
示例
[0288]
示例1
[0289]
突变体kras:hla-a*11:01特异性tcr的生成和表征
[0290]
来自2个健康供体的t细胞系用混合的kras突变肽刺激3次,并在高尔基体抑制剂存在下与装载突变kras肽的抗原呈递细胞(apc)一起孵育4小时。通过流式细胞术测量细胞
因子产生(ifn-γ和tnfα)。数据如图1所示。来自3个不同供体的30个hla-a11/kras特异性t细胞系用100ng/ml的混合kras突变肽刺激16小时,然后汇集并根据cd137表达进行分类。数据如图2所示。对编码完整tcrβ链(adaptive biotechnologies,seattle,wa)或配对的vα和vβ结构域(10x genomics,pleasanton,ca)的基因进行测序。
[0291]
然后针对功能转导的宿主细胞测试tcr。用hla-a11/kras特异性tcr转导表达nur77-dttomato报告基因(报告人类t细胞中抗原特异性信号;参见ahsouri and weiss,j immunol 198(2):657-668(2017))的jurkat细胞,并与装载有突变kras肽的apc孵育24小时。数据如图3所示,表明转导的细胞在载有抗原的apc存在下是有功能的。此外,如图4a和4b所示,用示例性tcr转导的t细胞识别不同的突变kras表位。
[0292]
图5a-5d中提供了来自附加表征实验的数据;这些数据显示表达本公开的示例性tcr的原代cd8
+
t细胞在用抗原刺激后产生ifn-γ,并且具有高功能亲和力。
[0293]
在表达抗原的肿瘤细胞系存在下测试tcr转导的t细胞的反应性。数据显示在图6a-7g中。当thp-1、capan-2或ga-10.4细胞刺激时,几个tcr的cd137表达升高。
[0294]
使用杀伤试验测试了tcr转导的t细胞杀伤肿瘤细胞系的能力。(外源表达抗原,或者在图8a中的721细胞的情况下,用抗原包被)数据显示在图8a-8d中。使用肿瘤细胞系进行额外的杀伤测定。如图21a-22b所示,tcr转导的t细胞有效杀死panc-1、aspc-1、cfpac-1和/或capan-2细胞。
[0295]
示例2
[0296]
突变体kras:hla-a*03:01特异性tcr的生成和表征
[0297]
使用netmhc版本3.4(可在cbs.dtu.dk/services/netmhc/在线获取)测量突变的kras g12v肽(10-mer(vvvgavgvgk;seq id no:2);9-mer(vvgavgvk;seq id no:3))对hla-a*0301的预测hla结合亲和力。结果如图9所示。在3轮肽刺激后,通过四聚体标记检测来自健康供体的hla-a3/kras(g12v)特异性t细胞系(图10)。接下来,用肽刺激t细胞系并在cd137或四聚体上评分。
[0298]
示例3
[0299]
突变体kras:hla-a*02:01特异性tcr的生成和表征
[0300]
使用iedb测量突变的kras g12v肽对hla-a*02:01的预测hla结合亲和力,并使用netmhcpan、syfpeithi和bimas(未显示)重复测量。iedb预测的结果如图12所示。来自健康供体的t细胞系用肽抗原刺激并检查cd137表达(图13a和13b)。接着,测试t细胞响应肽抗原产生ifn-γ的能力。数据显示在图14a-14d中。示例性tcr的hla和肽特异性通过四聚体标记实验(与标记四聚体结合时的平均荧光强度)以及相对亲和力读数和在不存在cd8的情况下与四聚体结合的能力来证实。四聚体标记mfi数据显示在图15a和15b中。细胞可以独立于cd8与四聚体结合,如图16所示的以下细胞计数数据所证明。
[0301]
tcr转导的t细胞的功能亲合力和特异性在4小时试验中通过肽剂量反应进行测试。图17中的数据表明,与野生型肽相比,这些t细胞对突变kras肽具有高度特异性和反应性。图18a-18c中的数据显示了亲和力曲线证明t细胞在低肽刺激水平和高计算亲和力下产生ifn-γ。
[0302]
通过与cfpac-1胰腺肿瘤细胞孵育过夜并用cd137/41-bb抗体标记来测试了tcr转导的t细胞对内源性加工和呈递肽反应的能力。反应性如图19所示。
[0303]
使用杀伤试验测试tcr转导的t细胞杀伤cfpac-1肿瘤细胞系的能力。如图20a-20c所示,转导的t细胞有效杀死hla-a2+和kras g12v+cfpac-1肿瘤细胞。
[0304]
示例4
[0305]
特异于突变kras:hla-a*11:01的额外tcr的生成和表征
[0306]
如实施例1中所述,对另外的a11/kras特异性供体t细胞系进行分选并且对tcr进行测序。如图23a和23b所示,tcr被转导到原代t细胞中,并测量cd137对抗原的表达。如图24a-26b所示,转导的t细胞响应肽抗原表达ifn-γ。包括来自实施例1的tcr13和20,以用于比较。
[0307]
如图27a和27b所示,tcr转导的t细胞有效杀死表达kras突变肽的肿瘤细胞系。
[0308]
如实施例1中所述,对另外的a11/kras特异性供体t细胞系进行分选并且对tcr进行测序。tcr被转导到原代t细胞中,并测量响应于抗原的cd137表达,如图28a和28b所示。如图29a所示,用这些tcr转导的t细胞响应突变的kras肽特异性地产生ifn-γ。测试了来自实施例1和4的a11/kras特异性tcr对肿瘤细胞系的杀伤活性。如图32a-32d所示,用这些tcr转导的t细胞对多种肿瘤细胞系具有杀伤活性。
[0309]
可以组合上述各种实施例以提供进一步的实施例。本说明书中提及和/或申请数据表中列出的所有美国专利、美国专利申请出版物、美国专利申请、外国专利、外国专利申请和非专利出版物(包括于2019年2月20日提交的美国临时申请号62/808,248)的全部内容通过引用并入本文。如果需要采用各种专利、申请和出版物的概念来提供另外的实施例,则可以修改实施例的方面。
[0310]
根据以上详细描述,可以对实施例进行这些和其他改变。通常,在以下权利要求中,所使用的术语不应被解释为将权利要求限于说明书和权利要求中公开的特定实施例,但应被解释为包括所有可能的实施例以及这些权利要求所授权的等效物的完整范围。因此,权利要求不受本公开的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1