抗-BCMA抗体结合物、包含其的组合物及其制备及使用方法与流程
抗-bcma抗体结合物、包含其的组合物及其制备及使用方法
相关申请案的交叉参考
1.本技术案主张2019年5月3日提出申请的美国临时申请案第62/843,226号的权益,该临时申请案为以全文引用的方式并入本文中。以电子方式提交的序列表参考
2.本技术案以引用方式并入作为文本档案与本技术案一起提交的序列表,其标题为14247-525-228_seq_listing.txt,创建于2020年4月28日且大小为30,207个字节。
技术领域
3.本文提供对b细胞成熟抗原(bcma)具有结合特异性的抗体结合物及包含该等抗体结合物的组合物(包括药物组合物)、产生该等结合物的方法及使用该等结合物及组合物用于疗法的方法。该等结合物及组合物可用于治疗及预防细胞增殖及癌症的方法中、检测细胞增殖及癌症的方法中以及诊断细胞增殖及癌症的方法中。该等结合物及组合物亦可用于治疗、预防、检测及诊断自体免疫疾病及传染病的方法中。先前技术
4.b细胞成熟抗原(bcma)为识别b细胞活化因子的肿瘤坏死因子(tnf)受体超家族的成员。人类中的该蛋白质为由肿瘤坏死因子受体超家族成员17(tnfrsf17)基因编码且优先在成熟b淋巴球中表达。
5.bcma在调控b细胞成熟且分化成浆细胞方面起重要作用。其与baff受体(baff-r)及跨膜活化剂及钙调亲环素配体相互作用因子(transmembrane activator and calcium modulator and cyclophilin ligand interactor,taci)紧密相关。尽管bcma、baff-r及taci为促进不同发育阶段b细胞存活的iii型跨膜蛋白,但bcma仅在b细胞谱为细胞中表达,例如浆母细胞及分化的浆细胞(avery等人(2003)j.clin.invest.112(2):286-297;o’connor等人(2004)j.exp.med.199(1):91-98)。其在血浆细胞分化期间被选择性地诱导,与分化细胞中baff-r表达的丧失同时发生(darce等人(2007)j.immunol.178(9):5612-5622)。bcma表达似乎支持正常浆细胞及浆母细胞的存活,但通常在初始b细胞及大多数记忆b细胞上并不存在。因此,整体b细胞稳态似乎不需要bcma表达,但其为骨髓中长寿命浆细胞的最佳存活所必需的(o’connor等人(2004)上文文献;xu,s.及k.p.lam(2001)mol.cell.biol.21(12):4067-4074)。
6.在多发性骨髓瘤中,已显示bcma以升高含量普遍且广泛地在恶性浆细胞中表达;然而,其在除浆细胞以外的正常人类组织中通常检测不到。由于其作为细胞表面受体在多发性骨髓瘤细胞株上的选择性表达,bcma可潜在地成为治疗多发性骨髓瘤的疗法中的靶标。bcma表达亦与白血病及淋巴瘤相关。因此,业内需要改良的靶向及/或调节bcma活性的方法。鉴于bcma在浆细胞上的特异性表达及在非癌组织中的较低表达,业内需要改良的可特异性地靶向表达或过表达bcma的细胞及组织的治疗剂。针对bcma的抗体结合物可用于将治疗性或诊断性有效载荷部分递送至表达bcma的靶细胞,以用于治疗或诊断此等疾病。
no:17的氨基酸序列的轻链。举例而言,该抗体结合物可包含含有seq id no:15的氨基酸序列的重链及含有seq id no:17的氨基酸序列的轻链,其中根据eu编号方案,对应于重链(hc)-f404及hc-y180的每一氨基酸已取代为对-叠氮基甲基-苯丙氨酸残基。
12.在本文所提供的任一抗体结合物的某些实施方案中,抗体为单克隆抗体。在本文所提供的任一抗体结合物的某些实施方案中,抗体为iga、igd、ige、igg或igm。在本文所提供的任一抗体结合物的某些实施方案中,抗体为人类化或人类的。在本文所提供的任一抗体结合物的某些实施方案中,抗体为无糖基化的。在本文所提供的任一抗体结合物的某些实施方案中,抗体为抗体片段,例如fv片段、fab片段、f(ab’)2片段、fab’片段、scfv(sfv)片段或scfv-fc片段。在本文所提供的任一抗体结合物的某些实施方案中,抗体特异性结合人类bcma及食蟹猴bcma。在本文所提供的任一抗体结合物的某些实施方案中,抗体特异性结合人类bcma及小鼠bcma。
13.本文进一步提供试剂盒,其包含本文所提供的任一抗体结合物及抗体结合物的使用说明书。在具体实施方案中,抗体结合物为冻干的。在另一具体实施方案中,试剂盒进一步包含用于还原冻干抗体的流体。
14.本文进一步提供药物组合物,其包含本文所提供的任一抗体结合物及药物上可接受的载剂。
15.本文进一步提供治疗或预防有需要个体的疾病或病状的方法,其包含向该个体投与有效量的本文所提供的任一抗体结合物或本文所提供的任一抗体结合物的药物组合物。在某些实施方案中,疾病或病状为癌症。在某些实施方案中,疾病或病状为白血病或淋巴瘤。在某些实施方案中,疾病或病状为多发性骨髓瘤。在具体实施方案中,根据国际分期系统或修订的国际分期系统,该多发性骨髓瘤为第i期、第ii期或第iii期。在某些实施方案中,该多发性骨髓瘤为新诊断的多发性骨髓瘤。在其他实施方案中,该多发性骨髓瘤为复发性或难治性多发性骨髓瘤。
16.本文进一步提供诊断有需要个体的疾病或病状的方法,其包含向该个体投与有效量的本文所提供的任一抗体结合物。在某些实施方案中,疾病或病状为癌症。在某些实施方案中,疾病或病状为白血病或淋巴瘤。在某些实施方案中,疾病或病状为多发性骨髓瘤。在具体实施方案中,根据国际分期系统或修订的国际分期系统,该多发性骨髓瘤为第i期、第ii期或第iii期。在某些实施方案中,该多发性骨髓瘤为新诊断的多发性骨髓瘤。在其他实施方案中,该多发性骨髓瘤为复发性或难治性多发性骨髓瘤。
附图说明
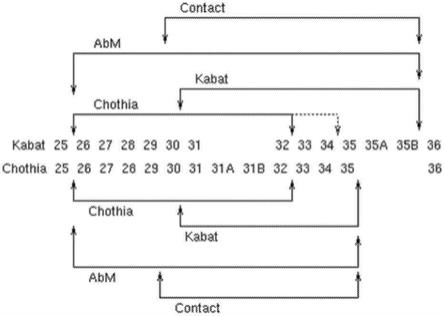
17.图1提供cdr-h1的kabat及chothia编号系统的比较。改编自martin a.c.r.(2010),protein sequence and structure analysis of antibody variable domains,r.kontermann及s.d
ü
bel(编辑),antibody engineering,第2卷(第33-51页)。springer-verlag,berlin heidelberg。
18.图2为图解说明植入arp-1多发性骨髓瘤肿瘤的小鼠在投与单一剂量的如本文所公开的不同bcma抗体-药物结合物的后的体重变化的图表。
19.图3a及3b为图解说明植入arp-1多发性骨髓瘤肿瘤的小鼠在投与单一剂量的如本文所公开的不同bcma抗体-药物结合物的后的肿瘤生长曲线及肿瘤大小的图表。
20.图4为图解说明植入mm.1s多发性骨髓瘤细胞的小鼠在投与单一剂量的如本文所公开的不同bcma抗体-药物结合物的后的体重变化的图表。
21.图5为图解说明植入mm.1s多发性骨髓瘤细胞的小鼠在投与单一剂量的如本文所公开的不同bcma抗体-药物结合物的后的卡普兰-迈耶(kaplan-meier)存活图的图表。
22.图6为图解说明植入mm.1s多发性骨髓瘤细胞的小鼠在投与单一剂量的如本文所公开的bcma抗体-药物结合物、达雷木单抗(daratumumab)、velcade或其不同组合的后的卡普兰-迈耶存活图的图表。
23.图7a至7c为图解说明植入mm.1s多发性骨髓瘤细胞的小鼠在投与单一剂量的如本文所公开的bcma抗体-药物结合物连同达雷木单抗或velcade的后的存活图的图表。
24.图8a及8b为图解说明植入mm.1s多发性骨髓瘤细胞的小鼠在投与单一剂量的如本文所公开的不同浓度bcma抗体-药物结合物的后的卡普兰-迈耶存活图及存活图的图表。
25.图9为图解说明植入arp-1多发性骨髓瘤肿瘤的小鼠在投与单一剂量的如本文所公开的不同剂量bcma抗体-药物结合物的后的体重变化的图表。
26.图10a及10b为图解说明植入arp-1多发性骨髓瘤肿瘤的小鼠在投与单一剂量的如本文所公开的不同剂量bcma抗体-药物结合物的后的肿瘤生长曲线及肿瘤大小的图表。
27.图11为图解说明pbs、人类、小鼠及食蟹猴血浆中结合物4随时间推移的平均dar的图表。
28.图12提供图解说明结合物4及结合物1与表达人类bcma、baff-r及taci受体的细胞的细胞结合的图表。1.定义
29.除非另有定义,否则本文所使用的所有专门术语、符号及其他科学术语均意欲具有熟习本发明所属技术者所通常理解的含义。在一些情形中,具有所通常理解含义的术语为清晰起见及/或为供及时参考而定义于本文中,且在本文中纳入此等定义不必解释为表示与业内所通常理解不同。本文所阐述或提及的技术及程序通常众所周知且由本领域技术人员使用习用方法采用,例如以下文献中所阐述的广泛利用的分子选殖方法:green及sambrook,molecular cloning:a laboratory manual,第4版(2012),cold spring harbor laboratory press,cold spring harbor,ny;及ausubel等人,current protocols in molecular biology,john wiley&sons。若适当,除非另有注明,否则涉及使用市售试剂盒及试剂的程序通常为根据制造商所定义的方案及条件来实施。
30.除非上下文另外明确指示,否则如本文所使用,单数形式“一(a、an)”及“该”包括复数个指示物。
31.术语“约”指示且涵盖所指示值以及高于及低于该值的范围。在某些实施方案中,术语“约”指示指定值
±
10%、
±
5%或
±
1%。在某些实施方案中,术语“约”指示指定值
±
该值的一个标准偏差。
32.术语“其组合”包括该术语所指要素的每种可能组合。举例而言,陈述“若α2为a,则α3不为d;α5不为s;或α6不为s;或其组合”的句子包括在α2为a时的以下组合:(1)α3不为d;(2)α5不为s;(3)α6不为s;(4)α3不为d;α5不为s;且α6不为s;(5)α3不为d且α5不为s;(6)α3不为d且α6不为s;及(7)α5不为s且α6不为s。
33.术语“bcma”及“b细胞成熟抗原”在本文中可互换使用。bcma亦有同义词称谓,包括
bcm、肿瘤坏死因子受体超家族成员17(“tnfrsf17”)、cd269、tnfrsf13a及tnf受体超家族成员17等。除非另有指定,否则该等术语包括由细胞天然表达或由经bcma或bcma基因转染的细胞表达的人类bcma的任何变体、同种型及物种同系物。bcma蛋白包括(例如)人类bcma同种型1(seq id no:1)及人类bcma同种型2(seq id no:2)。在一些实施方案中,bcma蛋白包括食蟹猴bcma(seq id no:3)。在一些实施方案中,bcma蛋白包括鼠类bcma(seq id no:4)。
34.术语“免疫球蛋白”为指一类通常包含两对多肽链(一对轻(l)链及一对重(h)链)的结构相关蛋白质。在“完整免疫球蛋白”中,该等链中的所有四者由二硫键相互连结。免疫球蛋白的结构已予以充分表征。例如,参见paul,fundamental immunology,第7版,第5章(2013)lippincott williams&wilkins,philadelphia,pa。简言之,每一重链通常包含重链可变区(vh或vh)及重链恒定区(ch或ch)。重链恒定区通常包含三个结构域,缩写为ch1(或ch1)、ch2(或ch2)及ch3(或ch3)。每一轻链通常包含轻链可变区(v
l
或vl)及轻链恒定区。轻链恒定区通常包含一个结构域,缩写为c
l
或cl。
35.术语“抗体”阐述免疫球蛋白分子的一种类型且其在本文中为以最广泛的意义使用。抗体具体包括完整抗体(例如完整免疫球蛋白)及抗体片段。抗体包含至少一个抗原结合结构域。抗原结合结构域的一个实施例为由v
h-v
l
二聚体形成的抗原结合结构域。“bcma抗体”、“抗bcma抗体”、“bcma ab”、“bcma特异性抗体”、“抗bcma ab”、“bcma抗体”、“抗bcma抗体”、“bcma ab”、“bcma特异性抗体”或“抗bcma ab”或该等词组中“bcma”由“tnfsf17”取代的任何重复为如本文所阐述的特异性结合至bcma的抗体。在一些实施方案中,该抗体结合bcma的细胞外结构域。
[0036]vh
及v
l
区可进一步细分成超变性区域(“超变区(hvr)”;亦称为“互补决定区”(cdr))及更保守的区域,二者间杂排列。更保守的区域称为框架区(fr)。每一vh及v
l
通常包含三个cdr及四个fr,其按以下顺序排列(自n末端至c末端):fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。cdr参与抗原结合,且影响抗体的抗原特异性及结合亲和力。参见kabat等人,sequences of proteins of immunological interest第5版(1991)public health service,national institutes of health,bethesda,md,其为以全文引用的方式并入。
[0037]
基于来自任何脊椎动物物种的轻链的恒定结构域序列,可将该轻链指派为称为卡帕(κ)及拉姆达(λ)的两种类型中的一者。
[0038]
可将来自任何脊椎动物物种的重链指派为五种不同类别(或同型)中的一者:iga、igd、ige、igg及igm。该等类别亦分别称为α、δ、ε、γ及μ。基于序列及功能的差异,将igg及iga类别进一步分成亚类。人类表达以下亚类:igg1、igg2、igg3、igg4、iga1及iga2。
[0039]
本领域技术人员可使用多种已知编号方案中的任一者来定义cdr的氨基酸序列边界,该等编号方案包括以下文献中所阐述的彼等:kabat等人,上文文献(“kabat”编号方案);al-lazikani等人,1997,j.mol.biol.,273:927-948(“chothia”编号方案);maccallum等人,1996,j.mol.biol.262:732-745(“contact”编号方案);lefranc等人,dev.comp.immunol.,2003,27:55-77(“imgt”编号方案);以及honegge及pl
ü
ckthun,j.mol.biol.,2001,309:657-70(“aho”编号方案);该等文献各自为以全文引用的方式并入。
[0040]
表1提供如通过kabat及chothia方案所鉴别的cdr-l1、cdr-l2、cdr-l3、cdr-h1、cdr-h2及cdr-h3的位置。对于cdr-h1,残基编号为使用kabat及chothia编号方案二者来提
供。表1.根据kabat及chothia编号方案的cdr中的残基。cdrkabatchothial1l24-l34l24-l34l2l50-l56l50-l56l3l89-l97l89-l97h1(kabat编号)h31-h35bh26-h32或h34*h1(chothia编号)h31-h35h26-h32h2h50-h65h52-h56h3h95-h102h95-h102*当使用kabat编号惯例编号时,取决于cdr的长度而定,cdr-h1的c末端在h32与h34之间变化,如图1中所图解说明。
[0041]
除非另有指定,否则用于鉴别本文特定cdr的编号方案为kabat/chothia编号方案。倘若该两个编号方案所涵盖的残基有所不同(例如cdr-h1及/或cdr-h2),则将编号方案指定为kabat或chothia。为便捷起见,本文中有时将cdr-h3称为kabat或chothia。然而,此并不意欲暗示不存在的序列差异,且本领域技术人员通过检查序列可容易地确认序列相同还是不同。
[0042]
举例而言,可使用可在www.bioinf.org.uk/abs/abnum/处获得且阐述于abhinandan及martin,immunology,2008,45:3832-3839中的抗体编号软件(例如abnum)来指派cdr,该文献为以全文引用的方式并入。
[0043]“eu编号方案”通常在提及抗体重链恒定区中的残基时使用(例如,如kabat等人,上文文献中所报导)。除非另有说明,否则eu编号方案用于指本文所阐述抗体重链恒定区中的残基。
[0044]“抗体片段”包含完整抗体的一部分,例如完整抗体的抗原结合或可变区。抗体片段包括(例如)fv片段、fab片段、f(ab’)2片段、fab’片段、scfv(sfv)片段及scfv-fc片段。
[0045]“fv”片段包含一个重链可变结构域及一个轻链可变结构域的非共价连接的二聚体。
[0046]
除重链及轻链可变结构域以外,“fab”片段亦包含轻链的恒定结构域及重链的第一恒定结构域(c
h1
)。fab片段可(例如)通过重组方法或通过木瓜酶消化全长抗体来生成。
[0047]“f(ab
′
)
2”片段含有两个在铰链区附近通过二硫键接合的fab
′
片段。f(ab
′
)2片段可(例如)通过重组方法或通过胃蛋白酶消化完整抗体来生成。f(ab
′
)片段可(例如)通过利用β-巯基乙醇进行处理来解离。
[0048]“单链fv”或“sfv”或“scfv”抗体片段包含单一多肽链中的vh结构域及v
l
结构域。vh及v
l
通常通过肽连接体连接。参见pl
ü
ckthun a.(1994)。在一些实施方案中,连接体为seq id no:26。在一些实施方案中,连接体为seq id no:27。antibodies from escherichia coli.,rosenberg m及moore g.p.(编辑),the pharmacology of monoclonal antibodies,第113卷(第269-315页)。springer-verlag,new york,其为以全文引用的方式并入。
[0049]“scfv-fc”片段包含连接至fc结构域的scfv。举例而言,fc结构域可连接至scfv的
c末端。fc结构域可在vh或v
l
的后,此取决于scfv中可变结构域的定向而定(即,v
h-v
l
或v
l-vh)。可使用业内已知或本文所阐述的任一适宜fc结构域。在一些情形中,fc结构域包含igg1 fc结构域。在一些实施方案中,igg1 fc结构域包含seq id no:19或其一部分。seq id no:19提供人类igg1恒定区的ch1、ch2及ch3的序列。
[0050]
术语“单克隆抗体”为指来自实质上同源的抗体群体的抗体。实质上同源的抗体群体包含实质上类似且结合相同表位的抗体,通常可在单克隆抗体的产生期间出现的变体除外。此等变体通常仅以极少量存在。单克隆抗体通常通过包括自复数种抗体选择单一抗体的制程获得。举例而言,选择制程可为自复数个纯为(例如杂交瘤纯为、噬菌体纯为、酵母纯为、细菌纯为或其他重组dna纯为的库)选择独特纯为。所选抗体可经进一步改变,以例如改良对靶标的亲和力(“亲和力成熟”)、使抗体人类化、改良其在细胞培养物中的产生及/或降低其在个体中的免疫原性。
[0051]
术语“嵌合抗体”为指重链及/或轻链的一部分源自特定来源或物种,而重链及/或轻链的其余部分源自不同来源或物种的抗体。
[0052]
非人类抗体的“人类化”形式为含有源自非人类抗体的最小序列的嵌合抗体。人类化抗体通常为其中来自一或多个cdr的残基经来自非人类抗体(供体抗体)的一或多个cdr的残基替代的人类免疫球蛋白(接受者抗体)。供体抗体可为具有期望特异性、亲和力或生物效应的任何适宜非人类抗体,例如小鼠、大鼠、兔、鸡或非人类灵长类动物抗体。在一些情况中,接受者抗体的所选框架区残基经来自供体抗体的相应框架区残基替代。人类化抗体亦可包含在接受者抗体或供体抗体中未发现的残基。可作出此等修饰以进一步改善抗体功能。关于其他细节,参见jones等人,nature,1986,321:522-525;riechmann等人,nature,1988,332:323-329;及presta,curr.op.struct.biol.,1992,2:593-596,该等文献各自为以全文引用的方式并入。
[0053]“人类抗体”为具有对应于如下抗体的氨基酸序列的氨基酸序列者:其为由人类或人类细胞产生或源自利用人类抗体谱或其他人类抗体编码序列(例如自人类来源获得或从头设计)的非人类来源。人类抗体明确地排除人类化抗体。
[0054]“经分离抗体”为已自其自然环境的组分分离及/或回收的抗体。自然环境的组分可包括酶、激素及其他蛋白质性或非蛋白质性材料。在一些实施方案中,将经分离抗体纯化至足以例如通过使用旋杯式测序仪获得至少15个n末端或内部氨基酸序列残基的程度。在一些实施方案中,将经分离抗体纯化至在还原或非还原条件下通过凝胶电泳(例如sds-page)及通过考马斯蓝(coomassie blue)或银染色检测呈均质性。经分离抗体包括重组细胞内的原位抗体,此乃因抗体自然环境的至少一种组分不存在。在一些方面中,经分离抗体为通过至少一个纯化步骤来制备。
[0055]
在一些实施方案中,将经分离抗体纯化至至少80重量%、85重量%、90重量%、95重量%或99重量%。在一些实施方案中,将经分离抗体纯化至至少80体积%、85体积%、90体积%、95体积%或99体积%。在一些实施方案中,经分离抗体为以占至少85重量%、90重量%、95重量%、98重量%、99重量%至100重量%的溶液形式来提供。在一些实施方案中,经分离抗体为以占至少85体积%、90体积%、95体积%、98体积%、99体积%至100体积%的溶液形式来提供。
[0056]“亲和力”为指分子(例如抗体)的单一结合位点与其结合配偶体(例如抗原)之间
的非共价相互作用的总和强度。除非另有指示,否则如本文所使用,“结合亲和力”为指反映结合对的成员(例如抗体与抗原)之间的1:1相互作用的固有结合亲和力。分子x对其配偶体y的亲和力可由解离常数(kd)来表示。亲和力可通过业内已知的常用方法(包括本文所阐述的彼等方法)来测量。举例而言,亲和力可使用表面电浆共振(spr)技术(例如仪器)来测定。在一些实施方案中,亲和力为在25℃下测定。
[0057]
关于抗体与靶分子的结合,术语“特异性结合”、“特异性地结合至”、“特异性针对”、“选择性地结合”及“选择性针对”特定抗原(例如多肽靶标)或特定抗原上的表位意指可测量地不同于非特异性或非选择性相互作用的结合。特异性结合可(例如)通过测定与对照分子的结合相比分子的结合来测量。特异性结合亦可通过与模拟靶标上的抗体结合位点的对照分子进行竞争来测定。在该情形中,若对照分子竞争性地抑制抗体与靶标的结合,则指示特异性结合。
[0058]
如本文所使用的术语“k
d”或“kd”(sec-1
)为指特定抗体-抗原相互作用的解离速率常数。此值亦称为k解离值。
[0059]
如本文所使用的术语“k
a”或“ka”(m-1
×
sec-1
)为指特定抗体-抗原相互作用的缔合速率常数。此值亦称为k缔合值。
[0060]
如本文所使用的术语“k
d”(亦称为“kd”或“kd”,m或nm)为指特定抗体-抗原相互作用的解离平衡常数。kd=kd/ka。kd的值通常在大小上等于一半蛋白质分子以平衡状态结合至配体时的配体浓度。
[0061]
如本文所使用的术语“k
a”或“k
a”(m-1
)为指特定抗体-抗原相互作用的缔合平衡常数。ka=ka/kd。
[0062]“亲和力成熟”抗体为在其一或多个cdr或fr中具有一或多个改变的抗体,与不具有该(等)改变的亲代抗体相比,该(等)改变使得该抗体对其抗原的亲和力改良。在一个实施方案中,亲和力成熟抗体对靶抗原具有奈摩尔浓度或皮摩尔浓度亲和力。亲和力成熟抗体可使用业内已知的多种方法来产生。举例而言,marks等人(bio/technology,1992,10:779-783,其为以全文引用的方式并入)阐述通过vh及v
l
结构域改组的亲和力成熟。cdr及/或框架残基的随机诱变阐述于(例如)barbas等人,(proc.nat.acad.sci.u.s.a.,1994,91:3809-3813);schier等人,gene,1995,169:147-155;yelton等人,j.immunol.,1995,155:1994-2004;jackson等人,j.immunol.,1995,154:3310-33199;及hawkins等人,j.mol.biol.,1992,226:889-896中,该等文献各自为以全文引用的方式并入。
[0063]
当在本文中用于两种或更多种抗体的背景中时,术语“与
……
竞争”或“与
……
交叉竞争”指示该两种或更多种抗体竞争结合至抗原(例如bcma)。在一个例示性分析中,将bcma涂覆在板上且使其结合第一抗体,的后添加第二经标记的抗体。若第一抗体的存在降低第二抗体的结合,则该等抗体竞争。在另一例示性分析中,将第一抗体涂覆在板上且使其结合抗原,且然后添加第二抗体。术语“与
……
竞争”亦包括如下抗体组合:一种抗体降低另一抗体的结合,但当以相反顺序添加抗体时未观察到竞争。然而,在一些实施方案中,第一与第二抗体抑制彼此的结合,而与其添加顺序无关。在一些实施方案中,一种抗体使另一抗体对其抗原的结合降低至少50%、至少60%、至少70%、至少80%或至少90%。
[0064]
术语“表位”意指抗原中能够特异性结合至抗体的部分。表位通常为由表面可及氨基酸残基及/或糖侧链组成,且可具有特异性三维结构特征以及特异性电荷特征。构形及非
构形表位的不同的处在于,在变性溶剂存在下与前者结合但不与后者结合。表位可包含直接参与结合的氨基酸残基及不直接参与结合的其他氨基酸残基。抗体所结合的表位可使用用于表位测定的已知技术(例如测试抗体与具有不同点突变的bcma变体的结合)来测定。
[0065]
多肽序列与参照序列之间的“一致性”百分比定义为在比对序列且引入空位(若需要)以达成最大序列一致性百分比后,多肽序列中与参照序列中的氨基酸残基一致的氨基酸残基的百分比。出于确定氨基酸序列一致性百分比的目的,比对可以本领域技术人员所熟知的各种方式来达成,例如使用可公开获得的计算机软件,例如blast、blast-2、align、megalign(dnastar)、clustalw、clustal omega或muscle软件。本领域技术人员可确定用于比对序列的适当参数,包括在所比较序列的全长范围内达成最大比对所需要的任何算法。
[0066]“保守取代”或“保守氨基酸取代”为指利用在化学上或功能上相似的氨基酸来取代氨基酸。提供相似氨基酸的保守取代表为业内所熟知。具有此等取代的多肽序列称为“保守修饰变体”。藉助实施例,表2至4中所提供的氨基酸组在一些实施方案中视为彼此的保守取代。表2.在某些实施方案中视为彼此的保守取代的所选氨基酸组。酸性残基d及e碱性残基k、r及h亲水性不带电残基s、t、n及q脂肪族不带电残基g、a、v、l及i非极性不带电残基c、m及p芳香族残基f、y及w含醇基的残基s及t脂肪族残基i、l、v及m环烯基相关残基f、h、w及y疏水性残基a、c、f、g、h、i、l、m、r、t、v、w及y带负电荷的残基d及e极性残基c、d、e、h、k、n、q、r、s及t带正电荷的残基h、k及r小残基a、c、d、g、n、p、s、t及v极小残基a、g及s参与转弯形成的残基a、c、d、e、g、h、k、n、q、r、s、p及t挠性残基q、t、k、s、g、p、d、e及r表3.在某些实施方案中视为彼此的保守取代的其他所选氨基酸组。表3.在某些实施方案中视为彼此的保守取代的其他所选氨基酸组。表4.在某些实施方案中视为彼此的保守取代的其他所选氨基酸组。
组aa及g组bd及e组cn及q组dr、k及h组ei、l、m、v组ff、y及w组gs及t组hc及m
[0067]
其他保守取代可参见(例如)creighton,proteins:structures and molecular properties第2版(1993)w.h.freeman&co.,new york,ny。通过对亲代抗体中的氨基酸残基进行一或多个保守取代生成的抗体称为“保守修饰变体”。
[0068]
术语“氨基酸”为指20种常见天然氨基酸。天然氨基酸包括丙氨酸(ala;a)、精氨酸(arg;r)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、半胱氨酸(cys;c);麸氨酸(glu;e)、麸酰胺酸(gln;q)、甘氨酸(gly;g);组氨酸(his;h)、异白氨酸(ile;i)、白氨酸(leu;l)、离氨酸(lys;k)、甲硫氨酸(met;m)、苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)及缬氨酸(val;v)。
[0069]
天然编码氨基酸为本领域技术人员已知的蛋白原性氨基酸。其包括20种常见氨基酸(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、麸酰胺酸、麸氨酸、甘氨酸、组氨酸、异白氨酸、白氨酸、离氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸及缬氨酸)以及较不常见的吡咯离氨酸及硒基半胱氨酸。天然编码氨基酸包括22种天然氨基酸的转译后变体,例如戊二烯化氨基酸、异戊二烯化氨基酸、肉豆蔻酰化氨基酸、棕榈酰化氨基酸、n-连接的糖基化氨基酸、o-连接的糖基化氨基酸、磷酸化氨基酸及酰化氨基酸。
[0070]
术语“非天然氨基酸”为指不为蛋白原性氨基酸或其转译后修饰变体的氨基酸。特定而言,该术语为指不为20种常见氨基酸或吡咯离氨酸或硒基半胱氨酸或其转译后修饰变体中的一者的氨基酸。
[0071]
术语“结合物”或“抗体结合物”为指连接至一或多个有效载荷部分的抗体。抗体可为本文所阐述的任一抗体。有效载荷可为本文所阐述的任一有效载荷。抗体可经由共价键直接连接至有效载荷,或抗体可经由连接体间接连接至有效载荷。通常,连接体共价键结至抗体且亦共价键结至有效载荷。术语“抗体药物结合物”或“adc”为指其中至少一个有效载荷为诸如药物等治疗性部分的结合物。
[0072]
术语“有效载荷”为指可结合至抗体的分子部分。在特定实施方案中,有效载荷为选自由治疗性部分及标记部分组成的群。
[0073]
术语“连接体”为指能够形成至少两个共价键的分子部分。通常,连接体能够与抗体形成至少一个共价键且与有效载荷形成至少另一个共价键。在某些实施方案中,连接体可与抗体形成一个以上共价键。在某些实施方案中,连接体可与一个有效载荷形成一个以上共价键或可与一个以上有效载荷形成多个共价键。在连接体与抗体或有效载荷或该二者形成键的后,其余结构(即在形成一或多个共价键的后连接体的残基)在本文中仍可称为“连接体”。术语“连接体前体”为指具有一或多个能够与抗体或有效载荷或该二者形成共价键的反应性基团的连接体。在一些实施方案中,连接体为可裂解连接体。举例而言,可裂解
连接体可为由生物不稳定官能基释放的连接体,其可经工程改造或可不经工程改造。在一些实施方案中,连接体为不可裂解连接体。举例而言,不可裂解连接体可为在抗体降解后释放的连接体。
[0074]
在某些实施方案中,“治疗(treating或treatment)”任何疾病或病症为指改善个体中存在的疾病或病症。在另一实施方案中,“治疗(treating或treatment)”包括改善至少一个物理参数,个体可能对此感受不到。在另一实施方案中,“治疗(treating或treatment)”包括在物理方面调节疾病或病症(例如稳定可感受到的症状)或在生理学方面调节疾病或病症(例如稳定物理参数)或二者皆有。在另一实施方案中,“治疗(treating或treatment)”包括延迟或预防疾病或病症的发作。
[0075]
如本文所使用,术语“治疗有效量”或“有效量”为指抗体或组合物在投与给个体时有效治疗疾病或病症的量。在一些实施方案中,治疗有效量或有效量为指抗体或组合物在投与给个体时有效预防或改善疾病或该疾病的进展或使症状改善的量。
[0076]
如本文所使用,术语“抑制生长”(例如关于细胞,例如肿瘤细胞)意欲包括与不与bcma抗体接触的相同细胞的生长相比,在与bcma抗体接触时,细胞生长(例如肿瘤细胞生长)的任何可测量的降低。在一些实施方案中,可使生长抑制至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或100%。细胞生长的降低可通过多种机制发生,包括(但不限于)抗体内化、细胞凋亡、坏死及/或效应功能介导的活性。
[0077]
如本文所使用,术语“个体”意指哺乳动物个体。例示性个体包括(但不限于)人类、猴、狗、猫、小鼠、大鼠、牛、马、骆驼、鸟类、山羊及绵羊。在某些实施方案中,个体为人类。在一些实施方案中,个体患有可利用本文所提供的抗体治疗或诊断的疾病。在一些实施方案中,该疾病为白血病、淋巴瘤或多发性骨髓瘤、浆细胞样树突细胞肿瘤、b细胞谱为恶性病、浆细胞赘瘤、弥漫性大b细胞淋巴瘤(dlbcl)、低级b细胞淋巴瘤、柏基特氏淋巴瘤(burkitt’s lymphoma)、浆母细胞性淋巴瘤或滤泡性淋巴瘤。
[0078]
在本文所图解说明的一些化学结构中,某些取代基、化学基团及原子用与一或多个键相交的弯曲/波形线(例如)绘示,以指示该等取代基、化学基团及原子键结的原子。举例而言,在一些结构中,例如(但不限于)例如(但不限于)此弯曲/波形线指示结合物或连接体-有效载荷结构的主链中由所图解说明的化学实体键结的原子。在一些结构中,例如(但不限于)此弯曲/波形线指示所图解说明的化学实体所键结的抗体或抗体片段中的原子以及结合物或连接体-有效载荷结构的主链中的原子。
[0079]
术语“位点特异性”为指在多肽中的预定序列位置处的多肽修饰。修饰为在多肽的
单一、可预测残基处,极少有变化或没有变化。在特定实施方案中,在该序列位置处例如重组地或合成地引入经修饰的氨基酸。类似地,部分可“位点特异性地”连接至多肽中特定序列位置处的残基。在某些实施方案中,多肽可包含一个以上位点特异性修饰。2.结合物
[0080]
本文提供针对bcma的抗体的结合物。该等结合物包含经由连接体共价连接至有效载荷的针对bcma的抗体。在某些实施方案中,该抗体连接至一个有效载荷。在其他实施方案中,该抗体连接至一个以上有效载荷。在某些实施方案中,该抗体连接至两个、三个、四个、五个、六个、七个、八个或更多个有效载荷。
[0081]
在本文所提供的结合物中,抗体可来自任何物种。在某些实施方案中,bcma为脊椎动物bcma。在某些实施方案中,bcma为哺乳动物bcma。在某些实施方案中,bcma为人类bcma。在某些实施方案中,bcma为小鼠bcma。在某些实施方案中,bcma为食蟹猴bcma。
[0082]
抗体通常为包含多条多肽链的蛋白质。在某些实施方案中,抗体为包含两条相同轻(l)链及两条相同重(h)链的异四聚体。每一轻链可通过一个共价二硫键连接至重链。每一重链可通过一或多个共价二硫键连接至另一重链。每一重链及每一轻链亦可具有一或多个链内二硫键。如本领域技术人员所已知,每一重链通常包含一个可变结构域(vh),后接多个恒定结构域。每一轻链通常包含在一端的可变结构域(v
l
)及恒定结构域。如本领域技术人员所已知,抗体通常对其靶分子(即抗原)具有选择性亲和力。
[0083]
本文所提供的抗体可具有本领域技术人员已知的任何抗体形式。其可为全长的或为片段。例示性全长抗体包括iga、iga1、iga2、igd、ige、igg、igg1、igg2、igg3、igg4、igm等。例示性片段包括fv、fab、fc、scfv、scfv-fc等。
[0084]
在某些实施方案中,结合物的抗体包含本文所阐述的六个cdr序列。在某些实施方案中,结合物的抗体包含本文所阐述的重链可变结构域(vh)。在某些实施方案中,结合物的抗体包含本文所阐述的轻链可变结构域(v
l
)。在某些实施方案中,结合物的抗体包含本文所阐述的重链可变结构域(vh)及本文所阐述的轻链可变结构域(v
l
)。在某些实施方案中,结合物的抗体包含本文所阐述的成对重链可变结构域及轻链可变结构域(v
h-v
l
对)。
[0085]
在某些实施方案中,抗体结合物可自包含一或多个反应性基团的抗体形成。在某些实施方案中,抗体结合物可自包含所有天然编码氨基酸的抗体形成。本领域技术人员将认识到,若干个天然编码氨基酸包括能够结合至有效载荷或连接体的反应性基团。该等反应性基团包括半胱氨酸侧链、离氨酸侧链及氨基末端基团。在该等实施方案中,抗体结合物可包含连接至抗体反应性基团的残基的有效载荷或连接体。在该等实施方案中,有效载荷前体或连接体前体包含能够与抗体反应性基团形成键的反应性基团。典型反应性基团包括马来酰亚氨基团、活化碳酸酯(包括(但不限于)对硝基苯基酯)、活化酯(包括(但不限于)n-羟基琥珀酰亚胺、对硝基苯基酯及醛)。尤其有用的反应性基团包括马来酰亚胺及琥珀酰亚胺,例如n-羟基琥珀酰亚胺,其用于与半胱氨酸及离氨酸侧链形成键。其他反应性基团阐述于下文章节及实施例中。
[0086]
在其他实施方案中,抗体包含一或多个具有如本文所阐述的反应性基团的经修饰氨基酸。通常,经修饰氨基酸不为天然编码氨基酸。该等经修饰氨基酸可包含可用于与连接体前体或与有效载荷前体形成共价键的反应性基团。本领域技术人员可使用该反应性基团将多肽连接至能够与经修饰氨基酸形成共价键的任何分子实体。因此,本文提供包含抗体
的结合物,该抗体包含直接或经由连接体间接连接至有效载荷的经修饰氨基酸残基。例示性经修饰氨基酸阐述于下文章节中。通常,经修饰氨基酸具有能够与具有互补反应性基团的连接体或有效载荷形成键的反应性基团。
[0087]
在某些实施方案中,非天然氨基酸定位在抗体多肽链中的选定位置处。该等位置鉴别为提供非天然氨基酸取代的最佳位点。每一位点能够携带具有用于产生抗体的最佳结构、功能及/或方法的非天然氨基酸。
[0088]
在某些实施方案中,用于取代的位点特异性位置提供稳定的抗体。稳定性可通过对本领域技术人员显而易见的任何技术来测量。
[0089]
在某些实施方案中,用于取代的位点特异性位置提供具有最佳功能性质的抗体。举例而言,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示对其靶抗原的结合亲和力损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示增强的结合。
[0090]
在某些实施方案中,用于取代的位点特异性位置提供可有利地制备的抗体。举例而言,在某些实施方案中,该抗体在下文所论述的其合成方法中显示出有利性质。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示生产产率损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示提高的生产产率。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示trna抑制损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体在产生中可显示增强的trna抑制。
[0091]
在某些实施方案中,用于取代的位点特异性位置提供具有有利溶解性的抗体。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示溶解性损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示增强的溶解性。
[0092]
在某些实施方案中,用于取代的位点特异性位置提供具有有利表达的抗体。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示表达损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示增强的表达。
[0093]
在某些实施方案中,用于取代的位点特异性位置提供具有有利折叠的抗体。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示适当折叠损失极少或没有损失。在某些实施方案中,与没有位点特异性非天然氨基酸的抗体相比,该抗体可显示增强的折叠。
[0094]
在某些实施方案中,用于取代的位点特异性位置提供能够有利结合的抗体。如下文所阐述,若干个非天然氨基酸具有促进该抗体与第二药剂的结合(直接或经由连接体)的侧链或官能基。在某些实施方案中,与在其他位置没有相同或其他非天然氨基酸的抗体相比,该抗体可显示增强的结合效率。在某些实施方案中,与在其他位置没有相同或其他非天然氨基酸的抗体相比,该抗体可显示增强的结合产率。在某些实施方案中,与在其他位置没有相同或其他非天然氨基酸的抗体相比,该抗体可显示增强的结合特异性。
[0095]
一或多个非天然氨基酸位于抗体的至少一个多肽链中的选定位点特异性位置。多肽链可为抗体的任一多肽链而无限制,包括任一轻链或任一重链。位点特异性位置可在抗
体的任一结构域中,包括任一可变结构域及任一恒定结构域。
[0096]
在某些实施方案中,本文所提供的抗体包含一个在位点特异性位置处的非天然氨基酸。在某些实施方案中,本文所提供的抗体包含两个在位点特异性位置处的非天然氨基酸。在某些实施方案中,本文所提供的抗体包含三个在位点特异性位置处的非天然氨基酸。在某些实施方案中,本文所提供的抗体包含三个以上在位点特异性位置处的非天然氨基酸。
[0097]
在某些实施方案中,根据kabat或chothia或eu编号方案,本文所提供的抗体在位置hc-f404及hc-y180各自包含非天然氨基酸或其转译后的经修饰变体。在该等名称中,hc指示重链残基,且lc指示轻链残基。本领域技术人员将认识到,非天然氨基酸取代抗体氨基酸序列中的残基hc-f404及hc-y180。在某些实施方案中,非天然氨基酸为本文式(30)的残基。3.结合基团及其残基
[0098]
结合基团促进本文所阐述的有效载荷与第二化合物(例如本文所阐述的抗体)的结合。在某些实施方案中,结合基团在本文中指定为r。结合基团可经由本领域技术人员已知的任何适宜反应机制反应。在某些实施方案中,结合基团经由[3+2]炔烃-叠氮化物环加成反应、逆电子需求的狄尔斯-阿尔德(diels-alder)接合反应、硫醇-亲电子剂反应或羰基-氧基胺反应来反应,如本文所详细阐述。在某些实施方案中,结合基团包含炔烃,例如应变炔烃。在某些实施方案中,结合基团为:其他结合基团阐述于(例如)美国专利公开案第2014/0356385号、美国专利公开案第2013/0189287号、美国专利公开案第2013/0251783号、美国专利第8,703,936号、美国专利第9,145,361号、美国专利第9,222,940号及美国专利第8,431,558号中。
[0099]
在结合后,形成结合基团的二价残基且其键结至第二化合物的残基。二价残基的结构由用于形成结合物的结合反应的类型决定。
[0100]
在某些实施方案中,当经由[3+2]炔烃-叠氮化物环加成反应形成结合物时,结合基团的二价残基包含三唑环或包含三唑环的稠合环状基团。在某些实施方案中,当经由应变促进的[3+2]炔烃-叠氮化物环加成(spaac)反应形成结合物时,结合基团的二价残基为:及/或
[0101]
在一实施方案中,本文提供根据式101a至105b中任一者的结合物,其中comp指示抗bcma抗体的残基且pay指示有效载荷部分:
[0102]
在前述实施方案中的任一者中,结合物包含n个pay部分,其中n为1至8的整数。在一些实施方案中,n为2。在一些实施方案中,n为3。在一些实施方案中,n为4。在一些实施方案中,n为5。在一些实施方案中,n为6。在一些实施方案中,n为7。在一些实施方案中,n为8。
[0103]
在特定实施方案中,本文提供根据式105a至105b中任一者的抗bcma结合物,其中comp指示根据下式(30)的非天然氨基酸残基。在特定实施方案中,本文提供根据式105a至105b中任一者的抗bcma结合物,其中comp指示根据eu编号系统在重链位置404处的根据下式(30)的非天然氨基酸残基。在特定实施方案中,本文提供根据式105a至105b中任一者的抗bcma结合物,其中comp指示根据eu编号系统在重链位置180处的根据下式(30)的非天然氨基酸残基。本领域技术人员将认识到,诸如式(30)等氨基酸为作为残基并入至多肽及抗体中。举例而言,式(30)的残基可为根据下式:进一步修饰(例如在-n3处)亦涵盖在本文的术语残基内。
[0104]
在一实施方案中,本文提供根据式105c至105d中任一者的结合物,其中comp指示抗bcma抗体的残基且pay指示有效载荷部分:
[0105]
在前述实施方案中的任一者中,结合物包含n个pay部分,其中n为1至8的整数。在一些实施方案中,n为2。在一些实施方案中,n为3。在一些实施方案中,n为4。在一些实施方案中,n为5。在一些实施方案中,n为6。在一些实施方案中,n为7。在一些实施方案中,n为8。
[0106]
在特定实施方案中,本文提供根据式105c至105d中任一者的抗bcma结合物,其中comp指示根据下式(30)的非天然氨基酸残基。在特定实施方案中,本文提供根据式105c至105d中任一者的抗bcma结合物,其中comp指示根据eu编号系统在重链位置404处的根据下式(30)的非天然氨基酸残基。在特定实施方案中,本文提供根据式105c至105d中任一者的抗bcma结合物,其中comp指示根据eu编号系统在重链位置180处的根据下式(30)的非天然氨基酸残基。本领域技术人员将认识到,诸如式(30)等氨基酸为作为残基并入至多肽及抗体中。举例而言,式(30)的残基可为根据下式:进一步修饰(例如在-n3处)亦涵盖在本文的术语残基内。
[0107]
在特定实施方案中,本文提供具有结合物m的结构的抗bcma结合物:
其中n为1至6的整数。在一些实施方案中,n为1至4的整数。在一些实施方案中,n为2。举例而言,在特定实施方案中,抗bcma结合物具有以下结构:
[0108]
在一些实施方案中,n为4。举例而言,在特定实施方案中,抗bcma结合物具有以下结构:
[0109]
在其中抗bcma结合物具有结合物m的结构之前述实施方案中的任一者中,根据kabat或kabat的eu编号方案,带括号的结构可在位点hc-f404及hc-y180处共价键结至抗体的一或多个非天然氨基酸。在特定实施方案中,每一非天然氨基酸为根据式(30)的残基。
[0110]
在一个实施方案中,抗bcma结合物为结合物4,其具有如下结构:
其中抗体包含seq id no:15中所提供的重链序列及seq id no:17中所提供的轻链序列;其中抗体进一步包含根据eu编号方案在位点hc-f404及hc-y180中的每一者处取代的对-叠氮基甲基-苯丙氨酸残基;且该等式的括号内的每一结构在该等对-叠氮基甲基-苯丙氨酸残基中的一者处键结至抗体。
[0111]
在一个实施方案中,抗bcma结合物为结合物4,其中占优物种系:其中抗体包含seq id no:15中所提供的重链序列及seq id no:17中所提供的轻链序列;其中抗体进一步包含根据eu编号方案在位点hc-f404及hc-y180中的每一者处取代的对-叠氮基甲基-苯丙氨酸残基;且该等式的括号内的每一结构在该等对-叠氮基甲基-苯丙氨酸残基中的一者处键结至抗体。
[0112]
在一个实施方案中,抗bcma结合物为结合物4,其中占优物种系:
其中抗体包含seq id no:15中所提供的重链序列及seq id no:17中所提供的轻链序列;其中抗体进一步包含根据eu编号方案在位点hc-f404及hc-y180中的每一者处取代的对-叠氮基甲基-苯丙氨酸残基;且该等式的括号内的每一结构在该等对-叠氮基甲基-苯丙氨酸残基中的一者处键结至抗体。
[0113]
在一个实施方案中,抗bcma结合物为结合物4,其中占优物种系:其中抗体包含seq id no:15中所提供的重链序列及seq id no:17中所提供的轻链序列;其中抗体进一步包含根据eu编号方案在位点hc-f404及hc-y180中的每一者处取代的对-叠氮基甲基-苯丙氨酸残基;且该等式的括号内的每一结构在该等对-叠氮基甲基-苯丙氨酸残基中的一者处键结至抗体。4.抗体特异性
[0114]
结合物包含选择性地结合人类bcma的抗体。在一些方面中,抗体选择性地结合至人类bcma(人类bcma)的细胞外结构域。
[0115]
在一些实施方案中,抗体结合至人类bcma的同系物。在一些方面中,抗体结合至来自选自以下物种的人类bcma的同系物:猴、小鼠、狗、猫、大鼠、牛、马、山羊及绵羊。在一些方面中,同系物为食蟹猴同系物。在一些方面中,同系物为小鼠或鼠类同系物。
[0116]
在一些实施方案中,抗体包含轻链。在一些方面中,轻链为κ轻链。在一些方面中,轻链为λ轻链。在具体实施方案中,κ轻链包含含有seq id no:20所提供的氨基酸序列的恒定区。
[0117]
在一些实施方案中,抗体包含重链。在一些方面中,重链为iga。在一些方面中,重链为igd。在一些方面中,重链为ige。在一些方面中,重链为igg。在一些方面中,重链为igm。在一些方面中,重链为igg1。在一些方面中,重链为igg2。在一些方面中,重链为igg3。在一些方面中,重链为igg4。在一些方面中,重链为iga1。在一些方面中,重链为iga2。
[0118]
在一些实施方案中,抗体为抗体片段。在一些方面中,抗体片段为fv片段。在一些
方面中,抗体片段为fab片段。在一些方面中,抗体片段为f(ab
′
)2片段。在一些方面中,抗体片段为fab
′
片段。在一些方面中,抗体片段为scfv(sfv)片段。在一些方面中,抗体片段为scfv-fc片段。
[0119]
在一些实施方案中,抗体为单克隆抗体。在一些实施方案中,抗体为多克隆抗体。
[0120]
在一些实施方案中,抗体为嵌合抗体。在一些实施方案中,抗体为人类化抗体。在一些实施方案中,抗体为人类抗体。
[0121]
在一些实施方案中,抗体为亲和力成熟抗体。在一些方面中,抗体为源自本公开内容中所提供的说明性序列的亲和力成熟抗体。
[0122]
本文所提供的抗体结合物可用于治疗包括癌症在内的多种疾病及病状。在一些实施方案中,本文所提供的抗体结合物可用于治疗实体肿瘤的癌症。举例而言,本文所提供的抗体结合物可用于治疗结肠直肠癌。
[0123]
在一些实施方案中,抗体包含seq id no:13中所提供的vh序列、由其组成或基本上由其组成。在一些实施方案中,抗体包含seq id no:14中所提供的v
l
序列、由其组成或基本上由其组成。在一些实施方案中,抗体包含vh序列及v
l
序列。在一些方面中,vh序列为包含seq id no:13、由其组成或基本上由其组成的vh序列且v
l
序列为包含seq id no:14、由其组成或基本上由其组成的v
l
序列。在某些实施方案中,抗体包含seq id no:15中所提供的重链序列、由其组成或基本上由其组成。在具体实施方案中,重链序列(例如seq id no:15中所提供的重链序列)另外包含n末端甲硫氨酸。在某些实施方案中,此重链序列为由seq id no:16中所提供的核苷酸序列编码。在某些实施方案中,抗体包含seq id no:17中所提供的轻链序列、由其组成或基本上由其组成。在具体实施方案中,轻链序列(例如seq id no:17中所提供的轻链序列)另外包含n末端甲硫氨酸。在某些实施方案中,此轻链序列为由seq id no:18中所提供的核苷酸序列编码。
[0124]
在一些实施方案中,抗体包含下表5中所指示的六个cdr。在特定实施方案中,选择chothia cdr。在特定实施方案中,选择kabat cdr。
[0125]
表5.抗体2265-f02 cdr。
[0126]
在一些实施方案中,抗体包含以下中的三者:包含seq id no:5及6中的一者的cdr-h1;包含seq id no:7及8中的一者的cdr-h2;包含seq id no:9的cdr-h3;及以下中的一者、两者或全部三者:包含seq id no:10的cdr-l1;包含seq id no:11的cdr-l2;及包含seq id no:12的cdr-l3。在特定实施方案中,cdr为根据chothia。在特定实施方案中,cdr为根据kabat。5.种系
[0127]
在一些实施方案中,特异性结合bcma的抗体为包含由特定种系基因或其变体编码的可变区的抗体。本文所提供的说明性抗体包含由重链可变区种系基因vh1-18、vh3-33、vh2-5、vh2-70及vh4-30-4或其变体;及轻链可变区种系基因vκ1-5、vκ3-11、vκ2-20、vκ1-33
及vκ1-16或其变体编码的可变区。
[0128]
本领域技术人员将认识到,本文所提供的cdr序列在与由其他可变区种系基因或其变体编码的可变区组合时亦可为有用的。特定而言,本文所提供的cdr序列在与由结构上类似于上文所列举可变区种系基因的可变区种系基因或其变体编码的可变区组合时可为有用的。举例而言,在一些实施方案中,本文所提供的cdr-h序列可与由选自v
h 1、v
h 2、v
h 3或v
h 4家族或其变体的可变区种系基因编码的可变区组合。在一些实施方案中,本文所提供的cdr-l序列可与由选自vκ1、vκ2或vκ3或其变体的可变区种系基因编码的可变区组合。6.糖基化变体
[0129]
在某些实施方案中,可改变抗体以提高、减少或消除其糖基化的程度。多肽的糖基化通常为“n-连接”或“o-连接”。
[0130]“n-连接”的糖基化为指碳水化合物部分与天冬酰胺残基的侧链的连接。三肽序列天冬酰胺-x-丝氨酸及天冬酰胺-x-苏氨酸(其中x为除脯氨酸外的任一氨基酸)为碳水化合物部分与天冬酰胺侧链酶促连接的识别序列。因此,多肽中存在该等三肽序列中的任一者均可产生潜在糖基化位点。
[0131]“o-连接”的糖基化为指糖n-乙酰基半乳糖胺、半乳糖或木糖中的一者与羟基氨基酸(最常见为丝氨酸或苏氨酸,但亦可使用5-羟基脯氨酸或5-羟基离氨酸)的连接。
[0132]
将n-连接的糖基化位点添加至抗体或自抗体缺失n-连接的糖基化位点可通过改变氨基酸序列从而使得产生或移除上述三肽序列中的一或多者来实现。o-连接的糖基化位点的添加或缺失可通过在抗体序列中或向(任选)抗体序列中添加、缺失或取代一或多个丝氨酸或苏氨酸残基来实现。7.fc变体
[0133]
在某些实施方案中,可将氨基酸修饰引入至本文所提供抗体的fc区中,以生成fc区变体。在某些实施方案中,fc区变体具有一些但非全部效应功能。此等抗体可用于(例如)抗体在活体内的半衰期为重要的,但某些效应功能为不必要的或有害的应用中。效应功能的实施例包括补体依赖性细胞毒性(cdc)及抗体导向性补体介导的细胞毒性(adcc)。业内已知多种取代或具有改变的效应功能的取代或缺失。
[0134]
在一些实施方案中,fc在至少一个ch3序列中包含一或多个修饰。在一些实施方案中,fc在至少一个ch2序列中包含一或多个修饰。举例而言,fc可包括一或多个选自由以下组成的群的修饰:v262e、v262d、v262k、v262r、v262s、v264s、v303r及v305r。在一些实施方案中,fc为单一多肽。在一些实施方案中,fc为多个肽,例如两个多肽。fc区中的例示性修饰阐述于(例如)2017年6月14日提出申请的国际专利申请案第pct/us2017/037545号中。
[0135]
cdc及/或adcc活性的改变可使用活体外及/或活体内分析来确认。举例而言,可进行fc受体(fcr)结合分析来测量fcγr结合。用于介导adcc的原代细胞(nk细胞)仅表达fcγriii,而单核球表达fcγri、fcγrii及fcγriii。造血细胞上的fcr表达汇总于ravetch及kinet,ann.rev.immunol.,1991,9:457-492中,其为以全文引用的方式并入。
[0136]
用以评价所关注分子的adcc活性的活体外分析的非限制性实施例提供于美国专利第5,500,362号及第5,821,337号;hellstrom等人,proc.natl.acad.sci.u.s.a.,1986,83:7059-7063;hellstrom等人,proc.natl.acad.sci.u.s.a.,1985,82:1499-1502;及bruggemann等人,j.exp.med.,1987,166:1351-1361中;该等文献各自为以全文引用的方式
并入。用于此等分析的可用效应细胞包括外周血单核细胞(pbmc)及天然杀手(nk)细胞。或者或另外,所关注分子的adcc活性可在活体内使用例如clynes等人,proc.natl.acad.sci.u.s.a.,1998,95:652-656中所公开的动物模型来评价,该文献为以全文引用的方式并入。
[0137]
亦可实施c1q结合分析以确认抗体不能结合c1q且因此缺乏cdc活性。c1q结合分析的实施例包括wo 2006/029879及wo 2005/100402中所阐述的彼等分析,该等文献各自为以全文引用的方式并入。
[0138]
补体活化分析包括(例如)gazzano-santoro等人,j.immunol.methods,1996,202:163-171;cragg等人,blood,2003,101:1045-1052;以及cragg及glennie,blood,2004,103:2738-2743中所阐述的彼等分析;该等文献各自为以全文引用的方式并入。
[0139]
亦可(例如)使用petkova等人,intl.immunol.,2006,18:1759-1769中所阐述的方法来测量fcrn结合及活体内清除(半衰期测定),该文献为以全文引用的方式并入。8.经修饰氨基酸
[0140]
当抗体结合物包含经修饰氨基酸时,该经修饰氨基酸可为从业人员视为适宜的任一经修饰氨基酸。在特定实施方案中,经修饰氨基酸为对-叠氮基-甲基-l-苯丙氨酸(亦称为对甲基叠氮基苯丙氨酸)。在特定实施方案中,非天然氨基酸为化合物(30):或其盐。此等非天然氨基酸可呈盐形式。本领域技术人员将理解,对-叠氮基-甲基-l-苯丙氨酸残基的叠氮基部分与结合基团反应以形成稠合环状基团的三唑,该稠合环状基团为经由用于制备本文所阐述的某些结合物的应变促进的[3+2]炔烃-叠氮化物环加成反应形成的。9.抗体结合物的制备9.1.抗原制备
[0141]
用于分离抗体的bcma蛋白可为完整bcma或bcma的片段。完整bcma蛋白或bcma片段可呈经分离的蛋白质或由细胞表达的蛋白质的形式。可用于生成抗体的其他bcma形式将对本领域技术人员显而易见。9.2.单克隆抗体
[0142]
单克隆抗体可(例如)使用首次由kohler等人,nature,1975,256:495-497(其为以全文引用的方式并入)阐述的杂交瘤方法及/或通过重组dna方法(例如,参见美国专利第4,816,567号,其为以全文引用的方式并入)来获得。单克隆抗体亦可(例如)使用基于噬菌体或酵母的文库来获得。例如,参见美国专利第8,258,082号及第8,691,730号,该等专利各自
为以全文引用的方式并入。
[0143]
在杂交瘤方法中,对小鼠或其他适当宿主动物实施免疫以引发产生或能够产生抗体的淋巴球,该等抗体将特异性地结合至用于免疫的蛋白质。或者,可在活体外免疫淋巴球。然后使用适宜融合剂(例如聚乙二醇)将淋巴球与骨髓瘤细胞融合,以形成杂交瘤细胞。参见goding j.w.,monoclonal antibodies:principles and practice第3版(1986)academic press,san diego,ca,其为以全文引用的方式并入。
[0144]
将杂交瘤细胞接种于含有一或多种抑制未融合亲代骨髓瘤细胞的生长或存活的物质的适宜培养基中且使其在该培养基中生长。举例而言,若亲代骨髓瘤细胞缺少次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),则杂交瘤的培养基通常将包括次黄嘌呤、胺喋呤及胸苷(hat培养基),该等物质阻止hgprt缺陷型细胞的生长。
[0145]
可用骨髓瘤细胞系有效地融合、支持所选抗体产生细胞稳定大量地产生抗体且为敏感性培养基条件(例如存在或不存在hat培养基)的彼等细胞。在该等细胞中,优选骨髓瘤细胞株为鼠类骨髓瘤为,例如源自mop-21及mc-11小鼠肿瘤(可自salk institute cell distribution center,san diego,ca获得)及sp-2或x63-ag8-653细胞(可自american type culture collection,rockville,md获得)的彼等骨髓瘤为。亦已阐述用于产生人类单克隆抗体的人类骨髓瘤及小鼠-人类异源骨髓瘤细胞株。例如,参见kozbor,j.immunol.,1984,133:3001,其为以全文引用的方式并入。
[0146]
在鉴别出产生具有期望特异性、亲和力及/或生物活性的抗体的杂交瘤细胞后,所选纯为可通过限制性稀释程序经亚选殖且通过标准方法生长。参见goding,上文文献。出于此目的的适宜培养基包括(例如)d-mem或rpmi-1640培养基。另外,杂交瘤细胞可作为动物中的腹水肿瘤在活体内生长。
[0147]
编码单克隆抗体的dna可容易地使用习用程序分离并测序(例如,通过使用能够特异性地结合至编码单克隆抗体的重链及轻链的基因的寡核苷酸探针)。因此,杂交瘤细胞可用作编码具有期望性质的抗体的dna的可用来源。在分离后,可将dna置入表达载体中,然后将该等表达载体转染至宿主细胞中以产生单克隆抗体,该等宿主细胞系例如原本不会产生抗体的细菌(例如大肠杆菌(e.coli))、酵母(例如酵母菌属(saccharomyces)或毕赤酵母属(pichia sp.))、cos细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞。9.3.人类化抗体
[0148]
人类化抗体可通过用相应人类抗体序列替代非人类单克隆抗体的大多数或全部结构部分来生成。由此生成其中仅抗原特异性可变区或cdr为由非人类序列构成的杂合分子。获得人类化抗体的方法包括(例如)以下文献中所阐述的彼等方法:winter及milstein,nature,1991,349:293-299;rader等人,proc.nat.acad.sci.u.s.a.,1998,95:8910-8915;steinberger等人,j.biol.chem.,2000,275:36073-36078;queen等人,proc.natl.acad.sci.u.s.a.,1989,86:10029-10033;及美国专利第5,585,089号、第5,693,761号、第5,693,762号及第6,180,370号;该等文献各自为以全文引用的方式并入。9.4.人类抗体
[0149]
人类抗体可通过业内已知的多种技术来生成,例如通过使用转基因动物(例如人类化小鼠)。例如,参见jakobovits等人,proc.natl.acad.sci.u.s.a.,1993,90:2551;jakobovits等人,nature,1993,362:255-258;bruggermann等人,year in immuno.,1993,
7:33;及美国专利第5,591,669号、第5,589,369号及第5,545,807号;该等文献各自为以全文引用的方式并入。人类抗体亦可源自噬菌体展示文库(例如,参见hoogenboom等人,j.mol.biol.,1991,227:381-388;marks等人,j.mol.biol.,1991,222:581-597;及美国专利第5,565,332号及第5,573,905号;该等文献各自为以全文引用的方式并入)。人类抗体亦可通过活体外活化的b细胞来生成(例如,参见美国专利第5,567,610号及第5,229,275号,该等专利各自为以全文引用的方式并入)。人类抗体亦可源自基于酵母的文库(例如,参见美国专利第8,691,730号,其为以全文引用的方式并入)。9.5.结合
[0150]
抗体结合物可通过标准技术来制备。在某些实施方案中,使抗体与有效载荷前体在适于自抗体至有效载荷形成键的条件下接触,以形成抗体-有效载荷结合物。在某些实施方案中,使抗体与连接体前体在适于自抗体至连接体形成键的条件下接触。使所产生的抗体-连接体与有效载荷前体在适于自抗体-连接体至有效载荷形成键的条件下接触,以形成抗体-连接体-有效载荷结合物。在某些实施方案中,使有效载荷前体与连接体前体在适于自有效载荷至连接体形成键的条件下接触。使所产生的有效载荷-连接体与抗体在适于自有效载荷-连接体至抗体形成键的条件下接触,以形成抗体-连接体-有效载荷结合物。本文中公开用于制备抗体结合物的适宜连接体,且例示性结合条件阐述于下文实施例中。
[0151]
在一些实施方案中,抗bcma结合物为通过使如本文所公开的抗bcma抗体与具有结构(m)的连接体前体接触来制备:此一连接体前体可通过标准技术来制备或自商业来源获得,例如wo 2019/055931、wo 2019/055909、wo 2017/132617、wo 2017/132615,其各自为以全文引用的方式并入。
[0152]
应理解,来自本文所公开结合反应的结合物可能产生结合物的混合物,其中分布有一或多种连接至抗体的药物(例如pay部分)。个别结合物可在混合物中通过(例如)质谱术鉴别出且通过hplc(例如疏水相互作用层析)、包括业内已知的此等方法分离。在某些实施方案中,结合物的混合物包含占优结合物物种。在某些实施方案中,可例如通过电泳或层析自结合混合物分离出具有单一药物对抗体比率(dar)值的均质结合物。
[0153]
dar的范围可为每个结合物1至8个单位。亦可根据n确定dar的定量分布。在一些情形中,可通过诸如电泳等方式达成其中n为某一值的均质结合物的分离、纯化及表征。
[0154]
在某些实施方案中,本文所提供结合物的dar范围为1至8。在某些实施方案中,本文所提供结合物的dar范围为约2至约6;约3至约5。
[0155]
在一些实施方案中,本文所提供结合物的dar为约1。在一些实施方案中,本文所提
供结合物的dar为约2。在一些实施方案中,本文所提供结合物的dar为约2.5。在一些实施方案中,本文所提供结合物的dar为约3。在一些实施方案中,本文所提供结合物的dar为约3.5。在一些实施方案中,本文所提供结合物的dar为约4。在一些实施方案中,本文所提供结合物的dar为约3.0、约3.1、约3.2、约3.3、约3.4、约3.5、约3.6、约3.7、约3.8或约3.9。在一些实施方案中,本文所提供结合物的dar为约5。在一些实施方案中,本文所提供结合物的dar为约6。在一些实施方案中,本文所提供结合物的dar为约7。在一些实施方案中,本文所提供结合物的dar为约8。
[0156]
在一些优选实施方案中,本文所提供结合物的dar为约4。10.载体、宿主细胞及重组方法
[0157]
实施方案亦为关于提供编码抗bcma抗体的经分离核酸、包含该等核酸的载体及宿主细胞及用于产生该等抗体的重组技术。
[0158]
对于抗体的重组产生,可将编码其的核酸分离且插入至可复制载体中以进行进一步选殖(即扩增dna)或表达。在一些方面中,核酸可通过同源重组来产生,例如如美国专利第5,204,244号中所阐述,该专利为以全文引用的方式并入。
[0159]
许多不同载体为业内所已知。载体组分通常包括(但不限于)以下中的一或多者:信号序列、复制起点、一或多个标记物基因、增强子组件、启动子及转录终止序列,例如如美国专利第5,534,615号中所阐述,该专利为以全文引用的方式并入。
[0160]
适宜宿主细胞的说明性实施例提供于下文中。该等宿主细胞不意欲具有限制性。
[0161]
适宜宿主细胞包括任何原核细胞(例如细菌)、低等真核细胞(例如酵母)或高等真核细胞(例如哺乳动物)。适宜原核生物包括真细菌,例如革兰氏阴性(gram-negative)或革兰氏阳性生物体,例如肠杆菌科(enterobacteriaceae),例如大肠杆菌属(escherichia)(大肠杆菌)、肠杆菌属(enterobacter)、伊文氏杆菌属(erwinia)、克留氏菌属(klebsiella)、变形杆菌属(proteus)、沙门杆菌属(salmonella)(鼠伤寒沙门杆菌(s.typhimurium))、沙雷氏菌属(serratia)(黏质沙雷氏菌(s.marcescans))、志贺杆菌属(shigella)、杆菌属(bacilli)(枯草杆菌(b.subtilis)及地衣芽胞杆菌(b.licheniformis))、假单胞菌属(pseudomonas)(绿脓杆菌(p.aeruginosa))及链霉菌属(streptomyces)。其他可用大肠杆菌选殖宿主为大肠杆菌294,但诸如大肠杆菌b、大肠杆菌x1776及大肠杆菌w3110等其他菌株亦为适宜的。
[0162]
除原核生物以外,诸如丝状真菌或酵母等真核微生物亦为抗bcma抗体编码载体的适宜选殖或表达宿主。啤酒酵母(saccharomyces cerevisiae)或常见焙用酵母常用于低等真核宿主微生物。然而,可获得且可使用多种其他属、种及菌株,例如草地贪夜蛾(spodoptera frugiperda)(例如sf9)、粟酒裂殖酵母(schizosaccharomyces pombe)、克鲁维酵母属(kluyveromyces)(乳酸克鲁维酵母(k.lactis)、脆壁克鲁维酵母(k.fragilis)、干酪克鲁维酵母(k.bulgaricus)、威克海姆克鲁维酵母(k.wickeramii)、瓦尔特克鲁维酵母(k.waltii)、果蝇克鲁维酵母(k.drosophilarum)、耐热克鲁维酵母(k.thermotolerans)及马克斯克鲁维酵母(k.marxianus))、耶罗威亚酵母(yarrowia)、巴斯德毕赤酵母(pichia pastoris)、念珠菌属(candida)(白色念珠菌(c.albicans))、里氏木霉菌(trichoderma reesia)、红面包霉菌(neurospora crassa)、许旺酵母属(schwanniomyces)(西方许旺酵母(s.occidentalis))及丝状真菌(例如青霉菌属(penicillium)、弯颈霉属(tolypocladium)
及曲菌属(aspergillus)(小巢状曲菌(a.nidulans)及黑曲菌(a.niger)))。
[0163]
可用哺乳动物宿主细胞包括cos-7细胞、hek293细胞;幼小仓鼠肾(bhk)细胞;中国仓鼠卵巢(cho);小鼠赛特利细胞(sertoli cell);非洲绿猴肾细胞(vero-76)及诸如此类。
[0164]
用于产生本发明的抗bcma抗体的宿主细胞可在多种培养基中培养。市售培养基(例如ham’s f10、最小必需培养基(mem)、rpmi-1640及达尔伯克改良伊格尔培养基(dulbecco’s modified eagle’s medium,dmem))适于培养宿主细胞。另外,可使用以下文献中所阐述的任一培养基:ham等人,meth.enz.,1979,58:44;barnes等人,anal.biochem.,1980,102:255;及美国专利第4,767,704号、第4,657,866号、第4,927,762号、第4,560,655号及第5,122,469号或wo 90/03430及wo 87/00195。前述参考文献中的每一者为以全文引用的方式并入。
[0165]
该等培养基中的任一者可视需要补充有激素及/或其他生长因子(例如胰岛素、运铁蛋白或表皮生长因子)、盐(例如氯化钠、氯化钙、氯化镁及磷酸盐)、缓冲液(例如hepes)、核苷酸(例如腺苷及胸苷)、抗生素、微量元素(定义为通常以微摩尔浓度浓度范围内的最终浓度存在的无机化合物)及葡萄糖或等效能量来源。亦可包括本领域技术人员已知的适当浓度的任何其他所需补充剂。
[0166]
培养条件(例如温度、ph及诸如此类)为先前与经选择用于表达的宿主细胞一起使用的彼等条件,且将对本领域技术人员显而易见。
[0167]
在使用重组技术时,抗体可在细胞内、在周质空间中产生或直接分泌至培养基中。若抗体为在细胞内产生,则作为第一步骤,例如通过离心或超滤去除微粒碎片,即宿主细胞或溶解片段。举例而言,carter等人(bio/technology,1992,10:163-167)阐述用于分离分泌至大肠杆菌周质空间的抗体的程序。简言之,使细胞团在乙酸钠(ph 3.5)、edta及苯甲基磺酰氟(pmsf)存在下经约30min解冻。可通过离心去除细胞碎片。
[0168]
在一些实施方案中,抗体为在无细胞系统中产生。在一些方面中,无细胞系统为如yin等人,mabs,2012,4:217-225中所阐述的活体外转录及转译系统,该文献为以全文引用的方式并入。在一些方面中,无细胞系统利用来自真核细胞或来自原核细胞的无细胞提取物。在一些方面中,原核细胞系大肠杆菌。抗体的无细胞表达在例如以下情形中可为有用的:抗体在细胞中累积为不溶性聚集体或来自周质表达的产量较低。无细胞系统中所产生的抗体可为无糖基化的,此取决于细胞的来源。
[0169]
倘若抗体分泌至培养基中,则通常首先使用市售蛋白质浓缩过滤器(例如或超滤单元)来浓缩来自此等表达系统的上清液。可在任一前述步骤中纳入诸如pmsf等蛋白酶抑制剂以抑制蛋白水解,且可纳入抗生素以防止外来污染物生长。
[0170]
可使用(例如)羟磷灰石层析、凝胶电泳、透析及亲和层析来纯化自细胞制备的抗体组合物,其中亲和层析为尤其有用的纯化技术。蛋白质a作为亲和配体的适宜性取决于抗体中所存在的任一免疫球蛋白fc结构域的种类及同型。蛋白质a可用于纯化基于人类γ1、γ2或γ4重链的抗体(lindmark等人,j.immunol.meth.,1983,62:1-13,其为以全文引用的方式并入)。蛋白质g可用于所有小鼠同型及人类γ3(guss等人,embo j.,1986,5:1567-1575,其为以全文引用的方式并入)。
[0171]
亲和配体所连接的基质最常为琼脂糖,但亦可使用其他基质。机械稳定基质(例如
定孔玻璃或聚(苯乙烯二乙烯基)苯)容许达成比使用琼脂糖可达成更快的流速及更短的处理时间。倘若抗体包含ch3结构域,则bakerbond树脂可用于纯化。
[0172]
亦可使用其他蛋白质纯化技术,例如在离子交换管柱上分级分离、乙醇沈淀、反相hplc、在二氧化硅上层析、在肝素上层析、层析聚焦、sds-page及硫酸铵沈淀,且可由本领域技术人员施加。
[0173]
在任何初步纯化步骤后,可使用ph介于约2.5至约4.5之间的溶析缓冲液使包含所关注抗体及污染物的混合物经受低ph疏水相互作用层析,其通常为在低盐浓度(例如约0m至约0.25m盐)下实施。11.药物组合物及投与方法
[0174]
可使用业内可获得的方法及本文所公开的彼等方法将本文所提供的抗体结合物调配成药物组合物。本文所提供的任一抗体结合物均可以适当药物组合物提供且通过适宜投与途径来投与。
[0175]
本文所提供的方法涵盖投与包含至少一种本文所提供的抗体结合物及一或多种兼容且药物上可接受的载剂的药物组合物。在此背景中,术语“药物上可接受”意指已经联邦或州政府的管理机构批准或列示于美国药典(u.s.pharmacopeia)或其他公认药典中用于动物且更特定而言用于人类中。术语“载剂”包括与治疗剂一起投与的稀释剂、佐剂(例如弗氏佐剂(freund’s adjuvant)(完全及不完全))、赋形剂或媒剂。此等药物载剂可为无菌液体,例如水及油,包括石油、动物、植物或合成起源的彼等油,例如花生油、大豆油、矿物油、芝麻油及诸如此类。当静脉内投与药物组合物时,可使用水作为载剂。亦可采用盐水溶液及右旋糖水溶液及甘油溶液作为液体载剂、特定而言用于可注射溶液。适宜药物载剂的实施例阐述于martin,e.w.,remington’s pharmaceutical sciences中。
[0176]
在临床实践中,本文所提供的药物组合物或抗体结合物可通过业内已知的任何途径来投与。例示性投与途径包括(但不限于)吸入、动脉内、真皮内、肌内、腹膜内、静脉内、经鼻、非经肠、经肺及皮下途径。在一些实施方案中,非经肠投与本文所提供的药物组合物或抗体结合物。
[0177]
用于非经肠投与的组合物可为乳液或无菌溶液。非经肠组合物可包括(例如)丙二醇、聚乙二醇、植物油及可注射的有机酯(例如油酸乙酯)。该等组合物亦可含有润湿剂、等渗剂、乳化剂、分散剂及稳定剂。可以若干种方式来进行灭菌,例如使用细菌过滤器、通过辐射或通过加热。非经肠组合物亦可以无菌固体组合物的形式来制备,可将其在使用时溶解于无菌水或任何其他可注射的无菌介质中。
[0178]
在一些实施方案中,本文所提供的组合物为药物组合物或单一单位剂型。本文所提供的药物组合物及单一单位剂型包含预防或治疗有效量的一或多种预防性或治疗性抗体结合物。
[0179]
药物组合物可包含一或多种药物赋形剂。可使用任何适宜药物赋形剂,且本领域技术人员能够选择适宜药物赋形剂。适宜赋形剂的非限制性实施例包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石、氯化钠、脱脂乳粉、甘油、丙二醇、水、乙醇及诸如此类。特定赋形剂是否适于并入至药物组合物或剂型中取决于业内所熟知的多种因素,包括(但不限于)剂型将投与个体的方式及剂型中的具体抗体。若期望,组合物或单一单位剂型亦可含有极少量的润湿剂或乳化剂或ph缓冲剂。因此,
下文所提供的药物赋形剂意欲为说明性的,且不具有限制性。其他药物赋形剂包括(例如)handbook of pharmaceutical excipients,rowe等人(编辑)第6版(2009)中所阐述的彼等药物赋形剂,该文献为以全文引用的方式并入。
[0180]
在一些实施方案中,药物组合物包含消泡剂。可使用任何适宜消泡剂。在一些方面中,消泡剂为选自醇、醚、油、蜡、聚硅氧、表面活性剂及其组合。在一些方面中,消泡剂为选自矿物油、植物油、亚乙基双硬脂酰胺、石蜡、酯蜡、脂肪醇蜡、长链脂肪醇、脂肪酸皂、脂肪酸酯、硅二醇、氟聚硅氧、聚乙二醇-聚丙二醇共聚物、聚二甲基硅氧烷-二氧化硅、乙醚、辛基醇、辛酰基醇、去水山梨醇三油酸酯、乙醇、2-乙基-己醇、聚二甲基硅氧烷、油醇、二甲基硅油及其组合。
[0181]
在一些实施方案中,药物组合物包含共溶剂。共溶剂的说明性实施例包括乙醇、聚(乙)二醇、丁二醇、二甲基乙酰胺、甘油及丙二醇。
[0182]
在一些实施方案中,药物组合物包含缓冲剂。缓冲剂的说明性实施例包括乙酸盐、硼酸盐、碳酸盐、乳酸盐、苹果酸盐、磷酸盐、柠檬酸盐、氢氧化物、二乙醇胺、单乙醇胺、甘氨酸、甲硫氨酸、瓜尔胶及麸氨酸单钠。
[0183]
在一些实施方案中,药物组合物包含载剂或填充剂。载剂或填充剂的说明性实施例包括乳糖、麦芽糊精、甘露醇、山梨醇、几丁聚糖、硬脂酸、黄原胶及瓜尔胶。
[0184]
在一些实施方案中,药物组合物包含表面活性剂。表面活性剂的说明性实施例包括d-α生育酚、苯扎氯铵(benzalkonium chloride)、苄索氯铵(benzethonium chloride)、溴化十六烷基三甲铵、氯化鲸蜡基吡啶鎓、多库酯钠、山嵛酸甘油酯、单油酸甘油酯、月桂酸、15羟基硬脂酸聚乙二醇酯、肉豆蔻基醇、磷脂、聚氧乙烯烷基醚、聚氧乙烯去水山梨醇脂肪酸酯、聚氧乙烯硬脂酸酯、聚烃氧基甘油酯、月桂基硫酸钠、去水山梨醇酯及维生素e聚乙烯(二醇)琥珀酸酯。
[0185]
在一些实施方案中,药物组合物包含抗结块剂。抗结块剂的说明性实施例包括磷酸(三)钙、羟甲基纤维素、羟丙基纤维素及氧化镁。
[0186]
可与药物组合物一起使用的其他赋形剂包括(例如)白蛋白、抗氧化剂、抗细菌剂、抗真菌剂、生物吸收性聚合物、螯合剂、控制释放剂、稀释剂、分散剂、溶解增强剂、乳化剂、胶凝剂、软膏基、渗透促进剂、防腐剂、增溶剂、溶剂、稳定剂及糖。该等药剂中的每一者的具体实施例阐述于(例如)handbook of pharmaceutical excipients,rowe等人(编辑)第6版(2009),the pharmaceutical press中,该文献为以全文引用的方式并入。
[0187]
在一些实施方案中,药物组合物包含溶剂。在一些方面中,溶剂为盐水溶液,例如无菌等渗盐水溶液或右旋糖溶液。在一些方面中,溶剂为注射用水。
[0188]
在一些实施方案中,药物组合物为呈微粒形式,例如微观粒子或奈米粒子。微观粒子及奈米粒子可自任何适宜材料(例如聚合物或脂质)形成。在一些方面中,微观粒子或奈米粒子为胶束、脂质体或聚合物囊泡。
[0189]
本文进一步提供包含抗体结合物的无水药物组合物及剂型,此乃因在一些实施方案中,水可促进一些抗体的降解。
[0190]
可使用无水或含低水分的成分及低水分或低湿度条件来制备本文所提供的无水药物组合物及剂型。若预期在制造、包装及/或储存期间与水分及/或湿度实质接触,则包含乳糖及至少一种包含一级或二级胺的活性成分的药物组合物及剂型可为无水的。
[0191]
无水药物组合物可经制备及储存使得其无水性质得以维持。因此,可使用已知防止暴露于水的材料来包装无水组合物,使得其可纳入适宜配方试剂盒中。适宜包装的实施例包括(但不限于)气密性密封箔、塑料、单位剂量容器(例如小瓶)、泡罩包装及条带包装。
[0192]
本文所提供的无乳糖组合物可包含业内所熟知且列示于(例如)美国药典(usp)sp(xxi)/nf(xvi)中的赋形剂。一般而言,无乳糖组合物包含药物上兼容及药物上可接受量的活性成分、黏合剂/填充剂及润滑剂。例示性无乳糖剂型包含活性成分、微晶纤维素、预胶化淀粉及硬脂酸镁。
[0193]
亦提供药物组合物及剂型,其包含一或多种降低抗体或抗体结合物将分解的速率的赋形剂。本文称为“稳定剂”的此等赋形剂包括(但不限于)抗氧化剂(例如抗坏血酸)、ph缓冲剂或盐缓冲剂。11.1.非经肠剂型
[0194]
在某些实施方案中,提供非经肠剂型。非经肠剂型可通过各种途径投与给个体,该等途径包括(但不限于)皮下、静脉内(包括浓注注射)、肌内及动脉内。由于其投与通常绕过个体针对污染物的天然防御,故非经肠剂型通常为无菌的或能够在投与给个体之前经灭菌。非经肠剂型的实施例包括(但不限于)即注射型溶液、欲溶解或悬浮于药物上可接受的媒剂中的即注射型无水产品、即注射型悬浮液及乳液。
[0195]
可用于提供非经肠剂型的适宜媒剂为本领域技术人员所熟知。实施例包括(但不限于)usp注射用水;水性媒剂,例如(但不限于)氯化钠注射液、林格氏注射液(ringer’s injection)、右旋糖注射液、右旋糖及氯化钠注射液以及乳酸化林格氏注射液;水可混溶性媒剂,例如(但不限于)乙醇、聚乙二醇及聚丙二醇;及非水性媒剂,例如(但不限于)玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯及苯甲酸苄基酯。
[0196]
亦可将提高一或多种本文所公开抗体的溶解度的赋形剂纳入至非经肠剂型中。11.2.剂量及单位剂型
[0197]
在人类治疗学中,医师将根据预防性或治愈性治疗且根据欲治疗个体所特有的年龄、体重、病状及其他因素有来确定其认为最适当的剂量学。
[0198]
在某些实施方案中,本文所提供的组合物为药物组合物或单一单位剂型。本文所提供的药物组合物及单一单位剂型包含预防或治疗有效量的一或多种预防性或治疗性抗体。
[0199]
将有效地预防或治疗病症或其一或多种症状的抗体结合物或组合物的量将随疾病或病状的性质及严重程度以及抗体的投与途径而变化。频率及剂量亦将根据每一个体所特有的因素取决于所投与的具体疗法(例如治疗剂或预防剂)、病症、疾病或病状的严重程度、投与途径以及个体的年龄、身体、体重、反应及过去病历而变化。可根据源自活体外或动物模型测试系统的剂量-反应曲线来推断有效剂量。
[0200]
在某些实施方案中,组合物的例示性剂量包括毫克或微克量的抗体/公斤个体或样品重量(例如约10微克/公斤至约50毫克/公斤、约100微克/公斤至约25毫克/公斤或约100微克/公斤至约10毫克/公斤)。在某些实施方案中,基于抗体的重量,投与以预防、治疗、管控或改善个体的病症或其一或多种症状的本文所提供抗体结合物的剂量为0.1mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、10mg/kg或15mg/kg或以上的个体体重。在另一实施方案中,投与以预防、治疗、管控或改善个体的病症或其一或多种症状的本文所提
供组合物或组合物的剂量为0.1mg至200mg、0.1mg至100mg、0.1mg至50mg、0.1mg至25mg、0.1mg至20mg、0.1mg至15mg、0.1mg至10mg、0.1mg至7.5mg、0.1mg至5mg、0.1至2.5mg、0.25mg至20mg、0.25至15mg、0.25至12mg、0.25至10mg、0.25mg至7.5mg、0.25mg至5mg、0.25mg至2.5mg、0.5mg至20mg、0.5至15mg、0.5至12mg、0.5至10mg、0.5mg至7.5mg、0.5mg至5mg、0.5mg至2.5mg、1mg至20mg、1mg至15mg、1mg至12mg、1mg至10mg、1mg至7.5mg、1mg至5mg或1mg至2.5mg。
[0201]
剂量可根据适宜时间表来投与,例如每周一次、两次、三次或四次。在一些情形中可能需要使用在本文所公开范围以外的抗体结合物剂量,如本领域技术人员将显而易见。此外,应注意,临床医师或治疗医师将结合个体反应知晓如何及何时中断、调整或终止疗法。
[0202]
不同的治疗有效量可适用于不同的疾病及病状,如本领域技术人员容易地知晓。类似地,本文所阐述的剂量量及剂量频率时间表亦涵盖足以预防、管控、治疗或改善此等病症、但不足以引起或足以减轻与本文所提供抗体相关的不良效应的量。此外,当向个体投与多个剂量的本文所提供组合物时,所有剂量无需相同。举例而言,可提高投与给个体的剂量以改良组合物的预防或治疗效应,或可降低剂量以减少特定个体正经历的一或多种副作用。
[0203]
在某些实施方案中,治疗或预防可以一或多个负载剂量的本文所提供抗体结合物或组合物起始、的后为一或多个维持剂量。
[0204]
在某些实施方案中,可投与一定剂量的本文所提供抗体结合物或组合物以在个体的血液或血清中达成抗体的稳态浓度。稳态浓度可通过根据本领域技术人员可获得的技术测量来测定或可基于个体的身体特征(例如身高、体重及年龄)。
[0205]
在某些实施方案中,可重复投与相同组合物且投与可间隔至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或6个月。在其他实施方案中,可重复投与相同预防或治疗剂且投与可间隔至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或6个月。11.3.组合疗法及调配物
[0206]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与本文所公开的一或多种化学治疗剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等组合的治疗方法。化学治疗剂的实施例包括(但不限于)苯达莫司汀(bendamustine)(cephalon);维奈托克(venetoclax)(abbvie,genentech);地诺单抗(denosumab)(amgen;amgen);卡非佐米(carfilzomib)(amgen);伊沙佐米(ixazomib)(takeda);厄洛替尼(erlotinib)(genentech/osi pharm.);硼替佐米(bortezomib)(millennium pharm.);氟维司群(fulvestrant)(astrazeneca);舒癌特(sutent)(su11248,pfizer);来曲唑(letrozole)(novartis);甲磺酸伊马替尼(imatinib mesylate)(novartis);ptk787/zk 222584(novartis);奥沙利铂(oxaliplatin)(sanofi);5-fu(5-氟尿嘧啶);甲酰四氢叶酸
(leucovorin);雷帕霉素(rapamycin)(西罗莫司(sirolimus)、wyeth);拉帕替尼(lapatinib)(gsk572016,glaxo smith kline);洛那法尼(lonafarnib)(sch 66336);索拉非尼(sorafenib)(bay43-9006,bayer labs)及吉非替尼(gefitinib)(astrazeneca);ag1478;ag1571(su 5271;sugen);烷基化剂,例如噻替派(thiotepa)及环磷酰胺;磺酸烷基酯,例如白消安(busulfan)、英丙舒凡(improsulfan)及哌泊舒凡(piposulfan);氮丙啶(aziridine),例如苯并多巴(benzodopa)、卡波醌(carboquone)、美托达帕(meturedopa)及尤里达帕(uredopa);亚乙亚胺及甲基三聚氰胺,包括六甲蜜胺(altretamine)、三亚乙基三聚氰胺、三亚乙基磷酰胺、三亚乙基硫磷酰胺及三甲基三聚氰胺;多聚乙酰(尤其布拉他辛(bullatacin)及布拉他辛酮(bullatacinone));喜树碱(camptothecin)(包括合成类似物托泊替康(topotecan));苔藓虫素(bryostatin);卡利斯他汀(callystatin);cc-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)及比折来新(bizelesin)合成类似物);念珠藻素(cryptophycin)(特定而言念珠藻素1及念珠藻素8);尾海兔素(dolastatin);倍癌霉素(duocarmycin)(包括合成类似物kw-2189及cb1-tm1);艾榴塞洛素(eleutherobin);水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥,例如苯丁酸氮芥(chlorambucil)、萘氮芥(chlomaphazine)、氯磷酰胺、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、甲基二氯乙基胺、氧化氮芥盐酸盐、美法仑(melphalan)、新氮芥(novembichin)、胆甾醇对苯乙酸氮芥(phenesterine)、泼尼莫司汀(prednimustine)、曲磷胺(trofosfamide)、尿嘧啶氮芥;亚硝基脲,例如卡莫司汀(carmustine)、氯脲菌素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)及雷莫司汀(ranimnustine);抗生素,例如烯二炔类抗生素(例如卡奇霉素(calicheamicin),尤其昂塞拉霉素(uncialamycin)、卡奇霉素γ1i及卡奇霉素ωi1(angew chem.intl.ed.engl.(1994)33:183-186);达内霉素(dynemicin),包括达内霉素a;双磷酸盐,例如氯膦酸盐(clodronate);埃斯波霉素(esperamicin);以及新制癌菌素(neocarzinostatin)发色团及相关色蛋白烯二炔抗生素发色团)、阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、安曲霉素(authramycin)、偶氮丝氨酸、博来霉素(bleomycin)、放线菌素c(cactinomycin)、卡雷比素(carabicin)、洋红霉素(caminomycin)、嗜癌霉素(carzinophilin)、色霉素(chromomycinis)、放线菌素d(dactinomycin)、道诺霉素(daunorubicin)、地托比星(detorubicin)、6-重氮基-5-氧代基-l-正白氨酸、(多柔比星(doxorubicin))、吗啉基-多柔比星、氰基吗啉基-多柔比星、2-吡咯啉基-多柔比星及脱氧多柔比星、表柔比星(epirubicin)、依索比星(esorubicin)、伊达比星(idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素(mitomycin)(例如丝裂霉素c)、霉酚酸(mycophenolic acid)、诺拉霉素(nogalamycin)、橄榄霉素(olivomycin)、培洛霉素(peplomycin)、泊非霉素(porfiromycin)、嘌呤霉素(puromycin)、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链黑霉素(streptonigrin)、链脲霉素(streptozocin)、杀结核菌素(tubercidin)、乌苯美司(ubenimex)、净司他汀(zinostatin)、佐柔比星(zorubicin);抗代谢物,例如胺甲喋呤及5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸(denopterin)、胺甲喋呤、普拉地内酯b
(pladienolide b)、蝶罗呤(pteropterin)、三甲曲沙(trimetrexate);嘌呤类似物,例如氟达拉滨(fludarabine)、6-巯嘌呤、硫咪嘌呤(thiamniprine)、硫鸟嘌呤;嘧啶类似物,例如安西他滨(ancitabine)、阿扎胞苷(azacitidine)、6-阿扎尿苷(6-azauridine)、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、二脱氧尿苷、脱氧氟尿苷、依诺他滨(enocitabine)、氟尿苷;雄激素,例如卡普睪酮(calusterone)、丙酸屈他雄酮(dromostanolone propionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睪内酯;抗肾上腺剂,例如胺鲁米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂,例如亚叶酸;醋葡醛内酯(aceglatone);醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶(amsacrine);倍曲布西(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);地磷酰胺(defofamine);秋水仙胺(demecolcine);地吖醌(diaziquone);依氟鸟氨酸(elformithine);依利醋铵(elliptinium acetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidainine);类美坦素(maytansinoid),例如美坦辛(maytansine)及安丝菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidanmol);硝胺丙吖啶(nitraerine);喷司他汀(pentostatin);蛋胺氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸2-乙肼;丙卡巴肼(procarbazine);多糖复合体(jhs natural products,eugene,oreg.);雷佐生(razoxane);利索新(rhizoxin);西左非兰(sizofuran);锗螺胺(spirogermanium);替奴佐酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2
”‑
三氯三乙胺;单端孢霉烯(trichothecene)(尤其t-2毒素、疣疱菌素a(verracurin a)、杆孢菌素a(roridin a)及蛇形菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达喀尔巴嗪(dacarbazine);甘露莫司汀(mannomustine);二溴甘露醇;二溴卫矛醇;哌泊溴烷(pipobroman);加赛特辛(gacytosine);阿拉伯糖苷(“ara-c”);环磷酰胺;噻替派;类紫杉烷,例如(太平洋紫杉醇(paclitaxel);bristol-myers squibb oncology,princeton,n.j.)、(不含克列莫佛(cremophor-free))、太平洋紫杉醇的白蛋白工程改造型奈米粒子调配物(american pharmaceutical partners,schaumberg,ill.)及(多西他赛(doxetaxel);rhone-poulenc rorer,antony,france);苯丁酸氮芥;(吉西他滨(gemcitabine));6-硫鸟嘌呤;巯嘌呤;胺甲喋呤;铂类似物,例如顺铂(cisplatin)及卡铂(carboplatin);长春碱(vinblastine);依托泊苷(etoposide)(vp-16);异环磷酰胺;米托蒽醌;长春新碱(vincristine);(长春瑞滨(vinorelbine));能灭瘤(novantrone);替尼泊苷(teniposide);依达曲沙;道诺霉素(daunomycin);胺喋呤;卡培他滨(capecitabine)伊班膦酸盐(ibandronate);cpt-11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);类视色素,例如视黄酸;及上述任一者的药物上可接受的盐、酸及衍生物。
[0207]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与一或多种pd-1或pd-l1抑制剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等组合的治疗方法。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂包含pd-1或pd-l1路径的小分子阻断剂。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂包含抑制
pd-1或pd-l1活性的抗体。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂为选自由以下组成的群:ca-170、bms-8、bms-202、bms-936558、ck-301及aunp12。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂为选自由以下组成的群:阿维鲁单抗(avelumab)、尼沃鲁单抗(nivolumab)、派姆单抗(pembrolizumab)、阿替珠单抗(atezolizumab)、德瓦鲁单抗(durvalumab)、amp-224(glaxosmithkline)、medi0680/amp-514(astrazeneca)、pdr001(novartis)、塞米匹单抗(cemiplimab)、tsr-042(tesaro,glaxosmithkline)、替雷珠单抗(tizlelizumab)/bgb-a317(beigene)、ck-301(checkpoint therapeutics)、bms-936559(bristol-meyers squibb)、塞米匹单抗(regeneron)、卡瑞利珠单抗(camrelizumab)、信迪利单抗(sintilimab)、特瑞普利单抗(toripalimab)、杰诺珠单抗(genolimzumab)及a167(sichuan kelun-biotech biopharmaceutical)。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂为选自由以下组成的群:mga012(incyte/macrogenics)、pf-06801591(pfizer/merck kgaa)、ly3300054(eli lilly)、faz053(novartis)、pd-11(novartis)、cx-072(cytomx)、bgb-a333(beigene)、bi 754091(boehringer ingelheim)、jnj-63723283(johnson and johnson/jannsen)、agen2034(agenus)、ca-327(curis)、cx-188(cytomx)、sti-a1110(servier)、jtx-4014(jounce)、am0001(armo biosciences、eli lilly)、cbt-502(cbt pharmaceuticals)、fs118(f-star/merck kgaa)、xmab20717(xencor)、xmab23104(xencor)、ab122(arcus biosciences)、ky1003(kymab)、rxi-762(rxi)。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂为选自由以下组成的群:prs-332(pieris pharmaceuticals)、alpn-202(alpine immune science)、tsr-075(tesaro/anaptys bio)、mcla-145(merus)、mgd013(macrogenics)、mgd019(macrogenics)、ro7121661(hoffman-la roche)、ly3415244(eli lilly)。在一些实施方案中,该一或多种pd-1或pd-l1抑制剂为选自(例如)wo 2016/077397、wo 2018/156777及于2018年5月23日提出申请的国际申请案第pct/us2013/034213号中所阐述的抗pd1单特异性或双特异性抗体。
[0208]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与一或多种lag3抑制剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等组合的治疗方法。在一些实施方案中,该一或多种lag3抑制剂包含lag3路径的小分子阻断剂。在一些实施方案中,该一或多种lag3抑制剂包含抑制lag3活性的抗体。在一些实施方案中,该一或多种lag3抑制剂为选自由以下组成的群:imp321(依法拉吉莫德α(eftilagimod alpha),immutep)、瑞来单抗(relatilimab)(brisol-myers squibb)、lag525(novartis)、mk4280(merck)、bi 754111(boehringer ingelheim)、regn3767(regeneron/sanofi)、sym022(symphogen)及tsr-033(tesaro/gsk)。
[0209]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与一或多种tim3抑制剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等组合的治疗方法。在一些实施方案中,该一或多种tim3抑制剂包含tim3路径的小分子阻断剂。在一些实施方案中,该一或多种tim3抑制剂包含抑制tim3活性的抗体。在一些实施方案中,该一或多种tim3抑制剂为选自由以下组成的群:tsr-022(tesaro)、ly3321367(eli lilly)、sym023(symphogen)及mbg453(novartis)。
[0210]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与一或多种cd73抑制剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等
组合的治疗方法。在一些实施方案中,该一或多种cd73抑制剂包含cd73路径的小分子阻断剂。在一些实施方案中,该一或多种cd73抑制剂包含抑制cd73活性的抗体。在一些实施方案中,该一或多种cd73抑制剂为选自由以下组成的群:medi9447(medimmune)、ab680(arcus)及bms-986179(bristol-myers squibb)。
[0211]
在某些实施方案中,提供包含本文所提供的任一抗体结合物与一或多种cd39抑制剂的组合的组合物、治疗性调配物及治疗方法或用途,以及包含向有需要的个体投与此等组合的治疗方法。在一些实施方案中,该一或多种cd39抑制剂包含cd39路径的小分子阻断剂。在一些实施方案中,该一或多种cd39抑制剂包含抑制cd39活性的抗体。在一些实施方案中,该一或多种cd39抑制剂为选自由以下组成的群:cpi-444(corvus)、pbf-509(pablobio,novartis)、mk-3814(merck)及azd4635(astrazeneca)。
[0212]
在某些实施方案中,本文所提供的抗体结合物为与(硼替佐米)、(卡非佐米)、(阿西佐米(ixazomib))组合投与。在某些实施方案中,本文所提供的抗体结合物为与(帕比司他(panobinostat))组合投与。在某些实施方案中,本文所提供的抗体结合物为与(达雷木单抗)组合投与。在某些实施方案中,本文所提供的抗体结合物为与(埃罗妥珠单抗(elotuzumab))组合投与。在某些实施方案中,本文所提供的抗体结合物为与(帕米膦酸(pamidronate))或(唑来膦酸(zolendronic acid))组合投与。在某些实施方案中,本文所提供的抗体结合物为与(地诺单抗)或(地诺单抗)组合投与。
[0213]
在某些实施方案中,本文所提供的抗体结合物为与γ分泌酶抑制剂(gsi)组合投与,该抑制剂为例如阿伽司他(avagacestat)(bms-708163;bristol-myers squib)、mk-0752(merck&co.)、r04929097(roche)、瑟伽司他(semagacestat)(ly-450139;eli lilly&co.)、dapt(n-[n-(3,5-二氟苯基乙酰基-l-丙胺酰基)]-s-苯基甘氨酸叔丁基酯)、l685,458、化合物e((s,s)-2-(3,5-二氟苯基)-乙酰基氨基1-n-(1-甲基-2-氧代基-5-苯基-2,3-二氢-1h-苯并[e][1,4]二氮杂卓-3-基)-丙酰胺)、dbz(二苯并氮杂卓)、jlk6(7-氨基-4-氯-3-甲氧基异香豆素)或[11-内]-n-(5,6,7,8,9,10-六氢-6,9-桥亚甲基苯并[9][8]轮烯-11-基)-噻吩-2-磺酰胺。
[0214]
与本文所公开的抗体结合物组合的药剂可在该等抗体结合物即将投与之前、与其同时或在其后不久投与。在某些实施方案中,本文所提供的抗体结合物为以第一投药时间表投与,且一或多种第二药剂为以其自身投药时间表投与。出于本公开内容的目的,此等投与方案视为抗体结合物与额外治疗活性组分的“组合”投与。实施方案包括其中本文所公开的抗体结合物与本文所公开的化学治疗剂、pd-1抑制剂或pd-l1抑制剂中的一或多者共调配的药物组合物。12.治疗应用
[0215]
对于治疗应用,本发明的抗体结合物为以药物上可接受的剂型(例如业内已知的彼等剂型及上文所论述的彼等剂型)投与给哺乳动物、通常人类。举例而言,本发明的抗体结合物可以浓注形式静脉内投与给人类或通过在一段时间内连续输注、通过肌内、腹膜内、脑脊内、皮下、关节内、滑膜内、鞘内或肿瘤内途径投与给人类。抗体结合物亦适宜地通过瘤
周、病灶内或病灶周围途径来投与,以发挥局部以及全身性治疗效应。腹膜内途径可尤其用于(例如)治疗卵巢肿瘤。
[0216]
本文所提供的抗体结合物可用于治疗涉及bcma的任何疾病或病状。在一些实施方案中,疾病或病状为可通过bcma的过表达诊断的疾病或病状。在一些实施方案中,疾病或病状为可受益于利用抗bcma抗体治疗的疾病或病状。在一些实施方案中,疾病或病状为癌症。在一些实施方案中,疾病或病状为白血病、淋巴瘤或多发性骨髓瘤。
[0217]
可利用本文所提供的抗体结合物治疗任何适宜癌症。说明性适宜癌症包括(例如)急性淋巴母细胞性白血病(all)、急性类骨髓性白血病(aml)、肾上腺皮质癌、肛门癌、阑尾癌、星细胞瘤、基底细胞癌、脑瘤、胆管癌、膀胱癌、骨癌、乳癌、支气管肿瘤、未知原发性起源癌、心脏肿瘤、子宫颈癌、脊索瘤、结肠癌、结肠直肠癌、颅咽管瘤、导管癌、胚胎瘤、子宫内膜癌、室管膜瘤、食管癌、敏感性神经胚细胞瘤、纤维性组织细胞瘤、尤恩氏肉瘤(ewing sarcoma)、眼癌、生殖细胞瘤、胆囊癌、胃癌、胃肠类癌性肿瘤、胃肠基质瘤、妊娠滋养层疾病、神经胶质瘤、头颈癌、肝细胞癌症、组织球增生症、霍奇金氏淋巴瘤(hodgkin lymphoma)、下咽癌、眼内黑色素瘤、胰岛细胞肿瘤、卡波西氏肉瘤(kaposi sarcoma)、肾癌、兰格罕细胞组织球增生症(langerhans cell histiocytosis)、喉癌、唇及口腔癌、肝癌、小叶原位癌、肺癌、巨球蛋白血症、恶性纤维性组织细胞瘤、黑色素瘤、默克细胞癌(merkel cell carcinoma)、间皮瘤、隐匿性原发性转移性鳞状颈癌、涉及nut基因的中线道癌、口癌、多发性内分泌赘瘤形成症候群、多发性骨髓瘤、蕈状肉芽肿、骨髓发育不良症候群、骨髓发育不良/骨髓增生性赘瘤、鼻腔及副鼻窦癌、鼻咽癌、神经胚细胞瘤、非小细胞肺癌、口咽癌、骨肉瘤、卵巢癌、胰脏癌、乳头状瘤病、副神经节瘤、副甲状腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、胸膜肺母细胞瘤、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌、肾盂及输尿管癌、视网膜母细胞瘤、横纹肌样瘤、唾液腺癌、塞扎里症候群(sezary syndrome)、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、脊髓瘤、胃癌、t细胞淋巴瘤、类畸胎瘤、睪丸癌、喉癌、胸腺瘤及胸腺癌、甲状腺癌、尿道癌、子宫癌、阴道癌、外阴癌及威尔姆氏肿瘤(wilms tumor)。
[0218]
在一些实施方案中,欲利用本文所提供的抗体结合物治疗的疾病为胃癌、结肠直肠癌、肾细胞癌、子宫颈癌、非小细胞肺癌、卵巢癌、子宫癌、子宫内膜癌、前列腺癌、乳癌、头颈癌、脑癌、肝癌、胰脏癌、间皮瘤及/或上皮起源性癌症。在特定实施方案中,疾病为结肠直肠癌。在一些实施方案中,疾病为卵巢癌。在一些实施方案中,疾病为乳癌。在一些实施方案中,疾病为肺癌。在一些实施方案中,疾病为头颈癌。在一些实施方案中,疾病为肾细胞癌。在一些实施方案中,疾病为脑癌。在一些实施方案中,疾病为子宫内膜癌。
[0219]
在某些实施方案中,欲利用本文所提供的抗体结合物治疗的疾病为多发性骨髓瘤。在具体实施方案中,根据国际分期系统或修订的国际分期系统,该多发性骨髓瘤为第i期、第ii期或第iii期。在某些实施方案中,该多发性骨髓瘤为新诊断的多发性骨髓瘤。在其他实施方案中,该多发性骨髓瘤为复发性或难治性多发性骨髓瘤。
[0220]
在国际分期系统(iss)下,多发性骨髓瘤的阶段为如下:第i期:血清β-2微球蛋白《3.5mg/l且血清白蛋白≥3.5g/dl;第ii期:非第i期或第iii期;第iii期:血清β-2微球蛋白≥5.5mg/l。在修订的国际分期系统(r-iss)下,多发性骨髓瘤的阶段为如下:第i期:iss第i期且通过荧光原位杂交(fish)为标准风险染色体异常(亦即,无高风险)且血清乳酸去氢酶
(ldh)含量处于或低于正常值上限;第ii期:非r-iss第i期或第iii期;第iii期:iss第iii期且通过fish为高风险染色体异常(例如,存在del(17p)及/或易位t(4;14)及/或易位t(14;16))或血清ldh含量高于正常值上限。
[0221]
多发性骨髓瘤亦可使用durie-salmon系统进行分期。在此系统下,将多发性骨髓瘤分类为第i期、第ii期或第iii期(1、2或3)。取决于肾功能是否已受影响将每一期进一步分类为a或b,其中b分类指示显著的肾损害。第i期:患者不显示症状;然而,若癌症已影响肾功能,则无论处于何种阶段,预后均可能更糟。第i期的要素特征包括:红血球的数量在正常范围内或略低于正常范围;血液中钙量正常;血液或尿液中m蛋白质的含量较低;针对igg,m蛋白质《5g/dl;针对iga,《3g/dl;针对尿液轻链,《4g/24h;及/或在x射线上无骨损害或仅可见1个骨病灶。第ii期:更多的癌细胞存在于第ii期骨中,且若肾功能受影响,则无论处于何种阶段,预后均会更糟。第ii期的准则定义为不符合第i期亦不符合第iii期的彼等。第iii期:许多癌细胞存在于第iii期骨中。此阶段的要素特征包括:贫血,其中血红素《8.5g/dl;高钙血症;晚期骨损害(3个或更多个骨病灶);血液或尿液中m蛋白质的含量较高;及/或针对igg,m蛋白质》7g/dl;针对iga,》5g/dl;针对尿液轻链,》12g/24h。13.诊断应用
[0222]
在一些实施方案中,本文所提供的抗体结合物用于诊断应用中。举例而言,抗bcma抗体结合物可用于针对bcma蛋白的分析中。在一些方面中,抗体结合物可用于检测bcma在各种细胞及组织中的表达。该等分析可用于(例如)对疾病(例如癌症)作出诊断及/或预后。
[0223]
在一些诊断及预后应用中,抗体结合物可标记有可检测部分。适宜可检测部分包括(但不限于)放射性同位素、荧光标记及酶-底物标记。在另一实施方案中,抗bcma抗体结合物不需要进行标记,且可使用特异性地结合至抗bcma抗体结合物的经标记抗体来检测抗体结合物的存在。14.亲和纯化试剂
[0224]
本文所提供的抗体结合物可用作亲和纯化剂。在此过程中,可使用业内所熟知的方法将抗体结合物固定在诸如树脂或滤纸等固相上。使经固定的抗体结合物与含有欲纯化的bcma蛋白(或其片段)的样品接触,且的后利用适宜溶剂洗涤载体,此将去除样品中除bcma蛋白(其结合至经固定抗体)外的实质上全部的材料。最后,利用另一适宜溶剂(例如甘氨酸缓冲液,ph 5.0)洗涤载体,此将自抗体释放bcma蛋白。15.试剂盒
[0225]
在一些实施方案中,本文所提供的抗bcma抗体结合物为以试剂盒形式提供,即预定量的试剂与实施程序的说明书的包装组合。在一些实施方案中,该程序为诊断分析。在其他实施方案中,该程序为治疗程序。
[0226]
在一些实施方案中,试剂盒进一步包含用于还原抗bcma抗体结合物的溶剂。在一些实施方案中,抗bcma抗体结合物为以药物组合物的形式提供。
实施例
实施例1抗bcma抗体的生成生成及噬菌体展示选择
[0227]
使用噬菌体展示发现初始人类抗体先导物2190-b01及2213-a06。使用在经修饰的市售p3噬粒载体(antibody design labs)中优化的优化曲妥珠单抗(trastuzumab)fab序列密码子构筑抗体fab文库。简言之,修饰噬粒载体以表达fab重链作为c末端p3融合蛋白,且针对fab展示含量优化调控区(起始密码子、限制酶位点、周质前导序列)。使用标准重叠延伸pcr方案,利用靶向重链互补决定区(cdr)的诱变性引子来构筑文库。参见heckman及pease,nat.protoc.,2007,2:924-932。经由电穿孔在m13-k07感染的ss320大肠杆菌细胞中拯救文库。使用标准噬菌体展示方案实施文库选择。参见rajan及sidhu,methods enzymol.,2012,502:3-23;marks及bradbury,methods mol biol.,2004,248:161-76。在多轮选择后,将fab重链库转移至无细胞表达载体中以表达为带his6及flag标签的igg1。核糖体展示选择
[0228]
使用核糖体展示发现初始人类抗体先导物2137-a05及2137-c07。核糖体展示亦用于使2137-c07、2137-a05、2190-b01及2213-a06亲和力成熟以生成改良的衍生物2265等。
[0229]
使用标准重叠延伸pcr方案,利用靶向互补决定区(cdr)的诱变性引子来构筑抗体fab文库。参见heckman及pease,上文文献。使用标准核糖体展示方案实施针对新颖抗体的选择。参见hanes及pl
ü
ckthun,proc.natl.acad.sci.u.s.a.,1997,94:4937-4942。具体而言,根据已公开的方案实施基于fab的核糖体展示选择。参见stafford等人,2014,protein eng.des.sel.27:97-109;dreier及pl
ü
ckthun,2011,methods mol biol 687:283-306。在多轮选择后,使用标准分子生物学技术将来自rt-pcr输出的dna选殖至优化载体中以进行无细胞表达。参见yin等人,2012,mabs 4:217-225。所有构筑体均带有his及flag标签以简化纯化及筛选期间的测试。
[0230]
表6中报告例示性抗体。抗体4在本文中亦称为“抗体2265-f02”。表6.通过核糖体及噬菌体展示产生的抗体抗体vhseq id no.vlseq id no.42265-f0213曲妥珠单抗14实施例2抗体的初级筛选抗体变体的初级elisa筛选
[0231]
将选择工作流程生成的抗体变体文库转化至大肠杆菌中且使其在含有抗生素(康霉素(kanamycin))的琼脂板上生长。使个别群落于液体培养液(tb+抗生素康霉素)中生长,且用作经由滚环式扩增(rca)进行dna扩增的模板。然后在如所阐述的无细胞蛋白质合成反应中使变体表达。参见yin等人,mabs,2012,4:217-225。简言之,在室温(20℃)下将无细胞提取物用50μm碘乙酰胺处理30min且添加至含有无细胞组分(参见cai等人,biotechnol prg,2015,3:823-831)、10%(v/v)所关注hc变体的rca dna模板(大约10μg/ml dna)及2.5μg/ml曲妥珠单抗lc的预混合物。于96孔板中将60μl无细胞(cf)反应在振荡器上以650rpm在30℃下培育12小时。取决于不同选择活动的预测多样性,筛选400-1500个群落。在合成后,将每一反应以1:200稀释且通过elisa测试与人类或食蟹猴bcma-fc蛋白的结合。简言之,将bcma-fc(r&d systems,minneapolis,mn)于0.1m碳酸氢盐(ph 8.9)中涂覆至384孔maxisorp板且利用于pbst中的1%bsa封阻。将来自1:200稀释的cf反应的抗体在板上培育,洗涤,且利用hrp结合的抗人类fab抗体(jackson immunoresearch,west grove,pa)及
pierce pico supersignal elisa底物(thermofisher scientific)进行检测。高通量细胞结合
[0232]
实施高通量初级筛选以快速评价小规模(60μl)无细胞反应中所产生的抗体的细胞结合。在此筛选中,于u形底96孔板(greiner目录号650201)或平底384孔板(greiner目录号781201)中将四种组分以等体积合并至最终体积为100μl/孔。该等组分为:1)于分析缓冲液(1
×
pbs+0.2%bsa,无菌过滤)中稀释以达成最终浓度为500,000个细胞/孔的表达bcma的nci-h929细胞,2)经celltrace俄勒冈绿(invitrogen目录号34555)染色且于分析缓冲液中稀释以达成最终浓度为500,000个细胞/孔的bcma阴性molt-4细胞,3)产生所关注抗体的于分析缓冲液中稀释的无细胞反应的1:50稀释液,及4)于分析缓冲液中以1:100稀释的二级抗人类抗体(alexafluor 647affinipure f(ab
′
)2驴抗人类igg,fc特异性;jackson immunoresearch目录号709-606-098)。然后将板在冰上培育1小时。通过在1500
×
g下旋转5分钟使细胞沈淀且重新悬浮于分析缓冲液中。然后在facs仪器(bd biosciences facscanto ii或bd biosciences lsr ii)上对重新悬浮的细胞实施高通量流式细胞术,且利用flowjo软件分析数据。通过与molt-4bcma阴性细胞上的信号相比,ncih929 bcma阳性细胞上二级抗体信号(假定为由于与所关注抗体的结合所引起)的成比例值来评价抗体结合。实施例3抗体的二次筛选igg的制备
[0233]
经由qiaprep 96turbo微量制备试剂盒(qiagen)根据制造商说明书对来自首轮筛选的热点先导物(top lead)进行培养并微量制备。将7.5μg/ml微量制备的hc dna及2.5μg/ml曲妥珠单抗lc添加至4ml无细胞反应,且在30℃下以650rpm培育过夜达12小时。使用半自动化高通量批量纯化方法,经由imac纯化对来自澄清的无细胞反应的经表达变体进行纯化。简言之,以96孔板形式实施纯化,其中使50μl/孔的imac树脂(ni sepharose high performance,ge healthcare)于imac结合缓冲液(50mm tris ph 8.0、300mm nacl、10mm咪唑)中平衡,与1ml无细胞反应一起培育15分钟,的后在imac结合缓冲液中洗涤两次。然后使用200μl imac溶析缓冲液(50mm tris ph 8.0、300mm nacl、500mm咪唑)溶析带his标签的抗体变体,且使用96孔zeba板(7kd mwco,thermofisher),将缓冲液交换成pbs。经由高通量毛细管电泳,根据制造商说明书使用labchip gxii(perkin elmer)针对贺癌平(herceptin)标准曲线量化经纯化抗体。scfv的制备
[0234]
以v
hvl
或v
lvh
定向制备单链抗体,其中连接体序列位于vh与v
l
结构域之间。通常scfv连接体为由(ggggs)n(seq id no:28)重复序列构成,其中对于15、20、25或30个残基的连接体,n分别=3、4、5或6。对于无细胞表达,添加n末端met,但对于哺乳动物表达,添加前导肽。在scfv的c末端上,可添加fc序列以延长活体内半衰期,或可直接使用scfv。可在scfv与fc之间并入可选连接体序列。例示性scfv-fc连接体序列为aagsdqepkss(seq id no:27)。可任选添加c末端亲和标签以促进纯化及分析开发。例示性亲和标签为c末端flaghis标签gsgdykddddkgsghhhhhh(seq id no:25)。终止密码子通常插入在序列末端。例示性scfv可包括n末端met残基、vh结构域、ggggsggggsggggs(seq id no:26)连接体、v
l
结构域、
mediatech;manassas,va)及2mmol/l-glutamax(life technology;carlsbad,ca)的ham’s f-12-高葡萄糖dmem(50-50)(cellgro-mediatech;manassas,va)中。细胞结合实验
[0240]
在荧光活化细胞分选(facs)细胞结合分析中测试在二次筛选中纯化出足够蛋白质的变体。使用bcma阳性nci-h929及293t-食蟹猴bcma细胞以及bcma阴性293t细胞来筛选facs结合物。在细胞结合前24小时利用1μm dapt处理293t细胞以防止bcma脱落。使用biomekfx(beckman coulter)将自约100-200nm抗体浓度开始的抗bcma变体的6-12点稀释液分配至每一孔中。然后将细胞在冰上培育1小时,用facs缓冲液洗涤且在冰上与50ml含有使用biomekfx(beckman coulter)分配的2.5μg/ml alexa647结合的山羊抗人类igg的facs缓冲液一起培育1小时。然后将细胞用facs缓冲液洗涤2次且在荧光检测前于含有2%三聚甲醛(pfa)的200ml pbs中固定10分钟。使用beckton dickinson lsrii facs获取样品。使用软件(tree star,inc.)分析bcma抗体结合的几何平均荧光强度。细胞杀死分析
[0241]
在对bcma阳性细胞的细胞杀死分析中通过结合至二级抗体的药物评估抗体的内化。使用bcma阳性细胞株arp-1及u266b1来筛选内化先导物。将细胞用不含钙及镁的达尔伯克氏磷酸盐缓冲盐水(dpbs)洗涤两次,用(innovative cell technologies;san diego,ca)收获且通过vi-cell细胞存活率分析仪(beckman coulter,brea,ca)计数。在分析当天将于25微升体积中的总计12,500个细胞接种于384孔平底白色聚苯乙烯板(greiner bio-one,monroe,nc)中。将先导抗体以4
×
起始浓度调配于细胞培养基中且经由multiscreenhts 96孔滤板(millipore;billerica,ma)过滤。将12.5μl连续稀释抗体(自100nm开始1:3连续稀释)添加至处理孔中,且然后将12.5μl根据结合物p(经由可裂解连接体的哈米特林(hemiasterlin))或根据结合物m(经由不可裂解连接体的类美登素(maytansinoid))结合的抗人类奈米抗体以20nm的固定最终浓度添加至每一孔中。在分析之前使分析板于co2培育器中在37℃下培养72小时。对于细胞存活率测量,将30μl cell试剂(promega corp.madison,wi)添加至每一孔中,且按照产品说明书处理板。在读板仪(perkin-elmer;waltham,ma)上测量相对发光。使用未经处理的细胞作为对照,将相对发光读数转换成存活率%。利用graphpad prism(graphpad v 5.0软件;san diego,ca),使用log(抑制剂)对反应-可变斜率、4参数拟合利用非线性回归分析对数据进行拟合。数据表示为相对细胞存活率(atp含量)%对抗体剂量。实施例4说明性抗bcma抗体的特征
[0242]
表7a及7b显示通过初始先导物的核糖体及噬菌体展示产生且在亲和力成熟后的抗体所获得的结果。表7a.来自核糖体及噬菌体展示的抗体。
nk=无杀死表7b.来自核糖体及噬菌体展示的抗体。nd=未检测到实施例5抗体-药物结合物及dar比率测定
[0243]
抗体-药物结合物阐述于zimmerman es等人,2014,bioconjugate chem.,25(2),第351-361页中。简言之,使经纯化的抗bcma抗体变体结合至细胞毒性剂。将原料药溶解于dmso中至最终浓度为5mm。利用pbs将化合物稀释至1mm,且然后添加至经纯化的蛋白质样品中,使最终药物浓度为100μm。将混合物在室温(20℃)下培育17小时。通过使反应样品穿过于调配缓冲液中平衡的zeba板(thermo scientific)中的7000mwco树脂使未并入的药物去除。然后使滤液穿过q板(pall corp.)以去除内毒素。
[0244]
纯化后,在caliper gxii系统上通过与在同一protein express labchip(caliper life sciences编号760499)上运行的的质量标准进行比较来量化经纯化的抗体或抗体药物结合物样品。除在caliper系统上分析之前将样品(混合于样品缓冲液+50mm nem中)在65℃下加热10分钟以外,如protein express reagent试剂盒(caliper life sciences编号760328)中所规定来制备样品以用于分析。
[0245]
在37℃下利用10mm tcep(pierce)使抗体药物结合物还原10min。向经还原的样品添加30ul ta30(30%乙腈、70%的0.1%三氟乙酸)。将20mg超dhb(sigma,部件号50862)溶解至ta50(50%乙腈、50%的0.1%三氟乙酸)中以生成样品基质。接下来,将于ta30中的0.5ul样品添加至于ta50中的0.8ul超dhb基质,且沈积至maldi样品板上。在具有以下初始设置的bruker autoflex speed maldi仪器上获取光谱:质量范围7000-70000da,采样率及数化器设置为0.05、0.1、0.5、1、2,实时平滑设置为高且无基线偏移调整。接通高电压且将离子源1调整至20kv。脉冲离子引出为200ns,基质抑制为偏转且抑制高达6000da。峰检测算法为质心法,其中信号噪声比临限值为20,峰宽度为150m/z,高度为80%,基线扣除为tophat法。平滑算法为savtzkygolay,其中宽度为10m/z且循环为10。将所有样品的药物-抗体比率(dar)测定为每一结合物的解卷积质谱曲线下面积的加权平均值。实施例6活体外血浆稳定性
[0246]
在此实施例中,在来自人类、食蟹猴及小鼠的血浆中评估结合物4的活体外稳定性。通过基于lc/ms的分析,利用亲和捕获的抗体来测量连接体-弹头稳定性。将adc(50μl,
100μg/ml)与pbs或来自人类、食蟹猴或小鼠的血浆(锂-肝素)样品一起培育不同时间长度(0、2、24、72、168、336及504小时)。在预定时间点取出样品且添加至streptavidin mag sepharose珠粒(ge healthcare,目录号28-9857-99),该等珠粒已涂覆有生物素-(fab)2山羊抗人类igg fcγ片段特异性(jackson immnoresearch,目录号109-066-098)抗体(用于pbs、食蟹猴及小鼠血浆样品)或生物素化人类bcma ecd(用于人类血浆样品)(10ug/样品)。将血浆样品/珠粒混合物在温和旋转下在室温下培育2小时。然后于1ml hbs-e缓冲液中将珠粒洗涤三次,的后用1ml水洗涤两次。在室温下添加25μl的1%甲酸溶液对所捕获的adc实施溶析达5min。自珠粒去除释放的抗体且用15μl的1m tris-hcl(ph 9.0)中和。
[0247]
在连接至具有binary sl帮浦的agilent 1200系列hplc系统的agilent 6520a accurate mass q-tof ms上获取下拉adc的dar。在agilent dad上在278nm及214nm下获取其他层析迹线。优化下拉方法的负载以使全部样品体积(40μl)在80℃及0.4ml/min下注射至agilent advance bio desalting hplc柱(2.1
×
12.50mm)上。采用lc-ms的标准移动相:a:于水中的0.1%甲酸;b:于乙腈中的0.1%甲酸。在10%b下1min脱盐时间后,自65%至80%b将蛋白质自柱中溶析1.5至4.5min。在每次注射之间运行清洁分级来防止残留。
[0248]
使用来自agilent的masshunter qualitative(b.06.00),自单一tic峰提取且合并所有光谱。使用masshunter qualitative中的最大熵算法使光谱解卷积,且自所观察到的中性质量确认属性(identity)。解卷积限于源自完全组装抗体的离子,在1.0da的质量步长下搜索140,000-160,000da的质量范围。
[0249]
在dar calculator b.1.0(agilent technologies)中指派峰面积。倘若自动选峰失败,则手动定义峰。将所生成的峰表导出至excel工作单且视需要重新指派dar值。在观察到药物-连接体降解的情形中,仅将产物物种上的剩余药物视为活性的。举例而言,具有一个完整药物-连接体及仅一连接体(自双药物物种降解)的抗体认为等同于单药物物种。将总dar值计算为解卷积峰面积的加权平均值。将重复样品的总dar值一起求平均值。
[0250]
结合物4的例示性血浆稳定性结果提供于图11中。实施例7bcma adc变体在arp-1多发性骨髓瘤肿瘤中的剂量反应关系的评估
[0251]
进行研究以比较结合物4(表8中所阐述)在皮下arp-1多发性骨髓瘤肿瘤中的效能。表8.测试物品列表
[0252]
通过将连接体有效载荷在本文所阐述抗体的f404位点处连接至对-叠氮基-甲基-苯丙氨酸(pamf)来生成抗bcma adc。结合物1为gsk2857916(gsk,trudel等人,2018,lancet oncol.19:1641-1653;trudel等人,2019,blood cancer journal 9:37)的替代adc,其为通过将马来酰亚氨基-己酰基单甲基奥里斯他汀(auristatin)f(mc-mmaf)连接体-弹头结合至抗bcma抗体j6m0来生成。利用cho细胞株choebnalt(icosagen)制备j6m0抗体,且通过proa纯化。将mc-mmaf连接体-弹头结合至j6m0以产生结合物1。不同于gsk2857916,结合物1不使用无岩藻糖基化抗体,该抗体可能增强fc-γriii相互作用。
[0253]
利用异氟醚将9周龄雌性严重复合型免疫缺失(scid)米色小鼠麻醉,且向右后肋部中皮下植入1
×
107个人类arp-1mm细胞与基质胶的1:1混合物。当平均肿瘤大小为约150mm3(对应于植入后15天)时,起始随机化及治疗开始。治疗组概述于表9中。将所有测试物品调配于10mm柠檬酸盐ph 6.0、10%蔗糖中。每周监测1至2次体重及肿瘤大小。主要研究终点为媒剂对照组的平均肿瘤大小》1,500mm3时。表9.治疗组列表
[0254]
使用单因子方差分析(anova)与邓奈特(dunnett)多重比较测试分析体重及肿瘤大小。小于5%的概率(p《0.05)视系统计学上显著的。
[0255]
在此研究中,利用范围为0.1mg/kg至8mg/kg的4个剂量量的结合物4或2mg/kg结合物1对荷有已确立arp-1肿瘤的动物治疗一次。所有测试物品均耐受性良好,且基于图2中的体重减轻均不展现任何毒性。
[0256]
图3a及图3b中图解说明治疗对arp-1肿瘤生长的效应,且显示两种药物的活性提高与剂量之间的正相关性。与媒剂对照类似,两种bcma adc变体在两个较低剂量(0.1及0.5mg)下均几乎不具有活性,而在2mg/kg下则观察到中等活性(图3a)。8mg/kg的最高结合物4剂量使得肿瘤停滞,在治疗后大约10天观察到肿瘤再生长(图3a)。
[0257]
来自此研究的结果显示,在此模型中,结合物4的活性与结合物1相比无统计学差异。实施例8评估bcma adc变体结合物4及5在弥漫性mm.1s多发性骨髓瘤模型中的剂量反应关系
[0258]
进行研究以评估结合物4在nsg小鼠中的弥漫性mm.1s模型中的效能。
[0259]
将5
×
106个多发性骨髓瘤mm.1s细胞接种至8-9周龄雌性nod严重复合型免疫缺失(scid)γ(nsg)小鼠的尾静脉中。在肿瘤接种后7天起始按体重的随机化且开始治疗。治疗组概述于表10中。将所有研究性测试物品调配于10mm柠檬酸盐ph 6.0、10%蔗糖中。监测组1至10(n=6只/组)的存活终点,其特征在于体重减轻》20%及包括嗜睡、后肢麻痹或垂死在内的临床征象。组11至20(n=3只/组)用于骨髓收获且分析在肿瘤细胞接种后第28天的肿瘤负荷。对于所有组而言,每周监测1至2次体重。表10.治疗组列表
international)。通过腹膜内(ip)或静脉内(iv)注射投与测试物品。每周监测1至2次体重。研究终点为存活且特征在于》20%体重减轻及包括嗜睡、后肢麻痹或垂死在内的临床征象。表11.治疗组列表
[0267]
使用单因子方差分析(anova)与邓奈特及西达克(sidak)多重比较测试分别分析平均存活(天数),以比较治疗组对媒剂组或相关治疗组之间的效应。小于5%的概率(p《0.05)视为显著的。
[0268]
在此研究中,在接种后第7天用0.25mg/kg结合物4(单一剂量)、3mg/kg达雷木单抗(单一剂量)、10mg/kg达雷木单抗(单一剂量)、0.8mg/kg velcade(q7dx2)或0.25mg/kg结合物4与每一剂量的达雷木单抗或velcade的组合治疗荷有已确立mm.1s肿瘤的动物。另外,以10mg/kg投与单一高剂量的结合物4。
[0269]
图6显示所有治疗在最初均诱导最低的体重减轻(约5%体重减轻)且耐受性良好。如在此模型中所预期,媒剂对照动物中的体重减轻开始于大约第24天,的后为进行性的体重减轻(直至》20%),此与包括后肢麻痹、立毛及嗜睡在内的临床征象的发生同时。图7a至7c显示因应于0.25mg/kg结合物4及mm soc治疗剂作为单一药剂或组合的卡普兰-迈耶存活曲线。媒剂组的平均存活为30.6天(图7a至7c)。与媒剂对照相比,利用0.25mg/kg结合物4或0.8mg/kg velcade的单一药剂治疗使得平均存活显著更长(分别50.2天及40.6天)(图7a)。结合物4+velcade的共投与似乎对平均存活具有加性效应(61.2天),此与任一单一药剂相比具有显著差异。同时,与媒剂对照相比,3mg/kg或10mg/kg的单一药剂达雷木单抗对存活均不具有显著效应(图7a、图7b及图7c)。然而,与单独的单一药剂相比,结合物4+任一剂量的达雷木单抗使得平均存活显著延长(分别71.6天及75.6天)(图7b及图7c)。单一药剂达雷木单抗效能的缺乏暗示其与结合物4组合具有协同效应。
[0270]
图8a显示因应于10mg/kg较高剂量的结合物4的卡普兰-迈耶存活曲线。利用10mg/kg结合物4治疗的动物的平均存活为89.4天,此与媒剂对照或0.25mg/kg结合物4相比显著延长(图8b)。
[0271]
来自此研究的结果显示,与单独的结合物4或mm soc单一药剂相比,结合物4与velcade或达雷木单抗组合显著地增强效能。应注意,由于nsg小鼠缺乏nk细胞,故在此模型中所观察到的达雷木单抗的组合益处可归因于其nk非依赖性功能(phipps c等人,2015,ther.adv.hem.63:120-127)。另外,与媒剂或0.25mg/kg结合物4相比,利用10mg/kg结合物4治疗明显地延长存活。实施例10
评价具有不同抗bcma抗体的bcma adc变体在皮下arp-1肿瘤中的效能
[0272]
此实施例评估bcma adc变体在皮下arp-1中的活性。
[0273]
利用异氟醚将10周龄雌性scid米色小鼠麻醉,且向右后肋部中皮下植入8
×
106个人类arp-1mm细胞与基质胶的1:1混合物。当平均肿瘤大小为约150mm3(植入后14天)时,起始随机化及治疗开始(治疗后第0天)。测试物品及治疗组概述于表12中。将所有研究性测试物品调配于10mm柠檬酸盐ph 6.0、10%蔗糖中。每周监测至少1至2次体重及肿瘤大小。主要研究终点为媒剂对照组的平均肿瘤大小》1,200mm3时。表12.治疗组列表
[0274]
使用单因子方差分析(anova)与邓奈特多重比较测试来分析肿瘤大小。小于5%的概率(p《0.05)视系统计学上显著的。
[0275]
在此研究中,利用3mg/kg具有不同抗bcma抗体的bcma adc变体及结合物1对荷有已确立arp-1肿瘤的动物治疗一次。所有测试物品均耐受性良好且不展现任何实质性毒性(定义为体重减少》20%)。
[0276]
第14天(当媒剂对照肿瘤的平均值》1,200mm3时)的肿瘤大小的统计分析显示,与对照相比,所有治疗组均显著有效。基于p值,结合物4(约70%tgi,p《0.001)为有效的。持续监测显示结合物4为强效的。直至约第17天,结合物1在诱导肿瘤消退及停滞方面为最强效的。实施例11评价皮下arp-1多发性骨髓瘤肿瘤对较高剂量的结合物4的反应
[0277]
进行研究以评价皮下arp-1多发性骨髓瘤肿瘤对较高剂量的结合物4的反应。
[0278]
利用异氟醚将9周龄雌性严重复合型免疫缺失(scid)米色小鼠麻醉,且向右后肋部中皮下植入1
×
107个人类arp-1mm细胞与基质胶的1:1混合物。当平均肿瘤大小为约150mm3(植入后14天)时,起始随机化及治疗开始(治疗后第0天)。治疗组概述于表13中。将所有sutro研究性测试物品调配于10mm柠檬酸盐ph 6.0、10%蔗糖中。每周监测1至2次体重及肿瘤大小。主要研究终点为媒剂对照组的平均肿瘤大小》1,500mm3时。表13.治疗组列表
[0279]
使用单因子方差分析(anova)与邓奈特多重比较测试来分析体重及肿瘤大小。小于5%的概率(p《0.05)视系统计学上显著的。
[0280]
在此研究中,利用范围为5mg/kg至20mg/kg的4个剂量量的结合物4或5mg/kg的结合物1对荷有已确立arp-1肿瘤的动物治疗一次。所有测试物品均耐受性良好,且基于体重减轻均不展现任何毒性(图9)。然而,随着研究进展,在所有剩余治疗组中均观察到体重的增加,其中利用5mg/kg结合物1治疗的动物体重变化最大。体重的持续增加以及在一些动物中注意到腹部膨胀暗示通常在此模型中所观察到的内部arp-1肿瘤的形成。出于此原因,该研究在第52天终止。
[0281]
图10a及10b中图解说明bcma adc结合物4及结合物1治疗对arp-1肿瘤生长的效应。观察到在结合物4剂量递增时功效增加,此指示线性剂量-反应关系(图10a)。在第11天当媒剂组的平均肿瘤大小达到研究终点(》1,500mm3)时对肿瘤大小的分析显示,与媒剂对照相比,结合物4自10mg/kg开始展现显著的效能(图10b)。剂量≥10mg/kg的结合物4及5mg/kg结合物1诱导肿瘤消退。在大约第11天开始,观察到10mg/kg结合物4组的8只动物中有4只出现肿瘤再生长,而较高剂量的结合物4或5mg/kg结合物1维持生长抑制直至第52天(图10a及图10b)。
[0282]
此研究的结果显示,剂量》15mg/kg的结合物4在治疗后诱导肿瘤消退且延长生长抑制》50天。实施例12受体交叉反应性分析
[0283]
本实施例评估结合物4对工程改造的稳定293t细胞上的人类bcma、baff-r及taci受体的潜在交叉反应性结合及识别。结果展示,结合物4特异性地结合至工程改造293t细胞株上的bmca,但不结合至baff-r或taci。对照为结合物1。
[0284]
bcma、b细胞活化因子受体(baff-r,亦称为tnfrsf13c)以及跨膜活化剂及钙调亲环素配体相互作用因子(taci,亦称为tnfrsf13b)为同源性相关的iii型跨膜受体,其对tnf(肿瘤坏死因子)配体、b细胞活化因子(baff,亦称为blys)及增殖诱导配体(april)具有不同表达谱及亲和力以促进b细胞存活及成熟(hengeveld及kerstan,2015,blood cancer journal 2015年2月27日;5:e282)。
[0285]
自atcc(american type culture collection)购得293t细胞,且使用lipofectamine ltx试剂与plus试剂(thermofisher scientific)用编码人类bcma、baff-r及taci的质体进行转染。利用来自biolegend的市售抗体抗bcma(纯为19f2)、抗baff-r(纯为11c1)及抗taci(纯为1a1)来确认人类bcma、baff-r及taci在稳定细胞株上的表达。
[0286]
在细胞结合研究之前,利用1μm分泌酶抑制剂dapt(santa cruz biotechnology)将稳定表达人类bcma的工程改造293t细胞处理过夜以维持较高的bcma表达程度。收集稳定地表达bcma、baff-r及taci的亲代及工程改造293t细胞,洗涤且重新悬浮于facs缓冲液(含有1%牛血清白蛋白及0.05%v/v叠氮化钠的dpbs缓冲液)中。将细胞平铺于96孔板(100k/孔)中且与ab一起培育。将67nm的抗人类bcma adc在冰上培育1小时。利用藻红素结合的抗人类fc ab(jackson immunoresearch,west grove,pa)在冰上检测adc结合达1小时。使用bd facs canto系统分析细胞。使用flowjo软件分析facs数据以生成细胞结合直方图。
[0287]
在饱和浓度(67nm)下测试的结合物4及结合物1替代基准adc二者均显示出对表达人类bcma的293t细胞的特异性结合,但对表达baff-r及taci的293t细胞不显示特异性结合(图12)。该等结果指示,结合物4特异性地结合至bcma,但不结合至baff-r及taci。
实施例13adc相对于游离药物分解代谢物的活体外细胞毒性
[0288]
本实施例比较结合物4及结合物1(马来酰亚氨基己酰基单甲基奥里斯他汀f)及其各别游离药物分解代谢物针对一组不同多发性骨髓瘤细胞株的相对细胞杀死活性。
[0289]
在肿瘤细胞增殖分析中以两个单独实验评价adc及其各别游离药物分解代谢物的细胞毒性效应。将2万个细胞/孔平铺于96孔平底半区板中,且将adc或游离药物分解代谢物以于细胞培养基中自12.5nm开始至0.049nm(2倍稀释)且对于游离药物分解代谢物而言自2μm至0.03nm(4倍稀释)添加至细胞(每一实验n=3个重复)。于co2培育器中将细胞在37℃下培养3天。对于细胞存活率测量,添加cell 试剂(promega corp,madison,wi),且根据制造商的方案处理板并进行读取。在读板仪(perkin-elmer;waltham,ma)上测量相对发光。使用未经处理的细胞作为对照,将相对发光读数转换成存活率%。使用graphpad prism统计软件,使用log(抑制剂)对反应、可变斜率、4参数拟合方程式利用非线性回归分析对数据进行拟合。将数据表示为相对于未经处理的对照细胞的存活率%对以nm计的adc的剂量,其中误差杠指示三次重复的标准偏差(sd)。
[0290]
在两个独立实验中,结合物4(表14)针对三种bcma阳性mm细胞株(nci-h929、opm2及u266b1)显示相似功效活性(表14),其中ec
50
值在0.8nm至1.8nm范围内。相比的下,结合物1(j6m0-mcmmaf替代基准adc)(表14)基于ec
50
值(0.2nm至0.9nm)显示出略大的细胞杀死功效,但其跨度细胞杀死%与结合物4类似。两种adc针对bcma阴性k562细胞株均不显示活性。
[0291]
相较于结合物4,作为游离药物化合物的结合物4的活性分解代谢物4-1及4-2(表14)针对所有三种bcma阳性mm细胞株(包括bcma阴性k562细胞株)显示出显著更弱的活性。另外,与结合物4相比,作为游离药物化合物的结合物1的活性分解代谢物1-1(表14)亦显示出更弱的对所有四种细胞株的细胞杀死活性。
[0292]
来自该等实验的数据指示,抗bcma adc结合物4较所释放的分解代谢物更强效,此表明结合物4的细胞毒性主要为由于mm细胞中的bcma靶向及内化。表14:活体外细胞杀死:adc及分解代谢物
*:估计值nc:由于稀释曲线不完整而无法计算nk:未观察到杀死adc:抗体药物结合物实施例14多发性骨髓瘤细胞株相对于gfp对照的活体外细胞毒性比较
[0293]
本实施例评估结合物4与dar为4的各别抗gfp阴性对照结合物结合物20相比,对三种bcma阳性mm细胞株(nci-h929、u266b1及opm-2)及一种bcma阴性细胞株(k562)的细胞杀死活性。
[0294]
作为此实验的阴性对照adc,抗gfp igg为作为无细胞(cf)产生的抗体来生成。参见结合物m,该抗体在抗gfp重链上的相同y180及f404位点结合至相同药物连接体以产生结合物20。
[0295]
在肿瘤细胞增殖分析中以两个单独实验来评价结合物4及各别抗gfp阴性对照adc结合物20的细胞毒性效应。在两个实验中,结合物4对所有三种bcma阳性mm细胞株(nci-h929、opm-2及u266b1)均显示强效的细胞杀死活性,其中ec
50
值在0.7nm至2.0nm范围内(表15)。未观察到结合物4对bcma阴性k562细胞株的细胞杀死。相比的下,抗gfp结合物20阴性对照adc针对所测试的四种细胞株中的任一者均不显示任何细胞杀死活性。来自该等实验的数据表明,结合物4的活体外细胞杀死效应为经由bcma靶标介导的adc在bcma阳性mm细胞株中的内化来介导的。表15:针对不同细胞株的细胞杀死ec50及跨度的汇总
nk=无杀死实施例15结合物细胞杀死活性的特异性
[0296]
该实施例评估结合物4对表达bcma的多发性骨髓瘤细胞的特异性细胞杀死活性。
[0297]
在肿瘤细胞增殖分析中评价adc(结合物4、结合物1)在过量未结合的抗bcma抗体2265-f02及重组人类bcma细胞外结构域(ecd)蛋白质(目录号310-16,peprotech,nj,usa)不存在下或存在下的细胞毒性效应。将2万个细胞/孔平铺于96孔平底半区板中。将2μm浓度(超过最高adc浓度100倍)的重组人类bcma ecd蛋白与adc一起在室温下预培育1小时,的后将其添加至细胞以阻断adc上的bcma结合位点。在室温下将未结合的抗bcma抗体2265-f02以500nm浓度(超过最高adc浓度25倍)添加至细胞持续1小时。然后将adc的2倍连续稀释液添加至孔中,起始浓度为20nm且最终浓度为0.078nm。于co2培育器中将细胞在37℃下培养3天。对于细胞存活率测量,添加cell试剂(promega corp,madison,wi),且根据制造商的方案处理板并进行读取。在读板仪(perkin-elmer;waltham,ma)上测量相对发光。使用未经处理的细胞作为对照,将相对发光读数转换成存活率%。使用graphpad prism统计软件,使用log(抑制剂)对反应、可变斜率、4参数拟合方程式利用非线性回归分析对数据(两次重复的平均值)进行拟合。将数据绘制为相对于未经处理的对照孔的细胞存活率%对以奈摩尔浓度浓度(nm)计的adc的剂量,其中误差杠指示两次重复的标准偏差(sd)。
[0298]
结合物4及结合物1替代基准adc(表16)对所测试的所有四种bcma阳性mm细胞株均显示出强效的细胞杀死活性(表16),其中ec
50
值在0.4nm至3.3nm范围内(表16)。在过量未结合的抗bcma ab 2265-f02或重组人类bcma ecd蛋白存在下,跨越所有四种bcma阳性细胞株均未观察到结合物4或结合物1的细胞杀死。来自此实验的数据指示,结合物4的活体外细胞杀死效应对bcma具有特异性。表16:针对不同细胞株的细胞杀死ec50及跨度的汇总
nk=无杀死实施例16活体外细胞结合及细胞杀死:多发性骨髓瘤细胞株
[0299]
此实施例比较跨越一大组表达bcma的多发性骨髓瘤(mm)细胞株,结合物4相对于结合物1(马来酰亚氨基己酰基单甲基奥里斯他汀f)替代基准adc的活体外细胞结合及细胞杀死功效。在此实验中,与替代基准adc相比,结合物4显示更优选的细胞结合及相似功效的细胞杀死。
[0300]
nci-h929、u266b1、rpmi-8226、mm.1s、mc/car及k-562细胞购自atcc(american type culture collection,manassas,va,usa)。opm-2细胞购自leibniz institute dsmz(german collection of microorganisms and cell cultures gmbh,braunschweig,germany)。arp-1细胞系自translational genomics research institute(phoenix,arizona,usa)的dr.jonathan j.keats实验室获得许可。将所有细胞株维持于补充有20%热不活化胎牛血清(thermo scientific,grand island,ny)、2mm glutamax(thermo scientific,grand island,ny)及1
×
青霉素/链霉素(corning,corning,ny)的rpmi高葡萄糖培养基(corning,corning,ny)中。
[0301]
收集肿瘤细胞,洗涤且重新悬浮于facs缓冲液(含有1%牛血清白蛋白及0.05%v/v叠氮化钠的dpbs缓冲液)中。将与2.5μg人类fc block(bd biosciences,目录号564220)一起在室温下预培育10分钟的mm细胞平铺于96孔板中(100-200k/孔),且与抗体(自66.7nm以3倍连续稀释液进行滴定)一起在冰上培育1小时。利用藻红素结合的抗人类fc ab(jackson immunoresearch,west grove,pa)在冰上检测抗体结合达1小时。使用bd facs canto系统分析细胞。使用flowjo软件分析荧光活化细胞分选(facs)数据以计算平均荧光强度(mfi)(n=3个重复),且使用graphpad prism软件生成数据(平均mfi+/-平均值的标准误差[sem]对抗体nm)。
[0302]
在肿瘤细胞增殖分析中评价结合物4 2265-f02(作为结合物4的阴性未结合的抗体形式)及结合物1替代基准adc的细胞毒性效应。
[0303]
结合物4及其未结合的抗体形式2265-f02二者对六种mm细胞株(nci-h929、arp-1、opm-2、u266b1、mm.1s及rpmi-8226)均显示类似的高亲和力结合,其中kd在0.9nm至3.9nm范围内。相比的下,结合物1mcmmaf替代基准adc显示较弱的结合。2265-f02的结合曲线在66.7nm下未饱和。所测试的所有三种ab均显示对bcma阴性骨髓瘤mc/car细胞无显著结合(表17)。结果指示,在f404/y180位点上的药物-连接体结合不影响抗bcma抗体的结合,且结合物4adc对表达bcma的mm细胞株具有高亲和力结合。
[0304]
结合物4及结合物1替代基准adc二者在跨越表达bcma的六种mm细胞株中的五种中均显示相似的强效细胞杀死活性。分别而言,结合物4adc的细胞杀死功效ec
50
范围为0.70nm
至2.1nm,且结合物1替代基准adc为0.29nm至1.4nm(表18)。在低bcma表达rpmi-8226mm细胞株上观察到两种adc的低细胞杀死活性。结果指示,结合物4针对多种mm细胞株具有强效细胞杀死潜能。
[0305]
结合物4以高亲和力结合至表达bcma的mm细胞株,且在跨越表达bcma的六种mm细胞株中的五种中显示与结合物1替代基准adc相似的强效细胞杀死活性。表17:对不同mm细胞株的kd及bmax结合的汇总对不同mm细胞株的kd及bmax结合的汇总《lod=低于检测限nc=观察到结合,但kd及bmax由于稀释曲线不完整而无法计算nsb=无显著结合表18:对不同mm细胞株的ec
50
及细胞杀死跨度的汇总《lod=低于检测限nc=观察到细胞杀死,但ec50及跨度由于稀释曲线不完整而无法计算nk=无杀死实施例17活体外细胞结合及细胞杀死:物种交叉反应性
[0306]
此实施例比较结合物4相对于结合物1(马来酰亚氨基己酰基单甲基奥里斯他汀f)替代基准adc对过表达人类、食蟹猴灵长类动物、大鼠或小鼠bcma的稳定293t细胞的活体外细胞结合及细胞杀死功效。
[0307]
自atcc(american type culture collection)购得293t细胞,且使用
lipofectamine ltx试剂与plus试剂(thermofisher scientific)用编码人类、食蟹猴灵长类动物或大鼠bcma的质体进行转染。通过使用fugene hd试剂(promega),用编码小鼠bcma的质体(invivogen)转染hek293t细胞来生成293t-小鼠bcma细胞。
[0308]
在细胞结合研究之前,利用1μmγ-分泌酶抑制剂dapt(santa cruz biotechnology)将稳定表达人类、食蟹猴灵长类动物或大鼠bcma的工程改造293t细胞处理过夜以维持较高的bcma表达程度。收集细胞,洗涤且重新悬浮于facs缓冲液(含有1%牛血清白蛋白及0.05%v/v叠氮化钠的dpbs缓冲液)中。将细胞平铺于96孔板(100k/孔)中,且与ab(自200nm以2倍连续稀释液进行滴定)一起在冰上培育1小时。利用藻红素结合的抗人类fc ab(jackson immunoresearch,west grove,pa)在冰上检测ab结合达1小时。使用bd facs canto系统分析细胞。
[0309]
收集293t-小鼠bcma细胞,洗涤且悬浮于facs缓冲液(含有1%牛血清白蛋白及0.05%v/v叠氮化钠的dpbs缓冲液)中。将细胞平铺于96孔板(100k/孔)中,且与抗体(自200nm以半对数连续稀释液进行滴定)一起在冰上培育1小时。洗涤细胞,然后利用藻红素结合的抗人类fc二级抗体(jackson immunoresearch,west grove,pa)在冰上检测抗体结合达1小时。使用bd lsr-fortessa x-20流式细胞术系统分析细胞。使用flowjo软件分析facs数据以计算几何荧光强度(gmfi)(n=3个重复),且使用graphpad prism软件生成数据(几何平均mfi+/-sem对log ab nm)。
[0310]
在肿瘤细胞增殖分析中评价sp8919 adc及j6m0-mcmmaf替代基准adc的细胞毒性效应。将500个细胞/孔平铺于96孔平底半区板中过夜,且第二天将adc于细胞培养基中自20nm开始(2倍稀释)添加至细胞(n=3个重复)。于co2培育器中将细胞在37℃下培养5天。对于细胞存活率测量,添加cell试剂(promega corp,madison,wi),且根据制造商的方案处理板并进行读取。在读板仪(perkin-elmer;waltham,ma)上测量相对发光。使用未经处理的细胞作为对照,将相对发光读数转换成存活率%。使用graphpad prism统计软件,使用log(抑制剂)对反应、可变斜率、4参数拟合方程式利用非线性回归分析对数据进行拟合。将数据表示为相对细胞存活率%对adc的剂量(平均值+/-sem)。
[0311]
结合物4及其未结合的ab形式2265-f02 y180/f404二者对过表达人类及食蟹猴bcma的293t细胞均显示类似的高亲和力结合,但对亲代293t细胞或经稳定转染以表达大鼠bcma或小鼠bcma的细胞则不显示高亲和力结合。与表达人类及食蟹猴bcma的293t细胞结合的kd为在1.4nm至2.8nm范围内(表19)。相比的下,结合物1替代基准adc显示略微较弱的结合活性,kd值为在7.1nm至8.6nm范围内(表19)。结果指示,与未结合的ab对照相比,在f404/y180位点处的连接体有效载荷结合不影响抗bcma结合物4的结合,且结合物4结合至人类及食蟹猴灵长类动物bcma,但不结合至大鼠或小鼠bcma。
[0312]
基于阳性物种交叉反应性细胞结合结果,比较结合物4及结合物1替代基准adc对表达人类或食蟹猴灵长类动物bcma的293t细胞的细胞杀死活性。结合物4及结合物1替代基准adc二者对表达人类及食蟹猴灵长类动物bcma的稳定转染293t细胞均显示相似的细胞杀死活性,但对亲代293t细胞则不显示细胞杀死活性。结果指示,结合物4具有与结合物1替代基准adc相似的食蟹猴灵长类动物bmca结合反应性,此由细胞杀死分析予以确认。
[0313]
总的,来自此实验的结果指示,结合物1及结合物4针对过表达人类及食蟹猴灵长类动物bcma的293t细胞显示特异性细胞结合识别及细胞杀死敏感性,但不结合大鼠或小鼠
bcma。此表明,类似于结合物1替代基准adc,可在食蟹猴灵长类动物中对结合物4进行毒性评价测试。表19:对稳定表达人类、食蟹猴灵长类动物、大鼠或小鼠bcma的293t细胞的kd及bmax结合的汇总hbcma:人类bcma,cbcma:食蟹猴bcma,rbcma:大鼠bcma,mbcma:小鼠bcma,nb:无结合实施例18adc对bcma与baff及april配体结合的阻断
[0314]
此实施例比较结合物4adc及结合物1替代基准adc对bcma受体与配体baff(b细胞活化因子)及april(增殖诱导配体)结合的阻断。
[0315]
bcma结合至配体baff及april以调介骨髓浆细胞及浆母细胞的存活,以及mm细胞生长及存活。tai等人,2014,blood 123(20):3128-38。j6m0 ab除作为adc以靶向表达bcma的mm细胞以外,亦报导作为额外治疗作用机制来阻断baff及april结合。tai等人,上文文献。
[0316]
在4℃下将重组人类bcma ecd蛋白(acro biosystems)以于碳酸盐/碳酸氢盐ph 9.6缓冲液(sigma-aldrich)中0.5μg/ml涂覆于96孔nunc maxisorp板中过夜。所有以下步骤均为在室温下实施。将板用pbst缓冲液(dpbs+0.05%tween-20)洗涤且用elisa封阻缓冲液(dpbs+1%bsa)封阻1小时。将ab及配体于elisa稀释缓冲液(dpbs+0.5%bsa+0.05%tween-20)中稀释且以1:1体积比混合,测试ab以最终浓度为200nm开始,2倍连续稀释,重组配体baff或april的最终浓度分别为1ng/ml及10ng/ml。将混合的ab及配体添加至经人类bcma涂覆的板以结合2小时。洗涤板,且将链霉抗生物素蛋白结合的hrp ab(jackson immunoresearch)于elisa稀释缓冲液中稀释1,000倍并在黑暗中添加至板达1小时。洗涤板,且在黑暗中添加tmb底物(sureblue reserve,kpl)达20分钟。利用等体积的1m磷酸使底物反应淬灭,且在m5 spectramax读板仪(molecular devices)上在450nm下读板。对od值进行绘制,且使用graphpad prism软件以产生具有希尔(hill)斜率曲线的单位点特异性结合(对数变换)以确定ic
50
值(平均值
±
sem,n=2)。
[0317]
通过elisa,结合物4adc及结合物1替代基准adc二者均显示阻断baff(表20)及april(表21)配体二者与重组bcma结合的等效活性,其中ic
50
值在6.8nm至8.9nm范围内。抗her2抗体曲妥珠单抗为作为阴性对照添加在分析中,且不阻断baff或april与bcma的结合。
[0318]
结果指示,结合物4adc阻断baff及april配体二者与bcma的结合,且表明结合物4adc在潜在地降低mm细胞增殖方面可能与结合物1共有相同的额外作用机制。表20:baff ic50的汇总
表21:april ic50的汇总实施例19结合物4的化学特征
[0319]
结合物4为抗体与药物-连接体的结合物。结合物4为无糖基化的抗b细胞成熟抗原(抗bcma)人类化igg1抗体药物结合物(adc),其包含在按eu编号标称位置180及404(实际位置186及410)的非天然氨基酸(nnaa)对-叠氮基甲基-l-苯丙氨酸(pamf)残基处共价结合至20-甲基-1-(3-甲基-3,9-二氢-8h二苯并[b,f][1,2,3]三唑并[4,5-d]氮杂环辛四烯(azocin)-8-基)-1,5,21-三氧代基-8,11,14,17-四氧杂-4,20-二氮杂二十五烷-25-酰基(去乙酰基)类美登素药物-连接体的抗bcma igg1人类化抗体(无糖基化的2265-f02)。结合物4adc为药物对抗体比率(dar)为4的单一占优结合物种(作为两种区域异构物的约1:1混合物存在)。结合物4的分子量为大约151kda。使用本文所阐述的方法制备的结合物4的样品展现3.9至4的dar,如使用本文所阐述的方法测量及计算(例如,参见实施例6)。
[0320]
结合物4中的二硫键如下:链间(lc1):cys 24-cys 89;cys 135-cys 195。链间(hc1):cys 23-cys 97;cys 150-cys 206;cys 267-cys 327;cys 373-cys 431。链间(hc2):cys 23-cys 97;cys 150-cys 206;cys 267-cys 327;cys 373-cys 431。链间(lc2):cys 24-cys 89;cys 135-cys 195。lc1-hc-1内部:cys 215-cys 226。lc2-hc-2内部:cys 215-cys 226。hc-hc-铰链-1内部:cys 232-cys 232。hc-hc-铰链-2内部:cys 235-cys 235。实施例20序列
[0321]
表22提供本文所提及的序列。表22.序列
等效内容
[0322]
上文所陈述的公开内容可涵盖可独立使用的多个不同发明。尽管该等发明中的每一者已以其优选形式予以公开,但如本文所公开及说明的其具体实施方案不应视为具有限制性意义,此乃因可能存在多种变化形式。该等发明的目标物包括本文所公开各个要素、特征、功能及/或性质的所有新颖及不明显组合及子组合。以下申请专利范围特别地指出认为新颖且不明显的某些组合及子组合。在本技术案、主张本技术案的优先权的申请案或相关申请案中可主张特征、功能、要素及/或性质的其他组合及子组合中所体现的发明。此等申请专利范围无论为关于不同发明抑或为关于同一发明,且无论范围与原始申请专利范围相比较宽、较窄、相同抑或不同,均亦视为包括在本公开内容的发明的目标物内。
[0323]
来自本文所阐述的任何实施方案或图中的一或多个特征可在不背离本发明的范围的情形下与本文所阐述的任何其他实施方案或图中的一或多个特征组合。
[0324]
本说明书中所引用的所有公开案、专利及专利申请案均为以引用的方式并入本文中,如同每一个别公开案或专利申请案明确且个别地指示以引用的方式并入一般。尽管已出于理解清楚的目的藉助说明及实施例相当详细地阐述前述发明,但本领域技术人员鉴于本发明的教示将易于明了可在不背离随附申请专利范围的精神或范围的情形下对本发明作出某些改变及修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1