CD147嵌合抗原受体和使用方法
cd147嵌合抗原受体和使用方法
1.相关申请的交叉引用
2.本技术要求于2019年3月15日提交的美国临时专利申请第62/819,403号的权益,所述申请通过引用整体并入本文。
技术领域
3.本公开涉及免疫疗法,特别是靶向cd147的嵌合抗原受体和其用于治疗癌症的用途。
4.政府支持声明
5.本发明是根据美国国立卫生研究院授予的基金号ai130197、hl125018、ai124769
‑
01和ai129594在政府支持下进行的。政府享有本发明的某些权利。
背景技术:
6.肝癌是全球癌症相关死亡的第二大常见原因。预计到2030年,肝癌的负担将超过100万例。肝癌在全球病例中排名第五并且在男性死亡病例中排名第二。每年有50多万患者死于肝细胞癌(hcc)。
7.原发性肝癌包括肝细胞癌(hcc)、肝内胆管癌(icca)、纤维层癌和肝母细胞瘤。hcc和icca是最常见的原发性肝癌,占原发性肝癌病例的99%以上。仅hcc(每年近800,000新病例)就占所有原发性肝癌病例的90%。目前,没有有效疗法可用于治疗hcc。索拉非尼(checkmate
‑
040,一种广泛用于晚期hcc患者的功效低且副作用严重的多激酶抑制剂)是hcc的一线标准全身药剂。目前,pd
‑
1阻断欧狄沃(opdivo)(纳武单抗(nivolumab))已被美国食品药品监督管理局(fda)批准作为二线治疗策略,用于先前用索拉非尼治疗的hcc患者。测试pd
‑
1阻断作为hcc的一线治疗的临床试验正在进行中。同时,使用pd
‑
1或pd
‑
l1阻断与其它干预相组合的各种临床试验也正在进行中。例如,在hcc可切除和潜在可切除的患者中评估抗pd
‑
1抗体联合抗ctla
‑
4抗体的研究正在临床试验中进行测试(nct03222076)。
8.嵌合抗原受体(car)修饰的t细胞疗法已经成为用于治疗各种血癌的有前景的免疫治疗性策略。尽管car修饰的t细胞免疫疗法最近在血癌中取得了进展,但高成本和严重的毒性阻碍了其广泛使用。同时,car
‑
t细胞在靶向实体瘤期间面临着如在肿瘤微环境中维持持久的增殖和持久性等另外的挑战。car介导的肝癌免疫疗法的另外的挑战是寻找有效的靶标。
技术实现要素:
9.cd147在不同的细胞类型(例如造血细胞、上皮细胞和内皮细胞)上以不同水平表达。然而,cd147在如在hcc、乳腺癌、膀胱癌、结直肠癌、卵巢癌、黑色素瘤和骨肉瘤等疾病状态下显著上调。提供了特异性靶向表达cd147的细胞的car。这些car可以用于表达或过表达cd147的癌症的免疫疗法。
10.本文公开了特异性结合cd147的经修饰的单链可变片段(scfv)。在一些实施方案
中,所述scfv具有氨基酸序列,所述氨基酸序列包括seq id no:8的可变重链(vh)结构域互补决定区1(cdr1)、cdr2和cdr3氨基酸序列和seq id no:9的可变轻链(vl)结构域cdr1、cdr2和cdr3氨基酸序列。在一些实例中,所述scfv与seq id no:2的氨基酸序列具有至少90%的序列相同性,或者包括seq id no:2的氨基酸序列或由seq id no:2的氨基酸序列组成。还提供了编码所述经修饰的cd147 scfv的核酸,如与seq id no:1的核酸分子具有至少90%的序列相同性的核酸,或者包括seq id no:1的核酸序列或由seq id no:1的核酸序列组成的核酸;以及包括所述核酸序列的载体。在另外的实施方案中,提供了编码所述经修饰的cd147 scfv(如seq id no:1)的载体,所述载体进一步包含与所述cd147 scfv核酸分子可操作地连接的诱导型启动子或增强子核酸分子。在一些实例中,所述增强子核酸是与编码所述cd147 scfv的核酸可操作地连接的gal4上游激活序列(uas)。在另一实例中,所述载体是synnotch构建体,例如包括与synnotch和gal4
‑
vp64编码序列(例如seq id no:17)连接的经修饰的cd147 scfv核酸分子(例如seq id no:1)的核酸序列的载体。
11.还提供了car,所述car包括本文提供的经修饰的cd147 scfv、铰链结构域、跨膜结构域、包含一个或多个共刺激分子细胞内结构域以及细胞内信号传导结构域的细胞内结构域。在一个实施方案中,所述cd147
‑
car包括本文提供的经修饰的cd147 scfv、igg1铰链结构域、cd28跨膜结构域、cd28和4
‑
1bb共刺激结构域以及cd3ζ信号传导结构域。在一些实例中,所述cd147
‑
car包括与seq id no:5的氨基酸序列具有至少90%相同性的氨基酸序列,或者包括seq id no:5的氨基酸序列或由seq id no:5的氨基酸序列组成。
12.在一些实施方案中,所述cd147
‑
car进一步包括如胱天蛋白酶9等的诱导型自杀分子。在一些实例中,所述自杀分子的表达由四环素、多西环素或雷帕霉素诱导。在一个实例中,所述具有诱导型自杀基因的cd147
‑
car包括与seq id no:7的氨基酸序列具有至少90%相同性的氨基酸序列或者包括seq id no:7的氨基酸序列或由seq id no:7的氨基酸序列组成。所述cd147
‑
car可以进一步包括细胞因子受体细胞内结构域,如白介素
‑
15受体细胞内结构域(例如seq id no:12)、白介素
‑
12受体细胞内结构域或白介素18受体细胞内结构域。
13.还提供了编码本文公开的cd147
‑
car的核酸以及包括所述核酸的载体(如病毒载体)。在一些实例中,所述cd147
‑
car由与seq id no:4或seq id no:6的核酸序列具有至少90%相同性的核酸序列编码。在其它实例中,所述cd147
‑
car由包括seq id no:4或seq id no:6的核酸序列或由seq id no:4或seq id no:6的核酸序列组成的核酸编码。
14.在另外的实施方案中,提供了编码cd147
‑
car(如seq id no:4或seq id no:6)的载体,所述载体进一步包含与cd147
‑
car核酸分子可操作地连接的诱导型启动子或增强子核酸分子。在一些实例中,所述增强子核酸是与编码cd147
‑
car的核酸可操作地连接的gal4上游激活序列(uas)(例如seq id no:14)。在一个实例中,所述载体包括synnotch构建体中的cd147
‑
car,例如包括seq id no:15的核酸序列的载体。在其它实例中,所述cd147
‑
car核酸分子(例如seq id no:1)与synnotch和gal4
‑
vp64编码序列(例如seq id no:17)连接。
15.还提供了表达所公开的scfv和/或car的t细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、双阴性t(dnt)细胞(cd3
+
cd4
‑
cd8
‑
)、中性粒细胞或巨噬细胞,如包含编码所公开的cd147 scfv或cd147
‑
car的核酸或编码所公开的cd147 scfv或cd147
‑
car的载体的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞。在一些实例中,所述nk细胞是nk
‑
92
或nk
‑
92mi细胞。提供了产生表达所述car的细胞的方法,所述细胞包括但不限于cd147
‑
car
‑
nk细胞、cd147
‑
car
‑
t细胞或cd147
‑
car
‑
巨噬细胞。这些方法包括用编码所公开的car的载体转导或转染t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞。
16.在另外的实施方案中,提供了表达与诱导型启动子或增强子元件的激活剂可操作地连接的cd147
‑
car的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞。在一些实例中,所述t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞进一步表达编码与诱导型启动子或增强子元件的激活剂可操作地连接的抗gpc3特异性结合剂(如抗gpc3 scfv)的核酸。在其它实施方案中,提供了t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞,所述t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞表达与诱导型启动子或增强子元件可操作地连接的cd147 scfv并且进一步包含编码与诱导型启动子或增强子可操作地连接的抗gpc3嵌合抗原受体的核酸分子。
17.本文公开了治疗患有癌症的受试者的方法,所述方法例如通过向所述受试者施用本文公开的表达car的nk细胞、t细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞(例如cd147
‑
car nk细胞、cd147
‑
car
‑
t细胞或cd147
‑
car巨噬细胞)来进行。在一些实例中,所述受试者患有表达cd147的癌症。在特定的非限制性实例中,所述受试者患有肝细胞癌、成神经细胞瘤、乳腺癌、胰腺癌、白血病、淋巴瘤、多发性骨髓瘤、结直肠癌、肺癌、黑色素瘤、肾细胞癌、肉瘤或鼻咽癌。
18.本公开的前述和其它特征将根据以下参考附图进行的详细描述而变得更加明显。
19.附图简述
20.图1a
‑
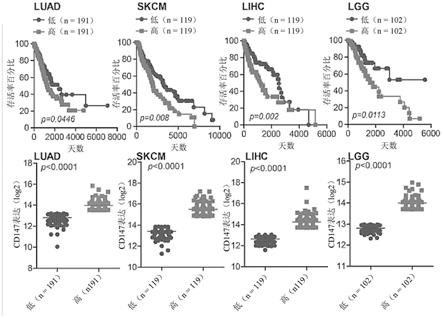
1e示出了cd147在肝细胞癌细胞中的过表达。图1a示出了来自tcga数据集的cd147上调表达针对人癌症患者的总存活率的预后值。基于相对cd147高表达和低表达(下图)的不同患者群体的存活率曲线(上图)。收集luad(肺腺癌)、skcm(皮肤黑色素瘤)、lihc(肝细胞癌)和lgg(脑低级胶质瘤)的数据进行分析。图1b示出了来自tcga数据集的多种癌症类型中正常组织(nt)与肿瘤样品(tp)之间的cd147表达的比较。数据表示三个单独实验的平均值
±
sem。采用未配对的学生t检验。*p<0.05、**p<0.01、***p<0.001和n.s(无显著性差异)。根据tcga数据库,每种癌症类型的全称是:brca(浸润性乳腺癌)、chol(胆管癌)、gbm(多形性胶质母细胞瘤)、lgg(脑低级胶质瘤)、hnsc(头颈部鳞状细胞癌)、kich(肾嫌色细胞癌)、kipan泛肾队列(kich+kirc+kirp)、kirp(肾乳头状细胞癌)、lihc(肝细胞癌)、luad(肺腺癌)、lusc(肺鳞状细胞癌)、prad(前列腺癌)、ucec(子宫内膜癌)。图1c示出了hcc细胞系中cd147的蛋白质印迹分析。将各种细胞系的1
×
106个细胞在200μl ripa缓冲液中裂解并与50μl 5x sds上样缓冲液混合,之后独立上样到sds
‑
page上。小鼠抗人cd147(him6,小鼠igg1)用于蛋白质印迹分析。抗gapdh用作上样对照。图1d示出了hcc细胞系(sk
‑
hep1和hepg2)中的cd147。用2μg fitc小鼠抗人cd147(抗cd147)或2μg fitc同种型小鼠igg1(同种型,κ)对sk
‑
hep1和hepg2(1
×
106个细胞)进行染色。在温育和洗涤之后,通过流式细胞术分析样品。数字表示每个样品的平均荧光强度(mfi)。图1e是示出了从pdx小鼠模型分离的人hcc肿瘤上的cd147抗原表达的组织病理学分析的一系列小图。来自分别用pbs、nk
‑
92mi和cd147
‑
car nk
‑
92mi处理的不同患者来源的异种移植(pdx)小鼠的肿瘤样品的代表性h&e(上行)和cd147 ihc染色(中间行)。底行示出了没有一抗的ihc染色。比例尺表示50μm。数据表示三个独立实验。
21.图2a
‑
2f示出了cd147
‑
car的设计和car修饰的nk
‑
92mi细胞的表型分型。图2a示出了基于sfg逆转录病毒载体的cd147特异性car的示意性设计。构建体包括cd147特异性单链抗体片段(经修饰的scfv,来自克隆5f6,migg1)、人igg1 ch2ch3铰链区和cd28跨膜区,随后是共刺激cd28、4
‑
1bb的细胞内结构域和cd3ζ的细胞内结构域。图2b示出了对亲本nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi表面上的car表达和cd56进行的流式细胞术分析。数据表示至少三个实验。图2c示出了在亲本nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi细胞中通过抗人cd3ζ特异性抗体检测内源性cd147和cd147
‑
car融合蛋白进行的car表达的蛋白质印迹分析。图2d示出了亲本nk
‑
92mi、car
‑
cd19(4
‑
1bb)
‑
nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi细胞中的nk激活和抑制标志物。每个数据表示至少三个或四个实验。流式图中的数字表示每个样品的平均荧光强度(mfi)。图2e示出了使用山羊抗人igg(h+l)对cd19
‑
car
‑
nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi上的car表达进行的流式细胞术分析。野生型nk
‑
92mi细胞用作对照。图2f示出了对nk
‑
92mi、cd19
‑
car
‑
nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi上的cd147表达进行的流式细胞术分析。图2g示出了nk
‑
92mi、cd19
‑
car
‑
nk
‑
92mi和cd147
‑
car
‑
nk
‑
92mi上的cd147表达水平的重叠流式细胞术谱。数据表示两个独立实验。
22.图3a
‑
3d示出了用其敏感靶向细胞刺激的cd147
‑
car
‑
nk
‑
92mi细胞中的cd107a脱粒和细胞因子产生。图3a示出了代表性流式细胞术数据,说明了在用培养基(对照)、sk
‑
hep1和hepg2 10小时后,nk
‑
92mi、cd19
‑4‑
1bb
‑
car、cd19
‑
cd28
‑
car和cd147
‑
car上的cd107a脱粒。效应子与靶细胞的比例为1:1.2。对细胞根据cd56阳性亚群进行门控以定量表面cd107a表达。图3b示出了在不同刺激下cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达百分比的定量数据,如所示。由通过不同条件刺激的cd147
‑
car
‑
nk
‑
92mi、cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi、cd19
‑
cd28
‑
car
‑
nk
‑
92mi和野生型nk
‑
92mi产生细胞因子tnf
‑
α(图3c)和ifn
‑
γ(图3d)。将nk
‑
92mi细胞与sk
‑
hep1细胞以1:1的效应子/靶比率或在培养基中共培养12小时。佛波醇
‑
12
‑
肉豆蔻酸酯
‑
13
‑
乙酸酯(pma)/离子霉素(iono)用于阳性对照。通过以下等式计算细胞因子释放比率:样品值/阳性对照值的平均值
×
100(%)。从至少三个或四个实验汇集数据。
23.图4a
‑
4c示出了两个hcc细胞系的cd147
‑
car
‑
nk
‑
92mi杀伤。图4a是huh7(左)和hco2(右)细胞系上的表面cd147分子的代表性流式细胞术染色。图4b是示出了通过标准4小时
51
cr释放测定测量的cd147
‑
car
‑
nk
‑
92mi的细胞毒性的图。cd147阳性huh7细胞用作cd147
‑
car
‑
nk
‑
92mi易感靶细胞。野生型nk
‑
92mi用作对照。图4c是示出了通过标准4小时
51
cr释放测定测量的cd147
‑
car
‑
nk
‑
92mi的细胞毒性的图。cd147阳性hco2细胞用作cd147
‑
car
‑
nk
‑
92mi易感靶细胞。野生型nk
‑
92mi用作对照。数据表示来自三个独立实验的平均值
±
sem。*p<0.05、**p<0.01并且***p<0.001。
24.图5a
‑
5g示出了在cd147阳性靶细胞刺激时cd147
‑
car
‑
nk
‑
92mi细胞的激活。图5a示出了代表性数据,示出在不同刺激时cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达百分比,如所示。用sk
‑
hep1或hepg2细胞刺激cd147
‑
car
‑
nk
‑
92mi细胞4小时。为了阻断cd147
‑
car与cd147分子之间的相互作用,向效应子和靶细胞的混合物中加入5μg小鼠抗人cd147(him6)。作为对照,使用5μg同种型小鼠igg(igg)或pbs(媒剂对照组),如所示。图5b和5c是示出了用cd147阳性sk
‑
hep1(图5b)和cd147阳性hepg2(图5c)细胞系刺激的cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a染色百分比的定量数据的图。仅野生型nk
‑
92mi细胞和仅cd147
‑
car
‑
nk
‑
92mi细胞用作对照,如所示。图5d示出了代表性数据,示出了用cd147阳性野生型(wt)sk
‑
hep1细胞系(上图)和cd147
‑
敲除(cd147
‑
/
‑
)sk
‑
hep1细胞系(中间图)刺激的cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达的百分比。仅培养基组用作对照。幼稚(naive)nk
‑
92mi和4
‑
1bb
‑
cd19
‑
car(cd19
‑
car)用作对照效应细胞。图5e示出了分别用cd147阳性sk
‑
hep1(wt)和cd147
‑
敲除sk
‑
hep1(cd147
‑
/
‑
)细胞系刺激的cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a染色百分比的定量数据。图5f示出了代表性数据,示出了用cd147阳性野生型(wt)hepg2细胞系(上图)和cd147
‑
敲除hepg2细胞系(中间图)刺激的cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达的百分比。仅培养基组用作对照。幼稚和cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi(cd19
‑
car)用作对照效应细胞。图5g示出了分别用cd147阳性hepg2(wt)和cd147
‑
敲除hepg2(cd147
‑
/
‑
)细胞系刺激的cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a染色百分比的定量数据。效应子与靶细胞的比例为1:1.2。通过cd56抗体表面染色对cd147
‑
car
‑
nk
‑
92mi细胞进行门控。通过流式细胞术用cd107a表面染色测量nk脱粒。数据表示三个单独实验的平均值
±
sem。*p<0.05、**p<0.01并且***p<0.001。
25.图6示出小鼠抗人cd147(him6)不影响cd19
‑
car
‑
nk细胞的细胞毒性。使用ffluc报告系统测定测量cd19
‑
car
‑
nk
‑
92mi的细胞毒性。简言之,将daudi
‑
ffluc细胞(1
×
104个)预接种在经matrigel(bd)处理的96孔光学底部微板中过夜。将两种不同效应子/靶比率(5:1和1:1,如所示)下的效应细胞(cd19
‑
car
‑
nk
‑
92mi)共培养6小时。通过酶标仪对发光信号进行定量,并且计算特异性裂解的百分比。从三个独立实验汇集数据。误差条示出了
±
sem(平均值的标准误差)。*p<0.05、**p<0.01并且***p<0.001。
26.图7a和7b示出了cd147
‑
car
‑
nk
‑
92mi杀伤活性的代表性图像。将效应细胞(1
×
104个)cd147
‑
car
‑
nk
‑
92mi和nk
‑
92mi与靶细胞ffluc
‑
gfp
‑
sk
‑
hep1(图7a,顶部)(1
×
104个)和ffluc
‑
gfp
‑
hepg2(图7a,底部)在96孔光学底部微板中共培养12小时。常规荧光显微镜检测gfp荧光(上泳道),并且明场(下泳道)用于在相同设置下可视化cd147
‑
car
‑
nk
‑
92mi杀伤活性。通过imagej软件(nih)对gfp荧光强度进行定量(图7b)。通过graph prism 5软件(graphpad software,san diego,ca,usa)绘制gfp的定量平均荧光强度(mfi)。
27.图8a
‑
8n示出了cd147
‑
car
‑
t细胞和cd147
‑
car
‑
nk细胞在体外特异性杀伤cd147阳性肿瘤细胞。图8a示出了通过ffluc报告基因测定测量的原代cd147
‑
car
‑
t细胞的细胞毒性。cd147阳性ffluc
‑
gfp
‑
sk
‑
hep1用作cd147
‑
car
‑
t易感靶细胞。κ
‑
car t细胞用作每个实验的对照组。图8b和8c示出了通过ffluc报告基因测定,使用敲除
‑
cd147 ffluc
‑
gfp
‑
sk
‑
hep1细胞系和hepg2细胞系的cd147
‑
car
‑
t细胞的细胞毒性显著降低。数据表示来自三个独立实验的平均值
±
sem。图8d示出了通过4小时标准
51
cr释放测定测量的原代cd147
‑
car
‑
nk细胞的细胞毒性。cd147阳性ffluc
‑
gfp
‑
sk
‑
hep1用作cd147
‑
car
‑
t易感靶细胞。κ
‑
car t细胞用作每个实验的对照组。图8e和8f表明通过4小时标准
51
cr释放测定,使用敲除
‑
cd147ffluc
‑
gfp
‑
sk
‑
hep1细胞系和hepg2细胞系的原代cd147
‑
car
‑
nk细胞的细胞毒性显著降低。数据表示来自三个独立实验的平均值
±
sem。图8g示出了抗nkg2d抗体阻断原代cd147
‑
car
‑
nk对ffluc
‑
gfp
‑
sk
‑
hep1的自然杀伤。将不同比例的原代cd147
‑
car
‑
nk细胞与ffluc
‑
gfp
‑
sk
‑
hep1、敲除
‑
cd147 ffluc
‑
gfp
‑
sk
‑
hep1细胞系或敲除
‑
cd147 ffluc
‑
gfp
‑
sk
‑
hep1细胞系以及5μg抗nkg2d共培养4小时。使用ffluc报告基因测定。数据表示来自三个独立实验的平均值
±
sem。图8h示出了通过标准4小时
51
cr释放测定测量cd147
‑
car
‑
nk
‑
92mi
对sk
‑
hep1的细胞毒性。将效应细胞(cd147
‑
car
‑
nk
‑
92mi和nk
‑
92mi)与每孔1
×
104个靶细胞ffluc
‑
gfp
‑
sk
‑
hep1共培养。四小时后,收集上清液并用γ计数器测量释放的
51
cr。图8i和8j是用于cd147
‑
car
‑
nk
‑
92mi特异性杀伤ffluc
‑
gfp
‑
sk
‑
hep1和ffluc
‑
gfp
‑
hepg2细胞系的ffluc报告基因系统测定。将效应细胞(cd147
‑
car
‑
nk
‑
92mi和nk
‑
92mi)与每孔1
×
104个ffluc
‑
gfp
‑
sk
‑
hep1(图8i)或ffluc
‑
gfp
‑
hepg2(图8j)靶细胞在96孔光学底部微板中共培养6小时。在与d
‑
荧光素温育5分钟后,通过酶标仪测量发光信号以计算nk细胞的细胞毒性。所使用的对照组是与cd147阳性ffluc
‑
gfp
‑
sk
‑
hep1或cd147阳性ffluc
‑
gfp
‑
hepg2温育的野生型nk
‑
92mi。图8k和8l表明通过ffluc报告基因系统测定,使用敲除
‑
cd147 ffluc
‑
gfp
‑
sk
‑
hep1(图8k)和敲除
‑
cd147
‑
ffluc
‑
gfp
‑
hepg2(图8l)的cd147
‑
car
‑
nk
‑
92mi细胞系的细胞毒性降低。将效应细胞(cd147
‑
car
‑
nk
‑
92mi和nk
‑
92mi)与每孔1
×
104个野生型或cd147敲除靶细胞在96孔光学底部微板中共培养6小时。在与d
‑
荧光素温育5分钟后,通过酶标仪测量发光信号以计算nk细胞的细胞毒性。图8m和8n是示出了抗cd147(克隆,him6)抑制针对ffluc
‑
gfp
‑
sk
‑
hep1(图8m)和ffluc
‑
gfp
‑
hepg2(图8n)的cd147
‑
car
‑
nk
‑
92mi特异性裂解效果的图。将效应细胞(cd147
‑
car
‑
nk
‑
92mi和nk
‑
92mi)与每孔1
×
104个ffluc
‑
gfp
‑
sk
‑
hep1或ffluc
‑
gfp
‑
hepg2靶细胞在96孔光学底部微板中共培养6小时。在与d
‑
荧光素温育5分钟后,通过酶标仪测量发光信号以计算nk细胞的细胞毒性。数据表示来自三个独立实验的平均值
±
sem。*p<0.05、**p<0.01并且***p<0.001。
28.图9a和9b示出了通过流式细胞术和蛋白质印迹对敲除
‑
cd147 sk
‑
hep1和hepg2细胞系的验证。图9a示出了野生型(wt)sk
‑
hep1和cd147
‑
/
‑
‑
sk
‑
hep1细胞系(顶部)以及野生型(wt)hepg2和cd147
‑
/
‑
‑
hepg2细胞系(底部)上的表面cd147分子的染色。图9b示出了对野生型(wt)sk
‑
hep1和cd147
‑
/
‑
‑
sk
‑
hep1细胞系以及野生型(wt)hepg2和cd147
‑
/
‑
‑
hepg2细胞系上的cd147分子的蛋白质印迹分析。gapdh用作上样对照(底部)。
29.图10a
‑
10c示出了cd147
‑
car
‑
nk
‑
t细胞特异性杀伤cd147阳性肿瘤细胞。通过ffluc报告系统测定测量cd147
‑
car
‑
t细胞的细胞毒性。cd147阳性ffluc
‑
egfp
‑
hep
‑
g2(图10a)和cd147阳性ffluc
‑
egfp
‑
sk
‑
hep1(图10b)用作cd147
‑
car
‑
t易感靶细胞。κ
‑
car t细胞用作每个实验的对照组。图10c示出了通过ffluc报告系统测定,使用敲除
‑
cd147 ffluc
‑
gfp
‑
sk
‑
hep1细胞系的cd147
‑
car
‑
t细胞的细胞毒性显著降低。简言之,将效应细胞(cd147
‑
car
‑
t细胞)与靶细胞ffluc
‑
egfp
‑
sk
‑
hep1或cd147敲除ffluc
‑
egfp
‑
sk
‑
hep1(1
×
104个)在96孔光学底部微板中共培养6小时。通过酶标仪读取的发光信号测量cd147
‑
car
‑
t细胞的细胞毒性。数据表示来自三个独立实验的平均值
±
sem。*p<0.05、**p<0.01并且***p<0.001。
30.图11a
‑
11d示出了异种移植小鼠模型中的hcc的cd147
‑
car
‑
t
‑
92mi细胞对照进展。图11a是hcc异种移植模型的实验设计图。简言之,向nsg小鼠皮下注射预混有等体积matrigel(第0天)的4
×
106个sk
‑
hep1细胞。监测小鼠的肿瘤负担(达到近50mm2)并在第4天进行随机分组。在第5天(d5),向小鼠注射(静脉内)一剂1
×
107个效应cd147
‑
car
‑
t(第1组)细胞以及2
×
104iu il
‑
2。仅向对照组注射媒剂(pbs)对照(第2组)。在第7天、第9天和第16天,对每组施用相同的治疗。图11b示出了分别用cd147
‑
car
‑
t和pbs(媒剂对照组)治疗的sk
‑
hep1异种移植的肿瘤负担的定量。所有结果都是平均值
±
sem。通过双向anova分析来分析每组的差异。图11c是在指示的时间点评估每组的定量体重。图11d示出了在用cd147
‑
car
‑
t细胞和pbs(媒剂对照组)治疗后,携带肿瘤的小鼠的卡普兰
‑
迈耶存活曲线。通过对数
秩(mantel
‑
cox)检验分析p值。
31.图12a
‑
12d示出了小鼠异种移植模型中cd147
‑
car
‑
nk
‑
92
‑
mi细胞对hcc的抗肿瘤功效。图12a是hcc异种移植模型中原代cd147
‑
car
‑
nk的抗肿瘤功效的实验设计图。在肿瘤植入5天(第5天)后,向小鼠注射(静脉内)一剂1
×
107个效应原代cd147
‑
car
‑
nk细胞以及2
×
104iu il
‑
2。向对照组注射相同数量的未经转导的原代nk细胞以及2
×
104iu il
‑
2(第2组)或仅注射pbs(第3组)。在第5天、第7天、第9天、第16天和第18天,对每组施用相同的治疗,如所示。图12b示出了分别用原代cd147
‑
car
‑
nk、未经转导的原代nk和pbs(媒剂对照组)治疗的hcc异种移植小鼠的定量肿瘤负担。所有结果都是平均值
±
sem。通过双向anova分析来分析每组的差异。图12c示出了在指示的时间点评估每组的定量体重。图12d是在用原代cd147
‑
car
‑
nk、亲本原代nk组和pbs(媒剂对照组)治疗后的携带肿瘤的小鼠的卡普兰
‑
迈耶存活曲线。通过对数秩(mantel
‑
cox)检验的p值分析。通过双向anova分析来分析每组的差异。*p<0.05、**p<0.01并且***p<0.001指示为cd147
‑
car修饰的细胞治疗组与对照组的比较。
32.图13示出了在体外杀伤hcc细胞系中,经辐照的cd147
‑
car
‑
nk
‑
92mi细胞与未经辐照的cd147
‑
car
‑
nk
‑
92mi细胞之间的相当的抗hcc肿瘤活性。通过标准4小时
51
cr释放测定测量经辐照和未经辐照的cd147
‑
car
‑
nk
‑
92mi的细胞毒性。cd147阳性野生型hepg2肿瘤细胞(实验组,左图)或cd147
‑
敲除(cd147ko,右图)hepg2肿瘤细胞系用作cd147
‑
car
‑
nk
‑
92mi易感靶细胞。经辐照和未经辐照的野生型nk
‑
92mi细胞用作效应细胞对照组。数据表示三个独立实验。所有数据都呈现为平均值
±
sem。
33.图14a
‑
14d示出了在异种移植小鼠模型中,经辐照的cd147
‑
car
‑
nk
‑
92mi细胞与未经辐照的cd147
‑
car
‑
nk
‑
92mi细胞在控制hcc进展时相当的抗hcc肿瘤活性。图14a是hcc异种移植模型的实验设计图。向nsg小鼠注射(皮下)预混有等体积matrigel(第0天)的2
×
106个sk
‑
hep1细胞。治疗前一天(第4天),确定肿瘤负担(达到近50mm2),并将小鼠随机分组。在第5天(d5)向小鼠注射(静脉内)一剂未经辐照的1
×
107个效应cd147
‑
car
‑
nk
‑
92mi(第1组)细胞以及2
×
104iu il
‑
2。向对照组注射于pbs中的相同数量的经辐照的cd147
‑
car
‑
nk
‑
92mi以及2
×
104iu il
‑
2(第2组)或仅注射媒剂对照(第3组)。在第7天、第9天、第16天和第18天,对每组施用相同的治疗。图14b示出了分别用cd147
‑
car
‑
nk
‑
92mi和pbs(媒剂对照组)治疗的sk
‑
hep1异种移植的肿瘤负担的定量。所有结果都是平均值
±
sem。通过双向anova分析来分析每组的差异。图14c是在指示的时间点评估每组的定量体重的图。图14d示出了在用cd147
‑
car
‑
nk
‑
92mi细胞和pbs(媒剂对照组)治疗后,携带肿瘤的小鼠的卡普兰
‑
迈耶存活曲线。通过对数秩(mantel
‑
cox)检验分析p值。数据表示两个独立实验。所有数据都呈现为平均值
±
sem。
34.图15a
‑
15d示出了在异种移植小鼠模型中cd147
‑
car
‑
nk
‑
92mi细胞控制hcc的进展。图15a是hcc异种移植模型的实验设计图。简言之,向nsg小鼠皮下注射预混有等体积matrigel(第
‑
7天)的4
×
106个sk
‑
hep1细胞。在第0天(第1天的前一天),确定肿瘤负担(约50mm2)并将小鼠随机分组。在第1天(d1),向小鼠注射(静脉内)一剂1
×
107个效应cd147
‑
car
‑
nk
‑
92mi(第1组)细胞以及2
×
104iu il
‑
2。向对照组注射于pbs中的相同数量的nk
‑
92mi以及2
×
104iu il
‑
2(第2组)或仅注射媒剂对照(第3组)。在第3天和第5天,对每组施用相同的治疗。图15b示出了分别用cd147
‑
car
‑
nk
‑
92mi、亲本nk
‑
92mi细胞(对照组)和pbs(媒
剂对照组)治疗的sk
‑
hep1异种移植的肿瘤负担的定量。所有结果都是平均值
±
sem。通过双向anova分析来分析每组的差异。*p<0.05、**p<0.01和***p<0.001指示为cd147
‑
car治疗组与nk
‑
92mi治疗组的比较。+p<0.05、++p<0.01和+++p<0.001指示为cd147
‑
car治疗组与媒剂对照治疗组的比较。图15c示出了在指示的时间点评估每组的定量体重,并且图15d示出了在用cd147
‑
car
‑
nk
‑
92mi细胞、亲本nk
‑
92mi组和pbs(媒剂对照组)治疗后,携带肿瘤的小鼠的卡普兰
‑
迈耶存活曲线。通过对数秩(mantel
‑
cox)检验分析p值。
35.图16a
‑
16d示出了在pdx小鼠模型中cd147
‑
car
‑
nk
‑
92mi细胞控制hcc的进展。图16a是在由the jackson laboratory生成的肝pdx模型中cd147
‑
car
‑
nk
‑
92mi的抗肿瘤功效的实验设计图。患者来源的异种移植肝癌小鼠购自the jackson laboratory。在肿瘤植入4周后(第1天),确定肿瘤负担(约50mm2)并将小鼠随机分组。然后向指示的小鼠注射(静脉内)一剂5
×
106个效应cd147
‑
car
‑
nk
‑
92mi细胞以及2
×
104iu il
‑
2。向对照组注射于pbs中的相同数量的nk
‑
92mi细胞以及2
×
104iu il
‑
2(第2组)或仅注射pbs(第3组)。在第6天、第8天、第11天、第15天、第18天、第22天和第26天,对每组施用相同的治疗,如所示。图16b是分别用cd147
‑
car
‑
nk
‑
92mi细胞、亲本nk
‑
92mi细胞(对照组)和pbs(媒剂对照组)治疗的pdx小鼠的定量肿瘤负担。所有结果都是平均值
±
sem。通过双向anova分析来分析每组的差异。*p<0.05、**p<0.01和***p<0.001指示为cd147
‑
car治疗组与nk
‑
92mi治疗组的比较。+p<0.05、++p<0.01和+++p<0.001指示为cd147
‑
car治疗组与媒剂对照治疗组的比较。图16c示出了在指示的时间点评估每组的定量体重。图16d是在用cd147
‑
car
‑
nk
‑
92mi细胞、亲本nk
‑
92mi组和pbs(媒剂对照组)治疗后,携带肿瘤的小鼠的卡普兰
‑
迈耶存活曲线。通过对数秩(mantel
‑
cox)检验的p值分析。
36.图17a
‑
17d示出了cd147
‑
car
‑
t细胞对cd147阳性hcc细胞的杀伤。针对cd147
‑
car
‑
t细胞特异性杀伤ffluc
‑
egfp
‑
hepg2的ffluc报告基因系统测定(图17a)。对照组使用与cd147阳性ffluc
‑
egfp
‑
hepg2一起温育的野生型κ
‑
car
‑
t细胞。图17b示出了通过ffluc报告系统测定,使用敲除
‑
cd147 ffluc
‑
gfp
‑
hepg1的cd147
‑
car
‑
t细胞的细胞毒性降低。图17c示出了通过标准4小时
51
cr释放测定测量的cd147
‑
car
‑
t细胞的细胞毒性。图17d示出了通过标准4小时
51
cr释放测定,使用敲除
‑
cd147 ffluc
‑
gfp
‑
hepg1的cd147
‑
car
‑
t细胞的细胞毒性显著降低。
37.图18a和18b示出了cd147 car
‑
t或cd147 car
‑
nk细胞的cd107a脱粒。图18a示出了代表性流式细胞术数据,表明了在用培养基(对照)、sk
‑
n
‑
sh肿瘤细胞10小时后,cd147
‑
car
‑
t细胞上的cd107a脱粒。对细胞根据cd56阳性亚群进行门控以对表面cd107a表达进行定量。图18b示出了在不同刺激下cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达百分比的定量数据,如所示。从至少三个或四个实验汇集数据。
38.图19示出了cd147
‑
car
‑
nk
‑
92mi细胞在体外对daoy细胞的细胞毒性。
39.图20是示出了经优化的cd147 scfv核酸序列(seq id no:1)与原始scfv序列(seq id no:3)和共有序列(seq id no:13)进行比较的比对。
40.图21a
‑
21e示出了患者来源的原代cd147
‑
car
‑
nk细胞在体外特异性杀伤cd147阳性肿瘤细胞。图21a是来自hcc患者不同阶段的肝样品的代表性h&e(顶部)和ihc(底部)染色。图21c是从肝癌组织的不同区域采集hcc样品的实验设计图。简言之,获得三个关注区域(肿瘤区、相邻区和非肿瘤区)。从这些区分离原代nk细胞(图21b所示)。图21d是对来自肝组
织不同区的cd147
‑
car阳性原代nk细胞的流式细胞术分析。图21e示出了通过4小时标准
51
cr释放测定测量的原代cd147
‑
car
‑
nk细胞的细胞毒性。
41.图22a和22b是对cd147在不同类型细胞上的表达的代表性流式细胞术分析(图22a)和通过标准4小时
51
cr释放测定针对具有不同cd147表达水平的靶细胞测量的cd147
‑
car
‑
nk
‑
92mi的细胞毒性(图22b)。数据表示两个独立实验。所有数据都呈现为平均值
±
sem。
42.图23a
‑
23h表明synnotch gpc3诱导型cd147
‑
car t细胞选择性靶向gpc3+cd147+hepg2细胞,但不靶向gpc3+cd147
‑
或gpc3
‑
cd147+hepg2细胞。图23a是sfg逆转录病毒载体中gpc3
‑
gal4vp64
‑
synnotch受体和基于phr慢病毒载体的cd147
‑
car的示意性设计。sfg逆转录病毒载体含有egfp,其可以用作用于选择gpc3
‑
gal4vp64
‑
synnotch阳性细胞的标志物。phr构建体包括cd147特异性单链抗体片段(克隆,5f6)、人igg1 ch2ch3铰链区和cd28跨膜区,随后是共刺激cd28、4
‑
1bb的细胞内结构域和cd3ζ的细胞内结构域。phr慢病毒载体含有mcherry,其可以用作用于选择cd147
‑
car阳性细胞的标志物。图23b是“逻辑门控”gpc3
‑
synnotch和cd147
‑
car的示意性设计,其当两种抗原共表达时显示诱导的细胞毒性,但当所述两种抗原在旁邻或健康细胞上单独表达时则不显示诱导的细胞毒性。图23c和23d是gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry载体共转导的t细胞的示意性实验设计(图23c)以及对gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry表达进行的代表性流式细胞术分析(图23d)。图23e是gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry载体通过gpc3
高
cd147
低
hepg2细胞系的致敏共转导到t细胞中,并且随后在不同的经转导t细胞亚群中进行cd147
‑
car表达分析的示意性实验设计,所述经转导t细胞亚群包括仅mcherry阳性亚群、仅gfp阳性亚群、gfp和mcherry双阳性亚群以及gfp和mcherry双阴性亚群。图23f示出了对在不同的经转导t细胞亚群的表面上的cd147
‑
car表达进行的代表性流式细胞术分析。在每个代表性流式细胞术图中显示了平均荧光强度(mfi)和cd147
‑
car百分比两者。图23g是对cd147和gpc3在hepg2肿瘤细胞系上的表达进行的代表性流式细胞术分析。图23h示出了在由不同的hepg2肿瘤细胞系进行“致敏和触发”方案2小时后,对在不同的经转导t细胞亚群上的表面cd107a表达进行的定量分析。数据表示两个独立实验。
43.图24示出了γ分泌酶抑制剂(mk
‑
0752,notch信号传导抑制剂)特异性阻断在gpc3
‑
synnotch
‑
egfp+和cd147
‑
car
‑
mcherry+原代t细胞亚群中的gpc3
‑
synnotch诱导型cd147
‑
car表达,但不阻断在原代t细胞的其它亚群中的表达。对不同原代t细胞亚群中的cd147
‑
car表达进行的代表性流式细胞术分析(中间图)。分别用dmso(0.3%;对照)、mk
‑
0752(10μm)、tapi
‑
1(10μm)、gi254023x(10μm)和mk
‑
0752+tapi
‑
1+gi254023x的组合处理经转导的t细胞。同时,这些细胞在存在cd147ko gpc3high hepg2细胞的情况下致敏。通过流式细胞术分析在不同的经转导的t细胞亚群的表面上的cd147
‑
car表达。在每个代表性流式细胞术图中显示了平均荧光强度(mfi)和cd147
‑
car百分比两者。数据表示两个独立实验。所有数据都呈现为平均值
±
sem。
44.图25a
‑
25h示出了synnotch cd147诱导型gpc3
‑
car t细胞选择性靶向gpc3+cd147+hepg2细胞,但不靶向gpc3+cd147
‑
或gpc3
‑
cd147+hepg2细胞。图25a是sfg逆转录病毒载体中的myc
‑
cd147
‑
gal4vp64
‑
synnotch受体和基于phr慢病毒载体的gpc3
‑
car的示意性设计。sfg逆转录病毒载体含有myc标签,其可以用作用于选择cd147
‑
gal4vp64
‑
synnotch阳性细
胞的标志物。phr构建体由gpc3特异性单链抗体片段(scfv,克隆5f6,migg1)、人igg1 ch2ch3铰链区和cd28跨膜区,随后是共刺激cd28、4
‑
1bb的细胞内结构域和cd3ζ的细胞内结构域组成。phr慢病毒载体含有mcherry,其可以用作用于选择具有gpc3
‑
car阳性细胞的细胞的标志物。图25b是“逻辑门控”cd147
‑
synnotch和gpc3
‑
car的示意性设计,其当两种抗原共表达时显示诱导的细胞毒性,但当所述两种抗原在旁邻或健康细胞上单独表达时则不被激活。图25c和25d是myc
‑
cd147
‑
synnotch和gpc3
‑
car
‑
mcherry载体共转导的t细胞的示意性实验设计(图25c)以及对myc
‑
cd147
‑
synnotch和gpc3
‑
car
‑
mcherry表达进行的代表性流式细胞术分析(图25d)。图25e是myc
‑
cd147
‑
synnotch和gpc3
‑
car
‑
mcherry载体通过gpc3
高
cd147
低
hepg2细胞系致敏共转导在t细胞中,并且随后在不同的经转导的t细胞亚群中进行gpc3
‑
car表达分析的示意性实验设计,所述经转导的t细胞亚群包括仅mcherry阳性亚群、仅gfp阳性亚群、gfp和mcherry双阳性亚群以及gfp和mcherry双阴性亚群。图25f是对在不同的经转导的t细胞亚群的表面上的gpc3
‑
car表达进行的代表性流式细胞术分析。在每个代表性流式细胞术图中显示了平均荧光强度(mfi)和gpc3
‑
car百分比两者。图25g是在由不同的hepg2肿瘤细胞系进行“致敏和触发”方案后,对在不同的经转导的t细胞亚群上的表面cd107a表达进行的代表性流式细胞术分析。图25h示出了在由不同的hepg2肿瘤细胞系进行“致敏和触发”方案后,对在不同的经转导的t细胞亚群上的表面cd107a表达进行的定量分析。cd107a mfi的倍数变化计算如下:[(样品mfi
‑
仅致敏mfi)/仅致敏mfi]。数据表示两个独立实验。所有数据都呈现为平均值
±
sem。*p<0.05、**p<0.01并且***p<0.001。
[0045]
图26a
‑
26d示出了synnotch gpc3诱导型cd147
‑
car t细胞选择性杀伤gpc3
高
cd147
高
hepg2细胞,但不杀伤cd147
敲除
gpc3
高
hepg2细胞。图26a和26b是对cd3、cd56、gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry表达进行的代表性流式细胞术分析。用cd147
‑
car
‑
mcherry慢病毒转导原代pbmc。使用流式细胞术分选这些mcherry阳性t细胞,然后用gpc3
‑
synnotch
‑
gfp逆转录病毒进行二次转导。分别显示了对cd3和cd56(图26a)以及gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry表达(图26b)进行的代表性流式细胞术分析。图26c是通过7小时ffluc报告基因测定测量的原代gpc3
‑
synnotch
‑
gfp
‑
cd147
‑
car
‑
mcherry t细胞对hepg2
‑
cd147
高
‑
gpc3
高
和hepg2
‑
cd147
敲除
‑
gpc3
高
的细胞毒性的图。图26d是示出了通过7小时cr
‑
51释放测定测量的原代gpc 3
‑
synnotch
‑
gfp
‑
cd147
‑
car
‑
mcherry t细胞对hepg2
‑
cd147
高
‑
gpc3
高
和hepg2
‑
cd147
敲除
‑
gpc3
高
的细胞毒性的图。数据表示两个独立实验。
[0046]
序列表
[0047]
使用核苷酸碱基和氨基酸的标准字母缩写示出本文或随附序列表中列出的任何核酸和氨基酸序列,如37 c.f.r.
§
1.822中所限定。在至少一些情况下,每个核酸序列只示出了一条链,但是对所显示的链的任何引用被理解为包括互补链在内。
[0048]
seq id no:1是编码经修饰的cd147 scfv的核酸序列。核苷酸349
‑
409是接头序列。
[0049]
seq id no:2是经修饰的cd147 scfv的氨基酸序列。
[0050]
seq id no:3是编码起始cd147 scfv的核酸序列。
[0051]
seq id no:4是编码cd147
‑
car的核酸序列。信号肽:核苷酸1
‑
57;vh结构域:核苷酸58
‑
411;接头序列:核苷酸412
‑
468;vl结构域:核苷酸469
‑
792;cd28 tm结构域
‑
41bb细胞内结构域
‑
cd3ζ结构域:核苷酸793
‑
2202。
[0052]
seq id no:5是cd147
‑
car的氨基酸序列。信号肽:氨基酸1
‑
19;vh结构域:氨基酸20
‑
137;接头序列:氨基酸138
‑
156;vl结构域:氨基酸157
‑
264;cd28 tm结构域
‑
41bb细胞内结构域
‑
cd3ζ结构域:氨基酸269
‑
734。
[0053]
seq id no:6是编码具有诱导型胱天蛋白酶9的cd14
‑
car的核酸序列。icaspase9序列是核苷酸355
‑
1200。
[0054]
seq id no:7是cd147
‑
icaspase 9
‑
car的氨基酸序列。氨基酸119
‑
400是icaspase9。
[0055]
seq id no:8是抗cd147 vh cdr结构域的氨基酸序列。
[0056]
seq id no:9是抗cd147 vl cdr结构域的氨基酸序列。
[0057]
seq id no:10和11是用于生成cd147敲除细胞系的靶向cd147的向导rna。
[0058]
seq id no:12是示例性il
‑
15受体细胞内结构域。
[0059]
seq id no:13是经优化的cd147 scfv核酸序列(seq id no:1)与原始scfv序列(seq id no:3)相比的共有核酸序列。
[0060]
seq id no:14是gal4uas cd147
‑
car构建体的核酸序列。
[0061]
seq id no:15是phr_gal4uas
‑
cd147
‑
car
‑
pgk_mcherry载体的核酸序列。
[0062]
seq id no:16是gpc3
‑
car的核酸序列。
[0063]
seq id no:17是编码gal4
‑
vp64激活物的核酸。
[0064]
seq id no:18
‑
35是用于质粒构建的引物的核酸序列。
具体实施方式
[0065]
本文公开了表达新的cd147靶向car的免疫细胞(包括t细胞和nk细胞)。cd147抗原的生物学性质允许cd147
‑
car
‑
nk细胞和cd147
‑
car
‑
t细胞在体外和体内对肝细胞癌产生强效抗肿瘤活性。另外,cd147
‑
car
‑
nk细胞还能够在体外杀伤人成神经细胞瘤细胞。
[0066]
由于cd147还以不同表达水平在若干器官上表达,因此cd147
‑
car修饰的免疫细胞可能潜在地表现出“上靶(on
‑
target)、脱肿瘤(off
‑
tumor)”毒性。本文公开了用于解决这种潜在毒性的构建体和方法,包括“自杀基因”(如诱导型胱天蛋白酶9)和如仅在结合如cd147和gpc3等两种抗原时才被激活的表达car的细胞等组合治疗。
[0067]
i.术语
[0068]
除非另有说明,否则技术术语均根据常规用法使用。分子生物学中的常见术语的定义可以在以下中找到:lewin's genes x,krebs等编辑,jones&bartlett publishers,2009(isbn 0763766321);kendrew等(编辑),the encyclopedia of molecular biology,blackwell publishers出版,1994(isbn 0632021829);robert a.meyers(编辑),molecular biology and biotechnology:a comprehensive desk reference,wiley,john&sons,inc.出版,1995(isbn 0471186341);和george p.r
é
dei,encyclopedic dictionary of genetics,genomics,proteomics and informatics,第3版,springer,2008(isbn:1402067534)以及其它类似的参考。
[0069]
除非另有解释,否则本文所用的所有技术和科学术语都具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。除非上下文另外明确指出,否则单数术语“一个/种(a)”、“一个/种(an)”和“所述(the)”包含复数指代。“包含a或b”意指包括a或b或a和
b。应进一步理解,针对核酸或多肽给出的所有碱基大小或氨基酸大小以及所有分子量或分子质量值都是近似的并且是为了描述而提供的。
[0070]
尽管类似或等效于本文所描述的方法和材料的方法和材料可以用于实践或测试本公开,但是下面描述了合适的方法和材料。本文所提及的所有出版物、专利申请、专利和其它参考文献通过引用整体并入,genbank登录号也是如此。在冲突的情况下,应以本说明书(包括术语的解释)为准。另外,材料、方法和实例仅是说明性的并且不意图是限制性的。
[0071]
为了便于回顾本公开的各个实施方案,提供了对具体术语的以下解释:
[0072]
抗体:包含识别和结合(如特异性识别和特异性结合)抗原表位的至少一个可变区的多肽配体。哺乳动物免疫球蛋白分子由重(h)链和轻(l)链构成,每条链都具有可变区,分别被称为可变重链(v
h
)区和可变轻链(v
l
)区。v
h
区和v
l
区一起负责结合由抗体识别的抗原。哺乳动物免疫球蛋白有五个主要的重链类别(或同种型),其决定抗体分子的功能活性:igm、igd、igg、iga和ige。
[0073]
抗体可变区含有“框架”区和被称为“互补决定区”或“cdr”的高变区。cdr主要负责与抗原的表位结合。抗体的框架区用于在三维空间中定位和比对cdr。可以使用许多众所周知的编号方案中的任何编号方案容易地确定给定cdr的氨基酸序列边界,所述编号方案包括以下描述的那些:kabat等(sequences of proteins of immunological interest,u.s.department of health and human services,1991;“kabat”编号方案);chothia等(参见chothia和lesk,j mol biol 196:901
‑
917,1987;chothia等,nature 342:877,1989;以及al
‑
lazikani等,jmb 273,927
‑
948,1997;“chothia”编号方案),以及immunogenetics(imgt)数据库(参见lefranc,nucleic acids res 29:207
‑
9,2001;“imgt”编号方案)。在线维护kabat和imgt数据库。
[0074]
单链抗体(scfv)是遗传工程化的分子,含有由合适的多肽接头连接的一个或多个抗体的v
h
和v
l
结构域作为遗传融合的单链分子(参见例如bird等,science,242:423
‑
426,1988;huston等,proc.natl.acad.sci.,85:5879
‑
5883,1988;ahmad等,clin.dev.immunol.,2012,doi:10.1155/2012/980250;marbry,idrugs,13:543
‑
549,2010)。scfv中v
h
‑
结构域和v
l
‑
结构域的分子内定向对于scfv来说通常不是决定性的。因此,可以使用具有两种可能排列(v
h
结构域
‑
接头结构域
‑
v
l
结构域;v
l
结构域
‑
接头结构域
‑
v
h
结构域)的scfv。在dsfv中,v
h
和v
l
已经发生突变以引入二硫键来稳定链的缔合。双抗体也包含在内,所述双抗体是二价双特异性抗体,其中v
h
和v
l
结构域在单个多肽链上表达,但使用的接头太短,以至于无法使同一链上的两个结构域之间配对,由此迫使结构域与另一条链的互补结构域配对并产生两个抗原结合位点(参见例如holliger等,proc.natl.acad.sci.,90:6444
‑
6448,1993;poljak等,structure,2:1121
‑
1123,1994)。
[0075]
抗体还包括如嵌合抗体(如人源化鼠抗体)和异源缀合抗体(如双特异性抗体)等遗传工程化形式。还参见pierce catalog and handbook,1994
‑
1995(pierce chemical co.,rockford,il);kuby,j.,immunology,第3版,w.h.freeman&co.,new york,1997。
[0076]
癌症:以异常或不受控制的细胞生长为特征的恶性肿瘤。通常与癌症相关的其它特征包括转移、干扰相邻细胞的正常功能、以异常水平释放细胞因子或其它分泌性产物以及抑制或加重炎症或免疫应答、侵袭如淋巴结等周围或远端组织或器官。“转移性疾病”是指癌细胞已经例如通过血流或淋巴系统离开原始肿瘤位点并迁移到身体的其它部位。
[0077]
cd147:也被称为basigin(bsg),细胞外基质金属蛋白酶抑制剂(emmprin或emprin)。在正常细胞功能和疾病中具有多种功能的跨膜糖蛋白(hahn等,j.leukocyte biol.98:33
‑
48,2015)。cd147在免疫细胞中对于t细胞激活和增殖以及细胞迁移、粘附和侵袭很重要(hahn等,j.leukocyte biol.98:33
‑
48,2015)。cd147在不同细胞类型(例如造血细胞、上皮细胞和内皮细胞)上以不同水平表达(liao等,mol.cell biol.31:2591
‑
2604,2011)并且可以在如hcc等疾病状态下显著上调。
[0078]
cd147序列可公开获得。例如,genbank登录号:nm_198590、nm_198591、nm_001728、nm_198589和nm_001322243公开了人cd147核酸序列,并且genbank登录号:np_940992、np_940993、np_001719、np_940991和np_001309172公开了人cd147氨基酸序列。类似地,nm_009768和nm_001077184公开了小鼠cd147核酸序列并且genbank登录号np_033898和np_001070652公开了小鼠cd147氨基酸序列。所有这些序列以于2019年3月15日在genbank中存在的形式通过引用并入。
[0079]
嵌合抗原受体(car):包括抗原结合部分(如单结构域抗体或scfv)和如来自t细胞受体(例如cd3ζ)的信号传导结构域等信号传导结构域的嵌合分子。通常,car包括抗原结合部分、跨膜结构域和细胞内结构域。细胞内结构域通常包括具有如cd3ζ或fcεriγ等基于免疫受体酪氨酸的激活基序(itam)的信号传导链。在一些情况下,细胞内结构域还包括如cd28、4
‑
1bb(cd137)、icos、ox40(cd134)、cd27和/或dap10等至少一个另外的共刺激结构域的细胞内部分。
[0080]
互补决定区(cdr):限定抗体的结合亲和力和特异性的高变氨基酸序列的区域。哺乳动物免疫球蛋白的轻链和重链各有具有三个cdr,分别命名为vl
‑
cdr1、vl
‑
cdr2、vl
‑
cdr3和vh
‑
cdr1、vh
‑
cdr2、vh
‑
cdr3。
[0081]
磷脂酰肌醇蛋白聚糖
‑
3(gpc3):与cd26结合并抑制cd26活性的细胞表面硫酸乙酰肝素蛋白聚糖。gpc3可以诱导一些细胞类型的凋亡。gpc3被一些肿瘤表达,包括肝细胞癌、黑色素瘤、卵巢透明细胞癌、卵黄囊瘤、成神经细胞瘤、肝母细胞瘤和威尔姆斯瘤(wilms tumor)。
[0082]
gpc3序列可公开获得。例如,genbank登录号:nm_001164619、nm_001164618、nm_004484和nm_001164617公开了示例性人gpc3核酸序列,并且genbank登录号:np_001158091、np_001158090、np_004475和np_001158089公开了示例性人gpc3氨基酸序列。类似地,genbank登录号:nm_016697公开了示例性小鼠gpc3核酸序列,并且genbank登录号:np_057906公开了示例性小鼠gpc3氨基酸序列。这些序列中的每个序列以于2020年2月27日在genbank中存在的形式通过引用并入。
[0083]
经分离的:如核酸、蛋白质(包括抗体)或细胞器等“经分离的”生物组分已经与该组分天然存在的环境(如细胞)中的其它生物组分即其它染色体和染色体外dna和rna、蛋白质和细胞器基本上分开或从中被纯化出来。“经分离的”核酸和蛋白质包括通过标准纯化方法纯化的核酸和蛋白质。所述术语还涵盖通过在宿主细胞中重组表达制备的核酸和蛋白质以及化学合成的核酸。
[0084]
肝癌:肝细胞癌(hcc)是最常见的原发性恶性肝肿瘤类型,常发生于患有病毒性肝炎(例如乙型肝炎或丙型肝炎)、毒素暴露或肝硬化(有时由酒精中毒引起)的患者中。其它类型的肝癌包含肝内胆管癌(icca)、纤维层癌和肝母细胞瘤。
[0085]
自然杀伤(nk)细胞:根据mhc类别,在不存在特定抗原刺激和没有限制的情况下杀伤靶细胞的免疫系统细胞。靶细胞可以是肿瘤细胞或携带病毒的细胞。nk细胞的特征在于存在cd56和不存在cd3表面标志物。nk细胞通常包含正常外周血中的大约10%到15%的单个核细胞级分。历史上,nk细胞首先是通过其在没有事先免疫或激活的情况下裂解某些肿瘤细胞的能力来鉴定的。nk细胞被认为针对可以通过下调mhc i类呈递来逃避ctl应答的病毒和肿瘤提供“备用”保护机制。除了参与直接细胞毒性杀伤之外,nk细胞还在细胞因子产生中发挥作用,这对于控制癌症和感染可能是重要的。
[0086]
在一些实例中,“经修饰的nk细胞”是用异源核酸(如本文公开的核酸或载体中的一种或多种)转导或转染的或表达一种或多种异源蛋白质的nk细胞。术语“经修饰的nk细胞”和“经转导的nk细胞”在本文的一些实例中可互换地使用。
[0087]
经纯化的:术语经纯化的不需要绝对纯度;相反,其旨在作为相对术语。因此,例如,经纯化的蛋白质或核酸制剂是其中蛋白质或核酸比在其自然环境中(例如在细胞内)的蛋白质或核酸更富集的制剂。在一个实施方案中,对制剂进行纯化,使得蛋白质或核酸占制剂的总蛋白质或核酸含量的至少50%。基本上纯化是指从其它蛋白质或细胞组分中的纯化。基本上经纯化的蛋白质或核酸为至少60%、70%、80%、90%、95%或98%纯。因此,在一个特定的非限制性实例中,基本上经纯化的蛋白质或核酸是90%不含其它组分。
[0088]
重组:具有不是天然存在的序列或者具有由两个以其它方式经分离的序列片段通过人工组合制作的序列(例如“嵌合”序列)的核酸或蛋白质。这种人工组合可以通过化学合成或人工操纵经分离的核酸片段例如通过遗传工程技术来完成。
[0089]
受试者:活的多细胞脊椎动物生物体,其类别包括人和兽医受试者两者,包括人和非人哺乳动物。
[0090]
t细胞:作为免疫应答的重要介质的白细胞(淋巴细胞)。t细胞包括但不限于cd4
+
t细胞和cd8
+ t细胞。cd4
+ t淋巴细胞是在其表面上携带被称为“分化簇4(cd4)”的标志物的免疫细胞。这些细胞也被称为辅助t细胞,有助于编排免疫应答,包括抗体应答以及杀伤t细胞应答。cd8
+ t细胞携带“分化簇8(cd8)”标志物。在一个实施方案中,cd8
+ t细胞是细胞毒性t淋巴细胞(ctl)。在另一个实施方案中,cd8
+
细胞是抑制性t细胞。
[0091]
活化的t细胞可以通过细胞增殖和/或一种或多种细胞因子(如il
‑
2、il
‑
4、il
‑
6、ifnγ或tnfα)的表达或分泌的增加来检测。cd8
+ t细胞的活化还可以通过响应于抗原的细胞溶解活性的增加来检测。
[0092]
在一些实例中,“经修饰的t细胞”是用异源核酸(如本文公开的核酸或载体中的一种或多种)转导或转染的或表达一种或多种异源蛋白质的t细胞。术语“经修饰的t细胞”和“经转导t细胞”在本文的一些实例中可互换地使用。
[0093]
经转导的或经转化的:经转化的细胞是通过分子生物学技术将核酸分子引入到其中的细胞。如本文所用,术语转导和转化涵盖可以将核酸分子引入到此类细胞中的所有技术,包括用病毒载体转染、使用质粒载体以及通过电穿孔、脂转染和粒子枪加速引入dna。
[0094]
治疗或改善疾病:“治疗”是指在疾病或病理状况开始发展之后,如减少肿瘤大小或肿瘤负担等减少或抑制所述疾病或病理状况的迹象或症状的治疗性干预。“改善”是指如癌症等疾病的迹象或症状的数量或严重程度的降低。
[0095]
载体:可以引入到宿主细胞(例如通过转染或转导)中由此产生经转化的宿主细胞
的核酸分子。重组dna载体是具有重组dna的载体。载体可以包括允许其在宿主细胞中复制的核酸序列如复制起点。载体还可以包括一个或多个可选择标志物基因和本领域已知的其它遗传元件。病毒载体是具有来源于一种或多种病毒的至少一些核酸序列的重组核酸载体。复制缺陷型病毒载体是由于至少一个复制必需基因功能的缺陷而需要补足与复制所需的病毒基因组中的一个或多个区域的载体。
[0096]
ii.若干实施方案的概述
[0097]
本文公开了cd147特异性结合剂,包括经修饰的cd147 scfv。还公开了嵌合抗原受体(car),其编码与铰链区、跨膜结构域和包括共刺激结构域和细胞内信号传导结构域的细胞内结构域融合的cd147特异性结合剂。在一些实例中,所述共刺激结构域来自cd28和/或4
‑
1bb,并且所述信号传导结构域来自cd3ζ。还提供了编码cd147特异性结合剂和cd147
‑
car的核酸以及包括所述核酸的载体。
[0098]
本文还提供了表达cd147
‑
car的经修饰的免疫细胞(如t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞)。在一些实施方案中,经修饰的免疫细胞表达如靶向肝炎病毒(例如乙型肝炎或丙型肝炎)的car等一种或多种另外的car。在其它实施方案中,经修饰的免疫细胞表达诱导型cd147
‑
car和诱导cd147
‑
car表达的构建体,如驱动cd147
‑
car的诱导剂表达的抗gpc3 synnotch构建体。在进一步的实施方案中,经修饰的免疫细胞表达诱导型gpc3
‑
car和诱导gpc3
‑
car表达的构建体,如驱动gpc3
‑
car的诱导剂表达的抗cd147 synnotch构建体。在特定实例中,cd147
‑
car和/或抗cd147 synnotch构建体包括本文公开的经修饰的cd147 scfv。
[0099]
还提供了在受试者中治疗表达cd147的癌症的方法。在一些实施方案中,所述方法包括向受试者施用有效量的包含编码cd147
‑
car的核酸的经修饰的免疫细胞(如t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞)。在其它实施方案中,所述方法包括向受试者施用有效量的经修饰的免疫细胞(如t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞),所述经修饰的免疫细胞包含编码诱导型cd147
‑
car的核酸和表达cd147
‑
car表达的诱导剂的抗gpc3 synnotch的核酸。在其它实施方案中,所述方法包括向受试者施用有效量的经修饰的免疫细胞(如t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞),所述经修饰的免疫细胞包含编码gpc3
‑
car的核酸和表达gpc3
‑
car表达的诱导剂的抗cd147 synnotch构建体。在一些实例中,经修饰的免疫细胞是自体的。在其它实例中,免疫细胞是同种异体的。在一些具体实例中,受试者患有肝细胞癌或成神经细胞瘤。
[0100]
iii.cd147特异性结合剂
[0101]
本文公开了cd147结合剂,所述cd147结合剂在一些实例中用作嵌合抗原受体的靶向部分。在一些实施方案中,cd147结合剂是cd147 scfv,其是编码来自5f6克隆的cd147特异性scfv的经修饰的片段(美国专利第8,618,264号)。图20示出了起始cd147 scfv核酸序列(seq id no:3)和经修饰的scfv核酸序列(seq id no:1)的比对。在一些实例中,经修饰的cd147特异性scfv结合高表达cd147的细胞。
[0102]
在一些实施方案中,cd147特异性结合剂是特异性结合cd147并包括表1中提供的cdr序列的单结构域抗体(如scfv)。在一些实例中,scfv特异性结合cd147并且包括氨基酸序列,所述氨基酸序列包含seq id no:8的可变重链(vh)结构域互补决定区1(cdr1)、cdr2和cdr3氨基酸序列和seq id no:9的可变轻链(vl)结构域cdr1、cdr2和cdr3氨基酸序列。在
一些实施方案中,scfv包括表1中提供的cdr氨基酸序列并且与seq id no:1的氨基酸序列具有至少90%的序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列相同性)。在其它实施方案中,scfv包括seq id no:1的氨基酸序列或由seq id no:1的氨基酸序列组成。
[0103]
表1:cdr在cd147 scfv序列中的位置(使用kabat编号方案确定)
[0104][0105][0106]
在另外的实例中,scfv由包括表1中提供的cdr序列并且与seq id no:2的核苷酸序列具有至少90%的序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列相同性)的核酸编码。在其它实施方案中,scfv由包括seq id no:2的核苷酸序列或由seq id no:2的核苷酸序列组成的核酸编码。
[0107]
还提供了包括编码上述cd147特异性结合剂的核酸的载体。在一些实例中,所述载体包括与seq id no:1具有至少90%的序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的核酸,例如编码与seq id no:2具有至少90%的序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的氨基酸序列的核酸。
[0108]
在另外的实例中,本文提供了与编码gal4
‑
vp64的核酸(例如seq id no:17)可操作地连接的编码cd147特异性结合剂的核酸(如与seq id no:1具有至少90%的序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的核酸)。在一些实例中,所述核酸是synnotch构建体的一部分。当cd147结合此构建体编码的蛋白质时,gal4
‑
vp64被激活并且可以利用gal4应答元件(如gal4uas)诱导构建体的表达。图25a中示出了编码抗cd147 scfv synnotch诱导剂构建体的示例性载体。
[0109]
iv.cd147嵌合抗原受体
[0110]
本文提供了包括上述第iii节中描述的cd147特异性结合剂的cd147
‑
car。在一些实施方案中,car包括抗原结合结构域,所述抗原结合结构域包括cd147特异性scfv(如seq id no:2)、铰链结构域、跨膜结构域以及包括至少一个共刺激结构域和细胞内信号传导结构域的细胞内结构域。
[0111]
在一些实施方案中,所述抗原结合结构域是cd147特异性scfv,所述cd147特异性scfv例如具有与seq id no:2具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%相同性)的氨基酸序列或者包括seq id no:2的氨基酸序列或由seq id no:2的氨基酸序列组成。
[0112]
在一些实施方案中,所述铰链结构域是igg铰链区。在一个实例中,所述铰链结构域是igg1铰链。可以使用其它铰链结构域,如来自其它免疫球蛋白(例如igg4或igd)的铰链区或来自cd8、cd28或cd40的铰链区。
[0113]
在另外的实施方案中,所述跨膜结构域是cd28跨膜结构域。在一个实例中,所述跨膜结构域来自cd28。所述跨膜结构域还可以来自其它t细胞蛋白,如cd8、cd4、cd3ζ、cd40、ox40l、41bbl、icos、icos
‑
l、cd80、cd86、icam
‑
1、lfa
‑
1、icam
‑
1、cd56、ctla
‑
4、pd
‑
1、tim
‑
3、nkp30、nkp44、nkp40、nkp46、b7
‑
h3、pd
‑
l1、pd
‑
2和cd70。
[0114]
在另外的实施方案中,所述细胞内结构域包括来自共刺激分子的一个或多个细胞内区域或其部分。示例性共刺激分子包括cd28、4
‑
1bb、cd8、cd40、ox
‑
40、icos、cd27和dap10、ox40
‑
l、4
‑
1bbl、icos
‑
l、cd80、cd86、icam
‑
1、lfa
‑
1、cd56、ctla
‑
4、pd
‑
1、tim
‑
3、nkp30、nkp44、nkp40、nkp46、b7
‑
h3、pd
‑
l1、pd
‑
2和cd70。在特定实例中,所述共刺激结构域来自cd28和/或4
‑
1bb。在一个实例中,所述共刺激结构域包括来自cd28和4
‑
1bb两者的结构域。所述细胞内结构域还包括来自cd3ζ的细胞内信号传导结构域。在其它实例中,所述细胞内信号传导结构域来自dap10、dap12、pdk或fcεriγ。在一个实例中,所述细胞内信号传导结构域来自cd3ζ。
[0115]
在一些实施方案中,cd147
‑
car还包括定位于scfv结构域的n端的信号序列。在一些实例中,所述信号序列是igg信号序列或gm
‑
csf信号序列。在一个实例中,所述信号序列是seq id no:5的氨基酸1
‑
19。
[0116]
在特定实施方案中,cd147
‑
car包括与seq id no:5具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%相同性)的氨基酸序列。在一些实例中,cd147
‑
car包括seq id no:5的氨基酸序列或由seq id no:5的氨基酸序列组成。
[0117]
在另外的实施方案中,cd147
‑
car进一步包括可以用于消除表达cd147
‑
car的细胞的诱导型基因(例如“自杀”基因)。诱导型基因可以在出现如细胞因子释放综合征(“细胞因子风暴”)等脱靶副作用(或上靶/脱肿瘤效应)时被激活。在一些实例中,自杀基因的表达可由如四环素或多西环素(“tet on”系统)或雷帕霉素等小分子诱导。参见例如gargett等,front.pharmacol.5:235,2014;stavrou等,mol.ther.6:1266
‑
1276,2018。在其它实例中,自杀基因可由fas结构域诱导型系统诱导。在一些实例中,诱导型自杀结构域位于car的抗原结合结构域的n端或c端,而在其它实例中,诱导型自杀结构域位于car的cd3ζ结构域的c端。诱导型自杀结构域通过自切割肽(如p2a肽或t2a肽)与car分离。在一些实施方案中,诱导型自杀结构域包括胱天蛋白酶9,如seq id no:7的氨基酸119
‑
400。在一些实例中,包括四环素诱导型胱天蛋白酶9的cd147
‑
car包括与seq id no:7具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%相同性)的氨基酸序列。在其它实例中,包括四环素诱导型胱天蛋白酶9的cd147
‑
car包括seq id no:7的氨基酸序列或由seq id no:7的氨基酸序列组成。
[0118]
在其它实施方案中,cd147
‑
car进一步包括增加表达car的经修饰的免疫细胞的存活或持久性的结构域。在一些实例中,所述结构域是来自细胞因子受体的细胞内结构域,例如,来自白介素(il)受体15(例如seq id no:12)、il
‑
12受体或il
‑
18受体的细胞内结构域。在其它实例中,所述结构域是生长因子受体的细胞内结构域,如cd40、nkg2d、nkp40或nkp46的细胞内结构域。在一些实例中,所述结构域位于car的cd3ζ结构域的c端。
[0119]
在一些实例中,cd147
‑
car进一步包括一个或多个另外的抗原结合结构域,所述一个或多个另外的抗原结合结构域特异性结合在肿瘤细胞上与cd147共表达的抗原。在一些非限制性实例中,cd147
‑
car包括特异性结合肝癌抗原如磷脂酰肌醇蛋白聚糖
‑
3、甲胎蛋白或粘蛋白
‑
1中的一种或多种的至少一个另外的抗原结合结构域。可以基于所治疗的癌症类型选择另外的肿瘤抗原。
[0120]
还提供了编码本文公开的cd147
‑
car的核酸。在一些实施方案中,所述核酸编码包括cd147特异性scfv的car,如与seq id no:1具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列相同性)的核酸序列或包括seq id no:1的核酸序列或由seq id no:1的核酸序列组成。在一些实例中,cd147特异性car核酸还编码igg铰链结构域、cd28跨膜结构域、cd28和4
‑
1bb共刺激结构域以及cd3ζ结构域。在一个实例中,cd147特异性car由与seq id no:4具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列相同性)的核酸序列编码或包括seq id no:4的核酸序列或由seq id no:4的核酸序列组成。在一些实例中,cd147特异性car核酸还编码诱导型胱天蛋白酶9结构域,例如与seq id no:6具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列相同性)的核酸序列或者包括seq id no:6的核酸序列或由seq id no:6的核酸序列组成。
[0121]
还提供了本文所述的car或其结构域的功能变体,所述功能变体保留了其作为变体的car的生物活性或保留特定结构域的生物活性。功能变体可以在氨基酸序列上与亲本car或结构域具有至少约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更多的相同性。可以例如在细胞外靶向结构域、铰链结构域、跨膜结构域和细胞内结构域中的一个或多个中进行取代。
[0122]
在一些实例中,功能变体包括具有至少一个保守氨基酸取代(如至多10个保守氨基酸取代,例如1个、2个、3个、4个、5个、6个、7个、8个、9个或10个保守取代)的亲本car或结构域的氨基酸序列。在其它实例中,功能变体包括具有至少一个非保守氨基酸取代(如至多10个非保守氨基酸取代,例如1个、2个、3个、4个、5个、6个、7个、8个、9个或10个非保守取代)的亲本car或结构域的氨基酸序列。在此情况下,非保守氨基酸取代不干扰或抑制功能变体的生物活性。非保守氨基酸取代可以增强功能变体的生物活性,使得与亲本car或结构域相比,功能变体的生物活性增加。
[0123]
在一些实例中,car或其结构域可以包括一个或多个合成氨基酸来代替一个或多个天然存在的氨基酸。此类合成氨基酸包括例如氨基环己烷羧酸、正亮氨酸、a
‑
氨基正癸酸、高丝氨酸、s
‑
乙酰氨基甲基
‑
半胱氨酸、反式
‑3‑
和反式
‑4‑
羟基脯氨酸、4
‑
氨基苯丙氨酸、4
‑
硝基苯丙氨酸、4
‑
氯苯丙氨酸、4
‑
羧基苯丙氨酸、β
‑
苯基丝氨酸、β
‑
羟基苯丙氨酸、苯基甘氨酸、α
‑
萘基丙氨酸、环己基丙氨酸、环己基甘氨酸、二氢吲哚
‑2‑
羧酸、1,2,3,4
‑
四氢
异喹啉
‑3‑
羧酸、氨基丙二酸、氨基丙二酸单酰胺、n'
‑
苄基
‑
n'
‑
甲基
‑
赖氨酸、ν',ν'
‑
二苄基
‑
赖氨酸、6
‑
羟基赖氨酸、鸟氨酸、α
‑
氨基环戊烷羧酸、α
‑
氨基环己烷羧酸、oc
‑
氨基环庚烷羧酸、
‑
(2
‑
氨基
‑2‑
降莰烷)
‑
羧酸、γ
‑
二氨基丁酸、α,β
‑
二氨基丙酸、高苯丙氨酸和α
‑
叔丁基甘氨酸。car可以是糖基化的、酰胺化的、羧基化的、磷酸化的、酯化的、n
‑
酰化的、通过例如二硫键环化的或转化成酸加成盐和/或任选地二聚化或聚合的或缀合的。
[0124]
在一些实施方案中,编码公开的car的核酸分子包括在表达载体(如病毒载体)中,用于在如t细胞或nk细胞等宿主细胞中表达。在一些实例中,表达载体包括与编码car的核酸分子可操作地连接的启动子。另外的表达控制序列,如一个或多个增强子、转录和/或翻译终止子以及初始序列,也可以包括在表达载体中。在一些实施方案中,编码本文提供的cd147
‑
car的核酸包括在病毒载体中。合适的病毒载体的实例包含逆转录病毒(例如momlv病毒或慢病毒)、腺病毒、腺相关病毒、痘苗病毒和禽痘载体。在具体实例中,cd147
‑
car编码核酸包括在momlv载体如sfg逆转录病毒载体或phage
‑
cppt慢病毒载体中。在其它实例中,载体可以是dna载体。
[0125]
在一些实施方案中,所述载体进一步包括允许cd147
‑
car诱导型表达的上游激活序列(uas)。在一个非限制性实例中,uas是由gal4激活的gal4 uas。然而,本领域技术人员可以识别可以利用的其它反式激活系统。在一个实例中,gal4uas cd147
‑
car核酸包括与seq id no:14具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的核酸序列。编码gal4uas cd147
‑
car构建体的示例性载体在图23a中示出,如phr_gal4uas
‑
cd147
‑
car
‑
pgk_mcherry。在一些实例中,所述载体包括与seq id no:15具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的核酸序列。在一些实例中,所述载体包括可选择标志物(如seq id no:15中的mcherry),但在其它实例中,所述可选择标志物不包括在载体中。
[0126]
在一些实例中,所述载体进一步包括编码至少一个另外的car的核酸序列。在一些实例中,所述另外的car对另外的肿瘤抗原具有特异性,例如以增加cd147
‑
car靶向表达或过表达cd147的肿瘤细胞的特异性。在一些实例中,所述载体包括编码一种或多种car的核酸,所述一种或多种car包括特异性结合肝癌抗原如磷脂酰肌醇蛋白聚糖
‑
3、甲胎蛋白或粘蛋白
‑
1中的一种或多种的抗原结合结构域。可以基于所治疗的癌症类型选择另外的肿瘤抗原/car。在其它实例中,所述载体包括编码car的核酸,所述car包括对乙型肝炎或丙型肝炎具有特异性的抗原结合结构域。在一些实例中,所述另外的car结合hbv包膜蛋白或乙型肝炎表面抗原(hbsag)。在其它实例中,所述另外的car结合hcv e2糖蛋白。在一些实例中,所述一种或多种另外的car包括在具有cd147
‑
car的载体中,例如由自切割肽如p2a肽序列分离。
[0127]
v.表达cd147 car或cd147特异性结合剂的细胞
[0128]
本文还提供了表达所公开的cd147
‑
car或cd147特异性结合剂的细胞(例如免疫细胞)。在特定实施方案中,所述细胞包括t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞。在一些实施方案中,所述细胞是表达cd147
‑
car的t细胞、nk细胞或巨噬细胞。
[0129]
在一些实例中,所述细胞进一步表达如抗gpc3 scfv等gpc3特异性结合剂。在特定实例中,所述细胞表达与编码gal4
‑
vp64(例如synnotch构建体)的核酸可操作地连接的抗
gpc3 scfv。当gpc3与此构建体编码的蛋白质结合时,gal4
‑
vp64被激活并且可以利用gal4应答元件(如gal4uas)诱导构建体的表达。图23a中示出了编码抗gpc3scfv synnotch诱导剂构建体的示例性载体。因此,在一些实例中,所述t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞表达诱导型cd147
‑
car(例如seq id no:14)和诱导诱导型cd147
‑
car表达的抗gpc3结合剂构建体。
[0130]
在其它实施方案中,所述细胞是表达如cd147 scfv(例如seq id no:1)和gpc3
‑
car等cd147特异性结合剂的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞。在一些实例中,gpc3
‑
car包括与seq id no:16具有至少90%序列相同性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同性)的核酸序列。在特定实例中,所述细胞表达与编码gal4
‑
vp64(例如synnotch构建体)的核酸可操作地连接的抗cd147 scfv。当cd147与此构建体编码的蛋白质结合时,gal4
‑
vp64被激活并且可以利用gal4应答元件(如gal4uas)诱导构建体的表达。图25a中示出了编码抗cd147 scfv synnotch诱导剂构建体和抗gpc3
‑
car的示例性载体。因此,在一些实例中,所述t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞、巨噬细胞表达诱导型gpc3
‑
car(例如seq id no:16)和诱导诱导型gpc3
‑
car表达的抗cd147结合剂构建体。
[0131]
在一些实例中,所述免疫细胞用一种或多种表达载体转导或转染,所述一种或多种表达载体包括一个或多个核酸,包括编码cd147
‑
car、诱导型gpc3
‑
car、诱导型cd147
‑
car、与诱导剂可操作地连接的cd147特异性结合剂、与诱导剂可操作地连接的gpc3特异性结合剂或其两种或更多种的任何组合的核酸。在其它实例中,可以通过将细胞与包括载体或dna的纳米颗粒接触来引入载体(或编码构建体的dna)。在一些实例中,例如在向受试者施用之前,在转导或转染之后,对细胞进行辐照(例如用γ
‑
辐照处理,如剂量为至少1,000拉德、至少2,000拉德、至少3,000拉德、至少5,000拉德、至少7,000拉德、至少8,000拉德、至少9,000拉德、至少10,000拉德、至少11,000拉德、至少12,000拉德或至少15,000拉德或约1,000
‑
15,000拉德、2,000
‑
12,000拉德、1,000
‑
5,000拉德、5,000
‑
10,000拉德或8,000
‑
12,000拉德或约10,000拉德)。
[0132]
在一些实例中,经转导或经转染的细胞是经分离的t细胞(如原代t细胞或从受试者获得的t细胞)、经分离的nk细胞(如原代nk细胞或从受试者获得的nk细胞)、经分离的nkt细胞、经分离的dnt细胞、经分离的中性粒细胞或经分离的巨噬细胞(如原代巨噬细胞或从受试者获得的巨噬细胞)。在一些实例中,所述t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞从外周血、脐带血、淋巴结组织、骨髓或肿瘤组织获得。在一些实例中,例如在用所公开的表达载体中的一种或多种转导之前和/或之后,t细胞、nk细胞、nkt细胞或dnt细胞还从来自受试者的样品富集、纯化和/或扩增。
[0133]
在一个非限制性实施方案中,所述细胞是nk
‑
92细胞。nk
‑
92细胞是来源于非霍奇金氏淋巴瘤患者的nk细胞系(例如crl
‑
2407
tm
)。此细胞系具有激活的nk细胞的性质(参见例如gong等,leukemia 8:652
‑
658,1994)。在另一个实施方案中,所述细胞是nk
‑
92mi细胞(例如crl
‑
2408
tm
)。nk
‑
92mi细胞系是来源于nk
‑
92的白介素
‑
2(il
‑
2)非依赖性nk细胞系,其稳定地表达人il
‑
2(参见例如tam等,hum.gene ther.10:1359
‑
1373,1999)。表达car(如本文公开的cd147
‑
car和/或其它核酸)的nk
‑
92或nk
‑
92mi细胞可以在本文中用作“现成的”免疫疗法,因为不必为每个受试者产生自体nk细胞。可以与本文所述的
cd147
‑
car(或其它核酸)一起使用的其它nk细胞系包括nkl、khyg
‑
1和yts细胞。
[0134]
nk
‑
92介导的免疫疗法目前正在进行i/ii期临床试验(arai等,2008;tonn等,2013)。通常,必须在输注之前对nk
‑
92细胞进行辐照以防止永久性植入。所需的辐照量为大约10gy。经辐照的nk
‑
92输注剂量至多可达10
10
nk92个细胞/m2。重要的是,经辐照的nk
‑
92细胞已显示对于患者输注是安全的,如若干nk
‑
92临床试验(nct00900809、nct00990717、nct00995137和nct01974479)所证明。
[0135]
在一些非限制性实施方案中,免疫细胞用编码cd147
‑
car的载体转导。在转导之后,可以例如通过使用结合cd147的标记抗体进行的流式细胞术来检测和/或富集表达cd147
‑
car的细胞。在一些实例中,经转导的细胞(如nk细胞或t细胞)例如通过在转导后进行细胞培养一段时间来扩增。在一些实例中,冷冻保存一些或全部经修饰的细胞以备后用。
[0136]
vi.免疫治疗的方法
[0137]
提供了用本文公开的cd147
‑
car治疗受试者的癌症(如表达或过表达cd147的癌症)的方法。在一些实施方案中,所述方法包括向受试者施用组合物,所述组合物包括表达cd147
‑
car的经修饰的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞(例如用编码car的载体转导)和药学上可接受的载剂(carrier)。在其它实例中,所述方法包括向受试者施用药物组合物,所述药物组合物包括编码cd147
‑
car的表达载体和药学上可接受的载剂。
[0138]
还提供了用诱导型cd147
‑
car和与本文公开的诱导型cd147
‑
car的诱导剂的表达连接的gpc3特异性结合剂治疗受试者的癌症(如表达或过表达cd147的癌症)的方法。在一些实施方案中,所述方法包括向受试者施用组合物,所述组合物包括表达诱导型cd147
‑
car和与诱导剂连接的gpc3特异性结合剂(例如用编码cd147
‑
car和gpc3特异性结合剂的一种或多种载体转导)的经修饰的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞以及药学上可接受的载剂。在其它实例中,所述方法包括向受试者施用编码诱导型cd147
‑
car(例如seq id no:15)和与诱导剂连接的gpc3特异性结合剂的一种或多种表达载体和药学上可接受的载剂。
[0139]
还提供了用诱导型gpc3
‑
car和本文公开的与诱导型gpc3
‑
car的诱导剂连接的cd147特异性结合剂治疗受试者的癌症(如表达或过表达cd147的癌症)的方法。在一些实施方案中,所述方法包括向受试者施用组合物,所述组合物包括表达诱导型gpc3
‑
car和与诱导剂连接的cd147特异性结合剂(例如用编码gpc3
‑
car(例如seq id no:16)和cd147特异性结合剂的一种或多种载体转导)的经修饰的t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞以及药学上可接受的载剂。在其它实例中,所述方法包括向受试者施用一种或多种表达载体,所述一种或多种表达载体编码诱导型gpc3
‑
car和与诱导剂连接的cd147特异性结合剂和药学上可接受的载剂。
[0140]
可以将本文所述的表达cd147
‑
car或cd147特异性结合剂的经修饰的细胞(如t细胞、nk细胞、nkt细胞、dnt细胞、中性粒细胞或巨噬细胞)掺入到药物组合物中。此类组合物通常包括细胞群(如cd147
‑
car
‑
nk细胞或cd147
‑
car
‑
t细胞)和药学上可接受的载剂。“药学上可接受的载剂”包括与药物施用相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等(参见例如remington:the science and practice of pharmacy,the university of the sciences in philadelphia,editor,lippincott,
williams,&wilkins,philadelphia,pa,第21版,2005)。此类载剂或稀释剂的实例包含但不限于水、盐水、林格氏溶液、右旋糖溶液、平衡盐溶液和5%人血清白蛋白。还可以使用脂质体和如非挥发油等非水性媒剂。还可以将补充性活性化合物掺入组合物中。用于制备可施用组合物的实际方法包括remington:the science and practice of pharmacy,the university of the sciences in philadelphia,editor,lippincott,williams,&wilkins,philadelphia,pa,第21版,(2005)中提供的那些方法。
[0141]
在一些实例中,所述组合物包括约104个到10
12
个经修饰的nk细胞或t细胞(例如约104‑
108个细胞、约106‑
108个细胞或约106‑
10
12
个细胞)。例如,可以制备组合物,使得向受试者施用约104个到10
10
个经修饰的nk细胞或经修饰的t细胞/kg(如约104、105、106、107或108个细胞/kg)。在具体实例中,所述组合物包括至少104、105、106或107个cd147
‑
car
‑
nk细胞或cd147
‑
car
‑
t细胞。经修饰的nk细胞群或经修饰的t细胞群通常肠胃外施用,例如静脉内施用;然而,还可以使用向肿瘤或肿瘤附近注射或输注(局部施用)或向腹腔施用。可以基于如受试者、所治疗的病状和其它因素等因素来确定适当的施用途径。
[0142]
可以向受试者施用多剂量的经修饰的nk细胞群或经修饰的t细胞群。例如,可以每天、每隔一天、每周两次、每周、每隔一周、每三周、每月或以更低频率施用cd147
‑
car
‑
nk细胞或cd147
‑
car
‑
t细胞。熟练的临床医生可以基于受试者、所治疗的病状、先前治疗史和其它因素选择施用方案。
[0143]
在另外的实例中,还向受试者施用至少一种、至少一种、至少两种、至少三种或至少四种细胞因子(如il
‑
2、il
‑
15、il
‑
21和/或il
‑
12)以支持经修饰的nk细胞或经修饰的t细胞的存活和/或生长。在具体的非限制性实例中,至少一种细胞因子包括il
‑
2和il
‑
15。在经修饰的nk细胞或经修饰的t细胞之前、之后或基本上同时施用所述细胞因子。在具体实例中,至少一种细胞因子(例如il
‑
2)例如与cd147
‑
car
‑
nk细胞同时施用。
[0144]
在一些实例中,被治疗的受试者患有实体瘤,例如表达cd147的实体瘤。实体瘤的实例包括肉瘤(如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤、软组织肉瘤和其它肉瘤)、滑膜瘤、间皮瘤、尤文肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、结直肠癌、腹膜癌、食管癌(如食管鳞状细胞癌)、胰腺癌、乳腺癌(包含基底乳腺癌、导管癌和小叶乳腺癌)、子宫内膜癌、肺癌(如非小细胞肺癌)、卵巢癌、前列腺癌、肝癌(包含肝细胞癌)、胃癌、鳞状细胞癌(包含头颈部鳞状细胞癌)、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤、皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肝癌、胆管癌、绒毛膜癌、威尔姆斯瘤、宫颈癌、输卵管癌、睾丸肿瘤、精原细胞瘤、膀胱癌(如肾细胞癌)、黑色素瘤和cns肿瘤(如胶质瘤、胶质母细胞瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、成神经细胞瘤和视网膜母细胞瘤)。实体瘤还包括肿瘤转移(例如转移到肺、肝、脑或骨)。在一些实例中,受试者患有肝细胞癌、成神经细胞瘤、乳腺癌、胃癌、子宫内膜癌、膀胱癌(如肾细胞癌)、肺癌(如非小细胞肺癌)、宫颈癌、髓母细胞瘤、食管癌(如食管鳞状细胞癌)、前列腺癌、精原细胞瘤、胶质母细胞瘤、骨肉瘤、星形细胞瘤或软组织肉瘤。在特定实例中,受试者患有肝细胞癌或成神经细胞瘤。
[0145]
在其它实例中,受试者患有恶性血液肿瘤,例如表达cd147的恶性血液肿瘤。恶性血液肿瘤的实例包括白血病,包含急性白血病(如11q23阳性急性白血病、急性淋巴细胞白血病(all)、t细胞all、急性髓细胞性白血病、急性髓性白血病(aml)和成髓细胞白血病、前
髓细胞性白血病、粒单核细胞白血病、单核细胞性白血病和红白血病)、慢性白血病(如慢性粒细胞性(粒细胞)白血病、慢性髓细胞性白血病和慢性淋巴细胞白血病)、淋巴母细胞白血病、真性红细胞增多症、淋巴瘤、弥漫性大b细胞淋巴瘤、伯基特淋巴瘤、t细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、waldenstrom巨球蛋白血症、重链病、骨髓增生异常综合征、毛细胞白血病和脊髓发育不良。在特定实例中,受试者患有急性淋巴细胞白血病(all)、t细胞all、急性髓细胞性白血病或急性髓性白血病(aml)。
[0146]
在一些实例中,受试者还用外科手术、放疗和化疗剂中的一种或多种治疗。示例性化疗剂包括(但不限于)烷化剂,如氮芥(nitrogen mustard)(如氮芥(mechlorethamine)、环磷酰胺、美法仑、尿嘧啶氮芥或苯丁酸氮芥)、烷基磺酸盐类(如白消安)、亚硝基脲(如卡莫司汀、洛莫司汀、司莫司汀、链脲菌素或达卡巴嗪)等;抗代谢物,如叶酸类似物(如甲氨蝶呤)、嘧啶类似物(如5
‑
fu或阿糖胞苷)和嘌呤类似物,如巯嘌呤或硫鸟嘌呤;或天然产物,例如长春花生物碱(如长春碱、长春新碱或长春地辛)、表鬼臼毒素(如依托泊苷或替尼泊苷)、抗生素(如放线菌素d、柔红霉素、多柔比星、博来霉素、普卡霉素或丝裂霉素c)和酶(如l
‑
天冬酰胺酶)。另外的药剂包括铂配位复合物(如顺二胺
‑
二氯铂ii,也称为顺铂)、经取代的脲(如羟基脲)、甲基肼衍生物(如丙卡巴肼)和肾上腺皮质抑制剂(如米托坦和氨鲁米特);激素和拮抗剂,如肾上腺皮质类固醇(如泼尼松)、孕激素类(如己酸羟孕酮、醋酸甲羟孕酮和醋酸甲地孕酮(magestrol acetate))、雌激素类(如己烯雌酚和炔雌醇)、抗雌激素类(如他莫昔芬)和雄激素类(如丙酸睾酮和氟甲睾酮)。最常用的化疗药物的实例包括阿霉素、美法仑ara
‑
c(阿糖胞苷)、卡莫司汀、白消安、洛莫司汀、卡铂、顺铂、环磷酰胺柔红霉素、达卡巴嗪、5
‑
氟尿嘧啶、氟达拉滨、羟基脲、伊达比星、异环磷酰胺、甲氨蝶呤、光神霉素、丝裂霉素、米托蒽醌、氮芥、紫杉醇(或其它紫杉烷如多西他赛)、长春碱、长春新碱、vp
‑
16,而较新的药物包括吉西他滨曲妥珠单抗伊立替康(cpt
‑
11)、克拉立平、诺维本、利妥昔单抗伊马替尼(sti
‑
571)、托泊替康卡培他滨、替伊莫单抗(ibritumomab)和骨化三醇。熟练的临床医生可以根据如受试者、所治疗的癌症、治疗史和其它因素等因素为受试者(从此处列出或其它当前疗法中)选择适当的另外的疗法。
[0147]
实施例
[0148]
提供以下实施例以说明某些特定特征和/或实施方案。这些实施例不应被解释为将本公开限制于所描述的特定特征或实施方案。
[0149]
实施例1
[0150]
材料和方法
[0151]
抗体和试剂:经纯化的抗cd247(也称为t细胞表面糖蛋白cd3ζ链,cd3)抗体(克隆6b10.2,biolegend)、经纯化的抗人cd147、fitc缀合的抗人cd147(克隆him6,biolegend)、pe或apc缀合的抗人cd3抗体(克隆okt3,biolegend)、fitc或bv 510缀合的抗人cd56抗体(克隆hcd56,biolegend)、pe缀合的抗人cd69抗体(克隆fn50,biolegend)、apc/fire 750缀合的抗人cd226抗体(也称为dnam
‑
1,克隆11a8,biolegend)、apc/fire 750缀合的抗人klrg1(mafa)抗体(克隆sa231a2,biolegend)、bv421缀合的抗人cd335(nkp46)抗体(克隆
9e2,biolegend)、pe/cy7缀合的抗人cd158b(kir2dl2/l3,biolegend)抗体(克隆dx27,biolegend)、pe/cy7缀合的抗人cd244(2b4)抗体(克隆c1.7,biolegend)、pe缀合的抗人cd152(ctla
‑
4)抗体(克隆bni3)、apc缀合的抗人cd366(tim
‑
3)抗体(克隆f38
‑
2e2)、percp/cy5.5抗人tigit(vstm3)抗体(克隆a15153g)、fitc缀合的抗人cd223(lag
‑
3)抗体(克隆11c3c65,biolegend)和percp/cy5.5缀合的抗人cd94(克隆dx22,biolegend)购自biolegend(san diego,ca,usa)。
[0152]
apc缀合的抗人cd16抗体(克隆b73.1,bd biosciences)、fitc缀合的抗人cd3抗体(克隆ucht1,bd biosciences)、bv480缀合的抗人cd85j抗体(lir
‑
1)抗体(克隆ghi/75,bd biosciences)、bv711缀合的抗人cd314(nkg2d)抗体(克隆1d11,bd biosciences)和pe或fitc缀合的抗人cd107a抗体(克隆h4a3,bd biosciences)购自bd biosciences(san jose,ca,usa)。
[0153]
fitc缀合的抗人kir/cd158抗体(克隆180704,r&d systems)、pe缀合的抗人kir2dl1/kir2ds5抗体(克隆143211,r&d systems)、apc缀合的抗人kir3dl1抗体(克隆dx9,r&d systems)、af405缀合的抗人kir3dl2/cd158k抗体(克隆539304,r&d systems)、apc缀合的抗人nkg2a/cd159a抗体(克隆131411,r&d systems)和pe缀合的抗人nkg2c/cd159c抗体(克隆134591,r&d systems)购自r&d systems。af647山羊抗人igg f(ab')2片段抗体购自jackson immunoresearch(west grove,pa,usa)。
[0154]
来自公共癌症患者数据库的生物信息学分析:关于cd147的患者存活数据和rsem(通过期望最大化的rna
‑
seq)归一化表达数据集从the cancer genome atlas(tcga)生成并且从oncolnc(oncolnc.org)下载。数据使用graphpad prism 5.0(graphpad)绘制卡普兰
‑
迈耶曲线。来源于tcga的rsem归一化表达数据集来自由the broad institute(gdac.broadinstitute.org)开发的firehose broad gdac。图通过graphpad prism 5生成。
[0155]
细胞系:293t、k562、daudi细胞、sk
‑
hep1和hepg2细胞系购自美国典型培养物保藏中心(american type culture collection,atcc)。为建立daudi
‑
ffluc细胞,用编码ffluc
‑
gfp的慢病毒载体转导cd147阳性hepg2和sk
‑
hep1细胞,如先前所述。用于从健康供体采集外周血的方案得到rutgers
‑
new jersey medical school(newark,nj)的机构审查委员会(irb)和伦理审查委员会的批准。
[0156]
nk
‑
92mi细胞培养和car修饰的nk
‑
92mi细胞的生成:nk
‑
92mi细胞系购自(crl
‑
2408
tm
,usa)。nk
‑
92mi,白介素
‑
2(il
‑
2)非依赖性nk细胞系,来源于用人il
‑
2 cdna稳定地表达的nk
‑
92(crl
‑
2407
tm
)细胞系(gong等,leukemia 8:652
‑
658,1994)(tam等,hum gene ther 10:1359
‑
1373,1999;tam等,j.hematother.8:281
‑
290,1999)。将nk
‑
92mi细胞系维持在不含核糖核苷和脱氧核糖核苷但含有2mm l
‑
谷氨酰胺和1.5g/l碳酸氢钠的特定nk
‑
92mi培养基(α最小必需培养基,α
‑
mem)中。为制备完全生长培养基,向基础培养基中加入以下组分:0.2mm肌醇、0.1mm2
‑
巯基乙醇、0.02mm叶酸、终浓度为12.5%的马血清和终浓度为12.5%的胎牛血清。在第3天在包被有重组纤连蛋白片段(fn ch
‑
296;retronectin;takara,japan)的平板中用逆转录病毒上清液转导nk
‑
92mi细胞。转导之后,使用il
‑
2扩增nk细胞。为检查nk
‑
92mi细胞上cd147
‑
car表达的百分比,将这些细胞进行cd3和cd56染色以对nk细胞进行染色,然后进行流式细胞术分析。
[0157]
cd147
‑
敲除细胞系的生成:为生成cd147敲除肝细胞细胞系,使用慢病毒递送系统,靶向cd147序列的向导rna:#1(5
‑
ttgacatcgttggccaccgc
‑
3;seq id no:10),#3(5
‑
gtggacgcagatgaccgctc
‑
3;seq id no:11)。通过用包装质粒pspax2和pmd2g转染lenti
‑
crispr v2在hek 293t中产生慢病毒。3天后,过滤上清液(0.45μm)并与肝细胞和8μg/ml聚凝胺(sigma)温育。温育48小时后,将经转导的细胞更换到新鲜培养基并且用8.0μg/ml嘌呤霉素选择5天。进行蛋白质印迹和流式细胞术分析以证实敲除细胞系的功效。
[0158]
质粒构建和逆转录病毒产生:编码来自5f6克隆的cd147特异性scfv的密码子优化的dna片段由genewiz合成,并且框内亚克隆到sfg逆转录病毒载体逆转录病毒骨架中,与人igg1的铰链组分、cd28跨膜结构域、cd28加4
‑
1bb细胞内结构域和人tcr/cd3复合物的ζ链符合读框。为产生cd147
‑
car逆转录病毒,用含有cd147特异性scfv、rdf和pegpam3的质粒组合转染293t细胞,如先前所述(loskog等,leukemia20:1819
‑
1828,2006)。先前已经描述了cd19
‑
cd28
‑
car和cd19
‑4‑
1bb
‑
car的构建体(xiong等,mol.ther.26:963
‑
975,2018)。
[0159]
用cd147
‑
car转导nk
‑
92mi细胞:在扩增的第7天收获nk细胞并在包被有retronectin(fn ch
‑
296,takara,japan)的平板中用cd147
‑
car逆转录病毒转导。两天后,将细胞转移到g
‑
rex 6多孔细胞培养板上并维持在35ml含有200u/ml il
‑
2(peprotech)的完全rpmi
‑
1640培养基中。每3
‑
4天更换培养基,并且每次将2
×
107个细胞保存在每个孔中继续培养。使用台盼蓝排除法计数总细胞数。为检查nk细胞的百分比和car的表达,将细胞对cd3、cd56和igg f(ab')2染色并通过流式细胞术分析。
[0160]
流式细胞术分析和分选:在含有1%胎牛血清(fbs)的facs染色缓冲液中,用荧光缀合的抗体在冰上对car
‑
nk细胞染色30分钟,用pbs洗涤并在facs lsrii或lsr fortessa流式细胞仪(bd)上分析。在数据收集之前调节pmt电压并计算补偿值。使用facs diva软件(bd)获取数据并使用flowjo软件(tree star)分析。
[0161]
对于流式细胞术单个活细胞分选,用荧光缀合的抗体(与含有1%fbs的rpmi1640)在冰上对所有样品细胞染色30分钟,用pbs洗涤两次,重悬于完全培养基中并通过sorp bd facs aria iii分选。分选后,用预热培养基洗涤收集样品一次并培养以供使用。
[0162]
car
‑
nk脱粒测定(cd107a):将car
‑
nk细胞(1
×
105)与靶细胞在u型底96孔板中在37
°
℃完全nk
‑
92mi培养基中温育4小时或过夜。之后,收获细胞,洗涤,用golgistop(bd)在冰上对cd3、cd56和cd107a染色30分钟并通过流式细胞术分析。
[0163]
细胞因子释放测定:根据制造商的方案,通过商业elisa试剂盒(invitrogen
‑
thermo fisher scientific)测量由car
‑
nk分泌的ifnγ和tnf
‑
α细胞因子。
[0164]
51
cr释放测定:为评估car
‑
nk细胞的细胞毒性活性,使用标准4小时
51
cr释放测定。简言之,在37℃用
51
cr标记靶细胞2小时,然后以2
×
105/ml重悬于含有10%fbs、不含il2的nk
‑
92mi培养基中。然后,将2
×
104个靶细胞与连续稀释的car
‑
nk细胞在37℃温育4小时。离心后,收集上清液并用γ计数器(wallac,turku,finland)测量释放的
51
cr。细胞毒性(按百分比计)计算如下:[(样品
‑
自发释放)/(最大释放
‑
自发释放)]
×
100。
[0165]
ffluc报告基因系统测定:为定量car修饰的免疫细胞的细胞毒性,开发了ffluc报告基因系统测定。简言之,在第1天,将靶细胞以2
×
104或3
×
104个靶细胞/孔(ffluc
‑
gfp稳定转导的细胞)预接种到光学96孔板(greiner bio
‑
one
tm
编号:655098))中100μl/孔的靶细胞全营养培养基中并在37℃用5%co2温育过夜。次日,根据效应子/靶比率制备效应细胞的
连续稀释液,并将所指示的效应细胞加入每孔(100μl/孔)。将反应在37℃与5%co2一起温育4小时,然后轻轻丢弃上清液。将100μl工作d
‑
荧光素加入每孔并在37℃与5%co2关灯温育5分钟。使用酶标仪(perkinelmer,usa)定量数据。通过下式将获得的值转换为特异性裂解百分比来对数据定量:特异性裂解百分比(%)=[1
‑
(s
‑
e)/(t
‑
m)]*100,其中s为样品孔的发光值,e为“仅效应细胞”孔与样品孔相比的发光值,t为“仅靶细胞”孔的平均发光值,并且m为“仅空白培养基”孔的平均发光值。
[0166]
动物研究:所有动物实验都得到institutional animal care and use committee(iacuc)批准。来自the jackson laboratory(bar harbor,me)的nod.cg
‑
prkdc
scid il2rg
tm1wjl
/szj(nsg)小鼠用于所有体内实验。为建立肝细胞癌细胞系异种移植模型,向雄性和雌性nsg小鼠(8周龄)两者右侧腹皮下注射于100μl pbsmatrix中的4
×
106个sk
‑
hep1细胞。当肿瘤负担达到约40
‑
50mm2时,将小鼠随机分为三组。从第1天开始治疗,向小鼠注射(i.v.)于100μl pbs中的5
×
106个cd147
‑
car
‑
nk
‑
92mi细胞。向对照组输注亲本nk
‑
92mi细胞或媒剂(pbs)。次日(第2天),向所有动物注射(i.v.)il
‑
2(20,000单位/小鼠)。每周收集两次动物体重和肿瘤负担。用卡尺测量肿瘤大小并且记录最大纵向直径(长度)和最大横向直径(宽度)。通过经修改的椭球公式计算基于卡尺测量结果的肿瘤大小。肿瘤大小计算如下:肿瘤大小(mm2)=1/2(长
×
宽2)。当肿瘤负担超过2000mm2或动物的体重减少>20%时,根据iacuc指南对小鼠实施安乐死。同时记录动物存活数据。
[0167]
对于患者来源的异种移植(pdx)模型,患者肝细胞癌动物模型由the jackson laboratory开发。简言之,将新鲜的pdx样本皮下植入到6
‑
8周龄nod scidγ(nsg)小鼠的侧腹中。在肿瘤负担达到约40
‑
50mm2后,将小鼠随机分为三组以进行进一步分析。所使用的主要治疗程序如上所述。用10%福尔马林固定异种移植样本,将其包埋在石蜡中以进行切割并进行ihc染色或直接冷冻到液氮中以进行进一步分析。
[0168]
统计分析:利用bonferroni post
‑
test,通过双向anova进行肿瘤大小统计分析。使用对数秩检验计算总存活统计学。使用两尾未配对学生t检验和两尾配对学生t检验确定其它统计学显著性。所有统计计算图均通过graphpad prism 5.0生成。p<0.05(*)、p<0.01(**)和p<0.001被认为具有统计学意义。
[0169]
实施例2
[0170]
cd147在肝细胞癌细胞系和来自患者的肝癌样本中表达
[0171]
为确定cd147是否是肝细胞癌和其它类型癌症的有效合理靶,分析了患者存活与来自tcga(the cancer genome atlas,cancergenome.nih.gov)数据集的cd147的表达水平之间的相关性。来自两个不同患者亚群(cd147
高
和cd147
低
)的存活百分比比较表明,cd147与存活百分比之间存在强负相关性(图1a)。具体地,多个肿瘤组织中的cd147
高
表明了存活百分比低(图1a)。另外,多种癌症类型中正常组织(nt)与肿瘤样品(tp)之间cd147表达的比较表明,不同类型肿瘤组织中的cd147表达显著上调(图1b)。
[0172]
为验证来自生物信息学分析的数据,通过蛋白质印迹分析了不同肿瘤细胞系和其它组织中cd147的表达,这包括野生型nk
‑
92(人nk细胞系)、t2(突变型t
×
b细胞杂种)、721.221(无hla
‑
a、hla
‑
b、hla
‑
c的人细胞系)、mda
‑
mb
‑
231(人乳腺癌细胞系)、k562(人髓细胞性白血病细胞系)、hepg2(人肝细胞癌细胞系)、sk
‑
hep1(人肝腺癌细胞系),raji(人b淋
巴细胞伯基特氏淋巴瘤细胞系)、daudi(人b淋巴母细胞细胞系)、nk
‑
92
‑
mi(白介素2非依赖性自然杀伤细胞系)和人外周血单核细胞(pbmc)。与pbmc相比,cd147分子在hepg2和sk
‑
hep1细胞系(两种肝细胞癌细胞系)中高度上调(图1c)。与肿瘤细胞系相比,cd147在pbmc上的表达相对较低(图1c)。通过流式细胞术分析获得类似结果(图1d)。此外,免疫组织化学(ihc)测定的结果证实,cd147在从pdx小鼠模型分离的hcc组织中显著上调(图1e)。
[0173]
实施例3
[0174]
cd147
‑
car
‑
nk细胞的生成和特性
[0175]
构建了使用sfg载体的cd147
‑
car(loskog等,leukemia 20:1819
‑
1828,2006;xiong等,mol.ther.26:963
‑
975,2018)。cd147
‑
car含有抗cd147抗体的经修饰的单链可变片段(scfv)(如实施例1中所述,来源于克隆5f6)、igg
‑
ch2ch3间隔区、cd28的跨膜结构域、cd28
‑4‑
1bb的细胞内结构域和tcr
‑
ζ链的细胞内信号传导结构域(图2a)。
[0176]
首先,在nk
‑
92mi细胞系中测试了此car构建体。转导后,nk
‑
92mi表达了cd147
‑
car分子(图2b)。通过流式细胞术分选后,cd147阳性nk
‑
92mi细胞的百分比在96%以上(图2b)。通过蛋白质印迹进一步证实了cd147
‑
car分子在nk
‑
92mi细胞中的表达。与亲本nk
‑
92mi细胞系相比,cd147
‑
car
‑
nk
‑
92mi表达了嵌合scfv
‑
cd147
‑
car。近似分子量约为80
‑
85kd(图2c)。通过流式细胞术进一步表征cd147
‑
car
‑
nk
‑
92mi细胞系。观察到相当的激活受体(例如cd56、nkg2d、nkp46、nkg2a、cd16、cd94/nkg2c、cd226(也称为dnam
‑
1)和cd244(也称为2b4))和抑制性受体(例如klrg1、lag
‑
3、ctla
‑
4、tim
‑
3、pd
‑
1和tigit)表达(图2d)。鉴于在nk92
‑
mi细胞上低水平的cd147表达,还通过流式细胞术分析了cd147在cd147
‑
car
‑
nk
‑
92mi细胞系上的表达。转导后,cd147
‑
car在nk
‑
92mi上的表达是稳定的,持续30天以上。然而,cd147
‑
car表达与nk
‑
92mi细胞系上cd147的丢失相关,表明cd147
‑
car
‑
nk
‑
92mi细胞中的限制性自相杀伤(图2e
‑
2g)。值得注意的是,cd147
‑
car
‑
nk
‑
92mi细胞上cd147分子表达的丢失并不影响其体外功能性和表达。
[0177]
实施例4
[0178]
cd147
‑
car nk细胞在体外特异性杀伤肝细胞癌(hcc)
[0179]
成功建立cd147
‑
car
‑
nk细胞后,测试了cd147
‑
car
‑
nk
‑
92mi细胞清除cd147
+
hcc细胞系(包括sk
‑
hep1和hepg2细胞)的能力。与对照cd19
‑
cd28
‑
car
‑
nk
‑
92mi和cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi细胞相比,cd147
‑
car
‑
nk
‑
92mi细胞对于两个hcc细胞系sk
‑
hep1和hepg2(图3a和3b)以及huh5和hco2细胞系(图4a
‑
4c)表现出显著的细胞毒性。另外,由cd147
‑
car
‑
nk
‑
92mi细胞产生tnf
‑
α和ifn
‑
γ两者均显著高于由sk
‑
hep1和hepg2细胞刺激的cd19
‑
cd28
‑
car
‑
nk
‑
92mi和cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi细胞产生tnf
‑
α和ifn
‑
γ(图3c和3d)。有趣的是,cd147
‑
car
‑
nk
‑
92mi细胞被其易感靶细胞的激活可以被抗cd147抗体(克隆him6)阻断,但不能被对照igg1阻断(图5a
‑
5c)。通过测试对cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi细胞的细胞毒性的影响,进一步验证此抗cd147抗体的特异性。此抗cd147抗体无法阻断cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi细胞对于cd19阳性daudi细胞系的细胞毒性(图6),表明cd19
‑4‑
1bb
‑
car
‑
nk
‑
92mi细胞和抗cd147抗体的选择性。
[0180]
为进一步证实cd147
‑
car
‑
nk
‑
92mi细胞的特异性,生成cd147
‑
敲除(cd147
‑
/
‑
)sk
‑
hep1细胞系(cd147
‑
/
‑
‑
sk
‑
hep1)和cd147
‑
敲除(cd147
‑
/
‑
)hepg2细胞系(cd147
‑
/
‑
‑
hepg2)。cd147
‑
/
‑
‑
hepg2和cd147
‑
/
‑
‑
sk
‑
hep1细胞未被cd147
‑
car
‑
nk
‑
92mi细胞识别(图5d
‑
5g),当与
cd147
‑
ko细胞系共培养时,所述cd147
‑
car
‑
nk
‑
92mi细胞通过cd107a表面表达进行定量。
[0181]
可以使用cd107a测定和细胞因子产生测定两者来评估易感靶细胞对cd147
‑
car
‑
nk
‑
92mi细胞的激活。为直接测试cd147
‑
car
‑
nk
‑
92mi细胞是否可以杀伤cd147阳性hcc细胞,使用了4小时标准铬
‑
51(
51
cr)释放测定(在免疫学领域中用于评估ctl和nk细胞的细胞毒性的金标准测定)。cd147
‑
car
‑
nk
‑
92mi细胞杀伤sk
‑
hep1和daudi细胞。cd147
‑
car
‑
nk
‑
92mi细胞对于如huh7细胞系(kasai等,hum cell 31:261
‑
267,2018)和hco2细胞系(trinh等,plos one 10:e0136673,2015)等另外的hcc细胞系的类似杀伤活性。
[0182]
为进一步验证cd147
‑
car
‑
nk
‑
92mi细胞的杀伤活性,开发了用于使用荧光素酶生物发光信号评估cd147
‑
car
‑
nk
‑
92mi细胞细胞毒性的新颖、易于使用的和非放射性的方法。首先,生成ffluc
‑
egfp
‑
sk
‑
hep1和ffluc
‑
egfp
‑
hepg2细胞系。为评估对靶细胞的直接杀伤,将cd147
‑
car
‑
nk
‑
92mi细胞分别与ffluc
‑
egfp
‑
sk
‑
hep1和ffluc
‑
egfp
‑
hepg2细胞系共培养。在cd147
‑
car
‑
nk
‑
92mi细胞在预接种有稳定表达egfp
‑
萤火虫荧光素酶融合基因(egfp
‑
ffluc)的靶细胞的96孔光学底微板中温育4小时后,通过荧光酶标仪对egfp
‑
ffluc的化学生物发光信号进行定量。如实施例1所述,类似于
51
cr释放测定,将ffluc信号转化为特异性裂解百分比(图8h和8i)。
[0183]
首先,cd147
‑
car修饰的从人外周血单个核细胞(pbmc)中分离出的原代t细胞和nk细胞可以消除多种hcc细胞系(包括sk
‑
hep1、huh7和hepg2等),但κ
‑
car修饰的t细胞不能(图8a
‑
8c)。我们通过
51
cr释放测定还证明了,cd147
‑
car修饰的人原代nk细胞在体外有效地杀伤hcc细胞系(图8d
‑
8f)。为进一步证明原代nk除了cd147
‑
car原代nk细胞毒性外通过nkgd/nkg2dl相互作用的自然杀伤能力,我们发现抗nkg2d进一步阻断cd147
‑
car
‑
nk对cd147
‑
/
‑
‑
sk
‑
hep1细胞的杀伤(图8g)。
[0184]
剂量依赖性特异性裂解与
51
cr释放测定是可比较的。在普通倒置荧光显微镜下进一步定量通过这种方法测量的细胞毒性活性以评估靶细胞中egfp信号的形态和动态(图7a和7b)。因此,两种互补方法证明了cd147
‑
car nk细胞在体外特异性杀伤肝细胞癌(hcc)。
[0185]
与亲本sk
‑
hep1和hepg2细胞相比,cd147
‑
car
‑
nk
‑
92mi细胞不能杀伤cd147
‑
/
‑
‑
sk
‑
hep1和cd147
‑
/
‑
‑
hepg2(图8k和8l)。通过在效应细胞和靶细胞共培养系统中加入抗cd147抗体进一步验证了cd147
‑
car
‑
nk
‑
92mi细胞细胞毒性的特异性(图8m和8n)。为进一步验证cd147作为hcc的有效合理靶,测试了cd147
‑
car
‑
t细胞对于两种不同hcc细胞系—hepg2(图10a)和sk
‑
hep1(图10b)的细胞毒性。当cd147分子在sk
‑
hep1细胞系(cd147
‑
敲除sk
‑
hep1细胞系)中缺失时,cd147
‑
car
‑
t细胞的特异性裂解显著降低(图10c),进一步验证了cd147
‑
car
‑
t细胞对于cd147阳性hcc细胞系的特异性细胞毒性。
[0186]
实施例5
[0187]
cd147
‑
car
‑
nk细胞在体内控制hcc的进展
[0188]
为评估cd147
‑
car是否可以在体内杀伤hcc,使用了两种不同的异种移植模型。首先,在sk
‑
hep1异种移植小鼠模型中评估了cd147
‑
car修饰的来源于pbmc的原代t细胞和nk细胞。cd147
‑
car修饰的原代t细胞显著抑制肿瘤大小并延长存活(图11a
‑
11d)。为进一步评估cd147
‑
car修饰的原代nk细胞的功效,我们包括了未经转导(nt)的原代nk组作为另外的对照(图12a
‑
12d)。接受亲本nt
‑
nk对照组和pbs媒剂对照组的小鼠发展快速疾病进展。相比而言,接受cd147
‑
car原代t细胞和nk细胞的小鼠受到免于快速进展的显著保护,并且其存
活中值延长(p<0.05),其中不同组中的体重相当(图11c和12c),表明cd147
‑
car修饰的原代t细胞和nk细胞的体内毒性可耐受。
[0189]
此外,为进一步开发另外的“现成的”细胞疗法策略,我们评估了cd147
‑
car修饰的nk
‑
92mi细胞的功效。由于nk
‑
92mi的恶性性质,car修饰的nk
‑
92mi细胞需要进行辐照,之后施用于患者46、61。通过标准4小时
51
cr释放测定比较了未经辐照和经辐照的cd147
‑
car
‑
nk
‑
92mi细胞的细胞毒性(图13)。在体外观察到未经辐照的与经辐照的cd147
‑
car
‑
nk
‑
92mi细胞之间相当的细胞毒性(图13)。
[0190]
进一步比较了异种移植nsg小鼠模型中未经辐照的与经辐照的cd147
‑
car
‑
nk
‑
92mi细胞之间的功效(图14a
‑
14d)。观察到未经辐照的与经辐照的cd147
‑
car
‑
nk
‑
92mi输注小鼠之间通过存活中值测量的相当体内功效(图14a
‑
14d)。
[0191]
为进一步评估cd147
‑
car
‑
nk
‑
92mi细胞(在肿瘤植入后第1天、第3天和第5天注射)控制肿瘤生长的功效,通过肿瘤大小测量疾病进展(图15a)。接受亲本nk
‑
92mi和pbs媒剂对照组的小鼠发展快速疾病进展(图15b)。相比而言,接受cd147
‑
car
‑
nk
‑
92mi细胞的小鼠受到免于快速进展的显著保护,并且其中值存活期延长(p<0.01),其中不同组中的体重相当(图15c和15d),表明cd147
‑
car
‑
nk
‑
92mi细胞的体内毒性可耐受。
[0192]
尽管癌细胞系在对生物学和治疗效果进行精确建模的能力方面可能存在显著局限性,但患者来源的异种移植(pdx)模型在生物学上是稳定的并且可以模拟关于突变状态、基因表达模式和肿瘤异质性的人临床病状。因此,使用来自患者的转移性肝癌组织,采用了第二异种移植小鼠模型。测试了在移植后第0天、第4天、第8天、第11天、第15天、第22天、第25天和第35天施用的cd147
‑
car
‑
nk
‑
92mi细胞的效果。用cd147
‑
car
‑
nk
‑
92mi细胞治疗的小鼠的中值存活期为63天,这显著高于对照小鼠的(中值存活期为约42天)。在用cd147
‑
car
‑
nk
‑
92mi细胞治疗的小鼠中观察到肿瘤负担减轻和疾病进展减少(图16a
‑
16d),表明cd147
‑
car
‑
nk
‑
92mi细胞在pdx小鼠模型中抑制肝癌进展的有效性。
[0193]
实施例6
[0194]
cd147
‑
car
‑
t细胞特异性杀伤cd147阳性肿瘤细胞
[0195]
针对8个hcc细胞系(huh7、huh7.5、hepg2、sk
‑
hep1、hep3b、hu1545、hco2和lh86)测试了cd147
‑
car
‑
t细胞杀伤hcc细胞的能力。从健康供体获得外周血单个核细胞(pbmc)。为转导pbmc,将细胞在10%fbs rpmi
‑
1640培养基中用1μg/ml抗cd3(克隆,okt3,ortho biotech,bridgewater,nj,usa)以及1μg/ml抗cd28和100u/ml重组人il
‑
2(阿地介白素;chiron,emeryville,ca,usa)活化。为产生cd147
‑
car
‑
t细胞,在第3天在包被有重组纤连蛋白片段(fn ch
‑
296;retronectin;takara shuzo,otsu,japan)的平板中用逆转录病毒上清液转导活化的t细胞。转导后,用il
‑
2扩增t细胞,然后用于测定。
[0196]
使用如实施例1中所述的ffluc报告基因系统测定测试cd147
‑
car
‑
t细胞对ffluc
‑
egfp
‑
hepg2的特异性杀伤(图17a)。将效应细胞(cd147
‑
car
‑
t细胞)与每孔1
×
104个细胞的靶细胞在96孔光学底微板中共培养6小时。对照组使用与cd147阳性ffluc
‑
egfp
‑
hepg2一起温育的野生型κ
‑
car
‑
t细胞。ffluc报告系统测定示出了使用敲除
‑
cd147 ffluc
‑
gfp
‑
hepg1的cd147
‑
car
‑
t细胞的细胞毒性降低(图17b)。将效应细胞(cd147
‑
car
‑
t和κ
‑
car
‑
t细胞)与靶细胞cd147阳性ffluc
‑
egfp
‑
hepg2(1
×
104)在96孔光学底微板中共培养6小时。通过酶标仪读取的发光信号测量cd147
‑
car
‑
t细胞的细胞毒性。通过标准4小时
51
cr释放测定测量
cd147
‑
car
‑
t细胞的细胞毒性(图17c)。κ
‑
car
‑
t细胞用作阴性对照组。
[0197]
实施例7
[0198]
cd147
‑
car
‑
t细胞对成神经细胞瘤细胞的作用
[0199]
在用培养基(对照)或sk
‑
n
‑
sh肿瘤细胞(图18a)以及daoy和d283细胞进行10小时后,观察到cd147
‑
car
‑
t细胞上的cd107a脱粒。效应子和靶比率为1:1.2。对细胞根据cd56阳性亚群进行门控以定量表面cd107a表达。在不同刺激下cd147
‑
car
‑
nk
‑
92mi细胞上的表面cd107a表达百分比的定量数据,如所示(图18b)。cd147
‑
car
‑
nk
‑
92mi细胞在3小时后对daoy细胞也具有细胞毒性(图19)。
[0200]
实施例8
[0201]
hcc患者来源的原代cd147
‑
car
‑
nk细胞在体外特异性杀伤cd147阳性肿瘤细胞
[0202]
由于cd147跨多种实体瘤类型的广泛表达模式,cd147是基于cd147
‑
car的癌症免疫疗法的有吸引力的靶。此处我们检查了cd147在人hcc组织样品中是否上调。与健康肝组织相比,不同阶段的hcc肿瘤组织对cd147呈强阳性染色(图21a)。
[0203]
为评估cd147
‑
car修饰的直接从hcc肝中分离的原代nk细胞是否可以在体外杀伤hcc,从肝组织的不同区分离nk细胞(图21b),所述不同区包括患有hcc的人肝中的肿瘤区、肿瘤相邻区和非肿瘤区。然后,扩增这些nk细胞(图21c)。cd147
‑
car使用这些来自人hcc肝组织的经扩增的nk细胞生成。活化的nk细胞的转导效率通常大于70%(图21d)。cd147
‑
car
‑
nk细胞特异性识别表达cd147的肿瘤细胞。针对hcc细胞系评估cd147
‑
car
‑
nk的抗肿瘤活性(图21e)。综上,这表明cd147
‑
car重新定向的原代人肝nk细胞特异性和选择性地杀伤cd147阳性靶细胞。
[0204]
实施例9
[0205]
synnotch gpc3诱导型cd147
‑
car t细胞选择性靶向gpc3+cd147+hcc细胞,但不靶向gpc3+cd147
‑
或gcp3
‑
cd147+hcc细胞
[0206]
为生成抗gpc3 synnotch诱导的受体载体,通过genewiz合成可以与人gpc3抗原特异性结合的抗gpc3(小鼠gc33克隆)scfv。通过重叠pcr,将编码n端处的信号肽和myc标签的序列与来源于(addgene质粒号79125)的synnotch
‑
gal4vp64诱导型元件融合。将片段插入到由限制性核酸内切酶ncoi和xhoi消化的sfgγ逆转录病毒载体中。
[0207]
为构建抗cd147
‑
car
‑
mcherry载体,将整个cd147
‑
car元件插入到由限制性核酸内切酶mlui和ndei消化的phr_gal4uas_pgk_mcherry(addgene质粒号79124)中。mcherry基因的表达受pgk启动子的控制。在此策略中,将egfp和mcherry双阳性细胞门控为经synnotch car修饰的细胞,以进行进一步分析和功能评估。
[0208]
为生成抗cd147 synnotch诱导型受体载体,通过重叠pcr将抗cd147 scfv与来源于phr_pgk_anticd19_synnotch_gal4vp64(addgene质粒号79125)的synnotch
‑
gal4vp64诱导型元件融合。向n端加入myc标签。将片段插入到信号肽后的由限制性核酸内切酶sali和mlui消化的sfgγ逆转录病毒载体中。
[0209]
为构建抗gpc3
‑
car
‑
mcherry载体,将含有抗gpc3(小鼠gc33克隆)scfv的完整gpc3
‑
car元件插入到由限制性核酸内切酶mlui和ndei消化的phr_gal4uas_pgk_mcherry(addgene质粒号79124)中。mcherry基因的表达受pgk启动子的控制。在此策略中,将myc标签和mcherry双阳性细胞门控为经synnotch car修饰的细胞,以进行进一步分析和功能评
估。
[0210]
表2:用于质粒构建的引物
[0211][0212][0213]
为减轻对正常组织的脱肿瘤毒性,测试了在不同类型细胞(以造血细胞为重点)中cd147表达密度对cd147
‑
car的抗肿瘤活性的作用。评估了hepg2、raji、daudi和pbmc中的cd147表达。观察到cd147的不同表达水平(图22a)。值得注意的是,那些表达低水平cd147的细胞(例如pbmc)不会触发cd147
‑
car
‑
nk
‑
92mi细胞的细胞毒性活性,即使当cd147
‑
car细胞与靶细胞以10比1的高效应子和靶比率(e:t比率)培养时也是如此(图22b)。这些发现表明,抗cd147的经优化的scfv序列仅允许特异性scfv结构域结合具有高表达cd147分子的细胞,这可以减轻对表达低水平cd147分子的正常组织的脱肿瘤毒性。
[0214]
为进一步减轻cd147
‑
car的脱肿瘤毒性,使用了可以释放转录因子的synnotch受体,所述转录因子进而驱动针对不同肿瘤抗原的car的表达。这种“逻辑门控”synnotch car
仅可以杀伤双抗原阳性肿瘤细胞,而不能杀伤单肿瘤抗原阳性肿瘤细胞。设计了由gpc
‑
3和cd147组成的组合方法以减轻脱肿瘤毒性。简言之,构建了sfg逆转录病毒载体,其编码连接gal4
‑
vp64细胞内转录激活结构域的抗gpc3特异性synnotch受体。将组成型表达的增强型gfp(egfp)置于gpc3
‑
synnotch的下游以鉴定经转导的细胞(图23a)。
[0215]
构建了慢病毒载体,其中将抗cd147
‑
car置于上游激活序列(uas)启动子的控制下,所述uas启动子可以由在synnotch受体接合(engagement)后释放的gal4
‑
vp64转录因子激活。将组成型表达的单体红色荧光蛋白cherry(mcherry)置于诱导型cd147
‑
car的下游以鉴定经转导的细胞(图23a)。
[0216]
用慢病毒和逆转录病毒载体两者共转导人pbmc(图23c)。使用流式细胞术分析,通过egfp(抗gpc3
‑
synnotch的标志物)和mcherry(cd147
‑
car的标志物)验证双阳性细胞(图23d)。分析了经转导t细胞的四个亚群(包括仅mcherry阳性、仅gfp阳性、gfp和mcherry双阳性以及gfp和mcherry双阴性亚群)(图23e)。这些经转导的t细胞由gpc3
高
cd147
低
hepg2细胞系致敏以诱导表面上的cd147
‑
car表达(图23f)。在不存在synnotch接合的情况下,未观察到cd147
‑
car表达。在经转导的原代t细胞中未观察到car表达的泄漏。然而,在经转导的nk
‑
92mi细胞中观察到约10%的car表达泄漏(数据未示出)。通过γ分泌酶抑制剂(mk
‑
0752,notch信号传导抑制剂)治疗测定进一步验证了这一观察结果(图24)。在mk
‑
0752治疗时,显著抑制了gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry双阳性t细胞上的cd147
‑
car表达(图24)。
[0217]
在gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry共转导t细胞并由gpc3
高
cd147
低
hepg2细胞系致敏后,经转导t细胞的活性由不同的hcc细胞系亚群触发2小时,以评估杀伤功效。hcc细胞系的不同亚群是:cd147+gpc3
高
hepg2细胞系、cd147
ko
gpc3
高
hepg2细胞系、cd147+gpc3
低
hepg2细胞系、cd147
ko
gpc3
低
hepg2细胞系(图23g)。佛波醇
‑
12
‑
肉豆蔻酸酯
‑
13
‑
乙酸酯(pma)/离子霉素(iono)用作阳性对照。
[0218]
用cd147
ko
gpc3
高
hepg2细胞致敏的gpc3
‑
synnotch
‑
gfp和cd147
‑
car
‑
mcherry双阳性t细胞可被cd147+gpc3
高
hepg2细胞特异性激活(图23h),当与不同的靶细胞系共培养时,通过cd107a表面表达进行定量。当将带myc标签的cd147特异性synnotch
‑
gfp和诱导型gpc3
‑
car
‑
mcherry共转导到t细胞中时,获得了类似结果(图25a
‑
25h)。
[0219]
综上,所述数据表明只有synnotch gpc3诱导型cd147
‑
car t细胞可以被gpc3+cd147+hepg2细胞特异性激活,但不能被gpc3+cd147
‑
或gpc3
‑
cd147+hepg2细胞激活。这些激活的cd147
‑
car t细胞可以杀伤cd147+gpc3+hepg2细胞,但不能杀伤cd147
‑
gpc3+hepg2细胞(图26a
‑
26d)。
[0220]
鉴于可以应用本公开的原理的许多可能的实施方案,应当认识到,所说明的实施方案仅仅是实例并且不应被视为限制本发明的范围。相反,本发明的范围由以下权利要求限定。因此,我们要求保护落入这些权利要求的范围和精神内的所有内容作为本发明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1