双循环微生理系统的制作方法
1.本发明涉及用于细胞培养物的微生理系统,主要用于提供研究药物代谢的手段的目的。微生理系统也可称为微流体细胞培养系统或器官芯片(organ
‑
on
‑
a
‑
chip)。系统包括双循环布置,用于为细胞培养物提供培养基(以及任选的用于研究的选择的化合物)。双循环布置允许容易地为细胞培养物的不同阶段改变培养条件。本发明的方面进一步涉及细胞培养和研究药物代谢的方法。
背景技术:
2.药物代谢是将母体化合物转化为代谢物,代谢物通常接着从身体中排出。药物代谢的主要器官是肝脏。体外药物代谢的测量是药物开发过程的必不可少的部分。为了实现精确的测量,两个基本要求是:i)具有代谢测试化合物/药物的功能能力的体外系统,ii)足够高的细胞数与培养基体积比,以确保可精确地测量母体和/或代谢物的浓度。该测量通常使用液相色谱法进行。
3.目前用于药物代谢的技术包括微粒体、悬浮肝细胞和铺板肝细胞。所有这些技术具有显著的缺点,即系统中的微粒体/细胞的功能性能随着时间的推移而下降,在一些情况下非常迅速下降。这使得它们不适合测量代谢缓慢的化合物,因为化合物必须与测量系统保持延长时间段的接触。在该延长时间段期间,细胞停止运作和/或死亡。例如,在悬浮培养中,肝细胞可能无法维持超过6小时。di等人提出了该问题的解决方案(di l,trapa p,obach rs,atkinson k,bi ya,wolford ac,tan b,mcdonald ts,lai y,tremaine lm.,a novel relay method for determining low
‑
clearance values,drug metab dispos.2012年9月;40(9):1860
‑
5),其中化合物与悬浮细胞一起孵育很短时间,并且然后转移至新鲜培养物中,称为中继法。虽然成功,但是该过程耗时并且需要大量的细胞。在可选的解决方案中,chan等人(chan ts,yu h,moore a,khetani sr,tweedie d.meeting the challenge of predicting hepatic clearance of compounds slowly metabolized by cytochrome p450 using a novel hepatocyte model,hepatopac.drug metab dispos.2013年12月;41(12):2024
‑
32)将化合物与肝细胞和小鼠成纤维细胞(hepatopac)共同孵育7天的时间段,以允许足够的时间用于母体化合物的可测量的消失或代谢物的产生。同样,这会导致长期的并且劳动密集的检验。
4.微生理系统(或器官芯片)是功能强大的体外细胞培养系统,其适用于药物代谢实验。通常将细胞放置在系统中并且预培养数天,以允许在药物的实验开始(即测试阶段)之前形成功能性微组织。用于该预培养时间段的培养条件要求低的细胞数与培养基体积比,以消除对于频繁培养基更换的需要。该低的细胞数与培养基体积比使得精确地确定缓慢代谢的化合物的代谢和稀有代谢物的检测具有挑战性。
5.用于肝细胞培养的示例性微生理系统包括美国专利6,197,575和us 2005/0260745中描述的那些。这些出版物公开了包括单一培养基循环的用于肝细胞培养的系统。pct/us2017/016721(公开为wo 2017/176357)公开了细胞培养平台,其中离散微生理系统
通过溢流道特征与其他器官相连。ep 2322913描述了用于分析布置在多孔板的多个孔中的培养基中的细胞的装置,包括用于插入多孔板的孔中的阻挡件。us 2008/145922描述了用于检测培养物中细胞的代谢活性的装置,该装置包括可移动的分离元件,以限定反应空间。
6.本发明的实施方式的目标之一是提供可选的微生理细胞培养系统。在优选实施方式中,系统旨在允许更容易地进行药物代谢实验;特别是,利用本发明可以进行缓慢代谢化合物或稀有代谢物的实验。从描述中其他目标和优点将是显而易见的。
技术实现要素:
7.本发明通过提供微生理细胞培养系统解决了现有技术的缺点,该微生理细胞培养系统包括两个分开的培养基循环路径。第一路径可用于循环相对大体积的培养基,从而允许低的细胞数与培养基体积比,并且第二路径可用于循环相对低体积的培养基,从而允许高的细胞数与培养基体积比。第一路径可在生长的预培养阶段中使用,并且然后在进行代谢物检验时切换至第二路径。在添加化合物之前,为预培养时间段优化第一循环,并且为测试阶段优化第二循环,在测试时间段期间保持功能的同时,提供高的细胞与培养基比。微生理系统使细胞能够在培养中保持数周的长时间段,克服了肝细胞在6小时内死亡的悬浮细胞培养物固有的局限性。
8.根据本发明的第一方面,提供了微生理细胞培养系统,系统包括:
9.细胞培养腔室;
10.第一流体回路和第二流体回路,各自在腔室出口和腔室入口处连接至所述腔室,其中至少第一回路腔室出口和第二回路腔室出口在分开的位置;
11.其中细胞培养腔室限定第一流体填充水平和第二流体填充水平,第一流体填充水平表示比第二流体填充水平更大的流体的体积;
12.其中第一流体回路腔室出口位于第一流体填充水平或第一流体填充水平和第二流体填充水平之间,并且第二流体回路腔室出口位于第二流体填充水平或低于第二流体填充水平;从而当腔室充满流体至第一填充水平时,第一流体回路或者第一流体回路和第二流体回路都能够运转,并且当腔室充满流体至第二填充水平时,只有第二流体回路能够运转。
13.因此,对于初始预培养时间段,系统可填充培养基至第一填充水平。该第一填充水平允许第一流体回路和第二流体回路运转,从而提供相对大体积的培养基的循环。一旦细胞培养物建立,培养基可用较小体积的培养基更换,至第二填充水平,并且添加测试化合物。
14.系统可包括用于在第一流体回路和第二流体回路的运转之间切换的装置。例如,每个回路可包括可分开运转的微型泵或类似装置,可根据需要而打开或关闭。系统可进一步包括用于运转微型泵的控制器。在某些实施方式中,第一流体回路和第二流体回路中的一个或两个可包括允许关闭回路的阀门。同样,系统可包括用于运转阀门的控制器。尽管没有必要包括一个或多个阀门,但是非常优选地至少提供在测试阶段期间关闭第一回路的阀门,以便确保测试期间培养基不进入该回路。在测试阶段期间,进入第一回路的培养基具有降低测试的精度的可能性,因为第二回路中的体积将发生变化,由此将改变浓度变化率。
15.细胞培养腔室可限定用于接收细胞的位置,所述位置位于第二流体填充水平或低
于第二流体填充水平。鉴于第二填充水平表示相对小的体积,该位置允许将细胞就放置在第二填充水平下面,以便在测试阶段期间允许足够的氧气到达培养物。
16.在某些实施方式中,第一填充水平和第二填充水平由第一高度和第二高度的细胞培养腔室的壁限定,所述壁限定第一腔室出口和第二腔室出口。可使用其他阻挡件。系统可包括包围细胞培养腔室的第一壁和第二壁的另一壁。该布置允许以溢流道的形式简单地限定腔室出口,溢流道从第一壁和/或第二壁引出并且由第一壁和/或第二壁限定。使用溢流道的优点在于其提供了简单的方式使一个或两个流体回路包括暴露于环境的部分,允许循环培养基的再氧化(当系统填充至第一填充水平时尤其重要,并且细胞可不靠近填充水平,从而限制溶解氧的获取)。溢流道可进入包括在流体回路中的培养基储器,培养基可从该储器返回培养物腔室。
17.第一流体回路的体积通常比第二流体回路的体积大,例如,至少大2、3、5、10倍或更多倍。虽然不必要,但是鉴于使用第一回路和第二回路二者比仅使用第二回路会固有地允许更大体积的培养基的循环,使用不同尺寸的回路允许体积差显著更大。在某些实施方式中,第一回路的典型体积可为1000
‑
5000μl,优选1500
‑
4000μl,更优选1500
‑
3000μl,并且最优选约2000μl。在优选实施方式中,第二回路的体积约为第一回路的体积的十分之一;通常体积可为100
‑
500μl,优选150
‑
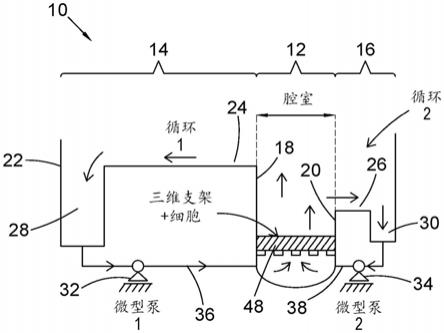
400μl,更优选150
‑
300μl,并且最优选约200μl。
18.第一流体回路优选比第二流体回路长,更优选至少长2、3、5、10倍。在最优选的实施方式中,第一流体回路明显比第二流体回路更长,并且尤其第一回路的溢流道部分至少比第二回路的溢流道部分长25、50或100倍。例如,在具体的实施方式中,第一回路具有10cm的溢流道,第二回路具有1mm的溢流道。
19.优选地,第一流体回路和第二流体回路中的一个或两个包括至少暴露于环境的部分;更优选地,至少第一回路包括至少暴露于环境的部分。
20.系统可进一步包括至少一个储器,该储器不是用于接收液体的流体回路的一部分;优选地,至少一个储器邻近第二流体回路。例如,可邻近第一流体回路提供另外的储器。使用中的储器可填充液体;这可有助于增加局部湿度和减少从系统的蒸发,这可是小体积的循环培养基特别关注的。
21.在实施方式中,腔室可包括细胞培养物;例如,肝细胞培养物;或肺细胞培养物、肠细胞培养物或肾细胞培养物。细胞培养物可包括在三维支架或透孔(transwell)嵌套件内。技术人员了解生成用于细胞培养物的三维支架或透孔嵌套件的方法。
22.本发明的方面提供了用于培养细胞的方法,该方法包括:
23.将待培养的细胞放置在本文限定的系统中;
24.将培养基放置在系统中至第一流体填充水平;
25.使第一流体回路运转和任选地也使第二流体回路运转,以使所述培养基循环,并且培养所述细胞;
26.去除或更换系统中的培养基至第二流体填充水平;
27.仅使所述第二流体回路运转,以使所述培养基循环,并且培养所述细胞。
28.优选地,当培养基处于第一填充水平时,使第一流体回路和第二流体回路一起运转。当运转切换至仅第二流体回路时,这优选地以第一回路和第二回路的组合速率运转(或仅以第一回路的速率运转,其中第二回路在第一填充水平处不运转)。这在方法的细胞培养
的第一阶段和第二阶段中保持了相同的总培养基流量,因此减少了变异性。
29.本发明进一步提供了用于在细胞培养物中研究药物代谢的方法,方法包括:
30.将待培养的细胞放置在本文限定的系统中;
31.将培养基放置在系统中至第一流体填充水平;
32.使第一流体回路运转和任选地也使第二流体回路运转,以使所述培养基循环,并且培养所述细胞;
33.去除或更换系统中的培养基至第二流体填充水平,所述培养基包括待研究其代谢的药物;
34.仅使所述第二流体回路运转,以使所述培养基循环,并且培养所述细胞;和
35.分析所述培养基,以确定是药物代谢物的存在或缺失。
36.可通过任何合适的方法分析培养基;例如,培养基的液相色谱法。
附图说明
37.现在将仅通过示例并且参考附图来描述本发明的这些方面和其他方面。
38.图1显示了根据本发明的实施方式的微生理细胞培养系统的示意性侧截面图;
39.图2显示了图1的系统的示意性顶视图;
40.图3显示了图1的指示第一流体填充水平的系统;
41.图4显示了图1的指示第二流体填充水平的系统;
42.图5显示了本发明的可选实施方式的微生理细胞培养系统的示意性侧截面图。
具体实施方式
43.根据本发明的实施方式的微生理细胞培养系统显示在图1中的示意性侧截面图和图2中的示意性俯视图中。参考两幅图,细胞培养系统10包括细胞培养腔室12以及第一流体回路14和第二流体回路16。细胞培养腔室12由不同高度的第一壁18和第二壁20界定。系统作为整体由另一壁22界定。第一壁18(通过其高度)限定了第一流体填充水平(见图3中的52),并且同样,第二壁20限定了第二流体填充水平(见图4中的54)。第一流体填充水平表示比第二流体填充水平更大的体积。
44.每个壁进一步以开放式的溢流道24、26的形式限定了来自腔室12的第一出口和第二出口;高于各自壁18、20水平的流体将沿着溢流道24、26流至培养基储器28、30。每个流体回路中的微型泵32、34通过回流通道36、38泵送来自储器28、30的培养基,以使其返回至细胞培养腔室12。
45.从图中显而易见,第一流体回路14包括第一壁18、第一溢流道24、第一培养基储器28、第一微型泵32和第一回流通道36。第二流体回路16包括壁20、溢流道26、培养基储器30、微型泵34和回流通道38。进一步,第一溢流道24位于第一流体填充水平52处或低于第一流体填充水平52,但高于第二流体填充水平54;而第二溢流道26位于第二流体填充水平54处或低于第二流体填充水平54。这确保当细胞培养基以第一流体填充水平52存在于系统中时,第一流体回路14和第二流体回路16二者都可运转,而当细胞培养基仅以第二流体填充水平54存在时,仅第二流体回路16可运转。
46.如图2中显示,系统还包括未连接至流体回路的一系列储器40、42、44、46。这些储
器邻近溢流道24、26和培养基储器28、30放置。
47.细胞培养腔室12包括三维细胞支架48,该支架48接种有细胞,例如肝细胞。
48.在使用中,系统可如下运转。
49.将肝细胞,通常人原代肝细胞(但是也可使用其他细胞类型)接种至微生理系统中腔室12内的三维支架48中。支架48的设计和用于细胞接种的方案是本领域已知的。例如,见cn bio innovations提供的肝芯片系统,并且如aurelie vivares、sandrine salle lefort、catherine arabeyre fabre、robert ngo、geraldine penarier、michele bremond、patricia moliner、gallas、gerard fabre&sylvie klieber(2015)morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device,xenobiotica,45:1,29
‑
44,doi:10.3109/00498254.2014.944612中描述。
50.系统配备适当的细胞培养基至第一填充水平52。使两个微型泵32、34运转,以便使细胞培养基经由第一流体回路14和第二流体回路16通过含有细胞的支架循环。在流体通过含有细胞的支架48之后,其通过溢流道24、26返回泵32、34,每个溢流道限定了表面通道,其允许流体通过与环境空气接触而再氧化。请注意,第一回路的溢流道24明显比第二回路的溢流道26更长(例如,长达100倍);鉴于第一回路中更大的培养基体积,这有助于培养基在循环过程中的再氧化。这是第一循环,培养基在其周围连续再循环。支架通常包含60万个肝细胞,并且第一循环包含2000μl的细胞培养基。这已被证明能维持高功能细胞,并且使得对更新细胞培养基的需要最小化。
51.例如,上面引用的vivares等人2015年的文章表明,三维肝脏支架(在vivares等人2015年中布置为单环路)比单层培养的人原代肝细胞更好地维持肝脏代谢功能。对于功能寿命而言,持续几天的单层培养物被认为优于广泛用于药物代谢工作(例如在中继检验中)的持续数小时的悬浮培养物。此外,rowe等人(perfused human hepatocyte microtissues identify reactive metabolite
‑
forming and mitochondria
‑
perturbing hepatotoxins,toxicology in vitro第46卷,2018年2月,第29
‑
38页)表明三维肝支架可维持细胞7天,其代谢转录组与新鲜解冻的细胞相似。新鲜解冻的细胞相当于悬浮检验开始时使用的细胞条件,然后在悬浮检验过程中死亡。
52.用于测试阶段的第二循环(当添加化合物并且测量代谢时)的体积明显更低,约200μl。以支架48上方的垂直高度低于第一循环的方式从含有细胞和支架的细胞培养腔室12中吸出第二循环
‑
见第二壁20和第二溢流道26以及第二流体填充水平54。这是重要的,因为其允许当第一循环为空时使第二循环运转,并且减少了含有细胞的三维支架的上方的细胞培养基的体积,从而确保支架内细胞的充分氧化。第二循环同样也包含微型泵34,其通过含有细胞的支架使细胞培养基连续循环。
53.在预培养时间段(通常为2
‑
3天),第一循环(流体回路14)和第二循环(流体回路16)二者都填充细胞培养基,并且微型泵32、34为运转的(也见图3,显示了第一流体填充水平)。在测试时间段(见图4,显示了第二流体填充水平),第一循环为空的,并且仅将含有待测试药物的新鲜细胞培养基添加到第二循环中,至第二流体填充水平54。用于第二循环的微型泵34以等于预培养时间段中两个微型泵32、34的速率之和的速率运行。这确保了不改变支架中的细胞在预培养时间段和测试时间段之间经历的流动条件。由于第一微型泵32未
运行,显然微型泵32、34都必须处于独立控制之下。鉴于第二循环的体积为低的(~200μl),但是支架中的细胞数是高的(~60万),测试时间段可通常为短的,例如,小于或等于24小时。描述的短时间将确保使用无血清和/或无蛋白培养基,因为消除了蛋白结合,该无血清和/或无蛋白培养基简化了代谢分析。
54.在检验进行期望的时间段(通常为1
‑
24小时)之后,可移除培养基的样品,并且以适当的方式进行分析,以确定代谢物含量。对此可使用标准技术,例如,液相色谱法。
55.为了降低从系统中蒸发的风险,特别是从低体积的第二循环中蒸发的风险,在第二循环附近设置了储器40、42、44、46,其可填充液体,以增加局部相对湿度。这是重要的,因为在测试时间段期间细胞培养基的蒸发可导致浓度测量不精确,并且从而导致代谢率的错误确定。短时间的测试也有助于减少蒸发。
56.使用本文公开的微生理系统的另外的好处是在三维支架中可包括肝脏的非实质细胞类型。这允许在一系列生理和病理条件(例如炎症)下检验代谢。
57.进一步,不必使用三维细胞支架或肝细胞。细胞来自肝以外的器官(例如肺、肠、肾)的可选实施方式是可能的,细胞培养物的可选形式(例如单层、透孔)也是可能的。图5显示了其中使用包括肠细胞的透孔嵌套件代替三维支架的实施方式。其他特征一样。
58.为了比较描述的系统和其他竞争技术的细胞数与培养基体积比,使用了chan等人表2中的数字:
59.悬浮肝细胞检验
‑
每孔5万个细胞,孔体积50μl
‑
每毫升100万个细胞。但是,超过6小时不能进行检验。
60.hepatopac检验
‑
每孔5千个细胞,孔体积64μl
‑
每毫升7.8万个细胞。检验至少需要7天。
61.本文描述的检验:
62.预培养时间段
‑
每孔60万个细胞,组合循环的体积为2000μl
‑
每毫升30万个细胞。培养3天。
63.测试时间段
‑
每孔60万个细胞,第二循环中的体积仅为200μl
‑
每毫升300万个细胞。检验为1
‑
24小时。
64.因此,本发明提供了允许容易地从预培养的低细胞数与体积比的系统切换至高细胞数与体积比的测试系统的系统。这允许快速分析可能稀有或低水平的代谢物。例如,vivares等人2015年描述的三维肝支架单环路系统可用于研究丙吡胺和噻吗洛尔的代谢。这两种化合物都被认为缓慢代谢。虽然单环路系统具有足够的代谢活性,能够测量代谢,但测试阶段需要5天才能产生可测量的变化。利用本文提出的双环路系统,我们预期测试阶段将缩短至少于1天。这节省了时间并且也有助于消除在无培养基交换的长时间测试中可能出现的蒸发问题。
65.本发明的进一步优点包括维持高功能细胞达到几周。培养基的再循环允许代谢物的积累;许多其他微生理系统是单程的,即培养基只在短时间内接触细胞一次,然后离开系统,这导致代谢的时间不足。
66.与hepatopac系统相比,检验的总长度较短(本系统包括预培养为4天,而hepatopac系统至少为7天,并且不包括预培养时间)。使用hepatopac培养允许延长的测试时间段,但是在微量滴定板中使用小体积时,在该时间段内,蒸发将是明显的问题。总的检
验时间较长(即使忽略hepatopac的预培养期);并且hepatopac系统包含人细胞和小鼠支持细胞,这可使代谢的分析混乱。
67.与提供合理的接近于人肝脏的代谢的人原代肝细胞悬浮培养相比,该系统也具有优势。重要的是,随着细胞的死亡,测试/检验时间限制为6小时。即使在6小时检验期间,细胞活力和代谢能力随着时间的推移也显著下降。众所周知,悬浮肝细胞不能用于评估代谢缓慢的化合物,因为化合物不能保持足够的接触时间以实现可测量的代谢。增加细胞与培养基比例以克服该问题是不可能的,因为在标准微量滴定板的孔中,营养物供应达到了极限,特别是氧合达到了极限。
68.提供中继法提供了可选方案,其克服了悬浮肝细胞的短的培养时间的缺点。如di等人描述的,使用5x4小时的孵育进行中继。在每次孵育中,使用25万细胞(每毫升50万个细胞,0.5毫升体积)。因此,要完成5次孵育,需要125万个细胞。这比本文中公开的检验中使用的细胞多2.1倍,并且细胞与培养基比更低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1