用于控制腔室中加注高度的方法和装置与流程
用于控制腔室中加注高度的方法和装置
背景技术:
1.本发明涉及一种用于控制装置的至少一个腔室中的悬浮液的加注高度的方法,所述装置用于向所述悬浮液施加电场,所述悬浮液为细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液。本发明还涉及一种用于向至少一个腔室中的细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液施加电场的装置,包括至少第一电极和第二电极、设置在腔室一端的至少一个入口端口和设置在腔室相对端的至少一个出口端口,其中所述第一电极设置在腔室内入口端口处,所述第二电极设置在腔室内出口端口处,并且其中所述腔室还包括至少一个接地电极。
2.将生物活性分子(如dna、rna或蛋白质)导入活细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡中,例如,可以用于检测这些分子的生物学功能,并且是将这些分子成功用于治疗用途(如,基因治疗)中的必要前提。将外源分子导入细胞的一个优选方法为所谓的电穿孔,与化学方法不同,所述电穿孔能限制靶细胞在结构和功能上的不良变化。在电穿孔中,外源分子经由短电流从水溶液,优选为适合细胞的特定缓冲溶液,或细胞培养基,导入细胞,即经由放电电容器的脉冲,使细胞膜对外源分子具有瞬时渗透性。在细胞膜中形成的临时“孔”允许生物活性分子首先进入细胞质,在所述细胞质中它们可能已经发挥其功能或任何待检测的治疗作用,然后,在某些条件下,也根据需要进入细胞核,例如在基因治疗应用中。由于在短时间内施加强电场,即具有高电流密度的短脉冲,细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡也可能融合。在这种所谓的电融合中,例如,通过不均匀的交变电场,使细胞最初与膜紧密接触。随后施加的电场脉冲导致膜部分之间进行相互作用,最终导致融合。也可使用与电穿孔装置相当的装置进行电融合。
3.在细胞的电穿孔期间,反应腔室内会产生一定量的碎屑和泡沫。当将处理过的细胞悬浮液从反应腔室中移出时,例如通过推入空气或让重力排空腔室时,这些碎屑和泡沫留在腔室内,并减少了将被加注到该腔室中进行下一个电穿孔周期的新细胞悬浮液的加注体积。也就是说,腔室容积可以变化,从而使下一次加注所需的容积几乎不可预测。为了避免将贵重材料过量加注到腔室中而导致其无法被处理,因此,动态地且相应地限制加注到腔室中的量是很重要的。然而,为了避免过量加注而预防性地减少加注体积会导致加注不足,从而导致在气液界面产生电弧放电。电弧放电会产生热量和高电流,损坏电气接口和部件,还会损害反应腔室内的生物材料。此外,当系统的最终用户插入管路时,对管路不确定的张力导致未知的内径。如果使用蠕动泵,又会导致泵每次旋转时处理体积的不确定性。因此,需要准确地加注,才能获得良好的电穿孔性能。
4.ep 3 138 920 b1公开了一种用于对细胞进行电穿孔的方法和一种用于电穿孔的一次性装置。该装置包含用于盛装细胞悬浮液的流体部和包含要转移到细胞中的化合物的流体。所述装置还包含第一和第二电极以及相应的接地电极。流体被引入到流体隔室中达到预定的加注高度,其中所述加注高度是通过测量第一和第二电极之间的电容或接地电极之间的电阻来确定的。例如,继续加注直至达到电极之间的最大容量。进行电穿孔后,将经处理的细胞悬浮液从流体部清除。通过控制流体隔室中的加注高度,该装置可以在半连续
模式下运行。此外,为了处理更大体积的细胞悬浮液,可以重复加注、电穿孔和清除的过程。
5.然而,如果必须执行多个电穿孔周期,不能保证在所有周期内对电穿孔腔室进行精确加注仍然是现有技术中装置和方法的缺陷。
技术实现要素:
6.本发明的一个目的是提供一种方法和装置,用于控制装置的至少一个腔室中的悬浮液的加注高度,所述装置用于向所述悬浮液施加电场,所述悬浮液为细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液。通过所述方法和所述装置,即使进行多次电穿孔周期,也可以避免所述腔室过量加注,并且,即使在腔室容积不可预测的情况下,也可以实现精确加注,以确保所有周期都能获得良好的重复电穿孔性能。
7.目的通过一种用于控制装置的至少一个腔室内的悬浮液的加注高度的方法来实现,所述装置用于向所述悬浮液施加电场,所述悬浮液为细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液,其中所述装置包含至少第一电极和第二电极、设置在所述腔室一端的至少一个入口端口和设置在所述腔室相对端的至少一个出口端口,其中所述第一电极设置在所述腔室内所述入口端口处,并且所述第二电极设置在所述腔室内所述出口端口处,并且其中所述腔室还包括至少一个接地(对)电极;所述方法包括:
8.a)开始加注程序,其中将所述悬浮液通过所述入口端口注入所述腔室;
9.b)在所述加注程序期间,在多个时间点测量所述腔室内所述第二电极和所述接地电极之间的电阻;以及
10.c)启动终止例程,包括终止所述加注程序,其中根据所述第二电极和所述接地电极之间的所述电阻的至少一个变化而启动所述终止例程。
11.即,根据本发明,通过确定出口端口处电阻的至少一个变化,在多个电穿孔周期中,动态地限制加注到腔室中的悬浮液的量。为此,在每个周期的加注程序期间,在多个时间点测量第二电极和接地电极之间的电阻,例如,设置在出口端口旁的电极与其对电极之间的电阻。当检测到电阻变化时,启动终止例程,并且,可选地,在延迟终止例程之后,最终终止加注程序。因此,即使在多个电穿孔周期中,在腔室的加注容积不断减少的情况下,也可以避免腔室的过量加注。因此,在每个电穿孔周期期间确保腔室的精确加注,可以保证重复电穿孔性能的提高。根据本发明的方法的另一个优点是可以有效避免宝贵且昂贵的生物材料的浪费。
12.在本发明的一个优选实施例中,当电阻达到预定值时,启动终止例程。在碎屑、残留物和气泡可能导致过早触发终止例程算法的情况下,可以引入凭经验确定的阈值,以区分残留物和真实样品的作用。在该实施例中,仅在达到预定电阻值和/或电阻下降到低于该值之后,才启动终止例程。例如,一旦电阻下降到低于某个极限(预定值),装置的控制系统就会触发启动终止例程。
13.在本发明的另一优选实施例中,如果满足终止条件,则终止加注程序,所述终止条件包括:
[0014]-所述电阻变化的第一斜率超过第一预定阈值,并且
[0015]-所述电阻变化的第二斜率达到第二预定阈值,其中所述第二阈值表示的斜率低于所述第一阈值表示的斜率。
[0016]
根据该实施例,通过确定电阻的变化范围,动态地限制加注到腔室中的悬浮液的量。即,如果电阻变化的斜率减小,则启动终止例程,并且可选地,在延迟终止例程之后,最终终止加注程序。例如,一旦确定电阻变化的斜率超过特定的预设阈值(第一阈值),则装置的控制系统等待斜率再次减小,直至达到另一个特定的预设阈值(第二阈值)。
[0017]
在本发明的另一优选实施例中,终止条件还包括在第二斜率之后确定的电阻变化的第三斜率等于或低于第二阈值。因此,只有在至少两次连续测量值达到或低于第二阈值时,才终止加注程序,以减少由测量差异引起的误差。
[0018]
在本发明的另一优选实施例中,在确定满足终止条件之后,终止例程包括延迟终止,其中,基于至少一个预设参数,在最终终止之前继续加注程序。通过这种措施,可以有效地补偿与电阻和加注高度相关的凭经验确定的差异。也就是说,继续执行加注程序,直至与准确的加注量之间的偏差被补偿,该偏差在反复加注的过程中不断增加。
[0019]
例如,所述预设参数可以包括由蠕动泵执行的步数。然而,根据本发明的方法,可以使用任何能够精确控制处理的液体量的泵(例如,注射器或输液泵)。例如,可以通过等式n_目标=(n_p+n_sts)/2+p,来计算蠕动(步进电机)泵的步数,其中n_目标为计算得出的完成加注程序所需的步数,n_p为前一加注程序期间执行的步数,n_sts为当前标准检测目标步数,并且p为凭经验确定的步数。在本文中,所述措辞“当前标准检测目标步数”是指仅通过当前加注周期信息计算得出的目标步数(与泵转数和体积相关)。由于样本引起的自然差异,随后,将该步数和前一周期的步数进行平均/平滑。
[0020]
如果确定与准确填充量之间仍然存在偏差,则可以通过在加注中增加蠕动泵的步数(n)来解决此问题。因此,例如,可以通过等式n_目标=((n_现在+s-r)+n_p)/2+p-n,来计算蠕动泵的步数,其中n_目标为计算得出的完成加注程序所需的步数,n_现在为当前步数,s为预设(凭经验确定的)步数,r为与电压脉冲能量相关的预设步数,n_p为在前一加注程序期间执行的步数,p为凭经验确定的步数,并且n为(所有之前的)加注程序(周期)的数量乘以20。此处使用的术语“当前”是指,当这一加注满足所有加注标准,并且装置的控制系统只需计算/预测准确加注所需的剩余步数时,在进行中的加注期间已运行的实际泵步数。
[0021]
在本发明的另一优选实施例中,在加注程序开始之前,开始初始传输程序。所述传输程序包括在入口端口上游的混合处将细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液与底物或探针混合,并通过入口端口将混合液或悬浮液注入腔室,直至在第一电极处检测到电阻下降,其中,在初始传输程序期间,在多个时间点测量腔室内第一电极和接地电极之间的电阻。即,在该“启动”过程中,测量第一电极和接地电极之间的电阻,例如,测量设置在入口端口旁的电极与其对电极之间的电阻。如果空电穿孔腔室的无穷大电阻下降到较低值,则可以可靠地表明液体(悬浮液/混合液)已达到最靠近入口端口处的电极。将悬浮液与入口端口上游的探针混合并测量入口端口处的电阻,以确保在悬浮液被引入腔室之前已为电穿孔做好了充足的准备,从而避免受到管路长度和细胞悬浮液的光学特性的影响,并避免在启动过程期间进行更复杂的测量,例如电容方法。特别地,反应腔室入口端口处的电极用于检测腔室内的基于液体的电变化,以确定第一部分液体何时进入反应腔室。
[0022]
在该实施例中,在第一电极处检测到的电阻下降可以为5-15欧姆的电阻下降,优选为约10欧姆。因此,用于在入口端口处对细胞悬浮液进行基于电阻的液体检测的电阻阈值应该比在启动开始时的初始电阻测量值低例如约10欧姆。当在第一电极上测得的电阻下
降了10欧姆时,就应认为已检测到悬浮液。
[0023]
为了确保悬浮液与底物或探针完全混合,所述初始传输程序还包括,当检测到电阻下降时,停止向腔室内注入悬浮液,然后将悬浮液收回至混合处,在所述混合处,在开始加注程序之前,将悬浮液与底物或探针混合。通过这种措施,以确保悬浮液在进入电穿孔腔室之前,与底物或探针充分混合。
[0024]
如果存在初始传输程序,则其仅在首次加注程序开始之前执行一次。
[0025]
为了进行电穿孔,在加注程序结束后,通过至少一个电极提供至少一个电压脉冲,以对腔室内的悬浮液施加电场。将悬浮液加注至腔室并随后提供至少一个电压脉冲可以重复预定的周期数。因此,与分批处理不同,可以以一种半连续处理的方式对悬浮液的等分试样进行连续重复电穿孔,来处理大量的悬浮液。
[0026]
目的还通过一种用于向至少一个腔室内的细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液施加电场的装置来实现,所述装置包括至少第一电极和第二电极、设置在腔室一端的至少一个入口端口和设置在腔室相对端的至少一个出口端口,其中所述第一电极设置在所述腔室内所述入口端口处,并且所述第二电极设置在所述腔室内所述出口端口处,并且其中所述腔室还包括至少一个接地(对)电极。根据本发明,至少所述第二电极是用于测量所述腔室内所述第二电极和所述接地电极之间的电阻的第一传感器电极。通过控制出口端口处的电阻,即使在多个电穿孔的周期中,在腔室的加注容积不断减少的情况下,也可以避免腔室的过量加注。因此,在每个电穿孔周期期间确保腔室的精确加注,可以保证重复电穿孔性能的提高。根据本发明的装置的另一个优点是,可以有效避免宝贵且昂贵的生物材料的浪费。
[0027]
在根据本发明的装置的一优选实施例中,第一电极为用于测量腔室内第一电极和接地(对)电极之间的电阻的第二传感器电极。通过控制第一电极的电阻,可以可靠地表明液体(悬浮液)已经达到最靠近入口端口处的电极。特别地,反应腔室入口端口处的电极用于检测腔室内的基于液体的电变化,以确定第一部分液体何时进入反应腔室。
[0028]
下面参照附图对本发明进行进一步示例性的详细描述。
附图说明
[0029]
图1示出了根据本发明的方法的示例性悬浮液处理程序的流程图。
[0030]
图2示出了根据本发明的方法的初始传输程序(“启动”)的示例性顺序的流程图。
[0031]
图3示出了根据本发明的方法的示例性实施例的流程图,包含加注程序和终止例程。
[0032]
图4示出了在加注程序期间由根据本发明的装置的出口端口处的电极测量的电阻的示例性进程图。
[0033]
x轴显示进行的测量次数(间隔:步进电机泵约33步);
[0034]
y轴显示测得的电阻值[欧姆]。
[0035]
图5示出了根据本发明的装置的示例性实施例的外侧透视图。
[0036]
图6示出了根据图5的装置的一个部件的内侧平面图。
[0037]
图7示出了根据图5的装置的另一个部件的内侧平面图。
具体实施方式
[0038]
图1示出了根据本发明的完整悬浮液处理过程的实施例的概述。首先,在向腔室中加注悬浮液之前,开始初始传输程序(“启动”)。该初始传输程序包括在入口端口上游的混合处,将悬浮液与底物/探针混合,并通过入口端口将混合液注入腔室。在开始首次加注程序之前,仅执行一次此传输程序。参考图2,对初始传输程序进一步详细描述。如果启动未成功,则终止悬浮液处理过程。如果启动成功,则开始加注程序。加注程序包括将悬浮液/探针混合液注入腔室,并控制加注高度,直至达到最优加注高度。参考图3,对加注程序进一步详细描述。接着,通过向混合液施加一个或多个电压脉冲(“脉冲”),来进行电穿孔。脉冲后,如果未达到预设的周期数,则清空腔室,并将混合液的第二个(下一个)等分试样加注到腔室中进行电穿孔。可以多次重复加注和脉冲程序,以达到预设的周期数。如果达到预设的周期数,或者连续两次测得的腔室内两个电极之间的电阻超出范围(“错误2”),则清除腔室,并最终终止悬浮液的处理过程。
[0039]
图2示出了初始传输程序(“启动”)的示例性顺序。为了避免受到管路长度和悬浮液的光学特性的影响,并避免在初始传输程序中进行更复杂的测量,例如电容方法,反应腔室的电极用于观察腔室内的基于液体的电变化,以确定第一部分悬浮液何时进入反应腔室。为此,通过启动第一泵(图2中所指的“上泵”,并且本实例中的第一泵为蠕动步进电机泵),启动初始传输程序(“启动”)。所述第一泵将细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液从第一储液器泵送至混合处,然后泵送至反应腔室的入口端口。当执行完第一泵的预设步数时,开始测量腔室的第一电极(图2中所指的“最低(电极)段”)处的电阻。例如,在开始电阻测量之前,泵送可能从1,000步开始。该操作的目的是在一开始时不受移动并影响阻值的小部分液体的影响(参见图4,“最初的阻值下降”)。如果在预设的超时时间(例如,60秒)内,在第一电极处测量的电阻下降到预定阈值以下,则停止第一(“上”)泵。例如,在启动程序开始时,电阻阈值可以比初始测量的电阻值低约10欧姆。当在第一电极上测得的电阻下降了10欧姆时,则应认为已检测到悬浮液。即,在该“启动”过程中,测量第一电极和接地电极之间的入口端口附近的电阻。如果空电穿孔腔室的无穷大电阻下降到预定阈值以下,则可以可靠地表明悬浮液已达到最靠近入口端口处的电极。
[0040]
如果由于检测到足够的电阻下降而停止第一泵,且未选择单独添加底物/探针,则终止初始传输程序并开始加注程序(参见图3)。然而,如果在第一电极处未检测到电阻下降,在这种情况下也会停止第一(“上”)泵,终止例程并指示错误。如果由于检测到足够的电阻下降而停止第一泵,并确认单独添加底物/探针,则通过反转第一泵的运行方向将悬浮液收回至混合处。在混合处,混合悬浮液与底物或探针。为此,开启第二泵(图2中所指的“下泵”,且本实例中的第二泵为蠕动步进电机泵),以将底物或探针从第二储液器泵送至混合处。在入口端口的上游将悬浮液与探针混合,并测量混合液进入腔室时的阻值,以确保悬浮液在被引入腔室之前为电穿孔做好了充足准备。由此可避免由于不同的管路长度和悬浮液的不同光学特性而导致的不完全混合。优选地,在混合处的上游,第二储液器与混合处的连接管处设置至少一个光学传感器,以检测包括底物或探针的液体。如果在预设的超时时间内没有光学检测到液体,则停止第二“下”泵,终止例程并指示错误。但是,如果检测到包括底物/探针的液体,则也会停止第二“下”泵,然后通过两个泵同时运行,将混合液注入混合处与入口端口的连接管,直至混合液达到所述入口端口(图2中所指的“储液筒的入口
””
)。
然后,终止初始传输程序并开始加注程序(参见图3)。
[0041]
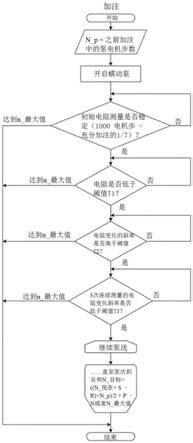
图3示出了根据本发明的加注程序和终止例程的示例性实施例,而图4示出了加注程序期间的典型电阻特征。根据本发明,通过监测腔室中出口端口(第二电极)处的电阻特征来控制反应腔室的加注。在加注程序开始时,至少一个泵(例如,根据图2的第一(“上”)和/或第二(“下”)泵)将一定体积的悬浮液/混合液泵入腔室。例如,如果使用蠕动(步进电机)泵,则将泵的预定电机步数设置为(n_p)。对于首次加注(周期),n_p被设置为默认值,并且对于所有之后的加注(周期),n_p被设置为基于先前加注的值的预定值。
[0042]
在整个加注程序中,连续测量反应腔室出口端口处的第二电极的电阻值。一旦电阻下降低于预定值(极限“阈值t1”),就启动终止例程。如果系统确定电阻变化的第一斜率超过第一预定阈值(t2),则系统等待斜率再次减小,直至进行至少两次连续测量使电阻变化的第二斜率达到第二预定阈值(t3)。如果满足这些标准,则泵(处于n_现在步数)继续运行另一个固定步数(s)。由于体积减小的作用也受到所传输电压脉冲能量的影响,因此,通过将目标步数减少r来进行泵校正。
[0043]
大量实验已经表明,为了充分减小与电阻和加注高度相关的差异,可以将当前加注(若非首次加注周期)的目标泵步设置为:
[0044]
(前一加注的步数“n_p”+当前标准检测目标步)/2+固定值(p)
[0045]
这些实验仍显示出与准确的加注量之间存在偏差,该偏差在反复加注的过程中不断增加。为了解决该偏差,向加注增加步n,所述步n为定值和当前加注周期的乘积:
[0046]
n_目标=((n_现在+s-r)+n_p)/2+p-n
[0047]
在执行增加的泵步之后,终止腔室的加注。此外,泵的步数不能高于前一加注(若非首次加注周期)的步。因此,如果达到预设的最大泵步数(n_最大值),则终止腔室的加注。
[0048]
t1可以例如设置为500欧姆;
[0049]
t2可以例如设置为50欧姆/400泵步(特定于系统);
[0050]
t3可以例如设置为20欧姆;
[0051]
s可以例如设置为850;
[0052]
r设置为与电压脉冲能量相关的步数;
[0053]
p为凭经验确定的值(例如,200);
[0054]
n设置为加注周期数,例如,乘以20;
[0055]
n_现在为当前步数;
[0056]
n_p为前一组合步数(第一泵+第二泵);
[0057]
n_目标为完成当前加注的目标步数(第一泵+第二泵的组合)。
[0058]
图5示出了根据本发明的装置1的示例性实施例的外侧,并且图6和图7分别示出了根据图5的装置1的一个部件的内侧。装置1包括基本构件2、30,每个基本构件2、30代表装置1的一个部件,所述装置由相互附接的两个部件(基本构件2和30)组装而成。在基本构件2、30的外侧,分别设有连接器31,用于将导管连接至弧形反应腔室6的端口7、8、10和11。可以通过合适的导管将一个或多个用于待处理悬浮液/探针的储液器和一个或多个用于经处理悬浮液的容器连接至连接器31。可以通过泵送元件,如真空泵或蠕动泵等,将悬浮液注入腔室6和从该腔室中排出,所述泵送元件可以连接至储液器/容器和连接器31之间的悬浮液管路上。为了使装置1与普通导管和泵送系统兼容,鲁尔连接器31可以是鲁尔滑动或鲁尔锁定
连接器。
[0059]
基本构件30还包括多个导电区32,用于为腔室6中的电极4、5提供电连接。导电区32可以包括导电聚合物,特别是掺杂有导电材料的聚合物或本征导电聚合物。导电区32被设计为在电极4、5与至少一个电接触点33之间提供电连接。在本实施例中,导电区32为至少部分地填充有导电材料的基本构件30中的孔。导电区32经由至少一个导电路径,如基本构件上的一层铜迹线(未示出),与至少一个电接触点33电耦合。可通过至少一个电触点与电触点33接触,以提供与电源和/或电压脉冲发生器之间的直接或间接电连接。
[0060]
基本构件2、30均包含设有四个电极4、5的弧形凹部3。根据装置1的一优选实施例,腔室6可以包括至少两段,每段包括至少两个电极,其中接地(对)电极为至少两段的共电极。即,三个电极为段电极4,而一个电极为对电极5。基本构件2代表装置1的一个部件,所述装置由相互附接的两个部件组装而成,其中,这些部件的至少内侧被反向设计。即,基本构件2和基本构件30具有相互附接的镜面对称的内侧,从而使基本构件2、30的凹槽3形成用于容纳细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡的悬浮液的腔室6。在该腔室6中,例如,可以将电场施加到细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡,例如以将生物活性分子如核酸或蛋白质转移至细胞、细胞衍生物、细胞器、亚细胞颗粒和/或囊泡中。为此,基本构件2的电极4、5和基本构件30的对应电极4、5建立电极对,其中基本构件2的段电极4和基本构件30的相对设置的对电极5建立三个电极对,而基本构件2的对电极5和基本构件30的三个相对设置的段电极4也建立三个电极对。在该配置中,基本构件2的对电极5和基本构件30的对电极5分别为三段的共电极,使得腔室6包括六段,其中,每段设置有一个段电极4和一个公共对电极5的区域。
[0061]
两个端口7、8设置在腔室6的一端9,两个端口10、11设置在腔室6的相对端12。在“下”端12,端口10、11中的一个端口可作为用于加注腔室6的入口端口,端口10、11中的另一端口既可以作为用于排空腔室6的出口端口,也可以作为用于清理腔室6的附加出口端口。在相对端9,端口7、8中的一个端口可作为用于排空腔室6的出口端口,端口7、8的另一个端口可作为附加的出口端口,用于排空腔室6,或者,例如,用于给腔室6通气。因此,在该示例性实施例中,每端9、12设置有两个端口7、8、10和11,通过这些端口可以将悬浮液注入腔室6和/或将悬浮液从腔室6中排出。根据流向,腔室的一端包括至少一个入口端口,而腔室的另一端包括至少一个出口端口。例如,如果端口10、11中的至少一个用作入口端口,并且端口7、8中的至少一个用作出口端口,则靠近端12上的入口端口10、11的电极4根据定义为第一电极20(第二传感器电极),并且靠近端9上的出口端口7、8的电极4根据定义为第二电极21(第一传感器电极)。因此,在该示例性实施例中,用于控制加注程序的电阻是在基本构件30的第二电极21和基本构件2的接地电极5之间测量的。用于控制初始传输程序的电阻测量值是在基本构件2的第一电极20和基本构件30的接地电极5之间测量的。然而,只要适合于实现如上所述的根据本发明的方法,可以实施任何其它电极配置和/或腔室设计。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1