脂质纳米颗粒的制作方法
脂质纳米颗粒
1.相关申请的交叉引用
2.本技术要求2019年4月26日提交的美国申请序列号62/839,452和2019年6月26日提交的美国申请序列号62/867,098的优先权权益,所述申请以引用的方式并入本文。
背景技术:
3.脂质纳米颗粒(lnp)是生物活性化合物(如治疗性核酸、蛋白质和肽)的有效药物递送系统,所述化合物否则是细胞不可渗透的。基于核酸的药物(其包括大核酸分子,例如体外转录的信使rna(mrna)以及与信使rna或基因相互作用的较小的多核苷酸)必须被递送至适当的细胞区室以便有效。例如,双链核酸,如双链rna分子(dsrna)(包括例如sirna)受到它们的物理化学性质的影响,所述物理化学性质使得它们是细胞不可渗透的。递送至适当的区室后,sirna通过称为rna干扰(rnai)的高度保守的调控机制阻断基因表达。通常,sirna的尺寸较大,分子量范围为12-17kda,并且由于其磷酸主链具有多达50个负电荷而具有高度阴离子性。此外,两条互补的rna链形成刚性螺旋。这些特征导致了sirna较差的“类药物”性质。当静脉内施用时,sirna迅速从体内排出,典型的半衰期在仅10分钟的范围内。此外,sirna被血液和其他体液或组织中存在的核酸酶快速降解,并且已显示出在体外和体内刺激强烈的免疫应答。参见例如,robbins等人,oligonucleotides 19:89-102,2009。mrna分子遭受类似的不可渗透性、脆性和免疫原性问题。参见国际专利申请公布号wo2016/118697。
4.脂质纳米颗粒制剂具有改进的体内核酸递送。例如,此类制剂显著降低了实现体内靶标敲低所需的sirna剂量。参见zimmermann等人,nature 441:111-114,2006.通常,此类脂质纳米颗粒药物递送系统是包含阳离子脂质、辅助脂质和含有聚乙二醇的脂质的多组分制剂。带正电荷的阳离子脂质与阴离子核酸结合,而其他组分支持脂质纳米颗粒的稳定自组装。
5.已经致力于提高脂质纳米颗粒制剂的递送功效。许多此类努力旨在开发更合适的阳离子脂质。参见例如,akinc等人,nature biotechnology 26:561-569,2008;love等人,proc.natl.acad.sci.usa 107:1864-1869,2010;baigude等人,journal of controlled release 107:276-287,2005;semple等人,nature biotechnology 28:172-176,2010。尽管做出了这些努力,但仍然需要含有脂质纳米颗粒的制剂,所述制剂在施用后提供高效力并且允许施用较低剂量的核酸。
技术实现要素:
6.本文提供了脂质纳米颗粒和包含所述脂质纳米颗粒的药物组合物。所述脂质纳米颗粒和药物组合物特别适用于向患者(例如人)或细胞递送核酸。
7.可用于递送核酸的脂质纳米颗粒制剂通常采用peg-脂质缀合物,其有助于在lnp制造过程中控制粒度并防止施用后在小瓶中和血液中的不想要的聚集。peg-脂质缀合物还有助于防止血液中的不想要的调理作用。这些peg-脂质缀合物使用mw为约2000的peg聚合
物组分是非常典型的。所述缀合物使用包含2个c
14
链的脂质部分并且这些peg-脂质缀合物以0.5%至2%的摩尔比(相对于所述组合物中的其他脂质)使用也是典型的。相比之下,本文所述的脂质纳米颗粒制剂可含有peg脂质,所述peg脂质的peg mw为500-1000,摩尔比为2%至5%;并且peg聚合物大小为5000-20000,摩尔比为0.2%至0.5%。因此,并且如本文更充分地描述,已经开发了新的制剂,所述制剂使用不同于通常使用的那些、以不同量使用的peg-脂质缀合物结构以为脂质纳米颗粒提供有益性质。
8.因此,在一个实施方案中,本文提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
9.(a)核酸;
10.(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
11.(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
12.(d)以所述颗粒中的总脂质的约2至约5mol%的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
13.其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,
14.其中所述peg-脂质缀合物的peg部分具有约500至约1,000道尔顿的平均分子量,
15.条件是当所述脂质锚定部分是二烷基部分时,两个烷基链中的至少一个小于c
14
。
16.还提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
17.(a)核酸;
18.(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
19.(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
20.(d)以所述颗粒中的总脂质的约0.2至约0.5mol%的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
21.其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,
22.其中所述peg-脂质缀合物的peg部分具有约5,000至约20,000道尔顿的平均分子量。
23.还提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
24.(a)核酸,其中所述核酸是mrna;
25.(b)阳离子脂质;
26.(c)非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
27.(d)聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
28.其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单链c
18
烷基部分。
29.还提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
30.(a)核酸,其中所述核酸是mrna;
31.(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
32.(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
33.(d)以所述颗粒中的总脂质的约1至约2.5mol%(例如,约1.6mol%)的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
34.其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单链c
14-c
22
(例如,c
14
、c
16
、c
18
、c
20
或c
22
)烷基部分,
35.其中所述peg-脂质缀合物的所述peg部分具有约500至约3,000道尔顿(例如,约2000道尔顿)的平均分子量。
36.还提供了一种用于降低向人施用脂质纳米颗粒(lnp)的免疫应答的方法,所述方法包括选择用于lnp中的聚乙二醇(peg)-脂质缀合物,其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单个烷基链,其中所述lnp包含mrna有效负载。
37.本发明还提供了一种药物组合物,所述药物组合物包含本发明的脂质纳米颗粒和药学上可接受的载体。
38.本发明还提供了一种用于将核酸递送至细胞的方法,所述方法包括使所述细胞与本发明的脂质纳米颗粒接触。更一般地,本发明提供了在体内或体外向活细胞施用核酸的方法。
39.本发明还提供了一种用于治疗以导致功能性蛋白质缺乏的遗传缺陷为特征的疾病的方法,所述方法包括:向患有所述疾病的受试者施用本发明的脂质纳米颗粒,其中核酸分子是编码功能性蛋白质或具有与所述功能性蛋白质相同的生物活性的蛋白质的mrna。
40.本发明还提供了一种用于治疗以多肽的过表达为特征的疾病的方法,所述方法包括向患有所述疾病的受试者施用本发明的脂质纳米颗粒,其中核酸分子是靶向所述过表达多肽的表达的sirna。
41.本发明还提供了本发明的脂质纳米颗粒,所述脂质纳米颗粒用于以导致功能性蛋白质缺乏的遗传缺陷为特征的疾病的治疗性或预防性治疗。
42.本发明还提供了本发明的脂质纳米颗粒,所述脂质纳米颗粒用于以多肽的过表达为特征的疾病的治疗性或预防性治疗。
43.本发明还提供了一种用于治疗动物的疾病或病症的方法,所述方法包括向所述动物施用治疗有效量的本发明的脂质纳米颗粒。
44.本发明还提供了本文公开的可用于制备本发明的脂质纳米颗粒的方法和中间体。
具体实施方式
45.定义
46.除非另作具体说明,否则本文所用以下术语具有属于其的含义。
47.术语“约”表示
±
5%、
±
4%、
±
3%、
±
2%或
±
1%。
48.术语“干扰rna”或“rnai”或“干扰rna序列”是指在干扰rna处于与靶基因或序列相同的细胞中时,能够减少或抑制靶基因或序列的表达(例如,通过介导降解或抑制与干扰rna序列互补的mrna的翻译)的单链rna(例如,成熟mirna)或双链rna(即,双链体rna,如sirna、airna或前体mirna)。干扰rna因此是指与靶mrna序列互补的单链rna或由两条互补
链或由单条自身互补链形成的双链rna。干扰rna可与靶基因或序列基本同一或完全同一,或者可包含错配区(即,错配基序)。干扰rna的序列可对应于全长靶基因或其子序列。
49.干扰rna包括“小干扰rna”或“sirna”,例如长度为约15-60、15-50或15-40个(双链体)核苷酸的干扰rna,更通常地长度为约15-30、15-25或19-25个(双链体)核苷酸,并且优选地长度为约20-24、21-22或21-23个(双链体)核苷酸(例如,双链sirna的每个互补序列的长度均为15-60、15-50、15-40、15-30、15-25或19-25个核苷酸,优选地长度为约20-24、21-22或21-23个核苷酸,并且双链sirna的长度为约15-60、15-50、15-40、15-30、15-25或19-25个碱基对,优选地长度为约18-22、19-20或19-21个碱基对)。sirna双链体可包含约1至约4个核苷酸或约2至约3个核苷酸的3’突出端和5’磷酸酯末端。sirna的实例包括但不限于:由两个分开链分子组装的双链多核苷酸分子,其中一条链为有义链并且另一个为互补反义链;由单链分子组装的双链多核苷酸分子,其中有义区和反义区由基于核酸或基于非核酸的接头连接;具有带自身互补有义区和反义区的发夹二级结构的双链多核苷酸分子;以及具有带自身互补有义区和反义区的两个或更多个环结构和一个茎结构的环形单链多核苷酸分子,其中环形多核苷酸可在体内或体外加工以产生活性双链sirna分子。
50.优选地,化学合成sirna。还可通过用大肠杆菌rna酶iii或切丁酶裂解较长的dsrna(例如,长度大于约25个核苷酸的dsrna)来产生sirna。这些酶将dsrna加工成生物活性的sirna(参见,例如,yang等人,proc.natl.acad.sci.usa,99:9942-9947(2002);calegari等人,proc.natl.acad.sci.usa,99:14236(2002);byrom等人,ambion technotes,10(1):4-6(2003);kawasaki等人,nucleic acids res.,31:981-987(2003);knight等人,science,293:2269-2271(2001);和robertson等人,j.biol.chem.,243:82(1968))。优选地,dsrna的长度为至少50个核苷酸至约100、200、300、400或500个核苷酸。dsrna的长度可以像1000、1500、2000、5000个核苷酸一样长或更长。dsrna可编码用于整个基因转录或部分基因转录。在某些实例中,可由质粒编码sirna(例如,转录为自动折叠到具有发夹环的双链体中的序列)。
51.如本文所使用,术语“错配基序”或“错配区”是指对其靶序列不具有100%互补性的干扰rna(例如,sirna、airna、mirna)序列的一部分。干扰rna可具有至少一个、两个、三个、四个、五个、六个或更多个错配区。错配区可为邻接的或可被1、2、3、4、5、6、7、8、9、10、11、12或更多个核苷酸分开。错配基序或区可包含单个核苷酸或可包含两个、三个、四个、五个或更多个核苷酸。
52.诸如核酸(例如,干扰rna或mrna)的核酸的“有效量”或“治疗有效量”是足以产生所需效果,例如与不存在干扰rna的情况下检测到的正常表达水平相比抑制靶序列的表达);或抑制一定量的蛋白质的mrna定向表达的量,在表达所述蛋白质的生物体中引起理想的生物学效应。当相对于对照使用干扰rna获得的值为约90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%或0%时,实现靶基因或靶序列的表达的抑制。在其他实施方案中,所表达的蛋白质是通常在体内细胞类型中表达的蛋白质的活性形式,并且mrna的治疗有效量是产生为通常在健康个体的细胞类型中表达的蛋白质的量的至少50%(例如,至少60%或至少70%或至少80%或至少90%)的量的所编码蛋白质的量。用于测量靶基因或靶序列的表达的合适测定包括,例如,使用本领域技术人员已知的技术(如斑点印迹、rna印迹、原位杂交、elisa、免疫沉淀、酶功能)以及本领
域技术人员已知的表型测定检查蛋白质或rna水平。
53.由干扰rna引起的免疫应答“减小(decrease)”、“减小(decreasing)”、“减少(reduce)”或“减少(reducing)”旨在意指给定干扰rna(例如,修饰的干扰rna)的免疫应答的可检测的减小。可相对于存在未修饰的干扰rna情况下的免疫应答水平确定由修饰的干扰rna引起的免疫应答的减小量。可检测的减小可比在存在未修饰的干扰rna情况下检测到的免疫应答低约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多。通常通过由体外应答细胞引起的细胞因子产生减少(例如,ifnγ、ifnα、tnfα、il-6或il-12)或在施用干扰rna之后哺乳动物受试者的血清中的细胞因子产生减少来测量干扰rna的免疫应答减小。
54.由mrna引起的免疫应答“减小(decrease)”、“减小(decreasing)”、“减少(reduce)”或“减少(reducing)”旨在意指给定干扰mrna(例如,修饰的mrna)的免疫应答的可检测的减小。可相对于存在未修饰的mrna情况下的免疫应答水平确定由修饰的mrna引起的免疫应答的减小量。可检测的减小可比在存在未修饰的mrna情况下检测到的免疫应答低约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多。通常通过由体外应答细胞引起的细胞因子产生减少(例如,ifnγ、ifnα、tnfα、il-6或il-12)或在施用mrna之后哺乳动物受试者的血清中的细胞因子产生减少来测量mrna的免疫应答减小。
55.如本文所使用,术语“应答细胞”是指在与免疫刺激性干扰rna如未修饰的sirna接触时产生可检测的免疫应答的细胞,优选为哺乳动物细胞。示例性的应答细胞包括例如树突细胞、巨噬细胞、外周血单核细胞(pbmc)、脾细胞等。可检测的免疫应答包括例如产生细胞因子或生长因子如tnf-α、ifn-α、ifn-β、ifn-γ、il-1、il-2、il-3、il-4、il-5、il-6、il-10、il-12、il-13、tgf及其组合。
[0056]“基本同一”是指在严格条件下与参比序列杂交或与在参比序列的指定区上具有指定百分比同一性的序列杂交的序列。
[0057]
短语“严格杂交条件”是指在所述条件下,通常在核酸的复杂混合物中,核酸将与其靶序列杂交但不与其他序列杂交的条件。严格条件是序列依赖性的并且在不同的环境中将是不同的。较长的序列在较高温度下特异性地杂交。核酸杂交的详尽指南参见tijssen,techniques in biochemistry and molecular biology—hybridization with nucleic probes,“overview of principles of hybridization and the strategy of nucleic acid assays”(1993)。通常,将严格条件选择为比限定离子强度ph下的特定序列的热熔点(tm)低约5℃-10℃。tm是在所述温度下处于平衡时50%互补于靶标的探针杂交于靶标序列(因为靶标序列过量存在,所以在tm下,在平衡时50%的探针被占据)的温度(在限定的离子强度、ph和核酸浓度下)。严格条件还可通过添加去稳定剂如甲酰胺来实现。针对选择性或特异性杂交,阳性信号为背景的至少两倍,优选地为背景杂交的10倍。
[0058]
示例性严格性杂交条件可如下:50%甲酰胺、5
×
ssc和1%sds,在42℃孵育,或者5
×
ssc、1%sds,在65℃孵育,其中在0.2
×
ssc和0.1%sds中在65℃下洗涤。对应pcr,低严格性扩增的温度通常为约36℃,虽然退火温度可取决于引物长度在约32℃与48℃之间变化。对于高严格性pcr扩增,通常的温度为约62℃,虽然高严格性退火温度可取决于引物长度和特异性在约50℃至约65℃的范围内。通常用于高严格性和低严格性扩增的循环条件包括90
℃-95℃的变性阶段持续30秒-2分钟、持续30秒-2分钟的退火阶段以及约72℃的延伸阶段持续1-2分钟。用于低严格性和高严格性扩增反应的方案和指导提供于例如innis等人,pcr protocols,a guide to methods and applications,academic press,inc.n.y.(1990)中。
[0059]
如果它们编码的多肽基本上相同,则在严格条件下不彼此杂交的核酸仍然是基本上相同的。例如,当使用遗传密码所允许的最大密码子简并性而生成核酸的拷贝时,发生这种情况。在此类情况下,核酸通常在中等严格杂交条件下杂交。示例性“中等严格杂交条件”包括在37℃下、在40%甲酰胺、1m nacl、1%sds的缓冲液中杂交,并且在45℃下在1
×
ssc中洗涤。阳性杂交为背景的至少两倍。本领域技术人员将很容易地认识到,可使用替代的杂交和洗涤条件来提供类似严格性的条件。用于确定杂交参数的另外指导提供于许多参考文献中,例如current protocols in molecular biology,ausubel等编著。
[0060]
在两种或更多种核酸背景下的术语“基本同一(substantially identical)”或“基本同一(substantial identity)”是指当在使用以下序列比较算法之一或通过手动比对和目测检查所测量的比较窗口或指定区上比较并且比对最大对应性时,相同的或具有指定百分比的相同核苷酸(即,在指定区上至少约60%、优选地至少约65%、70%、75%、80%、85%、90%或95%同一性)的两种或更多种序列或子序列。当上下文指明时,这个定义还类似地指序列的互补序列。优选地,基本同一性存在于长度为至少约5、10、15、20、25、30、35、40、45、50、55或60个核苷酸的区上。
[0061]
对于序列比较,通常一个序列充当参考序列,测试序列与所述参考序列进行比较。当使用序列比较算法时,将测试序列和参考序列输入到计算机中,如果需要,指定子序列坐标,并且指定序列算法程序参数。可使用默认程序参数或者可指定替代参数。序列比较算法然后基于程序参数计算测试序列相对于参考序列的序列同一性百分比。
[0062]
如本文所使用的“比较窗口”包括涉及多个连续位置中的任一个区段,所述连续位置选自由约5至约60、通常约10至约45、更通常约15至约30组成的组,其中在两个序列最佳对比之后,可将一个序列与相同数目的连续位置的参比序列比较。比对用于比较的序列的方法是本领域中熟知的。可通过以下方法来进行序列的最佳比对以供比较,例如smith和waterman,adv.appl.math.,2:482(1981)的局部同源性算法;needleman和wunsch,j.mol.biol.,48:443(1970)的同源性比对算法;pearson和lipman,proc.natl.acad.sci.usa,85:2444(1988)的相似性搜索法;这些算法的计算机实施(威斯康辛遗传学软件包(wisconsin genetics software package)中的gap、bestfit、fasta和tfasta,genetics computer group,575science dr.,madison,wis.);或手动比对和目视检查(参见例如,,ausubel等人,编辑(1995增刊))。
[0063]
适合用于确定序列同一性百分比和序列相似性的算法的优选实例是blast和blast 2.0算法,其分贝描述于altschul等人,nuc.acids res.,25:3389-3402(1977)和altschul等人,j.mol.biol.,215:403-410(1990)中。使用具有本文描述的参数的blast和blast2.0来确定核酸的序列同一性百分比。用于执行blast分析的软件可通过国家生物技术信息中心公开获得(http://www.ncbi.nlm.nih.gov/)。
[0064]
blast算法还进行两个序列之间的相似性的统计分析(参见例如karlin和altschul,proc.natl.acad.sci.usa,90:5873-5787(1993))。由blast算法提供的相似性的
一个量度是最小和概率(p(n))法,它提供了两个核苷酸序列之间的匹配偶然发生的概率的指示。例如,如果在测试核酸序列与参考核酸序列的比较中,最小和概率小于约0.2、更优选地小于约0.01并且最优选地小于约0.001,则认为测试核酸序列与参考序列相似。
[0065]
如本文所使用的术语“核酸”是指以单链或双链形式含有至少两个脱氧核糖核苷酸或核糖核苷酸的聚合物并且包括dna和rna。dna可呈以下形式:例如反义分子、质粒dna、预先缩合的dna、pcr产物、载体(p1、pac、bac、yac、人工染色体)、表达盒、嵌合序列、染色体dna或这些组的衍生物和组合。rna可呈以下形式:sirna、不对称干扰rna(airna)、微小rna(mirna)、mrna、trna、rrna、trna、病毒rna(vrna)、自我扩增rna以及它们的组合。核酸包括含有已知核苷酸类似物或修饰的主链残基或键联的核酸,所述核酸是合成的、天然存在的和非天然存在的,并且其具有与参靠核酸类似的结合性质。此类类似物的实例包括,但不限于,硫代磷酸酯、氨基磷酸酯、膦酸甲酯、手性膦酸甲酯、2'-o-甲基核糖核苷酸和肽-核酸(pna)。除非确切地限制,否则术语涵盖具有与参考核酸类似的结合性质的含有天然核苷酸的已知类似物的核酸。除非另外指出,否则特定的核酸序列也隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。具体地说,简并密码子取代可通过产生其中一个或多个选择的(或所有)密码子的第三位置被混合型碱基和/或脱氧肌苷残基取代的序列来实现(batzer等人,nucleic acid res.,19:5081(1991);ohtsuka等人,j.biol.chem.,260:2605-2608(1985);rossolini等人,mol.cell.probes,8:91-98(1994))。“核苷酸”含有糖脱氧核糖(dna)或核糖(rna)、碱基和磷酸酯基团。核苷酸通过磷酸酯基团连接在一起。“碱基”包括嘌呤和嘧啶,所述嘌呤和嘧啶进一步包括天然化合物腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶、尿嘧啶、肌苷和天然类似物;以及嘌呤和嘧啶的合成衍生物,其包括但不限于放置新反应性基团如但不限于胺、醇、硫醇、羧酸酯和烷基卤化物的修饰。
[0066]
术语“基因”是指包含产生多肽或前体多肽所需要的编码部分长度或全长序列的核酸(例如,dna或rna)序列。
[0067]
如本文所使用的“基因产物”是指基因的产物,如rna转录物或多肽。
[0068]
术语“脂质”是指包括但不限于脂肪酸的酯的一组有机化合物,并且特征在于不溶于水但溶于许多有机溶剂。它们通常分成至少三类:(1)“简单脂质”,其包括脂肪和油以及蜡;(2)“复合脂质”,其包括磷脂和糖脂;以及(3)“衍生的脂质”如类固醇。
[0069]
除非另外说明,否则术语“烷基”本身或作为另一个取代基的一部分是指具有指定的碳原子数(即,c
1-8
是指一至六个碳)的直链或支链烃基,其可以是饱和或不饱和的。烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基等。术语“烯基”是指具有一个或多个双键的不饱和烷基。类似地,术语“炔基”是指具有一个或多个三键的不饱和烷基。此类不饱和烷基的实例包括乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-丙炔基和3-丙炔基、3-丁炔基以及高级同系物和异构体。
[0070]
如本文所用,术语脂质纳米颗粒“lnp”是指脂质-核酸颗粒或核酸-脂质颗粒(例如,稳定的核酸-脂质颗粒)。lnp表示由脂质(例如,阳离子脂质、非阳离子脂质和防止颗粒聚集的缀合脂质)和核酸制成的颗粒,其中核酸(例如,sirna、airna、mirna、ssdna、dsdna、ssrna、短发夹rna(shrna)、dsrna、mrna、自我扩增rna或质粒,包括由其转录干扰rna或mrna
的质粒)包封在脂质中。在一个实施方案中,核酸被至少50%包封在脂质中;在一个实施方案中,核酸被至少75%包封在脂质中;在一个实施方案中,核酸被至少90%包封在脂质中;并且在一个实施方案中,核酸被完全包封在脂质中。lnp通常含有阳离子脂质、非阳离子脂质和脂质缀合物(例如,peg-脂质缀合物)。lnp极其有用于系统应用,因为它们可在静脉内(i.v.)注射后表现出延长的循环寿命,它们可在远端部位(例如,与施用部位物理分开的部位)上累积,并且它们可在这些远端部位处介导所转染基因的表达或靶基因表达的沉默。
[0071]
本发明的脂质颗粒(例如,lnp)通常具有约40nm至约150nm、约50nm至约150nm、约60nm至约130nm、约70nm至约110nm或约70至约90nm的平均直径,并且是基本上无毒的。另外,当存在于本发明的脂质颗粒中时,核酸在水溶液中对使用核酸酶的降解具有抗性。核酸-脂质颗粒及其制备方法公开于例如美国专利公布号20040142025和20070042031中,所述专利公布的公开内容出于所有目的以引用的方式整体并入本文。
[0072]
如本文所用,“脂质包封的”可以是指在完全包封、部分包封或两者情况下提供核酸(例如,干扰rna或mrna)的脂质颗粒。在一个实施方案中,核酸被完全包封在脂质颗粒中(例如,以形成lnp或其他核酸-脂质颗粒)。
[0073]
术语“阳离子脂质”是指在选定ph,如生理ph(例如约7.0的ph)下携带净正电荷的许多脂质种类中的任一种。出人意料地发现,包含具有多个不饱和位点,例如至少两个或三个不饱和位点的烷基链的阳离子脂质特别适用于形成具有增加的膜流动性的脂质颗粒。也可用于本发明中的许多阳离子脂质和相关类似物已经在美国专利公布号20060083780和20060240554;美国专利号5,208,036;5,264,618;5,279,833;5,283,185;5,753,613;和5,785,992以及pct公布号wo 96/10390中进行了描述,所述专利的公开内容出于所有目的各自以引用的方式整体并入本文。阳离子脂质的非限制性实例在本文中进行了详细描述。在一些情况下,阳离子脂质包含可质子化的叔胺(例如,ph可滴定的)头基、c18烷基链、所述头基与烷基链之间的醚键联以及0至3个双键。此类脂质包括例如dsdma、dlindma、dlendma和dodma。
[0074]
在本文所述的脂质纳米颗粒中,阳离子脂质可包含例如以下中的一种或多种:1,2-二亚油烯基氧基-n,n-二甲基氨基丙烷(dlindma)、1,2-二亚麻基氧基-n,n-二甲基氨基丙烷(dlendma)、2,2-二亚油烯基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(dlin-k-c2-dma;“xtc2”)、2,2-二亚油烯基-4-(3-二甲基氨基丙基)-[1,3]-二氧戊环(dlin-k-c3-dma)、2,2-二亚油烯基-4-(4-二甲基氨基丁基)-[1,3]-二氧戊环(dlin-k-c4-dma)、2,2-二亚油烯基-5-二甲基氨基甲基-[1,3]-二氧杂环己烷(dlin-k6-dma)、2,2-二亚油烯基-4-n-甲基哌嗪并-[1,3]-二氧戊环(dlin-k-mpz)、2,2-二亚油烯基-4-二甲基氨基甲基-[1,3]-二氧戊环(dlin-k-dma)、1,2-二亚油烯基氨基甲酰基氧基-3-二甲基氨基丙烷(dlin-c-dap)、1,2-二亚油烯基氧基-3-(二甲基氨基)乙酰氧基丙烷(dlin-dac)、1,2-二亚油烯基氧基-3-吗啉代丙烷(dlin-ma)、1,2-二亚油酰基-3-二甲基氨基丙烷(dlindap)、1,2-二亚油烯基硫代-3-二甲基氨基丙烷(dlin-s-dma)、1-亚油酰基-2-亚油烯基氧基-3-二甲基氨基丙烷(dlin-2-dmap)、1,2-二亚油烯基氧基-3-三甲基氨基丙烷氯化物盐(dlin-tma.cl)、1,2-二亚油酰基-3-三甲基氨基丙烷氯化物盐(dlin-tap.cl)、1,2-二亚油烯基氧基-3-(n-甲基哌嗪并)丙烷(dlin-mpz)、3-(n,n-二亚油烯基氨基)-1,2-丙二醇(dlinap)、3-(n,n-二油烯基氨基)-1,2-丙二醇(doap)、1,2-二亚油烯基氧代-3-(2-n,n-二甲基氨基)乙氧基丙烷
(dlin-eg-dma)、n,n-二油烯基-n,n-二甲基氯化铵(dodac)、1,2-二油烯基氧基-n,n-二甲基氨基丙烷(dodma)、1,2-二硬脂酰基氧基-n,n-二甲基氨基丙烷(dsdma)、n-(1-(2,3-二油烯基氧基)丙基)-n,n,n-三甲基氯化铵(dotma)、n,n-二硬脂酰基-n,n-二甲基溴化铵(ddab)、n-(1-(2,3-二油酰基氧基)丙基)-n,n,n-三甲基氯化铵(dotap)、3-(n—(n
′
,n
′‑
二甲基氨基乙烷)-氨基甲酰基)胆固醇(dc-chol)、n-(1,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(dmrie)、2,3-二油烯基氧基-n-[2(精胺-甲酰胺基)乙基]-n,n-二甲基-1-丙烷三氟乙酸铵(dospa)、双十八烷基酰胺基甘氨酰基精胺(dogs)、3-二甲基氨基-2-(胆甾-5-烯-3-β-氧基丁-4-氧基)-1-(顺式,顺式-9,12-十八二烯氧基)丙烷(clindma)、2-[5
′‑
(胆甾-5-烯-3-β-氧基)-3
′‑
氧杂戊氧基)-3-二甲基-1-(顺式,顺式-9
′
,1-2
′‑
十八二烯氧基)丙烷(cplindma)、n,n-二甲基-3,4-二油烯基氧基苄胺(dmoba)、1,2-n,n
′‑
二油烯基氨基甲酰基-3-二甲基氨基丙烷(docarbdap)、1,2-n,n
′‑
二亚油烯基氨基甲酰基-3-二甲基氨基丙烷(dlincarbdap)或它们的混合物。在某些实施方案中,阳离子脂质是dlindma、dlin-k-c2-dma(“xtc2”)或它们的混合物。
[0075]
阳离子脂质如dlin-k-c2-dma(“xtc2”)、dlin-k-c3-dma、dlin-k-c4-dma、dlin-k6-dma和dlin-k-mpz以及额外的阳离子脂质的合成在2008年10月9日提交的美国临时申请号61/104,212中描述,所述申请的公开内容出于所有目的以引用的方式整体并入本文。阳离子脂质如dlin-k-dma、dlin-c-dap、dlin-dac、dlin-ma、dlindap、dlin-s-dma、dlin-2-dmap、dlin-tma.cl、dlin-tap.cl、dlin-mpz、dlinap、doap和dlin-eg-dma以及额外的阳离子脂质的合成在2008年12月31日提交的pct申请号pct/us08/88676中描述,所述申请的公开内容出于所有目的以引用的方式整体并入本文。阳离子脂质如clindma以及额外的阳离子脂质的合成在美国专利公布号20060240554中描述,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0076]
各种阳离子脂质中的任一种可单独或与一种或多种其它阳离子脂质种类或非阳离子脂质种类组合用于本发明的脂质颗粒(例如,lnp)中。
[0077]
可用于本发明中的阳离子脂质可以是在生理ph下带有净正电荷的多种脂质种类中的任一种。此类脂质包括但不限于n,n-二油烯基-n,n-二甲基氯化铵(dodac)、1,2-二油烯基氧基-n,n-二甲基氨基丙烷(dodma)、1,2-二硬脂酰基氧基-n,n-二甲基氨基丙烷(dsdma)、n-(1-(2,3-二油烯基氧基)丙基)-n,n,n-三甲基氯化铵(dotma)、n,n-二硬脂酰基-n,n-二甲基溴化铵(ddab)、n-(1-(2,3-二油酰基氧基)丙基)-n,n,n-三甲基氯化铵(dotap)、3-(n—(n
′
,n
′‑
二甲基氨基乙烷)-氨基甲酰基)胆固醇(dc-chol)、n-(1,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(dmrie)2,3-二油烯基氧基-n-[2(精胺-甲酰胺基)乙基]-n,n-二甲基-1-丙烷三氟乙酸铵(dospa)、双十八烷基酰胺基甘氨酰基精胺(dogs)、3-二甲基氨基-2-(胆甾-5-烯-3-β-氧基丁-4-氧基)-1-(顺式,顺式-9,12-十八二烯氧基)丙烷(clindma)、2-[5
′‑
(胆甾-5-烯-3-β-氧基)-3
′‑
氧杂戊氧基)-3-二甲基-1-(顺式,顺式-9
′
,1-2
′‑
十八二烯氧基)丙烷(cplindma)、n,n-二甲基-3,4-二油烯基氧基苄胺(dmoba)、1,2-n,n
′‑
二油烯基氨基甲酰基-3-二甲基氨基丙烷(docarbdap)、1,2-n,n
′‑
二亚油烯基氨基甲酰基-3-二甲基氨基丙烷(dlincarbdap)、1,2-二亚油烯基氨基甲酰基-3-二甲基氨基丙烷(dlincdap)以及它们的混合物。许多这些脂质和相关类似物已经在美国专利公布号20060083780和20060240554;美国专利号5,208,036;5,264,618;5,279,833;5,
283,185;5,753,613;和5,785,992以及pct公布号wo 96/10390中进行了描述,所述专利的公开内容出于所有目的各自以引用的方式整体并入本文。此外,许多阳离子脂质的商业制剂是可获得的并且可用于本发明中。这些包括例如(可商购的包含dotma和dope的阳离子脂质体,来自gibco/brl,grand island,n.y.,usa);(可商购的包含dospa和dope的阳离子脂质体,来自gibco/brl);以及(可商购的包含dogs的阳离子脂质体,来自promega corp.,madison,wis.,usa)。
[0078]
此外,具有以下结构的式i的阳离子脂质可用于本发明中。
[0079][0080]
其中r1和r2是独立地选择的并且是h或c
1-c3烷基,r3和r4是独立地选择的并且是具有约10至约20个碳原子的烷基,并且r3和r4中的至少一者包含至少两个不饱和位点。在某些情况下,r3和r4两者相同,即r3和r4两者均是亚油基(c
18
)等。在某些其他情况下,r3和r4不同,即r3是十四碳三烯基(c
14
),并且r4是亚油基(c
18
)。在一个实施方案中,式i的阳离子脂质是对称的,即r3和r4两者相同。在另一个实施方案中,r3和r4两者均包含至少两个不饱和位点。在一些实施方案中,r3和r4独立地选自由以下组成的组:十二碳二烯基、十四碳二烯基、十六碳二烯基、亚油基和二十碳二烯基。在一个实施方案中,r3和r4两者均是亚油基。在一些实施方案中,r3和r4包含至少三个不饱和位点并且独立地选自例如十二碳三烯基、十四碳三烯基、十六碳三烯基、亚麻基和二十碳三烯基。在特定实施方案中,式i的阳离子脂质是1,2-二亚油烯基氧基-n,n-二甲基氨基丙烷(dlindma)或1,2-二亚麻基氧基-n,n-二甲基氨基丙烷(dlendma)。
[0081]
此外,具有以下结构的式ii的阳离子脂质可用于本发明中。
[0082][0083]
其中r1和r2是独立地选择的并且是h或c
1-c3烷基,r3和r4是独立地选择的并且是具有约10至约20个碳原子的烷基,并且r3和r4中的至少一者包含至少两个不饱和位点。在某些情况下,r3和r4两者相同,即r3和r4两者均是亚油基(c
18
)等。在某些其他情况下,r3和r4不同,即r3是十四碳三烯基(c
14
),并且r4是亚油基(c
18
)。在一个实施方案中,本发明的阳离子脂质是对称的,即r3和r4两者相同。在另一个实施方案中,r3和r4两者均包含至少两个不饱和位点。在一些实施方案中,r3和r4独立地选自由以下组成的组:十二碳二烯基、十四碳二烯基、十六碳二烯基、亚油基和二十碳二烯基。在一个实施方案中,r3和r4两者均是亚油基。在一些实施方案中,r3和r4包含至少三个不饱和位点并且独立地选自例如十二碳三烯基、十四碳三烯基、十六碳三烯基、亚麻基和二十碳三烯基。
[0084]
此外,具有以下结构的式iii的阳离子脂质(或其盐)可用于本发明中。
[0085][0086]
其中r1和r2是相同的或不同的并且独立地是任选取代的c
12-c
24
烷基、任选取代的c
12-c
24
烯基、任选取代的c
12-c
24
炔基或任选取代的c
12-c
24
酰基;r3和r4是相同的或不同的并且独立地是任选取代的c
1-c6烷基、任选取代的c
1-c6烯基或任选取代的c
1-c6炔基,或者r3和r4可连接以形成具有4至6个碳原子和1或2个选自氮和氧的杂原子的任选取代的杂环;r5不存在或是氢或是c
1-c6烷基以提供季胺;m、n和p是相同的或不同的并且独立地是0或1,条件是m、n和p不同时为0;q是0、1、2、3或4;并且y和z是相同的或不同的并且独立地是o、s或nh。
[0087]
在一些实施方案中,式iii的阳离子脂质是2,2-二亚油烯基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(dlin-k-c2-dma;“xtc2”)、2,2-二亚油烯基-4-(3-二甲基氨基丙基)-[1,3]-二氧戊环(dlin-k-c3-dma)、2,2-二亚油烯基-4-(4-二甲基氨基丁基)-[1,3]-二氧戊环(dlin-k-c4-dma)、2,2-二亚油烯基-5-二甲基氨基甲基-[1,3]-二氧杂环己烷(dlin-k6-dma)、2,2-二亚油烯基-4-n-甲基哌嗪并-[1,3]-二氧戊环(dlin-k-mpz)、2,2-二亚油烯基-4-二甲基氨基甲基-[1,3]-二氧戊环(dlin-k-dma)、1,2-二亚油烯基氨基甲酰基氧基-3-二甲基氨基丙烷(dlin-c-dap)、1,2-二亚油烯基氧基-3-(二甲基氨基)乙酰氧基丙烷(dlin-dac)、1,2-二亚油烯基氧基-3-吗啉代丙烷(dlin-ma)、1,2-二亚油酰基-3-二甲基氨基丙烷(dlindap)、1,2-二亚油烯基硫代-3-二甲基氨基丙烷(dlin-s-dma)、1-亚油酰基-2-亚油烯基氧基-3-二甲基氨基丙烷(dlin-2-dmap)、1,2-二亚油烯基氧基-3-三甲基氨基丙烷氯化物盐(dlin-tma.cl)、1,2-二亚油酰基-3-三甲基氨基丙烷氯化物盐(dlin-tap.cl)、1,2-二亚油烯基氧基-3-(n-甲基哌嗪并)丙烷(dlin-mpz)、3-(n,n-二亚油烯基氨基)-1,2-丙二醇(dlinap)、3-(n,n-二油烯基氨基)-1,2-丙二醇(doap)、1,2-二亚油烯基氧代-3-(2-n,n-二甲基氨基)乙氧基丙烷(dlin-eg-dma)或它们的混合物。在一些实施方案中,式iii的阳离子脂质是dlin-k-c2-dma(xtc2)。
[0088]
所述阳离子脂质通常占存在所述颗粒中的总脂质的约50mol%至约90mol%、约50mol%至约85mol%、约50mol%至约80mol%、约50mol%至约75mol%、约50mol%至约70mol%、约50mol%至约65mol%或约55mol%至约65mol%。
[0089]
对本领域技术人员来说显而易见的是,取决于颗粒的预期用途,组分的比例可变化并且可使用例如内体释放参数(erp)来测量特定制剂的递送效率。
[0090]
在某些实施方案中,术语“阳离子脂质”是指式cl1化合物或其盐:
[0091][0092]
在某些实施方案中,术语“阳离子脂质”是指式cl2化合物或其盐:
[0093][0094]
在某些实施方案中,术语“阳离子脂质”是指式cl3化合物或其盐:
[0095][0096]
用于本发明的脂质颗粒(例如,lnp)中的非阳离子脂质可为能够产生稳定复合体的任何各种中性不带电荷、两性离子或阴离子脂质。
[0097]
非阳离子脂质的非限制性实例包括磷脂如卵磷脂、磷脂酰乙醇胺、溶血卵磷脂、溶血磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、鞘磷脂、卵鞘磷脂(esm)、脑磷脂、心磷脂、磷脂酸、脑苷脂、磷酸二鲸蜡酯、二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰基-磷脂酰胆碱(popc)、棕榈酰油酰基-磷脂酰乙醇胺(pope)、棕榈酰油酰基-磷脂酰甘油(popg)、二油酰磷脂酰乙醇胺4-(n-马来酰亚胺基甲基)-环己烷-1-羧酸酯(dope-mal)、二棕榈酰基-磷脂酰乙醇胺(dppe)、二肉豆蔻酰基-磷脂酰乙醇胺(dmpe)、二硬脂酰基-磷脂酰乙醇胺(dspe)、单甲基-磷脂酰乙醇胺、二甲基-磷脂酰乙醇胺、二反式油酰基-磷脂酰乙醇胺(depe)、硬脂酰油酰基-磷脂酰乙醇胺(sope)、溶血磷脂酰胆碱、二亚油酰基磷脂酰胆碱及其混合物。还可使用其他二酰基磷脂酰胆碱和二酰基磷脂酰乙醇胺磷脂。这些脂质中的酰基通常是衍生自具有c
10-c
24
碳链的脂肪酸的酰基,例如月桂酰基、肉豆蔻酰基、棕榈酰基、硬脂酰基或油酰基。
[0098]
非阳离子脂质的另外实例包括固醇,如胆固醇及其衍生物,如胆固醇、胆甾烷酮、胆甾烯酮、粪固醇、胆固醇基-2'-羟乙基醚、胆固醇基-4'-羟丁基醚以及它们的混合物。
[0099]
在一些实施方案中,存在于脂质颗粒(例如,lnp)中的非阳离子脂质包含胆固醇或其衍生物或由其组成,例如不含磷脂的脂质颗粒制剂。在其他实施方案中,存在于脂质颗粒(例如,lnp)中的非阳离子脂质包含一种或多种磷脂或由其组成,例如不含胆固醇的脂质颗粒制剂。在其他实施方案中,存在于脂质颗粒(例如,lnp)中的非阳离子脂质包含一种或多种磷脂和胆固醇或其衍生物的混合物或由其组成。
[0100]
适合用于本发明的非阳离子脂质的其他实例包括不含磷的脂质例如像硬脂胺、十二烷基胺、十六烷基胺、乙酰基棕榈酸酯、甘油蓖麻醇酸酯(glycerolricinoleate)、硬脂酸十六烷基酯、肉豆蔻酸异丙酯、两性丙烯酸聚合物、十二烷基硫酸三乙醇胺、烷基-芳基硫酸酯聚乙氧基化脂肪酸酰胺、双十八烷基二甲基溴化铵、神经酰胺、鞘磷脂等。
[0101]
术语“疏水性脂质”是指具有非极性基团的化合物,所述非极性基团包括但不限于长链饱和和不饱和的脂肪族烃基和任选地被一个或多个芳香族、脂环族或杂环基团取代的此类基团。适合的实例包括但不限于二酰基甘油、二烷基甘油、n-n-二烷基氨基、1,2-二酰氧基-3-氨基丙烷以及1,2-二烷基-3-氨基丙烷。
[0102]
术语“融合”是指脂质颗粒如lnp与细胞的膜融合的能力。膜可为质膜或包围细胞器例如核内体、细胞核等的膜。
[0103]
如本文所使用,术语“水溶液”是指全部或部分包含水的组合物。
[0104]
如本文所使用,术语“有机脂质溶液”是指全部或部分包含具有脂质的有机溶剂的组合物。
[0105]
如本文所使用的“远端部位”是指物理分开的部位,其不限于相邻毛细血管床,但包括广泛分布在整个生物体中的部位。
[0106]
与脂质颗粒如lnp相关的“血清稳定的”意指颗粒在暴露于将显著降解游离dna或rna的血清或核酸酶测定之后不会显著降解。适合的测定包括例如标准血清测定、dna酶测定或rna酶测定。
[0107]
如本文所用的“系统递送”是指引起核酸(如干扰rna或mrna)广泛生物分布在生物体内的脂质颗粒的递送。施用的一些技术可引起某些剂的系统递送,但不会引起其他剂的系统递送。系统递送意指将有用量,优选地治疗量的剂暴露于身体的大多数部分。为了获得广泛生物分布,通常需要血液寿命,使得剂在到达远离施用部位的疾病部位之前不会被快速降解或清除(如通过首过器官(肝脏、肺等)或通过快速非特异性细胞结合)。脂质颗粒的系统递送可通过本领域中已知的任何方式实现,包括例如静脉内、皮下和腹膜内。在优选的实施方案中,脂质颗粒的系统递送通过静脉内递送实现。
[0108]
如本文所用的“局部递送”是指直接向生物体内的靶部位递送核酸,如干扰rna或mrna。例如,可通过直接注射到疾病部位如肿瘤或其他靶部位如炎症的部位或靶器官如肝脏、心脏、胰腺、肾脏等中来局部递送剂。
[0109]
术语“哺乳动物”是指任何哺乳动物种类,如人、小鼠、大鼠、犬、猫、仓鼠、豚鼠、兔、家畜等。
[0110]
术语“癌症”是指特征在于异常细胞不受控制生长的一类疾病的任何成员。术语包括所有已知的癌症和肿瘤性病状,无论表征为恶性的、良性的、软组织或实体以及所有阶段和等级的癌症,包括转移前癌症和转移后癌症。不同类型的癌症的实例包括但不限于肺癌、结肠癌、直肠癌、肛门癌、胆管癌、小肠癌、胃(胃部)癌、食道癌;胆囊癌、肝癌、胰腺癌、阑尾癌、乳腺癌、卵巢癌;宫颈癌、前列腺癌、肾癌(例如,肾细胞癌)、中枢神经系统的癌症、成胶质细胞瘤、皮肤癌、淋巴瘤、绒毛膜癌、头颈癌、骨原性肉瘤以及血癌。具体类型的肝癌的非限制性实例包括肝细胞癌(hcc)、继发性肝癌(例如,由一些其他非肝癌细胞类型的转移引起)以及肝母细胞瘤。如本文所使用,“肿瘤”包含一个或多个癌细胞。
[0111]
实施方案的描述
[0112]
在某些实施方案中,本文提供了脂质纳米颗粒,所述脂质纳米颗粒包含:
[0113]
(a)核酸;
[0114]
(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
[0115]
(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
[0116]
(d)以所述颗粒中的总脂质的约2至约5mol%的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
[0117]
其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,
[0118]
其中所述peg-脂质缀合物的peg部分具有约500至约1,000道尔顿的平均分子量,
[0119]
条件是当所述脂质锚定部分是二烷基部分时,两个烷基链中的至少一个小于c
14
。
[0120]
在某些实施方案中,脂质锚定部分是单个c
10-c
24
烷基链(例如,c
10
、c
11
、c
12
、c
13
、c
14
、c
15
、c
16
、c
17
、c
18
、c
19
、c
20
、c
21
、c
22
、c
23
或c
24
)。
[0121]
在某些实施方案中,脂质锚定部分是单个c
10
、c
12
、c
14
、c
16
或c
18
链。
[0122]
在某些实施方案中,脂质锚定部分是单个c
18
链。
[0123]
在某些实施方案中,脂质锚定部分是单个c
16-c
24
链。
[0124]
在某些实施方案中,脂质锚定部分是单个c
18-c
22
链。
[0125]
在某些实施方案中,脂质锚定部分是或包含固醇或固醇衍生物。
[0126]
在某些实施方案中,脂质锚定部分是或包含胆固醇或胆固醇衍生物。
[0127]
在某些实施方案中,脂质锚定部分是或包含多环结构。
[0128]
在某些实施方案中,脂质锚定部分是二烷基部分。
[0129]
在某些实施方案中,脂质锚定部分是对称二烷基部分。
[0130]
在某些实施方案中,脂质锚定部分是不对称二烷基部分。
[0131]
在某些实施方案中,脂质锚定部分是具有c
10
和c
14
烷基链的不对称二烷基部分。
[0132]
在某些实施方案中,脂质锚定部分是具有两个c8烷基链的二烷基部分。
[0133]
在某些实施方案中,脂质锚定部分是具有两个c
10
烷基链的二烷基部分。
[0134]
在某些实施方案中,脂质锚定部分是具有两个c
12
烷基链的二烷基部分。
[0135]
在某些实施方案中,脂质锚定部分是三烷基部分。
[0136]
在某些实施方案中,脂质锚定部分是具有三个c
10
或更小的烷基链的三烷基部分。
[0137]
在某些实施方案中,脂质锚定部分是对称三烷基部分。
[0138]
在某些实施方案中,脂质锚定部分是不对称三烷基部分。
[0139]
在某些实施方案中,脂质锚定部分是四烷基部分。
[0140]
在某些实施方案中,脂质锚定部分是具有三个c8或更小的烷基链的四烷基部分。
[0141]
在某些实施方案中,脂质锚定部分是对称四烷基部分。
[0142]
在某些实施方案中,脂质锚定部分是不对称四烷基部分。
[0143]
在某些实施方案中,所述peg-脂质缀合物的peg部分具有约750道尔顿的平均分子量。
[0144]
在某些实施方案中,抑制脂质纳米颗粒的聚集的聚乙二醇(peg)-脂质缀合物以所述颗粒中的总脂质的约2mol%的量存在。
[0145]
在某些实施方案中,抑制脂质纳米颗粒的聚集的聚乙二醇(peg)-脂质缀合物以所述颗粒中的总脂质的约3mol%的量存在。
[0146]
在某些实施方案中,抑制脂质纳米颗粒的聚集的聚乙二醇(peg)-脂质缀合物以所述颗粒中的总脂质的约4mol%的量存在。
[0147]
在某些实施方案中,抑制脂质纳米颗粒的聚集的聚乙二醇(peg)-脂质缀合物以所述颗粒中的总脂质的约5mol%的量存在。
[0148]
在某些实施方案中,本文提供了脂质纳米颗粒,所述脂质纳米颗粒包含:
[0149]
(a)核酸;
[0150]
(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
[0151]
(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
[0152]
(d)以所述颗粒中的总脂质的约0.2至约0.5mol%的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
[0153]
其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,
[0154]
其中所述peg-脂质缀合物的peg部分具有约5,000至约20,000道尔顿的平均分子量。
[0155]
在某些实施方案中,脂质锚定部分是单个烷基链。
[0156]
在某些实施方案中,脂质锚定部分是或包含固醇或固醇衍生物。
[0157]
在某些实施方案中,脂质锚定部分是或包含胆固醇或胆固醇衍生物。
[0158]
在某些实施方案中,脂质锚定部分是或包含多环结构。
[0159]
在某些实施方案中,脂质锚定部分是二烷基部分。
[0160]
在某些实施方案中,脂质锚定部分是对称二烷基部分。
[0161]
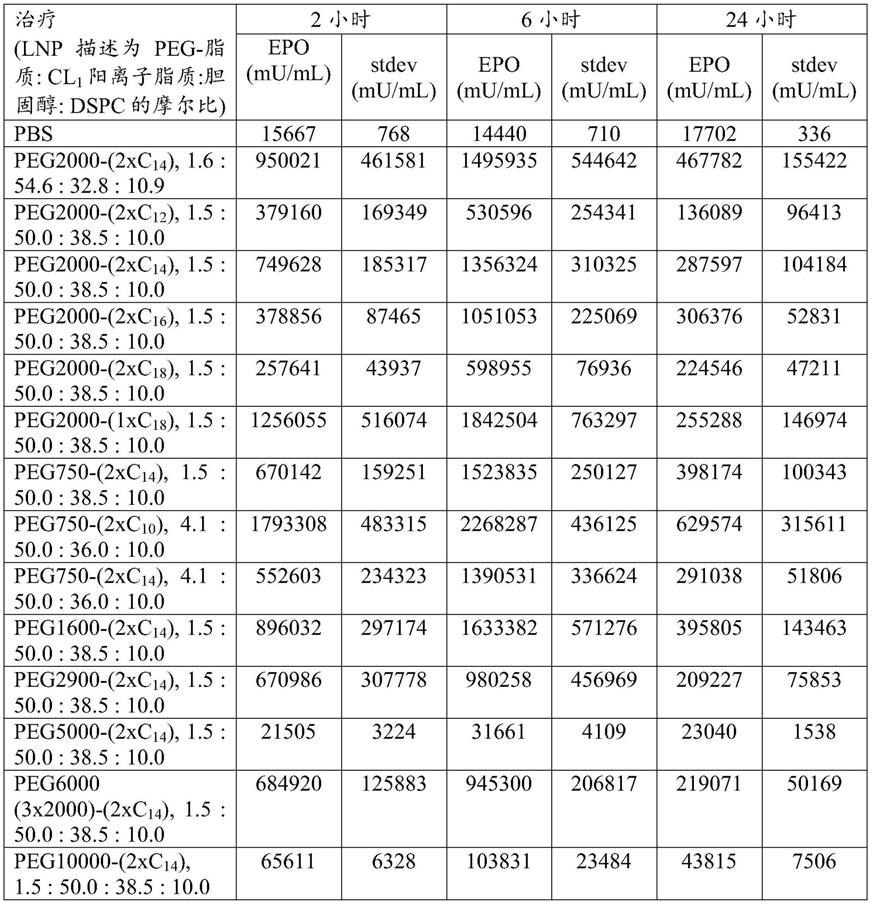
在某些实施方案中,脂质锚定部分是不对称二烷基部分。
[0162]
在某些实施方案中,脂质锚定部分是具有长于c
14
的烷基链的二烷基部分。
[0163]
在某些实施方案中,脂质锚定部分是具有c
14-c
22
烷基链(例如,c
14
、c
15
、c
16
、c
17
、c
18
、c
19
、c
20
、c
21
或c
22
)的二烷基部分。
[0164]
在某些实施方案中,脂质锚定部分是具有两个c
14
烷基链的二烷基部分。
[0165]
在某些实施方案中,脂质锚定部分是具有两个c
16
烷基链的二烷基部分。
[0166]
在某些实施方案中,脂质锚定部分是具有两个c
18
烷基链的二烷基部分。
[0167]
在某些实施方案中,脂质锚定部分是三烷基部分。
[0168]
在某些实施方案中,脂质锚定部分是具有三个c8或更大的烷基链的三烷基部分。
[0169]
在某些实施方案中,脂质锚定部分是对称三烷基部分。
[0170]
在某些实施方案中,脂质锚定部分是不对称三烷基部分。
[0171]
在某些实施方案中,脂质锚定部分是四烷基部分。
[0172]
在某些实施方案中,脂质锚定部分是具有三个c6或更大的烷基链的四烷基部分。
[0173]
在某些实施方案中,脂质锚定部分是对称四烷基部分。
[0174]
在某些实施方案中,脂质锚定部分是不对称四烷基部分。
[0175]
在某些实施方案中,所述peg-脂质缀合物的peg部分具有约5,000至约10,000道尔顿的平均分子量。
[0176]
在某些实施方案中,所述peg-脂质缀合物的peg部分具有约8,000至约10,000道尔顿的平均分子量。
[0177]
在某些实施方案中,所述peg-脂质缀合物的peg部分具有约5,000道尔顿的平均分子量。
[0178]
在某些实施方案中,所述peg-脂质缀合物的peg部分具有约10,000道尔顿的平均分子量。
[0179]
在某些实施方案中,核酸的长度是至少80个碱基。
[0180]
在某些实施方案中,核酸的长度是至少100个碱基。
[0181]
在某些实施方案中,核酸的长度是至少500个碱基。
[0182]
在某些实施方案中,核酸是dna、质粒dna、微环dna、cedna(封闭端dna)、mrna、自我复制rna、crispr rna、基因编辑构建体、rna编辑构建体或碱基编辑构建体。
[0183]
在某些实施方案中,核酸是mrna。
[0184]
在某些实施方案中,核酸是sirna。
[0185]
在某些实施方案中,核酸不是sirna。
[0186]
在某些实施方案中,“阳离子脂质”是指式cl1化合物或其盐:
[0187][0188]
在某些实施方案中,“阳离子脂质”是指式cl2化合物或其盐:
[0189][0190]
在某些实施方案中,“阳离子脂质”是指式cl3化合物或其盐:
[0191][0192]
在某些实施方案中,磷脂是dspc。
[0193]
在某些实施方案中,脂质锚定部分包含至少一个饱和烷基链。
[0194]
在某些实施方案中,脂质锚定部分包含至少一个不饱和烷基链。
[0195]
在某些实施方案中,脂质锚定部分包含具有至少一个双键的至少一个烷基链。
[0196]
某些实施方案提供了一种用于降低向人施用脂质纳米颗粒(lnp)的免疫应答的方法,所述方法包括选择用于lnp中的聚乙二醇(peg)-脂质缀合物,其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单个烷基链,其中所述lnp包含mrna有效负载。
[0197]
在某些实施方案中,脂质锚定部分是单个c
10-c
24
烷基链(例如,c
10
、c
11
、c
12
、c
13
、c
14
、c
15
、c
16
、c
17
、c
18
、c
19
、c
20
、c
21
、c
22
、c
23
或c
24
)。
[0198]
在某些实施方案中,脂质锚定部分是单个c
10
、c
12
、c
14
、c
16
、c
18 c
20
、c
22
或c
24
链。
[0199]
在某些实施方案中,脂质锚定部分是单个c
18
链。
[0200]
在某些实施方案中,所述方法还包括通过所述lnp的初始施用和所述lnp的至少一次后续施用来治疗有需要的人。
[0201]
某些实施方案提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
[0202]
(a)核酸,其中所述核酸是mrna;
[0203]
(b)阳离子脂质;
[0204]
(c)非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
[0205]
(d)聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
[0206]
其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单链c
18
烷基部分。
[0207]
某些实施方案提供了一种脂质纳米颗粒,所述脂质纳米颗粒包含:
[0208]
(a)核酸,其中所述核酸是mrna;
[0209]
(b)以所述颗粒中存在的总脂质的约30至约70mol%的量的阳离子脂质;
[0210]
(c)以所述颗粒中存在的总脂质的约30至约70mol%的量的非阳离子脂质,其中所述非阳离子脂质包含磷脂和胆固醇或其衍生物的混合物;以及
[0211]
(d)以所述颗粒中的总脂质的约1至约2.5mol%(例如,约1.6mol%)的量的聚乙二醇(peg)-脂质缀合物,所述聚乙二醇(peg)-脂质缀合物抑制脂质纳米颗粒的聚集,
[0212]
其中所述peg-脂质缀合物包含与脂质锚定部分连接的peg部分,其中所述脂质锚定部分是单链c
14-c
22
(例如,c
14
、c
15
、c
16
、c
17
、c
18
、c
19
、c
20
、c
21
或c
22
,例如,c
14
、c
16
、c
18
、c
20
或c
22
)烷基部分,
[0213]
其中所述peg-脂质缀合物的peg部分具有约500至约3,000道尔顿(例如,约2000道尔顿)的平均分子量。
[0214]
某些实施方案提供了一种药物组合物,所述药物组合物包含如本文所述的脂质纳米颗粒和药学上可接受的载体。
[0215]
在某些实施方案中,所述药物组合物被配制用于静脉内施用。
[0216]
某些实施方案提供了一种用于将核酸递送至细胞的方法,所述方法包括使所述细胞与如本文所述的脂质纳米颗粒接触。
[0217]
某些实施方案提供了一种用于治疗以导致功能性蛋白质缺乏的遗传缺陷为特征的疾病的方法,所述方法包括:向患有所述疾病的受试者施用如本文所述的脂质纳米颗粒,其中所述脂质纳米颗粒包含mrna,所述mrna编码所述功能性蛋白质或与所述功能性蛋白质具有相同生物活性的蛋白质。
[0218]
某些实施方案提供了一种用于治疗以多肽的过表达为特征的疾病的方法,所述方法包括向患有所述疾病的受试者施用如本文所述的脂质纳米颗粒,其中所述脂质纳米颗粒包含sirna,所述sirna靶向所述过表达多肽的表达。
[0219]
某些实施方案提供了如本文所述的脂质纳米颗粒,所述脂质纳米颗粒用于以导致功能性蛋白质缺乏的遗传缺陷为特征的疾病的治疗性或预防性治疗。
[0220]
某些实施方案提供了如本文所述的脂质纳米颗粒,所述脂质纳米颗粒用于以多肽的过表达为特征的疾病的治疗性或预防性治疗。
[0221]
在某些实施方案中,核酸被完全包封在脂质颗粒的脂质部分内,使得所述脂质颗粒中的核酸在水溶液中对例如由核酸酶或蛋白酶引起的酶促降解具有抗性。在某些其他实施方案中,脂质颗粒对哺乳动物如人基本无毒。
[0222]
在某些实例中,核酸包含干扰rna分子,例如像sirna、airna、mirna或它们的混合物。在某些其它实例中,核酸包含单链或双链dna、rna或dna/rna杂交体,例如像反义寡核苷酸、核酶、质粒、免疫刺激性寡核苷酸或它们的混合物。在某些其他情况下,核酸包含一个或多个mrna分子(例如,混合物)。
[0223]
在一个实施方案中,核酸包含sirna。在一个实施方案中,sirna分子包含长度为约15至约60个核苷酸(例如,长度为约15-60个、15-50个、15-40个、15-30个、15-25个或19-25个核苷酸,或长度为15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个核苷酸)的双链区。本发明的sirna分子能够在体外和/或在体内使靶序列的表达沉默。
[0224]
在一些实施方案中,sirna分子包含至少一个修饰的核苷酸。在某些优选的实施方案中,sirna分子在双链区中包含一个、两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个修饰的核苷酸。在某些实例中,sirna在双链区中包含约1%至约100%(例如,约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%)修饰的核苷酸。在优选的实施方案中,双链区中少于约25%(例如,少于约25%、20%、15%、10%或5%)或约1%至约25%(例如,约1%-25%、5%-25%、10%-25%、15%-25%、20%-25%或10%-20%的核苷酸包含修饰的核苷酸。
[0225]
在其他实施方案中,sirna分子包含修饰的核苷酸,包括但不限于2
’‑
o-甲基(2’ome)核苷酸、2
’‑
脱氧-2
’‑
氟(2’f)核苷酸、2
’‑
脱氧核苷酸、2
’‑
o-(2-甲氧基乙基)(moe)核苷酸、锁核酸(lna)核苷酸以及它们的混合物。在优选的实施方案中,sirna包含2’ome核苷酸(例如,2’ome嘌呤和/或嘧啶核苷酸),例如像2’ome-鸟苷核苷酸、2’ome-尿苷核苷酸、2’ome-腺苷核苷酸、2’ome-胞嘧啶核苷酸以及它们的混合物。在某些实例中,sirna不包含2’ome-胞嘧啶核苷酸。在其他实施方案中,sirna包含发夹环结构。
[0226]
sirna可在sirna分子的双链区的一条链(即,有义或反义的)或两条链中包含修饰的核苷酸。优选地,在sirna双链体的双链区中的选择性位置修饰尿苷和/或鸟苷核苷酸。关于尿苷核苷酸修饰,有义和/或反义链中的至少一个、两个、三个、四个、五个、六个或更多个尿苷核苷酸可以是修饰的尿苷核苷酸,如2’ome-尿苷核苷酸。在一些实施方案中,有义和/或反义链中的每个尿苷核苷酸均是2’ome-尿苷核苷酸。关于鸟苷核苷酸修饰,有义和/或反义链中的至少一个、两个、三个、四个、五个、六个或更多个鸟苷核苷酸可以是修饰的鸟苷核苷酸,如2’ome-鸟苷核苷酸。在一些实施方案中,有义和/或反义链中的每个鸟苷核苷酸均是2’ome-鸟苷核苷酸。
[0227]
在某些实施方案中,sirna序列中的至少一个、两个、三个、四个、五个、六个、七个或更多个5
’‑
gu-3’基序可例如通过引入错配以消除5
’‑
gu-3’基序和/或通过引入修饰的核苷酸如2’ome核苷酸来加以修饰。5
’‑
gu-3’基序可处于sirna序列的有义链、反义链或这两条链中。5
’‑
gu-3’基序可彼此相邻或可替代地,它们可被1、2、3、4、5、6、7、8、9、10、11、12或更多个核苷酸分开。
[0228]
在一些优选的实施方案中,修饰的sirna分子的免疫刺激性比相应的未修饰的sirna序列的免疫刺激性小。在此类实施方案中,具有减小的免疫刺激性质的修饰的sirna分子有利地保留对抗靶序列的rnai活性。在另一个实施方案中,修饰的sirna分子的免疫刺激性质和其使靶基因表达沉默的能力可通过在sirna序列内,例如像在sirna双链体的双链区内引入最小的且选择性的2’ome修饰来加以平衡或优化。在某些实例中,修饰的sirna的免疫刺激性比相应的未修饰的sirna的免疫刺激性小至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。本领域技术人员将很容易看出,修饰的sirna分子和相应的未修饰的sirna分子的免疫刺激性质可通过例如在哺乳动物体内系统
施用或使用适当的基于脂质的递送系统(如本文公开的lnp递送系统)转染哺乳动物应答细胞之后约两小时至约十二小时测量inf-α和/或il-6水平来确定。
[0229]
在某些实施方案中,修饰的sirna分子具有小于或等于相应的未修饰的sirna十倍的ic
50
(即,半数最大抑制浓度)(即,修饰的sirna具有小于或等于相应的未修饰的sirna的ic
50
十倍的ic
50
)。在其它实施方案中,修饰的sirna具有小于或等于相应的未修饰的sirna序列三倍的ic
50
。在其它实施方案中,修饰的sirna具有小于或等于相应的未修饰的sirna两倍的ic
50
。本领域技术人员将很容易看出,可产生剂量-反应曲线并且修饰的sirna和相应的未修饰的sirna的ic
50
值可使用本领域技术人员已知的方法容易地确定。
[0230]
在另一个实施方案中,相对于相应的未修饰的sirna序列,修饰的sirna分子能够使至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的靶序列的表达沉默。
[0231]
在一些实施方案中,sirna分子例如在双链区的有义和/或反义链中不包含磷酸主链修饰。在其他实施方案中,sirna例如在双链区的有义和/或反义链中包含一个、两个、三个、四个或更多个磷酸主链修饰。在优选的实施方案中,sirna不包含磷酸主链修饰。
[0232]
在另外的实施方案中,sirna例如在双链区的有义和/或反义链中不包含2
’‑
脱氧核苷酸。在另外的实施方案中,sirna例如在双链区的有义和/或反义链中包含一个、两个、三个、四个或更多个2
’‑
脱氧核苷酸。在优选的实施方案中,sirna不包含2
’‑
脱氧核苷酸。
[0233]
在某些实例中,在有义和/或反义链中的双链区的3
’‑
末端上的核苷酸不是修饰的核苷酸。在某些其他实例中,接近有义和/或反义链中的双链区的3
’‑
末端(例如,在3
’‑
末端的一个、两个、三个或四个核苷酸内)的核苷酸不是修饰的核苷酸。
[0234]
本文描述的sirna分子可在双链区的一侧或两侧上具有一个、两个、三个、四个或更多个核苷酸的3’突出端,或可在双链区的一侧或两侧上缺乏突出端(即,具有平末端)。优选地,sirna在双链区的每一侧具有两个核苷酸的3'突出端。在某些实例中,反义链上的3'突出端与靶序列具有互补性,并且有义链上的3'突出端与靶序列的互补链具有互补性。可替代地,3'突出端与靶序列或其互补链不具有互补性。在一些实施方案中,3'突出端包含一个、两个、三个、四个或更多个核苷酸,如2'-脱氧(2'h)核苷酸。在某些优选的实施方案中,3'突出端包含脱氧胸苷(dt)和/或尿苷核苷酸。在其他实施方案中,双链区的一侧或两侧上的3'突出端中的一个或多个核苷酸包含修饰的核苷酸。修饰的核苷酸的非限制性实例在上文描述,并且包括2'ome核苷酸、2'-脱氧-2'f核苷酸、2'-脱氧核苷酸、2'-o-2-moe核苷酸、lna核苷酸以及它们的混合物。在优选的实施方案中,存在于sirna的有义和/或反义链上的3'突出端中的一个、两个、三个、四个或更多个核苷酸包含2'ome核苷酸(例如,2'ome嘌呤和/或嘧啶核苷酸),例如像2'ome-鸟苷核苷酸、2'ome-尿苷核苷酸、2'ome-腺苷核苷酸、2'ome-胞嘧啶核苷酸以及它们的混合物。
[0235]
sirna可包含使靶基因表达沉默的未修饰的和/或修饰的sirna序列中的至少一个或混合物(例如,至少两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个)。sirna的混合物可包含针对相同区或结构域(例如“热点”)和/或针对一种或多种靶基因的不同区或结构域的序列。在某些实例中,在混合物中存在使靶基因表达沉默的一个或多个(例如,至少两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个)修饰的sirna。在某些其他实例中,在混合物中存在使靶基因表达沉默的一个或多个(例如,至少两个、三个、四个、
五个、六个、七个、八个、九个、十个或更多个)未修饰的sirna序列。
[0236]
在一些实施方案中,sirna分子的反义链包含与靶序列或其一部分至少约80%、85%、90%、95%、96%、97%、98%或99%互补的序列或由组成。在其他实施方案中,sirna分子的反义链包含与靶序列或其一部分100%互补的序列或由其组成。在其他实施方案中,sirna分子的反义链包含与靶序列或其一部分特异性地杂交的序列或由其组成。
[0237]
在其他实施方案中,sirna分子的有义链包含与靶序列或其一部分至少约80%、85%、90%、95%、96%、97%、98%或99%同一的序列或由其组成。在另外的实施方案中,sirna分子的有义链包含与靶序列或其一部分100%同一的序列或由其组成。
[0238]
胆固醇衍生物的实例包括但不限于胆固醇、胆甾烷酮、胆甾烯酮、粪固醇、胆固醇基-2'-羟乙基醚、胆固醇基-4'-羟丁基醚以及它们的混合物。本文描述了胆固醇基-2'-羟乙基醚的合成。
[0239]
如本文所用,dspc意指二硬脂酰磷脂酰胆碱。
[0240]
在本发明的脂质颗粒中,核酸可完全包封在所述颗粒的脂质部分内,从而保护核酸不受酶促降解。在优选的实施方案中,包含核酸如干扰rna(例如sirna)或mrna的lnp被完全包封在颗粒的脂质部分内,从而保护核酸不受核酸酶降解。在某些实例中,在37℃下将颗粒暴露于核酸酶至少约20、30、45或60分钟之后lnp中的核酸基本上不降解。在某些其他实例中,在37℃下将颗粒在血清中孵育至少约30、45或60分钟或至少约2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30、32、34或36小时之后lnp中的核酸基本上不降解。在其他实施方案中,核酸(例如核酸,如sirna或mrna)与颗粒的脂质部分复合。本发明的制剂的益处之一为脂质颗粒组合物对哺乳动物如人基本无毒。
[0241]
术语“完全包封”表示脂质颗粒中的核酸在暴露于血清或将显著降解游离dna、rna或蛋白质的核酸酶或蛋白酶测定后没有显著降解。在完全包封的系统中,在将通常降解100%的游离核酸的处理中降解优选小于约25%的颗粒中的核酸,更优选小于约10%并且最优选小于约5%的颗粒中的核酸被降解。在核酸治疗剂的背景下,完全包封可通过测定来确定。是用于定量溶液中的寡核苷酸和单链dna或rna的超灵敏荧光核酸染色剂(可从invitrogen corporation;carlsbad,calif.获得)。“完全包封的”还指示脂质颗粒为血清稳定的,也就是说当体内施用时它们不会快速分解为其组分部分。
[0242]
在另一个方面,本发明提供了包含多脂质颗粒的脂质颗粒(例如,lnp)组合物。在优选的实施方案中,核酸(例如,核酸)完全包封在脂质颗粒(例如lnp)的脂质部分内,使得约30%至约100%、约40%至约100%、约50%至约100%、约60%至约100%、约70%至约100%、约80%至约100%、约90%至约100%、约30%至约95%、约40%至约95%、约50%至约95%、约60%至约95%、约70%至约95%、约80%至约95%、约85%至约95%、约90%至约95%、约30%至约90%、约40%至约90%、约50%至约90%、约60%至约90%、约70%至约90%、约80%至约90%或至少约30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%(或其任何分数或其中的范围)的脂质颗粒(例如lnp)在其中包封核酸。
[0243]
通常,本发明的脂质颗粒(例如,lnp)具有约1至约100的脂质:活性剂(例如,脂质:核酸)比率(质量/质量比率)。在一些实例中,脂质:活性剂(例如,脂质:核酸)比率(质量/质
量比率)在约1至约50、约2至约25、约3至约20、约4至约15或约5至约10的范围内。
[0244]
通常,本发明的脂质颗粒(例如,lnp)具有约40nm至约150nm的平均直径。在优选的实施方案中,本发明的脂质颗粒(例如,lnp)具有约40nm至约130nm、约40nm至约120nm、约40nm至约100nm、约50nm至约120nm、约50nm至约100nm、约60nm至约120nm、约60nm至约110nm、约60nm至约100nm、约60nm至约90nm、约60nm至约80nm、约70nm至约120nm、约70nm至约110nm、约70nm至约100nm、约70nm至约90nm、约70nm至约80nm或小于约120nm、110nm、100nm、90nm或80nm(或其任何分数或其中的范围)的平均直径。
[0245]
本发明还提供了一种药物组合物,所述药物组合物包含本文所述的脂质颗粒(例如,lnp)和药学上可接受的载体。
[0246]
在另一方面,本发明提供了一种用于将一种或多种活性剂或治疗剂(例如核酸)引入细胞中的方法,所述方法包括使所述细胞与本文所述的脂质颗粒(例如,lnp)接触。在一个实施方案中,细胞处于哺乳动物中并且哺乳动物为人。在另一个实施方案中,本发明提供了一种用于体内递送一种或多种活性剂或治疗剂(例如核酸)的方法,所述方法包括向哺乳动物受试者施用本文所述的脂质颗粒(例如,lnp)。在优选的实施方案中,施用方式包括但不限于口服、鼻内、静脉内、腹膜内、肌肉内、关节内、病变内、气管内、皮下和皮内。优选地,哺乳动物受试者是人。
[0247]
在一个实施方案中,在注射后约8、12、24、36或48小时,至少约5%、10%、15%、20%或25%的脂质颗粒(例如,lnp)的总注射剂量存在于血浆中。在其它实施方案中,在注射之后约8、12、24、36或48小时,多于约20%、30%、40%以及多达约60%、70%或80%的脂质颗粒(例如,lnp)的总注射剂量存在于血浆中。在某些实例中,在施用后约1小时,多于约10%的多个颗粒存在于哺乳动物的血浆中。在某些其他实例中,在施用颗粒后至少约1小时可检测到脂质颗粒(例如,lnp)的存在。在某些实施方案中,在施用后(例如,肺、肝脏、肿瘤或炎症部位)约8、12、24、36、48、60、72或96小时的细胞中可检测到核酸,如干扰rna(例如sirna)或mrna的存在。在其他实施方案中,在施用后约8、12、24、36、48、60、72或96小时可检测到核酸,如干扰rna(例如,sirna)对靶序列表达的下调。在其他实施方案中,核酸如干扰rna(例如,sirna)对靶序列表达的下调优先在肿瘤细胞或炎症部位的细胞中发生。在其他实施方案中,在施用后约12、24、48、72或96小时或约6、8、10、12、14、16、18、19、20、22、24、26或28天可检测到施用部位近端或远端部位处的细胞中或肺、肝脏或肿瘤细胞中的核酸如干扰rna(例如,sirna)的存在或作用。在其他实施方案中,在施用后约8、12、24、36、48、60、72或96小时可检测到核酸,如mrna或自我扩增rna对靶序列表达的上调。在其他实施方案中,核酸如mrna或自我扩增rna对靶序列表达的上调优先在肿瘤细胞或炎症部位的细胞中发生。在其他实施方案中,在施用后约12、24、48、72或96小时或约6、8、10、12、14、16、18、19、20、22、24、26或28天可检测到施用部位近端或远端部位处的细胞中或肺、肝脏或肿瘤细胞中的核酸如mrna或自我扩增rna的存在或作用。在另外的实施方案中,本发明的脂质颗粒(例如,lnp)胃肠外或腹膜内施用。在实施方案中,本发明的脂质颗粒(例如,lnp)肌内施用。
[0248]
在一些实施方案中,本发明的脂质颗粒(例如,lnp)在用于治疗性递送包含干扰rna序列(例如,sirna)的一种或多种核酸的方法中有用。具体地说,本发明的一个目的为提供用于通过下调或沉默一个或多个目标靶核酸序列或基因的转录和/或翻译来治疗哺乳动物(例如,啮齿动物如小鼠或灵长类动物如人、黑猩猩或猴)体内的疾病或病症的体外和体
内方法。作为一个非限制性实例,本发明的方法有用于将干扰rna(例如,sirna)体内递送至哺乳动物受试者的肝脏和/或肿瘤。在某些实施方案中,疾病或病症与基因的表达和/或过表达相关,并且基因的表达或过表达通过干扰rna(例如,sirna)减少。在某些其他实施方案中,可向哺乳动物施用治疗有效量的脂质颗粒(例如,lnp)。在一些实例中,将干扰rna(例如,sirna)配制成lnp,并且将所述颗粒施用于需要这种治疗的患者。在其他实例中,从患者中去除细胞,体外(例如,使用本文所述的lnp)递送干扰rna(例如,sirna),并且将细胞再注入患者中。
[0249]
在另一方面,本发明提供了包含使靶基因表达沉默的不对称干扰rna(airna)分子的脂质颗粒(例如,lnp),以及使用此类颗粒来使靶基因表达沉默的方法。
[0250]
在一个实施方案中,airna分子包含长度为约10至约25个(碱基配对)核苷酸的双链(双链体)区,其中airna分子包含含有5'和3'突出端的反义链,并且其中airna分子能够使靶基因表达沉默。
[0251]
在某些实例中,airna分子包含长度为约12-20、12-19、12-18、13-17或14-17个(碱基配对)核苷酸,更通常为长度为12、13、14、15、16、17、18、19或20个(碱基配对)核苷酸的双链(双链体)区。在某些其他实例中,反义链上的5'和3'突出端包含与靶rna序列互补的序列,并且可任选地进一步包含非靶序列。在一些实施方案中,反义链上的5'和3'突出端各自包含1、2、3、4、5、6、7个或更多个核苷酸或由1、2、3、4、5、6、7个或更多个核苷酸组成。
[0252]
在其他实施方案中,airna分子包含选自由以下组成的组的修饰的核苷酸:2'ome核苷酸、2'f核苷酸、2'-脱氧核苷酸、2'-o-moe核苷酸、lna核苷酸以及它们的混合物。在一个优选的实施方案中,airna分子包含2'ome核苷酸。作为非限制性实例,2'ome核苷酸可选自由以下组成的组:2'ome-鸟苷核苷酸、2'ome-尿苷核苷酸以及它们的混合物。
[0253]
在相关方面,本发明提供了包含使靶基因表达沉默的微小rna(mirna)分子的脂质颗粒(例如,lnp),以及使用此类组合物来使靶基因表达沉默的方法。
[0254]
在一个实施方案中,所述mirna分子包含约15至约60个核苷酸的长度,其中所述mirna分子能够使靶基因表达沉默。
[0255]
在某些实例中,mirna分子包含约15-50、15-40或15-30个核苷酸的长度,更通常地约15-25或19-25个核苷酸的长度,并且优选约20-24、21-22或21-23个核苷酸的长度。在优选的实施方案中,mirna分子是靶向目标rna序列的成熟mirna分子。
[0256]
在一些实施方案中,mirna分子包含选自由以下组成的组的修饰的核苷酸:2'ome核苷酸、2'f核苷酸、2'-脱氧核苷酸、2'-o-moe核苷酸、lna核苷酸以及它们的混合物。在一个优选的实施方案中,mirna分子包含2'ome核苷酸。作为非限制性实例,2'ome核苷酸可选自由以下组成的组:2'ome-鸟苷核苷酸、2'ome-尿苷核苷酸以及它们的混合物。
[0257]
在一些实施方案中,本发明的脂质颗粒(例如,lnp)可用于治疗性递送一种或多种mrna分子的方法中。具体地,本发明的一个目的是提供用于通过表达一种或多种靶蛋白来治疗哺乳动物(例如,啮齿动物如小鼠或灵长类动物如人、黑猩猩或猴)的疾病或病症的体外和体内方法。作为非限制性实例,本发明的方法可用于将一种或多种mrna分子体内递送至哺乳动物受试者。在某些其他实施方案中,可向哺乳动物施用治疗有效量的脂质颗粒(例如,lnp)。在一些实例中,将一种或多种mrna分子配制成lnp,并且将所述颗粒施用于需要这种治疗的患者。在其它实例中,从患者中去除细胞,体外(例如,使用本文所述的lnp)递送一
种或多种mrna分子,并且将细胞再注入患者中。
[0258]
在其他实施方案中,mrna分子包含选自由以下组成的组的修饰的核苷酸:2'ome核苷酸、2'f核苷酸、2'-脱氧核苷酸、2'-o-moe核苷酸、lna核苷酸以及它们的混合物。在相关方面,本发明提供了包含使靶基因表达沉默的微小rna(mirna)分子的脂质颗粒(例如,lnp),以及使用此类组合物来使靶基因表达沉默的方法。
[0259]
如此,本发明的脂质颗粒(例如,lnp)是有利的并且适合用于施用活性剂或治疗剂,如核酸(例如,干扰rna,如sirna、airna和/或mirna;或mrna),因为它们在循环中稳定,具有药效学行为所需的大小,从而使得接近血管外位点,并且能够到达靶细胞群体。
[0260]
在本发明的上下文中,术语“多核苷酸”和“寡核苷酸”是指由天然存在的碱基、糖和糖间(骨架)连接组成的核苷酸单体或核苷单体的聚合物或低聚物。术语“多核苷酸”和“寡核苷酸”还包括包含非天然存在的单体或其功能类似的部分的聚合物或低聚物。此类修饰的或取代的寡核苷酸常常优于天然形式,因为例如像细胞摄取增强、免疫原性减小以及在核酸酶存在下稳定性增加的性质。
[0261]
寡核苷酸通常分为脱氧核糖寡核苷酸或核糖寡核苷酸。脱氧核糖寡核苷酸由称为脱氧核糖的5-碳糖组成,其在此糖的5’和3’碳上共价连接至磷酸酯以形成交替非支链聚合物。核糖寡核苷酸由类似重复结构组成,其中5-碳糖为核糖。
[0262]
存在于根据本发明的脂质-核酸颗粒中的核酸包括已知的任何形式的核酸。本文使用的核酸可以是单链dna或rna、或双链dna或rna、或dna-rna杂交体。本文描述了双链dna的实例并且包括例如结构基因、包括控制区和终止区的基因以及自我复制系统如病毒或质粒dna。双链rna的实例在本文进行了描述并且包括例如sirna和其他rnai剂,如airna和前体mirna。单链核酸包括例如反义寡核苷酸、核酶、成熟mirna以及形成三链体的寡核苷酸(triplex-forming oligonucleotide)。
[0263]
核酸可具有各种长度,通常取决于核酸的具体形式。例如,在具体实施方案中,质粒或基因的长度可为约1,000个至约100,000个核苷酸残基。在具体实施方案中,寡核苷酸的长度可在约10至约100个核苷酸范围内。在各种相关实施方案中,单链、双链和三链的寡核苷酸的长度都可在约10至约60个核苷酸、约15至约60个核苷酸、约20至约50个核苷酸、约15至约30个核苷酸或约20至约30个核苷酸的范围内。
[0264]
在具体实施方案中,本发明的寡核苷酸(或其链)特异性地与靶多核苷酸序列杂交或与靶多核苷酸序列互补。如本文所使用的术语“可特异性杂交”和“互补”指明充分程度的互补性,使得在dna或rna靶与寡核苷酸之间发生稳定的且特异性的结合。应该理解,寡核苷酸不需要与其待特异性杂交的靶核酸序列100%互补。在优选的实施方案中,在寡核苷酸与靶序列的结合干扰靶序列的正常功能以引起其实用性或表达丧失时,寡核苷酸为可特异性杂交的,并且存在充分程度的互补性以避免在其中所需特异性结合的条件下,即在体内测定或治疗处理的情况下在生理条件下、或在体外测定的情况下在其中进行测定的条件下寡核苷酸与非靶序列非特异性结合。因此,与靶向或与其特异性杂交的基因或mrna序列的区相比,寡核苷酸可包括1、2、3或更多个碱基取代。
[0265]
sirna
[0266]
本发明的脂质纳米颗粒的sirna组分能够使目标靶基因的表达沉默。sirna双链体的每条链的长度通常均为约15至约60个核苷酸,优选地长度为约15至约30个核苷酸。在某
30%、14%-30%、15%-30%、16%-30%、17%-30%、18%-30%、19%-30%、20%-30%、21%-30%、22%-30%、23%-30%、24%-30%、25%-30%、26%-30%、27%-30%、28%-30%或29%-30%的修饰的核苷酸)。
[0271]
sirna序列的选择
[0272]
可使用本领域中已知的任何方式鉴定合适的sirna序列。通常,将在elbashir等人,nature,411:494-498(2001)和elbashir等人,embo j.,20:6877-6888(2001)中描述的方法与在reynolds等人,nature biotech.,22(3):326-330(2004)中列举出的合理设计规则组合。
[0273]
一般来说,扫描来自目标靶基因的转录物的aug起始密码子的核苷酸序列3’的二核苷酸序列(例如,aa、na、cc、gg或uu,其中n
═
c、g或u)(参见,例如elbashir等人,embo j.,20:6877-6888(2001))。将紧邻二核苷酸序列的3’的核苷酸鉴定为可能的sirna序列(即,靶序列或有义链序列)。通常,将紧邻二核苷酸序列的3’的19个、21个、23个、25个、27个、29个、31个、33个、35个或更多个核苷酸鉴定为可能的sirna序列。在一些实施方案中,二核苷酸序列是aa或na序列,并且将紧邻aa或na二核苷酸的3'的19个核苷酸鉴定为可能的sirna序列。sirna序列通常沿着靶基因的长度在不同位置间隔开。为了进一步增强sirna序列的沉默效率,可分析可能的sirna序列以鉴定例如在靶细胞或生物体中不含有与其他编码序列同源的区的位点。例如,具有约21个碱基对的适合sirna序列通常在靶细胞或生物体中将不具有多于16-17个与编码序列同源的邻接碱基对。如果sirna序列将从rna pol iii启动子表达,选择缺乏多于4个邻接a’s或t’s的sirna序列。
[0274]
一旦已经鉴定出可能的sirna序列,就可设计互补序列(即,反义链序列)。还可使用本领域中已知的各种标准分析可能的sirna序列。例如,为了增强其沉默效率,可通过合理的设计算法鉴定具有以下特征中的一个或多个的序列来分析sirna序列:(1)g/c含量为约25%至约60%g/c;(2)在有义链的位置15-19上有至少3个a/u;(3)没有内部重复;(4)在有义链的位置19上有a;(5)在有义链的位置3上有a;(6)在有义链的位置10上有u;(7)在有义链的位置19上没有g/c;以及(8)在有义链的位置13上没有g。掺入为每个这些特征赋予适合值并且有用于选择sirna的算法的sirna设计工具可在例如http://boz094.ust.hk/rnai/sirna找到。本领域技术人员将了解,可选择具有一个或多个上述特征的序列用于进一步分析并且测试作为可能的sirna序列。
[0275]
另外,具有一个或多个以下标准的可能的sirna序列可常常省略为sirna:(1)包含成排的4个或更多个相同碱基的延伸的序列;(2)包含g的同聚物(即,为了减少由于这些聚合物的结构特征引起的可能的非特异性效应的序列;(3)包含三碱基基序(例如,ggg、ccc、aaa或ttt)的序列;(4)包含成排的7个或更多个g/c的延伸的序列;以及(5)在导致内部折回结构的候选物内包含具有4个或更多个碱基的直接重复的序列。然而,本领域技术人员将了解仍然可选择具有一个或多个上述特征的序列用于进一步分析并且测试作为可能的sirna序列。
[0276]
在一些实施方案中,可基于如在例如,khvorova等人,cell,115:209-216(2003);和schwarz等人,cell,115:199-208(2003)中描述的sirna双链体不对称性进一步分析可能的sirna序列。在其他实施方案中,可能的sirna序列可基于如在例如luo等人,biophys.res.commun.,318:303-310(2004)中描述的在靶位点处的二级结构进一步分析。
例如,可使用mfold算法(在http://www.bioinfo.rpi.edu/applications/mfold/rna/form1.cgi可获得)来建模靶位点处的二级结构以选择有利于在靶位点进入的sirna序列,其中存在较少的呈碱基配对和茎-环形式的二级结构。
[0277]
一旦已经鉴定出可能的sirna序列,就可例如使用体外细胞因子测定或体内动物模型分析序列的任何免疫刺激性质的存在。sirna序列的有义链和/或反义链中的基序如富含gu的基序(例如,5'-gu-3'、5'-ugu-3'、5'-gugu-3'、5'-ugugu-3'等)还可提供序列是否可能为免疫刺激性的指示。一旦发现sirna分子为免疫刺激性的,然后就可如本文所描述对其修饰以减少其免疫刺激性质。作为一个非限制性实例,可在使得细胞产生可检测的免疫应答以确定sirna是否为免疫刺激性或非免疫刺激性的sirna的条件下使sirna序列与哺乳动物应答细胞接触。哺乳动物应答细胞可来自初生哺乳动物(即,先前尚未与sirna序列的基因产物接触的哺乳动物)。哺乳动物应答细胞可以是例如外周血单核细胞(pbmc)、巨噬细胞等。可检测的免疫应答可包括产生细胞因子或生长因子例如像tnf-α、ifn-α、ifn-β、ifn-γ、il-6、il-12或其组合。然后可通过用修饰的核苷酸替代有义链和/或反义链上的至少一个核苷酸来修饰鉴定为免疫刺激性的sirna分子以减少其免疫刺激性质。例如,在sirna双链体的双链区中,少于约30%(例如,少于约30%、25%、20%、15%、10%或5%)的核苷酸可被修饰的核苷酸如2’ome核苷酸替代。然后可使修饰的sirna与如上描述的哺乳动物应答细胞接触以证实其免疫刺激性质有所减小或消除。
[0278]
用于检测免疫应答的适合的体外测定包括但不限于david等人(美国专利号4,376,110)的双单克隆抗体夹心免疫测定技术;单克隆-多克隆抗体夹心测定(wide等人,在kirkham和hunter,编辑,radioimmunoassay methods,e.and s.livingstone,edinburgh(1970)中);gordon等人(美国专利号4,452,901)的“蛋白质印迹”方法;标记配体的免疫沉淀(brown等人,j.biol.chem.,255:4980-4983(1980));如例如由raines等人,j.biol.chem.,257:5154-5160(1982)所描述的酶联免疫吸附测定(elisa);免疫细胞化学技术,包括使用荧光染料(brooks等人,clin.exp.immunol.,39:477(1980));以及活性的中和(bowen-pope等人,proc.natl.acad.sci.usa,81:2396-2400(1984))。除了以上描述的免疫测定之外,许多其他免疫测定可供使用,包括在美国专利号3,817,827;3,850,752;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074和4,098,876中描述的那些。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0279]
用于检测免疫应答的体内模型的非限制性实例包括如在例如judge等人,mol.ther.,13:494-505(2006)中描述的体内小鼠细胞因子诱导测定。在某些实施方案中,可进行的测定如下:(1)可通过在侧尾静脉中的标准静脉内注射来施用sirna;(2)在施用后约6小鼠可通过心脏穿刺收集血液并且加工成血浆用于细胞因子分析;以及(3)可根据制造商的说明使用夹心elisa试剂盒来定量细胞因子(例如,小鼠和人ifn-α(pbl biomedical;piscataway,n.j.);人il-6和tnf-α(ebioscience;san diego,calif.);以及小鼠il-6、tnf-α和ifn-γ(bd biosciences;san diego,calif.))。
[0280]
特异性地结合细胞因子和生长因子的单克隆抗体可从多种来源商业上获得并且可使用本领域中已知的方法产生(参见例如,kohler等人,nature,256:495-497(1975)以及harlow和lane,antibodies,a laboratory manual,cold spring harbor publication,new york(1999))。先前已描述了单克隆抗体的产生并且可通过本领域中已知的任何方式
实现(buhring等人,在hybridoma,第10卷,第1期,第77-78页(1991)中)。在一些方法中,标记(例如,使用通过光谱、光化学、生物化学、电学、光学或化学方式可检测的任何组合物)单克隆抗体以有利于检测。
[0281]
产生sirna分子
[0282]
可以若干形式提供sirna,包括例如呈一种或多种分离的小干扰rna(sirna)双链体、呈较长的双链rna(dsrna)或呈由dna质粒中的转录盒转录的sirna或dsrna。sirna序列可具有突出端(例如,如在elbashir等人,genes dev.,15:188(2001)或等人,cell,107:309(2001)中描述的3’或5’突出端),或者可缺乏突出端(即,具有平末端)。
[0283]
rna群可用来提供长前体rna,或与选择的靶序列基本上或完全同一的长前体rna可以用来制造sirna。可根据本领域技术人员熟知的方法从细胞或组织中分离rna,合成和/或克隆rna。rna可以是混合群体(从细胞或组织获得,由cdna转录,减去,选择等),或者可代表单一靶序列。rna可以是天然存在的(例如,从组织或细胞样品中分离的)、体外合成(例如,使用t7或sp6聚合酶和pcr产物或克隆的cdna)或化学合成。
[0284]
为了形成长dsrna,针对合成的rna,还在体外转录并且杂交补体以形成dsrna。如果使用天然存在的rna群,还例如通过转录相应于rna群的cdna或通过使用rna聚合酶提供rna补体(例如,以形成用于被大肠杆菌rna酶iii或切丁酶消化的dsrna)。然后杂交前体rna以形成用于消化的双链rna。可直接向受试者施用dsrna或可在施用之前体外消化所述dsrna。
[0285]
用于分离rna、合成rna、杂交核酸、制造和筛选cdna文库以及进行pcr的方法为本领域中熟知的(参见例如,gubler和hoffman,gene,25:263-269(1983);sambrook等人,同上;ausubel等人,同上),pcr方法同样如此(参见,美国专利号4,683,195和4,683,202;pcr protocols:a guide to methods and applications(innis等人,编辑,1990))。表达文库也为本领域技术人员熟知的。公开了在本发明中使用的一般方法的另外基础文章包括sambrook等人,molecular cloning,a laboratory manual(第2版1989);kriegler,gene transfer and expression:a laboratory manual(1990);以及current protocols in molecular biology(ausubel等人,编辑,1994)。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0286]
优选地,化学合成sirna。包含本发明的sirna分子的寡核苷酸可使用本领域中已知的任何各种技术来合成,如在usman等人,j.am.chem.soc.,109:7845(1987);scaringe等人,nucl.acids res.,18:5433(1990);wincott等人,nucl.acids res.,23:2677-2684(1995);以及wincott等人,methods mol.bio.,74:59(1997)中描述的那些。寡核苷酸的合成使用了常见的核酸保护基和偶联基,如5
’‑
末端上的二甲氧基三苯甲基和3
’‑
末端上的亚磷酰胺。作为一个非限制性实例,小规模合成可在使用0.2μmol规模方案的applied biosystems合成仪上进行。或者,在0.2μmol规模下的合成可在来自protogene(palo alto,calif.)的96孔板合成仪上进行。然而,更大或更小规模的合成也在本发明的范围内。用于寡核苷酸合成的适合试剂、用于rna去保护的方法以及用于rna纯化的方法为本领域技术人员已知的。
[0287]
sirna分子还可经由串联合成技术合成,其中两条链均合成为通过可裂解接头分开的单一连续寡核苷酸片段或链,所述可裂解接头随后裂解以提供杂交形成sirna双链体
的分开的片段或链。接头可为多核苷酸接头或非核苷酸接头。sirna的串联合成可易于适应多孔/多板合成平台以及采用间歇反应器、合成塔等的大规模合成平台。或者,可由两个相异的寡核苷酸组装sirna分子,其中一个寡核苷酸包含sirna的有义链并且另一个包含sirna的反义链。例如,可分开合成每条链并且在合成和/或去保护之后通过杂交或连接连在一起。在某些其他实例中,sirna分子可合成为单一连续寡核苷酸片段,其中自身互补有义区和反义区杂交形成具有发夹二级结构的sirna双链体。
[0288]
修饰sirna序列
[0289]
在某些方面中,sirna分子在双链区中包含具有两条链的双链体和至少一个修饰的核苷酸,其中每条链的长度均为约15至约60个核苷酸。有利地,修饰的sirna的免疫刺激性比相应的未修饰的sirna序列的免疫刺激性小,但仍保留使靶序列的表达沉默的能力。在优选的实施方案中,引入到sirna分子中的化学修饰的程度在sirna的免疫刺激性质的减小或消除与rnai活性保留之间达成平衡。作为一个非限制性实例,靶向目标基因的sirna分子可在sirna双链体内的选择性尿苷和/或鸟苷核苷酸上最小修饰(例如,小于约30%、25%、20%、15%、10%或5%修饰)以消除由sirna产生的免疫应答同时保留其使靶基因表达沉默的能力。
[0290]
适合用于本发明的修饰的核苷酸的实例包括但不限于具有2
’‑
o-甲基(2’ome)、2
’‑
脱氧-2
’‑
氟(2’f)、2
’‑
脱氧、5-c-甲基、2
’‑
o-(2-甲氧基乙基)(moe)、4
’‑
硫基、2
’‑
氨基或2
’‑
c-烯丙基的核糖核苷酸。具有northern构象的修饰的核苷酸如在例如saenger,principles of nucleic acid structure,springer-verlag编著(1984)中描述的那些也适合用于sirna分子。此类修饰的核苷酸包括但不限于锁核酸(lna)核苷酸(例如,2
’‑
o核苷酸、4
’‑
c-亚甲基-(d-呋喃核糖基)核苷酸)、2
’‑
o-(2-甲氧基乙基)(moe)核苷酸、2
’‑
甲基-硫-乙基核苷酸、2
’‑
脱氧-2
’‑
氟(2’f)核苷酸、2
’‑
脱氧-2
’‑
氯(2’cl)核苷酸以及2
’‑
叠氮基核苷酸。在某些实例中,本文描述的sirna分子包括一个或多个g型夹核苷酸。g型夹核苷酸是指修饰的胞嘧啶类似物,其中修饰赋予双链体内的互补鸟嘌呤核苷酸的watson-crick和hoogsteen这两个面的氢键能力(参见例如,lin等人,j.am.chem.soc.,120:8531-8532(1998))。另外,具有核苷酸碱基类似物例如像c-苯基、c-萘基、其他芳香族衍生物、肌苷、吡咯羧酰胺(azole carboxamide)以及硝基吡咯衍生物如3-硝基吡咯、4-硝基吲哚、5-硝基吲哚和6-硝基吲哚(参见例如,loakes,nucl.acids res.,29:2437-2447(2001))的核苷酸可掺入到sirna分子中。
[0291]
在某些实施方案中,sirna分子还可包含一种或多种化学修饰,如末端帽部分、磷酸主链修饰等。末端帽部分的实例包括但不限于:反向脱氧脱碱基残基、甘油基修饰、4’,5
’‑
亚甲基核苷酸、1-(β-d-赤呋喃糖基)核苷酸、4
’‑
硫代核苷酸、碳环核苷酸、1,5-脱水己糖醇核苷酸、l-核苷酸、α-核苷酸、修饰的碱基核苷酸、苏型呋喃戊糖基核苷酸、无环3’,4
’‑
闭联核苷酸、无环3,4-二羟基丁基核苷酸、无环3,5-二羟基戊基核苷酸、3
’‑3’‑
反向核苷酸部分、3
’‑3’‑
反向脱碱基部分、3
’‑2’‑
反向核苷酸部分、3
’‑2’‑
反向脱碱基部分、5
’‑5’‑
反向核苷酸部分、5
’‑5’‑
反向脱碱基部分、3
’‑5’‑
反向脱氧脱碱基部分、磷酸5
’‑
氨基-烷基酯、磷酸1,3-二氨基-2-丙酯、磷酸3-氨基丙酯、磷酸6-氨基己酯、磷酸1,2-氨基十二烷基酯、磷酸羟丙酯、磷酸1,4-丁二醇酯、3
’‑
氨基磷酸酯、5
’‑
氨基磷酸酯、磷酸己酯、磷酸氨基己酯、3
’‑
磷酸酯、5
’‑
氨基、3
’‑
硫代磷酸酯、5
’‑
硫代磷酸酯、二硫代磷酸酯以及桥联或未桥
联的膦酸甲酯或5
’‑
巯基部分(参见例如,美国专利号5,998,203;beaucage等人,tetrahedron 49:1925(1993))。磷酸主链修饰(即,产生修饰的核苷酸间键联)的非限制性实例包括硫代磷酸酯、二硫代磷酸酯、膦酸甲酯、磷酸三酯、吗啉代、酰胺化物、氨基甲酸酯、羧甲基、乙酰胺酯、聚酰胺、磺酸酯、磺酰胺、氨基磺酸酯、甲缩醛(formacetal)、硫代甲缩醛以及烷基甲硅烷基取代(参见例如,hunziker等人,nucleic acid analogues:synthesis and properties,在modern synthetic methods,vch,331-417(1995)中;mesmaeker等人,novel backbone replacements for oligonucleotides,在carbohydrate modifications in antisense research,acs,24-39(1994)中)。此类化学修饰可发生在sirna的有义链、反义链或这两条链的5
’‑
末端和/或3
’‑
末端。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0292]
在一些实施方案中,sirna分子的有义链和/或反义链还可包含3
’‑
末端突出端,其具有约1至约4个(例如,1个、2个、3个或4个)2
’‑
脱氧核糖核苷酸和/或修饰的和未修饰的核苷酸的任何组合。可引入到sirna分子中的修饰的核苷酸和化学修饰的类型的另外实例描述于例如英国专利号gb 2,397,818 b和美国专利公开号20040192626、20050282188和20070135372中,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0293]
本文描述的sirna分子可在sirna的一条链或两条链中任选地包含一个或多个非核苷酸。如本文所使用,术语“非核苷酸”是指可替代一个或多个核苷酸单元掺入到核酸链中的任何基团或化合物,包括糖和/或磷酸酯取代,并且允许剩余的碱基展现其活性。所述基团或化合物是脱碱基的,因为其不含有公认的核苷酸碱基如腺苷、鸟嘌呤、胞嘧啶、尿嘧啶或胸腺嘧啶并且因此在1
’‑
位置上缺乏碱基。
[0294]
在其他实施方案中,sirna的化学修饰包括将缀合物附接至sirna分子。缀合物可经由共价附接例如像生物可降解的接头在sirna的有义链和/或反义链的5
’‑
末端和/或3
’‑
末端上附接。还可例如通过氨基甲酸酯基团或其他连接基团将缀合物附接至sirna(参见,例如美国专利公开号20050074771、20050043219和20050158727)。在某些实例中,缀合物是有利于sirna递送至细胞中的分子。适用于附接至sirna的缀合物分子的实例包括但不限于类固醇如胆固醇、二醇如聚乙二醇(peg)、人血清白蛋白(hsa)、脂肪酸、类胡萝卜素、萜烯、胆汁酸、叶酸盐(例如,叶酸、叶酸盐类似物及其衍生物)、糖(例如,半乳糖、半乳糖胺、n-乙酰基半乳糖胺、葡萄糖、甘露糖、果糖、岩藻糖等)、磷脂、肽、能够介导细胞摄取的细胞受体的配体及其组合(参见,例如美国专利公开号20030130186、20040110296和20040249178;美国专利号6,753,423)。其他实例包括描述于美国专利公开号20050119470和20050107325中的亲脂性部分、维生素、聚合物、肽、蛋白质、核酸、小分子、寡糖、碳水化合物簇、嵌入剂、小沟粘合剂、裂解剂以及交联剂缀合物分子。其他的实例包括描述于美国专利公开号20050153337中的2
’‑
o-烷基胺、2
’‑
β-烷氧基烷基胺、多胺、c5-阳离子修饰的嘧啶、阳离子肽、胍基、脒鎓基团、阳离子氨基酸缀合物分子。其他实例包括描述于美国专利公开号20040167090中的疏水性基团、膜活性化合物、细胞穿透化合物、细胞靶向信号、相互作用改性剂以及空间稳定剂缀合物分子。另外的实例包括描述于美国专利公开号20050239739中的缀合物分子。可针对sirna的改进的药物代谢动力学特征、生物利用度和/或稳定性同时保留rnai活性来评价所使用的缀合物的类型和缀合至sirna分子的程度。因此,本领域技术人员可使用任何各种熟知的体外细胞培养物或体内动物模型筛选具有附接至其上的各种
缀合物的sirna分子以鉴定具有改进性质和全部rnai活性的sirna分子。上述专利文件的公开内容出于所有目的以引用的方式整体并入本文。
[0295]
靶基因
[0296]
在某些实施方案中,本文描述的脂质纳米颗粒的核酸组分(例如,sirna)可用来下调或沉默目标基因的翻译(即,表达)。目标基因包括但不限于:与病毒感染和存活相关的基因、与代谢疾病和病症(例如,肝脏疾病和病症)相关的基因、与肿瘤发生和细胞转化(例如,癌症)相关的基因、血管生成基因、免疫调节基因如与炎性和自身免疫应答相关的那些、配体受体基因以及与神经变性病症相关的基因。在某些实施方案中,目标基因在肝细胞中表达。
[0297]
与病毒感染和存活相关的基因包括病毒表达的那些基因,以便与细胞结合,进入细胞和在细胞中复制。特别感兴趣的是与慢性病毒疾病相关的病毒序列。特别感兴趣的病毒序列包括以下病毒的序列:丝状病毒,如埃博拉病毒和马尔堡病毒(参见例如,geisbert等人,j.infect.dis.,193:1650-1657(2006));沙粒病毒如拉沙病毒、胡宁病毒、马丘波病毒、瓜纳瑞托病毒和萨比亚病毒(buchmeier等人,arenaviridae:the viruses and their replication,in:fields virology,knipe等人(编辑),第4版,lippincott-raven,philadelphia,(2001));流感病毒如甲型流感病毒、乙型流感病毒和丙型流感病毒(参见,例如steinhauer等人,annu rev genet.,36:305-332(2002);和neumann等人,j gen virol.,83:2635-2662(2002));肝炎病毒(参见,例如hamasaki等人,febs lett.,543:51(2003);yokota等人,embo rep.,4:602(2003);schlomai等人,hepatology,37:764(2003);wilson等人,proc.natl.acad.sci.usa,100:2783(2003);kapadia等人,proc.natl.acad.sci.usa,100:2014(2003);和fields virology,knipe等人(编辑),第4版,lippincott-raven,philadelphia(2001));人免疫缺陷病毒(hiv)(banerjea等人,mol.ther.,8:62(2003);song等人,j.virol.,77:7174(2003);stephenson,jama,289:1494(2003);qin等人,proc.natl.acad.sci.usa,100:183(2003));疱疹病毒(jia等人,j.virol.,77:3301(2003));以及人乳头瘤病毒(hpv)(hall等人,j.virol.,77:6066(2003);jiang等人,oncogene,21:6041(2002))。
[0298]
可被沉默的示例性丝状病毒核酸序列包括但不限于编码结构蛋白(例如,vp30、vp35、核蛋白(np)、聚合酶蛋白(l-pol))和膜相关蛋白(例如,vp40、糖蛋白(gp)、vp24)的核酸序列。用于埃博拉病毒的完整基因组序列在例如genbank登录号nc_002549;ay769362;nc_006432;nc_004161;ay729654;ay354458;ay142960;ab050936;af522874;af499101;af272001;以及af086833中列出。埃博拉病毒vp24序列在例如genbank登录号u77385和ay058897中列出。埃博拉病毒l-pol序列在例如genbank登录号x67110中列出。埃博拉病毒vp40序列在例如genbank登录号ay058896中列出。埃博拉病毒np序列在例如genbank登录号ay058895中列出。埃博拉病毒gp序列在例如genbank登录号ay058898;sanchez等,virus res.,29:215-240(1993);will等人,j.virol.,67:1203-1210(1993);volchkov等人,febs lett.,305:181-184(1992);以及美国专利号6,713,069中列出。额外的埃博拉病毒序列在例如genbank登录号l11365和x61274中列出。用于马尔堡病毒的完整基因组序列在例如genbank登录号nc_001608;ay430365;ay430366和ay358025中列出。马尔堡病毒gp序列在例如genbank登录号af005734;af005733和af005732中列出。马尔堡病毒vp35序列在例如
genbank登录号af005731和af005730中列出。额外的马尔堡病毒序列在例如genbank登录号x64406;z29337;af005735和z12132中列出。靶向埃博拉病毒和马尔堡病毒核酸序列的sirna分子的非限制性实例包括在美国专利公布号20070135370中描述的那些,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0299]
可被沉默的示例性流感病毒核酸序列包括但不限于编码核蛋白(np)、基质蛋白(m1和m2)、非结构蛋白(ns1和ns2)、rna聚合酶(pa、pb1、pb2)、神经氨酸酶(na)以及血细胞凝集素(ha)的核酸序列。甲型流感病毒np序列在例如genbank登录号nc_004522;ay818138;ab166863;ab188817;ab189046;ab189054;ab189062;ay646169;ay646177;ay651486;ay651493;ay651494;ay651495;ay651496;ay651497;ay651498;ay651499;ay651500;ay651501;ay651502;ay651503;ay651504;ay651505;ay651506;ay651507;ay651509;ay651528;ay770996;ay790308;ay818138;以及ay818140中列出。甲型流感病毒pa序列在例如genbank登录号ay818132;ay790280;ay646171;ay818132;ay818133;ay646179;ay818134;ay551934;ay651613;ay651610;ay651620;ay651617;ay651600;ay651611;ay651606;ay651618;ay651608;ay651607;ay651605;ay651609;ay651615;ay651616;ay651640;ay651614;ay651612;ay651621;ay651619;ay770995;以及ay724786中列出。靶向流感病毒核酸序列的sirna分子的非限制性实例包括在美国专利公布号20070218122中描述的那些,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0300]
可被沉默的示例性肝炎病毒核酸序列包括但不限于在转录和翻译中涉及的核酸序列(例如,en1、en2、x、p)以及编码结构蛋白(例如,包括c蛋白和c相关蛋白的核心蛋白;包括s蛋白、m蛋白和/或l蛋白的衣壳蛋白和包膜蛋白或其片段)的核酸序列(参见,例如fields virology,同上)。可被沉默的示例性丙型肝炎病毒(hcv)核酸序列包括但不限于5
’‑
非翻译区(5
’‑
utr)、3
’‑
非翻译区(3
’‑
utr)、多蛋白翻译起始密码子区、内部核糖体进入位点(ires)序列、和/或编码以下蛋白质的核酸序列:核心蛋白、e1蛋白、e2蛋白、p7蛋白、ns2蛋白、ns3蛋白酶/解旋酶、ns4a蛋白、ns4b蛋白、ns5a蛋白、和/或ns5b rna-依赖的rna聚合酶。hcv基因组序列在例如genbank登录号nc_004102(hcv基因型1a)、aj238799(hcv基因型1b)、nc_009823(hcv基因型2)、nc_009824(hcv基因型3)、nc_009825(hcv基因型4)、nc_009826(hcv基因型5)和nc_009827(hcv基因型6)中列出。甲型肝炎病毒核酸序列在例如genbank登录号nc_001489中列出;乙型肝炎病毒核酸序列在例如genbank登录号nc_003977中列出;丁型肝炎病毒核酸序列在例如genbank登录号nc_001653中列出;戊型肝炎病毒核酸序列在例如genbank登录号nc_001434中列出;以及庚型肝炎病毒核酸序列在例如genbank登录号nc_001710中列出。使编码与病毒感染和存活相关的基因的序列沉默可以方便地与用来治疗病毒病状的常规剂的施用组合使用。靶向肝炎病毒核酸序列的sirna分子的非限制性实例包括在美国专利公布号20060281175;20050058982和20070149470;美国专利号7,348,314;和2009年3月20日提交的美国临时申请号61/162,127中描述的那些,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0301]
与代谢疾病和病症(例如,其中肝脏为靶标的病症以及肝脏疾病和病症)相关的基因包括例如在血脂异常中表达的基因(例如肝脏x受体如lxrα和lxrβ(genbank登录号nm_007121)、法尼酯x受体(fxr)(genbank登录号nm_005123)、固醇调控元件结合蛋白(srebp)、位点-1蛋白酶(s1p)、3-羟基-3-甲基戊二酰辅酶-a还原酶(hmg辅酶-a还原酶)、载脂蛋白b
1-微球蛋白/二库宁前体(ambp)、血管生成素相关蛋白3(angptl3)、血清淀粉样蛋白p组分(apcs)、载脂蛋白a-ii(apoa2)、载脂蛋白b-100(apob)、载脂蛋白c3(apoc3)、载脂蛋白c-iv(apoc4)、载脂蛋白f(apof)、β-2-糖蛋白1(apoh)、水通道蛋白9(aqp9)、胆汁酸-coa:氨基酸n-酰基转移酶(baat)、c4b结合蛋白β链(c4bpb)、由linc01554(c5orf27)编码的推定未表征蛋白、补体因子3(c3)、补体因子5(c5)、补体组分c6(c6)、补体组分c8α链(c8a)、补体组分c8β链(c8b)、补体组分c8γ链(c8g)、补体组分c9(c9)、钙调蛋白结合转录激活因子1(camta1)、cd38(cd38)、补体因子b(cfb)、补体因子h相关蛋白1(cfhr1)、补体因子h相关蛋白2(cfhr2)、补体因子h相关蛋白3(cfhr3)、大麻素受体1(cnr1)、血浆铜蓝蛋白(cp)、羧肽酶b2(cpb2)、结缔组织生长因子(ctgf)、c-x-c基序趋化因子2(cxcl2)、细胞色素p450 1a2(cyp1a2)、细胞色素p450 2a6(cyp2a6)、细胞色素p450 2c8(cyp2c8)、细胞色素p450 2c9(cyp2c9)、细胞色素p450家族2亚家族d成员6(cyp2d6)、细胞色素p450 2e1(cyp2e1)、叶绿醌ω-羟化酶cyp4f2(cyp4f2)、7-α-羟基胆甾-4-烯-3-酮12-α-羟化酶(cyp8b1)、二肽基肽酶4(dpp4)、凝血因子12(f12)、凝血因子ii(凝血酶)(f2)、凝血因子ix(f9)、纤维蛋白原α链(fga)、纤维蛋白原β链(fgb)、纤维蛋白原γ链(fgg)、纤维蛋白原样1(fgl1)、含黄素单氧化酶3(fmo3)、含黄素单氧化酶5(fmo5)、群组特异性组分(维生素d结合蛋白)(gc)、生长激素受体(ghr)、甘氨酸n-甲基转移酶(gnmt)、透明质酸结合蛋白2(habp2)、铁调素抗微生物肽(hamp)、羟基酸氧化酶(乙醇酸氧化酶)1(hao1)、hgf激活因子(hgfac)、结合珠蛋白相关蛋白质;结合珠蛋白(hpr)、血色素结合蛋白(hpx)、富含组氨酸的糖蛋白(hrg)、羟基类固醇(11-β)脱氢酶1(hsd11b1)、羟基类固醇(17-β)脱氢酶13(hsd17b13)、间α-胰蛋白酶抑制因子重链h1(itih1)、间α-胰蛋白酶抑制因子重链h2(itih2)、间α-胰蛋白酶抑制因子重链h3(itih3)、间α-胰蛋白酶抑制因子重链h4(itih4)、前激肽释放酶(klkb1)、乳酸脱氢酶a(ldha)、肝脏表达的抗菌肽2(leap2)、白细胞源性趋化因子2(lect2)、脂蛋白(a)(lpa)、甘露聚糖结合凝集素太酶2(masp2)、s-腺苷甲硫氨酸合酶同种型1型(mat1a)、nadph氧化酶4(nox4)、具有[adp-核糖]聚合酶1(parp1)、对氧磷酶1(pon1)、对氧磷酶3(pon3)、维生素k依赖性蛋白c(proc)、视黄醇脱氢酶16(rdh16)、血清淀粉样蛋白a4、组成型(saa4)、丝氨酸脱水酶(sds)、serpin家族a成员1(serpina1)、serpin a11(serpina11)、激肽释放素抑素(serpina4)、皮质类固醇结合球蛋白(serpina6)、抗凝血酶-iii(serpinc1)、肝素辅因子2(serpind1)、serpin家族h成员1(serpinh1)、溶质运载蛋白家族5成员2(slc5a2)、纳/胆汁酸协同转运蛋白(slc10a1)、溶质运载蛋白家族13成员5(slc13a5)、溶质运载蛋白家族22成员1(slc22a1)、溶质运载蛋白家族25成员47(slc25a47)、溶质运载蛋白家族2,促葡萄糖转运蛋白成员2(slc2a2)、钠偶联的中性氨基酸转运蛋白4(slc38a4)、溶质运载蛋白有机阴离子转运蛋白家族1b1(slco1b1)、神经鞘磷脂磷酸二脂酶1(smpd1)、胆汁盐磺基转移酶(sult2a1)、酪氨酸氨基转移酶(tat)、色氨酸2,3-双加氧酶(tdo2)、udp葡糖醛酸基转移酶2家族,多肽b10(ugt2b10)、udp葡糖醛酸基转移酶2、组多肽b15(ugt2b15)、udp葡糖醛酸基转移酶2家族,多肽b4(ugt2b4)以及玻连蛋白(vtn)。
[0310]
除了其用于使治疗目的的任何上述基因的表达沉默之外,本文所述的某些核酸(例如,sirna)还可用于研究和开发应用以及诊断、预防、预后、临床以及其他医疗保健应用。作为一个非限制性实例,某些核酸(例如,sirna)可以用于针对测试感兴趣的基因是否可能成为治疗性靶标的靶标验证研究中。某些核酸(例如sirna)还可用于旨在发现作为可
能的治疗性靶的基因的靶鉴定研究中。
[0311]
crispr
[0312]
靶向基因组编辑已从小众技术发展为许多生物学研究人员使用的方法。聚簇规律间隔的短回文重复序列(crispr)技术的出现在很大程度上推动了这一进展(参见例如,sander等人,nature biotechnology,32(4),347-355,包括补充信息(2014)和国际公布号wo 2016/197132和wo 2016/197133)。因此,本文提供了可与crispr技术组合使用以治疗诸如hbv的疾病的改进(例如脂质纳米颗粒及其制剂)。关于使用crispr的靶标,可将crispr技术中使用的向导rna(grna)设计为靶向特异性鉴定的序列,例如hbv基因组的靶基因。此类靶序列的实例在国际公布号wo 2016/197132中提供。此外,国际公布号wo 2013/151665(例如,参见表6;所述文件以引用的方式明确地并入本文,特别是包括表6,以及相关的序列表)描述在mrna表达构建体的背景下要求保护的约35,000个mrna序列。本发明的某些实施方案利用crispr技术来靶向这些序列中的任一者的表达。本发明的某些实施方案还可利用crispr技术来靶向本文讨论的靶基因的表达。
[0313]
airna
[0314]
像sirna一样,不对称干扰rna(airna)可以募集rna-诱导的沉默复合体(risc)并且通过介导相对于反义链的5’末端的核苷酸10与核苷酸11之间的靶序列的序列特异性裂解而在哺乳动物细胞中导致各种基因的有效沉默(sun等人,nat.biotech.,26:1379-1382(2008))。通常,airna分子包含具有有义链和反义链的短rna双链体,其中双链体在反义链的3’末端和5’末端上含有突出端。airna一般为不对称的,因为当与互补反义链相比时,有义链在两端上更短。在一些方面中,可在类似于用于sirna分子的那些条件下设计、合成和退火airna分子。作为一个非限制性实例,可使用以上描述用于选择sirna序列的方法选择和产生airna序列。
[0315]
在另一个实施方案中,可设计在反义链的3’末端和5’末端上具有突出端的各种长度(例如,约10-25、12-20、12-19、12-18、13-17或14-17个碱基对,更通常地12、13、14、15、16、17、18、19或个碱基对)的airna双链体以靶向目标mrna。在某些实例中,airna分子的有义链的长度为约10-25、12-20、12-19、12-18、13-17或14-17个核苷酸,更通常地长度为12、13、14、15、16、17、18、19或20个核苷酸。在某些其它实例中,airna分子的反义链的长度为约15-60、15-50或15-40个核苷酸,更通常地长度为约15-30、15-25或19-25个核苷酸,并且优选地长度为约20-24、21-22或21-23个核苷酸。
[0316]
在一些实施方案中,5’反义突出端含有一个、两个、三个、四个或更多个非靶向核苷酸(例如,“aa”、“uu”、“dtdt”等)。在其它实施方案中,3’反义突出端含有一个、两个、三个、四个或更多个非靶向核苷酸(例如,“aa”、“uu”、“dtdt”等)。在某些方面中,本文描述的airna分子可例如在双链(双链体)区和/或在反义突出端中包含一个或多个修饰的核苷酸。作为一个非限制性实例,airna序列可包含一个或多个以上针对sirna序列描述的修饰的核苷酸。在优选的实施方案中,airna分子包含2’ome核苷酸例如像2’ome-鸟苷核苷酸、2’ome-尿苷核苷酸或其混合物。
[0317]
在某些实施方案中,airna分子可包含相应于sirna分子例如本文描述的sirna分子之一的反义链的反义链。在其他实施方案中,airna分子可用于使上述靶基因中的任一者的表达沉默,例如与病毒感染和存活相关的基因、与代谢疾病和病症相关的基因、与肿瘤发
生和细胞转化相关的基因、血管生成基因、免疫调节基因(如与炎症性和自身免疫应答相关的基因)、配体受体基因以及与神经变性病症相关的基因。
[0318]
mirna
[0319]
通常,微小rna(mirna)为调节基因表达的长度为约21-23个核苷酸的单链rna分子。mirna由转录它们的dna的基因编码,但是mirna并没有翻译为蛋白质(非编码rna);相反,每个初始转录物(初始-mirna)均被加工为称作前体-mirna的短茎-环结构并且最终成为功能性成熟mirna。成熟mirna分子与一个或多个信使rna(mrna)分子部分或完全互补,并且其主要功能为下调基因表达。mirna分子的鉴定在例如lagos-quintana等人,science,294:853-858;lau等人,science,294:858-862;和lee等人,science,294:862-864中描述。
[0320]
编码mirna的基因比加工的成熟mirna分子长很多。首先mirna被转录为初始转录物或具有帽和poly-a尾的初始-mirna并且在细胞核中被加工成称为前体-mirna的短的、大约70个核苷酸的茎-环结构。通过称为由核酸酶drosha和双链rna结合蛋白pasha组成的微处理器复合体的蛋白质复合体在动物体内进行此加工(denli等人,nature,432:231-235(2004))。然后通过与核酸内切酶dicer相互作用在细胞质中将这些前体-mirna加工为成熟的mirna,这还启动rna-诱导的沉默复合体(risc)的形成(bernstein等人,nature,409:363-366(2001))。dna的有义链或反义链可用作产生mirna的模板。
[0321]
当切丁酶裂解前体-mirna茎-环时,形成两个互补的短rna分子,但只有一个合并到risc复合体中。此链称为引导链并且基于5’末端的稳定性通过risc复合体中的催化活性rna酶argonaute蛋白来选择(preall等人,curr.biol.,16:530-535(2006))。称为反引导或过客链的剩余链被降解为risc复合体底物(gregory等人,cell,123:631-640(2005))。在合并到活性risc复合体中之后,mirna与其互补mrna分子碱基配对并且诱导靶mrna降解和/或翻译沉默。
[0322]
哺乳动物mirna分子通常与靶mrna序列的3’utr中的位点互补。在某些实例中,mirna与靶mrna的退火通过阻断蛋白质翻译机制而抑制了蛋白质翻译。在某些其它例子中,mirna与靶mrna的退火通过类似于rna干扰(rnai)的方法有利于靶mrna的裂解和降解。mirna还可靶向相应于靶向的mrna的基因组位点的甲基化。通常,与蛋白质的补体相关的mirna功能统称为mirnp。
[0323]
在某些方面中,本文描述的mirna分子的长度为约15-100、15-90、15-80、15-75、15-70、15-60、15-50或15-40个核苷酸,更通常地长度为约15-30、15-25或19-25个核苷酸,并且优选地长度为约20-24、21-22或21-23个核苷酸。在某些其他方面中,mirna分子可包含一个或多个修饰的核苷酸。作为一个非限制性实例,mirna序列可包含一个或多个以上针对sirna序列描述的修饰的核苷酸。在优选的实施方案中,mirna分子包含2’ome核苷酸例如像2’ome-鸟苷核苷酸、2’ome-尿苷核苷酸或其混合物。
[0324]
在一些实施方案中,mirna分子可用于使上述靶基因中的任一者的表达沉默,例如与病毒感染和存活相关的基因、与代谢疾病和病症相关的基因、与肿瘤发生和细胞转化相关的基因、血管生成基因、免疫调节基因(如与炎症性和自身免疫应答相关的基因)、配体受体基因以及与神经变性病症相关的基因。
[0325]
在其他实施方案中,使用本发明的脂质颗粒(例如,脂质纳米颗粒)施用阻断靶向目标mrna的mirna的活性的一种或多种剂。阻断剂的实例包括但不限于空间阻挡寡核苷酸、
锁核酸寡核苷酸以及吗啉代寡核苷酸。此类阻断剂可直接与mirna结合或与靶mrna上的mirna结合位点结合。
[0326]
反义寡核苷酸
[0327]
在一个实施方案中,核酸为涉及目标靶基因或序列的反义寡核苷酸。术语“反义寡核苷酸”或“反义”包括与靶向的多核苷酸序列互补的寡核苷酸。反义寡核苷酸为与选择的序列互补的dna或rna的单链。反义rna寡核苷酸通过与rna结合防止互补rna链的翻译。反义dna寡核苷酸可用来靶向特异性的互补(编码或非编码)rna。如果发生结合,此dna/rna杂交体可被酶rna酶h降解。在具体实施方案中,反义寡核苷酸包含约10至约60个核苷酸,更优选地约15至约30个核苷酸。术语还涵盖可能不与所需的靶基因精确互补的反义寡核苷酸。因此,本发明可用于使用反义发现非靶特异性活性的实例中,或其中与靶序列含有一个或多个错配的反义序列为最优选的具体使用的实例中。
[0328]
已证明反义寡核苷酸为蛋白质合成的有效且靶向的抑制剂,并且因此可用来通过靶向基因特异性地抑制蛋白质合成。反义寡核苷酸用于抑制蛋白质合成的功效为良好确立的。例如,通过涉及其对应的mrna序列的反义寡核苷酸抑制聚半乳糖醛酸酶(polygalactauronase)和毒蕈碱2型乙酰胆碱受体的合成(参见,美国专利号5,739,119和5,759,829)。此外,反义抑制的实例已证明有核蛋白细胞周期蛋白、多药耐药性基因(mdr1)、icam-1、e-选择蛋白、stk-1、纹状体gabaa受体以及人egf(参见,jaskulski等人,science,240:1544-6(1988);vasanthakumar等人,cancer commun.,1:225-32(1989);penis等人,brain res mol brain res.,15;57:310-20(1998);以及美国专利号5,801,154;5,789,573;5,718,709和5,610,288)。此外,反义构建体也已被描述抑制并且可用来治疗各种异常的细胞增殖例如癌症(参见,美国专利号5,747,470;5,591,317;以及5,783,683)。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0329]
产生反义寡核苷酸的方法为本领域中已知的并且可容易地适合产生靶向任何多核苷酸序列的反义寡核苷酸。对给定的靶序列特异性的反义寡核苷酸序列的选择基于选择的靶序列的分析和二级结构、tm、结合能以及相对稳定性的确定。可基于其相对不能形成二聚体、发夹或其它二级结构的能力选择反义寡核苷酸,所述结构将在宿主细胞中减少或禁止与靶mrna的特异性结合。mrna的高度优选的靶区包括处于或接近aug翻译起始密码子的那些区和与mrna的5’区基本上互补的那些序列。这些二级结构分析和靶位点选择考虑可以例如使用oligo引物分析软件v.4版(molecular biology insights)和/或blastn 2.0.5算法软件(altschul等任,nucleic acids res.,25:3389-402(1997))来进行。
[0330]
核酶
[0331]
根据本发明的另一个实施方案,脂质纳米颗粒与核酶缔合。核酶为具有拥有核酸内切酶活性的特异性催化结构域的rna-蛋白质复合体(参见,kim等人,proc.natl.acad.sci.usa.,84:8788-92(1987);和forster等人,cell,49:211-20(1987))。例如,大量核酶加速了高度特异性的磷酸酯转移反应,常常在寡核苷酸底物中仅裂解若干磷酸酯之一(参见,cech等人,cell,27:487-96(1981);michel等人,j.mol.biol.,216:585-610(1990);reinhold-hurek等人,nature,357:173-6(1992)))。此特异性归因于在化学反应之前经由特异性碱基配对相互作用的底物与核酶的内部引导序列(“igs”)结合的需要。
[0332]
目前已知天然存在的酶促rna分子的至少六种基本种类。每种均可在生理条件下
催化反式rna磷酸二酯键的水解(并且因此可裂解其他rna分子)。一般来说,酶性核酸通过首先结合于靶标rna来起作用。所述结合通过酶性核酸的靶标结合部分来发生,所述部分被保持紧密邻近于分子的起裂解靶标rna作用的酶性部分。因此,酶性核酸首先通过互补碱基配对来识别并接着结合靶标rna,并且一旦结合于恰当位点,即以酶促方式起切割靶标rna作用。策略性裂解所述靶标rna将破坏它的引导编码蛋白质的合成的能力。在酶性核酸已结合并裂解它的rna靶标之后,它自那个rna释放以搜索另一靶标,并且可重复结合并裂解新靶标。
[0333]
酶促核酸分子可在例如锤头、发夹、肝炎δ病毒、i组内含子或rna酶p rna(与rna引导序列相关)或脉孢菌属vs rna基序中形成。锤头基序的具体实例在例如rossi等人,nucleic acids res.,20:4559-65(1992)中描述。发夹基序的实例在例如ep 0360257;hampel等人,biochemistry,28:4929-33(1989);hampel等人,nucleic acids res.,18:299-304(1990);以及美国专利号5,631,359中描述。肝炎δ病毒基序的实例在例如perrotta等人,biochemistry,31:11843-52(1992)中描述。rna酶p基序的实例在例如guerrier-takada等人,cell,35:849-57(1983)中描述。脉孢菌属vs rna核酶基序的实例在例如saville等人,cell,61:685-96(1990);saville等人,proc.natl.acad.sci.usa,88:8826-30(1991);collins等人,biochemistry,32:2795-9(1993)中描述。i组内含子的实例在例如美国专利号4,987,071中描述。根据本发明使用的酶促核酸分子的重要特征是它们具有与一个或多个靶基因dna或rna区互补的特异性底物结合位点,并且它们在向分子施加rna裂解活性的底物结合位点内或在其周围具有核苷酸序列。因此,核酶构建体不需要限制于本文提到的具体基序。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0334]
产生靶向任何多核苷酸序列的核酶的方法为本领域中已知的。可如在例如pct公开号wo 93/23569和wo 94/02595中所描述设计核酶并且合成以如在其中所描述的在体外和/或体内测试。这些pct出版物的公开内容出于所有目的以引用的方式整体并入本文。
[0335]
核酶活性可通过改变核酶结合臂的长度或化学合成具有防止其被血清核糖核酸酶降解的修饰的核酶(参见,例如pct公开号wo 92/07065、wo 93/15187、wo 91/03162和wo 94/13688;ep 92110298.4;以及美国专利号5,334,711,所述专利描述了可对酶促rna分子的糖部分进行的各种化学修饰,所述专利的公开内容出于所有目的各自以引用的方式整体并入本文),增强其在细胞中的功效的修饰以及去除茎ii碱基以缩短rna合成时间和减少化学需要来优化。
[0336]
免疫刺激性寡核苷酸
[0337]
与本发明的脂质颗粒缔合的核酸可为免疫刺激性的,包括在向受试者施用时能够诱导免疫应答的免疫刺激性寡核苷酸(iss;单链或双链),所述受试者可为哺乳动物如人。iss包括例如导致发夹二级结构的某些回文序列(参见,yamamoto等人,j.immunol.,148:4072-6(1992))或cpg基序以及其他已知的iss特征(如多g结构域;参见pct公开号wo 96/11266,所述专利的公开内容出于所有目的以引用的方式整体并入本文)。
[0338]
免疫刺激性核酸被认为在不需要它们特异性结合靶序列和减少靶序列的表达以便引起免疫应答时为非序列特异性的。因此,某些免疫刺激性核酸可包含相应于天然存在的基因或mrna的区的序列,但是它们可仍然认为是非序列特异性的免疫刺激性核酸。
[0339]
在一个实施方案中,免疫刺激性核酸或寡核苷酸包含至少一个cpg二核苷酸。寡核
假尿苷、2-硫代-1-甲基-1-脱氮-假尿苷、二氢尿苷、二氢假尿苷、2-硫代-二氢尿苷、2-硫代-二氢假尿苷、2-甲氧基尿苷、2-甲氧基-4-硫代-尿苷、4-甲氧基-假尿苷和4-甲氧基-2-硫代-假尿苷。
[0346]
在一些实施方案中,修饰的核苷包括5-氮杂-胞苷、假异胞苷、3-甲基-胞苷、n4-乙酰基胞苷、5-甲酰基胞苷、n4-甲基胞苷、5-羟甲基胞苷、1-甲基-假异胞苷、吡咯并-胞苷、吡咯并-假异胞苷、2-硫代-胞苷、2-硫代-5-甲基-胞苷、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-脱氮-假异胞苷、1-甲基-1-脱氮-假异胞苷、泽布拉恩、5-氮杂-泽布拉恩、5-甲基-泽布拉恩、5-氮杂-2-硫代-泽布拉恩、2-硫代-泽布拉恩、2-甲氧基-胞苷、2-甲氧基-5-甲基-胞苷、4-甲氧基-假异胞苷和4-甲氧基-1-甲基-假异胞苷。
[0347]
在其他实施方案中,修饰的核苷包括2-氨基嘌呤、2,6-二氨基嘌呤、7-脱氮-腺嘌呤、7-脱氮-8-氮杂-腺嘌呤、7-脱氮-2-氨基嘌呤、7-脱氮-8-氮杂-2-氨基嘌呤、7-脱氮-2,6-二氨基嘌呤、7-脱氮-8-氮杂-2,6-二氨基嘌呤、1-甲基腺苷、n6-甲基腺苷、n6-异戊烯基腺苷、n6-(顺式-羟基异戊烯基)腺苷、2-甲硫基-n6-(顺式-羟基异戊烯基)腺苷、n6-甘氨酰基氨甲酰基腺苷、n6-苏氨酰基氨甲酰基腺苷、2-甲硫基-n6-苏氨酰基氨甲酰基腺苷、n6,n6-二甲基腺苷、7-甲基腺嘌呤、2-甲硫基-腺嘌呤和2-甲氧基-腺嘌呤。
[0348]
在具体实施方案中,修饰的核苷是5'-0-(l-硫代磷酸酯)-腺苷、5'-0-(1-硫代磷酸酯)-胞苷、5'-0-(1-硫代磷酸酯)-鸟苷、5'-0-(1-硫代磷酸酯)-尿苷或5'-0-(l-硫代磷酸酯)-假尿苷。提供α-硫代取代的磷酸酯部分以便通过非天然的硫代磷酸酯主链键联来对rna聚合物赋予稳定性。硫代磷酸酯rna具有增加的核酸酶抗性并且因此在细胞环境中具有更长的半衰期。预期硫代磷酸酯连接的核酸还通过细胞先天性免疫分子的较弱结合/激活来减少先天性免疫应答。
[0349]
在某些实施方案中,例如,如果需要精确的蛋白质生产时间,则希望在细胞内降解引入细胞中的修饰的核酸。因此,本发明提供一种含有降解结构域的修饰的核酸,所述降解结构域能够在细胞内以定向的方式被作用。
[0350]
在其他实施方案中,修饰的核苷包括肌苷、1-甲基-肌苷、怀俄苷、怀丁苷、7-脱氮-鸟苷、7-脱氮-8-氮杂-鸟苷、6-硫代-鸟苷、6-硫代-7-脱氮-鸟苷、6-硫代-7-脱氮-8-氮杂-鸟苷、7-甲基-鸟苷、6-硫代-7-甲基-鸟苷、7-甲基肌苷、6-甲氧基-鸟苷、1-甲基鸟苷、n2-甲基鸟苷、n2,n2-二甲基鸟苷、8-氧代-鸟苷、7-甲基-8-氧代-鸟苷、1-甲基-6-硫代-鸟苷、n2-甲基-6-硫代-鸟苷和n2,n2-二甲基-6-硫代-鸟苷。
[0351]
修饰的核酸的任选组分
[0352]
在其它实施方案中,修饰的核酸可包括其他任选的组分,其在一些实施方案中可以是有益的。这些任选的组分包括但不限于非翻译区、kozak序列、内含子核苷酸序列、内部核糖体进入位点(ires)、帽和polya尾。例如,可提供5'非翻译区(utr)和/或3'utr,其中任一者或两者可独立地含有一种或多种不同的核苷修饰。在此类实施方案中,核苷酸修饰还可存在于可翻译区中。还提供了含有kozak序列的核酸。
[0353]
另外,提供了含有一个或多个能够从核酸中切除的内含子核苷酸序列的核酸。
[0354]
非翻译区(utr)
[0355]
基因的非翻译区(utr)被转录但不被翻译。5'utr始于转录起始位点,并且继续至起始密码子,但不包括起始密码子;而3'utr在终止密码子之后立即开始,并且持续直到转
录终止信号。越来越多的证据表明,utr在核酸分子的稳定性和翻译方面起着调控作用。可将utr的调控特征并入本发明中使用的mrna中以增加分子的稳定性。在转录物被错误引导至所不希望的器官部位的情况下还可并入所述特定特征以确保转录物的受控下调。
[0356]
5'加帽
[0357]
mrna的5
′
帽结构涉及核输出,从而增加mrna稳定性,并且结合mrna帽结合蛋白(cbp),所述mrna帽结合蛋白通过cbp与聚(a)结合蛋白缔合以形成成熟的环状mrna物种来负责细胞中的mrna稳定性和翻译能力。所述帽在mrna剪接过程中进一步帮助去除5’近端内含子。
[0358]
内源性mrna分子可以是5'端加帽的,从而在末端鸟苷帽残基与mrna分子的5'末端转录的有义核苷酸之间产生5'-ppp-5'-三磷酸酯键联。这种5
’‑
鸟苷酸帽然后可被甲基化以便产生n7-甲基-鸟苷酸残基。mrna的5'端的末端和/或前末端转录的核苷酸的核糖也可任选地2'-o-甲基化。通过鸟苷酸帽结构的水解和裂解进行的5'-脱帽可靶向降解的核酸分子,如mrna分子。
[0359]
ires序列
[0360]
含有内部核糖体进入位点(ires)的mrna也可用于实施本发明。ires可用作唯一核糖体结合位点或可用作mrna的多个核糖体结合位点之一。含有多于一个功能性核糖体结合位点的mrna可编码独立地通过核糖体翻译的几种肽或多肽(“多顺反子mrna”)。当mrna具有ires时,进一步任选地提供第二可翻译区。可根据本发明使用的ires序列的实例包括但不限于来自以下病毒的那些:细小核糖核酸病毒(例如fmdv)、昆虫病毒(cffv)、脊髓灰质炎病毒(pv)、脑心肌炎病毒(ecmv)、口蹄疫病毒(fmdv)、丙型肝炎病毒(hcv)、典型猪瘟病毒(csfv)、鼠白血病病毒(mlv)、猿猴免疫缺陷病毒(s1v)或蟋蟀麻痹病毒(crpv)。
[0361]
poly-a尾
[0362]
在rna加工过程中,可将长链腺嘌呤核苷酸(poly-a尾)添加至多核苷酸如mrna分子以便增加稳定性。紧随转录之后,转录物的3'端可被裂解以释放3'羟基。然后poly-a聚合酶将腺嘌呤核苷酸链添加至rna。所述过程(称为多腺苷酸化)添加长度可介于100与250个残基之间的poly-a尾。
[0363]
一般而言,poly-a尾的长度大于30个核苷酸。在另一个实施方案中,poly-a尾在长度上大于35个核苷酸(例如,至少或大于约35、40、45、50、55、60、70、80、90、100、120、140、160、180、200、250、300、350、400、450、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2,000、2,500以及3,000个核苷酸)。
[0364]
在这种背景下,poly-a尾可在长度上大于修饰的mrna 10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。poly-a尾还可被设计为它所属的修饰的核酸的一部分。在这种背景下,poly-a尾可以是修饰的mrna的总长度或修饰的mrna减去poly-a尾的总长度的10%、20%、30%、40%、50%、60%、70%、80%或90%或更多。
[0365]
产生mrna分子
[0366]
用于分离rna、合成rna、杂交核酸、制造和筛选cdna文库以及进行pcr的方法是本领域中熟知的(参见例如,gubler和hoffman,gene,25:263-269(1983);sambrook等人,molecular cloning,a laboratory manual(第2版1989));pcr方法同样如此(参见,美国专利号4,683,195和4,683,202;pcr protocols:a guide to methods and applications
(innis等人,编辑,1990))。表达文库也是本领域技术人员熟知的。公开了在本发明中使用的一般方法的另外基础文章包括kriegler,gene transfer and expression:a laboratory manual(1990);和current protocols in molecular biology(ausubel等人,编辑,1994)。这些参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0367]
编码的多肽
[0368]
本文所述的脂质纳米颗粒的mrna组分可用于表达目标多肽。人的某些疾病是由其中蛋白质正常存在且具有活性的细胞类型中的功能性蛋白质的缺失或受损引起的。由于例如编码基因的转录失活或由于编码基因中存在使蛋白质完全或部分无功能的突变,因此功能性蛋白可完全或部分缺失。由蛋白质的完全或部分失活引起的人疾病的实例包括x连锁严重联合免疫缺陷症(x-scid)和肾上腺脑白质营养不良(x-ald)。x-scid是由编码共同的γ链蛋白的基因中的一个或多个突变引起的,所述基因是参与免疫系统中b细胞和t细胞的发育和成熟的几种白细胞介素受体的组分。x-ald是由称为abcd1的过氧化物酶体膜转运蛋白基因中的一个或多个突变引起的。患有x-ald的个体在整个身体的组织中都具有非常高水平的长链脂肪酸,其导致可能导致精神障碍或死亡的多种症状。
[0369]
已经尝试使用基因疗法来治疗由其中蛋白质正常存在且具有活性的细胞类型中的功能性蛋白质的缺乏或损害所引起的一些疾病。基因治疗通常包括将包含编码受影响蛋白质的功能形式的基因的载体引入患病的人,并且表达所述功能性蛋白质以治疗所述疾病。迄今为止,基因治疗取得了有限的成功。另外,例如在国际公开号wo 2018/006052和wo 2015/011633中描述了使用lnp递送mrna的某些方面。
[0370]
如此,持续需要改进以在患有由功能性蛋白的完全或部分缺失引起的疾病的人中表达蛋白质的功能性形式,并且需要通过例如可触发更少的对疗法的免疫应答的方法和组合物进行的改进的核酸(例如,mrna)递送。本发明的某些实施方案在此背景下是有用的。因此,在某些实施方案中,多肽的表达改善疾病或病症的一种或多种症状。本发明的某些组合物和方法可用于治疗由人体内功能性多肽的缺乏或水平降低引起的人疾病。在其他实施方案中,本发明的某些组合物和方法可用于表达用于治疗癌症的疫苗抗原。
[0371]
自我扩增rna
[0372]
在某些实施方案中,核酸是一种或多种自我扩增rna分子。自我扩增rna(sa-rna)也可称为自我复制rna、具有复制能力的rna、复制子或reprna。reprna(称为自我扩增mrna)当来源于正链病毒时,是从缺乏至少一种结构基因的病毒基因组产生的;它可翻译和复制(因此“自我扩增”)而不会产生传染性子代病毒。在某些实施方案中,reprna技术可用于插入编码所需目标抗原的基因盒。例如,甲病毒基因组被分为两个开放阅读框(orf):第一orf编码rna依赖性rna聚合酶(复制酶)的蛋白,并且第二orf编码结构蛋白。在sa-rna疫苗构建体中,编码病毒结构蛋白的orf可用任何选择的抗原替代,而病毒复制酶仍然是疫苗的组成部分,并且在免疫后驱动rna的细胞内扩增。
[0373]
脂质颗粒的制备
[0374]
在某些实施方案中,本发明提供了经由连续混合方法产生的lnp,所述连续混合物方法是例如包括以下步骤的方法:在第一储罐中提供包含核酸的水溶液,在第二储罐中提供有机脂质溶液,以及将所述水溶液与所述有机脂质溶液混合,使得所述有机脂质溶液与所述水溶液混合,从而基本上瞬时产生包封核酸(例如,干扰rna或mrna)的脂质体。这种方
法和用于进行这种方法的装置在美国专利公布号20040142025中详细描述,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0375]
连续将脂质和缓冲溶液引入到混合环境中如在混合室中的动作引起用缓冲溶液连续稀释脂质溶液,从而当混合时基本上瞬时产生脂质体。如本文所使用,短语“用缓冲溶液连续稀释脂质溶液”(和变化)通常意指用足够实现囊泡产生的力在水合过程中充分快速地稀释脂质溶液。在存在缓冲溶液(即,水溶液)的情况下通过使包含核酸的水溶液与有机脂质溶液混合有机脂质溶液经历连续逐步稀释以产生脂质纳米颗粒。
[0376]
使用连续混合方法形成的lnp通常具有约40nm至约150nm、约50nm至约150nm、约60nm至约130nm、约70nm至约110nm或约70nm至约90nm的大小。因此所形成的颗粒不会聚集并且任选地大小设定为实现均匀的粒度。
[0377]
在另一个实施方案中,本发明提供了经由直接稀释方法产生的lnp,所述直接稀释方法包括形成脂质体溶液和立即并直接将所述脂质体溶液引入到含有控制量的稀释缓冲液的收集容器中。在优选的方面中,收集容器包括一个或多个被配置成搅拌收集容器的内容物以稀释的元件。在一个方面中,存在于收集容器中的稀释缓冲液的量基本上等于引入其中的脂质体溶液的体积。作为非限制性实例,当引入到含有相等体积的稀释缓冲液的收集容器中时,在45%乙醇中的脂质体溶液将有利地产生更小的颗粒。
[0378]
在另一个实施方案中,本发明提供了经由直接稀释方法产生的lnp,其中含有稀释缓冲液的第三储罐流体联接至第二混合区。在此实施方案中,在第一混合区中形成的脂质体溶液立即并直接与第二混合区中的稀释缓冲液混合。在优选的方面中,第二混合区包括t-连接器,所述t-连接器被布置以使得脂质体溶液流和稀释缓冲液流相遇呈反向180
°
流动;然而,可使用例如约27
°
至约180
°
的提供更小角度的连接器。泵机构将可控流量的缓冲液递送至第二混合区。在一个方面中,提供至第二混合区的稀释缓冲液的流速控制为基本上等于从第一混合区将脂质体溶液引入其中的流速。此实施方案有利地允许对与第二混合区中的脂质体溶液混合的稀释缓冲液的流量的更多控制,并且因此还控制整个第二混合过程中的缓冲液中的脂质体溶液的浓度。对稀释缓冲液流速的此种控制有利地允许在减少的浓度下的小的粒度形成。
[0379]
这些方法和用于进行这些直接稀释方法的装置在美国专利公开号20070042031中详细描述,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0380]
使用直接稀释方法形成的lnp通常具有约40nm至约150nm、约50nm至约150nm、约60nm至约130nm、约70nm至约110nm或约70nm至约90nm的大小。因此所形成的颗粒不会聚集并且任选地大小设定为实现均匀的粒度。
[0381]
如果需要,本发明的脂质颗粒(例如,lnp)可通过可供用于设定脂质体大小的任何方法来设定大小。可进行设定大小以便实现所需的大小范围和相对窄的粒度分布。
[0382]
若干技术可供用于将颗粒的大小设定为所需的大小。用于脂质体并且同等可适用于本发明颗粒的一种设定大小的方法在美国专利号4,737,323中描述,所述专利的公开内容出于所有目的以引用的方式整体并入本文。通过浴或探针超声对颗粒悬浮液超声产生了大小逐渐减小至大小小于约50nm的颗粒。均质化为依赖于剪切能量将更大的颗粒破碎成更小的颗粒的另一种方法。在通常的均质化工序中,颗粒流通穿过标准的乳液均化器直到观察到选择的粒度,通常在约60nm与约80nm之间。在这两种方法中,粒度分布可通过常规的激
光束粒度鉴别或qels来监测。
[0383]
通过小孔聚碳酸酯膜或不对称陶瓷膜将颗粒挤出也是用于将粒度减小至相对明确定义的大小分布的有效方法。通常,悬浮液循环穿过膜一次或多次直到实现所需的粒度分布。可通过孔越来越小的膜挤出颗粒来实现大小逐渐减小。
[0384]
在一些实施方案中,lnp中的核酸是如例如美国专利申请序列号09/744,103中所描述进行预缩合,所述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0385]
在其它实施方案中,所述方法将进一步包括使用本发明组合物添加有用于实现细胞脂转染的非脂质聚阳离子。适合的非脂质聚阳离子的实例包括海美溴铵(hexadimethrine bromide)(以商品名出售,来自aldrich chemical co.,milwaukee,wis.,usa)或海地美铵的其它盐。其他适合的聚阳离子包括例如聚-l-鸟氨酸、聚-l-精氨酸、聚-l-赖氨酸、聚-d-赖氨酸、聚丙烯胺以及聚乙烯亚胺的盐。这些盐的加入优选地在颗粒已形成之后。
[0386]
脂质颗粒的施用
[0387]
一旦形成,本发明的脂质颗粒(例如,lnp)可用于将核酸引入细胞中。因此,本发明还提供了用于将核酸(例如,干扰rna或mrna)引入到细胞中的方法。通过首先形成如上所述的颗粒并且然后使颗粒与细胞接触足够用于发生核酸递送至细胞的一段时间来体外或体内进行所述方法。
[0388]
本发明的脂质颗粒(例如,lnp)可被吸收至几乎与其混合或接触的任何细胞类型中。一旦吸收,颗粒可被细胞的一部分内吞,与细胞膜交换脂质,或与细胞融合。颗粒的核酸(例如,核酸)部分的转移或掺入可经由这些途径中的任何一种来发生。具体地说,当融合发生时,颗粒膜并入细胞膜中并且颗粒的内容物与细胞内流体组合。
[0389]
本发明的脂质颗粒(例如,lnp)可单独地或与根据施用途径和标准药物实践选择的药学上可接受的载体(例如,生理盐水或磷酸盐缓冲液)混合施用。通常,生理缓冲盐水(例如,135-150mm nacl)将采用作为药学上可接受的载体。其他适合的载体包括例如水、缓冲水、0.4%盐水、0.3%甘氨酸等,包括用于增强稳定性的糖蛋白,如白蛋白、脂蛋白、球蛋白等。另外合适的载体在例如remington's pharmaceutical sciences,mack publishing company,philadelphia,pa.,第17版(1985)中描述。如本文所使用,“载体”包括任何和所有的溶剂、分散介质、媒介物、包衣、稀释剂、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂、缓冲剂、载体溶液、悬浮液、胶体等。短语“药学上可接受的”是指当向人施用时不会产生过敏或类似不良反应的分子实体和组合物。
[0390]
药学上可接受的载体通常在颗粒形成后添加。因此,在颗粒形成后,可将颗粒稀释到药学上可接受的载体如生理缓冲盐水中。
[0391]
药物制剂中的颗粒浓度可广泛变化,即从小于约0.05重量%,通常在或至少约2重量%至5重量%至多达约10重量%至90重量%,并且将根据所选择的具体施用方式主要通过流体体积、粘度等来选择。例如,可增加浓度以降低与治疗相关的流体负荷。这可在患有动脉粥样硬化相关的充血性心力衰竭或严重高血压的患者中是特别可取的。或者,可将主要由刺激性脂质组成的颗粒稀释至低浓度以减少施用部位上的炎症。
[0392]
本发明的药物组合物可通过常规熟知的灭菌技术来灭菌。可将水性溶液进行包装以期使用或在无菌条件下过滤并冻干,冻干制剂在施用之前与无菌水溶液混合。当需要接
近生理条件时,组合物可含有药学上可接受的辅助物质,如ph调节剂和缓冲剂、张力调节剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾以及氯化钙。另外,颗粒悬浮液可包括在储存时保护脂质不受自由基和脂质过氧化损害的脂质保护剂。亲脂性自由基淬灭剂如α生育酚和水溶性铁特异性螯合剂如铁草胺为适合的。
[0393]
体内施用
[0394]
使用核酸-脂质颗粒如在pct公开号wo 05/007196、wo 05/121348、wo 05/120152和wo 04/002453中描述的那些已实现了用于体内疗法的系统递送,例如经由身体系统如循环将治疗性核酸递送至远端靶细胞,所述专利的公开内容出于所有目的以引用的方式整体并入本文。本发明还提供了完全包封的脂质颗粒,其保护核酸不受血清中的核酸酶降解、为非免疫原性的、尺寸小的并且适用于重复给药。
[0395]
针对体内施用,施用可以本领域中已知的任何方式,例如通过注射、口服施用、吸入(例如,鼻内或气管内)、透皮涂敷或直肠施用。施用可经由单次剂量或分开剂量来完成。药物组合物可胃肠外即关节内、静脉内、腹膜内、皮下或肌肉内施用。在一些实施方案中,药物组合物通过团注静脉内或腹膜内施用(参见,例如美国专利号5,286,634)。细胞内核酸递送还讨论于straubringer等人,methods enzymol.,101:512(1983);mannino等人,biotechniques,6:682(1988);nicolau等人,crit.rev.ther.drug carrier syst.,6:239(1989);和behr,acc.chem.res.,26:274(1993)中。施用基于脂质的治疗剂的其它方法在例如美国专利号3,993,754;4,145,410;4,235,871;4,224,179;4,522,803以及4,588,578中描述。脂质颗粒可通过在疾病部位处直接注射或通过在远离疾病部位的部位处注射来施用(参见,例如culver,human gene therapy,maryann liebert inc.,,publishers,new york.第70-71页(1994))。上述参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0396]
单独或与其他适合的组分组合的本发明组合物可制成有待经由吸入(例如,鼻内或气管内)施用的气雾剂制剂(即,它们可被“雾化”)(参见,brigham等人,am.j.sci.,298:278(1989))。气雾剂制剂可被置于加压可接受的推进剂中,如二氯二氟甲烷、丙烷、氮等。
[0397]
在某些实施方案中,药物组合物可通过鼻内喷雾、吸入和/或其他气雾剂递送媒介物来递送。用于经由鼻气雾剂喷雾直接将核酸组合物递送至肺的方法已描述于例如美国专利号5,756,353和5,804,212中。同样,使用鼻内微粒树脂和溶血磷脂酰-甘油化合物递送药物(美国专利号5,725,871)在药学领域中也是熟知的。类似地,以聚四氟乙烯载体基质形式的透粘膜药物递送在美国专利号5,780,045中描述。上述专利的公开内容出于所有目的以引用的方式整体并入本文。
[0398]
适用于胃肠外施用例如像通过关节内(在关节中)、静脉内、肌肉内、皮内、腹膜内以及皮下途径的制剂包括水性和非水性的等渗无菌注射溶液,其可含有抗氧化剂、缓冲剂、抑菌剂和使制剂与所预期的受体的血液等渗的溶质;和水性和非水性的无菌悬浮液,其可包括悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。在本发明的实践中,组合物优选地例如通过静脉内输注、口服、局部、腹膜内、膀胱内或鞘内施用。
[0399]
通常,当静脉内施用时,脂质颗粒制剂用适合的药物载体配制。许多药学上可接受的载体可在本发明的组合物和方法中采用。用于本发明的适合制剂例如在remington's pharmaceutical sciences,mack publishing company,philadelphia,pa.,第17版(1985)
中找到。可使用各种水性载体,例如水、缓冲水、0.4%盐水、0.3%甘氨酸等,并且可包括用于增强稳定性的糖蛋白,如白蛋白、脂蛋白、球蛋白等。通常,生理缓冲盐水(135mm-150mm nacl)将采用作为药学上可接受的载体,但其它适合的载体也将满足需要。这些组合物可通过常规脂质体灭菌技术如过滤来灭菌。当需要接近生理条件时,组合物可含有药学上可接受的辅助物质,如ph调节剂和缓冲剂、张力调节剂、湿润剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯等。可使用以上提到的技术对这些组合物进行灭菌,或者可替代地这些组合物可在无菌条件下产生。所得到的水溶液可包装使用或在无菌条件下过滤并且冻干,冻干的制剂在施用之前与无菌水溶液组合。
[0400]
在某些应用中,本文公开的脂质颗粒可经由口服施用向个体递送。颗粒可与赋形剂合并并且以可摄取片剂、颊部片剂、锭剂、胶囊剂、丸剂、糖锭、酏剂、漱口水、混悬剂、口服喷雾剂、糖浆剂、晶片等形式使用(参见,例如美国专利号5,641,515、5,580,579以及5,792,451,所述专利的公开内容出于所有目的以引用的方式整体并入本文)。这些口服剂型还可以含有以下物质:粘合剂、明胶;赋形剂、润滑剂和/或调味剂。当单位剂型为胶囊剂时,它可含有除了以上描述的材料以外的液体载体。各种其他材料可作为包衣存在或以其他方式修饰剂量单位的物理形式。当然,用于制备任何单位剂型的任何材料应该为药物纯的并且在所采用的量的情况下基本上无毒。
[0401]
通常,这些口服制剂可含有至少约0.1%的脂质颗粒或更多,虽然颗粒的百分比当然可改变并且可常规上为总制剂的重量或体积的约1%或2%与约60%或70%或更多之间。自然地,可适合剂量将在化合物的任何给定单位剂量中获得的方式制备每个治疗有用的组合物中的颗粒的量。制备此类药物制剂的领域中的技术人员将想到如溶解度、生物利用度、生物半衰期、施用途径、产品有效期的因素以及其他药理学考虑,并且同样地,各种剂量和治疗方案可以是可取的。
[0402]
适用于口服施用的制剂可由以下组成:(a)液体溶液,如有效量的悬浮在稀释剂如水、盐水或peg 400中的包装的治疗剂如核酸(例如,干扰rna或mrna);(b)胶囊剂、小药囊剂或片剂,每种均含有呈液体、固体、细粒或明胶形式的预先确定的量的治疗剂如核酸(例如,干扰rna或mrna);(c)在适当液体中的悬浮液;以及(d)适合的乳液。片剂形式可包含以下中的一者或多者:乳糖、蔗糖、甘露糖醇、山梨糖醇、磷酸钙、玉米淀粉、土豆淀粉、微晶纤维素、明胶、胶态二氧化硅、滑石、硬脂酸镁、硬脂酸和其它赋形剂、着色剂、填充剂、粘合剂、稀释剂、缓冲剂、湿润剂、防腐剂、调味剂、染料、崩解剂以及药学上相容的载体。糖锭形式可以包含在香料例如蔗糖中的治疗剂如核酸(例如,干扰rna或mrna)以及在惰性基质如明胶和甘油或蔗糖中包含治疗剂的锭剂和除了治疗剂以外含有本领域中已知的载体的阿拉伯树胶乳液、凝胶等。
[0403]
在其使用的另一个实例中,脂质颗粒可并入广范围的局部剂型中。例如,含有核酸-脂质颗粒如lnp的悬浮液可配制成凝胶、油、乳液、局部霜剂、糊剂、软膏、洗剂、泡沫、摩丝等形式并且以所述形式施用。
[0404]
当制备本发明的脂质颗粒的药物制剂时,优选使用大量已纯化减少或消除空颗粒或具有治疗剂如与外表面缔合的核酸的颗粒的这些颗粒。
[0405]
本发明的方法可在各种宿主中实践。优选的宿主包括哺乳动物种类,如灵长类动物(例如,人和黑猩猩以及其他非人灵长类动物)、犬、猫、马、牛、绵羊、山羊、啮齿动物(例
如,大鼠和小鼠)、兔类动物以及猪。
[0406]
所施用的颗粒的量将取决于治疗剂(例如,核酸)与脂质的比率、所使用的具体治疗剂(例如,核酸)、治疗的疾病或病症、患者的年龄、重量和病状以及临床医生的判断,但是通常将在约0.01mg/kg体重与约50mg/kg体重之间,优选地约0.1mg/kg体重与约5mg/kg体重之间,或每次施用(例如,注射)约10
8-10
10
个颗粒。
[0407]
体外施用
[0408]
针对体外应用,治疗剂如核酸(例如,干扰rna或mrna)可递送至培养生长的任何细胞,无论具有植物或动物来源、脊椎动物或无脊椎动物以及具有任何组织或类型。在优选的实施方案中,细胞是动物细胞,更优选地哺乳动物细胞,并且最优选地人细胞。
[0409]
当体外进行时细胞与脂质颗粒之间的接触发生在生物相容的培养基中。颗粒的浓度广泛取决于具体应用而改变,但是通常在约1μmol与约10mmol之间。通常在生理温度(约37℃)下进行用脂质颗粒对细胞的治疗,持续约1至48小时、优选地约2至4小时的时间段。
[0410]
在一组优选的实施方案中,将脂质颗粒悬浮液添加至细胞密度为约103至约105个细胞/ml、更优选地约2
×
104个细胞/ml的60%-80%汇合的涂铺细胞中。添加至细胞中的悬浮液的浓度优选地为约0.01μg/ml至0.2μg/ml,更优选地约0.1μg/ml。
[0411]
使用内体释放参数(erp)测定,可优化本发明的lnp或其他脂质颗粒的递送效率。erp测定在美国专利公开号20030077829中详细描述,所述专利的公开内容出于所有目的以引用的方式整体并入本文。更具体地,erp测定的目的在于基于其对内体膜的结合/吸收或融合/去稳定的相对作用区分lnp的各种阳离子脂质和协助脂质组分的作用。此测定允许人们定量确定lnp或其他脂质颗粒的每种组分如何影响递送效率,从而优化lnp或其他脂质颗粒。通常,erp测定测量报告蛋白质(例如,荧光素酶、β-半乳糖苷酶、绿色荧光蛋白(gfp)等)的表达,并且在一些实例中,针对表达质粒优化的lnp制剂也将适用于包封干扰rna或mrna。在其它实例中,erp测定可适用于测量干扰rna(例如,sirna)存在或不存在情况下的靶序列的转录或翻译的下调。在其他实例中,erp测定可适用于测量在存在或不存在mrna的情况下靶蛋白的表达。通过比较各种lnp或其他脂质颗粒中的每一种的erp,人们可容易地确定优化的系统,例如在细胞中具有最大吸收的lnp或其他脂质颗粒。
[0412]
用于递送脂质颗粒的细胞
[0413]
本发明的组合物和方法用来体内和体外治疗各种各样的细胞类型。合适的细胞包括例如造血前体(干)细胞、成纤维细胞、角质形成细胞、肝细胞、内皮细胞、骨骼肌和平滑肌细胞、成骨细胞、神经元、休眠淋巴细胞、终末分化细胞、慢循环或不循环原代细胞、实质细胞、淋巴样细胞、上皮细胞、骨细胞等。在一个实施方案中,将核酸如一种或多种核酸分子(例如,干扰rna(例如sirna)或mrna)递送至癌细胞,例如像肺癌细胞、结肠癌细胞、直肠癌细胞、肛门癌细胞、胆管癌细胞、小肠癌细胞、胃(胃的)癌细胞、食管癌细胞、胆囊癌细胞、肝癌细胞、胰腺癌细胞、阑尾癌细胞、乳腺癌细胞、卵巢癌细胞、宫颈癌细胞、前列腺癌细胞、肾癌细胞、中枢神经系统的癌细胞、成胶质细胞瘤肿瘤细胞、皮肤癌细胞、淋巴瘤细胞、绒毛膜癌肿瘤细胞、头颈癌细胞、骨原性肉瘤肿瘤细胞以及血癌细胞。
[0414]
脂质体颗粒的体内递送,如包封一种或多种核酸分子(例如,干扰rna(例如,sirna)或mrna)的lnp适合于靶向任何细胞类型的细胞。可针对各种各样的脊椎动物采用本发明的方法和组合物,所述脊椎动物包括哺乳动物例如像犬、猫、马、牛、绵羊、山羊、啮齿动
protocols,greene publishing associates,inc.and john wiley&sons,inc.(2002);以及美国专利号4,683,202;pcr protocols,a guide to methods and applications(innis等人编辑)academic press inc.san diego,calif.(1990);arnheim和levinson(1990年10月1日),c&en 36;the journal of nih research,3:81(1991);kwoh等人,proc.natl.acad.sci.usa,86:1173(1989);guatelli等人,proc.natl.acad.sci.usa,87:1874(1990);lomell等人,j.clin.chem.,35:1826(1989);landegren等人,science,241:1077(1988);van brunt,biotechnology,8:291(1990);wu和wallace,gene,4:560(1989);barringer等人,gene,89:117(1990);and sooknanan and malek,biotechnology,13:563(1995)中找到。体外克隆扩增的核酸的改进方法描述于美国专利号5,426,039中。在本领域中描述的其他方法为基于核酸序列的扩增(nasba
tm
,cangene,mississauga,ontario)和qβ-复制酶系统。这些系统可用来直接鉴定其中存在选择序列时pcr或lcr引物仅设计为延伸或连接的突变体。或者,通常可使用例如非特异性pcr引物和后来探测指明突变的特异性序列的扩增的靶区来扩增选择序列。上述参考文献的公开内容出于所有目的以引用的方式整体并入本文。
[0424]
用作例如在体外扩增方法中的探针、用作基因探针或作为抑制剂组分的核酸通常根据beaucage等人,tetrahedron letts.,22:1859 1862(1981)所描述的固相亚磷酰胺三酯方法,例如使用如在needham vandevanter等人,nucleic acids res.,12:6159(1984)中描述的自动合成器来化学合成。在必要的情况下,通常通过天然丙烯酰胺凝胶电泳或通过如在pearson等人,j.chrom.,255:137 149(1983)中描述的阴离子交换hplc来进行多核苷酸的纯化。可使用grossman和moldave(编辑)academic press,new york,methods in enzymology,65:499中maxam和gilbert(1980)的化学降解方法验证合成多核苷酸的序列。
[0425]
用于确定转录水平的替代方式为原位杂交。原位杂交测定为熟知的并且通常描述于angerer等人,methods enzymol.,152:649(1987)中。在原位杂交测定中,细胞被固定至固体载体,通常为载玻片。如果探测dna,用加热或碱使细胞变性。然后在中等温度下使细胞与杂交溶液接触以容许标记的特异性探针退火。探针优选地用放射性同位素或荧光报告分子标记。
[0426]
实施例
[0427]
将通过具体实施例来更详细地描述本发明。下列实施例是出于说明目的而提供,且不欲以任何方式限制本发明。
[0428]
实施例
[0429]
实施例1
[0430]
可用于递送核酸的脂质纳米颗粒制剂通常采用peg-脂质缀合物,其有助于在lnp制造过程中控制粒度并防止施用后在小瓶中和血液中的不想要的聚集。它还有助于防止血液中的不想要的调理作用。这些peg-脂质缀合物使用mw为约2000的peg聚合物组分是非常典型的。所述缀合物使用包含2个c
14
链的脂质部分并且这些peg-脂质缀合物以0.5%至2%的摩尔比(相对于所述组合物中的其他脂质)使用也是典型的。如本文所述,已经开发了新的制剂,所述制剂使用不同于通常使用的那些、以不同量使用的peg-脂质缀合物结构以为脂质纳米颗粒提供有益性质。
[0431]
因此,已鉴定出新的lnp组合物,所述组合物显示出比基准组合物显著更好的效
力。基准是patisiran(其是第一种获批的rnai产品)中使用的脂质组合物,所述组合物经常用作黄金标准基准。patisiran是用于治疗患有遗传性甲状腺素运载蛋白介导的淀粉样变性的人的多神经病的药物。它是含有sirna有效负载的lnp产品,其靶向异常形式的甲状腺素运载蛋白的产生。它是第一种获得fda批准的基于小分子干扰rna的药物。基准比较组合物采用式cl2的阳离子脂质、具有peg mw 2000的peg-脂质和2xc
14
脂质锚。这种peg-脂质占制剂的1.5mol%。相比之下,本文所述的脂质纳米颗粒制剂含有peg脂质,所述peg脂质的peg mw为500-1000,摩尔比为2%至5%;并且peg聚合物大小为5000-20000,摩尔比为0.2%至0.5%。
[0432]
实验
[0433]
脂质溶液含有4种组分:peg缀合脂质、可电离脂质、胆固醇和磷脂(例如,dspc)。使用如本文所述的脂质特性和摩尔比制备脂质储备液,以在100%乙醇中达到约7mg/ml的总浓度。将mrna(人促红细胞生成素)在乙酸盐(ph 5)缓冲液和不含核酸酶的水中稀释,以在100mm乙酸盐(ph 5)中达到0.366mg/ml mrna的目标浓度。通过t-连接器中将等体积的脂质和核酸溶液以400ml/min的流速掺混,并用约4体积的pbs(ph 7.4)稀释。然后将制剂置于slide-a-lyzer透析单元(mwco 10,000)中,并用10mm tris、500mm nacl(ph 8)缓冲液透析过夜。透析后,使用vivaspin浓缩器单元(mwco 100,000)将制剂浓缩至约0.6mg/ml,并且通过0.2μm注射器过滤器(pes膜)过滤。通过ribogreen测定确定核酸浓度。
[0434]
在实验中描述的制剂中使用的阳离子脂质是式cl1的化合物:
[0435][0436]
在基准比较制剂中使用的阳离子脂质是式cl2的化合物:
[0437][0438]
这些阳离子脂质中的每一者都是也可用于当前描述的脂质纳米颗粒及其制剂中的阳离子脂质的实例。
[0439]
通常,将lnp制剂以0.5mg/kg静脉内注射至雌性balb/c小鼠(5-8周龄)。就在注射之前,将lnp储备液稀释至所需的给药浓度。对于用epo mrna-lnp给药的动物,在给药后2-24小时收集血液。在终点时间点,用致死剂量的氯胺酮/甲苯噻嗪对动物实施安乐死。将所有血液样品收集到k2edta中并加工成血浆,然后在-80℃下冷冻保存直至分析。
[0440]
根据制造商的说明书,使用人epo elisa试剂盒(stemcell technologies,目录号01630或r&d systems,目录号dep00)测定血浆中的人促红细胞生成素(epo)活性。
[0441]
表1.含有人epo mrna和各种peg缀合脂质的0.5mg/kg lnp在balb/c小鼠(n=4)中静脉内给药后2小时、6小时和24小时的功效
[0442][0443][0444]
表2. 0.5mg/kg含有分子量为750-2000的peg缀合脂质的人epo mrna-lnp在静脉内给药后在balb/c小鼠(n=4)中的功效
[0445][0446]
表3. 0.5mg/kg含有分子量为2000-10000的peg缀合脂质的人epo mrna-lnp在静脉内给药后在balb/c小鼠(n=4)中的功效
[0447]
[0448][0449]
表4. 0.5mg/kg含有分子量为550-10000的peg缀合脂质的人epo mrna-lnp在静脉内给药后在balb/c小鼠(n=4)中的功效
[0450][0451]
如上所述,lnp组合物通常包含具有2000mw peg聚合物和2xc
14
脂质锚链的peg脂质.此类peg-脂质经常以约0.5至2mol%的量使用,如patisiran的情况。本文描述了具有以不同量使用的不同类型的peg-脂质的新组合物。新组合物采用与通常使用的相比具有更小(500至1000)或更大(5000至20000)mw的peg-脂质缀合物。当使用较小mw peg聚合物时,使用了大于标准量的peg-脂质。当使用较大mw peg聚合物时,使用了小于标准量的peg脂质。在绝大多数情况下,这些制剂比patisiran中使用的基准组合物显著更有效。
[0452]
peg-脂质和用于制备peg脂质的合成方法在下文描述。
[0453]
[0454]
[0455][0456]
peg-脂质实验
[0457][0458] c8c
10c12c14c16
peg550
‑‑‑‑
7a
‑‑‑‑‑‑‑‑‑‑‑‑
peg7507b7c7d7e
‑‑‑‑
peg2000
‑‑‑‑‑‑‑‑‑‑‑‑
7f
‑‑‑‑
peg5000
‑‑‑‑‑‑‑‑‑‑‑‑
7g7hpeg10000
‑‑‑‑‑‑‑‑‑‑‑‑
7i7j
[0459]
方案1:peg脂质的一般合成
[0460][0461]
将二碳酸二叔丁酯(14.23g,65.2mmol)于ch2cl2(40ml)中的溶液添加至3-氨基-1,2-丙二醇1(5.4g,59.3mmol)于ch3oh(40ml)中的搅拌溶液。在搅拌(18小时)后,将反应混合物浓缩至干,得到2(11.25g,99%),并且无需进一步加工即使用。rf 0.6(10%ch3oh-ch2cl2)kmno4染色剂。
[0462]
用于制备二烷基丙胺-tfa盐4的两步方案
[0463]
步骤1:
[0464][0465]
将2(1g,5.23mmol)、1-溴辛烷(3.03g,15.7mmol)和tbahs(0.89g,2.62mmol)于甲苯(20ml)中的溶液冷却(0℃)并用naoh(15ml,50%w/v)处理。剧烈搅拌双相混合物(18小时,室温)。将混合物用水稀释并用己烷萃取(2x),然后将合并的有机物用盐水洗涤,干燥(mgso4),过滤并浓缩。对粗物质进行色谱法,得到呈浅黄色油状的3a(1.25g,57%)。rf 0.45(10%etoac-己烷)cuso4染色剂。
[0466]
步骤2:
[0467][0468]
将3a(1.23g,2.96mmol)于ch2cl2(5ml)中的溶液用tfa(4.56ml,59.18mmol)处理。搅拌(2小时,室温)后,将反应混合物浓缩至干,得到呈tfa盐形式的4a(1.25g,定量),并且其无需进一步加工即使用。rf 0.4(10%ch2cl
2-ch3oh)cuso4染色剂。
[0469]
2,3-双(癸氧基)丙-1-胺-tfa盐4b
[0470]
二癸氧基胺4b以与4a相同的方式由溴癸烷(3.47g,15.7mmol)、2(1g,5.3mmol)、tbahs(0.89g,2.62mmol)、然后tfa(3.82ml,49.6mmol)制备,得到呈无色油状的4b(1.5g,93%)。
[0471]
2,3-双(月桂氧基)丙-1-胺-tfa盐4c
[0472]
双十二烷氧基胺4c以与4a相同的方式由溴十二烷(3.91g,15.7mmol)、2(1g,5.3mmol)、tbahs(0.89g,2.62mmol)、然后tfa(2.44ml,31.83mmol)制备,得到呈无色油状的4c(0.45g,93%)。
[0473]
2,3-双(十四烷氧基)丙-1-胺-tfa盐4d
[0474]
双十四烷氧基胺4d以与4a相同的方式由溴十四烷(21.75g,78.45mmol)、2(5g,26.15mmol)、tbahs(4.44g,13.1mmol)、然后tfa(16.3ml,212mmol)制备,得到呈白色蜡状固体的4d(8.3g,定量)。
[0475]
2,3-双(十六烷氧基)丙-1-胺-tfa盐4e
[0476]
将双十六烷氧基胺4e以与4a相同的方式由溴十六烷(46.1g,151mmol)、2(9.65g,50.4mmol)、tbahs(8.56g,25.2mmol)、然后tfa(37.9ml,492mmol)制备,得到呈白色固体的4e(21g,定量)。
[0477]
用于制备peg-碳酸琥珀酰亚胺酯6的一般程序
(15ml)中的溶液用tea(0.78ml,5.59mmol)处理。搅拌(18小时,室温)后,将溶液浓缩并进行色谱法,得到呈蜡状白色固体的7c(0.8g,51%)。rf 0.75(10%ch3oh-ch2cl2)cuso4染色剂。1h nmr(400mhz,cdcl3)5.18-5.09(m,1h),4.26-4.18(m,2h),3.70-3.60(m,60h),3.58-3.52(m,3h),3.51-3.39(m,8h),3.37(s,3h),1.59-1.49(m,4h),1.36-1.18(m,32h),0.88(t,6h)。
[0487][0488]
将甲氧基peg
750-sc 6b(0.87g,0.971mmol)和dla 4c(0.5g,0.925mmol)于ch2cl2(15ml)中的溶液用tea(0.515ml,3.7mmol)处理。搅拌(18小时,室温)后,将溶液浓缩并进行色谱法,得到呈蜡状白色固体的7d(0.728g,61%)。rf 0.75(10%ch3oh-ch2cl2)cuso4染色剂。1h nmr(400mhz,cdcl3)5.18-5.09(m,1h),4.28-4.16(m,2h),3.72-3.56(m,60h),3.56-3.52(m,4h),3.51-3.38(m,8h),3.37(s,3h),1.60-1.49(m,4h),1.35-1.18(m,40h),0.87(t,6h)。
[0489][0490]
将甲氧基peg
5000-sc 6d(1.09g,0.213mmol)和dpa 4e(0.1g,0.185mmol)于ch2cl2(15ml)中的溶液用tea(0.103ml,0.741mmol)处理。搅拌(18小时,室温)后,将溶液浓缩并进行色谱法,得到呈白色固体的7h(0.646g,63%)。rf 0.8(10%ch3oh-ch2cl2)cuso4染色剂。
[0491][0492]
将甲氧基peg
10000-sc 6e(2.38g,0.235mmol)和dpa 4e(0.169g,0.258mmol)于ch2cl2(15ml)中的溶液用tea(0.131ml,0.939mmol)处理。搅拌(18小时,室温)后,将溶液浓缩并进行色谱法,得到呈白色固体的peg
10000-c-dpa 7j(0.45g,18%)。rf 0.4(10%ch3oh-ch2cl2)cuso4染色剂。1h nmr(400mhz,cdcl3)5.17-5.11(m,1h),4.26-4.20(m,2h),3.84(t,4h),3.73-3.60(m,770h),3.60-3.54(m,4h),3.50-3.41(m,12h),3.38(s,3h),1.60-1.50(m,4h),1.37-1.20(m,60h),0.89(t,6h)。
[0493][0494]
方案2:tri-peg脂质的一般合成
[0495][0496][0497]
将甲氧基peg
2000-oh 8(5g,2.5mmol)和tea(1.39ml,10mmol)于ch2cl2(60ml)中的溶液冷却(0℃)并用mscl(0.39ml,5mmol)逐滴处理。搅拌(2小时,室温)后,将反应混合物用ch2cl2稀释,然后用nahco3(饱和水溶液)和盐水洗涤,干燥(mgso4),过滤并浓缩,得到呈白色固体的甲磺酸酯9(5.1g,99%)。
[0498][0499]
将甲磺酸酯9(3.33g,1.61mmol)和(3,4,5三羟基)苯甲酸甲酯(0.066g,0.36mmol)于乙腈(50ml)中的溶液用k2co3(0.5g,3.57mmol)处理。在回流下搅拌(85℃,64小时)后,将混合物冷却(约室温)并通过硅藻土过滤,然后浓缩。使粗物质经受色谱法(3%-10%ch3oh-ch2cl2),得到呈白色固体的10(1.45g,66%)。rf 0.55 10%ch3oh-ch2cl2。
[0500][0501]
将甲酯10(1.45g,0.23mmol)于ch3oh(60ml)中的溶液用naoh(40ml)处理。搅拌(66小时)后,通过用hcl(6m)处理使反应溶液呈酸性(ph<2),然后在减压下除去ch3oh。将剩余的水性混合物用ch2cl2萃取(3x),并将合并的有机物用盐水洗涤,干燥(mgso4),过滤并浓缩。粗羧酸11(1.4g,97%)无需进一步加工即使用。
[0502][0503]
将ch2cl2(10ml)中的粗羧酸11(1.4g,0.23mmol)和2,3-双(十四烷氧基)丙烷-1-胺-tfa盐4d(0.1g,0.23mmol)用edc(0.13g,0.681mmol)、胡宁氏碱(0.12ml,0.69mmol)和dmap(催化量)处理。搅拌(18小时,40℃)后,将溶液用ch2cl2稀释,然后用nahco3(饱和水溶液)和盐水洗涤,干燥(mgso4),过滤并浓缩。将粗物质进行色谱法(4%-10%ch3oh-ch2cl2),然后浓缩并溶解于水中,并进行切向流超滤(tfu,5倍体积)并冻干,得到呈白色粉末的12(0.38g,22%)。
[0504][0505]
tri-peg
2000-dpa 13(74mg,0.011mmol)以与tri-peg
2000-dma 12相同的方式由dpa(100mg,0.15mmol)和羧酸11(1g,0.16mmol)制备。
[0506][0507]
方案3:甲氧基peg
1000-二月桂基甘油(dlg)
[0508][0509]
将烯丙基甘油14(4g,3.742ml,29.964mmol,1当量)于dmf(175ml,0.171m,43.75体积)中的溶液用nah(4.794g,119.856mmol,4当量)逐滴处理。一旦冒泡平息,将反应混合物用1-溴-n-十二烷(23.097g,22.209ml,89.892mmol,3当量)处理,然后升温至85℃。搅拌(85℃,18小时)后,将混合物用etoac稀释并用盐水萃取(3x),干燥(mgso4),过滤并浓缩。对粗物质进行色谱法,得到呈无色油状的3-[2,3-双(十二烷氧基)丙氧基]丙-1-烯15(9.64g,20.563mmol,产率68.625%)。rf 0.8(10%etoac-己烷)cuso4染色剂。
[0510][0511]
将3-[2,3-双(十二烷氧基)丙氧基]丙-1-烯15(9.53g,20.328mmol,1当量)于)etoh(150ml,0.136m,15.74体积)中的溶液用tfa(44.4g,30ml,389.405mmol,19.156当量)和四(三苯基膦)钯(0)(2.349g,2.033mmol,0.1当量)处理。搅拌(18小时,85℃)后,除去乙醇并将粗物质进行色谱法,得到呈橙色油状的2,3-双(十二烷氧基)丙-1-醇16(5.4g,12.595mmol,产率61.958%)。rf 0.4(20%etoac-己烷)cuso4染色剂。
[0512][0513]
将2,3-双(十二烷氧基)丙-1-醇16(2g,4.665mmol,1当量)于乙腈(30ml,0.155m,15体积)和ch2cl2(10ml,5体积)中的溶液用dsc(1.792g,6.997mmol,1.5当量)和tea(0.944g,1.3ml,9.33mmol,2当量)处理。搅拌(18小时,室温)后,除去溶剂,并将残余物吸收在ch2cl2中,然后用nahco3(饱和水溶液)和盐水洗涤,干燥(mgso4),过滤并浓缩。粗碳酸2,3-双(十二烷氧基)丙酯2,5-二氧代吡咯烷-1-基酯17(2.53g,4.44mmol,产率95.18%)无需进一步加工即使用。rf 0.25(20%etoac-己烷)cuso4染色剂。
[0514][0515]
将甲氧基-peg
1000-n
3 18(1g,1mmol,1当量)和pd/c 10%湿载体(0.1g,0.1当量)于甲醇(10ml,0.1m,10体积)中的溶液用tfa(0.125g,0.085ml,1.1mmol,1.1当量)处理并用氢气吹扫。搅拌(18小时,室温)后,将混合物用氮气吹扫,然后通过硅藻土过滤并浓缩。粗peg
1000-nh
2-tfa 19(0.922g,92%)无需进一步加工即使用。rf 0.4(10%ch3oh-ch2cl2)mary试剂。
[0516][0517]
将碳酸2,3-双(十二烷氧基)丙酯2,5-二氧代吡咯烷-1-基酯17(0.525g,0.922mmol,1当量)和甲氧基-peg
1000-nh
2-tfa 19(0.922g,0.922mmol,1当量)于ch2cl2(5.254ml,0.175m,10体积)中的溶液用tea(0.187g,0.257ml,1.844mmol,2当量)处理。搅拌(18小时,室温)后,将反应溶液用dcm稀释,然后用nahco3(饱和水溶液)和盐水洗涤,然后干燥(mgso4),过滤并浓缩。对粗物质进行色谱法,得到呈淡黄色固体的甲氧基peg
1000-二月桂基甘油20(0.534g,0.334mmol,产率36.248%)。
[0518]
实施例2
[0519]
用于递送核酸的脂质纳米颗粒制剂通常采用peg-脂质缀合物,其用于在lnp制造过程中控制粒度以及防止施用后在小瓶中和血流中的不想要的聚集。如果携带lnp的核酸有效负载在血液中循环较长时间,则它们可具有免疫原性。例如,身体可产生识别表面化学物质(例如peg脂质)的抗体,并且这些抗体可快速清除后续剂量,从而使它们无效。具有紧密缔合的peg-脂质的lnp组合物(如具有两个c
18
脂质链作为其疏水锚的那些组合物)特别容
易受到影响(judge等人,molecular therapy,13,328-337(2006))。一种广泛采用的解决方案是使用具有较小锚的peg脂质,所述锚与颗粒快速解离,从而导致肝脏快速吸收,并且lnp触发免疫应答的机会较小。最常用的锚具有个与分子量约为2000g/mol的peg聚合物组分(例如,peg-c-dma,二肉豆蔻基)缀合的两c
14
烷基链。虽然此类peg脂质对sirna有效负载有效,并且在给药后未观察到抗peg抗体,但已发现使用mrna有效负载,更容易触发抗体反应。甚至对于采用快速解离c
14 peg-脂质的组合物也观察到抗体。令人感兴趣的是,如本文所述,已经发现可通过使用单个c
18
链peg脂质(硬脂酸酯)或包含两个c
12
烷基链的较小peg聚合物(例如,peg750-c-dla)来改正这一问题。本文讨论了在大鼠模型中获得的结果,证明封装mrna有效负载的在lnp中具有单个烷基链的peg-脂质可降低免疫原性并避免重复给药后效力的损失。
[0520]
实验
[0521]
所使用的脂质溶液含有4种组分:peg缀合脂质、可电离脂质(cl1)、胆固醇和磷脂(例如,dspc)。对于peg2000组合物,组分的摩尔比分别是1.6:54.6:32.8:10.9。对于peg750组合物,组分的摩尔比分别是3.0:54.0:32.4:10.8。
[0522]
使用如所描述的脂质特性和摩尔比制备脂质储备液,以在100%乙醇中达到约7mg/ml的总浓度。将mrna(人促红细胞生成素)在乙酸盐(ph 5)缓冲液和不含核酸酶的水中稀释,以在100mm乙酸盐(ph 5)中达到0.366mg/ml mrna的目标浓度。通过t-连接器中将等体积的脂质和核酸溶液以400ml/min的流速掺混,并稀释到pbs(ph7.4)中。将制剂置于切向流超滤(mwco 500,000)上并在最终储存缓冲液中浓缩至约0.5mg/ml,然后通过0.2μm注射器过滤器(pes膜)进行无菌过滤。通过ribogreen测定确定核酸浓度。将最终制剂等分到无菌微量离心管中并储存在-80℃下直至使用。
[0523]
将lnp制剂每周一次以0.25mg/kg静脉内注射到雄性sprague-dawley大鼠(7-8周龄,n=4)中,持续4周(在第0、7、14、21天施用剂量)。在给药的每一天和就在注射之前,将lnp储备液解冻,重新过滤并用pbs稀释至所需的给药浓度。在每个给药日在给药前和给药后6小时收集血液用于分析。在终点时间点,用致死剂量的氯胺酮/甲苯噻嗪对动物实施安乐死。将所有血液样品收集到k2edta中并加工成血浆,然后在-80℃下冷冻保存直至分析。通过elisa分析血浆样品的epo表达和抗peg抗体。
[0524]
表5.含有各种peg缀合脂质的人epo mrna-lnp在持续4周每周静脉内给药后6小时的功效(n=4只sprague-dawley大鼠)
[0525][0526]
表6.含有各种peg缀合脂质的人epo mrna-inp在每周静脉内给药持续4周后的抗peg igg抗体应答(n=4只sprague-dawley大鼠)
[0527]
[0528]
表7.含有各种peg缀合脂质的人epo mrna-lnp在每周静脉内给药持续4周后的抗peg igm抗体应答(n=4只sprague-dawley大鼠)
[0529][0530]
应理解上述描述意图为说明性而非限制性的。在阅读了以上描述之后,许多实施方案对于本领域技术人员而言将是显而易见的。因此不应参照以上描述来确定本发明的范围,而应参照所附权利要求连同所述权利要求赋予的等效物的全部范围来确定。所有文章和参考文献(包括专利申请、专利和pct公布)的公开内容出于所有目的以引用的方式并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1