氧代吖啶基乙酸衍生物及使用方法与流程
氧代吖啶基乙酸衍生物及使用方法
1.相关申请
2.本技术要求于2019年5月16日提交的美国临时申请号62/848,745的优先权和权益,其内容通过引用整体并入。
3.发明背景
4.通过激动或拮抗模式识别受体(prr)来调节先天免疫活性在临床应用中具有巨大的潜力,无论是作为单一疗法还是与其他药物或生物药物组合。应用范围从通过免疫抑制缓解自身免疫性疾病到通过刺激先天性抗肿瘤免疫来治疗实体癌和血液癌,以及用于抗病毒治疗或作为疫苗佐剂。
5.参与有效激活抗原呈递细胞(apc)的prr之一是干扰素基因(sting)蛋白的刺激物。sting是一种进化上保守的细胞质prr,其是cgas-cdn-sting轴的一部分。由于细胞应激、病毒或细胞内细菌感染、有丝分裂失败或吞噬作用,胞质溶胶中的异常dsdna被cgas酶识别,cgas酶会合成非经典的环状二核苷酸(cdn),2
’3’
cgamp。2
’3’
cgamp结合并稳定sting二聚体,导致irf3和nfkb激活和i型干扰素的合成。sting蛋白在对病毒感染的先天细胞反应和靶细胞和响应先天免疫细胞中的异常胞质dna积累中起着重要作用。sting激活的多效性取决于细胞类型和环境。例如,通过sting过度刺激t细胞和b细胞会导致促凋亡表型,而在骨髓细胞中,sting激活会提高i型干扰素和促炎细胞因子,而不会增加细胞凋亡。
6.肿瘤来源的dsdna被常驻树突细胞(dc)吞噬,从而刺激cgas-cdn-sting轴并激活dc,导致淋巴结迁移,并最终导致抗原特异性cd4+和cd8+t细胞增殖。在缺乏t细胞浸润的肿瘤中,该过程和伴随的i型ifn反应通常不存在,这突出了sting激动直接解决这些肿瘤利用的逃逸机制的潜力。尽管几种cdn衍生配体已显示出作为sting激动剂的临床前前景,但它们相对较大的分子量和极性限制了它们在肿瘤内注射的应用。此外,细胞溶质sting蛋白的结合和激活/抑制在体内受到细胞膜通透性的限制。此外,尽管它们通过全身给药(i.v.或i.p.)具有治疗效果,但先前确定的小分子sting激动剂dmxaa和cma表现出物种选择性,禁止它们用作人类治疗剂。因此,需要将sting的人类活性的小分子调节剂用作有效的治疗剂。本技术解决了这种需要。本技术的新型化合物克服了cdn衍生配体的局限性。
技术实现要素:
7.一方面,本技术涉及式i或式ii化合物或其药学上可接受的盐或酯:
[0008][0009]
其中z1、z2、z3、z4、y1、y2、y、y’、z、t1、m和n各自在本文中定义。
[0010]
在另一方面,本技术涉及包含治疗有效量的本技术化合物或其药学上可接受的盐或酯和药学上可接受的载体的药物组合物。
[0011]
本技术的另一方面涉及调节(例如,抑制或刺激)干扰素基因(sting)蛋白的刺激物的方法。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。在一个实施方案中,该sting蛋白是人类sting蛋白。
[0012]
本技术的另一方面涉及治疗或预防疾病的方法,其中所述疾病由sting表达、活性和/或功能(例如,sting表达、活性和/或功能的失调)引起或与其相关。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。
[0013]
本技术的另一方面涉及治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病的方法。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。
[0014]
本技术的另一方面涉及包含本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物的试剂盒。
[0015]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物,其用于制备药物,该药物用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0016]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物在制备药物中的用途,该药物用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0017]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物,其用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0018]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物的用途,其用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0019]
本技术提供了作为治疗或预防疾病如癌症和免疫障碍的治疗剂的sting蛋白调节剂。
[0020]
本公开的细节在以下所附说明中阐述。尽管在本技术的实践或测试中可以使用与本文所述的那些方法和材料相似或等效的方法和材料,但现在描述说明性的方法和材料。在发生冲突的情况下,以本说明书(包括定义)为准。此外,材料、方法和实施例仅是说明性的而不是限制性的。根据说明书和权利要求,本公开的其他特征、目的和优点将是显而易见
的。在说明书和所附权利要求中,除非上下文另有明确规定,否则单数形式也包括复数形式。除非另有定义,本文使用的所有技术和科学术语与本公开所属领域的普通技术人员通常理解的含义相同。
[0021]
在本技术中引用的所有文献(包括参考文献、已授权专利、公开的专利申请和共同未决的专利申请)的内容特此通过引用整体并入本文。此处引用的文献不被承认为本技术的现有技术。
[0022]
发明详述
[0023]
本技术涉及显示出有效且选择性地激活sting蛋白(例如人sting蛋白)的式i化合物。在一个实施方案中,本技术的化合物由式i表示:
[0024][0025]
或其药学上可接受的盐或酯,其中
[0026]
z1为卤素、cf3或ch3;
[0027]
z2为oh、n-(c
1-c4烷基)2、c
2-c4烷基、c
2-c4烯基、包含1或2个选自n、o和s的杂原子的5-元杂环基、或包含1或2个选自n、o和s的杂原子的5-元杂芳基,其中该杂环基或杂芳基任选取代有一个或多个独立地选自下列的基团:c
1-c4烷基、c
1-c4卤代烷基、oh和卤素;
[0028]
t1为r1、or1、n(r1)2、nhs(o)2rs、nhc(o)r1、nhoh或nhcn;
[0029]
每个r1独立地为h、c
1-c4烷基、或取代有一个或多个卤素的c
1-c4烷基;
[0030]rs
为r1或c
3-c8环烷基;
[0031]
每个y独立地为c
1-c6烷基、c
2-c6烯基、卤素、oh、o-(c
1-c6烷基)、s-(c
1-c6烷基)、o-(c
2-c4烯基)、nh2、nh-(c
1-c6烷基)、n-(c
1-c6烷基)2、或t,其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2;
[0032]
m为0、1或2;
[0033]
y1为h、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、卤素、oh、o-(c
1-c6烷基)、o-(c
2-c4烯基)、nh2、nh-(c
1-c6烷基)、n-(c
1-c6烷基)2或q-t,其中该烷基或烯基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2;
[0034]
每个q独立地为化学键、nh或c
1-c3亚烷基(alkylenyl);
[0035]
每个t独立地为c
3-c8环烷基、c
3-c8环烯基、包含一个或两个5-或6-元环和1-4个选自n、o和s的杂原子的杂环基、c
6-c
10
芳基或包含一个或两个5-或6-元环和1-4个选自n、o和s的杂原子的杂芳基,其中该环烷基、环烯基、杂环基、芳基或杂芳基任选取代有一个或多个r
t
;
[0036]
每个r
t
独立地为c
1-c6烷基、c
1-c6卤代烷基、oh、cn、卤素、c(o)-o-(c
1-c6烷基)、o-(c
1-c6烷基)、o-(c
1-c6卤代烷基)、s-(c
1-c6烷基)、nh2、nh-(c
1-c6烷基)或n-(c
1-c6烷基)2;
[0037]
n为0或1;和
[0038]
每个z独立地为c
1-c6烷基、卤素、oh、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh2、nh-(c
1-c6烷基)或n-(c
1-c6烷基)2,条件是
[0039]
当z1为卤素或ch3,z2为n-(c
1-c4烷基)2,m为0,n为0,且t1为oh时,则y1不是h、甲基或nh-(c
1-c6烷基),
[0040]
当z1为cl,z2为n-(c
1-c4烷基)2,m为0,且t1为oh时,则y1不是叔丁基,
[0041]
当z1为cl,z2为n-(c
1-c4烷基)2,m为0,t1为oh,y1为q-t,且q为nh时,则t不是未取代的苯基或未取代的环丁基,和
[0042]
当z1为cl,z2为n-(c
1-c4烷基)2,m为0,t1为oh,y1为q-t,且q为化学键时,则t不是未取代的呋喃基。
[0043]
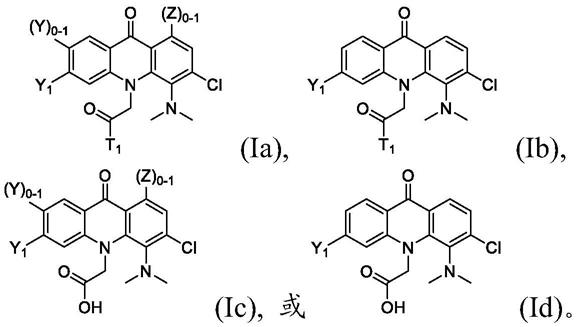
在一个实施方案中,式i化合物为式ia、ib、ic或id化合物:
[0044][0045]
或其药学上可接受的盐或酯。
[0046]
在一个实施方案中,本技术的化合物由式ii表示:
[0047][0048]
或其药学上可接受的盐或酯,其中:
[0049]
z3为卤素;
[0050]
z4为c
1-c4烷氧基;
[0051]
t1为r1、or1、n(r1)2、nhs(o)2rs、nhc(o)r1、nhoh或nhcn;
[0052]
每个r1独立地为h、c
1-c4烷基、或取代有一个或多个卤素的c
1-c4烷基;
[0053]rs
为r1或c
3-c8环烷基;
[0054]
每个y’独立地为c
1-c6烷基、c
2-c6烯基、卤素、oh、o-(c
1-c6烷基)、s-(c
1-c6烷基)、o-(c
2-c4烯基)、nh2、nh-(c
1-c6烷基)、n-(c
1-c6烷基)2或t’,其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2;
[0055]
m为0、1或2;
[0056]
y2独立地为c
2-c6烯基、卤素或t’;
[0057]
每个t’独立地为c
3-c8环烷基、c
3-c8环烯基或包含一个或两个5-或6-元环和1-4个
选自n、o和s的杂原子的杂环基,其中该环烷基、环烯基或杂环基取代有一个或多个r
t’;
[0058]
每个r
t’独立地为c
1-c6烷基、oh、cn、卤素、c(o)-o-(c
1-c6烷基)、o-(c
1-c6烷基)、o-(c
1-c6卤代烷基)、s-(c
1-c6烷基)、nh2、nh-(c
1-c6烷基)、n-(c
1-c6烷基)2或杂环基,其中该杂环基任选地被取代并且包含5-或6-元环和1-3个选自n、o和s的杂原子;
[0059]
n为0或1;和
[0060]
每个z独立地为c
1-c6烷基、卤素、oh、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh2、nh-(c
1-c6烷基)或n-(c
1-c6烷基)2。
[0061]
在一个实施方案中,式ii化合物为式iia或iib化合物:
[0062][0063]
或其药学上可接受的盐或酯。
[0064]
对于任何式i、ia、ib、ic、ii、iia或iib,在适用的情况下:
[0065]
(a1)在一个实施方案中,z1为卤素。
[0066]
(a2)在一个实施方案中,z1为f或cl。
[0067]
(a3)在一个实施方案中,z1为cl。
[0068]
(a4)在一个实施方案中,z1为f。
[0069]
(a5)在一个实施方案中,z1为cf3或ch3。
[0070]
(a6)在一个实施方案中,z1为ch3。
[0071]
(a7)在一个实施方案中,z1为cf3。
[0072]
(b1)在一个实施方案中,z2为n-(c
1-c4烷基)2、c
2-c4烷基、c
2-c4烯基、5-元杂环基或5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0073]
(b2)在一个实施方案中,z2为n-(c
1-c4烷基)2、5-元杂环基或5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0074]
(b3)在一个实施方案中,z2为n-(c
1-c4烷基)2。
[0075]
(b4)在一个实施方案中,z2为n(ch3)2。
[0076]
(b5)在一个实施方案中,z2为5-元杂环基或5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0077]
(b6)在一个实施方案中,z2为c
2-c4烷基或c
2-c4烯基。
[0078]
(b7)在一个实施方案中,z2为c
2-c4烷基。
[0079]
(b8)在一个实施方案中,z2为c
2-c4烯基。
[0080]
(c1)在一个实施方案中,z1为卤素,并且z2为n-(c
1-c4烷基)2。
[0081]
(c2)在一个实施方案中,z1为cl,并且z2为n-(c
1-c4烷基)2。
[0082]
(c3)在一个实施方案中,z1为卤素,并且z2为n(ch3)2。
[0083]
(c4)在一个实施方案中,z1为cl,并且z2为n(ch3)2。
[0084]
(c5)在一个实施方案中,z1为卤素,并且z2为c
2-c4烷基或c
2-c4烯基。
[0085]
(c6)在一个实施方案中,z1为卤素,并且z2为c
2-c4烷基。
[0086]
(c7)在一个实施方案中,z1为卤素,并且z2为c
2-c4烯基。
[0087]
(c8)在一个实施方案中,z1为cl,并且z2为c
2-c4烷基。
[0088]
(c9)在一个实施方案中,z1为cl,并且z2为c
2-c4烯基。
[0089]
(c10)在一个实施方案中,z1为卤素,并且z2为5-元杂环基或5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0090]
(c11)在一个实施方案中,z1为卤素,并且z2为5-元杂环基,其中该杂环基任选被取代。
[0091]
(c12)在一个实施方案中,z1为卤素,并且z2为5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0092]
(c13)在一个实施方案中,z1为cl,并且z2为5-元杂环基,其中该杂环基任选被取代。
[0093]
(c14)在一个实施方案中,z1为cl,并且z2为5-元杂芳基,其中该杂环基或杂芳基任选被取代。
[0094]
(c15)在一个实施方案中,z1为卤素,并且z2为oh。
[0095]
(c16)在一个实施方案中,z1为cl,并且z2为oh。
[0096]
(c17)在一个实施方案中,z1为ch3,并且z2为n-(c
1-c4烷基)2。
[0097]
(c18)在一个实施方案中,z1为ch3,并且z2为n(ch3)2。
[0098]
(c19)在一个实施方案中,z1为cf3,并且z2为n-(c
1-c4烷基)2。
[0099]
(c20)在一个实施方案中,z1为cf3,并且z2为n(ch3)2。
[0100]
(a’1)在一个实施方案中,z3为卤素。
[0101]
(a’2)在一个实施方案中,z3为f或cl。
[0102]
(a’3)在一个实施方案中,z3为cl。
[0103]
(a’4)在一个实施方案中,z3为f。
[0104]
(b’1)在一个实施方案中,z4为甲氧基、乙氧基、丙氧基或丁氧基。
[0105]
(b’2)在一个实施方案中,z4为甲氧基或乙氧基。
[0106]
(b’3)在一个实施方案中,z4为甲氧基。
[0107]
(d1)在一个实施方案中,z3为卤素,并且z4为甲氧基或乙氧基。
[0108]
(d2)在一个实施方案中,z3为cl,并且z4为甲氧基或乙氧基。
[0109]
(d3)在一个实施方案中,z3为卤素,并且z4为甲氧基。
[0110]
(d4)在一个实施方案中,z3为cl,并且z4为甲氧基。
[0111]
(e1)在一个实施方案中,t1为or1、nhs(o)2rs、nhoh或nhcn。
[0112]
(e2)在一个实施方案中,t1为or1。
[0113]
(e3)在一个实施方案中,t1为or1,并且r1为h。
[0114]
(e4)在一个实施方案中,t1为or1,并且r1为c
1-c4烷基或取代有一个或多个卤素的c
1-c4烷基。
[0115]
(e5)在一个实施方案中,t1为nhs(o)2rs。
[0116]
(e6)在一个实施方案中,t1为nhs(o)2rs,并且rs为r1。
[0117]
(e7)在一个实施方案中,t1为nhs(o)2rs,并且rs为c
1-c4烷基或取代有一个或多个卤素的c
1-c4烷基。在一个实施方案中,rs为甲基。
[0118]
(e8)在一个实施方案中,t1为nhs(o)2rs,并且rs为c
3-c8环烷基。在一个实施方案中,rs为环丙基或环丁基。
[0119]
(e9)在一个实施方案中,t1为nhoh或nhcn。
[0120]
(f1)在一个实施方案中,m为0。
[0121]
(f2)在一个实施方案中,m为1或2。
[0122]
(f3)在一个实施方案中,m为1。
[0123]
(f4)在一个实施方案中,m为2。
[0124]
(g1)在一个实施方案中,至少一个y为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,至少一个y为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基),其任选地如本文所述被取代。在一个实施方案中,至少一个y为c
1-c6直链或c
3-c6支链烷基,并且如本文所述被取代。在一个实施方案中,至少一个y为c
1-c6直链或c
3-c6支链烷基,其取代有oh、nh2、n3、卤素或o-(c
1-c6烷基)。在一个实施方案中,至少一个y为甲基,其任选地如本文所述被取代。
[0125]
(g2)在一个实施方案中,至少一个y为c
2-c6直链或c
3-c6支链烯基(例如乙烯基、丙烯基、丁烯基、戊烯基或己烯基)。
[0126]
(g3)在一个实施方案中,至少一个y为卤素(例如f、cl、br或i)。在一个实施方案中,至少一个y为f。在一个实施方案中,至少一个y为cl。在一个实施方案中,至少一个y为br。
[0127]
(g4-1)在一个实施方案中,至少一个y为oh或o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,至少一个y为o-甲基,其任选地如本文所述被取代。在一个实施方案中,至少一个y为o-乙基,其任选地如本文所述被取代。在一个实施方案中,至少一个y为o-异丙基,其任选地如本文所述被取代。
[0128]
(g4-2)在一个实施方案中,至少一个y为o-(c
2-c4烯基)(例如乙烯基、丙烯基或丁烯基)。
[0129]
(g5)在一个实施方案中,至少一个y为s-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0130]
(g6)在一个实施方案中,至少一个y为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)或n-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0131]
(g7)在一个实施方案中,至少一个y为t。
[0132]
(g8)在一个实施方案中,至少一个y为c
1-c6烷基、卤素、oh、o-(c
1-c6烷基)或t,如
本文所述。
[0133]
(g’1)在一个实施方案中,至少一个y’为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,至少一个y’为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基),其任选地如本文所述被取代。在一个实施方案中,至少一个y’为c
1-c6直链或c
3-c6支链烷基,并且如本文所述被取代。在一个实施方案中,至少一个y’为c
1-c6直链或c
3-c6支链烷基,其取代有oh、nh2、n3、卤素或o-(c
1-c6烷基)。在一个实施方案中,至少一个y’为甲基,其任选地如本文所述被取代。
[0134]
(g’2)在一个实施方案中,至少一个y’为c
2-c6直链或c
3-c6支链烯基(例如乙烯基、丙烯基、丁烯基、戊烯基或己烯基)。
[0135]
(g’3)在一个实施方案中,至少一个y’为卤素(例如f、cl、br或i)。在一个实施方案中,至少一个y’为f。在一个实施方案中,至少一个y’为cl。在一个实施方案中,至少一个y’为br。
[0136]
(g’4-1)在一个实施方案中,至少一个y’为oh或o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,至少一个y’为o-甲基,其任选地如本文所述被取代。在一个实施方案中,至少一个y’为o-乙基,其任选地如本文所述被取代。在一个实施方案中,至少一个y’为o-异丙基,其任选地如本文所述被取代。
[0137]
(g’4-2)在一个实施方案中,至少一个y’为o-(c
2-c4烯基)(例如乙烯基、丙烯基或丁烯基)。
[0138]
(g’5)在一个实施方案中,至少一个y’为s-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0139]
(g’6)在一个实施方案中,至少一个y’为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)或n-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、s-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0140]
(g’7)在一个实施方案中,至少一个y’为t’。
[0141]
(h1)在一个实施方案中,n为0。
[0142]
(h2)在一个实施方案中,n为1。
[0143]
(i1)在一个实施方案中,至少一个z为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个z为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0144]
(i2)在一个实施方案中,至少一个z为卤素(例如f、cl、br或i)。在一个实施方案中,至少一个z为f。在一个实施方案中,至少一个z为cl。在一个实施方案中,至少一个z为br。
[0145]
(i3)在一个实施方案中,至少一个z为oh或o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个z为oh。
[0146]
(i4)在一个实施方案中,至少一个z为s-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。
[0147]
(i5)在一个实施方案中,至少一个z为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)或n-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。
[0148]
(j1)在一个实施方案中,q为化学键。
[0149]
(j2)在一个实施方案中,q为nh或c
1-c3亚烷基。
[0150]
(j3)在一个实施方案中,q为nh。
[0151]
(j4)在一个实施方案中,q为c
1-c3亚烷基。在一个实施方案中,q为亚甲基。在一个实施方案中,q为亚乙基。在一个实施方案中,q为亚丙基。
[0152]
(k1)在一个实施方案中,至少一个t为环丙基、环丁基、环戊基、环己基、环庚基或环辛基,其各自任选取代有一个或多个r
t
。
[0153]
(k2)在一个实施方案中,至少一个t为环丁烯基、环戊烯基、环己烯基、环庚烯基或环辛烯基,其各自任选取代有一个或多个r
t
。
[0154]
(k3)在一个实施方案中,至少一个t为包含一个或两个5-或6-元环和1-4个选自n、o和s的杂原子的杂环基(例如吡咯烷基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、三唑烷基、四氢呋喃基、哌啶基、哌嗪基或吗啉基),其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个或两个5-或6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-或6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-或6-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-2个选自n和o的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-2个选自n和o的杂原子的杂环基,例如文中所述的那些,其任选取代有一个或多个r
t
。
[0155]
(k4)在一个实施方案中,至少一个t为c
6-c
10
芳基,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为苯基,其任选取代有一个或多个r
t
。
[0156]
(k5)在一个实施方案中,至少一个t为包含一个或两个5-或6-元环和1-4个选自n、o和s的杂原子的杂芳基(例如吡咯基、呋喃基、噻吩基、噻唑基、异噻唑基、咪唑基、三唑基、四唑基、吡唑基、噁唑基、异噁唑基、吡啶基、吡嗪基、哒嗪基、嘧啶基、喹啉基、异喹啉基、萘啶基、吲哚基、嘌呤基、吲嗪基、喹喔啉基、苯并噁唑基、苯并二噁唑基、苯并噻唑基、苯并咪唑基、苯并噻吩基或苯并呋喃基),其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个或两个5-或6-元环和1-3个选自n、o和s的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-或6-元环和1-3个选自n、o和s的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-或6-元环和1-3个选自n和o的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-3个选自n、o和s的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-3个选自n和o的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-2个选自n和o的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个5-元环和1-2个n的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-3个选自n、o和s的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-3个选自n和o的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-2个选自n和o的杂原子的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。在一个实施方案中,至少一个t为包含一个6-元环和1-2个n的杂芳基,例如文中所述的那些,其任选取代有一个或多个r
t
。
[0157]
(k’1)在一个实施方案中,至少一个t’为环丙基、环丁基、环戊基、环己基、环庚基或环辛基,其各自取代有一个或多个r
t’。
[0158]
(k’2)在一个实施方案中,至少一个t’为环丁烯基、环戊烯基、环己烯基、环庚烯基或环辛烯基,其各自取代有一个或多个r
t’。
[0159]
(k’3)在一个实施方案中,至少一个t’为包含一个或两个5-或6-元环和1-4个选自n、o和s的杂原子的杂环基(例如吡咯烷基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、三唑烷基、四氢呋喃基、哌啶基、哌嗪基或吗啉基),其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个或两个5-或6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个5-或6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个5-或6-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个5-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个5-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一
个t’为包含一个5-元环和1-2个选自n和o的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个6-元环和1-3个选自n、o和s的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个6-元环和1-3个选自n和o的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。在一个实施方案中,至少一个t’为包含一个6-元环和1-2个选自n和o的杂原子的杂环基,例如文中所述的那些,其取代有一个或多个r
t’。
[0160]
(l1)在一个实施方案中,至少一个r
t
为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0161]
(l2)在一个实施方案中,至少一个r
t
为c
1-c6卤代烷基,即取代有一个或多个卤素(例如f、cl、br或i)的c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为c
1-c4卤代烷基,即取代有一个或多个卤素(例如f、cl、br或i)的c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0162]
(l3)在一个实施方案中,至少一个r
t
为oh、cn、卤素或nh2。
[0163]
(l4)在一个实施方案中,至少一个r
t
为卤素(例如f、cl、br或i)。
[0164]
(l5)在一个实施方案中,至少一个r
t
为o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为o-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0165]
(l6)在一个实施方案中,至少一个r
t
为o-(c
1-c6卤代烷基)(即其中该c
1-c6卤代烷基为取代有一个或多个卤素(例如f、cl、br或i)的c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为o-(c
1-c4卤代烷基)(即其中该c
1-c4卤代烷基为取代有一个或多个卤素(例如f、cl、br或i)的c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基))。
[0166]
(l7)在一个实施方案中,至少一个r
t
为s-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为s-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0167]
(l8)在一个实施方案中,至少一个r
t
为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)、n-(c
1-c6直链或c
3-c6支链烷基)2或nhs(o)
2-(c
1-c6烷基)。在一个实施方案中,至少一个r
t
为nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为nh-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。在一个实施方案中,至少一个r
t
为nh-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为nh-(c
1-c4烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0168]
(l9)在一个实施方案中,至少一个r
t
为c(o)-o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t
为c(o)-o-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0169]
(l’1)在一个实施方案中,至少一个r
t’为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0170]
(l’2)在一个实施方案中,至少一个r
t’为oh、cn、卤素或nh2。
[0171]
(l’3)在一个实施方案中,至少一个r
t’为卤素(例如f、cl、br或i)。
[0172]
(l’4)在一个实施方案中,至少一个r
t’为o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为o-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0173]
(l’5)在一个实施方案中,至少一个r
t’为o-(c
1-c6卤代烷基)(即其中该c
1-c6卤代烷基为取代有一个或多个卤素(例如f、cl、br或i)的c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为o-(c
1-c4卤代烷基)(即其中该c
1-c4卤代烷基为取代有一个或多个卤素(例如f、cl、br或i)的c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基))。
[0174]
(l’6)在一个实施方案中,至少一个r
t’为s-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为s-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0175]
(l’7)在一个实施方案中,至少一个r
t’为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)、n-(c
1-c6直链或c
3-c6支链烷基)2或nhs(o)
2-(c
1-c6烷基)。在一个实施方案中,至少一个r
t’为nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为nh-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。在一个实施方案中,至少一个r
t’为nh-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为nh-(c
1-c4烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0176]
(l’8)在一个实施方案中,至少一个r
t’为c(o)-o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)。在一个实施方案中,至少一个r
t’为c(o)-o-c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基)。
[0177]
(l’9)在一个实施方案中,至少一个r
t’为杂环基(例如吡咯烷基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、三唑烷基、四氢呋喃基、哌啶基、哌嗪基或吗啉基)。在一个实施方案中,该杂环基包含一个5-元环和1-3个选自n、o和s的杂原子,例如文中所述的那些。
在一个实施方案中,该杂环基包含一个5-元环和1-3个选自n和o的杂原子,例如文中所述的那些。在一个实施方案中,该杂环基包含一个5-元环和1-2个选自n和o的杂原子,例如文中所述的那些。在一个实施方案中,该杂环基包含一个6-元环和1-3个选自n、o和s的杂原子,例如文中所述的那些。在一个实施方案中,该杂环基包含一个6-元环和1-3个选自n和o的杂原子,例如文中所述的那些。在一个实施方案中,该杂环基包含一个6-元环和1-2个选自n和o的杂原子,例如文中所述的那些。
[0178]
(m1)在一个实施方案中,y1为c
1-c6直链或c
3-c6支链烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,y1为c
1-c4烷基(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基),其任选地如本文所述被取代。在一个实施方案中,y1为c
1-c6直链或c
3-c6支链烷基,并且如本文所述被取代。在一个实施方案中,y1为c
1-c6直链或c
3-c6支链烷基,其取代有oh、cn、nh2、卤素、o-(c
1-c6烷基)或n-(c
1-c6烷基)2。在一个实施方案中,y1为甲基,其任选地如本文所述被取代。
[0179]
(m2)在一个实施方案中,y1为c
2-c6直链或c
4-c6支链烯基(例如乙烯基、丙烯基、丁烯基、戊烯基或己烯基),其任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,y1为c
2-c4烯基,其任选地如本文所述被取代。在一个实施方案中,y1为c
2-c6直链或c
4-c6支链烯基,并且如本文所述被取代。在一个实施方案中,y1为c
2-c6直链或c
3-c4支链烯基,其取代有oh、cn、nh2、卤素、o-(c
1-c6烷基)或n-(c
1-c6烷基)2。
[0180]
(m3)在一个实施方案中,y1为c
2-c6直链或c
4-c6支链炔基(例如乙炔基、丙炔基、丁炔基、戊炔基或己炔基)。
[0181]
(m4)在一个实施方案中,y1为卤素(例如f、cl、br或i)。在一个实施方案中,y1为f。在一个实施方案中,y1为cl。在一个实施方案中,y1为br。
[0182]
(m5-1)在一个实施方案中,y1为oh或o-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。在一个实施方案中,y1为o-甲基,其任选地如本文所述被取代。在一个实施方案中,y1为o-乙基,其任选地如本文所述被取代。在一个实施方案中,y1为o-异丙基,其任选地如本文所述被取代。
[0183]
(m5-2)在一个实施方案中,y1为o-(c
2-c4烯基)(例如乙烯基、丙烯基或丁烯基),其中该烯基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0184]
(m6)在一个实施方案中,y1为nh2、nh-(c
1-c6直链或c
3-c6支链烷基)(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基)或n-(c
1-c6直链或c
3-c6支链烷基)2(例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基或己基),其中该烷基部分任选取代有一个或多个独立地选自下列的基团:oh、cn、nh2、n3、卤素、o-(c
1-c6烷基)、nh-(c
1-c6烷基)和n-(c
1-c6烷基)2。
[0185]
(m7)在一个实施方案中,y1为q-t。
[0186]
(m8)在一个实施方案中,y1为c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、卤素、oh、o-(c
1-c6烷基)、nh-(c
1-c6烷基)或q-t,如本文所述。
[0187]
(m’1)在一个实施方案中,y2为c
2-c6直链或c
4-c6支链烯基(例如乙烯基、丙烯基、丁烯基、戊烯基或己烯基)。
[0188]
(m’2)在一个实施方案中,y2为卤素(例如f、cl、br或i)。在一个实施方案中,y2为f。在一个实施方案中,y2为cl。在一个实施方案中,y2为br。
[0189]
(m’3)在一个实施方案中,y2为t’。
[0190]
文中针对z1、z2、z3、z4、z、y1、y2、y、y’、t1、t、t’、q、r1、rs、r
t
、r
t’、m和n中的任何一个描述的任何基团可以与本文针对z1、z2、z3、z4、z、y1、y2、y、y’、t1、t、t’、q、r1、rs、r
t
、r
t’、m和n中的一个或多个所描述的任何基团组合。
[0191]
本技术的代表性化合物示于表1中。
[0192]
表1
[0193]
[0194]
[0195]
[0196]
[0197]
[0198][0199]
一些前述化合物可以包含一个或多个不对称中心,因此可以以各种异构形式存在,例如立体异构体和/或非对映异构体。因此,本技术的化合物可以是单独的对映异构体、非对映异构体或几何异构体的形式,或者可以是立体异构体的混合物的形式。在一个实施方案中,本技术的化合物为对映体纯的化合物。在另一个实施方案中,提供了立体异构体或非对映异构体的混合物。
[0200]
另一方面是同位素标记的本文所述的任何化学式的化合物和本文所述的任何化合物。此类化合物具有一个或多个引入化合物中的同位素原子,这些同位素原子可以是或可以不是放射性的(例如3h、2h、
14
c、
13
c、
18
f、
35
s、
32
p、
125
i和
131
i)。此类化合物可用于药物代谢研究和诊断以及治疗应用。
[0201]
效力也可以通过ic
50
值来确定。在基本相似的条件下测定的具有较低ic
50
值的化合物相对于具有较高ic
50
值的化合物更有效。在一些实施方案中,基本相似的条件包括在本技术化合物存在下,在体外或体内测定已知sting配体与sting蛋白的结合水平。
[0202]
在一个实施方案中,本技术的化合物可用作治疗剂,因此可用于治疗由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关的疾病、或与sting参与的一种或多种细胞内途径(例如,调节细胞内dna介导的i型干扰素激活)相关的疾病,例如文中所述的那些疾病。
[0203]
例如,可以通过将化合物调节sting表达/活性/功能的能力与其调节其他蛋白质或来自其他物种的sting蛋白质的能力进行比较来鉴定“选择性sting调节剂”。在一些实施方案中,可以通过测量化合物的ec
50
或ic
50
来鉴定选择性。在一些实施方案中,本技术的化合物是“选择性的人sting调节剂”。
[0204]
在某些实施方案中,本技术的化合物是sting调节剂(例如选择性人类sting调节剂),其选择性是其他蛋白质或来自其他物种(例如非人类动物,例如小鼠)的sting蛋白质的至少2倍、3倍、5倍、10倍、25倍、50倍或100倍。在各种实施方案中,本技术的化合物表现出比其他蛋白质或来自其他物种的sting蛋白质高1000倍的选择性。
[0205]
本技术的化合物在本文中通过它们的化学结构和/或化学名称来定义。如果化合物由化学结构和化学名称同时提及,并且化学结构和化学名称发生冲突,则化学结构决定了化合物的鉴定。
[0206]
本文中任何变量定义中的化学基团列表的引用包括将该变量定义为任何单个基团或所列基团的组合。文中对变量的实施方案的详述包括作为任何单个实施方案或与任何其他实施方案或其部分组合的实施方案。
[0207]
在另一方面,本技术提供了合成本文公开的化合物的方法。本技术化合物的合成可在本文和以下实施例中找到。其他实施方案是使用本文描述的任何一种反应或反应的组合制备本文中任何式的化合物的方法。该方法可包括使用本文描述的一种或多种中间体或化学试剂。
[0208]
本技术还提供了包含治疗有效量的本技术化合物、或其药学上可接受的盐或酯和药学上可接受的载体的药物组合物。
[0209]
本技术的另一方面涉及试剂盒,其包含本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。在另一方面,本技术提供了试剂盒,其包含能够调节sting活性的化合物(所述化合物选自一种或多种本文公开的化合物或其药学上可接受的盐或酯)、任选地与第二药剂组合以及使用说明书。
[0210]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物,其用于制备药物,该药物用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0211]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物在制备药物中的用途,该药物用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0212]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物,其用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0213]
本技术的另一方面涉及本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物的用途,其用于调节(例如抑制或刺激)sting蛋白、用于治疗或预防疾病(其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关)、或用于治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0214]
合成化合物的方法
[0215]
本技术的化合物可以使用市售的起始材料、文献中已知的化合物或由容易制备的中间体通过使用本领域技术人员已知的或本领域技术人员根据本文的教导显而易见的标准合成方法和工艺制备。用于制备有机分子以及官能团转化和操作的标准合成方法和工艺可以从相关科学文献或该领域的标准教科书中获得。尽管不限于任何一种或几种来源,但通过引用并入本文的经典教科书例如例如smith,m.b.,march,j.,march’s advanced organic chemistry:reactions,mechanisms,and structure,5
th edition,john wiley&sons:new york,2001;和greene,t.w.,wuts,p.g.m.,protective groups in organic synthesis,3
rd edition,john wiley&sons:new york,1999是本领域技术人员已知的有用
且公认的有机合成参考教科书。合成方法的以下描述旨在说明但不限制制备本技术化合物的一般工艺。这些工艺通常在整个工艺结束时或接近结束时提供所需的最终化合物,尽管在某些情况下可能需要进一步将化合物转化为其药学上可接受的盐、酯或前药。合适的合成路线在以下方案中描述。
[0216]
本领域技术人员将认识到本文公开的化合物中是否存在立体中心。因此,本技术包括两种可能的立体异构体(除非在合成中指明)并且不仅包括外消旋化合物而且还包括单独的对映异构体和/或非对映异构体。当需要化合物为单一对映异构体或非对映异构体时,它可以通过立体有择合成或通过拆分最终产物或任何方便的中间体来获得。最终产物、中间体或起始物的拆分可受本领域已知的任何合适方法的影响。参见例如"stereochemistry of organic compounds"by e.l.eliel,s.h.wilen,and l.n.mander(wiley-lnterscience,1994)。
[0217]
本技术的化合物可以以有机合成领域技术人员熟知的多种方式制备。举例来说,本技术的化合物可以使用下述方法以及合成有机化学领域中已知的合成方法或如本领域技术人员所理解的对其的变体来合成。优选的方法包括但不限于以下描述的那些方法。
[0218]
本技术的化合物可以按照以下方案中概述的步骤合成,其包含不同顺序的组装中间体。起始物可商购获得或通过报道文献中的已知工艺或如图所示制备。如以下方案所示,本技术的化合物可以通过与已知化合物的过渡金属催化的交叉偶联反应合成。如下所示的交叉偶联反应可提供本技术的化合物或中间体,其可进一步氢化或脱保护以提供目标化合物。
[0219]
方案1a-1d
[0220]
1a-1
[0221][0222]
1a-2
[0223][0224]
1a’[0225][0226]
1b
[0227][0228]
1c
[0229][0230]
如方案1a-1c所示,必需的苯胺(b1、b2、b3或b4)与适当取代的2-溴苯甲酸或2-碘苯甲酸(a)之间的铜催化的ullmann类型偶联产生相应的二苯基胺(c1、c2、c3或c4)(1a-1)。
或者,可根据1a-2或1a’制备二苯基胺(c1、c2、c3或c4)。二苯基胺(c1、c2、c3、c4)的环脱水得到取代的10h-吖啶-9-酮(d1、d2a、d2b、d3或d4)(1b)。10h-吖啶-9-酮(d1、d2a、d2b、d3或d4)的烷基化,然后皂化,生成目标化合物(e1、e2a、e2b、e3或e4)(1c)。
[0231]
方案2
[0232][0233]
如方案2所示,本技术的化合物或其前体可以通过化合物f的溴化,然后按照上述步骤进行皂化来制备。
[0234]
方案3a
[0235][0236]
方案3b
[0237][0238]
如方案3a和3b所示,本技术的化合物可以通过sonogashira偶联制备,其产物可以进行氢化以生成本技术的其他化合物。
[0239]
方案4
[0240][0241]
如方案4所示,本技术的化合物可以通过suzuki偶联制备,其产物可以进行皂化或氢化以生成本技术的其他化合物。
[0242]
方案5a和5b
[0243]
5a
[0244][0245]
5b
[0246][0247]
方案6a-6f
[0248]
6a
[0249][0250]
6b
[0251][0252]
6c
[0253][0254]
6d
[0255][0256]
6e
[0257][0258]
6f
[0259][0260]
方案7
[0261][0262]
方案8
[0263][0264]
方案9a
[0265][0266]
方案9b
[0267][0268]
方案10
[0269][0270]
方案11
[0271][0272]
方案12
[0273][0274]
本技术的另外的化合物可以使用根据方案5-12的工艺来制备。
[0275]
通过将化合物的游离碱形式与药学上可接受的无机或有机酸反应,可以将本技术的化合物制备为药学上可接受的酸加成盐。或者,本技术化合物的药学上可接受的碱加成盐可以通过使化合物的游离酸形式与药学上可接受的无机或有机碱反应来制备。药学上可接受的盐可以包括各种抗衡离子,例如无机或有机酸的抗衡离子、无机或有机碱的抗衡离子、或通过抗衡离子交换得到的抗衡离子。
[0276]
可用于本文方法中的酸和碱是本领域已知的。酸催化剂是任何酸性化学品,其性质可以是无机的(例如盐酸、硫酸、硝酸、三氯化铝)或有机的(例如樟脑磺酸、对甲苯磺酸、乙酸、三氟甲磺酸镱)。酸可以催化量或化学计量量使用以促进化学反应。碱是任何碱性化学品,其性质可以是无机的(例如碳酸氢钠、氢氧化钾)或有机的(例如三乙胺、吡啶)。碱可以催化量或化学计量量使用以促进化学反应。
[0277]
或者,本技术化合物的盐形式可以使用起始物或中间体的盐来制备。本技术化合
物的游离酸或游离碱形式可分别由相应的碱加成盐或酸加成盐形式制备。例如,酸加成盐形式的本技术化合物可以通过用合适的碱(例如氢氧化铵溶液、氢氧化钠等)处理而转化为相应的游离碱。碱加成盐形式的本技术化合物可以通过用合适的酸(例如盐酸等)处理而转化为相应的游离酸。
[0278]
本技术的含氮化合物可以通过用氧化剂(例如3-氯过氧苯甲酸(m-cpba)和/或过氧化氢)处理而转化为n-氧化物,以提供本技术的其他化合物。因此,当化合价和结构允许时,所有所示和要求保护的含氮化合物被认为包括所示化合物及其n-氧化物衍生物(其可以被指定为n
→
o或n
+-o-)。此外,在其他情况下,本技术化合物中的氮可以转化为n-羟基或n-烷氧基化合物。例如,n-羟基化合物可以通过用氧化剂例如m-cpba氧化母体胺来制备。当化合价和结构允许时,所有所示和要求保护的含氮化合物也被认为涵盖所示化合物及其n-羟基(即n-oh)和n-烷氧基(即n-or,其中r为取代或未取代的c
1-c 6
烷基、c
1-c6烯基、c
1-c6炔基、3-14-元碳环或3-14-元杂环)衍生物。
[0279]
本技术化合物的前药可以通过本领域普通技术人员已知的方法制备(例如,进一步的细节参见saulnier等人,(1994),bioorganic and medicinal chemistry letters,第4卷,第1985页)。例如,可以通过使本技术的非衍生化合物与合适的氨甲酰化剂(例如1,1-酰氧基烷基氨基甲酰氯(1,1-acyloxyalkylcarbanochloridate)、碳酸对-硝基苯基酯等)反应,来制备合适的前药。具体地,本发明化合物的中心n-乙酸部分和其他类似的羧酸基团可以通过本领域已知的技术进行修饰以生成本发明的有效前药。
[0280]
本技术化合物的被保护衍生物可以通过本领域普通技术人员已知的方式制备。在t.w.greene,"protecting groups in organic chemistry",第3版,john wiley和sons,inc.,1999中可以找到适合于生成保护基以及除去保护基的技术的详细描述。
[0281]
本技术化合物可以作为溶剂化物(例如,水合物)方便地制备或在应用过程中形成。本技术化合物的水合物可以通过使用有机溶剂例如二氧芑、四氢呋喃或甲醇从含水/有机溶剂混合物中重结晶而方便地制备。
[0282]
旋光异构体可以通过本文所述的方法或通过拆分外消旋混合物由它们各自的旋光前体制备。拆分可在拆分剂存在下,通过色谱法或通过重复结晶或通过本领域技术人员已知的这些技术的某种组合来进行。有关拆分的更多详细信息可在jacques,等人,enantiomers,racemates,and resolutions(john wiley&sons,1981)中找到。
[0283]
合成的化合物可以从反应混合物中分离出来,并通过例如柱色谱法、高压液相色谱法或重结晶等方法进一步纯化。本领域技术人员可以理解,合成本文通式的化合物的进一步方法对于本领域普通技术人员是显而易见的。此外,各种合成步骤可以交替的顺序或次序进行,以得到所需的化合物。此外,本文描述的溶剂、温度、反应持续时间等仅用于说明目的,本领域普通技术人员将认识到反应条件的变化可生成本技术所需的桥连大环产物。可用于合成本文所述化合物的合成化学转化和保护基团方法(保护和脱保护)是本领域已知的,并且包括例如在r.larock,comprehensive organic transformations,vch publishers(1989);t.w.greene和p.g.m.wuts,protective groups in organic synthesis,2d.ed.,john wiley and sons(1991);l.fieser和m.fieser,fieser and fieser's reagents for organic synthesis,john wiley和sons(1994);和l.paquette,ed.,encyclopedia of reagents for organic synthesis,john wiley和sons(1995)及其
后续版本中描述的那些。
[0284]
可以通过本文描述的任何合成方式附加各种官能团来修饰本技术的化合物以增强选择性生物学特性。此类修饰是本领域已知的并且包括增加生物渗透到给定生物系统(例如血液、淋巴系统、中枢神经系统)、增加口服利用度、增加溶解度以允许通过注射给药、改变代谢和改变排泄率的那些修饰。
[0285]
生物测定
[0286]
本技术化合物的生物活性可以通过本领域普通技术人员已知的各种生物化学或细胞测定法来测量。生物化学和细胞测定法的非限制性实例在下文中列出。
[0287]
swat蛋白fp竞争剂量响应测定
[0288]
在存在或不存在本技术化合物的情况下,将经验证的sting配体,例如用读出信号(例如荧光信号,如荧光素)标记的c-di-gmp与sting-ctd(例如小鼠sting-ctd或人sting-ctd)混合。测量读出信号的变化(例如,通过荧光各向异性)以确定化合物与sting-ctd的结合。
[0289]
药物组合物
[0290]
在另一方面,提供了一种药物组合物。该药物组合物包含治疗有效量的本技术化合物或其药学上可接受的盐或酯,以及药学上可接受的载体。
[0291]
本技术的化合物可以通过任何常规途径作为药物组合物给药,特别是肠内给药,例如口服给药,例如以片剂或胶囊的形式,或胃肠外给药,例如注射液或混悬液的形式,或局部给药,例如以洗剂、凝胶、软膏或霜剂的形式,或以鼻或栓剂的形式。
[0292]
包含游离形式或药学上可接受的盐形式的本技术化合物和至少一种药学上可接受的载体或稀释剂的药物组合物可以通过混合、制粒或包衣方法以常规方式制备。例如,口服组合物可以是片剂或明胶胶囊,其含有活性成分和a)稀释剂,例如乳糖、右旋糖、蔗糖、甘露醇、山梨糖醇、纤维素和/或甘氨酸;b)润滑剂,例如二氧化硅、滑石粉、硬脂酸、其镁盐或钙盐和/或聚乙二醇;对于片剂,还含有c)粘合剂,如硅酸镁铝、淀粉糊、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮;如果需要d)崩解剂,如淀粉、琼脂、海藻酸或其钠盐,或泡腾合剂;和/或e)吸收剂、着色剂、调味剂和甜味剂。可注射组合物可以是等渗水溶液或悬浮液,栓剂可以由脂肪乳剂或悬浮液制备。该组合物可以被灭菌和/或含有佐剂,例如防腐剂、稳定剂、润湿剂或乳化剂、溶液促进剂、用于调节渗透压的盐和/或缓冲剂。此外,它们还可能含有其他具有治疗价值的物质。适合经皮应用的制剂包括有效量的本技术化合物与载体。载体可以包含可吸收的药理学上可接受的溶剂以帮助通过宿主的皮肤。例如,透皮装置可以是绷带的形式,其包含背衬构件、含有任选地具有载体的化合物的储库、任选地可在较长时间内以受控和预定的速率将化合物递送至宿主皮肤的速率控制屏障,以及将装置固定到皮肤上的工具。也可以使用基质透皮制剂。用于例如皮肤和眼睛的局部应用的合适制剂优选是本领域公知的水溶液、软膏、乳膏或凝胶。这些可能含有增溶剂、稳定剂、张力增强剂、缓冲剂和防腐剂。
[0293]
本技术的药物组合物包含与一种或多种药学上可接受的载体一起配制的治疗有效量的本技术的化合物。如本文所用,术语“药学上可接受的载体”是指任何类型的无毒、惰性固体、半固体或液体填充剂、稀释剂、包封材料或制剂助剂。可用作药学上可接受的载体的材料的一些实例包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白质类例
如人血清白蛋白、缓冲物质例如磷酸盐、甘氨酸、山梨酸或山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质例如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、聚丙烯酸酯、蜡、聚乙烯聚氧丙烯嵌段聚合物、羊毛脂、糖类例如乳糖、葡萄糖和蔗糖;淀粉例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物例如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;黄蓍胶粉;麦芽;明胶;滑石;赋形剂例如可可脂和栓剂蜡、油类例如花生油、棉籽油;红花油;芝麻油;橄榄油;玉米油和大豆油;二醇类例如丙二醇、聚乙二醇;酯类例如油酸乙酯和月桂酸乙酯、琼脂;缓冲剂例如氢氧化镁和氢氧化铝;海藻酸;无热原水、等渗盐水;林格氏溶液;乙醇和磷酸盐缓冲溶液,以及其他无毒相容的润滑剂,如十二烷基硫酸钠和硬脂酸镁,以及着色剂、释放剂、包衣衣料、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可以根据配方设计师的判断是否存在于组合物中。
[0294]
本技术的药物组合物可以口服、直肠、肠胃外、脑池内、阴道内、腹膜内、局部(如通过粉剂、软膏剂或滴剂)、向颊给药或作为口腔或鼻喷雾剂施用于人和其他动物。
[0295]
用于口服给药的液体剂型可包括药学上可接受的乳液、微乳液、溶液、悬浮液、糖浆和酏剂。除活性化合物外,液体剂型可含有本领域常用的惰性稀释剂,例如水或其他溶剂、增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油类(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和脱水山梨糖醇的脂肪酸酯,以及它们的混合物。除惰性稀释剂外,口腔用组合物还可包括佐剂,例如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂和芳香剂。
[0296]
可根据已知技术使用合适的分散剂或润湿剂和悬浮剂配制可注射制剂,例如无菌可注射水性或油性混悬剂。无菌可注射制剂也可以是在无毒肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液、悬浮液或乳液,例如在1,3-丁二醇中的溶液。可以使用的可接受的载体和溶剂包括水、林格氏溶液、u.s.p.和等渗氯化钠溶液。此外,无菌的不挥发油通常用作溶剂或悬浮介质。为此目的,可以使用任何温和的固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸例如油酸用于制备注射剂。
[0297]
为了延长药物的作用,通常希望通过皮下或肌肉注射减慢药物的吸收。这可以通过使用水溶性差的结晶或无定形物质的液体悬浮液来实现。药物的吸收速率取决于它的溶解速率,而溶解速率又可能取决于晶体大小和晶型。或者,肠胃外给药的药物形式的延迟吸收是通过将药物溶解或悬浮在油性载体中来实现的。
[0298]
用于直肠或阴道给药的组合物优选是栓剂,其可通过将本技术的化合物与合适的非刺激性赋形剂或载体混合来制备,所述赋形剂或载体为例如可可脂、聚乙二醇或栓剂蜡,其在环境温度下为固体但在体温下为液体,因此其在直肠或阴道腔中融化并释放活性化合物。
[0299]
类似类型的固体组合物也可用作软和硬填充明胶胶囊中的填充剂,使用赋形剂如乳糖或牛奶糖以及高分子量聚乙二醇等。
[0300]
活性化合物也可以是含有一种或多种上述赋形剂的微囊形式。片剂、糖衣丸、胶囊剂、丸剂和颗粒剂的固体剂型可使用包衣和外壳例如肠溶包衣、控释包衣和药物配制领域众所周知的其他包衣制备。在这种固体剂型中,活性化合物可以与至少一种惰性稀释剂例如蔗糖、乳糖或淀粉混合。此类剂型还可以按照常规惯例包含除惰性稀释剂之外的其他物
质,例如压片润滑剂和其他压片助剂,例如硬脂酸镁和微晶纤维素。在胶囊、片剂和丸剂的情况下,该剂型还可包含缓冲剂。
[0301]
本技术化合物的局部或经皮给药的剂型包括软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、粉剂、溶液剂、喷雾剂、吸入剂或贴剂。活性成分在无菌条件下与药学上可接受的载体和任何可能需要的防腐剂或缓冲剂混合。眼用制剂、滴耳剂、眼膏、粉剂和溶液也被认为在本技术的范围内。
[0302]
除了本技术的活性化合物外,软膏剂、糊剂、乳膏剂和凝胶剂还可含有赋形剂,例如动植物脂肪、油、蜡、石蜡、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石和氧化锌,或它们的混合物。
[0303]
除了本技术的化合物之外,粉剂和喷雾剂还可包含赋形剂,例如乳糖、滑石、硅酸、氢氧化铝、硅酸钙和聚酰胺粉末,或这些物质的混合物。喷雾剂还可以含有常用的推进剂,例如氯氟烃。
[0304]
透皮贴剂具有可向身体受控递送化合物的额外优点。这种剂型可以通过将化合物溶解或分散在适当的介质中来制备。吸收促进剂也可用于增加化合物穿过皮肤的流量。可以通过提供速率控制膜或通过将化合物分散在聚合物基质或凝胶中来控制速率。
[0305]
对于任何化合物,治疗有效量可以在例如肿瘤细胞的细胞培养试验中,或在动物模型(通常是大鼠、小鼠、兔、狗或猪)中初步估计。动物模型也可用于确定合适的浓度范围和给药途径。然后可以使用这些信息来确定用于人体的有用剂量和给药途径。治疗/预防效力和毒性可以在细胞培养物或实验动物中通过标准制药工艺来确定,例如ed
50
(对50%的群体治疗有效的剂量)和ld
50
(对50%的群体致死的剂量)。毒性与治疗效果的剂量比即为治疗指数,其可表示为比值ld
50
/ed
50
。优选表现出大治疗指数的药物组合物。剂量可在此范围内变化,这取决于所采用的剂型、患者的敏感性和给药途径。
[0306]
调整剂量和给药以提供足够水平的活性剂或维持所需的效果。可以考虑的因素包括疾病状态的严重程度、受试者的总体健康状况、受试者的年龄、体重和性别、饮食、给药时间和频率、药物组合、反应敏感性和对治疗的耐受性/反应。取决于特定制剂的半衰期和清除率,长效药物组合物可以每3至4天、每周或每两周给药一次。
[0307]
单位剂量的组合物中活性成分(例如,所公开的化合物或其盐、水合物、溶剂化物或异构体的制剂)的量是有效量并且根据所涉及的特定治疗而变化。本领域技术人员将理解,有时需要根据患者的年龄和病况对剂量进行常规变化。该剂量也将取决于给药途径。考虑了多种途径,包括口服、肺部、直肠、肠胃外、经皮、皮下、静脉内、肌肉内、腹膜内、吸入、口腔、舌下、胸膜内、鞘内、鼻内等。本技术化合物的局部或经皮给药的剂型包括粉剂、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。在一个实施方案中,在无菌条件下将活性化合物与药学上可接受的载体以及任何所需的防腐剂、缓冲剂或推进剂混合。
[0308]
含有本技术的活性化合物的药物组合物可以以公知的方式制备,例如通过常规混合、溶解、制粒、糖衣丸制造、研磨、乳化、包封、包埋或冻干工艺。可以使用一种或多种药学上可接受的载体以常规方式配制药物组合物,所述载体包括促进将活性化合物加工成可药用制剂的赋形剂和/或助剂。当然,合适的制剂取决于所选择的给药途径。
[0309]
本技术公开的化合物的配制和给药技术可以在remington:the science and practice of pharmacy,19
th edition,mack publishing co.,easton,pa(1995)中找到。在
一个实施方案中,本文所述的化合物及其药学上可接受的盐与药学上可接受的载体或稀释剂组合用于药物制剂中。合适的药学上可接受的载体包括惰性固体填充剂或稀释剂和无菌水溶液或有机溶液。该化合物将以足以提供本文所述范围内的所需剂量的量存在于此类药物组合物中。
[0310]
使用方法
[0311]
一方面,本技术提供了一种调节(例如,抑制或刺激)sting蛋白的方法。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。
[0312]
在一些实施方案中,sting蛋白活性的调节通过ic
50
测量。在一些实施方案中,sting蛋白活性的调节通过ec
50
测量。
[0313]
本技术的化合物(例如,具有本文所述的任何式的化合物,或选自本文所述的任何化合物)能够治疗或预防疾病,其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关,或为与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病。
[0314]
一方面,本技术提供了治疗或预防疾病的方法,其中该疾病由sting表达、活性和/或功能(例如sting表达、活性和/或功能的失调)引起或与其相关。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。一方面,该疾病是sting介导的障碍。
[0315]
一方面,本技术提供了治疗或预防与sting蛋白参与的一种或多种细胞内途径失调(例如,细胞内dsdna介导的i型干扰素激活的失调)相关的疾病的方法。该方法包括向有此需要的受试者给药有效量的本技术的化合物或其药学上可接受的盐或酯、或本技术的药物组合物。
[0316]
在一个实施方案中,本技术提供一种治疗或预防本文所述的任何疾病、病症和障碍的方法,其中受试者是人。在一个实施方案中,本技术提供了一种治疗方法。在一个实施方案中,本技术提供了一种预防方法。
[0317]
作为sting蛋白的调节剂,本技术的化合物和组合物特别适用于治疗疾病、病症或障碍或减轻其严重性,其中sting蛋白或sting所涉及的一种或多种细胞内途径与该疾病、病症或障碍有关。在一个实施方案中,本技术提供了一种使用调节非典型环状二核苷酸(cdn)(例如2
’3’
cgamp)与sting蛋白结合的化合物来治疗疾病、病症或障碍或减轻其严重性的方法。在一个实施方案中,本技术提供了一种用调节i型干扰素和/或i型ifn应答合成的化合物治疗疾病、病症或障碍或减轻其严重性的方法。
[0318]
一方面,本技术还提供了一种治疗或预防细胞增殖性疾病例如增生、发育异常或癌前期病变的方法。发育异常是病理学家在活检中可识别的最早形式的癌前期病变。本技术的化合物可以为了防止增生、发育异常或癌前期病变继续扩大或变成癌的目的而给药。癌前期病变的实例可能发生在皮肤、食道组织、乳房和宫颈上皮内组织中。
[0319]
在一个实施方案中,该疾病或障碍包括但不限于免疫病变、自身免疫、细胞增殖性疾病或障碍、癌症、炎症、恶病质、神经退行性疾病或障碍、神经系统疾病或障碍、心脏功能障碍、移植或感染(例如,病毒、细菌和/或真菌感染,或由其他微生物引起的感染)。
[0320]
在一个实施方案中,该疾病或障碍是细胞增殖性疾病或障碍。
[0321]
如本文所用,术语“细胞增殖性障碍”是指其中细胞的不受调节或异常生长或两者可导致不想要的病症或疾病的发展的病症,所述病症或疾病可能是或可能不是癌性的。示例性细胞增殖性疾病或障碍包括其中细胞分裂失调的多种病症。示例性的细胞增殖性障碍包括但不限于赘生物、良性肿瘤、恶性肿瘤、癌前期病变、原位肿瘤、包膜肿瘤、转移性肿瘤、液体肿瘤、实体瘤、免疫肿瘤、血液肿瘤、癌症、癌、白血病、淋巴瘤、肉瘤和快速分裂的细胞。如本文所用,术语“快速分裂细胞”被定义为以超过或大于相同组织内相邻或并列细胞之间预期或观察到的速度分裂的任何细胞。细胞增殖性疾病或障碍包括初期癌或癌前病变。细胞增殖性疾病或障碍包括癌症。
[0322]
在一个实施方案中,该增殖性疾病或障碍是非癌性的。在一个实施方案中,该非癌性疾病或障碍包括但不限于类风湿性关节炎;炎症;自身免疫性疾病;淋巴增生性疾病;肢端肥大症;类风湿性脊柱炎;骨关节炎;痛风;其他关节炎;败血症;感染性休克;内毒素性休克;革兰氏阴性脓毒症;中毒性休克综合征;哮喘;成人呼吸窘迫综合征;慢性阻塞性肺疾病;慢性肺部炎症;炎症性肠病;克罗恩病;皮肤相关的过度增殖性疾病;银屑病;湿疹;特应性皮炎;色素沉着过度疾病;眼相关的过度增殖性疾病;老年性黄斑变性;溃疡性结肠炎;胰囊性纤维化;肝纤维化;急慢性肾病;肠易激综合征;发热(pyresis);再狭窄;脑型疟疾;中风和缺血性损伤;神经外伤;阿尔茨海默病;亨廷顿病;帕金森氏病;急慢性疼痛;变应性鼻炎;变应性结膜炎;慢性心力衰竭;急性冠脉综合征;恶病质;疟疾;麻疯病;利什曼病;莱姆病;reiter综合征;急性滑膜炎;肌肉变性、滑囊炎;肌腱炎;腱鞘炎;椎间盘突出、破裂或脱垂综合征;骨硬化症;血栓形成;再狭窄;矽肺病;肺结节病(pulmonary sarcosis);骨吸收疾病,如骨质疏松症;移植物抗宿主反应;纤维脂肪增生;脊髓小脑共济失调1型;cloves综合征;丑角样鱼鳞病;巨指综合征;proteus综合征(wiedemann综合征);leopard综合征;系统性硬化症;多发性硬化症;狼疮;纤维肌痛;艾滋病和其他病毒性疾病,如带状疱疹、单纯疱疹i或ii、流感病毒和巨细胞病毒;糖尿病;偏侧增生-多发性脂肪瘤综合征(hemihyperplasia-multiple lipomatosis syndrome);巨脑畸形;罕见的低血糖症、klippel-trenaunay综合征;错构瘤;cowden综合征;或发育过度-高血糖症。
[0323]
在一个实施方案中,该增殖性疾病或障碍为癌症。在一个实施方案中,该癌症为肺癌、结肠癌、乳腺癌、前列腺癌、肝癌、胰腺癌、脑癌、肾癌、卵巢癌、胃癌、皮肤癌、骨癌、胃癌、乳腺癌、胰腺癌、神经胶质瘤、胶质母细胞瘤、肝细胞癌、乳头状肾癌、头颈部鳞状细胞癌、白血病、淋巴瘤、骨髓瘤或实体瘤。
[0324]
术语“癌症”包括但不限于以下癌症:乳腺癌;卵巢癌;宫颈癌;前列腺癌;睾丸癌、泌尿生殖道癌;食道癌;喉癌、胶质母细胞瘤;神经母细胞瘤;胃癌;皮肤癌、角化棘皮瘤;肺癌、表皮样癌、大细胞癌、小细胞癌、肺腺癌;骨癌;结肠癌;结直肠癌;腺瘤;胰腺癌、腺癌;甲状腺癌、滤泡癌、未分化癌、乳头状癌;精原细胞瘤;黑色素瘤;肉瘤;膀胱癌;肝癌和胆道癌;肾癌;髓系疾病;淋巴疾病、霍奇金氏病、毛细胞;口腔和咽(口)、唇、舌、口、咽;小肠;结直肠、大肠、直肠、脑和中枢神经系统;慢性粒细胞白血病(cml)、白血病。术语“癌症”包括但不限于以下癌症:骨髓瘤、淋巴瘤或选自胃癌、肾癌或和以下癌症的癌症:头颈癌、口咽癌、非小细胞肺癌(nsclc)、子宫内膜癌、肝癌、非霍奇金淋巴瘤和肺癌。
[0325]
术语“癌症”还指由恶性肿瘤细胞增殖引起的任何癌症,例如肿瘤、赘生物、癌、肉瘤、白血病、淋巴瘤等。例如,癌症包括但不限于间皮瘤、白血病和淋巴瘤,例如皮肤t细胞淋
巴瘤(ctcl)、非皮肤外周t细胞淋巴瘤、与人类t细胞淋巴细胞病毒(htlv)相关的淋巴瘤,例如成人t细胞白血病/淋巴瘤(atll)、b细胞淋巴瘤、急性非淋巴细胞白血病、慢性淋巴细胞白血病、慢性髓性白血病、急性髓性白血病、淋巴瘤和多发性骨髓瘤、非霍奇金淋巴瘤、急性淋巴性白血病(all)、慢性淋巴性白血病(cll)、霍奇金淋巴瘤、伯基特淋巴瘤、成人t细胞白血病淋巴瘤、急性髓样白血病(aml)、慢性髓样白血病(cml)或肝细胞癌。其他实例包括骨髓增生异常综合征、儿童实体瘤例如脑瘤、神经母细胞瘤、视网膜母细胞瘤、维尔姆斯瘤、骨肿瘤、软组织肉瘤、成人常见实体瘤例如头颈癌(例如口腔癌、喉癌、鼻咽癌和食道癌)、泌尿生殖系统癌(例如前列腺癌、膀胱癌、肾癌、子宫癌、卵巢癌、睾丸癌)、肺癌(例如小细胞癌和非小细胞癌)、乳腺癌、胰腺癌、黑色素瘤和其他皮肤癌、胃癌、脑瘤、gorlin综合征相关的肿瘤(例如髓母细胞瘤、脑膜瘤等)和肝癌。可由主题化合物治疗的其他示例性癌症形式包括但不限于骨骼癌或平滑肌癌、胃癌、小肠癌、直肠癌、唾液腺癌、子宫内膜癌症、肾上腺癌、肛门癌、直肠癌、甲状旁腺癌和垂体癌。
[0326]
癌症还可能包括结肠癌、家族性腺瘤性息肉病和遗传性非息肉性结肠直肠癌或黑色素瘤。此外,癌症包括但不限于唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、甲状腺癌(甲状腺髓样癌和乳头状甲状腺癌)、肾癌、肾实质癌、宫颈癌、子宫体癌、子宫内膜癌、绒毛膜癌、睾丸癌、泌尿系统癌、黑色素瘤、脑瘤例如胶质母细胞瘤、星形细胞瘤、脑膜瘤、髓母细胞瘤和外周神经外胚瘤、胆囊癌、支气管癌、多发性骨髓瘤、基底细胞瘤、畸胎瘤、视网膜母细胞瘤、脉络膜黑色素瘤、精原细胞瘤、横纹肌肉瘤、颅咽管瘤、骨肉瘤、软骨肉瘤、肌肉肉瘤、脂肪肉瘤、纤维肉瘤、尤因肉瘤和浆细胞瘤。
[0327]
癌症还可能包括结直肠癌、甲状腺癌、乳腺癌和肺癌;以及骨髓增生性疾病,例如真性红细胞增多症,血小板增多症,骨髓化生伴骨髓纤维化、慢性髓性白血病、慢性粒单核细胞白血病、嗜酸细胞增多综合征、幼年型粒单核细胞白血病和系统性肥大细胞病。在一个实施方案中,本技术的化合物可用于治疗造血疾病,特别是急性髓性白血病(aml)、慢性髓性白血病(cml)、急性早幼粒细胞白血病和急性淋巴细胞白血病(all)。
[0328]
示例性的癌症还可包括但不限于肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、锁肛痔、肛管癌症、阑尾癌、儿童小脑星形细胞瘤、儿童大脑星形细胞瘤、基细胞癌、皮肤癌(非黑色素瘤)、胆癌、肝外胆管癌、肝内胆管癌、膀胱癌、泌尿膀胱癌、骨与关节癌、骨肉瘤和恶性纤维组织细胞瘤、脑癌、脑瘤、脑干神经胶质瘤、小脑星形细胞瘤、大脑星形细胞瘤/恶性神经胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤(supratentorial primitive neuroectodeimal tumors)、视通路和下丘脑神经胶质瘤、乳腺癌、支气管腺瘤/类癌、类癌瘤、胃肠癌、神经系统癌、神经系统淋巴瘤、中枢神经系统癌、中枢神经系统淋巴瘤、宫颈癌、儿童期癌症、慢性淋巴细胞白血病、慢性髓性白血病、慢性脊髓增生性病症、结肠癌、结直肠癌、皮肤t细胞淋巴瘤、淋巴样瘤、蕈样肉芽肿病、seziary综合征、子宫内膜癌症、食管癌、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、肝外胆管癌、眼癌、眼内黑色素瘤、视网膜母细胞瘤、胆囊癌、胃(gastric(stomach))癌、胃肠道类癌、胃肠道间质瘤(gist)、生殖细胞肿瘤、卵巢生殖细胞肿瘤、妊娠滋养细胞肿瘤神经胶质瘤、头颈癌、肝细胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼内黑色素瘤、眼癌、胰岛细胞肿瘤(内分泌胰腺)、卡波西肉瘤、肾癌、肾脏癌、肾癌、喉癌、急性淋巴细胞白血病、急性髓性白血病、慢性淋巴细胞白血病、慢性髓性白血病、毛细胞白血病、唇和口腔癌、肝癌、肺癌、非小细胞肺癌、小细胞肺癌、aids相关淋巴
瘤、非霍奇金淋巴瘤、原发性中枢神经系统淋巴瘤、华氏巨球蛋白血症、成神经管细胞瘤、黑色素瘤、眼内(眼)黑色素瘤、默克尔细胞癌、恶性间皮瘤、间皮瘤、转移性鳞状颈癌、口腔癌、舌菌、多发性内分泌肿瘤综合征、蕈样肉芽肿病、骨髓增生异常综合征、骨髓增生异常/骨髓增生性疾病、慢性髓性白血病、急性髓性白血病、多发性骨髓瘤、慢性脊髓增生性病症、鼻咽癌、神经母细胞瘤、口癌、口腔癌、口咽癌、卵巢癌、卵巢上皮癌、卵巢低恶性潜能肿瘤、胰腺癌、胰岛细胞胰腺癌、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体母细胞瘤和幕上原始神经外胚层肿瘤、垂体瘤、浆细胞肿瘤/多发性骨髓瘤、胸膜肺母细胞瘤、前列腺癌、直肠癌、肾盂和输尿管、移行细胞癌、视网膜母细胞瘤、横纹肌肉瘤、涎腺癌、尤因家族的肉瘤肿瘤(ewing family of sarcoma tumors)、卡波西肉瘤、软组织肉瘤、子宫癌、子宫肉瘤、皮肤癌(非黑色素瘤)、皮肤癌(黑色素瘤)、默克尔细胞皮肤癌、小肠癌、软组织肉瘤、鳞状细胞癌、胃(stomach(gastric))癌、幕上原始神经外胚层肿瘤、睾丸癌症、喉癌、胸腺瘤、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管及其他泌尿器官的移行细胞癌、妊娠滋养细胞肿瘤、尿道癌症、子宫内膜癌、子宫肉瘤、子宫体癌、阴道癌症、外阴癌和肾母细胞瘤。
[0329]“血液系统的细胞增殖性障碍”是涉及血液系统细胞的细胞增殖性疾病或障碍。血液系统的细胞增殖性障碍可包括淋巴瘤、白血病、髓样肿瘤、肥大细胞肿瘤、骨髓增生异常、良性单克隆丙球蛋白病、淋巴瘤样肉芽肿病、淋巴瘤样丘疹病、真性红细胞增多症、慢性粒细胞白血病、原因不明性髓样化生和原发性血小板增多症。血液系统的细胞增殖性障碍可包括血液系统细胞的增生、发育异常和化生。本技术的化合物和组合物可用于治疗选自血液癌症或血液细胞增殖性障碍的癌症。血液癌症可包括多发性骨髓瘤、淋巴瘤(包括霍奇金淋巴瘤、非霍奇金淋巴瘤、儿童淋巴瘤、淋巴细胞和皮肤来源的淋巴瘤)、白血病(包括儿童白血病、毛细胞白血病、急性淋巴细胞白血病、急性粒细胞白血病、慢性淋巴细胞白血病、慢性粒细胞白血病、慢性髓性白血病和肥大细胞白血病)、髓样肿瘤和肥大细胞肿瘤。
[0330]“肺的细胞增殖性障碍”是涉及肺细胞的细胞增殖性疾病或障碍。肺的细胞增殖性障碍可包括影响肺细胞的所有形式的细胞增殖性障碍。肺的细胞增殖性障碍可包括肺癌、肺的初期癌或癌前病变、肺的良性生长或病变、和肺的恶性生长或病变、以及除肺之外的身体组织和器官中的转移性病变。本技术的化合物和组合物可用于治疗肺癌或肺的细胞增殖性障碍。肺癌可包括所有形式的肺的癌症。肺癌可包括恶性肺肿瘤、原位癌、典型类癌和非典型类癌。肺癌可包括小细胞肺癌(“sclc”)、非小细胞肺癌(“nsclc”)、鳞状细胞癌、腺癌、小细胞癌、大细胞癌、腺鳞状细胞癌和间皮瘤。肺癌可包括“瘢痕癌”、细支气管肺泡癌、巨细胞癌、梭形细胞癌和大细胞神经内分泌癌。肺癌可包括具有组织学和超微结构异质性(例如混合细胞类型)的肺肿瘤。
[0331]
肺的细胞增殖性障碍还可包括肺的增生、化生和发育异常。肺的细胞增殖性障碍可包括石棉诱导的增生、鳞状上皮化生和良性反应性间皮细胞化生。肺的细胞增殖性障碍可包括用复层鳞状上皮替代柱状上皮和粘膜发育异常。暴露于吸入的有害环境因素(如香烟烟雾和石棉)的个体可能会增加患肺的细胞增殖性障碍的风险。可能使个体易患肺的细胞增殖性障碍的既往肺病可包括慢性间质性肺病、坏死性肺病、硬皮病、类风湿病、结节病、间质性肺炎、肺结核、反复肺炎、特发性肺纤维化、肉芽肿、石棉沉滞症、纤维化肺泡炎和霍奇金病。
[0332]“结肠的细胞增殖性障碍”是涉及结肠细胞的细胞增殖性障碍。结肠的细胞增殖性
障碍包括结肠癌。本技术的化合物和组合物可用于治疗结肠癌或结肠的细胞增殖性障碍。结肠癌可包括所有形式的结肠的癌症。结肠癌可包括散发性和遗传性结肠癌。结肠癌可包括恶性结肠肿瘤、原位癌、典型类癌和非典型类癌。结肠癌可包括腺癌、鳞状细胞癌和腺鳞状细胞癌。结肠癌可与选自遗传性非息肉性结肠直肠癌、家族性腺瘤性息肉病、gardner综合征、波伊茨-耶格综合征、turcot综合征和幼年性息肉病的遗传性综合征相关。结肠癌可由选自遗传性非息肉性结肠直肠癌、家族性腺瘤性息肉病、gardner综合征、波伊茨-耶格综合征、turcot综合征和幼年性息肉病的遗传性综合征引起。
[0333]
结肠的细胞增殖性障碍还可以包括结肠癌、结肠的癌前病变、结肠的腺瘤性息肉和结肠的异时性病变。结肠的细胞增殖性障碍可包括腺瘤。结肠的细胞增殖性障碍的特征在于结肠的增生、化生和发育异常。可能使个体易患结肠的细胞增殖性障碍的既往结肠疾病可包括既往结肠癌。可能使个体易患结肠的细胞增殖性障碍的当前的疾病可包括克罗恩病和溃疡性结肠炎。结肠的细胞增殖性障碍可能与选自p53、ras、fap和dcc的基因的突变有关。由于选自p53、ras、fap和dcc的基因中存在突变,个体患结肠的细胞增殖性障碍的风险可能升高。
[0334]“胰腺的细胞增殖性障碍”是涉及胰腺细胞的细胞增殖性障碍。本技术的化合物和组合物可用于治疗胰腺癌或胰腺的细胞增殖性障碍。胰腺的细胞增殖性障碍可包括影响胰腺细胞的所有形式的细胞增殖性障碍。胰腺的细胞增殖性障碍可包括胰腺癌、胰腺的初期癌或癌前病变、胰腺增生和胰腺发育异常、胰腺的良性生长或病变、胰腺的恶性生长或病变、以及除胰腺之外的身体组织和器官中的转移性病变。胰腺癌包括所有形式的胰腺的癌症。胰腺癌可包括导管腺癌、腺鳞癌、多形性巨细胞癌、粘液腺癌、破骨细胞样巨细胞癌、粘液性囊腺癌、腺泡癌、未分类的大细胞癌、小细胞癌、胰腺母细胞瘤、乳头状肿瘤、粘液性囊腺瘤、乳头状囊性肿瘤和浆液性囊腺瘤。胰腺癌还可包括具有组织学和超微结构异质性(例如混合细胞类型)的胰腺肿瘤。
[0335]“前列腺的细胞增殖性障碍”是涉及前列腺细胞的细胞增殖性障碍。本技术的化合物和组合物可用于治疗前列腺癌或前列腺的细胞增殖性障碍。前列腺的细胞增殖性障碍可包括影响前列腺细胞的所有形式的细胞增殖性障碍。前列腺的细胞增殖性障碍可包括前列腺癌、前列腺的初期癌或癌前病变、前列腺的良性生长或病变、前列腺的恶性生长或病变、以及除前列腺之外的身体组织和器官中的转移性病变。前列腺的细胞增殖性障碍可包括前列腺的增生、化生和发育异常。
[0336]“皮肤的细胞增殖性障碍”是涉及皮肤细胞的细胞增殖性障碍。本技术的化合物和组合物可用于治疗皮肤癌或皮肤的细胞增殖性障碍。皮肤的细胞增殖性障碍可包括影响皮肤细胞的所有形式的细胞增殖性障碍。皮肤的细胞增殖性障碍可包括皮肤的初期癌或癌前病变、皮肤的良性生长或病变、黑色素瘤、恶性黑色素瘤和皮肤的其他恶性生长或病变,以及除皮肤之外的身体组织和器官中的转移性病变。皮肤的细胞增殖性障碍可包括皮肤的增生、化生和发育异常。
[0337]“卵巢的细胞增殖性障碍”是涉及卵巢细胞的细胞增殖性障碍。本技术的化合物和组合物可用于治疗卵巢癌或卵巢的细胞增殖性障碍。卵巢的细胞增殖性障碍可包括影响卵巢细胞的所有形式的细胞增殖性障碍。卵巢的细胞增殖性障碍可包括卵巢的初期癌或癌前病变、卵巢的良性生长或病变、卵巢癌、卵巢的恶性生长或病变,以及除卵巢之外的身体组
织和器官中的转移性病变。卵巢的细胞增殖性障碍可包括卵巢的增生、化生和发育异常。
[0338]“乳腺的细胞增殖性障碍”是涉及乳腺细胞的细胞增殖性障碍。本技术的化合物和组合物可用于治疗乳腺癌或乳腺的细胞增殖性障碍。乳腺的细胞增殖性障碍可包括影响乳腺细胞的所有形式的细胞增殖性障碍。乳腺的细胞增殖性障碍可包括乳腺癌、乳腺的初期癌或癌前病变、乳腺的良性生长或病变、乳腺的恶性生长或病变,以及除乳腺之外的身体组织和器官中的转移性病变。乳腺的细胞增殖性障碍可包括乳腺的增生、化生和发育异常。
[0339]
在一个实施方案中,该疾病或障碍包括但不限于由溶组织内阿米巴、卡氏肺囊虫、克氏锥虫、布氏锥虫、墨西哥利什曼原虫、溶组织梭菌、金黄色葡萄球菌、口蹄疫病毒或法氏短膜虫引起或与之相关的疾病或障碍,以及与骨质疏松症、自身免疫、血吸虫病、疟疾、肿瘤转移、异染性脑白质营养不良、肌营养不良症或肌萎缩相关的疾病或障碍。
[0340]
疾病或障碍的其他实例包括但不限于由兽医和人类病原性原生动物、由顶复门或肉蚧门、锥虫、疟原虫、利什曼原虫、巴贝虫和泰勒虫、隐孢子虫、骶囊虫、变形虫、球虫和滴虫的细胞内活性寄生虫引起或与之相关的疾病或障碍。例如,所述疾病或障碍包括但不限于由例如恶性疟原虫引起的热带疟疾;由间日疟原虫或卵形疟原虫引起的间日疟,由三日疟原虫引起的三日疟;由鼠弓形虫引起的弓形虫病;例如由贝氏等孢子球虫引起的球虫病;由猪-人肉孢子虫引起的肠道住肉孢子虫病;由溶组织内阿米巴引起的痢疾;由微小隐孢子虫引起的隐孢子虫病;由克氏锥虫引起的恰加斯病;由罗德西亚布氏锥虫或冈比亚布氏锥虫引起的昏睡病,皮肤和内脏以及其他形式的利什曼病;由兽医原虫(veterinary pathogenic protozoa)引起的疾病或障碍,例如小泰勒虫(引起牛东海岸热的病原体)、刚果锥虫或间日疟原虫、布氏锥虫(引起非洲牛锥虫病的病原体)、引起苏拉病的布氏锥虫、二联巴贝虫(引起牛和水牛患德克萨斯牛瘟的病原体)、牛巴贝虫(引起欧洲牛巴贝虫病以及狗、猫和羊患巴贝虫病的病原体)、羊犬住肉孢子虫(sarcocystis ovicanis)和绵羊-猫肉孢子虫(ovifelis)(引起绵羊、牛和猪患肉孢子虫病的病原体)、隐孢子虫(引起牛和鸟类患隐孢子虫病的病原体)、艾美球虫属和等孢子球虫属(引起兔、牛、绵羊、山羊、猪和鸟类尤其是鸡和火鸡患球虫病的病原体)。立克次体属包括诸如猫立克次体、普氏立克次体、立氏立克次体、斑疹伤寒立克次体、康氏立克次体、非洲立克次体,并引起诸如斑疹伤寒、立克次体痘、南欧斑疹热、非洲蜱咬热、洛矶山斑疹热、澳大利亚蜱传斑疹伤寒、弗林德斯岛斑疹热和昆士兰蜱传斑疹伤寒。
[0341]
在一个实施方案中,该疾病或障碍由一种或多种细菌引起或与之相关。细菌的实例包括但不限于革兰氏阳性菌(例如金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌和屎肠球菌、肺炎链球菌)和革兰氏阴性菌(例如铜绿假单胞菌、洋葱伯克霍尔德菌、嗜麦芽黄单胞菌、大肠杆菌、肠杆菌属、肺炎克雷伯菌和沙门氏菌属)。
[0342]
在一个实施方案中,该疾病或障碍由一种或多种真菌引起或与之相关。真菌的实例包括但不限于白色念珠菌、新型组织胞浆菌、粗球孢子菌和马尔尼菲青霉。
[0343]
在一个实施方案中,该疾病或障碍是神经系统疾病或障碍。在一个实施方案中,该神经系统疾病或障碍涉及中枢神经系统(例如,脑、脑干和小脑)、外周神经系统(例如,颅神经)和/或自主神经系统(例如,其部分位于中枢和外周神经系统)。
[0344]
神经系统障碍的实例包括但不限于获得性癫痫样失语症;急性播散性脑脊髓炎;肾上腺脑白质营养不良;老年性黄斑变性;胼胝体发育不全;失认症;艾卡迪综合征;亚历山
大病;alpers病;交叉性肢体瘫痪;阿尔茨海默病;血管性痴呆;肌萎缩侧索硬化;无脑畸形;angelman综合征;血管瘤病;缺氧;失语症;失用症;蛛网膜囊肿;蛛网膜炎;anronl-chiari畸形;动静脉畸形;阿斯佩格综合征;共济失调毛细血管扩张症;注意力缺陷多动障碍;自闭症;自主神经功能障碍;背痛;batten病;贝切特病;贝尔麻痹;良性自发眼睑痉挛;良性局灶性;肌萎缩;良性颅内高压;宾斯旺格病;眼睑痉挛;bloch sulzberger综合征;臂丛神经损伤;脑脓肿;脑损伤;脑肿瘤(包括多形性胶质母细胞瘤);脊柱肿瘤;brown-sequard综合征;canavan病;腕管综合征;灼性神经痛;中枢性疼痛综合症;脑桥中央髓鞘溶解;头部疾病;脑动脉瘤;脑动脉硬化症;大脑萎缩;大脑性巨人症;脑瘫;夏-马-图三氏病;化疗引起的神经病和神经性疼痛;chiari畸形;舞蹈病;慢性炎性脱髓鞘性多发性神经病;慢性疼痛;慢性局部疼痛综合征;coffinlowry综合征;昏迷,包括持续性植物人状态;先天性面瘫;皮质基底节变性;颅动脉炎;颅缝早闭;克雅氏病;累积性创伤障碍;柯兴综合征;嗜酸性巨细胞包涵体疾病;巨细胞病毒感染;舞蹈眼-舞蹈脚综合征(dancing eyes-dancing feet syndrome);丹-沃二氏综合征;dawson病;德摩西埃综合征;dejerine-klumke麻痹;痴呆;皮肌炎;糖尿病神经病变;弥漫性硬化;家族性自主神经异常;书写障碍;阅读障碍;张力失常;早期幼儿癫痫性脑病;空蝶鞍综合征;脑炎;脑疝;脑三叉神经血管瘤病;癫痫;欧勃麻痹;特发性震颤;法布里病;法尔综合征;晕厥;家族性麻痹张力失常;家族性痉挛性瘫痪;发热性惊厥;菲希尔综合征;弗里德赖希共济失调症;额颞叶痴呆和其他“tau病变”;高歇氏病;格斯特曼综合征;巨细胞动脉炎;巨细胞性包涵体病;球形细胞脑白质营养不良;格林-巴利综合征;htlv-1相关的脊髓病;哈-斯二氏病;颅脑损伤;头痛;偏侧面肌痉挛;遗传性痉挛性截瘫;遗传病性多神经炎样共济失调;耳部带状疱疹;带状疱疹;平山综合征(hirayama syndrome);hiv相关性痴呆和神经病(还有aids的神经系统表现);前脑无裂畸形;亨廷顿病和其他多聚谷氨酰胺重复疾病(polyglutamine repeat diseases);积水性无脑畸形;脑积水;皮质醇增多症;缺氧;免疫介导的脑脊髓炎;包涵体肌炎;色素失调症;婴儿植烷酸贮积病;婴儿雷弗苏姆病;婴儿痉挛症;炎症性肌病;颅内囊肿;颅内高压症;朱伯特综合征;卡恩斯-塞尔综合征;肯尼迪病、舞蹈眼综合征(kinsbourne syndrome);克-费二氏综合征;克拉伯病;库格尔贝格-韦兰德病;库鲁病;拉福拉病;lambert-eaton肌无力综合征;landau-kleffner综合征;延髓外侧(wallenberg)综合征;学习障碍;利氏病;lennox-gastaut综合征;莱施-奈恩综合征;脑白质营养不良;路易体痴呆;无脑畸形;闭锁综合征;lou gehrig病(即运动神经元疾病或肌萎缩侧索硬化);lou gehrig病;腰椎间盘疾病;莱姆病—神经系统后遗症;machado-joseph病;脑肥大;巨脑;melkersson-rosenthal综合征;梅尼埃病;脑膜炎;门克斯病;异染性脑白质营养不良;小头畸形;偏头痛;米勒
·
费希尔综合征;小中风;线粒体肌病;默比乌斯综合征;单肢萎缩(monomelic amyotrophy);运动神经元疾病;烟雾病;粘多糖病;多发性梗塞性痴呆;多病灶运动神经病;多发性硬化症和其他脱髓鞘疾病;多系统萎缩伴体位性低血压;p肌营养不良症;重症肌无力;髓鞘质弥漫性硬化症;婴儿肌阵挛性脑病;肌阵挛;肌病;先天性肌强直;发作性睡病;神经纤维瘤病;神经阻滞剂恶性综合征;艾滋病的神经系统表现;狼疮的神经系统后遗症;神经性肌强直;神经元腊样脂褐质症;神经元迁移障碍;尼曼-皮克二氏病;o'sullivan-mcleod综合征;枕神经痛;隐匿性脊柱闭合不全序列;太田原综合征;橄榄体脑桥小脑萎缩;眼阵挛性肌阵挛(opsoclonus myoclonus);视神经炎;直立性低血压;过度使用综合征;感觉异常;帕金森病;先天性副肌强直症;副肿
瘤疾病;阵发性发作;帕罗综合征;佩利措伊斯-梅茨巴赫病;周期性瘫痪;周围神经病;疼痛性神经病和神经性疼痛;持续性植物人状态;广泛性发育障碍;光性喷嚏反射;植烷酸贮积病;皮克氏病;神经紧张;垂体瘤;多肌炎;脑穿通畸形;脊髓灰质炎后综合征;带状疱疹后神经痛;感染后脑脊髓炎;体位性低血压;普拉德-威利综合征;原发性侧索硬化症;朊病毒病;进行性面偏侧萎缩症;进行性多灶性白质脑病;进行性硬化性灰质萎缩(progressive sclerosing poliodystrophy);进行性核上麻痹;脑假瘤;ramsay-hunt综合征(i型和ii型);rasmussen脑炎;反射性交感神经营养不良综合征;雷夫叙姆病;重复性运动障碍;重复性压力损伤;不宁腿综合征;逆转录病毒相关脊髓病;rett综合征;瑞氏综合征;saint vitus舞蹈;sandhoff病;schilder病;裂脑畸形;透明隔-视神经发育不良;摇晃婴儿综合征;带状疱疹;shy-drager综合征;干燥综合征;睡眠呼吸暂停;soto综合征;痉挛状态;脊柱裂;脊髓损伤;脊髓肿瘤;脊髓性肌萎缩;僵人综合征;中风;斯特奇-韦伯二氏综合征;亚急性硬化性全脑炎;皮层下动脉硬化性脑病;西德纳姆舞蹈病;晕厥;脊髓空洞症;迟发性运动障碍;泰-萨克斯病;颞动脉炎;脊髓栓系综合征;肌强直性白内障;胸出口综合征;三叉神经痛症;todd麻痹;tourette综合征;短暂性脑缺血发作;传染性海绵状脑病;横贯性脊髓炎;外伤性脑损伤;震颤;三叉神经痛;热带痉挛性轻截瘫;结节性硬化症;血管性痴呆(多发梗死性痴呆);血管炎包括颞动脉炎;希林二氏病(von hippel-lindau disease);瓦伦伯格综合征;werdnig-hoffman病;west综合征;急性颈部扭伤(whiplash);威廉斯综合征;wildon病;和zellweger综合征。
[0345]
神经变性疾病的实例还可以包括但不限于肾上腺脑白质营养不良(ald)、亚历山大病、阿尔珀病、阿尔茨海默病、肌萎缩侧索硬化(lou gehrig病)、运动失调性毛细血管扩张症、batten病(也称为spielmeyer-vogt-sjogren-batten病)、牛海绵状脑病(bse)、canavan病、cockayne综合征、皮质基底节变性、克-雅氏病、家族性致死性失眠症、额颞叶退化、亨廷顿病、hiv相关性痴呆、肯尼迪病、克拉布病、路易体痴呆、神经疏螺旋体病、肯尼迪病、克拉伯病、路易体痴呆、神经疏螺旋体病、马查多-约瑟夫病(脊髓小脑共济失调3型)、球形细胞脑白质营养不良(krabbe's disease)、路易体痴呆、神经疏螺旋体病(neuroborreliosis)、马查多-约瑟夫病(脊髓小脑共济失调3型)、machado-joseph病(脊髓小脑共济失调3型)、多系统萎缩、多发性硬化症、发作性睡病、尼曼-皮克二氏病、帕金森病、佩-梅二氏病、皮克病、原发性侧索硬化症、朊病毒病、进行性核上性麻痹、植烷酸贮积症、sandhoff病、希德氏病(schilder's disease)、继发于恶性贫血的脊髓亚急性混合变性、spielmeyer-vogt-sjogren-batten病(也称为batten病)、脊髓小脑性共济失调(具有不同特征的多种类型)、脊髓性肌萎缩症、steele-richardson-olszewski病、脊髓痨和中毒性脑病。
[0346]
在一个实施方案中,该疾病或障碍是自身免疫性疾病。自身免疫性疾病的实例包括但不限于类风湿性关节炎、系统性红斑狼疮、炎性肠病(ibd)包括克罗恩病(cd)的和溃疡性结肠炎(uc),它们是具有多基因易感性的慢性炎症。
[0347]
在一个实施方案中,该疾病或障碍是炎症、关节炎、类风湿性关节炎、脊椎关节病、痛风性关节炎、骨关节炎、少年(慢性类风湿性)关节炎和其他关节炎病症、全身性红斑狼疮(sle)、皮肤相关疾病、牛皮癣、湿疹、烧伤、皮炎、神经炎症、变态反应、疼痛、神经性疼痛、发烧、肺部疾病、肺部炎症、成人呼吸窘迫综合征、肺结节病、哮喘、硅肺病、慢性肺部炎症和慢
性阻塞性肺疾病(copd)、心血管疾病、动脉硬化、心肌梗塞(包括心肌梗塞后适应症)、血栓形成、充血性心力衰竭、心肌缺血再灌注损伤,以及与高血压和/或心力衰竭相关的并发症,例如血管器官损伤、再狭窄、心肌病、中风(包括缺血性和出血性中风)、再灌注损伤、肾再灌注损伤、缺血(包括中风和脑缺血)以及由心脏/冠状动脉搭桥引起的缺血、神经退行性疾病、肝病和肾炎、胃肠道疾病、炎症性肠病、克罗恩病、胃炎、肠易激综合征、溃疡性结肠炎、溃疡性疾病、胃溃疡、病毒和细菌感染、败血症、感染性休克、革兰氏阴性败血症、疟疾、脑膜炎、hiv感染、机会致病菌感染、继发于感染或恶性肿瘤的恶病质、继发于获得性免疫缺陷综合征(aids)的恶病质、aids、arc(aids相关复合体)、肺炎、疱疹病毒、由感染引起的肌痛、流感、自身免疫性疾病、移植物抗宿主反应和同种异体移植物排斥、骨吸收疾病的治疗、骨质疏松症、多发性硬化症、癌症、白血病、淋巴瘤、结直肠癌、脑癌、骨癌、上皮细胞源性肿瘤(上皮癌)、基底细胞癌、腺癌、胃肠癌、唇癌、口癌、食道癌、小肠癌、胃癌、结肠癌、肝癌、膀胱癌、胰腺癌、卵巢癌、宫颈癌、肺癌、乳腺癌、皮肤癌、鳞状细胞癌和/或基底细胞癌、前列腺癌、肾细胞癌和其他影响全身上皮细胞的已知癌症、慢性髓性白血病(cml)、急性髓性白血病(aml)和急性早幼粒细胞白血病(apl)、血管生成包括瘤形成、转移、中枢神经系统疾病、具有炎症或凋亡成分的中枢神经系统疾病、阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化、脊髓损伤、周围神经病或b细胞淋巴瘤。
[0348]
在一个实施方案中,所述疾病或障碍选自自身免疫疾病、炎性疾病、增殖和过度增殖疾病、免疫介导的疾病、骨病、代谢疾病、神经和神经退行性疾病、心血管疾病、激素相关的疾病、变态反应、哮喘和阿尔茨海默病。在一个实施方案中,该疾病或障碍选自增殖性病症和免疫病症。
[0349]
作为sting蛋白的调节剂,本技术的化合物和组合物还可用于评估、研究或测试生物样品。本技术的一个方面涉及调节生物样品中sting蛋白的活性,包括将生物样品与本技术的化合物或组合物接触。
[0350]
如本文所用,术语“生物样品”是指体外或离体样品,包括但不限于细胞培养物或其提取物;从哺乳动物获得的活检材料或其提取物;以及血液、唾液、尿液、粪便、精液、眼泪或其他体液或其提取物。生物样品中蛋白激酶活性的调节(例如,抑制或刺激)可用于本领域技术人员已知的多种目的。此类目的的实例包括但不限于输血、器官移植和生物样本储存。
[0351]
本技术的另一方面涉及sting蛋白在生物学和病理现象中的研究;sting蛋白介导的细胞内信号转导通路的研究。这些用途的实例包括但不限于生物测定,例如酶测定和基于细胞的测定。
[0352]
本技术的化合物和组合物作为sting调节剂的活性可以在体外、体内或在细胞系中进行测定。体外测定包括通过竞争性结合测定确定sting配体与sting蛋白结合的调节(例如,抑制或刺激)的测定。替代的体外测定定量调节剂(例如抑制剂或刺激剂)与蛋白激酶结合的能力,并且可以通过在结合之前对调节剂(例如抑制剂或刺激剂)进行放射性标记、分离配体/蛋白质复合物并确定结合的放射性标记的量来测量。用于分析在本技术中用作调节剂或sting蛋白的化合物的详细条件在以下实施例中列出。
[0353]
根据上文,本技术提供了在需要此类治疗的受试者中预防或治疗本文所述的任何疾病或障碍的方法,其包括向受试者施用治疗有效量的本技术的化合物或其对映异构体、
非对映异构体、立体异构体或药学上可接受的盐,或本技术的药物组合物。对于任何上述用途,所需剂量将根据给药方式、待治疗的特定病症和所需效果而变化。
[0354]
本技术的化合物和组合物可以以治疗有效量与一种或多种治疗剂(药物组合)或物理疗法,例如抗增殖剂、抗癌剂、免疫调节剂(例如ctla-4和pd-1通路拮抗剂和其他免疫调节剂)、抗炎剂和/或抗病毒剂、和/或非药物疗法等在组合疗法中施用。例如,可以与抗增殖、抗癌、免疫调节(例如,ctla-4和pd-1通路拮抗剂和其他免疫调节剂)、抗炎和/或抗病毒物质产生协同作用。当本技术的化合物与其他疗法组合给药时,共同给药的化合物的剂量当然将根据所使用的共同药物的类型、所使用的具体药物、所治疗的病症等而变化。
[0355]
组合治疗可包括将主题化合物与一种或多种其他生物活性成分(例如但不限于第二sting调节剂、cgas-cdn-sting轴的调节剂或参与细胞内dsdna介导的1型干扰素激活的调节剂)进一步组合给药。其他生物活性成分还可包括抗增殖剂、抗癌剂(例如化疗剂)、免疫调节剂(例如ctla-4和pd-1通路拮抗剂和其他免疫调节剂)、抗体、脂质、脂质体、肽等。例如,本技术的化合物可以与其他药学活性化合物,优选能够增强本技术化合物的效果的化合物组合使用。本技术的化合物可以与其他药物疗法或治疗方式同时(作为单一制剂或分开的制剂)或依次给药。一般而言,组合疗法设想在单个治疗周期或疗程期间施用两种或更多种药物。
[0356]
在一个实施方案中,化疗剂是烷化剂;抗生素;抗代谢物;解毒剂;干扰素;多克隆或单克隆抗体;egfr抑制剂;her2抑制剂;组蛋白脱乙酰酶抑制剂;激素;有丝分裂抑制剂;mtor抑制剂;多激酶抑制剂;丝氨酸/苏氨酸激酶抑制剂;酪氨酸激酶抑制剂;vegf/vegfr抑制剂;紫杉烷或紫杉烷衍生物、芳香酶抑制剂、蒽环类药物、微管靶向药物、拓扑异构酶毒药、分子靶标或酶的抑制剂(例如,激酶抑制剂)、胞苷类似物药物或www.cancer.org/docroot/cdg/cdg_0.asp中列出的任何化疗、抗肿瘤或抗增殖剂。
[0357]
烷化剂是非相特异性试剂和强亲电子试剂。通常,烷化剂通过dna分子的亲核部分如磷酸根、氨基、巯基、羟基、羧基和咪唑基团,经烷基化与dna形成共价键。这种烷基化破坏了导致细胞死亡的核酸功能。烷化剂的实例包括但不限于氮芥,例如环磷酰胺(例如,)、美法仑(例如,)和苯丁酸氮芥(例如,);烷基磺酸酯(alkyl sulfonates),例如白消安(例如,);亚硝基脲,例如卡莫司汀(例如,);和三氮烯,例如达卡巴嗪(例如)。
[0358]
示例性的烷化剂还包括但不限于白消安(busulfex)、洛莫司汀(ceenu)、奥沙利铂(eloxatin)、卡莫司汀(gliadel)、异环磷酰胺(ifex)、甲氯乙胺(mustargen)、白消安(myleran)、卡铂顺铂(cddp,)、替莫唑胺(temodar)、噻替哌(thioplex)、苯达莫司汀(treanda)、链脲菌素(zanosar)、5-氮杂胞苷(例如,vidaza)、地西他滨(例如,decogen)、替莫唑胺(例如,temodar和temodal)、更生霉素(也称为放线菌素-d,以商品名cosmegen出售)、美法仑(也称为l-pam、l-肌溶素和苯丙氨酸芥末,以商品名alkeran出售)、六甲蜜胺(也称为六甲基三聚氰胺(hmm),以商品名hexalen出售)、卡莫司汀(例如,bcnu)、苯达莫司汀(例如,treanda)、卡铂(例如,)、洛莫司汀(也称为ccnu,以商品名出售)、顺铂(也称为cddp,以商品名和-aq出售)、环磷酰胺(以商品名和出售)、达
卡巴嗪(也称为dtic、dic和咪唑甲酰胺,以商品名出售)、六甲胺(也称为六甲基三聚氰胺(hmm),以商品名出售)、异环磷酰胺(例如,)、六甲蜜胺(也称为六甲基三聚氰胺(hmm),以商品名出售)、异环磷酰胺(例如,)、丙卡巴肼(例如,)、甲氯乙胺(也称为氮芥、芥子气和甲氯乙胺盐酸盐,以商品名出售)、链脲菌素(例如)和噻替哌(也称为硫代磷酰胺、tespa和tspa,以商品名出售)。
[0359]
抗生素抗肿瘤剂是非相特异性药物,其可与dna结合或嵌入。通常,这种作用会导致稳定的dna复合物或链断裂,从而破坏核酸的正常功能,导致细胞死亡。抗生素抗肿瘤剂的实例包括但不限于放线菌素例如更生霉素(例如,),蒽环类例如柔红霉素(例如,作为脂质体注射剂形式如或作为注射剂如)和阿霉素(例如,或adriamycin)和博来霉素(例如,)。
[0360]
示例性抗生素还包括但不限于多柔比星(adriamycin)、多柔比星脂质体(doxil)、米托蒽醌(novantrone)、博来霉素(blenoxane)、柔红霉素(cerubidine)、柔红霉素脂质体(daunoxome)、更生霉素(cosmegen)、表柔比星(ellence)、伊达比星(idamycin)、普卡霉素(mithracin)、丝裂霉素(mutamycin)、喷司他丁(nipent)、伐柔比星(valstar)、多柔比星(例如,和)、博来霉素(例如)、柔红霉素(也称为盐酸柔红霉素、柔红霉素和盐酸红霉素,以商品名出售)、柔红霉素脂质体(柠檬酸柔红霉素脂质体,以商品名daunoxome出售)、米托蒽醌(也称为dhad,以商品名出售)、表柔比星(例如ellence
tm
)、伊达比星(例如idamycin)和丝裂霉素c(例如)。
[0361]
抗代谢物抗肿瘤剂是在细胞周期的s期(dna合成)通过抑制dna合成或通过抑制嘌呤或嘧啶碱基合成从而限制dna合成而起作用的时相特异性药物。因此,s期不进行,细胞死亡随之而来。抗代谢物抗肿瘤剂的实例包括但不限于氟尿嘧啶及其类似物(例如,5-氟脱氧尿苷(氟尿苷)、5-氟脱氧尿苷单磷酸甲氨蝶呤)、阿糖胞苷(通常称为ara-c,可以获得)及其类似物(例如,氮杂胞苷、2',2'-二氟脱氧胞苷(吉西他滨))、巯嘌呤(例如)及其类似物(例如硫唑嘌呤)、硫鸟嘌呤(例如)及其类似物(例如喷司他丁、赤羟基壬基腺嘌呤(ehna)、磷酸氟达拉滨和克拉屈滨)、吉西他滨(例如)和甲氨蝶呤。
[0362]
示例性抗代谢物还包括但不限于氟尿嘧啶(adrucil)、卡培他滨(xeloda)、羟基脲(hydrea)、巯基嘌呤(purinethol)、培美曲塞(alimta)、氟达拉滨(fludara)、奈拉滨(arranon)、克拉屈滨(cladribine novaplus)、氯法拉滨(clolar)、阿糖胞苷(cytosar-u)、地西他滨(dacogen)、阿糖胞苷脂质体(depocyt)、羟基脲(droxia)、普拉曲沙(folotyn)、氟尿苷(fudr)、吉西他滨(gemzar)、克拉屈滨(leustatin)、氟达拉滨(oforta)、甲氨蝶呤(mtx、rheumatrex)、甲氨蝶呤(trexall)、硫鸟嘌呤(tabloid)、ts-1或阿糖胞苷(tarabine pfs)、克拉瑞滨(2-氯脱氧腺苷,以商品名出售)、5-氟尿嘧啶(以商品名出售)、6-硫鸟嘌呤(以商品名出售)、培美曲塞(以商品名
出售)、阿糖胞苷(也称为阿拉伯糖胞嘧啶(ara-c),以商品名出售)、阿糖胞苷脂质体(也称为脂质体ara-c,以商品名出售)、地西他滨(以商品名出售)、羟基脲和(以商品名和出售)、氟达拉滨(以商品名出售)、氟尿苷(以商品名出售)、克拉屈滨(也称为2-氯脱氧腺苷(2-cda),以商品名出售)、甲氨蝶呤(也称为氨甲蝶呤、甲氨蝶呤钠(mtx),以商品名和trexall
tm
出售)和喷司他丁(以商品名出售)。
[0363]
示例性的解毒剂包括但不限于氨磷汀(ethyol)和美司钠(mesnex)。
[0364]
示例性的干扰素包括但不限于干扰素α-2b(intron a)和干扰素α-2a(roferon-a)。
[0365]
示例性的多克隆或单克隆抗体包括但不限于曲妥珠单抗(herceptin)、奥法木单抗(arzerra)、贝伐珠单抗(avastin)、利妥昔单抗(rituxan)、西妥昔单抗(erbitux)、帕尼单抗(vectibix)、托西莫单抗/碘
131
托西莫单抗(bexxar)、阿仑珠单抗(campath)、替伊莫单抗(泽娃灵(zevalin)、in-111、y-90泽娃灵)、吉妥珠单抗(麦罗塔)、依库珠单抗(舒立瑞)和ordenosumab。
[0366]
示例性的egfr抑制剂包括但不限于吉非替尼(iressa)、拉帕替尼(tykerb)、西妥昔单抗(erbitux)、厄洛替尼(特罗凯)、帕尼单抗(vectibix)、pki-166、卡纳替尼(ci-1033)、马妥珠单抗(emd7200))和ekb-569。
[0367]
示例性的her2抑制剂包括但不限于曲妥珠单抗(herceptin);拉帕替尼(tykerb)和ac-480。
[0368]
示例性的组蛋白脱乙酰酶抑制剂包括但不限于伏立诺他(zolinza)。
[0369]
激素和激素类似物是治疗癌症的有用化合物,其中激素与癌症的生长和/或缺乏生长之间存在关系。用于癌症治疗的激素和激素类似物的实例包括但不限于肾上腺皮质激素,例如泼尼松和泼尼松龙;氨基鲁米特和其他芳香酶抑制剂,如阿那曲唑、来曲唑、伏洛唑和依西美坦;孕激素,如醋酸甲地孕酮;雌激素和抗雌激素如氟维司群、氟他胺、尼鲁他胺、比卡鲁胺、醋酸环丙孕酮和5-还原酶如非那雄胺和度他雄胺;抗雌激素,例如他莫昔芬、托瑞米芬、雷洛昔芬、屈洛昔芬、碘氧芬,以及选择性雌激素受体调节剂(serms),例如美国专利号5,681,835、5,877,219和6,207,716中描述的那些;和促性腺激素释放激素(gnrh)及其类似物;和lhrh激动剂和拮抗剂,如醋酸戈舍瑞林和卢普洛利。
[0370]
示例性的激素还包括但不限于他莫昔芬(soltamox、nolvadex)、雷洛昔芬(evista)、甲地孕酮(megace)、亮丙瑞林(lupron、lupron depot、eligard、viadur)、氟维司群(faslodex)、来曲唑(femara)、曲普瑞林(trelstar la,trelstar depot)、依西美坦(aromasin)、戈舍瑞林(zoladex)、比卡鲁胺(casodex)、阿那曲唑(arimidex)、氟甲睾酮(androxy、halotestin)、甲羟孕酮(provera、depo-provera)、雌莫司汀(emcyt)、氟他胺(eulexin)、托瑞米芬(fareston)、地加瑞克(firmagon)、尼鲁他胺(nilandron)、阿巴瑞克(plenaxis)或睾酮内酯(teslac)。
[0371]
抗微管或抗有丝分裂剂或有丝分裂抑制剂是在细胞周期的m期或有丝分裂期期间对肿瘤细胞的微管具有活性的时相特异性药物。抗微管剂的实例包括但不限于二萜类和长
春花生物碱。二萜类化合物的实例包括但不限于紫杉醇(例如,)及其类似物多西紫杉醇(例如,)。长春花生物碱的实例包括但不限于长春碱(例如,)、长春新碱(例如,)和长春瑞滨(例如,)。
[0372]
示例性的有丝分裂抑制剂还包括但不限于紫杉醇(taxol、onxol、abraxane)、多西他赛(taxotere)、长春新碱(oncovin、vincasar pfs)、长春碱(velban)、依托泊苷(toposar、etopophos、vepesid)、替尼泊苷(vumon)、伊沙匹隆(ixempra)、诺考达唑、埃坡霉素、长春瑞滨(navelbine)、喜树碱(cpt)、伊立替康(camptosar)、拓扑替康(hycamtin)、安吖啶和层板菌素d(lam-d)。
[0373]
示例性的mtor抑制剂还包括但不限于依维莫司(afinitor)、替西罗莫司(torisel)、雷帕霉素、42-(二甲基亚膦酰)雷帕霉素(ridaforolimus)和ap23573。
[0374]
示例性的多激酶抑制剂包括但不限于索拉非尼(多吉美)、舒尼替尼(sutent)、bibw 2992、e7080、zd6474、pkc-412、托西莫单抗和ap24534。
[0375]
示例性的丝氨酸/苏氨酸激酶抑制剂包括但不限于鲁伯斯塔(ruboxistaurin)、eril/easudil盐酸盐、flavopiridol、塞利西利(seliciclib)(cyc202、roscovitrine)、sns-032(bms-387032)、pkc412、苔藓虫素(bryostatin)、kai-9803、sf1126、vx-680、azd1152、arry-142886(azd-6244)、scio-469、gw681323、cc-401、cep-1347和pd 332991。
[0376]
丝氨酸/苏氨酸激酶抑制剂还包括map激酶级联阻断剂,其包括raf激酶(rafk)、丝裂原或细胞外调节激酶(mek)和细胞外调节激酶(erk)的阻断剂;和蛋白激酶c家族成员阻断剂,包括pkc(α、β、γ、ε、μ、λ、ι、ζ)、ikb激酶家族(ikka、ikkb)、pkb家族激酶、akt激酶家族成员和tgfβ受体激酶的阻断剂。丝氨酸/苏氨酸激酶抑制剂还描述在j.biochem.126,799(1999),biochem.pharmacol.60,1101(2000);cancer surveys 27,41(1996);cancer treatment res.78,3(1995);bioorg.med.chem.letters 10,223(2000);美国专利号6,268,391;和int.j.cancer 88,44(2000)中。
[0377]
酪氨酸激酶(也是非受体酪氨酸激酶)包括但不限于csrc、lck、fyn、yes、jak、cabl、fak(粘着斑激酶)、brutons酪氨酸激酶和bcr-abl。非受体酪氨酸激酶抑制剂描述于j.hematotherapy stem cell res.8,465(1999)和annual rev.immunol.15,371(1997)中。
[0378]
示例性的酪氨酸激酶抑制剂还包括但不限于厄洛替尼(特罗凯)、吉非替尼(iressa)、伊马替尼(gleevec)、索拉非尼(多吉美)、舒尼替尼(sutent)、曲妥珠单抗(赫赛汀)、贝伐珠单抗(阿瓦斯汀)、利妥昔单抗(rituxan)、拉帕替尼(tykerb)、西妥昔单抗(erbitux)、帕尼单抗(vectibix)、依维莫司(afinitor)、阿仑单抗(campath)、吉妥珠单抗(mylotarg)、替西罗莫司(torisel)、帕唑帕尼(votrient)、达沙替尼(sprycel)、尼罗替尼(tasigna)、瓦他拉尼(伐拉尼布)(ptk787、zk222584)、cep-701、su5614、mln518、xl999、vx-322、azd0530、bms-354825、ski-606cp-690、ag-490、whi-p154、whi-p131、ac-220和amg888。
[0379]
示例性的vegf/vegfr抑制剂包括但不限于贝伐珠单抗(avastin)、索拉非尼(多吉美)、舒尼替尼(sutent)、雷珠单抗、哌加他尼(pegaptanib)和凡德他尼(vandetinib)、阿西替尼、brivanib alaninate((s)-((r)-l-(4-(4-氟-2-甲基-lh-吲哚-5-基氧基)-5-甲基吡咯并[2,1-f][l,2,4]三嗪-6-基氧基)丙-2-基)2-氨基丙酸酯,也称为bms-582664)、莫替沙尼(tst-(2,3-二氢-3,3-二甲基-lh-吲哚-6-基)-2-[(4-吡啶基甲基)氨基]-3-吡啶甲酰胺)和帕瑞肽(也称为so 230)。
[0380]
磷脂酰肌醇-3激酶家族成员的抑制剂,包括pekinese、atm、dna-pk和ku的阻断剂也可以与本技术的化合物组合。curr.opinion immunol.8,412(1996);oncogene 17,3301(1998);int.j.biochem.cell biol.29,935(1997);和cancer res.60,1541(2000)中讨论了此类抑制剂。
[0381]
示例性的激酶抑制剂还包括但不限于贝伐珠单抗(靶向vegf)、bibw2992(靶向egfr和erb2)、西妥昔单抗/爱必妥(靶向erb1)、伊马替尼/格列卫(靶向bcr-abl)、曲妥珠单抗(靶向erb2)、吉非替尼/易瑞沙(靶向egfr)、雷珠单抗(靶向vegf)、哌加他尼(靶向vegf)、厄洛替尼/特罗凯(靶向erb1)、尼洛替尼(靶向bcr-abl)、拉帕替尼(靶向erb1和erb2/her2)、gw-572016/二甲苯磺酸拉帕替尼(靶向her2/erb2)、帕木单抗/vectibix(靶向egfr)、凡德他尼(靶向ret/vegfr)、e7080(多靶标,包括ret和vegfr)、赫赛汀(靶向her2/erb2)、pki-166(靶向egfr)、卡纳替尼/ci-1033(靶向egfr)、舒尼替尼/su-11464/sutent(sutent)(靶向egfr和flt3)、马妥珠单抗/emd7200(靶向egfr)、ekb-569(靶向egfr)、zd6474(靶向egfr和vegfr)、pkc-412(靶向vegr和flt3)、伐拉尼布/ptk787/zk222584(靶向vegr)、cep-701(靶向flt3)、su5614(靶向flt3)、mln518(靶向flt3)、xl999(靶向flt3)、vx-322(靶向flt3)、azd0530(靶向src)、bms-354825(靶向src)、ski-606(靶向src)、cp-690(靶向jak)、ag-490(靶向jak)、whi-p154(靶向jak)、whi-p131(靶向jak)、索拉非尼/多吉美(靶向raf激酶、vegfr-1、vegfr-2、vegfr-3、pdgfr-β、kit、flt-3和ret)、达沙替尼/sprycel(bcr/abl和src)、ac-220(靶向flt3)、ac-480(靶向所有her蛋白,“panher”)、二磷酸莫替沙尼(靶向vegf1-3、pdgfr和c-kit)、地舒单抗(靶向rankl、抑制src)、amg888(靶向her3)和ap24534(多靶标,包括flt3)。
[0382]
示例性的微管靶向药物包括但不限于紫杉醇、多西紫杉醇、长春新碱、长春碱、诺考达唑、埃博霉素和诺维本。
[0383]
示例性的拓扑异构酶毒药包括但不限于替尼泊苷、依托泊苷、阿霉素、喜树碱、柔红霉素、更生霉素、米托蒽醌、安吖啶、表柔比星和伊达比星。
[0384]
其他拓扑异构酶毒药包括拓扑异构酶ii抑制剂,例如表鬼臼毒素。表鬼臼毒素的实例包括但不限于依托泊苷(vp-16,)和替尼泊苷(vm-26,)。
[0385]
示例性的紫杉烷或紫杉烷衍生物包括但不限于紫杉醇和多西紫杉醇。
[0386]
受体激酶配体结合的抗体拮抗剂也可作为抑制剂。实例包括imclone c225 egfr特异性抗体(参见cancer treat.rev.26,269(2000))、erbb2抗体(参见breast cancer res.2,176(2000))和2cb vegfr2特异性抗体(参见cancer res.60,5117(2000))。实例包括imclone c225 egfr特异性抗体(参见cancer treat.rev.26,269(2000))、erbb2抗体(参见breast cancer res.2,176(2000))和2cb vegfr2特异性抗体(参见cancer res.60,5117(2000))。
[0387]
包括非受体mek血管生成抑制剂在内的抗血管生成治疗剂也可以与本技术的化合物组合。抗血管生成剂,例如抑制血管内皮生长因子作用的那些药物(例如,贝伐珠单抗[avastin
tm
])和通过其他机制起作用的化合物(例如,利诺胺、整合素ανβ3功能抑制剂、内皮抑素和血管抑制素)。
[0388]
可以与本技术的化合物组合的其他治疗剂还包括破坏各种酶或衔接蛋白中的sh2
或sh3结构域结合的sh2/sh3结构域阻断剂,包括pi3-k p85亚基、src家族激酶、衔接分子(she、crk、nek、grb2)和ras-gap。j.pharm.toxicol.methods 34,125(1995)中讨论了作为抗癌药物的sh2/sh3结构域阻断剂。
[0389]
可以与本技术的化合物组合的另外的治疗剂还包括肌醇信号传导抑制剂,例如磷脂酶c阻断剂和肌醇类似物。这类信号抑制剂描述于new molecular targets for cancer chemotherapy ed.,paul workman和david kerr,crc press 1994,london中。
[0390]
可以与本技术的化合物组合的另外的治疗剂还包括ras癌基因的抑制剂,包括法尼基转移酶、牻牛儿基牻牛儿基转移酶和caax蛋白酶的抑制剂,以及反义寡核苷酸、核酶和免疫疗法。此类抑制剂在j.biomed.sci.7,292(2000);curr.opin.lipidology 9,99(1998);和biochim.biophys.acta,1423,19(1989)中讨论。
[0391]
可以与本技术的化合物组合的另外的示例性一般化学治疗剂、抗肿瘤剂或抗增殖剂还包括但不限于六甲蜜胺(hexalen)、异维a酸(accutane、amnesteem、claravis、sotret)、维甲酸(vesanoid)、阿扎胞苷(vidaza)、硼替佐米(velcade)、天冬酰胺酶(elspar)、左旋咪唑(ergamisol)、米托坦(lysodren)、丙卡巴肼(matulane)、培门冬酶(oncaspar)、地尼白介素(denileukin diftitox)(ontak)、卟菲尔钠(photofrin)、阿地白介素(proleukin)、来那度胺(revlimid)、贝沙罗汀(targretin)、沙利度胺(thalomid)、替西罗莫司(torisel)、三氧化二砷(trisenox)、维替泊芬(visudyne)、含羞草碱(leucenol)(1m替加氟-0.4m 5-氯-2,4-二羟基嘧啶-1m氧嗪酸钾)和洛伐他汀。
[0392]
可与本技术的化合物组合的另外的治疗剂还包括抗病毒剂,其包括但不限于乙型肝炎病毒(hbv)抑制剂、丙型肝炎病毒(hcv)蛋白酶抑制剂、hcv聚合酶抑制剂、hcv ns4a抑制剂、hcv ns5 a抑制剂、hcv ns5b抑制剂和人类免疫缺陷病毒(hiv)抑制剂。
[0393]
可以与本技术的化合物组合的另外的治疗剂还包括抗原或佐剂,其包括但不限于b7共刺激分子、白介素-2、干扰素-y、gm-csf、ctla-4拮抗剂、ox-40/0x-40配体、cd40/cd40配体、沙格司亭、左旋咪唑、痘苗病毒、卡介苗(bcg)、脂质体、明矾、弗氏完全或不完全佐剂、解毒内毒素、矿物油、表面活性物质例如脂卵磷脂、普卢兰尼克多元醇(pluronic polyol)、聚阴离子、肽和油或烃乳液。在一个实施方案中,可以添加佐剂,例如氢氧化铝或磷酸铝,以增加疫苗触发、增强或延长免疫应答的能力。在一个实施方案中,还可以使用其他物质如细胞因子、趋化因子和细菌核酸序列,如cpg、toll样受体(tlr)9激动剂以及另外的激动剂如tlr 2、tlr 4、tlr 5、tlr 7、tlr8、tlr9激动剂,包括脂蛋白、lps、单磷酰脂类a、脂磷壁酸、咪喹莫德、瑞喹莫德,此外还可以使用视黄酸诱导基因i(rig-i)激动剂例如poly i:c。
[0394]
可以与本技术的化合物组合的另外的治疗剂还包括细胞毒性剂,其包括但不限于三氧化二砷门冬酰胺酶(也称为l-门冬酰胺酶和欧文氏菌属l-门冬酰胺酶,以商品名和出售)。
[0395]
可以与本技术的化合物组合的另外的治疗剂还包括类视黄醇,包括但不限于阿利维a酸(以商品名出售)、维a酸(全反式维甲酸,也称为atra,以商品名出售)、异维a酸(13-c/s-维a酸,以商品名以商品名和的出售),和
贝沙罗汀(以商品名出售)。
[0396]
可与本技术的化合物组合使用的另外的示例性化疗剂包括但不限于醋酸阿比特龙、六甲蜜胺、脱水长春碱、奥瑞他汀、贝沙罗汀、比卡鲁胺、bms 184476、2,3,4,5,6-五氟-n-(3-氟-4-甲氧基苯基)苯磺酰胺、博来霉素、n,n-二甲基-l-缬氨酰基-l-缬氨酰基-n-甲基-l-缬氨酰基-l-脯氨酰基-1-l脯氨酸-叔丁基酰胺、恶病质素、西马多丁、苯丁酸氮芥、环磷酰胺、3',4'-二脱氢-4'-去氧-8'-去甲长春碱(norvin-caleukoblastine)、多烯紫杉醇(docetaxol)、多西他赛(doxetaxel)、环磷酰胺、卡铂、卡莫司汀、顺铂、念珠藻素、环磷酰胺、阿糖胞苷、达卡巴嗪(dtic)、更生霉素、柔红霉素、地西他滨、多拉司他汀、多柔比星(阿霉素)、依托泊苷、5-氟尿嘧啶、非那雄胺、氟他胺、羟基脲和羟基脲和紫杉烷、异环磷酰胺、利罗唑、氯尼达明、洛莫司汀(ccnu)、mdv3100、二氯甲基二乙胺(氮芥)、美法仑、羟乙基磺酸米伏布林、根霉素、舍替尼夫、链脲菌素、丝裂霉素、甲氨蝶呤、紫杉烷类、尼鲁米特、纳武单抗、奥那司酮、紫杉醇、派姆单抗、泼尼莫司汀、丙卡巴肼、rpr109881、磷酸司莫司汀、他莫昔芬、他索纳明、泰素、维甲酸、长春碱、长春新碱、硫酸长春地辛和长春氟宁。
[0397]
可以与本技术的化合物组合的另外的治疗剂还包括细胞周期信号传导抑制剂、促凋亡剂、parp抑制剂、检查点治疗剂和免疫调节剂。
[0398]
细胞周期信号传导抑制剂抑制参与细胞周期控制的分子。称为细胞周期蛋白依赖性激酶(cdk)的蛋白激酶家族及其与称为细胞周期蛋白的蛋白家族的相互作用控制着真核细胞周期的进程。不同细胞周期蛋白/cdk复合物的协调激活和失活对于细胞周期的正常进程是必要的。几种细胞周期信号传导抑制剂正在开发中。例如,细胞周期蛋白依赖性激酶的实例包括cdk2、cdk4和cdk6,并且其抑制剂描述于exp.opin.ther.patents 10,215(2000)中。
[0399]
在促凋亡方案中使用的治疗剂(例如,bcl-2反义寡核苷酸)也可以与本技术的化合物组合使用。
[0400]
如本文所用,parp抑制剂是指酶聚adp核糖聚合酶(parp)的一组药理学抑制剂。示例性的parp抑制剂包括但不限于奥拉帕利(azd-2281,由astra zeneca)、rucaparib(pf-01367338,由clovis oncology)、niraparib(mk-4827,由tesaro)、talazoparib(bmn-673)、veliparib(abt-888)、奥拉帕利(azd-2281)、奥拉帕利toparp-a、rucaparib(pf-01367338、ag014699)、cep 9722、e7016(由eisai开发)、bgb-2901、iniparib(bsi 201)和3-氨基苯甲酰胺。
[0401]
用于免疫治疗方案的药剂也可与本技术的化合物组合使用。免疫治疗方法包括增加患者肿瘤细胞免疫原性的体外和体内方法例如用细胞因子(例如白细胞介素2、白细胞介素4或粒细胞-巨噬细胞集落刺激因子)转染、降低t细胞能量的方法、使用转染的免疫细胞(例如细胞因子转染的树突细胞)的方法、使用细胞因子转染的肿瘤细胞系的方法,以及使用抗独特型抗体的方法。
[0402]
如本文所用,检查点抑制剂疗法是指靶向免疫检查点的癌症治疗免疫疗法的形式,免疫检查点是刺激或抑制其作用的免疫系统的关键调节剂,这可使肿瘤保护自身免受免疫系统的攻击。检查点疗法可以阻断抑制性检查点,恢复免疫系统功能。
[0403]
如本文所用,“免疫调节剂”是指任何物质,包括影响免疫系统的单克隆抗体。免疫
调节剂可用作治疗癌症的抗肿瘤剂。例如,免疫调节剂包括但不限于抗-ctla-4抗体,例如伊匹木单抗(yervoy)和抗-pd-1抗体(opdivo/纳武单抗和keytruda/派姆单抗)。其他免疫调节剂包括但不限于icos抗体、ox-40抗体、pd-l1抗体、lag3抗体、tim-3抗体、41bb抗体和gitr抗体。
[0404]
clta-4和pd-1通路是免疫应答的重要负调节因子。活化的t细胞上调ctla-4,ctla-4与抗原呈递细胞结合并抑制t细胞刺激、il-2基因表达和t细胞增殖。pd-1与活性t细胞结合并抑制t细胞活化。pd-1与活性t细胞结合并抑制t细胞活化。pd-1拮抗剂已证明具有抗肿瘤作用。可与本技术的化合物组合使用的ctla-4和pd-1途径拮抗剂包括伊匹木单抗、曲美木单抗、纳武单抗、派姆单抗、ct-011、amp-224和mdx-1106。
[0405]
如本文所用,pd-1抑制剂和pd-l1抑制剂是指可用于治疗癌症的一组检查点抑制剂或免疫检查点抑制剂。pd1和pd-l1都是存在于细胞表面的蛋白质。pd-1和pd-l1抑制剂的作用是抑制程序性死亡配体(pd-l1)与其受体程序性细胞死亡蛋白1(pd-1)的结合。示例性的pd-1和/或pd-l1抑制剂包括但不限于纳武单抗(opdivo)、派姆单抗(mk-3475或或兰利珠单抗、keytruda)、阿特珠单抗(tecentriq)、阿维单抗(bavencio)、度伐鲁单抗(imfinzi)、皮地利珠单抗、amp-224、amp-514、pdr001、cemiplimab、bms-936559和ck-301。
[0406]
抗pd-1抗体及其制备方法是本领域已知的。这种针对pd-ll的抗体可以是多克隆或单克隆的,和/或重组的,和/或人源化的。示例性的pd-l抗体公开于美国专利号8,217,149、8,383,796、8,552,154、9,212,224和8,779,108以及美国专利申请公开号20110280877、20140341902和20130045201中。针对pd-l1(也称为cd274或b7-h1)的其他示例性抗体和使用方法公开于美国专利号7,943,743、8,168,179和7,595,048;wo2014055897、wo2016007235;以及美国专利申请公开号20130034559和20150274835中。在一个实施方案中,该抗pd-ll抗体为bms-936559(mdx-1105)、mpdl3280a(rg7446)、medi4736、tecentriq
tm
(atezolizumab)、yw243.55.s70、mpdl3280a、bms-936559、medi4736或msb0010718c,或包含wo2013019906中描述的vh和v
l
的抗体(例如,其中的seq id no:21和24)。抗pd-ll抗体及其制备方法的实例也描述于wo 2010077634、wo 2007005874、wo 2011066389、wo 2013019906、wo 2010077634、美国专利号8,217,149和8,383,796,以及美国专利申请公开号2013034559中。
[0407]
pd-1拮抗剂或pd-1抑制剂是指阻断癌细胞上表达的pd-l1与免疫细胞(t细胞、b细胞或nkt细胞)上表达的pd-1结合的任何化合物或生物分子,并且优选地还阻断癌细胞上表达的pd-l2与免疫细胞表达的pd-1的结合。pd-1及其配体的替代名称或同义词包括:pd-1为pdcd1、pd1、cd279和sleb2;pd-l1为pdcd1l1、pdl1、b7h1、b7-4、cd274和b7-h;并且pd-l2为pdcd1l2、pdl2、b7-dc、btdc和cd273。人类pd-1氨基酸序列可见于ncbi基因座编号:np_005009。人类pd-l1和pd-l2氨基酸序列可分别见于ncbi基因座编号:np_054862和np_079515。
[0408]
pd-1拮抗剂包括与pd-1或pd-l1特异性结合,优选与人pd-1或人pd-l1特异性结合的单克隆抗体(mab)或其抗原结合片段。该mab可以是人抗体、人源化抗体或嵌合抗体,并且可以包括人恒定区。在一些实施方案中,人恒定区选自igg1、igg2、igg3和igg4恒定区,并且在优选实施方案中,人恒定区是igg1或igg4恒定区。在一些实施方案中,该抗原结合片段选自fab、fab'-sh、f(ab')2、scfv和fv片段。
[0409]
与人pd-1结合的mab的实例描述于美国专利号7,488,802、7,521,051、8,008,449、8,354,509和8,168,757、wo 2004004771、wo 2004072286、wo 2004056875,以及美国专利申请公开号20110271358中。在一个实施方案中,可用作pd-1拮抗剂的抗人pd-1mab包括:mk-3475、纳武单抗、人源化抗体h409all、h409a16和h409a17,其描述于wo 2008156712和amp-514中。
[0410]
在本技术的任何方面和实施方案中有用的其他pd-1拮抗剂包括与pd-1特异性结合并且优选与人pd-1特异性结合的免疫粘附素,例如包含与恒定区(例如免疫球蛋白分子的fc区)融合的pd-l1或pd-l2的细胞外或pd-1结合部分的融合蛋白。与pd-1特异性结合的免疫粘附分子的实例描述于2010027827和wo 2011066342中。在一个实施方案中,pd-1拮抗剂包括amp-224(也称为b7-dcig),它是pd-l2-fc融合蛋白,并与人pd-1结合。
[0411]
在一个实施方案中,该抗pd-1抗体为keytruda/派姆单抗,公开在美国专利号8,168,757中,或opdivo/纳武单抗(也称为bms-936558、mdx-1106和ono-4538,公开于美国专利号us 8,008,449中。
[0412]
在一个实施方案中,该ctla-4拮抗剂为yervoy(伊匹木单抗),描述于美国专利号6,984,720和7,605,238中。
[0413]
用于与本技术化合物组合或共同给药的其他治疗剂(抗肿瘤剂)的其他实例包括针对icos的抗体。针对icos或icos结合蛋白的激动剂抗体公开于wo 2012013004、wo 2014033327、wo 2016120789、美国专利申请公开号20160215059和us20160304610中,例如公开于wo 2016120789中的seq id no:1-6或其直接等价物,包含与wo 2016120789中公开的seq id no:7至少90%相同的氨基酸序列的vh结构域,和/或包含与wo 2016120789中公开的seq id no:8至少90%相同的氨基酸序列的v
l
结构域。
[0414]
用于与本技术化合物组合或共同给药的其他治疗剂(抗肿瘤剂)的其他实例包括针对oxo40的抗体。此类抗体描述于wo 2012027328、wo 2013028231(例如,包含具有与seq id no:10至少90%相同的序列的v
l
和/或其中具有与seq id no:4至少90%相同的序列的vh的抗体)。
[0415]
与本技术的化合物组合使用或共同给药的其他治疗剂的其他实例包括免疫刺激剂。如本文所用,免疫刺激剂是指可以刺激免疫系统的任何药剂。如本文所用,免疫刺激剂包括但不限于疫苗佐剂,例如toll样受体激动剂、t细胞检查点阻滞剂,例如pd-1和ctl4的mab和t细胞检查点激动剂,例如ox-40和icos的激动剂mab。如本文所用,“免疫刺激剂”是指可以刺激免疫系统的任何药剂。如本文所用,免疫刺激剂包括但不限于疫苗佐剂。
[0416]
在一个实施方案中,tlr激动剂包括但不限于pam3cys(一种tlr1/2激动剂);cfa(一种tlr2激动剂);malp2(一种tlr2激动剂);pam2cys(一种tlr2激动剂);fsl-i(一种tlr-2激动剂);hib-ompc(一种tlr-2激动剂);聚肌苷酸:聚胞苷酸(poly i:c)(一种tlr3激动剂);多聚腺苷-聚尿苷酸(poly au)(一种tlr3激动剂);用聚l-赖氨酸和羧甲基纤维素(hiltonol)稳定的聚肌苷酸-聚胞苷酸(一种tlr3激动剂);细菌鞭毛蛋白(一种tlr5激动剂);咪喹莫德(一种tlr7激动剂);瑞喹莫德(一种tlr7/8激动剂);洛索立宾(一种tlr7/8激动剂);和未甲基化的cpg二核苷酸(cpg-odn)(一种tlr9激动剂)。另外的tlr激动剂包括但不限于氨基烷基氨基葡糖苷磷酸(agp)。天然存在的tlr4激动剂的一个实例是细菌lps。半合成tlr4激动剂的一个实例是单磷酰脂质a(mpl)。另外的agp衍生物公开于美国专利号7,
2002074769、wo 20040054974、wo 2004055012、wo 2004055010、wo 2004055016、wo 2004055011和wo 2004054581中公开的那些,和类似药物;药代动力学增强剂如cobicistat;神经氨酶抑制剂如cs-8958、扎那米韦、奥司他韦、培拉米韦和类似药物;离子通道阻滞剂,如金刚烷胺或金刚乙胺,以及类似的药物;干扰rna和反义寡核苷酸类,如isis-14803和类似的药物;以及未确定作用机制的抗病毒剂,例如在wo 2005105761、wo 2003085375、wo 2006122011中公开的那些、利巴韦林和类似的药物。
[0422]
本技术的化合物可与至少一种可用于治疗卡波西肉瘤相关的疱疹病毒感染(kshv和kshv相关)的其他治疗剂组合使用,其他治疗剂包括但不限于化疗剂如博来霉素、长春碱、长春新碱、环磷酰胺、泼尼松、阿利维a酸和脂质体蒽环类药物如多柔比星、柔红霉素,免疫治疗剂如利妥昔单抗、托珠单抗、司妥昔单抗和其他药剂如紫杉醇和纳巴霉素。
[0423]
本技术的化合物可与至少一种可用于治疗结核病感染(结核分枝杆菌)和土拉菌病(franciseiia tularensis)的其他治疗剂组合使用,其他治疗剂包括但不限于一线口服药异烟肼、利福平、吡嗪酰胺、乙胺丁醇、链霉素、利福布汀;注射剂包括卡那霉素、阿米卡星、卷曲霉素、链霉素;氟喹诺酮类包括左氧氟沙星、莫西沙星、氧氟沙星;口服抑菌剂对氨基水杨酸、环丝氨酸、特立齐酮、硫酰胺、丙硫异烟胺;sq-109pnu-100480、利福喷汀、利奈唑胺、pa-824azd5847、加替沙星、莫西沙星、sirturo(贝达喹啉)、德拉马尼(opc-67683)和治疗耐药结核病的作用机制不明的药剂,包括氯法齐明、利奈唑胺、阿莫西林/克拉维酸盐、氨硫脲、亚胺培南/西司他丁、高剂量异烟肼、克拉霉素和环丙沙星。
[0424]
本技术的化合物可以与至少一种抗分枝杆菌剂(例如异烟肼(inh)、ehambutol利福平和吡嗪酰胺(pza))、杀菌抗生素(例如利福布汀或利福喷汀)、氨基糖苷氟喹诺酮(左氧氟沙星、莫西沙星、氧氟沙星)、硫代酰胺(ehionamide)、环孢素对氨基水杨酸环丝氨酸卡那霉素链霉素、紫霉素、卷曲霉素)、富马酸贝达喹啉噁唑烷酮pnu-100480或德拉马尼(opc-67683)组合使用。
[0425]
本技术的化合物可与至少一种可用于治疗衣原体的其他治疗剂组合使用,该其他治疗剂包括但不限于阿奇霉素、多西环素、红霉素、左氧氟沙星和氧氟沙星。
[0426]
本技术的化合物可与至少一种可用于治疗疟原虫感染的其他治疗剂组合使用,该其他治疗剂包括但不限于氯喹、阿托伐醌-氯胍、蒿甲醚-本芴醇、甲氟喹、奎宁、奎尼丁、doxocycline、克林霉素(cindamycin)、青蒿琥酯和伯氨喹。
[0427]
在治疗肌萎缩侧索硬化(als)时,本技术的化合物可以与谷氨酸阻滞剂(利鲁唑)、奎尼丁抗胆碱能药(抗胆碱能药(东莨菪碱贴剂(transderm))、拟效感神经药(伪麻黄碱)、粘液溶解药(愈创甘油醚)或镇痛药(曲马多酮咯酸吗啡;或芬太尼贴剂)组合使用。
[0428]
在多发性硬化症的治疗中,本技术的化合物可与皮质类固醇(泼尼松、甲泼尼龙)、干扰素β1-a聚乙二醇干扰素β-ια
醋酸格拉替雷醋酸格拉替雷醋酸格拉替雷(的通用等价物);富马酸二甲酯芬戈莫德);特立氟胺达方吡啶(dalfampridine)达利珠单抗(zinbryta);阿仑珠单抗那他珠单抗或米托蒽醌盐酸盐组合使用。
[0429]
本技术的化合物可以与用于预防或治疗病毒感染的一种或多种疫苗或免疫原性抗原组合使用。此类疫苗或免疫原性抗原包括但不限于病原体衍生的蛋白质或颗粒,例如减毒病毒、病毒颗粒和通常用作免疫原性物质的病毒蛋白。病毒和病毒抗原的实例包括但不限于脊髓灰质炎病毒、冠状病毒科和冠状病毒、鼻病毒(所有亚型)、腺病毒(所有亚型)、甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、人乳头瘤病毒(包括所有亚型)、狂犬病病毒、人类t细胞嗜淋巴病毒(所有亚型)、风疹病毒、腮腺炎病毒、柯萨奇病毒a(所有亚型)、柯萨奇病毒b(所有亚型)、人类肠道病毒、疱疹病毒包括巨细胞病毒、epstein-barr病毒、人类疱疹病毒(所有亚型)、单纯疱疹病毒、水痘带状疱疹病毒、人类免疫缺陷病毒(hiv)(所有亚型)、epstein-barr病毒、呼肠孤病毒(所有亚型)、丝状病毒包括马尔堡病毒和埃博拉病毒(所有污渍)、沙粒病毒包括淋巴细胞脉络丛脑膜炎病毒、拉沙病毒、胡宁病毒和马丘波病毒、虫媒病毒包括西尼罗河病毒、登革热病毒(所有血清型)、寨卡病毒、科罗拉多蜱热病毒、辛德毕斯病毒、披膜病毒科、黄病毒科、布尼亚病毒科、呼肠孤病毒科、弹状病毒科、正粘病毒科、痘病毒包括正痘病毒(天花病毒、猴痘病毒、痘苗病毒、牛痘病毒)、亚塔痘病毒属(塔那痘病毒、雅巴猴瘤病毒)、副痘病毒属、软疣痘病毒属、黄热病、汉坦病毒包括汉他病毒、首尔病毒、多布拉瓦病毒、辛诺伯病毒、普马拉病毒和多布拉瓦样萨列马病毒、人类副流感病毒和流感病毒(所有类型)、hlnl流感和猪流感病毒、呼吸道合胞病毒(所有亚群)、轮状病毒包括人轮状病毒a-e、牛轮状病毒、恒河猴轮状病毒、多瘤病毒属包括猴病毒40、jc病毒、bk病毒、科蜱病毒属、eyach病毒、杯状病毒和细小病毒科包括依赖病毒属、细小病毒属和红病毒属。
[0430]
本技术的化合物可与至少一种可用于预防或治疗病毒感染的其他治疗剂组合使用,其他治疗剂例如免疫疗法(例如,干扰素或其他细胞因子/趋化因子、细胞因子/趋化因子受体调节剂、细胞因子激动剂或拮抗剂和类似药剂);以及治疗性疫苗、抗纤维化剂、抗炎剂例如皮质类固醇或nsaid(非甾体抗炎药)和类似药剂。
[0431]
本技术的化合物可以与其他抗炎剂组合使用,其他抗炎剂包括口服或局部皮质类固醇、抗tnf剂、5-氨基水杨酸和美沙拉嗪制剂、羟基氯喹、硫嘌呤、甲氨蝶呤、环磷酰胺、环孢素、钙调神经磷酸酶抑制剂、麦考酚酸、mtor抑制剂、jak抑制剂、syk抑制剂、抗炎生物制剂包括抗il6生物制剂、抗ill制剂、抗il17生物制剂、抗cd22、抗整合素制剂、抗ifna、抗cd20或cd4生物制剂和其他细胞因子抑制剂、或t细胞或b细胞受体的生物制剂、或白细胞介素。
[0432]
例如,在系统性红斑狼疮和相关狼疮疾病的治疗中,本技术的化合物可以与至少一种其他治疗剂组合使用,其他治疗剂包括皮质类固醇(例如泼尼松龙(orapred、millipred、omnipred、econopred、flo-pred)、免疫抑制剂(例如甲氨蝶呤地塞米松地塞米松吗替麦考酚酯
)、b细胞疗法(贝利木单抗b细胞抑制剂((抗cd22)、sbi-087(抗cd20)、抗baff抗体(ly2127399、a623)、)、硫唑嘌呤曲安西龙羟氯喹沙利度胺免疫球蛋白疗法抗干扰素-α疗法(ifn kinoid)、tlr7和tlr9阻滞剂(imo-3100)、抗细胞因子疗法(抗il6(cnto-136)、抗干扰素-γ(amg811)、免疫调节疗法(lupuzor
tm
、阿巴西普、amg557、拉喹莫德、帕喹莫德、来氟米特、抗icos(medi-570)、抗cd40配体抗体(cdp7657))和/或血小板聚集抑制剂(阿司匹林)。
[0433]
在血管炎和伴有中小血管炎症的疾病的治疗中,本技术的化合物可以与烷化剂(环磷酰胺,)、抗风湿性抗cd20抗体和抗tnf抑制剂组合使用。
[0434]
在银屑病的治疗中,本技术的化合物可以与ixekizumab、tildrakizumab(mk-3222)或苏金单抗(ain457)组合使用。
[0435]
在一个实施方案中,至少一种其他治疗剂选自吸入皮质类固醇、长效β激动剂、吸入皮质类固醇和长效β激动剂的组合、短效β激动剂、白三烯调节剂、抗ige、甲基黄嘌呤支气管扩张剂、肥大细胞抑制剂和长效毒蕈碱拮抗剂。例如,在哮喘的治疗中,本技术的化合物可以与下列药物组合使用:吸入皮质类固醇((ics)如丙酸氟替卡松二丙酸倍氯米松布地奈德(普米克)、曲安奈德氟尼缩松糠酸莫米松或环索奈德)、长效β激动剂((laba),例如富马酸福莫特罗昔萘酸沙美特罗)、ics和laba的组合(例如糠酸氟替卡松和维兰特罗(breo)、福莫特罗/布地奈德吸入剂二丙酸倍氯米松/福莫特罗和丙酸氟替卡松/沙美特罗短效β激动剂((saba)例如硫酸沙丁胺醇(proventilventolin吸入溶液)、酒石酸左旋沙丁胺醇(hfa)、异丙托溴铵/沙丁胺醇异丙托溴铵(hfa)、白三烯调节剂(例如孟鲁司特钠扎鲁司特或齐留通和抗ige(例如奥马珠单抗)、甲基黄嘌呤支气管扩张剂(例如茶碱甲基黄嘌呤支气管扩张剂(例如茶碱甲基黄嘌呤支气管扩张剂(例如茶碱甲基黄嘌呤支气管扩张剂(例如茶碱甲基黄嘌呤支气管扩张剂(例如茶碱甲基黄嘌呤支气管扩张剂(例如茶碱肥大细胞抑制剂(例如色甘酸钠和奈多罗米钠
)、长效毒蕈碱拮抗剂((lama)例如糠酸莫米松/富马酸福莫特罗二水合物)。
[0436]
可能适合用于治疗哮喘的组合疗法的其他药剂包括蛋白酪氨酸激酶抑制剂(马赛替尼)、crth2/d-前列腺素受体拮抗剂(amg 853)、茚达特罗肾上腺素吸入气雾剂(e004)、糠酸氟替卡松/丙酸氟替卡松、vinanterol吸入剂/糠酸氟替卡松粉雾剂(relovair
tm
)、丙酸氟替卡松/富马酸福莫特罗脱水剂(eformoterol fumarate dehydrate)瑞利珠单抗、沙丁胺醇干粉吸入剂、噻托溴铵福莫特罗/布地奈德糠酸氟替卡松vectura's vr506、来金珠单抗(rg3637)、磷酸二酯酶(pde)-3和(pde)-4抑制剂的组合(rpl554)。
[0437]
在一个实施方案中,至少一种其他治疗剂选自长效β受体激动剂、长效吸入抗胆碱能或毒蕈碱拮抗剂、磷酸二酯酶抑制剂、吸入皮质类固醇长效β激动剂、短效β激动剂和吸入皮质类固醇的组合。例如,在治疗copd中,本技术的化合物可以与laba(例如昔萘酸沙美特罗(serevent)、芜地溴铵/维兰特罗(anoro)、芜地溴铵(incruse)、酒石酸阿福特罗富马酸福莫特罗吸入粉剂马来酸茚达特罗马来酸茚达特罗或丙酸氟替卡松/富马酸福莫特罗脱水剂(eformoterol fumarate dehydrate))、长效吸入性抗胆碱能药(或毒蕈碱拮抗剂例如噻托溴铵和阿地溴铵磷酸二酯酶(pde-r)抑制剂(例如罗氟司特、)、ics/laba组合(例如糠酸氟替卡松和维兰特罗(breo)、丙酸氟替卡松/沙美特罗布地奈德/福莫特罗莫米松/福莫特罗异丙托溴铵/硫酸沙丁胺醇沙丁胺醇/异丙托铵(combivent))、saba(例如异丙托溴铵和硫酸沙丁胺醇)、以及ics(例如布地奈德和丙酸氟替卡松二丙酸倍氯米松组合使用。
[0438]
其他可能适合用于治疗copd的组合疗法的药物包括sch527123(cxcr2拮抗剂)、格隆溴铵(glycoprronium bromide)((nva237))、格隆溴铵(glycoprronium bromide)和马来酸茚达特罗((qva149))、吡咯糖(glycopyrrolate)和富马酸福莫特罗(pt003)、马来酸茚达特罗(qva149)、奥达特罗噻托溴铵/奥达特罗和阿地溴铵/福莫特罗吸入剂。
[0439]
在一个实施方案中,至少一种其他治疗剂选自口服皮质类固醇、抗胸腺细胞球蛋白、沙利度胺、苯丁酸氮芥、钙通道阻滞剂、局部润肤剂、ace抑制剂、5-羟色胺再摄取抑制剂、内皮素-1受体抑制剂、抗纤维化剂、质子泵抑制剂或伊马替尼、arg201和托珠单抗。
[0440]
例如,在系统性硬皮病的治疗中,本技术的化合物可以与口服皮质类固醇(例如泼尼松龙(orapred、millipred、omnipred、econopred、flo-pred)、免疫抑制剂
(例如甲氨蝶呤环孢素抗胸腺细胞球蛋白吗替麦考酚酯环磷酰胺fk506(他克莫司)、沙利度胺苯丁酸氮芥硫唑嘌呤)、钙通道阻滞剂(例如硝苯地平或尼卡地平局部润肤剂(硝酸甘油软膏)、ace抑制剂(例如赖诺普利地尔硫卓(diltaizem)(cardizemcardizemcardizem))、5-羟色胺再摄取抑制剂(例如氟西汀)、内皮素-1受体抑制剂(例如波生坦或依前列醇)、抗纤维化剂(例如秋水仙碱对氨基苯甲酸(paba)、二甲亚砜(dmso)和d-青霉胺干扰素α和干扰素γ(inf-g))、质子泵抑制剂(例如奥美拉唑甲氧氯普胺兰索拉唑埃索美拉唑泮托拉唑雷贝拉唑)或伊马替尼arg201(argentis pharmaceutical)、贝利木单抗托珠单抗组合使用。
[0441]
在干燥综合征的治疗中,本技术的化合物可以与抗风湿药(羟氯喹和)、胆碱能激动剂jak抑制剂和抗tnf治疗剂和抗tnf治疗剂组合使用。
[0442]
在本发明的一个实施方案中,至少一种其他治疗剂是睫状神经营养生长因子或基因转移剂。例如,在治疗色素性视网膜炎时,本技术的化合物可与睫状神经营养生长因子(nt-501-cntf)或基因转移剂组合使用。
[0443]
在本发明的一个实施方案中,至少一种其他治疗剂选自三价(iiv3)灭活流感疫苗、四价(iiv4)灭活流感疫苗、三价重组流感疫苗、四价减毒活流感疫苗、抗病毒剂或灭活流感疫苗。例如,在流感的治疗中,本技术的化合物可以与三价(iiv3)灭活流感疫苗(例如本技术的化合物可以与三价(iiv3)灭活流感疫苗(例如)、四价(iiv4)灭活流感疫苗(例如quadrivalent、quadrivalent、quadrivalent)、三价重组流感疫苗(例如)、四价减毒活流感疫苗(例如quadrivalent)、抗病毒剂(例如奥司他韦扎那米韦金刚乙胺或金刚烷胺)或fludase、preflucel或组合使用。
[0444]
在葡萄球菌感染的治疗中,本技术的化合物可与抗生素(例如β-内酰胺头孢菌素(等)、萘夫西林磺胺类(磺胺甲噁唑和甲氧苄啶柳氮磺吡啶乙酰磺胺异噁唑
等)或万古霉素)组合使用。
[0445]
在一个实施方案中,至少一种其他治疗剂选自局部免疫调节剂或钙调神经磷酸酶抑制剂、局部皮质类固醇、口服皮质类固醇、干扰素γ、抗组胺药或抗生素。例如,在治疗特应性皮炎时,本技术的化合物可以与局部免疫调节剂或钙调神经磷酸酶抑制剂(例如吡美莫司或他克莫司软膏)、局部皮质类固醇(例如氢化可的松倍他米松氟氢缩松氟替卡松曲安西龙醋酸氟轻松和氯倍他索)、口服皮质类固醇(例如氢化可的松甲基泼尼松龙或泼尼松龙或泼尼松龙免疫抑制剂(例如环孢素或干扰素γ(alferon或干扰素γ(alferonintron a、))、抗组胺药(用于止痒,例如))、抗组胺药(用于止痒,例如)、抗生素(例如青霉素衍生物氟氯西林或双氯西林红霉素(等))、非甾体免疫抑制剂(例如硫唑嘌呤甲氨蝶呤甲氨蝶呤环孢素或吗替麦考酚酯)组合使用。
[0446]
在一个实施方案中,所述化合物可以与一种或多种单独的药剂,例如化疗剂、免疫治疗剂或辅助治疗剂,以及一种或多种如本文所述的其他第二药剂组合给药。
[0447]
如本文所用,“组合疗法”或“协同疗法”包括给药本技术的化合物或其药学上可接受的盐或酯,以及作为旨在提供来自这些治疗剂的共同作用的有益效果的特定治疗方案的一部分的至少第二药剂。该组合的有益效果包括但不限于由治疗剂组合产生的药代动力学或药效学的共同作用。这些治疗剂的组合给药通常在限定的时间段(通常几分钟、几小时、几天或几周,这取决于所选的组合)内进行。“组合疗法”可能(但通常不)旨在包括给药两种或更多种这些治疗剂作为单独的单一疗法方案的一部分,其偶然地和任意地导致本技术的组合。
[0448]“组合疗法”旨在包括以顺序方式给药这些治疗剂,其中每种治疗剂在不同时间给药,以及这些治疗剂或至少两种治疗剂以基本上同时的方式给药。基本上同时给药可以例如通过向受试者给药具有固定比例的每种治疗剂的单个胶囊或用于每种治疗剂的多个单个胶囊来实现。每种治疗剂的顺序或基本上同时给药可以通过任何合适的途径实现,包括但不限于口服途径、静脉内途径、肌肉内途径和通过粘膜组织的直接吸收。治疗剂可以通过相同途径或不同途径给药。例如,所选择的组合的第一种治疗剂可以通过静脉注射给药,而该组合的其他治疗剂可以口服给药。或者,例如,所有治疗剂可以口服给药或所有治疗剂可以通过静脉注射给药。给予治疗剂的顺序不是严格的关键。
[0449]“组合疗法”还包括施用如本文所述的治疗剂与其他生物活性成分和非药物疗法(例如,手术或放射疗法)的进一步组合。当组合治疗进一步包括非药物治疗时,该非药物治疗可以在任何合适的时间进行,只要实现治疗剂和非药物治疗的组合的共同作用的有益效果。例如,在适当的情况下,当非药物治疗暂时从治疗剂的给药中移除时,可能持续数天甚至数周,仍可实现有益效果。
[0450]
如本文所用,术语“免疫应答”涉及以下任何一种或多种:特异性免疫应答、非特异性免疫应答、特异性和非特异性应答、先天反应、初次免疫应答、适应性免疫、再次免疫应答、记忆免疫应答、免疫细胞活化、免疫细胞增殖、免疫细胞分化和细胞因子表达。在一个实施方案中,本技术的化合物或其药学上可接受的盐或酯与一种或多种其他治疗剂联合给药,其他治疗剂包括抗病毒化合物、旨在刺激对一种或多种预定抗原的免疫应答的疫苗、佐剂、ctla-4和pd-1通路拮抗剂及其他免疫调节剂、脂质、脂质体、多肽、抗癌剂和化疗剂等。
[0451]
定义
[0452]
下面列出的是本技术中使用的各种术语的定义。这些定义适用于在整个说明书和权利要求书中使用的术语,除非在特定情况下单独或作为较大基团的一部分另有限制。
[0453]
如本文所用,术语“烷基”是指饱和的、直链或支链的烃基,在某些实施方案中,含有1至6个碳原子。c
1-c6烷基的实例包括但不限于甲基、乙基、丙基、异丙基、正丁基、叔丁基、新戊基和正己基。
[0454]
如本文所用,术语“烯基”表示衍生自烃部分的一价基团,在某些实施方案中,该烃部分含有2至6个碳原子且具有至少一个碳-碳双键。该双键可能是也可能不是与另一个基团的连接点。烯基包括但不限于例如乙烯基、丙烯基、丁烯基、1-甲基-2-丁烯-1-基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基等。
[0455]
如本文所用,术语“炔基”表示衍生自烃部分的一价基团,在某些实施方案中,该烃部分含有2至6个碳原子且具有至少一个碳-碳三键。该三键可能是也可能不是与另一个基团的连接点。炔基包括但不限于例如乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基等。
[0456]
术语“烷氧基”是指-o-烷基。
[0457]
如本文所用,术语“卤”、“卤代”和“卤素”是指选自氟、氯、溴和碘的原子。
[0458]
如本文所用,术语“环烷基”表示衍生自单环或多环饱和或部分不饱和碳环化合物的一价基团。c
3-c8环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、环戊基和环辛基;并且c
3-c
12-环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、双环[2.2.1]庚基和双环[2.2.2]辛基。
[0459]
如本文所用,术语“环烯基”表示衍生自包含至少一个碳-碳双键的单环或多环饱和或部分不饱和碳环化合物的一价基团。c
4-c8环烯基包括但不限于环丁烯基、环戊烯基、环己烯基、环戊烯基和环辛烯基。
[0460]
如本文所用,术语“芳基”是指具有一个或多个稠合或非稠合芳环的单环或多环碳环系统,包括但不限于苯基、萘基、四氢萘基、茚满基、茚基等。
[0461]
如本文所用,术语“芳烷基”是指连接至芳环(例如文中所述的那些)的烷基残基(例如文中所述的那些)。实例包括但不限于苄基、苯乙基等。
[0462]
如本文所用,术语“杂芳基”是指具有至少一个芳环的单环或多环(例如双环或三环或更多环)稠合或非稠合的基团或环系统,其具有五至十个环原子,其中一个环原子选自s、o和n;零个、一个或两个环原子是独立地选自s、o和n的额外杂原子;并且其余的环原子是碳。杂芳基包括但不限于吡啶基、吡嗪基、嘧啶基、吡咯基、吡唑基、咪唑基、噻唑基、噁唑基、异噁唑基、噻二唑基、噁二唑基、噻吩基、呋喃基、喹啉基、异喹啉基、苯并咪唑基、苯并噁唑基、喹喔啉基、吲唑基、噌啉基、酞嗪基、哒嗪基、吲哚基、吖啶基、苯并喹啉基、嘧啶基、嘌呤
杂环烷基、-conh2、-conh-c
1-c
12-烷基、-conh-c
2-c
12-烯基,
[0475]-conh-c
2-c
12-烯基、-conh-c
3-c
12-环烷基、-conh-芳基、-conh-杂芳基,
[0476]-conh-杂环烷基、-oco
2-c
1-c
12-烷基、-oco
2-c
2-c
12-烯基、-oco
2-c
2-c
12-烯基、-oco
2-c
3-c
12-环烷基、-oco
2-芳基、-oco
2-杂芳基、-oco
2-杂环烷基、-oconh2、-oconh-c
1-c
12-烷基、-oconh-c
2-c
12-烯基、-oconh-c
2-c
12-烯基,
[0477]-oconh-c
3-c
12-环烷基、-oconh-芳基、-oconh-杂芳基、-oconh-杂环烷基、-nhc(o)-c
1-c
12-烷基、-nhc(o)-c
2-c
12-烯基、-nhc(o)-c
2-c
12-烯基、-nhc(o)-c
3-c
12-环烷基、-nhc(o)-芳基、-nhc(o)-杂芳基、-nhc(o)-杂环烷基、-nhco
2-c
1-c
12-烷基、-nhco
2-c
2-c
12-烯基、-nhco
2-c
2-c
12-烯基,
[0478]-nhco
2-c
3-c
12-环烷基、-nhco
2-芳基、-nhco
2-杂芳基、-nhco
2-杂环烷基、nhc(o)nh2、-nhc(o)nh-c
1-c
12-烷基、-nhc(o)nh-c
2-c
12-烯基,
[0479]-nhc(o)nh-c
2-c
12-烯基、-nhc(o)nh-c
3-c
12-环烷基、-nhc(o)nh-芳基、
[0480]-nhc(o)nh-杂芳基、nhc(o)nh-杂环烷基、-nhc(s)nh2,
[0481]-nhc(s)nh-c
1-c
12-烷基、-nhc(s)nh-c
2-c
12-烯基,
[0482]-nhc(s)nh-c
2-c
12-烯基、-nhc(s)nh-c
3-c
12-环烷基、-nhc(s)nh-芳基,
[0483]-nhc(s)nh-杂芳基、-nhc(s)nh-杂环烷基、-nhc(nh)nh2,
[0484]-nhc(nh)nh-c
1-c
12-烷基、-nhc(nh)nh-c
2-c
12-烯基、-nhc(nh)nh-c
2-c
12-烯基,
[0485]-nhc(nh)nh-c
3-c
12-环烷基、-nhc(nh)nh-芳基、-nhc(nh)nh-杂芳基,
[0486]-nhc(nh)nh杂环烷基、-nhc(nh)-c
1-c
12-烷基、-nhc(nh)-c
2-c
12-烯基,
[0487]-nhc(nh)-c
2-c
12-烯基、-nhc(nh)-c
3-c
12-环烷基、-nhc(nh)-芳基,
[0488]-nhc(nh)-杂芳基、-nhc(nh)-杂环烷基、-c(nh)nh-c
1-c
12-烷基,
[0489]-c(nh)nh-c
2-c
12-烯基、-c(nh)nh-c
2-c
12-烯基、c(nh)nh-c
3-c
12-环烷基,
[0490]-c(nh)nh-芳基、-c(nh)nh-杂芳基、-c(nh)nh杂环烷基,
[0491]-s(o)-c
1-c
12-烷基、-s(o)-c
2-c
12-烯基、-s(o)-c
2-c
12-烯基,
[0492]-s(o)-c
3-c
12-环烷基、-s(o)-芳基、-s(o)-杂芳基、-s(o)-杂环烷基-so2nh2,
[0493]-so2nh-c
1-c
12-烷基、-so2nh-c
2-c
12-烯基、-so2nh-c
2-c
12-烯基,
[0494]-so2nh-c
3-c
12-环烷基、-so2nh-芳基、-so2nh-杂芳基、-so2nh-杂环烷基,
[0495]-nhso
2-c
1-c
12-烷基、-nhso
2-c
2-c
12-烯基、-nhso
2-c
2-c
12-烯基,
[0496]-nhso
2-c
3-c
12-环烷基、-nhso
2-芳基、-nhso
2-杂芳基、-nhso
2-杂环烷基,
[0497]-ch2nh2、-ch2so2ch3、-芳基、-芳基烷基、-杂芳基、-杂芳基烷基、-杂环烷基,
[0498]-c
3-c
12-环烷基、聚烷氧基烷基、聚烷氧基、-甲氧基甲氧基、-甲氧基乙氧基、-sh,
[0499]-s-c
1-c
12-烷基、-s-c
2-c
12-烯基、-s-c
2-c
12-烯基、-s-c
3-c
12-环烷基、-s-芳基,
[0500]-s-杂芳基、-s-杂环烷基或甲硫基甲基。
[0501]
术语“癌症”包括但不限于以下癌症:表皮样口腔:口腔癌、唇癌、舌癌、口癌、咽癌;心脏:肉瘤(血管肉瘤、纤维肉瘤、横纹肌肉瘤、脂肪肉瘤)、粘液瘤、横纹肌瘤、纤维瘤、脂肪瘤和畸胎瘤;肺:支气管癌(鳞状细胞或表皮样癌、未分化小细胞癌、未分化大细胞癌、腺癌)、肺泡(细支气管)癌、支气管腺瘤、肉瘤、淋巴瘤、软骨瘤错构瘤、间皮瘤;胃肠道:食道(鳞状细胞癌、喉癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃(癌、淋巴瘤、平滑肌肉瘤)、胰腺(导管腺癌、胰岛素瘤、胰高血糖素瘤、胃泌素瘤、类癌瘤、舒血管肠肽瘤)、小肠(small bowel)或小
肠(small intestines)(腺癌、淋巴瘤、类癌瘤、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤、纤维瘤)、大肠(large bowel)或大肠(large intestines)(腺癌、管状腺瘤、绒毛状腺瘤、错构瘤、平滑肌瘤)、结肠、结肠-直肠、结直肠、直肠;泌尿生殖道:肾脏(腺癌、维尔姆斯瘤(肾母细胞瘤)、淋巴瘤、白血病)、膀胱和尿道(鳞状细胞癌、移行细胞癌、腺癌)、前列腺(腺癌、肉瘤)、睾丸(精原细胞瘤、畸胎瘤、胚胎性癌、畸胎瘤、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样肿瘤、脂肪瘤);肝脏:肝癌(肝细胞癌)、胆管上皮癌、肝母细胞瘤、血管肉瘤、肝细胞性腺瘤、血管瘤、胆道;骨:成骨性肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤因肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤脊索瘤、骨软骨瘤(骨软骨性外生骨疣)、良性软骨瘤、软骨母细胞瘤、软骨粘液纤维瘤、骨样骨瘤和巨细胞瘤;神经系统:颅骨(骨瘤、血管瘤、肉芽肿、黄瘤、变形性骨炎)、脑膜(脑膜瘤、脑膜肉瘤、神经胶质瘤病)、脑(星形细胞瘤、髓母细胞瘤、神经胶质瘤、室管膜瘤、生殖细胞瘤(松果体瘤)、多形性胶质母细胞瘤、少突神经胶质瘤、神经鞘瘤、视网膜母细胞瘤、先天性肿瘤)、脊髓神经纤维瘤、脑膜瘤、胶质瘤、肉瘤);妇科:子宫(子宫内膜癌)、宫颈(宫颈癌、癌前宫颈发育不良)、卵巢(卵巢癌(浆液性囊腺癌、粘液囊腺癌、未分类癌)、颗粒-卵泡膜细胞肿瘤(granulosa-thecal cell tumors)、塞尔托利-莱迪希细胞瘤、无性细胞瘤、恶性畸胎瘤)、外阴(鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤、黑色素瘤)、阴道(透明细胞癌、鳞状细胞癌、葡萄样肉瘤(胚胎型横纹肌肉瘤)、输卵管(癌)、乳腺;血液学:血液(髓样白血病(急性和慢性)、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生性疾病、多发性骨髓瘤、骨髓增生异常综合征)、霍奇金病、非霍奇金淋巴瘤(恶性淋巴瘤)毛细胞;淋巴疾病;皮肤:恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、角化棘皮瘤、痣发育不良痣(moles dysplastic nevi)、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕疙瘩、银屑病,甲状腺:乳头状甲状腺癌、滤泡性甲状腺癌;甲状腺髓样癌、未分化甲状腺癌、2a型多发性内分泌瘤病、2b型多发性内分泌瘤病、家族性甲状腺髓样癌、嗜铬细胞瘤、副神经节瘤;和肾上腺:神经母细胞瘤。因此,如本文所提供的术语“癌细胞”包括受上述任何一种病症折磨的细胞。
[0502]
如本文所用,术语“受试者”是指哺乳动物。因此,受试者是指例如狗、猫、马、牛、猪、豚鼠等。优选地,受试者是人。当受试者是人时,受试者在本文中可称为患者。
[0503]“治疗”("treat"、"treating"和"treatment")是指缓解或减轻疾病和/或其伴随症状的方法。
[0504]
如本文所用,“预防”或“防止”描述减少或消除疾病、病症或障碍的症状或并发症的发作。
[0505]
除非上下文另有明确规定,否则术语“疾病”、“障碍”和“病症”可互换使用。
[0506]
如本文所用,术语“治疗有效量”的本技术化合物或药物组合物是指足够量的化合物或药物组合物以减轻受试者的病症的症状。正如医学领域所熟知的,本技术的化合物或药物组合物的治疗有效量将处于适用于任何医学治疗的合理益处/风险比。然而,应当理解,本技术的化合物和组合物的总日用量将由主治医师在合理的医学判断范围内决定。任何具体患者的特定调节(例如抑制或刺激)剂量将取决于多种因素,包括所治疗的疾病和疾病的严重程度;所用的特定化合物的活性;所用的特定组合物;患者的年龄、体重、一般健康状况、性别和饮食;所用的特定化合物的给药时间、给药途径和排泄率;治疗的持续时间;与所用的特定化合物组合使用或同时使用的药物;以及医学领域众所周知的因素。
[0507]
如本文所用,短语“药学上可接受的”是指那些在合理医学判断范围内适合用于与人和动物组织接触而没有过度毒性、刺激性、过敏反应或其他问题或并发症、并具有合理的益处/风险比的化合物、材料、组合物、载体和/或剂型。
[0508]
如本文所用,术语“药学上可接受的盐”是指那些通过本技术方法形成的化合物的盐,这些盐在合理医学判断范围内适合用于与人和低等动物的组织接触而没有过度毒性、刺激性、过敏反应等、并具有合理的益处/风险比。药学上可接受的盐是本领域众所周知的。例如,s.m.berge等人在j.pharmaceutical sciences,66:1-19(1977)中详细描述了药学上可接受的盐。盐可以在本技术化合物的最终分离和纯化过程中原位制备,或者通过使游离碱或酸官能团与合适的酸或碱反应而单独制备。
[0509]
药学上可接受的盐的实例包括但不限于无毒酸加成盐:与无机酸如盐酸、氢溴酸、磷酸、硫酸和高氯酸或与有机酸如乙酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸形成的盐。其他药学上可接受的盐包括但不限于己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐(pamoate)、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、7-甲苯磺酸盐、十一酸盐、戊酸盐等。代表性的碱金属或碱土金属盐包括钠、锂、钾、钙、镁等。其他药学上可接受的盐在适当时包括使用抗衡离子例如卤化物、氢氧化物、羧酸盐、硫酸盐、磷酸盐、硝酸盐、具有1至6个碳原子的烷基、磺酸盐和芳基磺酸盐形成的无毒铵、季铵和胺阳离子。
[0510]
如本文所用,术语“药学上可接受的酯”是指通过本技术方法形成的在体内水解的化合物的酯,包括在人体内容易分解以留下母体化合物或其盐的那些酯。合适的酯基包括例如衍生自药学上可接受的脂肪族羧酸特别是链烷酸、链烯酸、环烷酸和烷二酸的那些,其中每个烷基或烯基部分有利地具有不超过6个碳原子。具体酯的实例包括但不限于甲酸酯、乙酸酯、丙酸酯、丁酸酯、丙烯酸酯和乙基琥珀酸酯。
[0511]
如本文所用,术语“药学上可接受的前药”是指那些通过本技术方法形成的化合物的前药,这些前药在合理医学判断范围内适合用于与人和低等动物的组织接触而没有过度毒性、刺激性、过敏反应等、并具有合理的益处/风险比、并且对它们的预期用途有效,以及(在可能的情况下)其为本技术化合物的两性离子形式。
[0512]
如本文所用,“前药”是指可通过代谢方式(例如,通过水解)在体内转化以提供由本技术的通式所描绘的任何化合物的化合物。各种形式的前药是本领域已知的,例如bundgaard,(ed.),design of prodrugs,elsevier(1985);widder,等人(ed.),methods in enzymology,vol.4,academic press(1985);krogsgaard-larsen,等人,(ed),"design and application of prodrugs,textbook of drug design and development,chapter 5,113-191(1991);bundgaard,等人,journal of drug deliver reviews,8:1-38(1992);bundgaard,j.of pharmaceutical sciences,77:285et seq.(1988);higuchi和stella(eds.)prodrugs as novel drug delivery systems,american chemical society
(1975);和bernard testa&joachim mayer,"hydrolysis in drug and prodrug metabolism:chemistry,biochemistry and enzymology,"john wiley和sons,ltd.(2002)中所讨论的。
[0513]“药学上可接受的赋形剂”是指可用于制备通常安全、无毒且在生物学上或其他方面均无不良反应的药物组合物的赋形剂,并且其包括可用于兽医用途以及人类药物用途的赋形剂。说明书和权利要求书中使用的“药学上可接受的赋形剂”包括一种和多于一种这样的赋形剂。
[0514]
本技术还包括含有本技术化合物的药学上可接受的前药的药物组合物,以及通过给药本技术化合物的药学上可接受的前药治疗该疾病的方法。例如,具有游离氨基、酰胺基、羟基或羧基的本技术化合物可以转化为前药。前药包括这样的化合物,其中氨基酸残基或两个或更多个(例如两个、三个或四个)氨基酸残基的多肽链通过酰胺或酯键共价连接至本技术化合物的游离氨基、羟基或羧酸基团。该氨基酸残基包括但不限于通常由三个字母符号指定的20个天然存在的氨基酸,并且还包括4-羟基脯氨酸、羟赖氨酸、锁链赖氨酸(demosine)、异锁链赖氨酸(isodemosine)、3-甲基组氨酸、正缬氨酸、β-丙氨酸、γ-氨基丁酸、瓜氨酸、高半胱氨酸、高丝氨酸、鸟氨酸和蛋氨酸砜。还包括其他类型的前药。例如,游离羧基可以衍生为酰胺或烷基酯。游离羟基可以使用包括但不限于半琥珀酸酯、磷酸酯、二甲基氨基乙酸酯和磷酰氧基甲氧基羰基的基团衍生,如advanced drug delivery reviews,1996,19,1-15中所述。还包括羟基和氨基的氨基甲酸酯前药,以及羟基的碳酸酯前药、磺酸酯和硫酸酯。还包括将羟基衍生为(酰氧基)甲基和(酰氧基)乙基醚,其中酰基可以是任选被包括但不限于醚、胺和羧酸官能团的基团取代的烷基酯,或者其中酰基是如本文所述的氨基酸酯。这种类型的前药描述于j.med.chem.1996,39,10中。游离胺也可以衍生为酰胺、磺酰胺或膦酰胺。所有这些前药部分可以包含包括但不限于醚、胺和羧酸官能团的基团。
[0515]
本技术所设想的取代基和变量的组合仅是导致形成稳定化合物的那些组合。如本文所用,术语“稳定的”是指化合物具有足以允许制备的稳定性并且在足够长的时间内保持化合物的完整性以用于本文详述的目的(例如对受试者的治疗性或预防性给药)。
[0516]
当任何变量(例如r1)在化合物的任何构成部分或分子式中出现一次以上时,其在每次出现时的定义独立于它在其他每一次出现时的定义。因此,例如,如果显示一个基团被一个或多个r部分取代,则每次出现时的r均独立于r的定义选择。此外,取代基和/或变量的组合是允许的,但前提是这种组合在指定原子的正常化合价内产生稳定的化合物。
[0517]
此外,本技术的一些化合物具有一个或多个双键,或一个或多个不对称中心。此类化合物可以外消旋体、外消旋混合物、单一对映异构体、单独的非对映异构体、非对映异构体混合物和顺式-或反式-或e-或z-双异构形式、以及其他立体异构形式存在,其可以根据绝对立体化学定义为(r)-或(s)-,或为(d)-或(l)-氨基酸。当本文所述的化合物包含烯属双键或其他几何不对称中心时,除非另有说明,否则该化合物旨在包括e和z几何异构体。选择本文出现的任何碳-碳双键的构型仅为方便起见,并非旨在指定特定构型,除非文中如此说明;因此,本文中任意描述为反式的碳-碳双键可以是顺式、反式或两者以任意比例的混合物。此类化合物的所有此类异构形式明确包括在本技术中。
[0518]“同分异构现象”是指分子式相同,但它们原子的键合顺序或它们原子在空间中的排列不同的化合物。它们原子在空间中排列不同的异构体称为“立体异构体”。不是彼此镜
像的立体异构体称为“非对映异构体”,并且互为不可重叠镜像的立体异构体称为“对映异构体”或有时称为光学异构体。包含等量的相反手性的单个对映体形式的混合物称为“外消旋混合物”。
[0519]
与四个不同取代基键合的碳原子称为“手性中心”。
[0520]“手性异构体”是指具有至少一个手性中心的化合物。具有一个以上手性中心的化合物可以作为单独的非对映异构体或作为非对映异构体的混合物存在,称为“非对映异构体混合物”。当存在一个手性中心时,立体异构体的特征可在于该手性中心(例如碳)的绝对构型(r或s)。绝对构型是指与手性中心相连的取代基在空间中的排列。根据cahn,ingold and prelog的顺序规则,将连接到所考虑的手性中心的取代基进行排序(cahn等人,angew.chem.inter.edit.1966,5,385;errata 511;cahn等人,angew.chem.1966,78,413;cahn和ingold,j.chem.soc.1951(london),612;cahn等人,experientia 1956,12,81;cahn,j.chem.educ.1964,41,116)。
[0521]“几何异构体”是指由于双键旋转受阻而存在的非对映异构体。根据cahn-ingold-prelog规则,这些构型的名称通过前缀顺式(cis)和反式(trans)或z和e来区分,这表明这些基团位于分子中双键的同一侧或相反侧。
[0522]
此外,本技术中讨论的结构和其他化合物包括其所有阻转异构体。“阻转异构体”是一种立体异构体,其中两种异构体的原子在空间上的排列不同。阻转异构体的存在是由于大基团围绕中心键的旋转受阻而导致旋转受限。此类阻转异构体通常以混合物形式存在,然而由于色谱技术的最新进展;在特定情况下已经可以分离两种阻转异构体的混合物。
[0523]“互变异构体”是平衡中存在的两种或更多种结构异构体中的一种,并且容易从一种异构形式转化为另一种形式。这种转化导致氢原子的正式迁移,伴随着相邻共轭双键的转换。互变异构体以溶液中互变异构体的混合物形式存在。在固体形式中,通常以一种互变异构体为主。在可能发生互变异构化的溶液中,将达到互变异构体的化学平衡。互变异构体的确切比例取决于几个因素,包括温度、溶剂和ph值。通过互变异构化可互变的互变异构体的概念称为互变异构现象。
[0524]
在可能的各种类型的互变异构中,通常观察到两种。在酮-烯醇互变异构中,电子和氢原子同时发生移动。环互变异构的产生是由于糖链分子中的醛基(-cho)与同一分子中的一个羟基(-oh)反应而形成环状(环形)形式,如葡萄糖所示。常见的互变异构对是:在杂环中(例如在核碱基如鸟嘌呤、胸腺嘧啶和胞嘧啶中)的酮-烯醇、酰胺-腈、内酰胺-内酰胺、酰胺-亚氨酸互变异构,胺-烯胺和烯胺-烯胺。本技术的化合物还可以以多种互变异构形式表示,在这种情况下,本技术明确包括本文所述化合物的所有互变异构形式(例如,环系统的烷基化可能导致多个位点的烷基化,本技术明确包括所有此类反应产物)。
[0525]
在本技术中,为方便起见,在某些情况下,化合物的结构式表示某种异构体,但本技术包括所有异构体,例如几何异构体、基于不对称碳的旋光异构体、立体异构体、互变异构体等。
[0526]
此外,本技术的化合物,例如化合物的盐,可以以水合或未水合(无水)形式或作为与其他溶剂分子的溶剂合物存在。水合物的非限制性实例包括一水合物、二水合物等。溶剂合物的非限制性实例包括乙醇溶剂合物、丙酮溶剂合物等。
[0527]“溶剂化物”是指含有化学计量或非化学计量量的溶剂的溶剂加成形式。一些化合
物倾向于在结晶固态中捕获固定摩尔比的溶剂分子,从而形成溶剂化物。如果溶剂是水,形成的溶剂化物是水合物;如果溶剂是醇,形成的溶剂化物是醇化物。水合物是由一个或多个水分子与一分子物质结合形成的,在这种物质中,水保持其分子状态为h2o。
实施例
[0528]
所有化合物的纯度均超过95%,并使用waters lc/ms系统进行分析。1h nmr在400mhz下获得。对于1h nmr,化学位移是相对于二甲基亚砜(δ=2.50)报告的。数据报告为(br=宽峰,s=单峰,d=双峰,t=三重峰,q=四重峰,m=多重峰)。
[0529]
以下实施例和本文其他地方使用的缩写是:
[0530]
acoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸
[0531]
atm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
气氛
[0532]
boc2o
ꢀꢀꢀꢀꢀꢀꢀꢀ
二碳酸二叔丁酯
[0533]
br
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
宽峰
[0534]
cuso4ꢀꢀꢀꢀꢀꢀꢀꢀ
硫酸铜
[0535]
cdcl3ꢀꢀꢀꢀꢀꢀꢀꢀ
氘代氯仿
[0536]
dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[0537]
diea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二异丙基乙基胺
[0538]
dma
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基乙酰胺
[0539]
dmap
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶
[0540]
dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺
[0541]
dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基亚砜
[0542]
dmso-d6ꢀꢀꢀꢀꢀꢀ
氘代二甲基亚砜
[0543]
edci
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-乙基-3-(3-二甲基氨基丙基)碳二亚胺
[0544]
esi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
电喷射离子化
[0545]
etoac
ꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0546]
hcl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
盐酸
[0547]hꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[0548]
hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐
[0549]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱法
[0550]
khmds
ꢀꢀꢀꢀꢀꢀꢀꢀ
六甲基二硅氮烷钾盐(potassium hexamethylsilazide)
[0551]
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱-质谱法
[0552]mꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
多重峰
[0553]
ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升
[0554]
mecn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈
[0555]
mei
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
碘甲烷
[0556]
meoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[0557]
mg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫克
[0558]
mmol
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫摩尔
[0559]
mgso4ꢀꢀꢀꢀꢀꢀꢀꢀ
硫酸镁
[0560]
mhz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
兆赫
[0561]
min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟
[0562]
ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱
[0563]
na2co3ꢀꢀꢀꢀꢀꢀꢀ
碳酸钠
[0564]
nahco3ꢀꢀꢀꢀꢀꢀꢀ
碳酸氢钠
[0565]
nmr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核磁共振
[0566]
tf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟甲磺酸盐
[0567]
pd2(dba)3ꢀꢀꢀꢀ
三(二亚苄基丙酮)二钯(0)
[0568]
pd(pph3)2cl
2 双(三苯基膦)二氯化钯(ii)
[0569]
pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚
[0570]
phn(so2cf3)
2 n-苯基-双(三氟甲磺酰亚胺)
[0571]
pme3ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三甲基膦
[0572]
ppm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
百万分之几
[0573]
ptsa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
对甲苯磺酸
[0574]
rt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
室温
[0575]
tbaf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四正丁基氟化铵
[0576]
t-buoh
ꢀꢀꢀꢀꢀꢀꢀ
叔丁醇
[0577]
tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸
[0578]
tms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三甲基硅烷
[0579]
thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃
[0580]
tlc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄层色谱法
[0581]
μl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微升
[0582]
xphos
ꢀꢀꢀꢀꢀꢀꢀꢀ
2-二环己基膦基-2
′
,4
′
,6
′‑
三异丙基联苯
[0583]z’ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
z-因子统计值
[0584]
实施例1:化合物1的合成
[0585][0586]
步骤1:在n2气氛下,在密封管中,将a(2.5g,16.0mmol,1.0eq)、ch3i(23.0g,160.0mmol,10.0eq)和cs2co3(10.5g,32.0mmol,2.0eq)在ch3cn(50.0ml)中的混合物于65℃搅拌16小时。将反应混合物过滤,并将滤饼用etoac(100ml)洗涤。将滤液用h2o(20ml x 2)
洗涤。将有机层经na2so4干燥并浓缩,得到b(2.9g,91%),为黄色固体。1h nmr(400mhz,cdcl3):δ7.67-7.69(m,1h),7.55(s,1h),6.89(d,j=8.4hz,1h),3.90(s,6h),3.88(s,3h)。
[0587]
步骤2:在45℃下,向b(1.0g,5.1mmol,1.0eq)和kno3(52.0mg,0.51mmol,0.1eq)在hoac(5.0ml)中的混合物中滴加hno3(67%wt.,0.9ml,20.4mmol)。将该混合物于45℃搅拌5小时。在20℃下,将该反应倒入到水(20ml)中。将沉淀物过滤收集,依次用水(20ml)和正己烷(20ml)洗涤,并干燥,得到c(1.0g,83%)。1h nmr(400mhz,cdcl3):δ7.46(s,1h),7.09(s,1h),3.98(s,6h),3.92(s,3h)。
[0588]
步骤3:在h2(15psi)气氛下,将c(1.0g,4.1mmol,1.0eq)和pd/c(10%wt.,300mg)在etoac(15.0ml)中的混合物于25℃搅拌16小时。将反应混合物通过硅藻土过滤,并将滤饼用etoac(20ml)洗涤。将滤液浓缩,得到d(840mg,97%),为淡黄色固体。1h nmr(400mhz,dmso-d6):δ7.12(s,1h),6.45(s,2h),6.36(s,1h),3.74(s,6h),3.64(s,3h)。
[0589]
步骤4:在n2气氛下,将d(500.0mg,2.4mmol,1.0eq)、e(818.0mg,2.9mmol,1.2eq)、pd2(dba)3(110.0mg,0.12mmol,0.05eq)、cs2co3(2.3g,7.2mmol,3.0eq)和binap(224.0mg,0.36mmol,0.15eq)在甲苯(5.0ml)中的混合物于110℃搅拌16小时。将反应混合物通过硅藻土过滤,并将滤饼用etoac(20ml)洗涤。将滤液浓缩,并将残余物通过硅胶柱色谱法(pe/etoac=10/1)纯化,得到f(600.0mg,68%),为黄色固体。lc/ms:365.1[m+h]
+
.
[0590]
步骤5:将f(600.0mg,1.6mmol,1.0eq)和koh(896.0mg,16.0mmol,10.0eq)在ch3oh/h2o(10ml/10ml)中的混合物于70℃搅拌16小时。将反应混合物用1n hcl(水溶液)酸化直至ph=3,并然后用etoac(15ml x 3)萃取。将合并的有机层经na2so4干燥并浓缩,得到g(550.0mg,98%),为黄色固体。lcms:351.3[m+h]
+
.
[0591]
步骤6:将g(550.0mg,1.57mmol,1.0eq)溶于伊顿试剂(10ml)中。将该混合物于70℃搅拌1小时。将反应混合物倒入到冰水(100ml)中,并用etoac/dcm/ch3oh(4/4/1,45x3)的混合物萃取。将合并的萃取液用饱和的nahco3(20ml x 2)洗涤。将有机层经na2so4干燥,并浓缩,得到h(500.0mg,95%),为黄色固体。lcms:333.2[m+h]
+
.
[0592]
步骤7:将h(150.0mg,0.45mmol,1.0eq)、i(1.26g,5.87mmol,13.0eq)和cs2co3(733.5g,2.25mmol,5.0eq)在ch3cn(15.0ml)中的混合物于40℃搅拌4小时,并于50℃搅拌另外16小时。将反应混合物用浓hcl(水溶液)酸化直至ph=2,并然后于50℃搅拌30分钟。将该混合物倒入到水(30ml)中,并用etoac(20ml x 3)萃取。将合并的有机层浓缩,并将残余物通过prep-hplc纯化,得到j(15.0mg,8%),为黄色固体。lcms:419.1[m+h]
+
.
[0593]
步骤8:将j(15.0mg,0.035mmol,1.0eq)和lioh
·
h2o(7.35mg,0.175mmol,5.0eq)在ch3cn/h2o/etoh(3.0ml/0.5ml/3.0ml)中的混合物于50℃搅拌3小时。将反应混合物用水(15ml)稀释,并用etoac(3ml)萃取。将水相用1m hcl(水溶液)酸化直至ph=1~2,并然后用etoac(5ml x 4)萃取。将合并的有机层浓缩,得到化合物1(11.8mg,84%),为黄色固体。lcms:391.2[m+h]
+
,1h nmr(400mhz,dmso-d6):δ12.85(brs,1h),8.14(d,j=8.4hz,1h),7.56(s,1h),7.35(d,j=8.8hz,1h),7.03(s,1h),4.94(s,2h),3.94(s,3h),3.87(s,3h),2.71(s,6h)。
[0594]
实施例2:化合物3的合成
[0595][0596]
步骤1:在氮气氛下,将a(1.25g,5.0mmol,1.0eq)、b(1.70g,6.0mmol,1.2eq)、乙酸钾(1.5g,15.0mmol,3.0eq)、醋酸铜(290.0mg,1.5mmol,0.3eq)和铜粉(96.0mg,1.5mmol,0.3eq)在2-戊醇(20.0ml)中的混合物于140℃搅拌过夜,随后冷却至室温。加入水(30ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl(水溶液)酸化至ph=2,然后加入另外量的水(50ml)。将生成的混合物用etoac(50ml x 2)萃取。将合并的有机层用盐水(50.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品,将其通过用pe(20ml)研磨纯化,得到c(1.5g,74.6%)。lcms:402.0[m+h]
+
.
[0597]
步骤2:将c(1.5g,3.73mmol)和伊顿试剂(20ml)的混合物于65℃加热1小时,然后冷却并倒入到冰水混合物中。将该固体过滤收集并干燥,得到粗品d(1.3g,90.1%)。lcms:385.0[m+h]
+
[0598]
步骤3:向d(1.3g,3.38mmol,1.0eq)和cs2co3(3.3g,10.14mmol,3.0eq)在乙腈(50ml)中的混合物中加入碘代乙酸乙酯(1.45g,6.76mmol,2.0eq)。将该混合物于40℃搅拌过夜,用水(50.0ml)稀释,用etoac(30ml x 2)萃取。将有机层浓缩,得到粗品f(1.4g,88.0%),为黄色固体。lcms:471.0[m+h]
+
.
[0599]
步骤4:将f(50.0mg;0.11mmol,1.0eq)、lioh
·
h2o(18.0mg,0.44mmol,4.0eq)在thf(5.0ml)和h2o(2.0ml)中的混合物于40℃搅拌过夜。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到化合物3(12.0mg,25.5%),为黄色固体。lcms:443.0[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.95(brs,1h),8.24(s,1h),8.13(d,j=8.8hz,1h),8.08(s,1h),7.45(d,j=8.8hz,1h),4.90(s,2h),2.72(s,6h)。
[0600]
实施例3:化合物4的合成
[0601][0602]
步骤1:向a(20g,114mmol,1.0eq)和et3n(13.7g,136mmol,1.2eq)的dcm(100ml)溶液中加入me2nh(2m的thf溶液,91ml,182mmol,1.6eq)。将该混合物于室温搅拌过夜,加入dcm(300ml),并用盐水(100ml)洗涤。将有机层经无水na2so4干燥并浓缩。将残余物通过硅胶色谱法(pe)纯化,得到b(21.6g,95%),为无色液体。lcms:201.2[m+h]
+
.
[0603]
步骤2:将b(21.6g,108mmol,1.0eq)、fe粉(30.8g,550mmol,5.1eq)和nh4cl(59.0g,1.1mol,10.2eq)在etoh/h2o(250ml/50ml)中的混合物在回流下搅拌1小时。将反应混合物冷却至室温并过滤。将沉淀物用etoac洗涤。将滤液蒸发,并将残余物通过硅胶色谱法(etoac/pe=1/30)纯化,得到c(18g,96%),为浅褐色液体。lcms:171.4[m+h]
+
.
[0604]
步骤3:向c(18.0g,106mmol,1.0eq)在水(240ml)和浓h2so4(60ml)中的混合物中加入nano2(7.32g,106mmol,1.0eq)在30ml水中的溶液,保持温度低于10℃。加入后,将该混合物搅拌30分钟,并倒入到ki(21.9g,132mmol,1.25eq)的水(120ml)溶液中。将生成的混合物于60℃加热3小时,冷却,并加入chcl3(300ml)。将有机层分离,并依次用饱和的na2co3(100ml)、1m硫代硫酸钠(100ml)、水(100ml)和盐水(100ml)洗涤,经无水na2so4干燥,并蒸发。将残余物通过硅胶色谱法(pe)纯化,得到d(20.6g,69.2%),为无色液体。1h nmr(400mhz,cdcl3):δ7.69(dd,j=1.2,8.0,1h),7.22(dd,j=1.2,8.0,1h),6.69(t,j=8.0hz,1h),2.77(s,6h)。lcms:282.0[m+h]
+
.
[0605]
步骤4:在n2气氛下,将e(2.0g,9.3mmol,1.0eq)、d(3.9g,14.0mmol,1.5eq)、koac(2.7g,28.0mmol,3.0eq)、铜粉(179mg,2.8mmol,0.3eq)和cu(oac)2(510mg,2.8mmol,0.3eq)在2-戊醇(30.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(100.0ml)。将该混合物通过硅藻土过滤。将滤液用浓hcl酸化至ph=2,并用etoac(100ml x 3)萃取。将合并的有机层浓缩。将残余物用pe/etoac(10/1)研磨并过滤,得到f(1.6g,47%)。lc/ms:369.0[m+h]
+
.
[0606]
步骤5:将f(1.6g,4.3mmol,1.0eq)的伊顿试剂(20.0ml)溶液于70℃搅拌1小时。将该混合物倒入到冰水中并过滤。将该固体干燥,得到g(1.3g,87%)。lc/ms:351.0[m+h]
+
.
[0607]
步骤6:将g(1.3g,3.7mmol,1.0eq)、h(1.6g,7.4mmol,2.0eq)和cs2co3(3.6g,11.1mmol,3.0eq)在乙腈(50.0ml)中的混合物在室温下搅拌过夜。将水(50ml)加入到该反应混合物中,用etoac(100ml x 2)萃取。将合并的有机层经无水na2so4干燥并浓缩。将残余物用乙腈研磨并过滤,得到i(850.0mg,53%),为黄色固体。lc/ms:437.0[m+h]
+
.
[0608]
步骤7:向i(100.0mg,0.23mmol,1.0eq)的甲苯(10.0ml)溶液中加入k(23.0mg,0.28mmol,1.2eq)、pd2(dba)3(21.0mg,0.023mmol,0.1eq)、xantphos(14.0mg,0.023mmol,0.1eq)和cs2co3(150.0mg,0.46mmol,2.0eq)。将该混合物于110℃搅拌过夜,并然后通过硅藻土过滤。将滤液浓缩。将残余物用etoac(20ml)稀释,用h2o(15ml x 2)洗涤。将有机层经无水na2so4干燥,并然后过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到j(50.0mg,50%)。lcms:438.3[m+h]
+
.
[0609]
步骤8:向j(50.0mg,0.12mmol,1.0eq)在thf/h2o(5.0/1.0ml)中的混合物中加入lioh h2o(48.0mg,1.15mmol,10.0eq)。将该混合物于室温搅拌过夜,用浓hcl(水溶液)酸化至ph=3,并用etoac(20ml x 2)萃取。将合并的有机层浓缩。将残余物通过硅胶色谱法(pe/etoac=2/1)纯化,得到化合物4(12.5mg,27%)。lcms:410.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.86(brs,1h),8.27(d,j=8.8hz,1h),8.17(d,j=8.8hz,1h),7.51(s,1h),7.43-7.39(m,2h),7.11(s,1h),6.18(t,j=3.2hz,1h),6.07(s,1h),4.94(s,2h),2.73(s,6h),2.29(s,3h)。
[0610]
实施例4:化合物5的合成
[0611][0612]
步骤1:在氮气下,将a(219mg,0.5mmol,1.0eq)、b(71.5mg,1.05mmol,2.1eq)、c(52mg,0.6mmol,1.2eq)、cui(10mg,0.05mmol,0.1eq)和cs2co3(343mg,1.05mmol,2.1eq)在dmf(8ml)中的混合物于125℃搅拌90分钟,将反应混合物冷却至室温,倒入到40ml饱和的nh4cl(含水)溶液中,并用etoac(20ml x 3)萃取。将合并的有机层用饱和的nh4cl(含水)溶液(10ml x 2)和盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过prep-hplc纯化,得到d(21.2mg,10%)。lcms:425.2[m+h]
+
.
[0613]
步骤2:将d(21.2mg,0.05mmol,1.0eq)和lioh.h2o(21mg,0.5mmol,10.0eq)在thf/h2o(4ml/4ml)中的混合物于室温搅拌过夜。将反应混合物减压浓缩以除去thf,冷却至0℃,用1n hcl酸化至ph=6,并用乙酸乙酯(10ml x 3)萃取。将合并的有机相经无水na2so4干燥,过滤并浓缩,得到粗产物,将其通过prep-hplc纯化,得到化合物5(3.4mg,10%),为黄色固体。lcms:397.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.53(s,1h),8.30(d,j=8.4hz,1h),8.16(d,j=8.8hz,1h),8.00(s,1h),7.75(s,1h),7.64(d,j=8.8hz,1h),7.42(d,j=8.8hz,1h),7.20(s,1h),5.03(s,2h),2.74(s,6h)。
[0614]
实施例5:化合物6的合成
[0615][0616]
步骤1:将a(150mg,0.343mmol)、b(49mg,0.720mmol)、n,n'-二甲基-1,2-乙二胺
(9mg,0.103mmol)、cui(6.5mg,0.034mmol)和cs2co3(235mg,0.720mmol)在dmf(5ml)中的混合物于140℃搅拌1.5小时。向反应混合物中加入水(100ml),并用etoac(100ml)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩。将残余物通过prep-hplc纯化,得到化合物6(9.3mg,5.7%)。lcms:397.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.78(s,1h),8.30(d,j=8.4hz,1h),8.17(d,j=8.8hz,1h),8.02(s,1h),7.88-7.86(m,2h),7.42(d,j=8.4hz,1h),6.66(s,1h),4.95(s,2h),2.74(s,6h)。
[0617]
实施例6:化合物7的合成
[0618][0619]
步骤1:在n2气氛下,将a(100.0mg,0.23mmol,1.0eq)、b(19.0mg,0.28mmol,1.2eq)、pd2(dba)3(21.0mg,0.023mmol,0.1eq)、xantphos(13.0mg,0.023mmol,0.1eq)和cs2co3(150.0mg,0.46mmol,2.0eq)在甲苯(5.0ml)中的混合物于110℃搅拌过夜。将反应混合物冷却至室温,用水(20ml)稀释,用etoac(25ml)萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并蒸发。将残余物通过prep-hplc纯化,得到c(48.0mg,50%),为黄色固体。lcms:424.1[m+h]
+
.
[0620]
步骤2:将c(48.0mg,0.11mmol,1.0eq)和lioh
·
h2o(46.0mg,1.1mmol,10.0eq)在thf/meoh/h2o(3.0ml/2.0ml/2.0ml)中的混合物于45℃搅拌3小时,并然后用水(15ml)稀释,用1n hcl(水溶液)酸化至ph=3-4。将该固体过滤收集并干燥,得到化合物7(31.3mg,70%),为黄色固体。lcms:396.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ9.02(s,1h),8.66(s,1h),8.28(d,j=8.4hz,1h),8.21(d,j=7.6hz,1h),8.15(d,j=8.4hz,1h),7.92(s,1h),7.65(d,j=7.6hz,1h),7.56(s,1h),7.38(d,j=8.8hz,1h),4.98(s,2h),2.76(s,6h)ppm.
[0621]
实施例7:化合物8的合成
[0622][0623]
步骤1:在n2气氛下,将a(100.0mg,0.23mmol,1.0eq)、b(84.0mg,0.69mmol,3.0eq)、pd(pph3)4(23.0mg,0.02mmol,0.1eq)和csf(105.0mg,0.69mmol,3.0eq)在dmf(3.0ml)中的混合物于90℃搅拌过夜。将反应混合物过滤并蒸发,得到粗品c(150mg,》100%),为褐色固体。lcms:436.1[m+h]
+
.
[0624]
步骤2:在n2气氛下,将c(150.0mg,0.3mmol,1.0eq)和naoh(60.0mg,1.5mmol,5.0eq)在etoh/h2o(5.0ml/1.0ml)中的混合物于室温搅拌过夜。将反应混合物蒸发。将残余物通过prep-hplc纯化,得到化合物8(6.0mg,8%),为黄色固体。lcms:408.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.81(brs,1h),8.74(s,2h),8.31(d,j=8.0hz,1h),8.16(d,j=8.8hz,1h),7.91(s,1h),7.85(s,2h),7.72(d,j=8.0hz,1h),7.41(d,j=8.8hz,1h),5.05(s,2h),2.74(s,6h)。
[0625]
实施例8:化合物9的合成
[0626][0627]
步骤1:在n2气氛下,将a(50.0mg,0.11mmol,1.0eq)、b(27.0mg,0.22mmol,2.0eq)、pd(pph3)4(11.0mg,0.01mmol,0.1eq)和csf(50.0mg,0.33mmol,3.0eq)在dmf(2.0ml)中的混合物于90℃搅拌过夜。将反应混合物过滤并蒸发,得到粗品c(100mg,》100%),为褐色固体。lcms:436.1[m+h]
+
.
[0628]
步骤2:在n2气氛下,将c(100.0mg,0.23mmol,1.0eq)和naoh(15.0mg,1.7mmol,2.0eq)在etoh/h2o(5.0ml/1.0ml)中的混合物于室温搅拌过夜。将反应混合物蒸发。将残余物通过prep-hplc纯化,得到化合物9(4.0mg,8%),为黄色固体。lcms:408.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ9.02(s,1h),8.66(s,1h),8.28(d,j=8.4hz,1h),8.21(d,j=7.6hz,1h),8.15(d,j=8.4hz,1h),7.92(s,1h),7.65(d,j=7.6hz,1h),7.56(s,1h),7.38(d,j=8.8hz,1h),4.98(s,2h),2.76(s,6h)。
[0629]
实施例9:化合物10的合成
[0630][0631]
步骤1:在n2气氛下,向a(100.0mg,0.23mmol,1.0eq)的甲苯(10.0ml)溶液中加入pd(pph3)4(53.0mg,0.046mmol,0.2eq)和b(127.0mg,0.35mmol,1.5eq)。将该混合物于110℃搅拌4小时,然后通过硅藻土过滤。将滤液浓缩。将残余物用etoac(20ml)稀释,用h2o(15ml x 2)洗涤。将有机层经无水na2so4干燥,并然后过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=8/1)纯化,得到c(95mg,95%)。lcms:436.2[m+h]
+
.
[0632]
步骤2:向c(95.0mg,0.287mmol,1.0eq)在thf/h2o(5.0/1.0ml)中的混合物中加入lioh h2o(95.0mg,2.87mmol,10.0eq)。将该混合物于40℃搅拌过夜。将该混合物用1n hcl(水溶液)酸化至ph=5-6,用etoac(15ml x5)萃取。将合并的有机相用盐水(20ml)洗涤,并经无水na2so4干燥,并然后过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=2/1)纯化,得到化合物10(55.1mg,62%)。lcms:408.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.78(s,1h),8.33-8.31(m,2h),8.19-8.17(m,2h),8.04-8.00(m,2h),7.50(t,j=7.2hz,1h),7.41(d,j=8.4hz,1h),5.00(s,2h),2.76(s,6h)。
[0633]
实施例10:化合物11的合成
[0634][0635]
步骤1:在氮气氛下,将a(87.6mg,0.2mmol,1.0eq)、b(49mg,0.4mmol,2.1eq)、pd(pph3)4(46.2mg,0.04mmol,0.2eq)和k2co3(55.2mg,0.4mmol,2.0eq)在dmf(2ml)中的混合
物于90℃搅拌过夜。将反应混合物冷却至室温,倒入到40ml饱和的nh4cl(含水)溶液中,并用etoac(20ml x 3)萃取。将合并的有机层依次用饱和的nh4cl溶液(10ml x 2)和盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过硅胶柱色谱法(etoac/pe=1/6)纯化,得到c(79.4mg,91.5%)。lcms:435.3[m+h]
+
.
[0636]
步骤2:将c(79.4mg,0.18mmol,1.0eq)和lioh.h2o(77mg,1.8mmol,10.0eq)在thf/h2o(10ml/10ml)中的混合物于30℃搅拌过夜。将反应混合物减压浓缩以除去thf,用1n hcl(水溶液)酸化至ph=6,并用乙酸乙酯(20ml x 3)萃取。将合并的有机相经无水na2so4干燥,过滤并浓缩,得到粗品,将其通过prep-hplc纯化,得到化合物11(15.4mg,20.7%),为黄色固体。lcms:407.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.27(d,j=8.4hz,1h),8.17(d,j=8.8hz,1h),7.83(d,j=1.2hz,1h),7.81(s,1h),7.78(s,1h),7.64(dd,j=8.0,0.8hz,1h),7.56(d,j=7.2hz,1h),7.54(d,j=7.6hz,1h),7.49-7.46(m,1h),7.40(d,j=8.8hz,1h),5.03(s,2h),2.78(s,6h)。
[0637]
实施例11:化合物21的合成
[0638][0639]
步骤1:在室温下,向a(6.9g,39.3mmol,1.0eq)和cs2co3(26.0g,78.6mmol,2.0eq)在dmf(150.0ml)中的混合物中加入etoh(2.7g,59.0mmol,1.5eq)。将生成的混合物于40℃搅拌7小时,冷却至室温,用水(500ml)稀释,并然后用etoac(100ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe/etoac=20/1)纯化,得到b(7.6g,96.0%)。
[0640]
步骤2:将b(13.0g,64.7mmol,1.0eq)、fe(18.0g,323.0mmol,5.0eq)和nh4cl(10.4g,194.0mmol,3.0eq)在etoh(130.0ml)/水(10.0ml)中的混合物于90℃搅拌3小时,冷却至室温,并然后过滤。将滤液用水(200ml)稀释,用etoac(100ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe)纯化,得到c(11.0g,80%纯度,大约00%)。lcms:172.1[m+h]
+
.
[0641]
步骤3:在0℃下,向c(11.0g,粗品)在dcm(500.0ml)中的混合物中加入br2(6.3g,39.4mmol)。将反应混合物于0℃搅拌1小时,依次用na2co3(饱和的水溶液)和水洗涤。将有机层经na2so4干燥,过滤,浓缩。将残余物通过硅胶色谱法(pe/etoac=100/1)纯化,得到d
(7.6g,47.2%,两步)。lcms:250.0[m+h]
+
.
[0642]
步骤4:将d(3.5g,14.0mmol,1.0eq)、mei(20.0g,140.0mmol,10.0eq)和cs2co3(13.7g,42mmol,3.0eq)在dmf(60ml)中的混合物于90℃搅拌16小时,然后冷却至室温。将生成的混合物浓缩,并将残余物通过硅胶色谱法(pe/etoac=100/1)纯化,得到e(3.8g,91.0%)。lcms:278.0[m+h]
+
.
[0643]
步骤5:在氩气氛下,将f(2.0g,8.1mmol,1.0eq)、pd(pph3)4(470mg,0.4mmol,0.05eq)、g(3.4g,20.3mmol,2.5eq)和k2co3(4.5g,32.5mmol,4.0eq)在etoh(50.0ml)/水(5.0ml)中的混合物于90℃搅拌过夜。将生成的混合物浓缩,得到h(1.7g,大约100%)。
[0644]
步骤6:在h2气氛(1atm)下,将h(1.7g,8.2mmol,1.0eq)和pd/c(170.0mg)在meoh(100ml)中的混合物于室温搅拌6小时,过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到i(1.0g,70.0%)。lcms:180.0[m+h]
+
.
[0645]
步骤7:在氩气氛下,将e(537.0mg,1.9mmol,1.0eq)、i(311.0mg,1.7mmol,0.9eq)、乙酸钾(378.0mg,3.9mmol,2.0eq)、铜粉(37.0mg,0.6mmol,0.3eq)和醋酸铜(106.0mg,0.6mmol,0.3eq)在2-戊醇(10.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(水溶液,200ml)。将生成的混合物通过硅藻土过滤。将滤液用浓hcl(水溶液)酸化至ph=2,然后用etoac(50ml x 2)萃取。将有机层浓缩。将残余物用pe(30ml)研磨并过滤,得到j(375.0mg,57.0%)。lcms:377.2[m+h]
+
.
[0646]
步骤8:在氩气氛下,将j(375.0mg)和伊顿试剂(10.0ml)的混合物于50℃加热2小时,然后冷却并倒入到冰水混合物中。将该固体通过过滤收集,通过用mecn(5ml)研磨纯化,得到k(330.0mg,92%)。lcms:359.2[m+h]
+
.
[0647]
步骤9:在室温下,向k(330.0mg,0.92mmol,1.0eq)和cs2co3(900.0mg,3.0mmol,3.0eq)在dmf(10ml)中的混合物中加入碘代乙酸乙酯(593.0mg,3.0mmol,3.0eq)。然后在氩气氛下将该混合物于40℃搅拌12小时。将生成的混合物用水(50ml)稀释,用etoac(30ml x 2)萃取。将有机层浓缩,并将残余物通过prep-hplc纯化,得到m(30.0mg,7.0%)。lcms:445.2[m+h]
+
.
[0648]
步骤10:在-70℃下,向m(30.0mg)在dcm(15.0ml)中的混合物中加入bbr3(1.0ml)。将该混合物温热至室温,并搅拌1小时,然后用冰淬灭。将有机层分离,并经na2so4干燥,过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到n(7.0mg,25.0%)。lcms:417.2[m+h]
+
.
[0649]
步骤11:将n(7.0mg,0.017mmol,1.0eq)和lioh
·
h2o(20.0mg,0.48mmol,28.0eq)在thf(1.0ml)、etoh(6.0ml)和h2o(2.0ml)中的混合物于40℃搅拌20小时。将该混合物用水(10.0ml)稀释,用浓hcl(水溶液)酸化至ph《1,并然后用etoac(30ml x 2)萃取。将有机层浓缩,并将残余物通过反相快速柱色谱法(5%mecn至80%mecn,1% ch3cooh)纯化,得到化合物21(1.5mg,23.1%)。lcms:389.1[m+h]
+
.1h nmr(400mhz,cd3od):δ8.24(d,j=8.4hz,1h),7.41(s,1h),7.30(d,j=8.0hz,1h),6.71(s,1h),4.91(s,2h),3.10-3.12(m,1h),2.76(brs,6h),1.34(d,j=6.8hz,6h)。
[0650]
实施例12:化合物26的合成
[0651][0652]
步骤1:在氮气氛下,将a(3.0g,14.4mmol,1.0eq)、二甲胺(2m的thf溶液,11ml,21.6mmol,1.5eq)、tea(4.0ml,28.8mmol,2.0eq)在thf(10ml)中的混合物于室温搅拌过夜。加入水(30ml)。将生成的混合物用etoac(20ml x 2)萃取。将合并的有机层用盐水(20ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品b(3.0g,89.5%)。
[0653]
步骤2:向b(3.0g,12.8mmol,1.0eq)在ch3oh(10ml)中的混合物中加入pd/c(0.30g,10%)。将该混合物于室温在h2气氛(1atm)下搅拌过夜,并通过硅藻土过滤。将滤液真空浓缩,得到粗品c(2.30g,90%),为黄色油状物。lcms:205.1[m+h]
+
.
[0654]
步骤3:向c(2.30g,11.3mmol,1.0eq)在hcl(3m,20ml)中的混合物中加入nano2(0.86g,12.4mmol,1.1eq)。将该混合物于0℃搅拌30分钟,然后在0℃下加入ki(5.6g,33.9mmol,3.0eq)。将该混合物于室温搅拌1小时。将生成的混合物用etoac(20ml x 2)萃取。将合并的有机层用盐水(20.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品d(2.8g,80%)。
[0655]
步骤4:在氮气氛下,将2-氨基-4-甲基苯甲酸(1.0g,6.60mmol,1.0eq)、d(2.70g,8.60mmol,1.3eq)、乙酸钾(1.90g,19.8mmol,3.0eq)、醋酸铜(0.36g,1.98mmol,0.3eq)和铜粉(0.13g,1.98mmol,0.3eq)在2-戊醇(20ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入水(30ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl(水溶液)酸化至ph=2,然后加入另外的水(50ml)。将生成的混合物用etoac(50ml x 2)萃取。将合并的有机层用盐水(50ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品,将其通过用pe(20ml)研磨纯化,得到e(1.60g,70.0%)。lcms:339.2[m+h]
+
.
[0656]
步骤5:将e(1.60mg,4.73mmol)和伊顿试剂(15ml)的混合物于70℃加热2小时,然后冷却至室温,并倒入到冰和水的混合物中。将该固体过滤收集并干燥,得到粗品f(1.0g,66.7%)。lcms:321.1[m+h]
+
[0657]
步骤6:向f(200.0mg,0.63mmol,1.0eq)和cs2co3(410.0mg,1.26mmol,2.0eq)在乙腈(10ml)中的混合物中加入碘代乙酸乙酯(203.0mg,0.95mmol,1.5eq)。将该混合物于室温搅拌过夜。将该混合物通过硅藻土过滤。将滤液真空浓缩,得到粗品g(130.0mg,52%),为黄色固体。lcms:407.2[m+h]
+
.
[0658]
步骤7:将g(130.0mg;0.32mmol,1.0eq)、lioh
·
h2o(67.0mg,1.60mmol,5.0eq)在thf(5.0ml)和h2o(5.0ml)中的混合物于室温搅拌过夜。将该溶液用水(15ml)稀释,用etoac(10ml x 2)萃取。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物26(30.0mg,25.0%),为黄色固体。lcms:379.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.18(d,j=8.4hz,1h),8.07(d,j=8.0hz,1h),7.61-7.58(m,2h),7.15(d,j=8.0hz,1h),5.03
(s,2h),2.75(s,6h),2.46(s,3h)
[0659]
实施例13:化合物29的合成
[0660][0661]
步骤1:向a(1.08g,5.0mmol,1.0eq)的2-戊醇(15.0ml)溶液中加入b(1.41g,5.0mmol,1.0eq)、cui(0.285g,1.5mmol,0.3eq)和k2co3(1.73g,12.5mmol,2.5eq)。在n2气氛下,将反应混合物于135℃搅拌过夜,并然后减压浓缩。加入冰水(10ml),并将该混合物用etoac(100ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(dcm/meoh=20/1)纯化,得到c(1.6g,86.7%),为白色固体。lcms:371.1[m+h]
+
.
[0662]
步骤2:将c(750mg,2.03mmol,1.0eq)在伊顿试剂(5ml)中的混合物于70℃搅拌3小时。将反应混合物倒入到冰水(10ml)中,然后加入nahco3溶液(10ml)。将悬浮液用etoac(50ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(dcm/meoh=20/1)纯化,得到d(540mg,75.8%),为白色固体。lcms:353.2[m+h]
+
.
[0663]
步骤3:将d(100.0mg,0.285mmol,1.0eq)、e(92.0mg,0.428mmol,1.5eq)和cs2co3(232.0mg,0.713mmol,2.5eq)在acn(5.0ml)中的混合物加热至40℃持续2天。加入冰水(10ml),并将该混合物用etoac(20ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(pe/etoac=15/1)纯化,得到f(80.0mg,64.2%),为白色固体。lcms:439.2[m+h]
+
[0664]
步骤4:将f(60.0mg,0.137mmol,1.0eq)、lioh
·
h2o(18.0mg,0.441mmol,3.0eq)在etoh(2.0ml)/thf(2.0ml)/h2o(2.0ml)中的混合物于室温搅拌过夜,并然后减压浓缩。加入饱和的nh4cl(含水)溶液(5.0ml),并将该混合物用etoac(20ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过prep-hplc纯化,得到化合物29(9.1mg,16.2%),为白色固体。lcms:411.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.92(brs,1h),8.26(d,j=2.8hz,1h),8.15(d,j=8.4hz,1h),7.94(dd,j=6.4,2.8hz,1h),7.64(d,j=9.2hz,1h),7.42(d,j=8.8hz,1h),4.87(s,2h),2.72(brs,6h)。
[0665]
实施例14:化合物30的合成
[0666][0667]
步骤1:在室温下,向a(1.08g,5.0mmol,1.0eq)的2-戊醇(15.0ml)溶液中加入b(1.41g,5.0mmol,1.0eq)、cui(0.285g,1.5mmol,0.3eq)和k2co3(1.73g,12.5mmol,2.5eq)。在n2气氛下,将反应混合物于135℃搅拌过夜,并然后减压浓缩。将残余物用水(10ml)稀释,用etoac(50ml x 2)萃取。将合并的有机相经无水na2so4干燥,并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(dcm/meoh=20/1)纯化,得到c(1.6g,86.7%),为白色固体。lcms:371.1[m+h]
+
.
[0668]
步骤2:将c(750mg,2.03mmol,1.0eq)在伊顿试剂(5ml)中的混合物于70℃搅拌3小时。将反应混合物倒入到冰水(10ml)中,然后加入nahco3溶液(10ml)。将该混合物用etoac(50ml x 2)萃取。将合并的有机相经无水na2so4干燥,并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(dcm/meoh=20/1)纯化,得到d(540.0mg,75.8%),为白色固体。lcms:353.2[m+h]
+
.
[0669]
步骤3:将d(100.0mg,0.285mmol,1.0eq)、e(92.0mg,0.428mmol,1.5eq)和cs2co3(232.0mg,0.713mmol,2.5eq)在acn(5.0ml)中的混合物加热至40℃持续2天。加入冰水(10ml),并将该混合物用etoac(20ml x 2)萃取。将合并的有机相经无水na2so4干燥,并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(pe/etoac=15/1)纯化,得到f(80.0mg,64.2%),为白色固体。lcms:439.2[m+h]
+
[0670]
步骤4:向f(80.0mg,0.183mmol,1.0eq)的dmf(3.0ml)溶液中加入g(27.0mg,0.219mmol,1.2eq)和na2co3(39.0mg,0.366mmol,2.0eq)。将烧瓶脱气并充入n2,然后加入pd(pph3)4(10.0mg,0.009mmol,0.05eq)。在n2气氛下,将反应混合物于60℃搅拌过夜。加入冰水(5ml),并将该混合物用etoac(20ml x 2)萃取。将合并的有机相经无水na2so4干燥,并过滤。将滤液浓缩。将残余物通过硅胶柱色谱法(pe/etoac=15/1)纯化,得到h(65.0mg,81.4%),为白色固体。lcms:433.1[m-h]-.
[0671]
步骤5:将h(65.0mg,0.149mmol,1.0eq)、lioh
·
h2o(19.0mg,0.447mmol,3.0eq)在etoh(2.0ml)/h2o(2.0ml)中的混合物于40℃搅拌2小时,然后减压浓缩。加入饱和的nh4cl(含水)溶液(5.0ml),并将该混合物用etoac(20ml x 2)萃取。将合并的有机相经无水na2so4干燥,并过滤。将滤液浓缩。将残余物通过prep-hplc纯化,得到化合物30(19.9mg,32.7%),为黄色固体。lcms:407.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.88(brs,1h),8.44(d,j=2.4hz,1h),8.20(d,j=8.4hz,1h),8.15(dd,j=6.4,2.4hz,1h),7.78-7.73(m,3h),7.54-7.50(m,2h),7.42-7.38(m,2h),4.94(s,2h),2.74(brs,6h)。
[0672]
实施例15:化合物31的合成
[0673][0674]
步骤1:在n2气氛下,将b(500.0mg,3.3mmol,1.0eq)、a(1.0g,3.6mmol,1.1eq)、乙酸钾(647.0mg,6.6mmol,2.0eq)、醋酸铜(198.0mg,0.99mmol,0.3eq)和铜粉(63.0mg,0.99mmol,0.3eq)在2-戊醇(25ml)中的混合物于130℃搅拌过夜。将该混合物冷却至室温,用水(30ml)稀释,用1n hcl(水溶液)酸化至ph=2-3,并用etoac(50ml x 2)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并蒸发。将残余物通过用pe(20ml)研磨纯化,得到c(610.0mg,61%)。lcms:305.1[m+h]
+
.
[0675]
步骤2:将c(390mg,1.28mmol)和伊顿试剂(10ml)的混合物于80℃搅拌1小时。将该混合物冷却至室温,缓慢倒入到冰水(30ml)中,用etoac(50ml x 2)萃取。将合并的有机层依次用饱和的nahco3(水溶液,25ml)和盐水(25ml)洗涤,经无水na2so4干燥,过滤并蒸发,得到d(330.0mg,90%)。lcms:287.0[m+h]
+
.
[0676]
步骤3:向d(330.0mg,1.15mmol,1.0eq)和cs2co3(1.1g,3.45mmol,3.0eq)的acn(8ml)溶液中加入e(738.0mg,3.45mmol,3.0eq)。将该混合物于35℃搅拌4小时。将该混合物冷却至室温,用水(25ml)稀释,用etoac(50ml x 2)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并蒸发。将残余物通过prep-hplc纯化,得到f(90.0mg,21%),为黄色固体。lcms:373.5[m+h]
+
.
[0677]
步骤4:将f(90.0mg,0.24mmol,1.0eq)和lioh
·
h2o(80.0mg,1.92mmol,8.0eq)在thf(5.0ml)和h2o(2.0ml)中的混合物于70℃搅拌过夜。将该混合物冷却至室温,用水(15.0ml)稀释,用1n hcl(水溶液)酸化至ph=3-4,用etoac(30ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并蒸发,得到化合物31(42.6mg,51%),为黄色固体。lcms:345.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.84(s,1h),8.15(d,j=8.4hz,1h),8.00(s,1h),7.64(d,j=7.2hz,1h),7.54(d,j=8.8hz,1h),7.35(d,j=8.4hz,1h),4.87(s,2h),2.73(brs,6h),2.42(s,3h)。
[0678]
实施例16:化合物32的合成
[0679][0680]
步骤1:将a(1.0mg,3.68mmol,1.0eq)、lioh
·
h2o(0.77g,18.4mmol,5.0eq)在thf(5ml)和h2o(2ml)中的混合物于室温搅拌过夜,用水(30ml)稀释,用etoac(20ml x 2)萃取。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到b(0.90g,94.7%),为白色固体。
[0681]
步骤2:将c(20.0g,113.9mmol,1.0eq)、二甲胺(2m的thf溶液,85.4ml,170.8mmol,1.5eq)、tea(23.4ml,170.8mmol,2.0eq)在thf(10.0ml)中的混合物于室温搅拌过夜。将该溶液用水(30.0ml)稀释。将生成的混合物用etoac(20.0ml x 2)萃取。将合并的有机层用盐水(20.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品d(22.0g,96.5%)。
[0682]
步骤3:向d(22.0g,110.0mmol,1.0eq)在etoh(150ml)和水(30.0ml)中的混合物中加入fe(30.8g,550.0mmol,5.0eq)、nh4cl(29.7g,550.0mmol,5.0eq)。将该混合物于85℃搅拌1小时,并通过硅藻土过滤。将滤液真空浓缩,得到粗品e(13.5g,72.2%),为黄色油状物。lcms:171.1[m+h]
+
.
[0683]
步骤4:向e(13.5g,79.4mmol,1.0eq)在hcl(水溶液,3m,200ml)中的混合物中加入nano2(6.0g,87.3mmol,1.1eq)。将该混合物于0℃搅拌30分钟,并然后在0℃下加入ki(26.4g,158.8mmol,2.0eq)。将该混合物于室温搅拌1小时,用etoac(100ml x 2)萃取。将合并的有机层用盐水(100.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品f(15.6g,70.0%),为黄色油状物。lcms:281.9[m+h]
+
.
[0684]
步骤5:在氮气氛下,将b(0.90g,3.49mmol,1.0eq)、f(1.50g,5.24mmol,1.5eq)、乙酸钾(1.0g,10.5mmol,3.0eq)、醋酸铜(0.19g,1.05mmol,0.3eq)和铜粉(0.067g,1.05mmol,0.3eq)在2-戊醇(10.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。将反应混合物用水(20ml)稀释,并通过硅藻土过滤。将滤液用2n hcl酸化至ph=2,加入水(50.0ml)。将生成的混合物用etoac(30ml x 2)萃取。将合并的有机层用盐水(30ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品,将其通过用pe(20ml)研磨纯化,得到g(0.86g,59.7%)。lcms:411.1[m+h]
+
.
[0685]
步骤6:将g(0.86mg,2.25mmol)和伊顿试剂(15ml)的混合物于70℃加热2小时。然后冷却并倒入到冰水混合物中。将该固体过滤收集并干燥,得到粗品h(0.41g,50.0%)。lcms:393.1[m+h]
+
[0686]
步骤7:向h(0.41g,1.05mmol,1.0eq)和cs2co3(1.0g,3.15mmol,3.0eq)在乙腈(10ml)中的混合物中加入碘代乙酸乙酯(0.46g,2.10mmol,2.0eq)。将该混合物于室温搅拌过夜。将该溶液通过硅藻土过滤。将滤液真空浓缩,得到粗品i(0.20g,40.8%),为黄色固体。lcms:479.1[m+h]
+
.
[0687]
步骤8:将i(100.0mg;0.21mmol,1.0eq)、lioh
·
h2o(44.0mg,1.05mmol,5.0eq)在thf(5.0ml)和h2o(1.0ml)中的混合物于室温搅拌过夜。将该溶液用水(15ml)稀释,并然后用etoac(10ml x 2)萃取。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物32(30.0mg,32.0%),为黄色固体。lcms:451.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.96(s,1h),8.28(s,1h),8.13(d,j=8.4hz,1h),7.55(s,1h),7.40(d,j=8.4hz,1h),4.91(s,2h),3.36(m,1h),2.72(s,6h),1.29(d,j=6.8hz,6h)。
[0688]
实施例17:化合物33的合成
[0689][0690]
步骤1:在n2气氛下,将a(150.0mg,0.32mmol,1.0eq)、(ch3)2zn(134.0mg,1.41mmol,4.4eq)和pd(pph3)4(37.0mg,0.032mmol,0.1eq)在thf(8.0ml)中的混合物于70℃搅拌过夜。将反应混合物冷却至室温,用水(15ml)稀释,并然后用etoac(20ml)萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并蒸发。将残余物通过硅胶柱色谱法(pe至pe/etoac=10/1)纯化,得到b(120.0mg,93%),为黄色固体。lcms:407.2[m+h]
+
.
[0691]
步骤2:将b(120.0mg,0.3mmol,1.0eq)和lioh
·
h2o(50.0mg,1.2mmol,4.0eq)在thf/meoh/h2o(3.0ml/3.0ml/2.0ml)中的混合物于40℃搅拌5小时,并然后用水(15ml)稀释,用1n hcl(水溶液)酸化至ph=3-4。将该固体过滤收集并干燥,得到化合物33(78.0mg,70%),为黄色固体。lcms:379.2[m+h]
+
.1h nmr(400mhz,cd3od):δ8.20-8.22(m,2h),7.59(s,1h),7.35(d,j=8.8hz,1h),4.94(s,2h),2.80(brs,6h),2.55(s,3h)ppm.
[0692]
实施例18:化合物34的合成
[0693]
[0694]
步骤1:在氮气氛下,将a(1.0g,4.35mmol,1.0eq)、b(1.83g,6.53mmol,1.5eq)、乙酸钾(1.28g,13.1mmol,3.0eq)、醋酸铜(0.24g,1.31mmol,0.3eq)和铜粉(0.084g,1.31mmol,0.3eq)在2-戊醇(20ml)中的混合物于120℃搅拌过夜,然后冷却至室温。加入水(30ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl(水溶液)酸化至ph=2,然后加入水(50.0ml)。将生成的混合物用etoac(50ml x 2)萃取。将合并的有机层用盐水(50.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品,将其通过用pe(20ml)研磨纯化,得到c(1.0g,59.9%)。lcms:383.0[m+h]
+
.
[0695]
步骤2:将c(0.86g,2.25mmol)和伊顿试剂(10ml)的混合物于70℃加热2小时,然后冷却并倒入到冰水混合物中。将该固体过滤收集并干燥,得到粗品d(0.67g,81.8%)。lcms:365.0[m+h]
+
[0696]
步骤3:向d(0.67g,1.84mmol,1.0eq)和cs2co3(1.20g,3.68mmol,2.0eq)在乙腈(20ml)中的混合物中加入碘代乙酸乙酯(0.60g,2.76mmol,1.5eq)。将该混合物于室温搅拌过夜,并通过硅藻土过滤。将滤液真空浓缩,得到粗品e(0.33g,40%),为黄色固体。lcms:451.1[m+h]
+
.
[0697]
步骤4:将e(100mg;0.22mmol,1.0eq)、lioh
·
h2o(46.6mg,1.11mmol,5.0eq)在thf(5.0ml)和h2o(1.0ml)中的混合物于室温搅拌过夜。将该溶液用水(15.0ml)稀释,并然后用etoac(10ml x 2)萃取。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15.0ml x 2)萃取。将合并的有机层用盐水(10.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物34(65.0mg,69.3%),为黄色固体。lcms:423.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.84(brs,1h),8.27(s,1h),8.14(d,j=8.8hz,1h),7.68(s,1h),7.40(d,j=8.8hz,1h),4.88(s,2h),2.72(brs,6h),2.52(s,3h)。
[0698]
实施例19:化合物35的合成
[0699][0700]
步骤1:在氮气氛下,将a(215mg,0.494mmol,1.0eq)、b(302mg,3.952mmol,8eq)、pd(dppf)cl2(72mg,0.099mmol,0.2eq)和csf(248mg,1.631mmol,3.3eq)在1,4-二噁烷(5ml)中的混合物于70℃搅拌过夜。将反应混合物冷却至室温,倒入到60ml水中,并用etoac(40ml x 3)萃取。将合并的有机层用盐水(20ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过prep-hplc纯化,得到c(12.9mg,6.3%)。lcms:413.1[m+h]
+
.
[0701]
步骤2:将c(12.9mg,0.031mmol,1.0eq)和lioh
·
h2o(33mg,0.313mmol,10.0eq)在thf/h2o(3ml/3ml)中的混合物于室温搅拌过夜。将反应混合物减压浓缩以除去thf,加入5ml水。将生成的混合物用1n hcl(水溶液)酸化至ph=6,过滤。将获得的固体通过prep-tlc(dcm/meoh=9/1)纯化,得到化合物35(7.0mg,58.2%),为黄色固体。lcms:385.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.97(brs,1h),8.15(s,1h),8.13(s,1h),7.39-7.36(m,2h),7.25(d,j=8.4hz,1h),4.87(s,2h),3.74-3.66(m,1h),2.73(s,6h),2.43-2.33(m,2h),2.23-2.13(m,2h),2.07-1.99(m,2h)。
[0702]
实施例20:化合物36的合成
[0703][0704]
步骤1:向a(100.0mg,0.23mmol,1.0eq)的二噁烷(5ml)溶液中加入b(59.0mg,0.69mmol,3.0eq)、csf(115.0mg,0.76mmol,3.3eq)和pd(dppf)cl2(20.0mg,0.023mmol,0.1eq)。在n2气氛下,将该混合物于75℃搅拌过夜。将该混合物用水(20ml)稀释,并用etoac(20ml x 2)萃取。将合并的有机层依次用水(15ml)和盐水(15ml)洗涤,经无水na2so4干燥并浓缩。将残余物通过prep-hplc纯化,得到c(28.0mg,30.8%)。lcms:399.1[m+h]
+
.
[0705]
步骤2:将c(28.0mg,0.07mmol,1.0eq)、lioh
·
h2o(12.0mg,0.28mmol,4.0eq)在thf/h2o(5/2ml)中的混合物于室温搅拌过夜。将该混合物用2n hcl(水溶液)酸化至ph=2-3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物36(12.6mg,48.5%),为黄色固体。lcms:371.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.82(brs,1h),8.14(d,j=8.8hz,1h),8.08(d,j=8.4hz,1h),7.37(d,j=8.8hz,1h),7.32(s,1h),6.99(d,j=8.4hz,1h),4.89(s,2h),2.72(s,6h),2.15-2.10(m,1h),1.12-1.07(m,2h),0.88-0.84(m,2h),
[0706]
实施例21:化合物37的合成
[0707][0708]
步骤1:向a(200.0mg,0.46mmol,1.0eq)的二噁烷(10ml)溶液中加入b(212.0mg,1.38mmol,3.0eq)、csf(230.0mg,1.52mmol,3.3eq)和pd(dppf)cl2(40.0mg,0.046mmol,0.1eq)。在n2气氛下,将该混合物于95℃搅拌过夜。将该混合物用水(30ml)稀释,并用etoac(30ml x 2)萃取。将合并的有机层依次用水(30ml)和盐水(30ml)洗涤,经无水na2so4干燥并浓缩。将残余物通过硅胶色谱法(pe/etoac=5/1)纯化,得到c(130.0mg,73.9%)。lcms:385.1[m+h]
+
.
[0709]
步骤2:向c(130.0mg,0.34mmol,1.0eq)的etoh/thf(5/1ml)溶液中加入pd/c(75.0mg)。在h2(1atm)下,将该混合物于室温搅拌1小时。将该混合物用水(20ml)稀释,并用etoac(20ml x 2)萃取。将合并的有机层用水(30ml)、盐水(30ml)洗涤,经无水na2so4干燥并浓缩。将残余物通过prep-hplc纯化,得到d(70.0mg,53.4%)。lcms:387.1[m+h]
+
.
[0710]
步骤3:将d(70.0mg,0.18mmol,1.0eq)、lioh
·
h2o(30.0mg,0.73mmol,4.0eq)在thf/h2o(5/2ml)中的混合物于室温搅拌过夜。将该混合物用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并
过滤。将滤液真空浓缩,得到化合物37(52.2mg,80.4%),为黄色固体。lcms:359.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.83(brs,1h),8.15(d,j=8.8hz,1h),8.13(d,j=8.0hz,1h),7.43(s,1h),7.38(d,j=8.8hz,1h),7.23(d,j=8.4hz,1h),4.88(s,2h),2.81-2.75(m,2h),2.72(s,6h),1.25(t,j=7.6hz,3h)。
[0711]
实施例22:化合物38、48和49的合成
[0712][0713]
步骤1:在室温下,将a(10.0g,48.4mmol,1.0eq)和2n hcl(水溶液200.0ml)的混合物搅拌5分钟,然后冷却至0℃,并在0℃下加入nano2(4.0g,58.1mmol,1.2eq)。将该混合物于0℃搅拌10分钟,然后加入ki(24.1g,145.3mmol,3.0eq)。将反应混合物在室温下搅拌1小时,用etoac(200ml x 2)萃取。将有机层浓缩。将残余物通过硅胶色谱法(pe)纯化,得到b(10.8g,70.6%)。
[0714]
步骤2:在氩气氛下,将c(4.0g,26.5mmol,1.0eq)、b(10.9g,34.4mmol,1.3eq)、乙酸钾(7.8g,79.3mmol,3.0eq)、铜粉(508.0mg,7.9mmol,0.3eq)和醋酸铜(1.5g,7.9mmol,0.3eq)在2-戊醇(100.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(水溶液200.0ml)。将该混合物通过硅藻土过滤。将滤液用浓hcl(水溶液)酸化至ph《1,并用etoac(100ml x 2)萃取。将有机层浓缩,得到粗品,将其用pe(50ml)研磨并过滤,得到d(7.4g,82.2%)。lcms:340.0[m+h]
+
.
[0715]
步骤3:在氩气氛下,将d(7.4g)和伊顿试剂(30.0ml)的混合物于50℃加热2小时,然后冷却至室温,并倒入到冰和水的混合物(100ml)中。将该固体通过过滤收集,用mecn(30ml)研磨并过滤,得到e(5.0g,71.4%)。lcms:321.9[m+h]
+
.
[0716]
步骤4:在室温下,向e(5.0g,15.6mmol,1.0eq)和cs2co3(20.3g,62.3mmol,4.0eq)在mecn(100ml)中的混合物中加入碘代乙酸乙酯(10.0g,46.7mmol,3.0eq)。然后将该混合物于50℃搅拌1小时,冷却至室温,并用水(100ml)稀释。将悬浮液用etoac(100ml x 2)萃取。将有机层浓缩,并通过硅胶色谱法(pe/etoac=10/1至etoac/thf=10/1)纯化,得到g(1.7g,27.0%)。lcms:408.0[m+h]
+
.
[0717]
步骤5:在氩气氛下,将g(1.7g,4.2mmol,1.0eq)、pd(pph3)4(482.0mg,0.4mmol,0.1eq)、h(0.9ml,5.4mmol,1.3eq)和k2co3(1.7g,12.5mmol,3.0eq)在etoh(30.0ml)/水(3.0ml)中的混合物于90℃搅拌3小时。将生成的混合物浓缩,并将残余物通过硅胶色谱法(pe/etoac=20/1至4/1,1%ch3cooh)纯化,得到化合物49(150.0mg,10.7%)。lcms:328.0[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.96(s,1h),8.19(d,j=8.4hz,1h),8.12(d,j=7.6hz,1h),7.45(d,j=8.4hz,1h),7.43(s,1h),7.18(d,j=8.0hz,1h),7.03-7.11(m,1h),5.67(d,j=11.2hz,1h),5.35(d,j=18.0hz,1h),5.05(s,2h),2.46(s,3h)。
[0718]
步骤6:在h2气氛(1atm)下,将化合物49(50.0mg,0.15mmol,1.0eq)和pd/c
(70.0mg)在meoh(15.0ml)/thf(5ml)中的混合物于室温搅拌6小时,过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到化合物38(2.1mg,4.2%)。lcms:296.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.99(br,1h),8.10(dd,j=8.0hz,1h),8.07(d,j=8.0hz,1h),7.69(d,j=7.6hz,1h),7.44(s,1h),7.32(t,j=7.6hz,1h),7.13(d,j=8.0hz,1h),5.02(s,2h),2.94(q,j=7.6hz,2h),2.45(s,3h),1.28(t,j=7.6hz,1h);化合物48(3.3mg,6.6%),lcms:330.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ13.06(s,1h),8.07(d,j=8.8hz,1h),8.04(d,j=8.0hz,1h),7.49(s,1h),7.42(d,j=7.6hz,1h),7.16(d,j=8.0hz,1h),5.04(s,2h),3.00(q,j=7.2hz,2h),2.46(s,3h),1.33(t,j=7.6hz,1h)。
[0719]
实施例23:化合物39的合成
[0720][0721]
步骤1:将a(1.00g,5.38mmol)、cs2co3(5.26g,16.14mmol)和mei(4.58g,32.26mmol)在dmf(5.0ml)中的混合物于80℃搅拌过夜。向反应混合物中加入水(100ml),并用etoac(100ml)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩,得到粗品b(700.0mg,60%),为褐色固体。lcms:214.1[m+h]
+
.
[0722]
步骤2:在n2气氛下,将b(700.0mg,3.27mmol)、c(631.0mg,3.27mmol)、cu(63.0mg,0.98mmol)、cu(oac)2(178.0mg,0.98mmol)和koac(960.0mg,9.8mmol)在2-戊醇(10.0ml)中的混合物于140℃搅拌过夜。向反应混合物中加入水(200ml),并用etoac(200ml)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩,得到粗品,将其通过prep-hplc(tfa)纯化,得到d(260.0mg,24.4%),为褐色油状物。lcms:327.1[m+h]
+
.
[0723]
步骤3:将d(260.0mg,0.8mmol)在伊顿试剂(10.0ml)中的混合物于50℃搅拌2小时,然后加入水(100ml)。将反应混合物用饱和的nahco3水溶液调节至ph=7-8,并用etoac(100ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤。将滤液真空浓缩,得到粗品e(160mg,65.1%),为黄色固体。lcms:309.1[m+h]
+
.
[0724]
步骤4:将e(160.0mg,0.52mmol)、2-碘乙酸乙酯(667.0mg,3.12mmol)和cs2co3(1020.0mg,3.12mmol)在ch3cn(10.0ml)中的混合物于45℃搅拌过夜。将反应混合物加入到水(50ml)中,并用etoac(50ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,并然后过滤。将滤液真空浓缩,得到粗品,将其通过prep-hplc(tfa)纯化,得到f(22mg,10.7%),为黄色固体。lcms:395.1[m+h]
+
.
[0725]
步骤5:向f(22.0mg,0.056mmol)的thf(5.0ml)溶液中加入lioh
·
h2o(9.4mg,0.22mmol)和水(1.0ml)。将反应混合物于30℃搅拌4天,然后用2n hcl(20ml)酸化,用etoac(10ml x 3)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,并
将残余物通过硅胶柱色谱法(dcm/meoh=10:1)纯化,得到化合物39(10mg,49%),为黄色固体。lcms:367.2[m+h]
+
.1h nmr(400mhz,d
6-dmso,ppm):δ8.12(d,j=8.4hz,1h),8.04(d,j=8.0hz,1h),7.51(d,j=1.2hz,1h),7.4(dd,j=8.4hz,1h),7.15(d,j=8.0hz,1h),4.85(s,2h),2.68(s,6h),2.49(s,3h),1.36(s,9h)。
[0726]
实施例24:化合物42的合成
[0727][0728]
步骤1:将a(60.0mg,0.155mmol)、b(37.5mg,0.31mmol)、hatu(87.4mg,0.23mmol)和diea(60.0mg,0.465mmol)在dmf(5.0ml)中的混合物于室温搅拌过夜。向反应混合物中加入水(50ml),并用etoac(50ml)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩,得到粗产物,将其通过prep-hplc(tfa)纯化,得到化合物42(5.4mg,7.1%),为黄色固体。lcms:490.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.17(brs,1h),8.15(d,j=2.8hz,1h),8.13(d,j=2.4hz,1h),7.46(d,j=9.2hz,1h),7.39(s,1h),7.37(s,1h),4.90(s,2h),2.74(s,6h),2.01-1.97(m,1h),1.35(s,9h),1.23-1.20(m,2h),1.13-1.11(m,2h)。
[0729]
实施例25:化合物43的合成
[0730][0731]
步骤1:将a(60.0mg,0.155mmol)、b(13.0mg,0.31mmol)、hatu(87.4mg,0.23mmol)和diea(60.0mg,0.465mmol)在dcm(5.0ml)中的混合物于40℃搅拌过夜。向反应混合物中加入水(50ml),并用etoac(50ml)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩,得到粗品,将其通过prep-hplc(tfa)纯化,得到化合物43(12.0mg,18.8%),为黄色固体。lcms:411.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.12(d,j=3.2hz,1h),8.10(d,j=3.2hz,1h),7.67(s,1h),7.39(d,j=8.8hz,1h),7.31(d,j=8.4hz,1h),6.74(brs,1h),4.77(s,2h),2.75(s,6h),1.35(s,9h)。
[0732]
实施例26:化合物44的合成
[0733][0734]
步骤1:将b(30mg,0.087mmol,1.0eq)、hatu(40mg,0.105mmol,1.2eq)和diea(45mg,0.348mmol,4.0eq)在dcm(4ml)中的混合物于室温搅拌1小时,并加入a(13mg,0.105mmol,1.2eq)。将反应混合物于室温搅拌过夜,然后浓缩。将残余物通过prep-hplc纯化,得到化合物44(31.0mg,79.7%),为黄色固体。lcms:448.3[m+h]
+
.1h nmr(400mhz,dmso-d6):12.10(brs,1h),8.13(d,j=8.8hz,1h),8.09(d,j=8.0hz,1h),7.36(d,j=8.8hz,1h),7.27(s,1h),7.18(d,j=8.4hz,1h),4.88(s,2h),3.08(s,1h),2.76(s,6h),2.47(s,3h),1.12-1.04(m,4h)。
[0735]
实施例27:化合物45的合成
[0736][0737]
步骤1:将b(30mg,0.087mmol,1.0eq)、hatu(40mg,0.105mmol,1.2eq)和diea(45mg,0.348mmol,4.0eq)在dcm(4ml)中的混合物于室温搅拌1小时,并加入a(4.5mg,0.105mmol,1.2eq)。将反应混合物于室温搅拌过夜,浓缩。将残余物通过prep-hplc纯化,得到化合物45(21.6mg,56.7%),为黄色固体。lcms:369.3[m+h]
+
.1h nmr(400mhz,cd3od):δ8.24(d,j=8.4hz,1h),8.20(d,j=8.4hz,1h),7.45(s,1h),7.31(d,j=8.8hz,1h),7.18(d,j=8.0hz,1h),4.92(s,2h),2.83(s,6h),2.54(s,3h)。
[0738]
实施例28:化合物46的合成
[0739][0740]
步骤1:在h2(15psi)气氛下,将a(300.0mg,1.06mmol,1.0eq)、pto2·
h2o(208.0mg,0.85mmol,0.8eq)在ch3oh/etoac(15ml/5ml)中的混合物于10℃搅拌10小时。将反应混合物
过滤,并将滤饼用etoac(20ml)洗涤。将合并的滤液浓缩,并将残余物通过prep-hplc纯化,得到b(100.0mg,33%),为淡黄色固体。lcms:286.1[m+h]
+
.
[0741]
步骤2:将b(20.0mg,0.07mmol,1.0eq)、c(30.0mg,0.14mmol,2.0eq)和cs2co3(68mg,0.21mmol,3.0eq)在ch3cn(5ml)中的混合物于13℃搅拌16小时。将反应混合物用水(20ml)稀释,并然后用浓hcl(水溶液)酸化直至ph=2,并于30℃搅拌15分钟。将该混合物用etoac(10ml x 2)萃取。将合并的有机相浓缩,并将残余物通过prep-tlc纯化,得到d(5.0mg,19%)。lcms:372.2[m+h]
+
.
[0742]
步骤3:将d(25.0mg,0.067mmol,1.0eq)和lioh
·
h2o(14.0mg,0.335mmol,5.0eq)在ch3cn/h2o/ch3oh(5.0ml/2.0ml/2.0ml)中的混合物于35℃搅拌16小时。将反应混合物用水(50ml)稀释,并用etoac(15ml x 2)萃取。将水相用1m hcl(水溶液)酸化直至ph=4~5,并用etoac(20ml x 3)萃取。将合并的有机层浓缩,得到化合物46(6.7mg,29%),为黄色固体。lcms:344.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ13.0(brs,1h),8.01-8.03(m,2h),7.52(s,1h),7.34-7.36(m,1h),7.11-7.13(m,1h),4.79(s,2h),3.67-3.76(m,1h),2.43(s,3h),1.47(d,j=6.8hz,6h)。
[0743]
实施例29:化合物47的合成
[0744][0745]
步骤1:在n2气氛下,将a(1.0g,3.1mmol,1.0eq)、b(1.4g,9.3mmol,3.0eq)、pd(pph3)2cl2(210.0mg,0.3mmol,0.1eq)和k2co3(1.3mg,9.3mmol,3.0eq)在thf/h2o(15ml/1.5ml)中的混合物于70℃搅拌16小时。将反应混合物浓缩,并将残余物通过prep-hplc纯化,得到c(600.0mg,68%),为黄色固体。1h nmr(400mhz,dmso-d6):δ10.25(s,1h),8.17(d,j=8.4hz,1h),8.09(d,j=8.0hz,1h),7.82(s,1h),7.32(d,j=8.8hz,1h),7.11-7.13(m,1h),5.69(s,1h),5.17(s,1h),2.45(s,3h),2.17(s,3h)。
[0746]
步骤2:将c(350.0mg,1.2mmol,1.0eq)、d(516.0mg,2.4mmol,2.0eq)和cs2co3(1.2g,3.6mmol,3.0eq)在ch3cn(20ml)中的混合物于35℃搅拌16小时。将另外的d(2.1g,9.6mmol,8.0eq)、cs2co3(2.4g,7.2mmol,6.0eq)和ch3cn(20ml)加入到该反应混合物中。将该混合物于35℃搅拌另外56小时。将反应混合物用浓hcl(水溶液)酸化直至ph=2,并然后于35℃搅拌15分钟。将该混合物用水(100ml)稀释,用etoac(50ml x 3)萃取。将合并的有机相浓缩,并将残余物通过prep-hplc纯化,得到e(100.0mg,23%)。lcms:370.1[m+h]
+
.
[0747]
步骤3:将e(100.0mg,0.27mmol,1.0eq)和lioh
·
h2o(57.0mg,1.35mmol,5.0eq)在thf/h2o(3.0ml/0.3ml)中的混合物于35℃搅拌16小时。将反应混合物用水(15ml)稀释,并
用etoac(5ml x 3)萃取。将水相用hcl水溶液(ph=4)酸化直至ph=5~6,并然后用etoac(10ml x 3)萃取。将合并的有机层浓缩,并将残余物通过prep-hplc纯化,得到化合物47(5.5mg,6%),为黄色固体。lcms:342.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ13.03(s,1h),8.24(d,j=8.4hz,1h),8.12(d,j=8.0hz,1h),7.46-7.48(m,2h),7.19(d,j=7.6hz,1h),5.56(s,1h),5.15-5.17(m,2h),5.07(s,1h),2.46(s,3h),2.18(s,3h)。
[0748]
实施例30:化合物50的合成
[0749][0750]
步骤1:在n2气氛下,将a(100.0mg,0.23mmol,1.0eq)、b(39.0mg,0.35mmol,3.0eq)、pd(pph3)4(12.0mg,0.01mmol,0.05eq)和na2co3(73.0mg,0.69mmol,3.0eq)在dmf(3.0ml)中的混合物于60℃搅拌过夜,过滤。将滤液浓缩,得到粗品c(63.0mg,65.0%),为褐色固体。lcms:425.2[m+h]
+
.
[0751]
步骤2:将c(63.0mg,0.15mmol,1.0eq)、lioh
·
h2o(32.0mg,0.75mmol,5.0eq)在etoh(3ml)和h2o(1ml)中的混合物于室温搅拌过夜。将该溶液用水(30ml)稀释,并用etoac(20ml x 2)萃取。将水层用2n hcl(水溶液)酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物50(53.0mg,90.0%),为黄色固体。lcms:397.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.18(d,j=8.4hz,1h),8.09(d,j=8.4hz,1h),8.02(s,1h),7.88(s,1h),7.60(d,j=8.4hz,1h),7.30(d,j=8.8hz,1h),7.18(d,j=3.2hz,1h),6.69(s,1h),4.78(s,2h),2.81(s,6h),
[0752]
实施例31:化合物51的合成
[0753][0754]
步骤1:在室温下,向a(2.0g,11.4mmol,1.0eq)和cs2co3(5.6g,17.1mmol,1.5eq)在dmf(30.0ml)中的混合物中加入异丙醇(685mg,11.4mmol,1.0eq)。将生成的混合物于40℃搅拌7小时,冷却至室温,用水稀释,用etoac(50ml x 2)萃取。将萃取物浓缩,并将残余物通过硅胶色谱法(pe)纯化,得到b(2.0g,81.3%)。
[0755]
步骤2:将b(2.0g,9.3mmol,1.0eq)、fe(2.6g,46.5mmol,5.0eq)和nh4cl(2.5g,
46.5mmol,5.0eq)在etoh(30ml)/水(6ml)中的混合物于90℃搅拌1小时,冷却至室温,过滤。将滤液用水稀释,用etoac(100ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe/etoac=100/1)纯化,得到c(1.6g,93.0%)。lcms:186.1[m+h]
+
.
[0756]
步骤3:在0℃下,向c(1.6g,8.65mmol,1.0eq)在dcm(100ml)中的混合物中加入br2(1.5g,9.51mmol,1.1eq)。将该混合物于0℃搅拌1小时,用饱和的na2co3水溶液和水洗涤。将有机层经na2so4干燥,过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=100/1)纯化,得到d(1.9g,83.7%)。lcms:264.0[m+h]
+
.
[0757]
步骤4:将d(1.9g,7.2mmol,1.0eq)、mei(5.1g,36.0mmol,5.0eq)和cs2co3(7.1g,21.6mmol,3.0eq)在dmf(30ml)中的混合物于90℃搅拌16小时,冷却至室温。将生成的混合物浓缩,并将残余物通过硅胶色谱法(pe/etoac=100/1)纯化,得到e(1.8g,85.7%)。
[0758]
步骤5:在氩气氛下,将f(1.12g,7.42mmol,1.2eq)、e(1.8g,6.19mmol,1eq)、乙酸钾(1.82g,18.57mmol,3.0eq)、铜粉(120.0mg,1.857mmol,0.3eq)和醋酸铜(340.0mg,1.857mmol,0.3eq)在2-戊醇(30.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(水溶液,200ml)。将生成的混合物通过硅藻土过滤。将滤液用浓hcl(水溶液)酸化至ph=2,然后用etoac(50ml x 2)萃取。将有机层浓缩。将残余物用pe(30ml)研磨并过滤,得到g(1.9g,84.8%)。lcms:363.1[m+h]
+
.
[0759]
步骤6:在氩气氛下,将g(1.9g)和伊顿试剂(20.0ml)的混合物于0℃搅拌3小时,然后冷却并倒入到冰水混合物中。将该混合物用etoac(100ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe/etoac=20/1)纯化,得到h(250.0mg,13.9%)。lcms:345.1[m+h]
+
.
[0760]
步骤7:在室温下,向h(100.0mg,0.29mmol,1.0eq)和cs2co3(283.0mg,0.87mmol,3.0eq)在ch3cn(10.0ml)中的混合物中加入碘代乙酸乙酯(125.0mg,0.58mmol,2.0eq)。然后在氩气氛下将该混合物于35℃搅拌4天。将生成的混合物用水稀释,用etoac(10ml x 2)萃取。将有机层浓缩,并将残余物通过prep-hplc纯化,得到i(25.0mg,20.0%)。lcms:431.2[m+h]
+
.
[0761]
步骤8:在氩气氛下,将i(25.0mg)和伊顿试剂(5.0ml)的混合物于35℃搅拌1天,然后冷却并倒入到冰水混合物中。将该混合物用etoac(100ml x 2)萃取。将有机层浓缩,得到j(15.0mg,66.0%)。lcms:389.1[m+h]
+
.
[0762]
步骤9:将j(20.0mg,0.052mmol,1.0eq)和lioh
·
h2o(9.0mg,0.21mmol,4.0eq)在thf/h2o(5ml/2ml)中的混合物于35℃搅拌20小时。将该混合物用水(10ml)稀释,用浓hcl(水溶液)酸化至ph=1,并然后用etoac(10ml x 2)萃取。将有机层浓缩,并将残余物通过反相快速柱色谱法纯化,得到化合物51(3.2mg,23.0%)。lcms:361.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ14.95(s,1h),8.14(d,j=8.4hz,1h),7.51(s,1h),7.24(d,j=8.0hz,1h),6.76(s,1h),4.88(s,2h),2.67(s,6h),2.45(s,3h)。
[0763]
实施例32:化合物52的合成
[0764]
[0765]
步骤1:在室温下,将异丁腈(474.0mg,6.9mmol,10.0eq)滴加到搅拌下的2m nahmds(1.8ml,3.5mmol,5.0eq)的甲苯(3ml)溶液。加入后,将该混合物搅拌10分钟,并然后在n2气氛下,在室温下加入到搅拌下的b(300.0mg,0.69mmol,1.0eq)、binap(52mg,0.069mmol,0.1eq)和pd(oac)2(15.3mg,0.069mmol,0.1eq)在甲苯(15ml)中的悬浮液。将反应混合物于50℃搅拌30分钟并浓缩。将残余物通过硅胶色谱法(pe至pe/etoac=10/1)纯化,得到a(127.0mg,43.6%)。lcms:426.2[m+h]
+
.
[0766]
步骤2:将a(163.0mg,0.38mmol,1.0eq)和lioh
·
h2o(322.2mg,7.7mmol,20.0eq)在thf(10ml)、etoh(30ml)和h2o(20ml)中的混合物于35℃搅拌20小时。将生成的混合物浓缩,用水(20ml)稀释,并用浓hcl(水溶液)酸化至ph《1。将沉淀物过滤收集,用水(10ml)洗涤并干燥,得到化合物52(156.0mg,91.6%),为黄色固体。lcms:398.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.94(brs,1h),8.24(d,j=8.4hz,1h),8.15(d,j=8.8hz,1h),7.72(s,1h),7.51(dd,j=8.0hz,1h),7.41(d,j=8.4hz,1h),4.91(s,2h),2.64(s,6h),1.78(s,6h)。
[0767]
实施例33:化合物55的合成
[0768][0769]
步骤1:向a(50.0mg,0.145mmol,1.0eq)的dmf(3ml)溶液中加入b(17.0mg,0.174mmol,1.2eq)、diea(57.0mg,0.435mmol,3.0eq)和hatu(66.0mg,0.174mmol,1.2eq)。将反应混合物于室温搅拌过夜,用冰水(5ml)稀释,并用etoac(10ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过prep-hplc纯化,得到化合物55(9.0mg,14.7%),为黄色固体。lcms:422.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.11(brs,1h),8.15-8.13(d,j=8.8hz,1h),8.11-8.09(d,j=8.0hz,1h),7.39-7.37(d,j=8.4hz,1h),7.34(s,1h),7.20-7.18(d,j=8.0hz,1h),4.87(s,2h),3.43(s,3h),3.34(s,3h),2.73(s,3h),2.48(s,3h)。
[0770]
实施例34:化合物56的合成
[0771][0772]
步骤1:在n2气氛下,将a(100.0mg,0.23mmol,1.0eq)、b(77mg,0.69mmol,3.0eq)、na2co3(49mg,0.46mmol,2eq)和pd(pph3)4(27.0mg,0.023mmol,0.1eq)在etoh/h2o(12ml/
2ml)中的混合物于90℃搅拌过夜。将该混合物冷却至室温,用水(15ml)稀释,用1n hcl(水溶液)酸化至ph=2-3,并用etoac(50ml x 2)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并蒸发。将残余物通过prep-hplc纯化,得到c(45.0mg,46%)。lcms:425.3[m+h]
+
.
[0773]
步骤2:将c(45.0mg,0.11mmol,1.0eq)和lioh
·
h2o(74.0mg,1.76mmol,16.0eq)在thf(5.0ml)和h2o(2.0ml)中的混合物于60℃搅拌过夜。将该混合物冷却至室温,用水(15ml)稀释,用1n hcl酸化至ph=3-4,用etoac(30ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并蒸发,得到e(40.0mg,95%),为黄色固体。lcms:397.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.81(brs,1h),8.44(s,1h),8.20(d,j=8.4hz,1h),8.16(d,j=8.8hz,1h),7.84(d,j=1.2hz,1h),7.75(s,1h),7.61(d,j=8.4hz,1h),7.39(d,j=8.8hz,1h),7.12(d,j=1.2hz,1h),5.01(s,2h),2.75(brs,6h)。
[0774]
步骤3:在n2气氛下,将e(54.0mg,0.14mmol,1.0eq)、d(16.0mg,0.17mmol,1.2eq)、hatu(65mg,0.17mmol,1.2eq)和diea(0.2ml)在dmf(3.0ml)中的混合物于室温搅拌过夜。将该混合物用水(10ml)稀释,用etoac(20ml x 2)萃取。将合并的有机层用盐水(15ml)洗涤,经无水na2so4干燥,过滤并蒸发。将残余物通过prep-hplc纯化,得到化合物56(7.8mg,12%),为黄色固体。lcms:474.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.40(s,1h),8.13-8.19(m,2h),7.84(s,1h),7.69(s,1h),7.62(d,j=8.4hz,1h),7.38(d,j=8.8hz,1h),7.07(s,1h),4.93(s,2h),3.25(s,3h),2.77(brs,6h)。
[0775]
实施例35:化合物57的合成
[0776][0777]
步骤1:向a(20.0mg,0.0517mmol,1.0eq)的dmf(3ml)溶液中加入b(6.0mg,0.0620mmol,1.2eq)、diea(20.0mg,0.1551mmol,3.0eq)和hatu(24.0mg,0.0620mmol,1.2eq)。将反应混合物于室温搅拌过夜,用冰水(5ml)稀释,并然后用etoac(10ml x 2)萃取。将合并的有机相用盐水洗涤,经无水na2so4干燥并过滤。将滤液浓缩。将残余物通过prep-hplc纯化,得到化合物57(1.5mg,6.3%),为黄色固体。lcms:464.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.12(d,j=3.2hz,1h),8.10(d,j=3.2hz,1h),7.66(s,1h),7.38(d,j=8.4hz,1h),7.30(d,j=8.4hz,1h),4.73(s,2h),2.79(s,3h),2.78(s,6h),1.33(s,9h)。
[0778]
实施例36:化合物58的合成
[0779][0780]
步骤1:将a(5.0g,23.1mmol,1.0eq)、b(7.8g,46.3mmol,2.0eq)、碳酸钾(12.8g,92.6mmol,4.0eq)、pd(pph3)4(1.3g,1.2mmol,0.05eq)的混合物溶于etoh/h2o(4/1,125ml)中。在氩气氛下,将反应混合物于90℃搅拌过夜,然后冷却至室温并浓缩。将残余物用h2o(50ml)稀释,用etoac(50ml x 3)洗涤。将水层用浓hcl(15.4ml)酸化至ph=1-2,并用etoac(50ml x 3)萃取。将有机层用盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到c(4.3g,大约100%)。lcms:178.1[m+h]
+
.
[0781]
步骤2:在h2气氛(1atm)下,将c(4.3g,24.3mmol,1.0eq)、10%pd/c(430mg,10%wt)在ch3oh(200ml)中的混合物于室温搅拌过夜,然后通过硅藻土过滤。将滤液浓缩,得到d(4.3g,大约100%)。lcms:180.1[m+h]
+
.
[0782]
步骤3:在氩气氛下,将d(3.0g,16.7mmol,1.0eq)、e(4.7g,16.7mmol,1.0eq)、乙酸钾(3.3g,33.4mmol,2.0eq)、铜粉(320.0mg,5.0mmol,0.3eq)和醋酸铜(911.8mg,5.0mmol,0.3eq)在2-戊醇(150.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(水溶液,200ml)。将生成的混合物通过硅藻土过滤。将滤液用浓hcl(水溶液)酸化至ph=2,用etoac(150ml x 3)萃取。将有机层浓缩,并将残余物通过硅胶柱色谱法(pe~pe/etoac=3:1,v/v)纯化,得到g(4.6g,82.7%)。lcms:333.1[m+h]
+
.
[0783]
步骤4:将f(3.0g,9.0mmol,1.0eq)的混合物溶于伊顿试剂(30.0ml)中,于70℃搅拌1小时,然后冷却并倒入到冰水混合物中,过滤。将滤饼用水洗涤。将获得的固体溶于thf/etoac(1/1,100ml)中,依次用饱和的nahco3水溶液和盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到d(2.7g,96.4%)。lcms:315.1[m+h]
+
.
[0784]
步骤5:在室温下,向d(1.0g,3.2mmol,1.0eq)和cs2co3(3.1g,9.6mmol,3.0eq)在ch3cn(100.0ml)中的混合物中加入碘代乙酸乙酯(1.4g,6.4mmol,2.0eq)。然后在氩气氛下将该混合物于50℃搅拌过夜。将生成的混合物用水稀释,用1n hcl(50ml)淬灭5分钟,用etoac(50ml x 3)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到e(1.1g,86.6%)。lcms:401.2[m+h]
+
.
[0785]
步骤6:将e(1.1g,2.7mmol,1.0eq)和lioh
·
h2o(567.0mg,13.5mmol,5.0eq)在thf/meoh/h2o(4:2:1,28ml)中的混合物于30℃搅拌3小时。将该混合物用水(50ml)稀释,用浓hcl酸化至ph=1,并用etoac(50mlx3)萃取。将有机层用盐水(50ml)洗涤并过滤。将滤液浓缩,并将残余物通过prep-hplc(cf3cooh)纯化,得到化合物58(356.0mg,30.2%)。lcms:373.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.92(brs,1h),8.12(d,j=8.8hz,2h),7.42(s,1h),7.34-7.25(m,2h),4.88(s,2h),3.08-3.04(m,1h),2.72(s,6h),1.27(d,j=6.8hz,6h)
[0786]
实施例37:化合物59的合成
[0787][0788]
步骤1:在n2气氛下,将a(7.90g,38.0mmol,1.2eq)、b(8.0g,32.0mmol,1.1eq)、cu(610.0mg,9.6mmol,0.3eq)、cu(oac)2(1.70g,9.6mmol,0.3eq)和koac(9.4g,96.0mmol,3.0eq)在2-戊醇(200ml)中的混合物于140℃搅拌过夜。将该混合物用1n hcl酸化至ph=3,过滤并用乙醇(50.0ml x 2)洗涤。将滤液浓缩。将残余物用acn研磨并过滤,得到c(4.20g,40%)。lcms:326.0[m+h]
+
.
[0789]
步骤2:在n2气氛下,将c(4.20g,12.9mmol,1.0eq)在伊顿试剂(50ml)中的混合物于70℃搅拌3小时。将该混合物倒入到冰水(200ml)中。将沉淀物通过过滤收集并干燥,得到d(4.0g,》99%),为黄色固体。lcms:307.9[m+h]
+
.
[0790]
步骤3:在n2气氛下,将d(400.0mg,1.3mmol,1.0eq)、e(350.0mg,2.6mmol,2.0eq)、pd(pph3)4(150.0mg,0.13mmol,0.1eq)和k2co3(540.0g,3.9mmol,3.0eq)在1,4-二噁烷/h2o(20.0ml/4ml)中的混合物于90℃搅拌过夜。将该混合物蒸发。将残余物通过硅胶色谱法(pe/etoac=5/1)纯化,得到f(200.0mg,47%),为黄色固体。lcms:320.9[m+h]
+
.
[0791]
步骤4:在n2气氛下,将f(200.0mg,0.62mmol,1.0eq)、g(270.0mg,1.2mmol,2.0eq)和cs2co3(580.0mg,1.8mmol,3.0eq)在acn(20.0ml)中的混合物于50℃搅拌过夜。将该混合物用1n hcl(水溶液)酸化至ph=3,并加入h2o(20ml),用etoac(50ml x 2)萃取。将萃取物用盐水洗涤。将有机层蒸发。将残余物通过prep-hplc纯化,得到h(70.0mg,27%),为黄色固体。lcms:306.1[m+h]
+
.
[0792]
步骤5:在n2气氛下,将h(70.0mg,0.17mmol,1.0eq)和lioh
·
h2o(70.0mg,1.7mmol,10.0eq)在thf/h2o(10ml/2ml)中的混合物于室温搅拌过夜。加入h2o(20ml),将该混合物用1n hcl(水溶液)酸化至ph=3。将沉淀物过滤收集,用水洗涤并干燥,得到化合物59(35.0mg,50%),为黄色固体。lcms:378.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.75(brs,1h),8.37(d,j=8.4hz,1h),8.25(d,j=6.4hz,1h),7.73(t,j=8.4hz,1h),7.60(d,j=8.4hz,1h),7.52(d,j=8.8hz,1h),7.42(s,2h),7.35(t,j=7.2hz,2h),7.22(d,j=7.6hz,1h),4.62(s,2h),1.98(s,3h)。
[0793]
实施例38:化合物60的合成
[0794][0795]
步骤1:向a(150.0mg,0.91mmol,1.0eq)和cs2co3(593.0mg,1.82mmol,2.0eq)在acn(20ml)中的混合物中加入b(188.0mg,1.37mmol,1.5eq)。将该混合物于40℃搅拌过夜。将生
成的混合物用水(30ml)稀释,用etoac(25ml x 2)萃取。将合并的有机层用盐水(25ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到c(80.0mg,26.5%),为黄色固体。lcms:334.1[m+h]
+
.
[0796]
步骤2:向c(80.0mg,0.24mmol,1.0eq)和cs2co3(235.0mg,0.72mmol,3.0eq)在acn(10ml)中的混合物中加入d(103.0mg,0.48mmol,2.0eq)。将该混合物于50℃搅拌过夜。将生成的混合物用水(20ml)稀释,用etoac(20ml x 2)萃取。将合并的有机层用盐水(20ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到e(58.0mg,57.6%),为黄色固体。lcms:420.1[m+h]
+
.
[0797]
步骤3:将e(58.0mg,0.14mmol,1.0eq)、lioh
·
h2o(23.0mg,0.55mmol,4.0eq)在thf(10ml)和h2o(2ml)中的混合物于室温搅拌过夜。将水层用2n hcl酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物60(42.0mg,77.8%),为黄色固体。lcms:392.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.59(brs,1h),7.92(d,j=8.4hz,1h),7.75(d,j=8.0hz,1h),7.45-7.48(m,2h),7.35(t,j=8.0hz,1h),5.32(s,2h),4.32(t,j=4.0hz,2h),3.88(s,3h),3.81(t,j=4.0hz,2h),3.39(s,3h)
[0798]
实施例39:化合物61的合成
[0799][0800]
步骤1:向a(500.0mg,2.7mmol,1.0eq)的thf(10ml)溶液中加入nah(270.0mg,6.75mmol,2.5eq)和异丙醇(245.0mg,4.05mmol,1.5eq)。将该混合物于室温搅拌过夜。将该混合物用水(30ml)稀释,用etoac(30ml x2)萃取。将合并的有机层用盐水(30x2ml)洗涤,经无水na2so4干燥并浓缩。将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到b(550.0mg,90.4%)。lcms:226.1[m+h]
+
.
[0801]
步骤2:在h2下,将b(550.0mg,2.4mmol)和兰尼镍(200.0mg)在meoh/nh3.h2o(5/1ml)中的混合物于室温搅拌2小时。将该混合物过滤并用水(30ml)稀释,用etoac(30ml x 2)萃取。将合并的有机层用水(30ml)、盐水(30ml)洗涤,经无水na2so4干燥并浓缩,得到c(450.0mg,94.5%)。lcms:196.1[m+h]
+
.
[0802]
步骤3:在氮气氛下,将c(450.0mg,2.31mmol,1.0eq)、d(800.0mg,3.0mmol,1.3eq)、乙酸钾(670.0mg,6.93mmol,3.0eq)、醋酸铜(130.0mg,0.693mmol,0.3eq)和铜粉(45.0mg,0.693mmol,0.3eq)在2-戊醇(20ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入水(30ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl(水溶液)酸化至ph=2,然后加入另外的水(50ml)。将生成的混合物用etoac(50.0ml x 2)萃取。将合并的有机层用盐水(50ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品,将其通过用pe
(20ml)研磨纯化,得到e(650.0mg,84.0%)。lcms:336.1[m+h]
+
.
[0803]
步骤4:将e(650.0mg)和伊顿试剂(10ml)的混合物于70℃加热1小时,然后冷却并倒入到冰水混合物中。将该固体过滤收集并干燥,得到粗品f(500.0mg,94.0%)。lcms:276.0[m+h]
+
[0804]
步骤5:向f(250.0mg,0.91mmol,1.0eq)和cs2co3(593.0mg,1.82mmol,2.0eq)在acn(20ml)中的混合物中加入g(284.0mg,1.37mmol,1.5eq)。将该混合物于40℃搅拌过夜。将生成的混合物用水(30ml)稀释,用etoac(25ml x 2)萃取。将合并的有机层用盐水(25ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到h(80.0mg,产率:21.9%)。lcms:404.1[m+h]
+
.
[0805]
步骤6:向h(80.0mg,0.20mmol,1.0eq)和cs2co3(195.0mg,0.60mmol,3.0eq)在acn(10ml)中的混合物中加入i(85.0mg,0.40mmol,2.0eq)。将该混合物于50℃搅拌过夜。将生成的混合物用hcl(水溶液,20ml,2n)稀释。将该混合物于室温搅拌0.5小时,然后用etoac(20ml x 2)萃取。将合并的有机层用盐水(20ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到j(54.0mg,产率:67.2%)。lcms:406.1[m+h]
+
.
[0806]
步骤7:将j(54.0mg,0.133mmol,1.0eq)、lioh
·
h2o(23.0mg,0.533mmol,4.0eq)在thf(10ml)和h2o(2ml)中的混合物于室温搅拌过夜。将水层用2n hcl酸化至ph=3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物61(35.4mg,70.4%),为黄色固体。lcms:378.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ7.92(d,j=8.4hz,1h),7.75(d,j=8.0hz,1h),7.44(t,j=7.2hz,2h),7.33(t,j=8.0hz,1h),5.33(s,2h),4.20(t,j=4.8hz,2h),3.85-3.88(m,5h)
[0807]
实施例40:化合物62的合成
[0808][0809]
步骤1:在氩气氛下,将a(340mg,2.47mmol,1.0eq)、b(1.0g,3.70mmol,1.5eq)、碳酸钾(1.03g,7.41mmol,3.0eq)、碘化亚铜(141.0mg,0.74mmol,0.3eq)和l-脯氨酸(85.0mg,
0.74mmol,0.3eq)在2-戊醇(30.0ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入水(50.0ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl酸化至ph=2,然后加入水(50.0ml)。将生成的混合物用etoac(50.0ml x 3)萃取。将合并的有机层用盐水(20.0ml x 5)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到c(粗品,600mg,74.5%)。lc/ms:326.0[m+h]
+
.
[0810]
步骤2:将c(600mg,1.84mmol)、硫酸(15.0ml)和h2o(2.0ml)的混合物于100℃加热2小时,然后冷却并倒入到冰和水的混合物(50.0ml)中,将该固体过滤收集并真空干燥,得到d(粗品,500mg,88.4%)。lc/ms:307.9[m+h]
+
.
[0811]
步骤3:在n2气氛下,将d(400.0mg,1.3mmol,1.0eq)、e(330.0mg,2.6mmol,2.0eq)、pd(pph3)4(150.0mg,0.13mmol,0.1eq)和k2co3(540.0mg,3.9mmol,3.0eq)在1,4-二噁烷/h2o(20.0ml/4.0ml)中的混合物于90℃搅拌过夜。将反应混合物浓缩。将残余物通过硅胶色谱法(pe/etoac=5/1)纯化,得到f(230.0mg,54%),为黄色固体。lcms:312.0[m+h]
+
.
[0812]
步骤4:在n2气氛下,将f(200.0mg,0.65mmol,1.0eq)、g(280.0mg,1.3mmol,2.0eq)和cs2co3(650.0mg,2.0mmol,3.0eq)在acn(20.0ml)中的混合物于50℃搅拌过夜。将该混合物用1n hcl(水溶液)酸化至ph=3,用h2o(50ml)稀释,用etoac(50ml x 2)萃取。将萃取物用盐水洗涤。将有机层蒸发,并将残余物通过prep-hplc纯化,得到h(80.0mg,31%),为黄色固体。lcms:398.1[m+h]
+
.
[0813]
步骤5:在n2气氛下,将h(80.0mg,0.2mmol,1.0eq)和lioh
·
h2o(80.0mg,2.0mmol,10.0eq)在thf/h2o(10.0ml/2.0ml)中的混合物于室温搅拌过夜。加入h2o(20ml)。将该混合物用1n hcl(水溶液)酸化至ph=3。将沉淀物过滤收集并干燥,得到化合物62(37.6mg,14%),为黄色固体。lcms:370.1[m+h]
+
,1h nmr(400mhz,dmso-d6):δ12.90(brs,1h),8.32(d,j=8.4hz,1h),8.22(d,j=7.2hz,1h),7.91(d,j=3.6hz,1h),7.73(d,j=7.2hz,1h),7.61(d,j=8.8hz,2h),7.37-7.28(m,3h),4.66(s,2h)。
[0814]
实施例41:化合物63的合成
[0815][0816]
步骤1:向乙醇(15.8g,342mmol,3.0eq)、nah(60%)(16g,399mmol,3.5eq)在thf(150ml)中的混合物中缓慢地加入a(20g,114mmol,1.0eq)的thf(50ml)溶液以保持反应温度低于10℃。加入后,将该混合物在室温下搅拌2小时。加入水(300ml),并将生成的混合物用etoac(150.0ml x 2)萃取。将合并的有机层用盐水(150.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品b,为黄色油状物(30g,大约100%)。
[0817]
步骤2:将b(30g,114mmol,1.0eq)、nh4cl(6.1g,114mmol,1.0eq)在乙醇(210ml)和水(90ml)中的混合物加热回流,并分批加入fe(19g,342mmol,3.0eq)。加入后,将该混合物在回流下搅拌2小时,并然后冷却至室温。将该混合物通过硅藻土过滤。将水(400ml)加入到该滤液中。将生成的混合物用etoac(200ml x 2)萃取。将合并的有机层用盐水(200ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品c,为黄色油状物(26g,大约100%)。lc/ms:172.1[m+h]
+
.
[0818]
步骤3:在氮气氛下,将c(3.0g,17.5mmol,1.0eq)、d(4.3g,17.5mmol,1.0eq)、乙酸钾(3.5g,35.0mmol,2.0eq)、醋酸铜(0.96g,5.3mmol,0.3eq)和铜粉(0.34g,5.3mmol,0.3eq)在2-戊醇(50.0ml)中的混合物于120℃搅拌过夜。然后将反应混合物冷却至室温,并加入水(30.0ml)。将该混合物通过硅藻土过滤。将滤液用2n hcl酸化至ph=2,并加入水(50.0ml)。将生成的混合物用etoac(50.0ml x 2)萃取。将合并的有机层用盐水(50.0ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到粗品。将该粗品通过用pe(20ml)研磨纯化,得到e(3.7g,60%)。lc/ms:292.2[m+h]
+
.
[0819]
步骤4:将e(2.7g,9.3mmol)和浓h2so4(27ml)的混合物于80℃加热30分钟,然后冷却并倒入到冰水混合物中。将该固体过滤收集并干燥,得到粗品。将该粗品用etoac(10ml)研磨并过滤,得到f(1.4g,55%)。1h nmr(400mhz,dmso-d6):δ11.29(s,1h),10.51(s,1h),
8.21(d,j=7.6hz,1h),7.98(d,j=8.4hz,1h),7.76-7.69(m,2h),7.27(t,j=7.6hz,1h),7.21(d,j=8.8hz,1h)。lc/ms:246.1[m+h]
+
.
[0820]
步骤5:在室温下,向f(520.0mg,2.0mmol,1.0eq)和k2co3(522.0mg,4.0mmol,2.0eq)在dmf(20.0ml)中的混合物中加入g(471.0mg,3.0mol,1.5eq),然后于室温搅拌过夜。将反应混合物用etoac(20ml)稀释,并用盐水(15ml x 3)洗涤。将有机相经无水na2so4干燥,并然后过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到h(450.0mg,62%)。
[0821]
步骤6:向h(450.0mg,1.23mmol,1.0eq)和cs2co3(1.21g,3.7mmol,3.0eq)在dmf(8.0ml)中的混合物中加入i(529.0mg,2.47mmol,2.0eq)。将该混合物于50℃搅拌5小时,用etoac(30ml)稀释,并用h2o(20ml x 3)洗涤。将有机相经无水na2so4干燥,并然后过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到j(388.0mg,70.0%)。lcms:452.3[m+h]
+
.
[0822]
步骤7:将j(180.0mg,0.4mmol,1.0eq)和pd/c(36mg,0.2eq)在meoh(5.0ml)和thf(5.0ml)中的混合物于室温搅拌1小时。将该混合物过滤并真空浓缩,通过硅胶色谱法(pe/etoac=2/1)纯化,得到化合物63(65.0mg,80.0%)。lcms:302.0[m-h]
+1
h nmr(400mhz,dmso-d6):δ8.36(d,j=7.6hz,1h),8.03(d,j=8.8hz,1h),7.91(t,j=7.2hz,1h),7.82(d,j=8.8hz,1h),7.42-7.49(m,2h),5.19(s,2h)。
[0823]
实施例42:化合物64的合成
[0824][0825]
步骤1:向a(2.0g,11.4mmol,1.0eq)和et3n(2.3g,22.8mmol,2.0eq)在thf(40ml)中的混合物中加入b(1.62g,22.8mmol,2.0eq)。将反应混合物于60℃搅拌过夜,冷却至室温,用水(100ml)稀释,并用dcm(50ml x 2)萃取。将萃取物用水(20ml x 2)洗涤。将有机层经无水na2so4干燥,过滤。将滤液浓缩,得到c(2.47g,95.5%)。lcms:227.1[m+h]
+
.
[0826]
步骤2:将c(2.47g,1.09mmol,1.0eq)和兰尼镍(100mg)在etoh(80ml)中的混合物于室温搅拌过夜。将反应混合物过滤。将滤液浓缩,得到d(2.04g,95.1%)。lcms:197.3[m+h]
+
.
[0827]
步骤3:在氩气氛下,将d(2.04g,10.4mmol,1.0eq)、e(2.73g,10.4mmol,1eq)、乙酸钾(3.06g,31.2mmol,3.0eq)、铜粉(200mg,3.12mmol,0.3eq)和醋酸铜(624mg,3.12mmol,0.3eq)在2-戊醇(40ml)中的混合物于140℃搅拌过夜,然后冷却至室温。将反应混合物倒入到水(100ml)中,用浓hcl(水溶液)酸化至ph=4,并用etoac(50ml x 3)萃取。将合并的有机层浓缩,并通过硅胶色谱法(pe/etoac=5/1)纯化,得到f(1.27g,36.6%)。lcms:331.1[m+h]
+
.
[0828]
步骤4:将f(500.0mg,1.52mmol,1.0eq)和伊顿试剂(10ml)的混合物于室温搅拌90
分钟,然后倒入到冰和水的混合物中。将该混合物用etoac(40ml x 2)萃取。将合并的有机层浓缩,并将残余物通过硅胶色谱法(pe/etoac=10/1)纯化,得到g(244.0mg,51.6%)。lcms:313.1[m+h]
+
.
[0829]
步骤5:在室温下,向g(244mg,0.782mmol,1.0eq)和cs2co3(765mg,2.346mmol,3.0eq)在ch3cn(15ml)中的混合物中加入h(502mg,2.346mmol,3.0eq)。将该混合物于室温搅拌过夜。将生成的混合物用水(45ml)稀释,用etoac(30mlx2)萃取。将合并的有机层浓缩,并将残余物通过prep-hplc纯化,得到i(145.0mg,46.6%)。lcms:399.1[m+h]
+
.
[0830]
步骤6:将i(135mg,0.34mmol,1.0eq)和lioh
·
h2o(72mg,1.7mmol,5.0eq)在thf/h2o(15ml/15ml)中的混合物于室温搅拌过夜。将该混合物用水(40ml)稀释,用浓hcl(水溶液)酸化至ph=5,用etoac(30mlx2)萃取。将合并的有机层浓缩,并将残余物通过prep-tlc纯化,得到化合物64(94.1mg,74.8%),为黄色固体。纯度:98.2%.1h nmr(400mhz,dmso-d6):δ12.83(brs,1h),8.15(d,j=8.8hz,1h),8.10(d,j=8.0hz,1h),7.44(d,j=8.8hz,1h),7.36(s,1h),7.18(d,j=8.0hz,1h),4.83(s,2h),3.11(s,4h),2.48(s,3h),1.98(s,4h)。lcms:371.3[m+h]
+
.
[0831]
实施例43:化合物67的合成
[0832][0833]
步骤1:在氩气氛下,将a(3.4g,31.7mmol,1.1eq)、b(5.3g,28.8mmol,1.0eq)、乙酸钾(3.9g,57.6mmol,2.0eq)、铜粉(378.8mg,8.6mmol,0.3eq)和醋酸铜(1.1g,8.6mmol,0.3eq)在2-戊醇(100ml)中的混合物于140℃搅拌过夜,然后冷却至室温。加入2n naoh(水溶液,200.0ml)。将生成的混合物通过硅藻土过滤。将滤液用浓hcl(水溶液)酸化至ph=2,用etoac(100ml x 3)萃取。将有机层浓缩,并将残余物通过硅胶柱色谱法(pe~pe/etoac=3:1,v/v)纯化,得到g(2.0g,33.9%)。lcms:296.0[m+h]
+
.
[0834]
步骤2:将c(2.0g)的混合物溶于伊顿试剂(20.0ml)中,于70℃搅拌1小时,然后冷却并倒入到冰水混合物中,过滤。将滤饼用水洗涤。将获得的固体溶于thf/etoac(1/1,100ml)中,依次用饱和的nahco3溶液和盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到d(1.8g,95.7%)。lcms:278.0[m+h]
+
.
[0835]
步骤3:在室温下,向d(1.8g,6.5mmol,1.0eq)和cs2co3(6.4g,19.5mmol,3.0eq)在ch3cn(100.0ml)中的混合物中加入碘代乙酸乙酯(2.8g,13.0mmol,2.0eq)。在氩气氛下,将该混合物于50℃搅拌过夜,用水稀释,通过1nhcl(水溶液,50ml)淬灭5分钟,用etoac(50ml x 3)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到e(2.4g,大约100%)。lcms:364.1[m+h]
+
.
[0836]
步骤4:将e(2.4g,6.5mmol,1.0eq)和lioh
·
h2o(1.4g,32.5mmol,5.0eq)在thf/meoh/h2o(4/2/1,50ml)中的混合物于25℃搅拌20小时。将该混合物用水(50ml)稀释,用浓hcl(水溶液)酸化至ph=1,用etoac(50mlx3)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到化合物67(1.9g,86.4%)。lcms:336.0[m+h]
+
.1h nmr(400mhz,dmso-d6):δ13.21(brs,1h),8.32-8.28(m,1h),8.06(d,j=8.8hz,1h),7.50-7.47(m,2h),7.27-7.22(m,1h),5.11(s,2h),3.78(s,3h),
[0837]
实施例44:化合物68的合成
[0838][0839]
步骤1:将化合物67(150mg,0.45mmol,1.0eq)、b(9.0ml,17.9mmol,40.0eq)的混合物溶于thf(10.0ml)中,并在密封管中将反应混合物于120℃搅拌2天,然后冷却至室温,浓缩。将残余物通过prep-hplc(nh3·
h2o)纯化,得到化合物68(16.3mg,10.1%)。lcms:361.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ13.14(brs,1h),8.00-7.94(m,2h),7.36(d,j=8.8hz,1h),6.89(s,1h),6.64(d,j=8.8hz,1h),6.30(s,1h),4.98(s,2h),3.74(s,3h),3.18(s,2h),1.21(t,j=6.8hz,3h)
[0840]
实施例45:化合物69的合成
[0841][0842]
步骤1:在n2气氛下,将a(50.0mg,0.11mmol,1.0eq)、b(76.0mg,0.33mmol,3.0eq)、pd(dppf)cl2(8.0mg,0.011mmol,0.1eq)和k2co3(46.0mg,0.33mmol,3.0eq)在二噁烷/h2o(3ml/0.5ml)中的混合物于70℃搅拌16小时。将反应混合物通过硅藻土和硅胶过滤,并将滤饼用etoac(15ml)洗涤。将滤液浓缩,并将残余物通过prep-tlc(etoac)纯化,得到c(80.0mg,》99%),为黄色固体。lcms:452.3[m+h]
+
.
[0843]
步骤2:将c(80.0mg,0.18mmol,1.0eq)和lioh
·
h2o(74.0mg,1.80mmol,10.0eq)在ch3cn/h2o/etoh(3.0ml/0.5ml/3.0ml)中的混合物于50℃搅拌3小时,然后在环境温度(约10℃)下再搅拌另外16小时。将反应混合物用水(50ml)稀释,并用etoac(10ml)萃取。将水相用1n hcl(水溶液)酸化直至ph=3~4,然后用etoac(20ml x 3)萃取。将合并的有机层浓缩,得到化合物69(21.9mg,29%),为黄色固体。lcms:424.3[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.87(brs,1h),11.80(brs,1h),8.27(d,j=8.0hz,1h),8.16(d,j=8.8hz,1h),7.80(s,1h),7.62(d,j=8.0hz,1h),7.54(d,j=6.8hz,1h),7.42(d,j=8.8hz,1h),6.80(s,1h),6.61(d,j=6.0hz,1h),5.03(s,2h),2.74(s,6h)。
[0844]
实施例46:化合物70的合成
[0845][0846]
步骤1:将a(1.0g,2.28mmol,1.0eq)、乙酸钾(671mg,6.84mmol,3.0eq)、pd(dppf)cl2(83.4mg,0.11mmol,0.05eq)和双(频哪醇合)二硼(1.74g,6.84mmol,3.0eq)在二噁烷(30ml)中的非均相溶液加热至100℃持续5小时。将粗的混合物浓缩到硅胶上,并通过快速柱色谱法(etoac的己烷溶液)分离,得到b(920mg,84%)。lcms:485.1[m+h]
+
.
[0847]
步骤2:向b(920mg,1.90mmol,1.0eq)在丙酮(30.0ml)和水(15.0ml)中的溶液中加入高碘酸钠(1.22g,5.69mmol,3.0eq)和乙酸铵(293mg,3.80mmol,2.0eq)。将该混合物搅拌过夜。加入浓hcl水溶液(3.0ml)。将有机层真空除去,并将该溶液进一步用etoac萃取。将有机层用盐水洗涤,并过滤。真空除去溶剂,得到c(377mg,49%),将其无需进一步纯化即可使用。lcms:403.1[m+h]
+
.
[0848]
步骤3:向c(30mg,0.075mmol,1.0eq)的二噁烷/h2o(5/1ml)溶液中加入d(23.0mg,0.12mmol,1.5eq)、k2co3(26.0mg,0.19mmol,2.5eq)和pd(dppf)cl2(6.0mg,0.0075mmol,0.1eq)。在n2气氛下,将该混合物于70℃搅拌过夜。将该混合物用水(20ml)稀释,并用etoac(20ml x 2)萃取。将合并的有机层用水(15ml)和盐水(15ml)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过硅胶色谱法(pe/etoac=20/1)纯化,得到e(13.0mg,39.9%)。lcms:437.1[m+h]
+
.
[0849]
步骤4:将e(13.0mg,0.03mmol,1.0eq)、lioh
·
h2o(13.0mg,0.3mmol,10.0eq)在thf/h2o(5/2ml)中的混合物于40℃搅拌过夜。将该混合物用2n hcl(水溶液)酸化至ph=2-3,并用etoac(15ml x 2)萃取。将合并的有机层用盐水(10ml x 2)洗涤,经无水na2so4干燥并过滤。将滤液真空浓缩,得到化合物70(10.0mg,83.0%),为黄色固体。lcms:409.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ9.46(s,1h),8.84(t,j=1.6hz,1h),8.74(d,j=2.4hz,1h),8.35(d,j=7.6hz,2h),8.19(d,j=8.8hz,1h),8.10(d,j=8.4hz,1h),7.43(d,j=8.8hz,1h),5.01(s,2h),2.75(s,6h)。
[0850]
实施例47:化合物71的合成
[0851][0852]
步骤1:在氩气氛下,将a(50.0mg,0.11mmol,1.0eq)、pd(pph3)2cl2(5.0mg,0.007mmol,0.06eq)和b(72.0mg,0.19mmol,1.7eq)在二噁烷(5.0ml)中的混合物于100℃搅拌5小时。将生成的混合物浓缩,得到粗品c(粗品,20%纯度)。lcms:437.2[m+h]
+
.
[0853]
步骤2:将c(粗品,20%纯度)和lioh
·
h2o(96.0mg,2.2mmol,20.0eq)在etoh(6.0ml)和h2o(2.0ml)中的混合物于40℃搅拌20小时。将该混合物用2n naoh(水溶液,10.0ml)稀释,用etoac(30ml)萃取。将水层用浓hcl(水溶液)酸化至ph《1,用etoac(30ml x 2)萃取。将有机层浓缩,并将残余物通过反相快速柱色谱法(0%mecn至50%mecn的水溶液,0.1%cf3cooh)纯化,得到化合物71(3.0mg,6.4%)。lcms:409.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ9.80(s,1h),9.40(d,j=5.2hz,1h),8.35(d,j=8.4hz,1h),8.16-8.19(m,2h),8.07(s,1h),7.82(d,j=8.0hz,1h),7.43(d,j=8.4hz,1h),5.07(s,2h),2.75(s,6h)。
[0854]
实施例48:化合物75的合成
[0855][0856]
步骤1:在氮气氛下,将a(50mg,0.106mmol,1.0eq)、b(34mg,0.265mmol,2.5eq)、pd2(dba)3(10mg,0.011mmol,0.1eq)、x-phos(6.2mg,0.011mmol,0.1eq)和cs2co3(104mg,0.318mmol,3.0eq)在甲苯(4ml)中的混合物于80℃搅拌过夜。将反应混合物冷却至室温,倒入到40ml水中,并用etoac(20ml x 3)萃取。将合并的有机层用盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过硅胶柱色谱法(etoac/pe=1/6)纯化,得到c(48.8mg,88.4%)。lcms:520.3[m+h]
+
.
[0857]
步骤2:将c(48.8mg,0.094mmol,1.0eq)和lioh
·
h2o(60mg,1.41mmol,15.0eq)在thf/h2o/etoh(5ml/5ml/1ml)中的混合物于40℃搅拌过夜。将反应混合物减压浓缩以除去thf和etoh,加入5ml的水,用1n hcl(水溶液)酸化至ph=6并过滤。将该固体通过prep-tlc(dcm/meoh=9:1)纯化,得到化合物75(31.1mg,67.4%),为黄色固体。lcms:492.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.87(brs,1h),8.20(s,1h),8.10-8.08(m,2h),7.50-7.43(m,1h),7.34(d,j=8.4hz,1h),7.29-7.25(m,2h),6.34(s,1h),4.50(s,2h),2.67(s,6h)。
[0858]
实施例49:化合物78的合成
[0859][0860]
步骤1:在氮气下,将a(50mg,0.114mmol,1.0eq)、b(30mg,0.274mmol,2.4eq)、pd2(dba)3(10.5mg,0.011mmol,0.1eq)、xantphos(6.6mg,0.011mmol,0.1eq)和cs2co3(111mg,0.342mmol,3.0eq)在甲苯(4ml)中的混合物于80℃搅拌过夜,将反应混合物冷却至室温,倒入到40ml水中,并用etoac(20ml x 3)萃取。将合并的有机层用盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过硅胶柱色谱法(etoac/pe=1/6)纯化,得到c(36.6mg,68.8%)。lcms:468.3[m+h]
+
.
[0861]
步骤2:将c(36.6mg,0.078mmol,1.0eq)和lioh
·
h2o(49mg,1.18mmol,15.0eq)在thf/h2o/etoh(5ml/5ml/1ml)中的混合物于40℃搅拌过夜。将反应混合物减压浓缩以除去thf和etoh,然后加入5ml的水,用1n hcl(水溶液)酸化至ph=6。将该固体过滤收集,并通过
prep-tlc(dcm/meoh=8/1)纯化,得到化合物78(22.4mg,65%),为黄色固体。lcms:440.3[m+h]
+
.1h nmr(400mhz,dmso-d6):8.85(s,1h),8.10(d,j=8.4hz,1h),8.02(d,j=8.8hz,1h),7.51-7.47(m,1h),7.34-7.28(m,2h),7.22-7.14(m,2h),6.94(s,1h),6.90(d,j=8.8hz,1h),4.70(s,2h),2.70(s,6h)。
[0862]
实施例50:化合物80的合成
[0863][0864]
步骤1:在n2气氛下,将a(100.0mg,0.23mmol,1.0eq)、b(26.0mg,0.28mmol,1.2eq)、pd2(dba)3(21.0mg,0.023mmol,0.1eq)、xantphos(13.0mg,0.023mmol,0.1eq)和cs2co3(150.0mg,0.46mmol,2.0eq)在甲苯(8.0ml)中的混合物于110℃搅拌过夜。将反应混合物冷却至室温,用水(20ml)稀释,用etoac(25ml)萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并蒸发。将残余物通过prep-hplc纯化,得到c(60.0mg,58%),为黄色固体。lcms:451.1[m+h]
+
.
[0865]
步骤2:将c(60.0mg,0.13mmol,1.0eq)和lioh
·
h2o(44.0mg,1.0mmol,8.0eq)在meoh/h2o(5.0ml/2.0ml)中的混合物于40℃搅拌过夜,并然后用水(15ml)稀释,用1n hcl(水溶液)酸化至ph=5-6。将该固体过滤收集并干燥,得到化合物80(33.9mg,60%),为黄色固体。lcms:423.3[m+h]
+
,1h nmr(400mhz,dmso-d6):δ12.88(brs,1h),9.27(s,1h),8.53(d,j=2.0hz,1h),8.24(d,j=4.4hz,1h),8.13-8.07(m,2h),7.75(d,j=8.0hz,1h),7.33-7.10(m,2h),7.07-7.03(m,2h),4.76(s,2h),2.71(s,6h)ppm.
[0866]
实施例51:化合物81的合成
[0867][0868]
步骤1:在n2气氛下,将a(50.0mg,0.11mmol,1.0eq)、b(31.0mg,0.33mmol,3.0eq)、pd2(dba)3(9.0mg,0.01mmol,0.1eq)、xantphos(6.0mg,0.01mmol,0.1eq)和t-buok(37.0mg,0.33mmol,3.0eq)在1,4-二噁烷(5.0ml)中的混合物于110℃搅拌过夜。将反应混合物蒸发。将残余物通过prep-hplc纯化,得到c(10.0mg,19%),为黄色油状物。lcms:451.1[m+h]
+
.
[0869]
步骤2:在n2气氛下,将c(10.0mg,0.02mmol,1.0eq)和lioh
·
h2o(4.0mg,0.1mmol,5.0eq)在etoh/h2o(5.0ml/1.0ml)中的混合物于40℃搅拌过夜。将残余物浓缩,并加入h2o(5ml),将该混合物用1n hcl(水溶液)酸化至ph=3。将残余物过滤,得到化合物81(5.5mg,58%),为黄色固体。lcms:423.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ9.51(s,1h),8.27(s,2h),8.11-8.08(m,2h),7.45(s,1h),7.28(d,j=8.0hz,1h),7.14(s,2h),7.08(d,j=8.0hz,1h),4.68(s,2h),2.77(s,6h)。
[0870]
实施例52:化合物84的合成
[0871][0872]
步骤1:在n2气氛下,在室温下,将nahmds的thf(2m,5.0ml,10.0mmol,7.1eq)溶液加入到搅拌下的b(3.0ml,40.7mmol,29.1eq)、a(500.0mg,1.4mmol,1.0eq)、binap(89.3mg,0.14mmol,0.1eq)、cui(133.7mg,0.7mmol,0.5eq)和pd(oac)2(32.2mg,0.14mmol,0.1eq)的甲苯(30ml)溶液中。将生成的混合物于100℃搅拌15小时并浓缩。将残余物通过硅胶色谱法(pe至pe/etoac/thf=1/1/1)纯化,得到c(242.0mg,50.1%)。lcms:338.1[m+h]
+
.
[0873]
步骤2:在室温下,向c(242.0mg,0.72mmol,1.0eq)和cs2co3(702.0mg,2.2mmol,3.0eq)在mecn(50.0ml)中的混合物中加入碘代乙酸乙酯(714.0mg,2.9mmol,4.0eq)。然后将该混合物于35℃搅拌过夜,冷却至室温。将生成的混合物用水(20ml)稀释,用etoac(50ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe至pe/etoac=4/1)纯化,得到e(121.0mg,59%纯度,23.6%)。lcms:424.2[m+h]
+
.
[0874]
步骤3:将e(121.0mg,59%纯度,0.17mmol,1.0eq)和lioh
·
h2o(175.0mg,4.2mmol,24.5eq)在thf(12.0ml)、etoh(12.0ml)和h2o(6.0ml)中的混合物于40℃搅拌2小时。将生成的混合物用2n naoh(水溶液,30.0ml)稀释,用etoac(50ml)萃取。将水层用浓hcl(水溶液)酸化至ph《1。将沉淀物过滤收集,用水(20ml)洗涤并干燥,得到化合物84(16.7mg,25.4%),为黄色固体。lcms:396.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.98(s,1h),8.18(d,j=8.4hz,1h),8.13(d,j=8.4hz,1h),7.53(s,1h),7.40(d,j=8.8hz,1h),7.22(d,j=8.4hz,1h),4.90(s,2h),2.73(brs,6h),1.91-1.95(m,2h),1.69-1.72(m,2h)。
[0875]
实施例53:化合物85的合成
[0876][0877]
步骤1:在氩气氛下,将a(300.0mg,0.69mmol,1.0eq)、pd(pph3)2cl2(15.0mg,0.02mmol,0.03eq)、b(231.0mg,1.4mmol,2.0eq)和cs2co3(225.0mg,0.69mmol,1.0eq)在thf
(10ml)/水(3ml)中的混合物于60℃搅拌12小时。将生成的反应混合物浓缩,并将残余物通过硅胶色谱法(pe至pe/etoac=10/1)纯化,得到c(270.0mg,ca 100%)。lcms:399.2[m+h]
+
.
[0878]
步骤2:在n2气氛下,在冰浴下,将tfa(0.5ml)加入到搅拌下的二乙基锌(1m,3.0ml,3.0mmol,7.0eq)的dcm(20ml)溶液中。加入后,将该混合物搅拌10分钟,并然后在冰浴下加入ch2i2(1.0ml,12.4mmol,28.8eq)。将生成的混合物在冰浴下搅拌10分钟,并然后加入c(170.0mg,0.43mmol,1.0eq)的dcm(5ml)溶液。将反应混合物于室温搅拌5小时,用盐水(30ml)稀释,过滤。将滤液用dcm(50ml x 2)萃取。将有机层浓缩,并将残余物通过硅胶色谱法(pe至pe/etoac=10/1)纯化,得到d(121mg,68.6%)。lcms:413.2[m+h]
+
.
[0879]
步骤3:将c(121.0mg,0.30mmol,1.0eq)和lioh
·
h2o(756.0mg,18.0mmol,60.0eq)在thf(10.0ml)、etoh(20.0ml)和h2o(20.0ml)中的混合物于50℃搅拌5小时。将生成的混合物浓缩,用水(20ml)稀释,用浓hcl(水溶液)酸化至ph《1。将沉淀物过滤收集,用水洗涤并干燥,得到化合物85(81.0mg,72.3%)。lcms:385.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.95(brs,1h),8.13(d,j=8.8hz,1h),8.09(d,j=8.4hz,1h),7.38(s,1h),7.37(d,j=8.0hz,1h),7.14(d,j=8.0hz,1h),4.89(s,2h),2.72(s,6h),1.46(s,3h),1.00-1.02(m,2h),0.90-0.92(m,2h)。
[0880]
实施例54:化合物86的合成
[0881][0882]
步骤1:在n2气氛下,将a(100mg,0.226mmol,1.0eq)、b(0.5ml,5.847mmol,25eq)、pd2(dba)3(21mg,0.023mmol,0.1eq)、xantphos(11mg,0.023mmol,0.1eq)、cs2co3(221mg,0.677mmol,3.0eq)的甲苯(2ml)溶液于110℃搅拌过夜。将该混合物用水(30ml)稀释,并用etoac(30ml x 2)萃取。将合并的有机层依次用水(30ml)和盐水(30ml)洗涤,经无水na2so4干燥,并过滤。将滤液浓缩,得到c(90mg,95%)。lcms:450.1[m+h]+.
[0883]
步骤2:将c(90.0mg,0.2mmol,1.0eq)、lioh
·
h2o(84.0mg,2.0mmol,10.0eq)在thf/h2o(5ml/5ml)中的混合物于40℃搅拌过夜。将反应混合物浓缩,并将残余物通过prep-hplc纯化,得到化合物86(19.3mg,23%)。lcms:422.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.87(brs,1h),8.08(d,j=8.4hz,1h),7.98(s,1h),7.33(d,j=8.4hz,1h),6.55(s,1h),5.83(d,j=7.6hz,1h),4.82(s,2h),3.86-3.81(m,1h),2.71(brs,6h),1.27(d,j=6.0hz,6h)。
[0884]
实施例55:化合物87的合成
[0885][0886]
步骤1:在室温下,将异丁腈(147.0mg,2.1mmol,10.0eq)加入到搅拌下的2m nahmds(0.6ml,1.1mmol,5.0eq)的甲苯(10ml)溶液中。加入后,将该混合物搅拌10分钟,并然后在n2气氛下,在室温下加入到搅拌下的a(300.0mg,0.69mmol,1.0eq)、binap(52.0mg,0.069mmol,0.1eq)和pd(oac)2(15.3mg,0.069mmol,0.1eq)在甲苯(5.0ml)中的悬浮液中。将反应混合物于60℃搅拌10分钟,并浓缩。将残余物通过硅胶色谱法(pe至pe/etoac=10/1)纯化,得到b(48.0mg,49.5%)。lcms:460.2[m+h]
+
.
[0887]
步骤2:将a(48.0mg,0.13mmol,1.0eq)和lioh
·
h2o(112.0mg,2.6mmol,20.0eq)在thf(10.0ml)、etoh(30.0ml)和h2o(20ml)中的混合物于35℃搅拌20小时。将生成的混合物浓缩,用水(10ml)稀释,用浓hcl(水溶液)酸化至ph=1。将沉淀物过滤收集,用水(20ml)洗涤并干燥,得到化合物87(35.0mg,大约100%),为黄色固体。lcms:432.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.98(brs,1h),8.19(s,1h),8.13(d,j=8.8hz,1h),7.75(s,1h),7.43(d,j=8.8hz,1h),4.94(s,2h),2.73(s,6h),1.90(s,6h)。
[0888]
实施例56:化合物88的合成
[0889][0890]
步骤1:将a(300mg,0.64mmol)、2-溴-2-甲基丙烷(175mg,1.28mmol)、ni(acac)2(16mg,0.06mmol)、dmap(78mg,0.64mmol)、mgcl2(91mg,0.96mmol)和zn(83mg,1.28mmol)在dma(10ml)中的混合物于室温搅拌过夜。向反应混合物中加入水(20ml),并用dcm(20ml x 3)萃取。将有机相用水和盐水洗涤,经na2so4干燥,过滤并真空浓缩。将残余物通过prep-tlc(pe/etoac=10:1)纯化,得到b(10mg,3%),为黄色固体。lcms:449.2[m+h]
+
.
[0891]
步骤2:向b(10mg,0.02mmol)的thf(5ml)/etoh(2ml)溶液中加入lioh
·
h2o(10mg,0.20mmol)和水(1ml)。将反应混合物于室温搅拌3天,然后用2n hcl(水溶液)酸化至ph=2-3,用etoac(10ml x 3)萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,浓缩,得到化合物88(7.6mg,81%),为黄色固体。lcms:421.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.13(d,j=8.8hz,1h),8.07(s,1h),7.67(s,1h),7.41(d,j=8.8hz,1h),4.88(s,2h),2.72(s,6h),1.52(s,9h)。
[0892]
实施例57:化合物89的合成
[0893][0894]
步骤1:在n2气氛下,将a(50mg,0.11mmol,1.0eq)、b(49mg,0.32mmol,3.0eq)、pd(pph3)4(13mg,0.011mmol,0.1eq)、na2co3(35mg,0.33mmol,3.0eq)的etoh/h2o(5ml/1ml)溶液于90℃搅拌过夜。将该混合物用水(30ml)稀释,并用etoac(30ml x 2)萃取。将合并的有机层依次用水(30ml)和盐水(30ml)洗涤,经无水na2so4干燥并过滤。将滤液浓缩,并将残余物通过prep-hplc纯化,得到化合物89(8.1mg,20%)。lcms:391.0[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.91(brs,1h),8.14-8.12(m,2h),7.84(s,1h),7.41(d,j=8.8hz,1h),7.16-7.09(m,1h),6.12(d,j=16.8hz,1h),5.68(d,j=11.6hz,1h),4.98(s,2h),2.73(brs,6h)。
[0895]
实施例58:化合物91的合成
[0896][0897]
步骤1:在氮气下,将a(50mg,0.114mmol,1.0eq)、b(23mg,0.274mmol,2.4eq)、pd2(dba)3(10.1mg,0.011mmol,0.1eq)、xantphos(6.2mg,0.011mmol,0.1eq)和cs2co3(105mg,0.342mmol,3.0eq)在甲苯(4ml)中的混合物于80℃搅拌过夜,将反应混合物冷却至室温,倒入到40ml水中,并用etoac(20ml x 3)萃取。将合并的有机层用盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过硅胶柱色谱法(etoac/pe=1/6)纯化,得到c(25mg,48.8%)。lcms:484.2[m+h]
+
.
[0898]
步骤2:将c(25mg,0.052mmol,1.0eq)和lioh
·
h2o(33mg,0.78mmol,15.0eq)在thf/h2o/etoh(5ml/5ml/1ml)中的混合物于38℃搅拌过夜。将反应混合物减压浓缩以除去thf和etoh,然后加入5ml的水。将该混合物用1n hcl酸化至ph=6,过滤,将该固体通过prep-tlc(dcm/meoh=8/1)纯化,得到化合物91(13.7mg,58%),为黄色固体。lcms:456.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.37(s,1h),8.10(d,j=3.6hz,1h),8.09(d,j=5.2hz,1h),7.42-7.35(m,5h),7.18(s,1h),7.15-7.12(m,1h),4.65(s,2h),2.67(s,6h)。
[0899]
实施例59:化合物92的合成
[0900][0901]
步骤1:在氮气氛下,将a(50mg,0.114mmol,1.0eq)、b(35mg,0.274mmol,2.4eq)、pd2(dba)3(10.5mg,0.011mmol,0.1eq)、xantphos(6.6mg,0.011mmol,0.1eq)和cs2co3(105mg,0.342mmol,3.0eq)在甲苯(4ml)中的混合物于80℃搅拌过夜,将反应混合物冷却至室温,倒入到40ml水中,并用etoac(20ml x 3)萃取。将合并的有机层用盐水(15ml)洗涤,经无水mgso4干燥,过滤并浓缩。将残余物通过硅胶柱色谱法(etoac/pe=1/6)纯化,得到c(45mg,81.2%)。lcms:486.3[m+h]
+
.
[0902]
步骤2:将c(45mg,0.092mmol,1.0eq)和lioh
·
h2o(33mg,1.38mmol,15.0eq)在thf/h2o/etoh(5ml/5ml/1ml)中的混合物于40℃搅拌过夜。将反应混合物减压浓缩以除去thf和etoh,并加入5ml的水。将该混合物用1n hcl(水溶液)酸化至ph=6,过滤,将沉淀物通过prep-tlc(dcm/meoh=8/1)纯化,得到化合物92(31.3mg,74.4%),为黄色固体。lcms:458.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ8.79(s,1h),8.10(d,j=8.8hz,1h),8.01(d,j=8.4hz,1h),7.36-7.31(m,2h),7.26-7.22(m,2h),6.69(s,1h),6.65(d,j=8.8hz,1h),4.67(s,2h),2.67(s,6h)。
[0903]
实施例60:化合物93的合成
[0904][0905]
步骤1:在h2下,将89(90.0mg,0.2mmol,1.0eq)、兰尼镍(10mg)在meoh(5ml)中的混合物于室温搅拌3小时。将反应混合物过滤并将滤液浓缩。将残余物通过prep-hplc纯化,得到化合物93(6mg,26%)。lcms:393.1[m+h]
+
.1h nmr(400mhz,dmso-d6):δ12.92(brs,1h),8.14(d,j=8.8hz,1h),8.11(s,1h),7.63(s,1h),7.40(d,j=8.4hz,1h),4.90(s,2h),2.89-2.84(m,2h),2.73(brs,6h),1.25(t,j=7.6hz,3h)。
[0906]
实施例61:合成17、25、15、16、28、41和54的代表性操作
[0907][0908]
将a(1eq)、所需的硼酸b(1.1eq)、四(三苯基膦)钯(0)(0.20eq)和碳酸钾(3.0eq)在二噁烷/水(9:1,0.2m)中的非均相溶液在密封管中加热25分钟。将反应混合物用乙酸稀释,并通过whatman 0.45um注射器式滤器过滤。将粗品溶液通过c18 prep-hplc(含有0.1%盐酸的5至95%乙腈的水溶液)分离,得到标题化合物c。
[0909]
实施例62:化合物14的合成
[0910][0911]
将(1)的tfa/dcm溶液搅拌20分钟。真空除去溶剂。将粗的残余物通过快速硅胶柱色谱法(1%乙酸和10%乙酸乙酯的二氯甲烷溶液)分离,得到b(9.0mg,9.4%),为黄色固体。lc/ms:396.16[m+h]
+
[0912]
实施例63:化合物2的合成
[0913][0914]
向a(30.0mg,0.07mmol,1eq)的二噁烷(0.5m,0.15ml)溶液中加入甲醇(14.8ul,0.37mmol,5.0eq)、叔丁醇钾(19.7mg,0.18mmol,2.4eq)和tbubrettphospd g3(3.1mg,3.7umol,0.05eq)。将该反应搅拌1小时。真空除去挥发物,并将粗的混合物溶于乙酸中并过滤。将该溶液通过制备型hplc c18(含有0.1%盐酸的10至95%乙腈的水溶液)纯化,得到b(1.0mg,3.8%),为黄色固体。lc/ms:361.23[m+h]
+
.1h nmr(400mhz,甲醇-d4)δ8.24(dd,j=9.0,5.5hz,2h),7.34(d,j=8.3hz,1h),6.98(d,j=6.4hz,2h),4.93(s,2h),3.96(s,3h),2.81(s,6h)。
[0915]
实施例64:化合物90的合成
[0916][0917]
将a(30.0mg,73.2umol,1eq)、b(9.9mg,80.5umol,1.1eq)、xantphos(12.7mg,22umol,0.3eq)、乙酸钯(2.5mg,11.0umol,0.15eq)和碳酸铯(72.0mg,22.0umol,3.0eq)在dme(0.61ml,0.12m)中的非均相溶液在密封管中加热至120℃持续20分钟。将反应混合物用乙酸(1.0ml)稀释,并通过ptfe注射器式滤器(0.45um)过滤。将该粗品溶液通过c18半制备型hplc(含有0.1%盐酸的5至95%乙腈的水溶液)分离,其得到c(9.9mg,30%产率),为白色固体。lc/ms:451.13[m+h]
+
.
[0918]
实施例65:化合物22的合成
[0919][0920]
步骤1
[0921]
将xphospdg3(4.8mg,6umol,0.05eq)、a(50.0mg,0.11mmol)和b(274ul,0.14mmol,1.2eq)在thf(0.5m,228ul)中的非均相溶液加热至100℃持续12小时。将该反应溶液浓缩到硅胶上。将粗品浸渍的二氧化硅进行快速柱色谱法(15%乙酸乙酯的己烷溶液)纯化,得到c(12.5mg,26%产率),为白色固体。lc/ms:429.22[m+h]
+
.
[0922]
步骤2
[0923]
将c(25mg,62.4umol)在thf(0.9ml)和4n naoh(水溶液,0.3ml)中的双相溶液在密封管中加热16小时。将该反应用tfa淬灭,并真空除去溶剂。将粗的残余物通过快速硅胶柱色谱法(10至40%乙酸乙酯的己烷溶液,添加2%乙酸)分离,其得到d(10.0mg,40%产率),为黄色固体。lc/ms:401.19[m+h]
+
.
[0924]
实施例66:化合物27的合成
[0925][0926]
向a(8mg)的甲醇(3ml)溶液中加入pd/c(10wt.%,8mg)。将反应顶部空间用氢气吹扫,并将该反应在氢气(1atm)下进一步搅拌16小时,并随后过滤。真空除去溶剂。提供的物质b(8mg,定量产率)无需进一步纯化即可使用。lc/ms:498.24[m+h]
+
.
[0927]
实施例67:化合物40的合成
[0928][0929]
将a(8mg)的溶液溶于tfa/dcm(1:1,0.8ml)中。将该反应搅拌30分钟,并然后将该反应溶液真空浓缩以得到b(8mg,定量产率),将其无需进一步纯化即可使用。lc/ms:386.13[m+h]
+
.1h nmr(500mhz,cdcl3)δ9.63
–
9.44(m,2h),8.29(d,j=8.4hz,1h),8.11(d,j=8.6hz,1h),7.70
–
7.58(m,2h),7.52(d,j=8.7hz,1h),6.82(t,j=2.3hz,1h),5.30(s,3h),4.51(s,2h),4.29(dq,j=6.2,3.2hz,2h),3.83(s,3h)。
[0930]
实施例68:化合物53的合成
[0931][0932]
向a(12.0mg)的甲醇溶液中加入pd/c(10wt.%,2.0mg)。将该反应在1atm氢气氛下搅拌40分钟。将该反应过滤并浓缩,得到b(12.0mg,定量产率),为白色固体。lc/ms:415.22[m+h]
+
.
[0933]
实施例69:化合物24的合成
[0934][0935]
步骤1:在n2气氛下,将a(131mg,0.3mmol,1.0eq)、2-异丙烯基-4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷(57ul,0.3mmol,1.0eq)、饱和的na2co3水溶液(1.5ml)和pd(pph3)4(11mg,0.009mmol,0.03eq)在1,4-二噁烷(2ml)中的混合物于85℃搅拌12小时。将该
反应冷却至室温后,加入dcm(5ml)和水(5ml)。将生成的混合物经硅藻土过滤,并将有机层通过快速硅胶色谱法(乙酸乙酯/己烷=1/2)纯化,得到b(85mg,产率=71%)。lc/ms:399.2[m+h]
+
.
[0936]
步骤2:向b(15mg,0.04mmol,1.0eq)的thf/meoh/h2o溶液中加入氢氧化锂一水合物(17mg,0.4mmol,10.0eq)。将生成的混合物于25℃搅拌16小时。通过tlc监测完成后,将反应混合物通过加入1n hcl(水溶液)酸化至ph=4。然后,加入dcm(10ml)。将有机层用盐水(3x5 ml)洗涤并经无水硫酸钠干燥。然后过滤除去溶剂得到化合物24(10.8mg,产率=77%)。1h nmr(400mhz,dmso-d6)δ12.88(s,1h),8.14(dd,j=8.5,3.8hz,2h),7.59(d,j=1.5hz,1h),7.52(dd,j=8.4,1.5hz,1h),7.38(d,j=8.6hz,1h),5.65(t,j=1.1hz,1h),5.32(p,j=1.5hz,1h),4.93(s,2h),2.72(s,6h),2.19(d,j=0.8hz,3h)。lc/ms:371.1[m+h]
+
.
[0937]
实施例70:化合物20的合成
[0938][0939]
向a(1.31g,3mmol,1.0eq)的thf/meoh/h2o(60ml/60ml/20ml)溶液中加入氢氧化锂一水合物(1.26g,30mmol,10.0eq)。将生成的混合物于25℃搅拌16小时。通过tlc监测完成后,通过加入1n hcl(水溶液)将反应混合物酸化至ph=4。然后将反应混合物在dcm(150ml)和盐水(100ml)之间分配。将有机层经无水硫酸钠干燥,过滤并浓缩得到粗产物。向残余物中加入dcm(10ml)和己烷(50ml),并搅拌10分钟。然后,过滤得到化合物20(1.13g,产率=92%)。1h nmr(400mhz,dmso-d6)δ12.91(s,1h),8.11(dd,j=13.2,8.6hz,2h),7.82(d,j=1.7hz,1h),7.50(dd,j=8.6,1.6hz,1h),7.41(d,j=8.6hz,1h),4.88(s,2h),2.71(s,6h)。lc/ms:409.1[m+h]
+
.
[0940]
实施例71:化合物23的合成
[0941][0942]
按照制备化合物23的相同方式,由a通过与2-(环己-1-烯-1-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(1eq)(饱和的na2co3水溶液:1.5ml;pd(pph3)4:0.03eq;1,4-二噁烷:2ml;85℃,12h,产率=84%)进行suzuki偶联,随后将乙基酯皂化制备化合物23。1h nmr(400mhz,dmso-d6)δ12.83(s,1h),8.12(dd,j=8.5,7.7hz,2h),7.48(d,j=1.6hz,1h),7.43(dd,j=8.4,1.5hz,1h),7.37(d,j=8.6hz,1h),6.46
–
6.39(m,1h),4.90(s,2h),2.72(s,6h),2.46
–
2.41(m,2h),2.24(ddd,j=10.2,5.0,2.3hz,2h),1.77
–
1.74(m,2h),1.64(dp,j=8.6,2.6hz,2h)。lc/ms:411.2[m+h]
+
.
[0943]
实施例72:化合物19的合成
[0944][0945]
按照制备化合物24的相同方式,由a通过与2-(顺式-1-乙基-丁-1-烯基)-苯并[1,3,2]二氧杂硼杂环戊烯(1.1eq)(csf:3.0eq;pd(pph3)4:0.1eq;1,4-二噁烷/水:2ml/0.5ml;100℃,16小时,产率=41%)进行suzuki偶联,随后将乙基酯皂化制备化合物19。1h nmr(400mhz,dmso-d6)δ13.00(s,1h),8.12(dd,j=8.4,6.5hz,2h),7.48(d,j=1.5hz,1h),7.41
–
7.33(m,2h),5.92(t,j=7.3hz,1h),4.89(s,2h),2.72(s,6h),2.61
–
2.53(m,2h),2.23(p,j=7.5hz,2h),1.09
–
0.99(m,3h),0.96(d,j=7.2hz,3h)。lc/ms:413.3[m+h]
+
.
[0946]
实施例73:化合物13的合成
[0947][0948]
按照制备化合物24的相同方式,由化合物20通过与4-异噁唑硼酸频哪醇酯(1eq)(na2co3:3.0eq;pd(pph3)4:0.05eq;1,4-二噁烷/水:2ml/0.5ml;100℃,12h,产率=30%)进行suzuki偶联制备化合物13。1h nmr(400mhz,dmso-d6)δ12.88(s,1h),8.16
–
8.11(m,2h),7.65
–
7.58(m,2h),7.57
–
7.53(m,1h),7.49
–
7.43(m,1h),7.37(t,j=8.7hz,1h),4.84(d,j=33.7hz,2h),2.72(d,j=0.7hz,6h)。lc/ms:398.2[m+h]
+
.
[0949]
实施例74:化合物12的合成
[0950][0951]
按照制备化合物24的相同方式,由化合物20通过与3,5-二甲基异噁唑-4-硼酸(1eq)(na2co3:3.0eq;pd(pph3)4:0.1eq;1,4-二噁烷/水:2ml/0.5ml;100℃,5h,产率=3%)进行suzuki偶联制备化合物12。lc/ms:426.2[m+h]
+
.
[0952]
实施例75:化合物18的合成
[0953][0954]
按照制备化合物24的相同方式,由a通过与2-(顺式-1-乙基-丁-1-烯基)-苯并[1,3,2]二氧杂硼杂环戊烯(1.1eq)(csf:3.0eq;pd(pph3)4:0.1eq;1,4-二噁烷/水:2ml/0.5ml;100℃,4h,产率=93%)进行suzuki偶联,随后将乙基酯皂化制备化合物18。1h nmr(400mhz,dmso-d6)δ13.19(s,1h),8.15(d,j=8.3hz,1h),8.04(d,j=8.7hz,1h),7.46
–
7.38(m,3h),5.94(t,j=7.3hz,1h),5.16(s,2h),3.76(s,3h),2.56(q,j=7.5hz,2h),2.24(p,j=7.4hz,2h),1.05(t,j=7.5hz,3h),0.97(t,j=7.4hz,3h)。lc/ms:400.2[m+h]
+
.
[0955]
实施例76:化合物65的合成
[0956][0957]
按照制备化合物24的相同方式,由a通过与2-异丙烯基-4,4,5,5-四甲基-[1,3,2]二氧杂硼杂环戊烷(1eq)(饱和的na2co3水溶液1ml;pd(pph3)4:0.03eq;1,4-二噁烷:1.5ml;85℃,12h,产率=88%)进行suzuki偶联,随后将乙基酯皂化制备化合物65。1h nmr(400mhz,dmso-d6)δ13.16(s,1h),8.21
–
8.16(m,1h),8.05(d,j=8.7hz,1h),7.57
–
7.52(m,2h),7.45(d,j=8.6hz,1h),5.67(t,j=1.1hz,1h),5.33(t,j=1.5hz,1h),5.19(s,2h),3.76(s,3h),2.22
–
2.16(m,3h)。lc/ms:358.1[m+h]
+
.
[0958]
实施例77:化合物66的合成
[0959][0960]
按照制备化合物20的相同方式,由a的皂化制备得到化合物66。1h nmr(400mhz,dmso-d6)δ8.13(d,j=8.5hz,1h),8.04(d,j=8.7hz,1h),7.84(d,j=1.7hz,1h),7.52(dd,j=8.5,1.7hz,1h),7.48(d,j=8.6hz,1h),5.11(s,2h),3.76(s,3h)。
[0961]
实施例78:人sting蛋白fp竞争浓度响应测定
[0962]
将荧光素标记的c-di-gmp(一种经过验证的sting配体)与重组体hsting-ctd以均相测定形式在黑色384孔板(10μl每孔)中的pbs中在存在或不存在本技术化合物(滴定)的情况下混合。在perkinelmer envisions多模式读板仪上确定荧光各向异性。混合试剂后可立即读板或几个小时不改变信号后读板。
[0963]
材料和设备
[0964]
1)hsting(供应商:hdb)
[0965]
2)2'-fluo-ahc-c-di gmp(biolog#f009)
[0966]
3)2'3'-cgamp(biolog#c161)
[0967]
4)dmxaa(invivogen#tlrl-dmx)
[0968]
5)dmso(sigma,#d5879-100 ml)
[0969]
6)10x pbs(hdb#mcp-020)
[0970]
7)检测板,384孔黑色板,纯黑色底部(greiner#784076)
[0971]
8)化合物稀释中间板,384ldv板(labcyte#lp-0200)
[0972]
9)液体处理器,echo550(labcyte)
[0973]
10)液体处理器,bravo(aglient)
[0974]
11)读板仪,envision(perkinelmer)
[0975]
12)离心机(eppendorf)
[0976]
13)多通道移液器(raining)
[0977]
14)10ml储液器(corning)
[0978]
15)15ml离心管(corning)
[0979]
16)胶板密封(biorad)
[0980]
化合物制备
[0981]
a)将每种化合物的容器在1000rpm下离心5分钟。
[0982]
b)将化合物以30mm的浓度溶于dmso中。
[0983]
c)将化合物充分涡旋,然后以1000rpm离心1分钟。
[0984]
d)将16ul的化合物溶液转移至ldv化合物板中。
[0985]
e)用dmso将化合物溶液进行2倍系列稀释,并在384孔ldv化合物板中制备14个浓度。
[0986]
f)将ldv板以1000rpm的速度旋转60秒,并用箔纸密封(如果不立即使用,保存于-20℃)。
[0987]
g)将ldv化合物板中的335nl的每种化合物转移至检测板(echo550)。
[0988]
探针的制备
[0989]
a)用ddh2o将200um探针储备液(2'-fluo-ahc-c-digmp)稀释至6um工作浓度。
[0990]
b)将探针的10-12ul 6um工作溶液转移到ldv板中。
[0991]
c)通过echo550缓冲液模式,将每孔50nl的探针的6um工作溶液从ldv板转移到空的检测板(greiner 784076)的每个孔中。
[0992]
d)当检测系统为10ul时,探针的最终浓度为30nm。
[0993]
e)将检测板以1000rpm旋转1分钟。
[0994]
化合物添加
[0995]
a)准备ldv化合物板后,根据检测板布局,将335nl化合物(echo550 dmso模式)从ldv化合物板转移到每个孔中包含50nl探针的检测板(greiner 784076)中。
[0996]
b)当检测系统为10ul时,dmso终浓度为3.35%。
[0997]
c)将检测板以1000rpm旋转1分钟。
[0998]
蛋白质添加
[0999]
a)将hsting蛋白的等分试样在冰上融化,短暂地产生均匀溶液。
[1000]
b)在1x pbs分析缓冲液中稀释55um储备蛋白,以生成10um最终溶液。
[1001]
c)对于测试化合物和zpe孔,使用多通道移液器将每孔10μl的10um蛋白溶液添加到同时包含探针和测试化合物或dmso的检测板中。
[1002]
d)对于hpe孔,使用多通道移液器将10μl/孔的1x pbs分析缓冲液代替蛋白质添加到同时包含探针和dmso的检测板中。
[1003]
e)将检测板以1000rpm旋转1分钟。
[1004]
f)将检测板在室温下温育10-20分钟。
[1005]
化合物板布局
[1006][1007][1008]
每个化合物板均包含hpe/zpe和24种测试化合物。每个检测均包括测试化合物和两种参考化合物:dmxaa和2'3'-cgamp。
[1009]
在384孔ldv化合物板中,将测试化合物用100%dmso以30mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。在384孔ldv化合物板中,将dmxaa用100%dmso以8.95mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。在384孔ldv化合物板中,将2'3'-cgamp用100%dmso以2.23mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。
[1010]
检测板布局
[1011][1012][1013]
每个检测板均包含hpe/zpe和12种测试化合物。
[1014]
hpe孔为335nl dmso+50nl包含6um探针的分析缓冲液+10ul分析缓冲液。
[1015]
zpe孔为335nl dmso+50nl含6um探针的分析缓冲液+10ul含10um hsting蛋白的分析缓冲液。
[1016]
测试化合物孔为含有化合物(最高浓度为1000um,以及通过2倍系列稀释获得的14个递减浓度)的335nl dmso+50nl含6um探针的分析缓冲液+10ul含10um hsting蛋白的分析缓冲液。
[1017]
对于每个测定,最后一个检测板中均包含了两种参考化合物dmxaa和2'3'-cgamp。
[1018]
dmxaa孔为含有dmxaa(最高浓度为8.95mm,以及通过2倍连续稀释获得的14个递减浓度)的335nl dmso+50nl含6um探针的分析缓冲液+10nl含10um hsting蛋白的分析缓冲液。
[1019]
2'3'-cgamp孔为含有2'3'-cgamp(最高浓度为2.23mm,以及通过2倍连续稀释获得的14个递减浓度)的335nl dmso+50nl包含6um探针的分析缓冲液+10ul含10um hsting蛋白的分析缓冲液。
[1020]
读板
[1021]
使用envision读板仪在试剂混合后立即或在几个小时没有信号变化后记录每个孔的fa值。
[1022]
数据分析
[1023]
原始数据和计算数据(荧光各向异性(fa))从envision读板仪导出。荧光各向异性(fa)=1000*(s-g*p)/(s+g*2*p),其中s=《检测器2或sting fp(1)通道2》,p=《检测器1或sting fp(1)通道1》,g=g-因子。每种剂量浓度的fa值首先归一化为与zpe(仅dmso)和hpe(2
’3’
cgamp+dmso)对照相比的抑制的百分比,其提供0-100%的抑制范围。然后使用非线性回归模型(4参数对数模型,s形曲线(sigmoidal)剂量响应模型)和最小二乘绘制出数据点。所得模型用于计算该化合物的ic
50
值。
[1024]
实施例79:小鼠sting蛋白fp竞争浓度响应测定
[1025]
在黑色的384孔板中,将荧光素标记的c-di-gmp与msting-ctd在有或没有本技术化合物的情况下在pbs中混合(每孔10μl)。在perkinelmer envisions多模式读板仪上确定荧光各向异性。混合试剂后立即读板或几个小时不改变信号后读板。
[1026]
材料和设备
[1027]
1)6xhis-sumo-msting(供应商:hdb)
[1028]
2)2'-fluo-ahc-c-di gmp(biolog#f009)
[1029]
3)2'3'-cgamp(biolog#c161)
[1030]
4)dmxaa(invivogen#tlrl-dmx)
[1031]
5)dmso(sigma,#d5879-100 ml)
[1032]
6)10x pbs(hdb#mcp-020)
[1033]
7)检测板,384孔黑色板,纯黑色底部(greiner#784076)
[1034]
8)化合物稀释中间板,384ldv板(labcyte#lp-0200)
[1035]
9)液体处理器,echo550(labcyte)
[1036]
10)液体处理器,bravo(aglient)
[1037]
11)读板仪,envision(perkinelmer)
[1038]
12)离心机(eppendorf)
[1039]
13)多通道移液器(raining)
[1040]
14)10ml储液器(corning)
[1041]
15)15ml离心管(corning)
[1042]
16)胶板密封(biorad)
[1043]
化合物制备
[1044]
a)将每种化合物的容器在1000rpm离心5分钟。
[1045]
b)将化合物以30mm的浓度溶于dmso中。
[1046]
c)将化合物充分涡旋,然后以1000rpm离心1分钟。
[1047]
d)将16ul的化合物溶液转移至ldv化合物板中。
[1048]
e)用dmso将化合物溶液进行2倍系列稀释,并在384孔ldv化合物板中制备14个浓度。
[1049]
f)将ldv板以1000rpm的速度旋转60秒,并用箔纸密封(如果不立即使用,保存于-20℃)。
[1050]
g)将ldv化合物板中的335nl的每种化合物转移至检测板(echo550)。
[1051]
探针制备
[1052]
a)用ddh2o将200um探针储备液(2'-fluo-ahc-c-digmp)稀释至6um工作浓度。
[1053]
b)将探针的10-12ul 6um工作溶液转移到ldv板中。
[1054]
c)通过echo550缓冲液模式,将每孔50nl的探针的6um工作溶液从ldv板转移到空的检测板(greiner 784076)的每个孔中。
[1055]
d)当检测系统为10ul时,探针的最终浓度为30nm。
[1056]
e)将检测板以1000rpm旋转1分钟。
[1057]
化合物添加
[1058]
a)准备ldv化合物板后,根据检测板布局,将100nl化合物(echo550 dmso模式)从ldv化合物板转移到每个孔中包含50nl探针的检测板(greiner 784076)中。
[1059]
b)当检测系统为10ul时,dmso终浓度为1%。
[1060]
c)将检测板以1000rpm旋转1分钟。
[1061]
蛋白质添加
[1062]
a)将6xhis-sumo-msting蛋白的等分试样在冰上融化,短暂地产生均匀溶液。
[1063]
b)在1x pbs分析缓冲液中稀释66um储备蛋白,以生成8um最终溶液。
[1064]
c)对于测试化合物和zpe孔,使用多通道移液器将每孔10μl的8um蛋白溶液添加到同时包含探针和测试化合物或dmso的检测板中。
[1065]
d)对于hpe孔,使用多通道移液器将10μl/孔的1x pbs分析缓冲液代替蛋白质添加到同时包含探针和dmso的检测板中。
[1066]
e)将检测板以1000rpm旋转1分钟。
[1067]
f)将检测板在室温下温育10-20分钟。
[1068]
化合物板布局
[1069][1070]
每个化合物板均包含hpe/zpe和24种测试化合物。每个测定均包括测试化合物和两种参考化合物:dmxaa和2'3'-cgamp。
[1071]
在384孔ldv化合物板中,将测试化合物用100%dmso以30mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。在384孔ldv化合物板中,将dmxaa用100%dmso以10mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。在384孔ldv化合物板中,将2'3'-cgamp用100%dmso以7.5mm的最高浓度和通过2倍系列稀释获得的14个递减浓度给予。
[1072]
检测板布局
[1073][1074][1075]
每个检测板均包含hpe/zpe和12种测试化合物。
[1076]
hpe孔为100nl dmso+50nl包含6um探针的分析缓冲液+10ul分析缓冲液。zpe孔为100nl dmso+50nl含6um探针的分析缓冲液+10ul含8um 6xhis-sumo-msting蛋白的分析缓冲液。
[1077]
测试化合物孔为含有化合物(最高浓度为30mm,以及通过2倍系列稀释获得的14个递减浓度)的100nl dmso+50nl含6um探针的分析缓冲液+10ul含8um 6xhis-sumo-msting蛋白的分析缓冲液。
[1078]
对于每个测定,最后一个检测板中均包含了两种参考化合物dmxaa和2'3'-cgamp。
[1079]
dmxaa孔为含有dmxaa(最高浓度为10mm,以及通过2倍连续稀释获得的14个递减浓度)的100nl dmso+50nl含6um探针的分析缓冲液+10nl含8um 6xhis-sumo-msting蛋白的分析缓冲液。
[1080]
2'3'-cgamp孔为包含2'3'-cgamp(最高浓度为7.5mm,以及通过2倍连续稀释获得的14个递减浓度)的100nl dmso+50nl包含6um探针的分析缓冲液+10nl含8um 6xhis-sumo-msting蛋白的分析缓冲液。
[1081]
读板
[1082]
使用envision读板仪在试剂混合后立即或在几个小时没有信号变化后记录每个孔的fa值。
[1083]
数据分析
[1084]
原始数据和计算数据(荧光各向异性(fa))从envision读板仪导出。荧光各向异性(fa)=1000*(s-g*p)/(s+g*2*p),其中s=《检测器2或sting fp(1)通道2》,p=《检测器1或sting fp(1)通道1》,g=g-因子。每种剂量浓度的fa值首先归一化为与zpe(仅dmso)和hpe(2
’3’
cgamp+dmso)对照相比的抑制的百分比,其提供0-100%的抑制范围。然后使用非线性回归模型(4参数对数模型,s形曲线剂量响应模型)和最小二乘绘制出数据点。所得模型用
于计算该化合物的ic
50
值。
[1085]
实施例80:放射性过滤结合竞争检测
[1086]
进行放射性过滤结合竞争检测以定量本技术的化合物对人或小鼠sting蛋白或相关的haq人同种型的结合亲和力。竞争形式过滤结合测定检测小分子化合物与氚化[h3]2
’3’
cgamp高亲和力sting配体结合并抑制其随后结合的能力。所得的剂量反应通过非线性回归拟合以确定ic
50
值,从中推断出每种化合物的ki值。
[1087]
简而言之,将人sting蛋白(140-379)或小鼠sting蛋白(139-328)[0.5μm]的重组c-端配体结合域在本技术化合物(8点,2倍稀释,由300μm开始)存在下或在对照条件下温育。然后加入h3标记的2
’3’
cgamp[25nm]并使其达到结合平衡(1小时)。然后将所得复合物过滤、干燥并加入闪烁液,测量剩余的放射信号以确定化合物配体抑制的程度。该检测形式针对人蛋白质和小鼠同源蛋白质的wt和haq同种型进行了优化。
[1088]
检测开发
[1089]
参数优化:
[1090]
a.蛋白质形式:6xhis-sumo标记或未标记
[1091]
b.目标蛋白浓度:达到》80最大信号的最低浓度
[1092]
c.测定dmso浓度:10%-0.1%
[1093]
d.分析缓冲液:碱(tris或磷酸盐),盐浓度,+/-tween(0.1-2%)
[1094]
e.探针的合成:(1)使用小鼠cgas酶将s
35-atp和冷的gtp酶促掺入到2
’3’
cgamp产物中,然后进行纯化。(2)将氚掺入到2
’3’
cgamp
[1095]
f.探针浓度:达到最大检测窗的最低浓度
[1096]
g.检测形式:闪烁接近珠或过滤结合板
[1097]
h.检测板:384vs 96孔形式
[1098]
i.对于连续的温育步骤的检测温育时间
[1099]
[1100][1101][1102]
本技术化合物的生物活性示于表2。
[1103]
wt-hswat:wt_fba_his-sumo-hswat ic50(μm)(“wt”=野生型);haq-hswat:haq_fba_his-sumo-hswat ic50(μm)(“haq”=sting蛋白的人类haq等位基因);和wt-mswat:mouse_fba_his-sumo-mswat ic50(μm),其是sting蛋白的小鼠亚型。
[1104]
表2
[1105]
[1106]
[1107]
[1108]
[1109]
[1110]
[1111]
[1112]
[1113]
[1114]
[1115]
[1116]
[1117]
[1118]
[1119]
[1120]
[1121]
[1122]
[1123]
[1124]
[1125]
[1126]
[1127][1128]
wt_fba_his-sumo-hswat ic50(μm);haq_fba_his-sumo-hswat ic50(μm);和mouse_fba_his-sumo-mswat ic50(μm):“a”《20μm;“b”=20-100μm;“c”=100-300μm;“d”》300μm.
[1129]
实施例81:sting差示扫描荧光法(dsf)测定
[1130]
进行sting dsf测定以确定响应小分子配体结合的蛋白质热稳定性变化。基于差示扫描荧光法的sting热稳定性变化测定用于测量(1)sting蛋白的载脂蛋白和配体结合状态之间的解链温度的净变化(δtm)和(2)作为结合亲和力(kd)的替代量度的热变性转变的浓度(ec50)。简而言之,将包含c末端结合域(r232-wt或haq亚型)的重组小鼠或人sting蛋白(aa140-379)通过亲和色谱法纯化,并进一步处理以去除纯化标签,然后进行凝胶过滤以达到纯度》95%。将测定缓冲液中的蛋白质转移到384孔板中,并与疏水性荧光染料sybr orange一起温育。将温度斜坡(temperature ramp)施加到板上,并将所得染料荧光绘制为温度的函数。然后使用该函数的一阶导数(df/dt)来推断不同浓度化合物下蛋白质的解链温度,并确定蛋白质/化合物复合物的热变性曲线。
[1131]
优化的测定参数
[1132]
1.蛋白质构建体(亲和标签去除相对sumo融合构建)
[1133]
2.蛋白质浓度
[1134]
3.染料浓度
[1135]
4.缓冲液
[1136]
5.热渐变速度(thermal ramp velocity)
[1137]
6.dmso耐受性
[1138]
7.化合物滴定参数
[1139]
8.hpe和zpe对照
[1140]
最终测定参数
[1141]
1.hsting-r232、或hsting-haq(aa140-379)、msting-r232(aa139-378)
[1142]
2. 5μm纯化的目标sting蛋白
[1143]
3. 8μm sypro orange染料
[1144]
4.缓冲剂:100mm nacl,30mm hepes,ph 7.5
[1145]
5.热斜坡:0.5℃/min
[1146]
6.《1%dmso
[1147]
7. 11点,2倍稀释,一式两份,300μm高浓度
[1148]
8.hpe(100μm 2
’3’
cgamp),zpe(dmso 1%)
[1149]
基于本技术化合物的dsf测定的生物活性描述于下表3中。
[1150]
表3
[1151]
[1152]
[1153]
[1154][1155]
wt_dsf_hswat温度变化(℃)温度变化(℃):“a”《0℃;“b”=0-2℃;“c”=2-7℃;“d”》7℃。
[1156]
实施例82:基于细胞的irf或ifn-β激活报告基因检测
[1157]
开发了细胞报告基因检测,以测量本技术化合物激活sting蛋白并激活髓源性细胞系thp-1中irf/ifn和nfkb信号传导通路的能力,thp-1可从多个供应商处购得。简而言之,转染并选择thp-1单核细胞以稳定整合2个报告基因构建体。通过抗生素对杀稻瘟素和吉欧霉素(zeocin)的抗性来进一步选择掺入稳定整合载体的克隆。报告基因构建体包括:(1)在isg54启动子控制下,萤火虫荧光素酶报告基因与五个干扰素(ifn)刺激的反应元件融合,以测量irf转录因子结合活性和(2)在ifn-β最小启动子的转录控制下,分泌的胚性碱性磷酸酶报告基因与nfkb共有转录反应元件的5个拷贝和c-rel结合位点的3个拷贝融合。
[1158]
所得的thp-1细胞系经过进一步修饰以掺入3个氨基酸点突变(h71r a230g q293r)。这种对thp-1细胞(haq)中天然tmem173基因的修饰旨在产生一种细胞报告基因,该报告基因表达人类群体中最常见的等位变体(thp-1r232,购自invivogen)。或者,敲除tmem173基因以提供同类对照,以反筛选独立于sting蛋白的化合物激活(thp-1sting ko)。
[1159]
一旦建立了细胞系,就会开发和优化报告基因检测方案,以筛选小分子化合物的激动剂活性。功效和z'值的测定优化包括以下参数的滴定:
[1160]
检测优化参数
[1161]
1.使用pma的细胞预激活
[1162]
2.细胞接种密度
[1163]
3.dmso耐受性
[1164]
4.培养基选择
[1165]
5.fbs浓度
[1166]
6.温育时间
[1167]
7.通过ctg检测共同评估细胞活力
[1168]
8.适当的hpe和zpe对照
[1169]
9.剂量反应滴定
[1170]
最终检测sop条件
[1171]
1.无使用pma的预激活
[1172]
2. 5x10^4细胞/孔,在96孔板形式
[1173]
3.《0.5%dmso
[1174]
4.rpmi 1640+2.5mg/ml葡萄糖
[1175]
5. 10%fbs
[1176]
6. 14-18小时温育
[1177]
7.去除上清液后的cell titer glo试剂(promega)
[1178]
8.hpe
irf
(100μm 2
’3’
cgamp),hpe
nfkb
(50nm pm3csk4),zpe(dmso0.5%)
[1179]
9. 8点,2倍,一式两份,从150μm开始
[1180]
检测性能
[1181][1182][1183]
基于本技术化合物的细胞报告基因检测的生物活性描述于下表4中。
[1184]
表4
[1185]
[1186]
[1187][1188]
thp1-dual-ki r232_irf(荧光素酶)ic50(μm):“a”《50μm;“b”=50-100μm;“c”=100-150μm;“d”》150μm。
[1189]
thp1-dual-ki r232_irf(荧光素酶)_测定的活性最大值(%):“a”《5%;“b”=5-25%;“c”=25-50%;“d”》50%。
[1190]
等效物
[1191]
本领域技术人员将认识到或能够仅使用常规实验来确定本文描述的特定实施方案和方法的许多等效物。此类等效物旨在包含在本技术的范围内。
[1192]
在此引用的所有专利、专利申请和参考文献均通过引用明确并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1