GABA激动剂和拮抗剂影响造血干细胞和巨核系祖细胞的分化的制作方法
gaba激动剂和拮抗剂影响造血干细胞和巨核系祖细胞的分化
1.相关申请的交叉引用
2.本专利申请案主张于2019年3月13日提交的编号为62/846,865的美国临时专利申请案的优先权,上述专利申请以引用方式全文并入本文中。
背景技术:
3.γ-氨基丁酸(gaba)是脊椎动物中枢神经系统中主要的抑制性神经递质,在神经发生中发挥作用。此外,gaba还存在于各种外周组织和器官中,例如肠、胃等。然而,迄今为止,从未报告过gaba受体的细胞类型特异性表达,也未报告过其在造血干细胞和祖细胞(hspc)中的解剖学分布和功能特性。
4.hsc能够逐步产生多种不同的细胞类型。hsc来源巨核系-红系祖细胞(mep)属于双能祖细胞,可分化为mkp(产生血小板)或红系祖细胞(ep;产生红细胞)。补充mkp是治疗严重血小板减少症以快速恢复患者凝血功能的颇有前景的治疗策略。因此,鉴定造血过程中促进mkp生成和分化的调节剂已成为一个重要课题。
技术实现要素:
5.本发明提供了用于在体内和体外调节巨核细胞生成的组合物和方法。在一些实施例中,所述方法使得造血干细胞(hsc)和祖细胞来源巨核细胞和血小板的产生得到增强。hsc来源巨核系-红系祖细胞(mep)属于双能祖细胞,可分化为巨核系祖细胞(mkp;产生血小板)或红系祖细胞(ep;产生红细胞)。出人意料的是,mkp细胞表达gabaρ受体gabrr1,并通过增加骨髓中或体外祖细胞中mkp细胞的产生量来响应gabrr1激动剂。
6.在一些实施例中,提供了用于使mkp细胞、巨核细胞和血小板中的一种或更多种的产生得到增强的方法,所述方法包含:使包含造血干细胞(hsc)和祖细胞的细胞群体与能够有效增加mkp细胞、巨核细胞和/或血小板产生量的一定剂量的gabrr1激动剂接触。在一些实施例中,所述接触在体内进行。在一些此类实施例中,患有血小板减少症或易发展为血小板减少症的受试者与有效剂量和方案的gabrr1激动剂接触以增加巨核细胞以及巨核细胞来源血小板的产生量。给药后,可以监测所述个体的血小板减少症的临床指标。
7.在一些实施例中,提供了用于产生巨核谱系细胞的体外培养系统,例如,mep、mkp、巨核细胞等。所述培养系统包含能够在包含有效浓度的gabrr1激动剂的培养基中产生巨核谱系细胞的造血干细胞或祖细胞,例如,hsc、mep等。
8.用于本发明的方法中的gabrr1激动剂包括但不限于4-氨基丁酸(gaba)、反式-4-氨基巴豆酸(taca)和蝇覃醇。在一些实施例中,所述激动剂对gaba rho受体具有选择性,例如,gabrr1,例如taca;顺式-4-氨基-巴豆酸(caca)、(+)-顺式-2-(氨基甲基)环丙烷羧酸(camp);(
±
)-反式-2-(氨基甲基)环丙烷羧酸(tamp);反式-2-甲基-4-氨基巴豆酸(2-metaca);3-(氨基甲基)-1-氧代-1-羟基-磷杂环戊烷(3-amohp);3-(氨基)-1-氧代-1-羟基-磷杂环戊烷(3-aohp);3-(胍基)-1-氧代-1-羟基-磷杂环戊烷(3-gohp);4-氨基环戊-1-烯甲酰胺(4-acpam);4-氨基-n-羟基环戊-1-烯甲酰胺(4-acpha);等等。
9.应当理解,虽然已结合本发明的优选具体实施例描述了本发明,但上述描述以及后续示例仅用于说明之目的,而非限制本发明的范围。本发明范围内的其他方面、优点和修改对于本发明所属领域的技术人员来说是显而易见的。
附图说明
10.结合附图阅读以下详细说明,可获得对本发明最全面的理解。需要强调的是,根据惯例,附图的各种特征并非是按比例绘制的。相反,为了清楚起见,可任意扩大或缩小各个特征的尺寸。附图中包括以下图示:
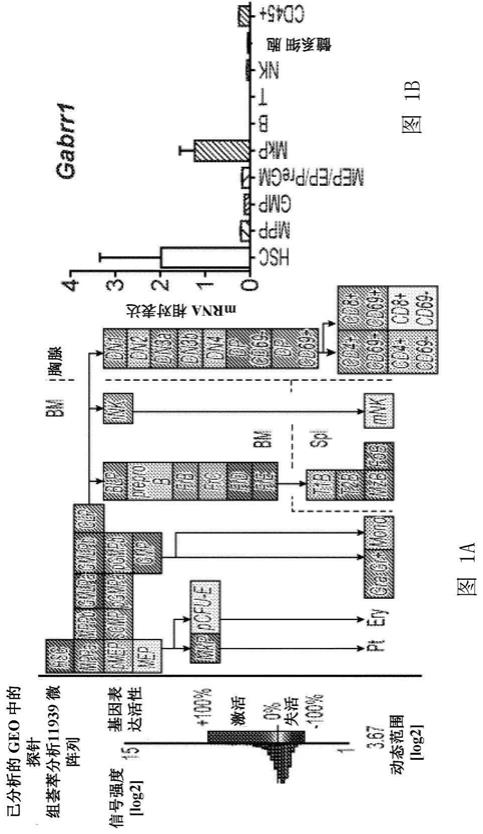
11.图1a-1k.图1a gabrr1在小鼠造血系统中的表达和功能。gabrr1在gene expression commons不同小鼠造血群体中的表达。图1b gabrr1在不同小鼠hspc群体中的基因表达分析(通过实时pcr进行)。显示的数据是同一组三次平行测定得到的平均值
±
sd,并且是至少三项独立实验的代表性数据。图1c gabrr1在小鼠骨髓来源hspc中的表达分析(通过多色流式细胞术进行)。数字表示gabrr1+细胞所占百分比。显示的数据是n=6只小鼠的代表性数据。图1d用于利用膜片钳记录gaba诱发电流的gr+mkp的代表性图像。图1e通过在不同膜电位(起始膜电位为-80mv,步长为20mv)下钳制的gr+和gr-mkp中应用1mm gaba诱导的代表性电流迹线。图1f-1g.gr+和gr-mkp(f)以及gr+和gr-hsc的最大电流密度和细胞电容的汇总图。图1g-1h gr+mkp和gr+hsc峰值电流密度的i-v曲线(x轴显示钳制电压;y轴显示电流密度(峰值电流/细胞电容))。图1i.免疫染色分析显示gad65+gad67、gaba、vgat、h2和突触素(sp4)在生长板/骨骺中的表达。j).不同部位的小鼠组织切片用五色染法染色。图1k.通过实时pcr分析纯化小鼠gr+和gr-hsc和mkp中的hsc和mkp相关基因。图1f和1g中所示数据是平均值
±
sem。已分析的细胞数目请见条形图。**p《0.01。比例尺,20μm(图1d),50μm(i中图),100μm(图1i左图和右图、图1j下图),200μm(j上图)。
12.图2a-2g.gabrr1活化或失活对小鼠hspc分化的影响。图2a将gr+hsc(n=8只小鼠)或gr-hsc(n=7只小鼠)移植到原代受体体内后16周时的嵌合百分比。每一列代表一只单独的小鼠。图2b骨髓细胞、b细胞、t细胞和nk细胞在原代移植中的平均供体谱系贡献。误差条表示s.d.。图2c来自供体小鼠的hspc群体在受体中起贡献作用的频率。图2d b6;129s4-gabrr1
tm1llu
/j小鼠及其近似对照动物wt b6129sf2/j小鼠外周血中的全血细胞计数。对于各细胞计数,将来自wt小鼠的相应数目设为1,据此将来自gabrr1 ko小鼠的相应数目标准化。图2e接受gabrr1激动剂或拮抗剂给药的小鼠的外周血中的血细胞计数。wbc,白细胞;mono,单核细胞;hgb,血红蛋白;gran,粒细胞;lym,淋巴细胞;plt,血小板;rbc,红细胞。对于各细胞计数,将来自wt小鼠的相应数目设为1,据此将来自接受其他给药方案的小鼠的相应数目标准化。图2f,2g来自接受gabrr1激动剂或拮抗剂给药的小鼠的骨髓的小鼠hspc汇总。对于各hspc群体,将来自wt小鼠的相应数目设为1,据此将来自接受其他给药方案的小鼠的相应数目标准化。图2d、2e和2f中所示数据是同一实验中各个小鼠分组(每组n=6)的平均值
±
sd。*p《0.05,**p《0.01,***p《0.001。
13.图3a-3h.gabrr1表达以及gabrr1在人造血系统中消融或过表达的后果。图3a gabrr1在人骨髓来源hspc中的表达分析(通过多色流式细胞术进行分析)。数字表示gabrr1+细胞所占百分比。图3b gabrr1在人hspc群体中的基因表达分析(通过实时pcr分析进行)。显示的数据是平均值
±
sd。图3c通过实时pcr分析纯化gr+hsc、gr-hsc、gr+mkp和gr-mkp中
的hsc和mkp相关基因。图3d对人lin-cd34+、lin-cd34+gr+、lin-cd34+gr-细胞体外分化后得到的hpsc亚群的流式细胞术分析。图3e由lin-cd34+、lin-cd34+gr+或lin-cd34+gr-细胞产生的cfu-mk集落。图3f cd34+cd41+细胞(mkp)和cd34+cd71+细胞(ep)从gabrr1基因敲除或过表达的纯化cd34+细胞中分化出来7天后的变化。将源自未经处理的wt细胞的各hspc群体所占百分比设为1,据此将源自接受其他处理的相应细胞的各hspc群体所占百分比标准化。图3g由gabrr1基因敲除或过表达的cd34+骨髓细胞产生的cfu-mk集落。gr-ko,gabrr1基因敲除;gr-o,gabrr1过表达。图3h人hspc亚群从gabrr1过表达的骨髓cd34+细胞中分化出来7天后的相应变化量化情况(通过多色流式细胞术进行分析)。将源自未经处理的细胞的各hspc群体所占百分比设为1,据此将源自gabrr1过表达细胞的各hspc群体所占百分比标准化。显示的数据是至少三项独立实验的代表性数据。误差条表示sd。*p《0.05,**p《0.01,***p《0.001。
14.图4a-4f.gabrr1激动剂和拮抗剂对人hspc分化的影响。图4a经gabrr1激动剂或拮抗剂处理的7天分化cd34+细胞中cd34+cd41+(mkp)和cd34+cd71+(ep)所占百分比的流式细胞术分析。图4b经gabrr1激动剂或拮抗剂处理的7天分化cd34+细胞中cd34+cd41+(mkp)和cd34+cd71+(ep)所占百分比的量化情况。将源自未经处理的细胞的各hspc群体所占百分比设为1,据此将源自接受其他处理的相应细胞的各hspc群体所占百分比标准化。图4c-4d).人hspc亚群从接受gabrr1激动剂或拮抗剂处理的cd34+骨髓细胞中分化出来7天后发生的变化的流式细胞术分析(图4c)和量化情况(图4d)(通过多色流式细胞术进行)。将源自未经处理的细胞的各hspc群体所占百分比设为1,据此将源自接受其他处理的相应细胞的各hspc群体所占百分比标准化。图4e对源自经gaba处理的cd34+骨髓细胞的7天分化细胞中巨核系和/或红系细胞相关基因的基因表达分析(通过实时pcr进行)。图4f由经gabrr1激动剂或拮抗剂处理的cd34+骨髓细胞产生的cfu-mk集落。图4b、4d、4e和4f中所示数据是至少三项独立实验的平均值
±
sd。*p《0.05,**p《0.01,***p《0.001。
15.图5a-5g.图5a gexc分析展示了合并微阵列数据中小鼠造血细胞中gaba受体家族成员的基因表达模式。图5b gabrr1在小鼠骨髓单核细胞来源hspc中的表达分析(与图1c相关)。图5c.gabrr1在不同成熟血细胞中的表达分析。图5d gabrr1在免疫表型定义的hsc(phsc)、mppa和mppb以及其他hspc群体中的表达。数据是n=6只小鼠的代表性数据。图5e gexc分析展示了sanjuan-pla等人(2013年)报告的微阵列数据中gabrr1的基因表达模式。图5f gad1和gad2在不同造血细胞和生态位细胞群体中的表达(通过实时pcr进行分析)。数据表示为同一组三次平行测定得到的平均值
±
sd,并且是三项独立实验的代表性数据。图5g用于内皮细胞标志物(cd31和ve-钙黏素)和gad共表达的免疫染色。上图是阴性对照,展示了仅用二抗染色的情况。比例尺,50μm。
16.图6a-6e.图6a对纯化小鼠gr+hsc、gr-hsc、gr+mkp和gr-mkp中造血谱系相关基因的表达分析(通过实时pcr进行)。数字表示管家基因β-肌动蛋白的δct值。图6b对小鼠gr+hsc和gr-hsc体外分化后得到的hspc亚群的流式细胞术分析。显示的数据是来自同一组三个单独样本的平均值
±
sd,并且是至少三项独立实验的代表性数据。图6c将gr+hsc(n=8只小鼠)或gr-hsc(n=7只小鼠)移植到原代受体体内后4、8和12周时的嵌合百分比。图6d-6e.再次移植后的多谱系重建证实了纯化细胞的hsc特性。每一列代表一只单独的小鼠。
17.图7a-7b.图7a对b6;129s4-gabrr1
tm1llu
/j小鼠(下图)及其近似对照动物
b6129sf2/j(上图)中hspc群体变化的多色流式细胞术分析。图7b对接受gabrr1激动剂或拮抗剂给药的小鼠中骨髓hspc亚群变化的流式细胞术分析(通过多色流式细胞术进行)。
18.图8a-8e.图8a多色流式细胞术中人hspc亚群的门控策略以及hspc群体在分化之前与分化7天后的变化。数据是至少三项独立实验的代表性数据。图8b对gabrr1基因敲除或过表达的7天分化cd34+细胞中cd34+cd41+(mkp)和cd34+cd71+(ep)所占百分比的流式细胞术分析(分别以未经处理或gfp转导细胞作为对照)。图8c-8d.gabrr1基因敲除(图8c)或过表达(图8d)并分化7天后骨髓cd34+中gabrr1、巨核系和/或红系细胞相关基因的基因表达分析(通过实时pcr进行)。显示的数据是同一组三次平行测定得到的平均值
±
sd,并且是至少三项独立实验的代表性数据。图8e对gabrr1过表达的骨髓cd34+细胞分化7天后得到的人hspc的多色流式细胞术分析。数据是至少三项独立实验的代表性数据。gr-o,gabrr1过表达;gr-ko,gabrr1基因敲除。
具体实施方式
19.为了更容易理解本发明内容,下文以及整个说明书中定义了某些术语和短语。本文提供的定义是非限制性的,并且应该基于所属领域技术人员在发明发布时所知晓的内容来解读。
20.在描述本发明的方法和组合物之前,应当理解,本发明不限于所描述的特定方法或组合物,因为在实际实施中一定会存在差异。还应当理解,本文中使用的术语仅用于描述特定实施例,而无意限制本发明构思,本发明的范围将仅由所附权利要求书限定。
21.在提供数值范围的情况下,应当理解,该范围的上限和下限之间的每个中间值都明确地公开。除非上下文另有明确规定,否则每个中间值应低至下限单位的十分之一。本发明涵盖了在所述范围内的任何所述值或介入值与在所述范围内的任何其他所述值或介入值之间的每个较小范围。这些较小范围的上限和下限可独立地包括在所述范围内或排除在所述范围外,并且本发明也涵盖一个限值、无限值或两个限值包括在所述较小范围内的各范围,同时需遵守所述范围内任何特别排除的限值的要求。在所述范围包括一个或两个限值的条件下,排除了那些所包括限值中的任一个或两个的范围也包括在本发明内。
22.除非另有定义,否则本文所用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。尽管与本文所描述的方法和材料类似或等同的方法和材料也可用于本发明的实施或测试中,但下文描述了一些潜在和首选的方法和材料。本文提及的所有出版物均以引用方式并入本文,以公开和描述与所引用出版物有关的方法和/或材料。应当理解,当存在矛盾时,本发明内容应取代所引用出版物中的任何公开内容。
23.应当注意的是,如本文和所附权利要求书中所使用的单数形式的“一”、“一个”和“所述/该”包括复数指代对象,除非上下文另有明确说明。因此,举例而言,“一个细胞”的指代对象包括多个此类细胞,而“所述肽”指的是一种或更多种药剂及所属领域技术人员已知的等效物,例如多肽,等等。
24.本文所讨论的出版物仅供在本专利的申请日之前披露。本文中无任何内容可以解释为承认由于之前的发明使得本发明无权早于此类出版物。此外,所提供的出版日期可能与实际出版日期不同,可能需要单独确认。
25.术语“受体”、“个人”、“受试者”、“宿主”和“患者”在本文中可互换使用,指的是需
要诊断、治疗或疗法治疗的任何哺乳动物受试者,尤其是人类。用于治疗目的“哺乳动物”是指分类为哺乳动物的任何动物,包括人类、家畜和农场动物,以及动物园动物、竞技动物或宠物,例如狗、马、猫、牛、绵羊、山羊、猪等。在一些实施例中,所述哺乳动物是人类。
26.本文中使用的“治疗有效量”是指足以预防、治疗或控制疾病或病症的治疗剂(例如gabrr1激动剂)的量。治疗有效量可以指足以延迟或最大限度地减少疾病发作(例如,延迟或最大限度地减少放射、化疗等引起的血小板减少症的发生)的治疗剂的量。治疗有效量也可以指在疾病的治疗或管理中提供治疗益处的治疗剂的量。此外,关于本发明治疗剂的治疗有效量是指单独或与其他疗法组合的治疗剂的量,其在疾病的治疗或管理中提供治疗益处。
27.本文中使用的术语“预防”、“预防的”和“防止”是指通过施用预防剂或治疗剂而预防受试者中一种或更多种病症的复发或发作。
28.本文中使用的术语“组合”是指使用一种以上的预防剂和/或治疗剂。术语“组合”的使用不限制患有病症的受试者施用预防剂和/或治疗剂的顺序。可以在(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之前)之前施用第一预防剂或治疗剂,伴随或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周后)向患有病症的受试者施用第二预防剂或治疗剂。
29.巨核细胞。巨核细胞(mk)会产生血小板,而血小板在受伤部位凝块形成中具有活性。mk是源自骨髓中存在的造血干细胞和祖细胞的多倍体细胞。通过使细胞质突起延伸穿过骨髓血窦,mk每天释放~1
×
10
11
血小板进入血流以维持循环血小板计数。血小板数量减少或血小板减少症可能在骨髓衰竭(遗传性或获得性,例如癌症后治疗)或创伤或手术后严重外周出血之后发生,且可能引起危及生命的出血。
30.目前,预防性和治疗性疗法主要依赖于输注浓缩血小板,然而,高剂量癌症治疗的增加、先进的外科手术和人口老龄化导致对血小板的需求不断增加。此外,hlai类同种免疫性长期输血患者和经产妇的难治性血小板输注需要专门提供匹配的血小板单位,这些血小板单位源自一小群基因分型的可召回供体。
31.造血细胞的分化可以向下追溯至特定谱系,也可以回溯至造血干细胞,其特征在于自我更新能力和多能分化潜能。这种罕见的血细胞亚群在个体的一生中都能提供外周血细胞。髓系/淋巴系分岔被认为是在分化过程中的多能祖细胞(mpp)内发生,其中所述髓系祖细胞进一步丧失分化为粒细胞/巨噬细胞和红细胞谱系的潜力,最终产生共同髓系祖细胞(cmp)、mep和单能mkp。但是,本文所述的方法不受特定谱系理论限制,可以应用于hsc据此分化为mk细胞的任何途径中。
32.根据本文所述的方法增强巨核细胞和血小板产生的因素可以使hsc和源自其的祖细胞向髓系和巨核细胞谱系分化;和/或可使mkp细胞的增殖和血小板的产生增加。本文中使用的术语“造血干细胞和祖细胞”可以包括但不限于造血干细胞、多能祖细胞、共同髓系祖细胞、巨核系-红系祖细胞、巨核系祖细胞等。请参见,例如,chao等人,冷泉港定量生物学研讨会,2008年,73:439-449;其内容以引用方式明确并入本文。
33.gabaa-ρ受体(也称为gaba-ρ、gabac、gabrr受体)是由ρ亚单位组成的同型五聚体
羟基-磷杂环戊烷(3-gohp);4-氨基环戊-1-烯甲酰胺(4-acpam);4-氨基-n-羟基环戊-1-烯甲酰胺(4-acpha);等等。
40.gaba激动剂的药学上可接受的盐用于所揭示目的的用途也包括在本发明范围内。它们还可以与碱结合形成酸加成盐和盐。此类盐是特别的药学上可接受的酸加成盐以及与碱结合形成的药学上可接受的盐。用于形成此类盐的合适的酸包括,例如,无机酸(例如盐酸、氢溴酸、硫酸或磷酸)或有机酸(例如有机磺酸和有机羧酸)。激动剂与碱结合形成的盐是,例如,碱金属盐(例如,钠盐或钾盐)或碱土金属盐(例如,钙盐或镁盐)以及铵盐(例如含氨或有机胺的盐)。
41.激动剂的光学异构体用于所揭示目的的用途也包括在本发明范围内。由于不对称碳原子的存在,许多已知的激动剂(例如巴氯芬和(3-氨基-2-(s)-羟丙基)甲基次膦酸)是手性化合物。依据不对称原子的存在情况,所述激动剂可以是异构体混合物,尤其可以是外消旋体,也可以是纯异构体,尤其可以是对映体。
42.为了用作巨核细胞生成的调节剂/刺激剂和血小板减少症的治疗剂,gaba受体激动剂可以适合于已知gaba 受体激动剂能够对其起效的其他病症的剂量使用。活性物质的典型日剂量变化范围广泛,并且取决于各种因素,例如每例患者的个体需求和给药途径。通常情况下,剂量范围为每天每公斤体重1μg至100mg,优选地为每天每公斤体重10 μg至10mg,更优选地为每天每公斤体重100μg至50mg。
43.临床应用时,本发明的化合物被配制成用于口服、直肠给药、肠胃外给药、经皮给药或以其他方式给药的药物制剂。所述药物制剂含有与一种或更多种药学上可接受的成分组合的本发明的化合物。所述载体可以是固体、半固体或液体稀释剂或胶囊。这些药物制剂是本发明的进一步目标。通常所述活性化合物的量为0.1-95%(按所述制剂重量计),肠胃外给药时优选地为0.2-20%(按所述制剂重量计),口服给药时优选地为1-50%(按所述制剂重量计)。
44.在用于口服给药的剂量单位形式的含有本发明的化合物的药物制剂的制备中,所选择的所述化合物可以与固体粉末状成分(例如乳糖、蔗糖、山梨醇、甘露醇、淀粉、支链淀粉、纤维素衍生物、明胶或其他合适成分)以及崩解剂和润滑剂(例如硬脂酸镁、硬脂酸钙、硬脂富马酸钠和聚乙二醇蜡)混合。然后,将所述混合物加工成颗粒或压成片剂。
45.软明胶胶囊可以用含有由本发明的活性化合物、植物油、脂肪或其他适用于软明胶胶囊的载体组成的混合物的胶囊制备。硬明胶胶囊可以含有由活性化合物组成的颗粒。硬明胶胶囊还可以含有活性化合物与固体粉末状成分,例如乳糖、蔗糖、山梨醇、甘露醇、马铃薯淀粉、玉米淀粉、支链淀粉、纤维素衍生物或明胶。
46.用于直肠给药的剂量单位可以制成(i)栓剂形式,其中含有与中性脂肪基料混合的活性物质;(ii)直肠用明胶胶囊形式,其中含有与植物油、石蜡油或其他适用于直肠用明胶胶囊的载体混合的活性物质;(iii)现成的微型灌肠剂形式;或(iv)给药前在合适的溶剂中复溶的干燥微型灌肠制剂形式。
47.用于口服给药的液体制剂可以制成糖浆或悬浮液形式,例如含有0.2%至20%(按活性成分重量计)的溶液或悬浮液,其余成分由糖或糖醇以及乙醇、水、甘油、丙二醇和聚乙二醇的混合物组成。如有需要,此类液体制剂可以含有着色剂、调味剂、糖精和羧甲基纤维素或其他增稠剂。用于口服给药的液体制剂也可以制成干粉形式,在使用前用合适的溶剂
复溶即可。
48.用于肠胃外给药的溶液可以制成本发明的化合物溶于药学上可接受的溶剂形成的溶液,优选浓度为0.1%至10%(按重量计)。这些溶液还可以含有稳定成分和/或缓冲成分,并以安瓿瓶或小瓶的形式分配成单位剂量。用于肠胃外给药的溶液也可以制成干制剂,在使用前用合适的溶剂临时复溶即可。
49.治疗和预防用途
50.在一些实施例中,提供了用于治疗或预防血小板减少症的方法,所述方法包含向患有血小板减少症或有发展为血小板减少症的风险的个体给药。向个体提供有效剂量或剂量方案的gabrr1激动剂,增加巨核细胞和血小板的产生量,从而缓解血小板减少症。
51.血小板减少症的预防或治疗可以升高活性血小板水平为目标。这意味着激动剂给药后血小板数量要多于给药前。有效增加受试者的血小板计数的量是使得循环血小板水平的量增加的量。实际达到的血小板水平将取决于许多变量,例如受试者免疫系统的初始状态,即受试者是否患有轻度至重度血小板减少症(例如,由自身免疫疾病或脾隔离症引起)。
52.一般而言,患有严重血小板减少症的受试者的血小板水平起初会非常低。此类受试者的血小板水平的任何增加,甚至增加至仍低于正常水平的水平,都可能对受试者有利,因为与此同时会上调血小板功能。抑制剂的施用旨在使血小板数量增加至少20、50、75或100%。依据个体的初始状态(严重或轻微血小板减少症或正常血小板数量),个体将在施用抑制剂后表现出轻微血小板减少症、正常血小板数量或正常水平的血小板数量)。或者,更具体而言,在预防血小板减少症的情况下,例如与化疗联合或在化疗之前,施用gagrr1激动剂的目的在于维持活性血小板数量(即防止因化疗而出现预期的血小板数量显著减少)。这些方法可以,例如,将血小板计数增加到至少20-50
×
103/μl、至少50-100
×
103/μl、至少100-150
×
103/μl,甚至达到基本正常水平。治疗后可以监测测量结果以确定功效。
53.本文中使用的“血小板减少症”是受影响个体出现的血小板水平由于产生分布紊乱或遭到破坏而低于所述个体的正常血小板数量范围的任何病症。人类正常血小板水平范围为每微升外周血约150,000至300,000个。血小板水平为每微升100,000个时,即使进行大手术,患者也未见异常出血;血小板计数为每微升50,000至100,000个时,出现严重创伤的情况下,患者的出血时间可能长于正常出血时间;血小板计数为每微升20,000至50,000个时,轻微创伤便会引起出血,但自发性出血并不常见;血小板计数低于每微升20,000个时,患者可能发生自发性出血;血小板计数低于每微升10,000个时,患者有较高风险出现严重出血。
54.血小板减少症还指与于某个参考时间点在个体中测得的血小板数量相比时所述个体的血小板数量减少的情况。与所述参考时间点的值相比,所述个体中血小板数量减少可以是减少超过20%、30%、40%、60%、80%、90%、95%,甚至更多。在某些个体中,与于某个参考时间点测得的血小板数量相比血小板数量减少伴有出血改变,而在其他个体中,类似减少不伴有出血改变。提到的参考时间点可以是,例如,治疗开始,例如放疗或化疗。
55.血小板减少症包括感染诱发的血小板减少症、治疗诱发的血小板减少症等。治疗诱发的血小板减少症是由治疗性疗法引起的,例如伽马辐照、治疗性辐射暴露、细胞毒性药物、含有苯或蒽的化学物质以及其他药物,例如氯霉素、硫脲嘧啶和巴比妥类安眠药。“其他类型的血小板减少症”包括特征为外周血中血小板水平偏低的病症,其由除引起血小板减
少症的传染原或治疗性疗法以外的任何机制引起。导致出现这种类型的血小板减少症的因素包括但不限于罕见的骨髓疾病(例如先天性无巨核细胞性发育不良和血小板减少伴桡骨缺失综合征(tar综合征))、脾脏大小增加或脾肿大(由门静脉高压引起,继发于肝病)或巨噬细胞贮积症(例如戈谢病)、自身免疫性疾病(例如特发性或免疫性血小板减少性紫癜(itp))、血管炎、溶血性尿毒症综合征、血栓性血小板减少性紫癜(ttp)、弥散性血管内凝血(dic)和人工心脏瓣膜。迄今为止,itp是这组血小板减少症中最常见的类型。
[0056]“患有血小板减少症的受试者”是指患有任何类型的血小板减少症的受试者,包括但不限于非化疗诱发的血小板减少症或化疗诱发的血小板减少症。“有发展为血小板减少症的风险的受试者”是指患上或发展为血小板减少症的可能性较高的受试者。例如,接受化疗治疗的恶性肿瘤患者有发展为治疗诱导的血小板减少症的风险,而暴露于传染原的风险增加的受试者有发展为感染诱导的血小板减少症的风险。
[0057]
包含有效量的gabrr1激动剂的用于诱导血小板产生的组合物可以与药学上可接受的稀释剂、载体或赋形剂混合。这种分子刺激血小板产生的特性使其成为治疗急性血小板减少症患者的有效辅助手段,例如,由于各种癌症的化疗或放疗引起的急性血小板减少症。
[0058]
术语“药物”是指包含上述分子和药学上可接受的载体或赋形剂(这两个术语可以互换使用)以治疗上述疾病的组合物。“药物”可以通过技术人员知识范围内的任何合适的方法施用。优选的给药途径是肠胃外给药。对于肠胃外给药,本发明的药物将与上文定义的药学上可接受的赋形剂一起配制成单位剂量可注射形式,例如溶液、悬浮液或乳剂。但是,所述剂量和给药方式将取决于个体。通常情况下,所述药物的施用使得所述化合物以0.1μg/kg至10mg/kg的剂量作为推注剂量或通过连续输注给予,包括通过渗透微型泵实现连续皮下递送。
[0059]
体外应用
[0060]
体外培养时,本文所述的用于增强巨核细胞产生的方法也可用于增强干细胞来源巨核细胞和mkp细胞(例如,hsc、ipsc等)和/或造血祖细胞(例如mpp、cmp、mep等)的产生。
[0061]
所述细胞群体可以在各种培养条件下体外生长。培养基可以是液体或半固体,例如含有琼脂、甲基纤维素等。所述细胞群体可以适宜的方式悬浮于适当营养培养基中,例如iscove改良dmem或rpmi1640,通常补充有胎牛血清(约5-10%)、谷氨酰胺、硫醇,尤其是2-巯基乙醇和抗生素,例如青霉素和链霉素。
[0062]
所述培养物可以含有所述细胞对其有反应的生长因子。本文所定义的生长因子是指能够通过对跨膜受体所起的特异性作用促进细胞在培养物中或完整组织中的存活、生长和/或分化的分子。生长因子包括多肽和非多肽因子。对于标的细胞,特别受关注的是促进血小板生成的因子,包括血小板生成素。可用于培养标的细胞的特定生长因子包括青灰因子(c-kit配体)、flk-2配体、il-11、il-3、gm-csf、红细胞生成素和血小板生成素。选择特定培养条件以实现特定目的,即分化成巨核细胞、维持祖细胞活性等。除所述因子本身外,所述因子可以通过模拟物、结合同源受体的抗体等表现出活性。例如,许多血小板生成素模拟物是本领域已知的模拟物。duffy等人(2002年,药物化学杂志,45(17):3576-8)鉴定了血小板生成活性的药效团;cwirla等人(1997年,科学,276:1696)描述了具有高度活性的血小板生成素模拟物。除生长因子外,或者作为生长因子的替代方法,标的细胞可以与基质细胞或
成纤维细胞饲养层细胞在共培养物中培养生长。适用于造血细胞生长的基质细胞是本领域已知的细胞。
[0063]
所述祖细胞可以与培养系统一起用于分离和评估与巨核细胞和血小板的分化和成熟相关的因子。因此,所述祖细胞可用于测定法中,以测定培养基(例如条件培养基)的活性、评价流体的生长因子活性、参与谱系贡献等。
[0064]
可以将基因引入所述细胞(例如,hsc或ipsc)以用于各种目的,例如,置换具有丧失功能的突变、标志物等的基因。或者,引入表达反义mrna或核酶的载体,从而阻断非预期基因的表达。其他基因治疗方法是引入耐药基因,使正常祖细胞具有优势并受到选择压力,例如多重耐药基因(mdr)或抗凋亡基因,例如bcl-2。本领域已知的各种技术可用于转染靶细胞,例如,电穿孔、钙沉淀dna、融合、转染、脂质体转染等。引入dna的特定方式对于本发明的实践无关紧要。
[0065]
所得到的mkp或巨核细胞可用于移植以重建受体的血小板功能,例如用于治疗血小板减少症。所述细胞可以通过任何生理学上可接受的培养基施用,通常在血管内,但是它们也可以被引入任何其他适宜的部位,其中所述细胞可以找到合适的生长部位来再生和分化。通常,以至少1
×
104个细胞/公斤体重的剂量施用,并且可以105、106、107或更多个细胞/公斤体重的剂量施用。可以通过注射、导管等方式引入所述细胞。所述细胞可以在液氮温度下冷冻并长期储存,解冻后即可使用。冷冻后,所述细胞通常储存在10%dmso、50%fcs、40%rpmi 1640培养基中。一旦解冻,即可以通过使用与祖细胞增殖和分化相关的生长因子和/或基质细胞来扩增所述细胞。
[0066]
本发明现已得到充分描述,对于本领域普通技术人员而言显而易见的是,可以在不偏离本发明的精神或范围的情况下进行各种改变和修改。
[0067]
示例
[0068]
gaba受体gabrr1在造血干细胞和巨核系祖细胞上表达并在其中发挥作用
[0069]
gabrr1是gaba的rho亚单位受体,而gaba是哺乳动物大脑中的主要抑制性神经递质。对其功能的大部分研究都集中在神经系统上,其在造血过程中的调节作用此前未见报道。在这项研究中,我们发现gabrr1主要在人和小鼠造血干细胞(hsc)和巨核系祖细胞(mkp)的亚群上表达。gabrr1阴性(gr-)hsc相较于gabrr1阳性(gr+)hsc产生更高的供体来源造血嵌合。在膜片钳研究中,gr+hsc(而非gr-hsc)/mkp对gaba有反应。通过基因敲除或拮抗剂抑制gabrr1便能抑制mkp分化和血液中血小板数量的减少。gabrr1的过表达或用激动剂处理能显著促进mkp的生成和巨核细胞集落。因此,这项研究确定了神经系统与造血系统之间的联系,并提供了操纵gaba信号传导以用于血小板所需的临床应用的方法。
[0070]
我们设计的用于对特定微阵列平台进行探针组荟萃分析并分析微阵列上任何基因的绝对表达的gene expression commons已经建立了人和小鼠造血模型。在这项研究中,我们首先确定了gexc“小鼠造血”中所有gaba受体(α1-6、β1-3、γ1-3、δ、ε、θ、π、ρ1-3)的表达情况,并且发现mkp细胞群体是选择性gabrr1
+
,其他gaba受体在任何hspc群体中均不表达(图1a和图5a)。造血细胞群体的rt-pcr证实了其表达模式(图1b)。gabaa-ρ受体(gabrr1-3)是配体门控离子通道,其在视网膜、脊髓和大脑中发挥生理作用。gabrr1可以完全由同源或异源五聚体ρ亚单位组成。由于只有gabrr1表达,因此我们预计我们的造血细胞只能形成同源寡聚体。
[0071]
通过流式细胞术对小鼠骨髓进行的进一步分析表明,gabrr1主要在hsc(8.18%
±
1.53%)和mkp(3.04%
±
0.7%)的亚群上表达(图1c和图5b)。其他血系(cd45
+
)细胞呈阴性(图5c)gabrr1在免疫表型定义的hsc(phsc、cd34-flk2-cd150+kls)、mppa(cd34+flk2-cd150+kls)和mppb(cd34+flk2-cd150-kls)中的表达为1%-3%早期干细胞和祖细胞表达gabrr1(图5d)。此外,在血小板偏向hsc中检测到更高水平的gabrr1表达(图5e)。
[0072]
随后纯化gabrr1
+
(gr
+
)和gabrr1-(gr-)hsc或mkp细胞,并使用膜片钳技术通过电生理记录进行测试。钳制细胞在不同膜电位下被钳制,并与1mm gaba一起孵育(图1d)。在gr+mkp细胞中,我们观察到显著的gaba诱导内向电流,但在gr-细胞中未观察到这一情况(图1e-f)。同样地,虽然振幅似乎小于gr+mkp细胞中的振幅,但仍将gaba应用于gr+hsc来诱导显著电流(图1g-h)。总之,这些结果表明在hsc和mkp中表达的gabrr1具有离子通道功能。
[0073]
然后,我们试图确定骨髓中gaba的来源。我们分离出的hspc均未释放出可检测水平的gaba。由于谷氨酸脱羧酶1(gad1)和gad2能够通过谷氨酸合成gaba,因此我们通过实时pcr检测gad的表达来找寻gaba的骨髓细胞来源。在接受测试的所有细胞中,包括骨髓细胞混合物、hspc群体、成熟血细胞、骨骼谱系(tie2-alphav+)细胞、非骨骼和非内皮(tie2-alphav-)及所有tie2+细胞
21
,仅源自骨髓细胞悬液部分的tie2+细胞通过实时pcr分析显示表达gad(图5f)。tie2标记罕见的hsc、早期内皮祖细胞和成熟内皮细胞,可能还标记其他尚未归入谱系的细胞。
[0074]
由于细胞悬液可以排除一些无蒂细胞,因此我们将小鼠骨骼切片并使用通常用于检测潜在gaba能细胞的抗血清对gad进行原位免疫荧光染色。生长板和股骨骨骺处gad阳性细胞的浓度最高(图1i-j)。更多的染色表明在同一区域也可以检测到gaba和囊泡gaba转运蛋白(vgat)。然而,gad与内皮细胞表面标志物(包括cd31和ve-钙黏素)的共染色表明只有非常罕见的双阳性细胞(图5g),因此tie2+细胞通常不属于内皮细胞。骨骺中的gad+细胞类似于软骨祖细胞。突触素可以用sp4的抗血清检测(图1i),在这项研究中,我们也在骨骺中检测到一些阳性细胞,但这些细胞无神经元形态。这些结果表明,骨骼和骨髓中的非神经细胞是产生和释放gaba的候选者,但无法明确哪些细胞是gaba能细胞。
[0075]
我们分离了gr+和gr-hsc以及mkp,并通过实时pcr鉴定了基因表达模式。我们探究了hsc和mkp共享转录本、hsc、mep、mkp、髓系、红系、淋巴系和血小板谱系相关基因的表达,发现gr+和gr-hsc或mkp细胞都表达了相应的细胞谱系特异性基因(图1k和图6a)。gr-hsc和gr-mkp群体保持高于gr+群体的多能基因表达水平,而gr+群体表现出更高的髓系、血小板和红系基因表达水平,并且它们都不表达淋巴系基因(图1k和图6a)。gr+和gr-hsc体外分化后,流式细胞术分析显示gr-细胞含有较多的祖细胞,这与基因表达分析结果一致(图6b)。
[0076]
然后,我们通过hsc移植表征了表达gabrr1的细胞和阴性细胞。源自cd45.2c57bl/6小鼠的gr+和gr-hsc与支持cd45.1骨髓细胞一起移植到受辐照的cd45.1小鼠受体中。图2a-b和图6c中所示的结果表明,gr-hsc相较于gr+hsc具有更高的完整多谱系重建能力。移植后二十周,gr-hsc移植小鼠中hsc、mpp、mkp、gmp和ep的相应频率更高(图2c)。再次移植表明,gr-hsc具有强大的多谱系嵌合能力,表明它们是长期hsc(图2d-e)。
[0077]
为了进一步了解gabrr1如何参与造血调节,我们使用了gabrr1基因敲除小鼠b6;129s4-gabrr1tm1llu/j(gr-/-小鼠),并使用了b6129sf2/j杂交杂交小鼠作为对照。gr-/-小鼠的血小板水平显著降低(87.7%
±
4.92%),而gr-/-小鼠中的wbc、lym、hgb和rbc无显著变
化(图2d)。在c-kit富集hspc中,gr-/-小鼠中的hsc减少到这些对照小鼠相应水平的50%,而与对照组相比,c-kit富集骨髓细胞中存在的mkp减少了13%
±
2.6%(图2e和图7a)。
[0078]
然后,我们探究了gabrr1激动剂和拮抗剂在c57bl/6j小鼠中的作用,包括激动剂gaba、taca、蝇蕈醇和拮抗剂sr95531。给药7天后,我们发现gaba给药使血小板数量增加了17.7%
±
11.2%,蝇蕈醇和taca给药分别使血小板数量增加了35.0%
±
13%和24.6%
±
19.0%(图2f)。这些给药方案使得rbc数量略有增加。sr95531对血小板数量无显著影响(图2f)。几种不同的激动剂治疗方案使骨髓mkp增加,包括:gaba使mkp增加了63.7%
±
24.4%、蝇蕈醇使mkp增加了55.0%
±
26.7%,taca使mkp增加了23.3%
±
31.1%。hsc和mpp也得到显著增加,增加量为1.5-2.5倍。有趣的是,ep和pre cfu-e也有所增加,这与外周血中rbc增加的情况一致(图2g和图7b)。
[0079]
为了研究gabrr1在人造血中所起的作用,我们通过facs探究了gabrr1细胞表面蛋白的表达情况。gabrr1主要在人hsc/mpp(3.45%
±
1.0%)、cmp(1.82%
±
0.34%)和mkp(1.60%
±
0.16%)中表达(图3a)。rt pcr分析证实了这一结果(图3b)。在gr+和gr-hsc/mpp或mkp细胞中通过rt pcr进行的hsc或mkp基因表达分析显示出与小鼠hspc相似的模式,并且在gr-细胞中表现出更高的多能基因表达水平(图3c)。接下来,我们在体外分化了lin-cd34+gr+和lin-cd34+gr-细胞。结果显示,lin-cd34+gr-细胞包括的祖细胞更多(图3d)。功能性巨核细胞集落形成测定显示,gr-lin-cd34+细胞比gr+lin-cd34+细胞产生更多的mk集落(图3e)。这些结果表明,在小鼠和人类中,gabrr1影响着hsc多能性和巨核细胞分化。
[0080]
然后,我们通过慢病毒介导的基因敲除和过表达对gabrr1表达水平进行了遗传操作。首先,crispr/cas9介导的基因敲除用于消除gabrr1表达。pcr分析证实其在cd34+细胞中的表达水平降低(图8c)。然后,通过在体外补充细胞因子tpo、hscf、hil3、hil6和flt3来培养和分化cd34
+
细胞(图8a)。cd34
+
cd41
+
(选择性mkp/巨核细胞标志物)和cd34
+
cd71
+
(选择性ep/红细胞标志物)细胞均减少了30-40%(图3f和图8b)。
[0081]
gabrr1在人cd34+细胞中的过表达使得cd34+cd41+和cd34+cd71+群体显著增加,增加量约为3-4倍(图3f和图8b)。利用rt pcr分析,我们分析了gabrr1基因敲除和过表达细胞中巨核系相关基因、红系基因和两种谱系基因的基因表达水平。结果表明,这些基因的rna表达在gabrr1过表达细胞中显著增强,而在gabrr1基因敲除细胞中则有所降低(图8c-d)。起初有10,000个cd34+细胞,而后我们从gabrr1过表达细胞中获得了52个巨核细胞集落,从gabrr1基因敲除细胞中获得了8个相应集落,从非病毒处理对照细胞中获得了30个相应集落,并从载体对照转导组中获得了20个相应集落(图3g)。
[0082]
由于hsc分化为mkp涉及几个步骤,因此我们接下来需要确定gabrr1在哪个阶段起作用。通过分析gabrr1过表达细胞中hspc群体的相应频率(图3h和图8e),我们发现,hsc/mpp增加到263.6%
±
51.6%,并且几乎所有下游后代也有所增加(cmp增加到267.3%
±
53.6%,mep增加到263.3%
±
68.7%,mkp增加到254.5%
±
92.6%,ep增加到423.2%
±
67.7%)。这些结果表明,gabrr1在分化早期影响mkp的产生。
[0083]
我们用不同的gabrr1激动剂和拮抗剂处理人cd34+细胞。cd34+cd41+和cd34+cd71+群体在gabrr1激动剂(gaba、taca和蝇蕈醇)处理下增加了约2-4倍,但在gabrr1拮抗剂sr95531处理下显著减少(图4a-b)。gaba是最有效的治疗方案,可将mkp提高到168.9%
±
41.0%。其他激动剂也使mkp的相应频率增加1.5-2倍。拮抗剂sr95531使得所有接受测试的
hspc的相应频率,尤其是mkp的相应频率降低至40.3%
±
13.6%(图4c-d)。实时pcr分析表明,gaba能够显著增加巨核系相关基因(图4e),而其他激动剂也表现出类似效果。cfu-mk测定表明,gaba、蝇蕈醇和taca使巨核细胞集落增加了1-3倍,而sr 95531使其减少了40%(图4f)。这些结果表明,gabrr1介导的gaba信号传导可以调节人造血功能。
[0084]
迄今为止,对hsc分化为mkp的精确控制因素在很大程度上仍是未知的,而且目前也无任何有效的方法从hsc中生产出mkp以用于临床应用。在我们的研究中,我们已经确定了小鼠和人类mkp的潜在调节剂。我们发现gabrr1在hsc和mkp的亚群上表达。通过基因敲除或拮抗剂抑制gabrr1信号传导能显著降低巨核细胞和血小板分化,而gabrr1过表达或激动剂处理促进了巨核细胞谱系发育。
[0085]
已经报告了神经系统对造血功能的调节作用,这也是一个活跃的研究领域。在我们的研究中,我们确定了小鼠和人类神经产物gaba与造血系统之间全新的、保守的关联,并提供了一种通过操纵gabrr1介导的gaba信号传导产生mkp和血小板的新策略。
[0086]
参考文献。erdo,s.l.和wolff,j.r.哺乳动物大脑外的γ-氨基丁酸.神经化学杂志54,363-372(1990).seita,j.和weissman,i.l.造血干细胞:自我更新与分化.wiley跨学科评论:系统生物学与医学2,640-653,(2010).nakorn,t.n.、miyamoto,t.和weissman,i.l.小鼠克隆性巨核系祖细胞的表征.美国国家科学院院刊100,205-210(2003).klimchenko,o.等人.一种共同双能祖细胞在胚胎干细胞衍生的原始造血过程中产生红细胞和巨核细胞谱系.血液114,1506-1517,(2009).seita,j.等人.gene expression commons:适用于绝对基因表达谱的开放平台.plos one 7,e40321,(2012).olsen,r.w.和sieghart,w.国际药理学联合会.lxx.γ-氨基丁酸(a)受体的亚型:基于亚单位组成、药理学和功能的分类.更新.药理学评论60,243-260,(2008).sim,x.、poncz,m.、gadue,p.和french,d.l.了解巨核细胞来源血小板的生成:对体外衍生血小板的影响.血液127,1227-1233,(2016).moreau,t.等人.通过化学定义的正向编程利用人多能干细胞大规模生产巨核细胞.自然-通讯,7,11208(2016).boitano,a.e.、de lichtervelde,l.、snead,j.l.、cooke,m.p.和schultz,p.g.基于图像的屏幕鉴定巨核细胞生成的小分子调节剂.美国国家科学院院刊109,14019-14023,(2012).berridge,m.v.、ralph,s.j.和tan,a.s.干细胞-巨核细胞-血小板谱系的细胞谱系抗原与血小板iib-iiia糖蛋白复合物有关.血液66,76-85,(1985).mori,y.、chen,j.y.、pluvinage,j.v.、seita,j.和weissman,i.l.人红细胞谱系特化祖细胞的前瞻性分离.美国国家科学院院刊112,9638-9643,(2015).
[0087]
材料和方法
[0088]
小鼠。c57bl/6j、b6.sjl-ptprca pepcb/boyj、b6;129s4-gabrr1tm1llu/j和b6129sf2/j小鼠购自杰克逊实验室(the jackson laboratory),并根据nih指南在我们的动物设施中饲养。将年龄相似(6-10周龄)的雄性小鼠用于实验。所有动物方案均已获得斯坦福大学实验室动物护理小组(administrative panel on laboratory animal care)批准。
[0089]
质粒。lenticrispr v2质粒购自addgene。设计gabrr1的sgrna并将其克隆到一体化crispr慢病毒载体中。pcdh-mscv-mcs-ef1-gfp+puro cdna克隆表达载体(cd713b-1)购自sbi。gabrr1 cdna(nm_001256703.1)由pdonr223克隆而来,pdonr223购自dnasu并嵌入mscv启动子。无gabrr1 cdna的相同空白载体用作载体对照。
[0103]
pre cfu-e:lin-c-kit+sca1-cd41-fcgrii-endogilin+cd150+
[0104]
mep:lin-c-kit+sca1-cd41-fcgrii-endogilin-cd150+。
[0105]
人骨髓或脐带血细胞以类似方式染色,使用大鼠igg进行封闭,并使用pi进行活力测定。人细胞用抗体混合物染色,具体如下:cd34、cd38、cd45ra、cd123、cd71、cd105、cd41和谱系标志物cd2、cd4、cd8、cd11b/mac-1、cd14、cd19、cd20、cd56和cd235a。gabrr1抗体也用于染色(bioss antibodies)。
[0106]
人造血干细胞和祖细胞群体的表面标志物混合物:
[0107]
hscs/mpps:lin-cd34+cd38-[0108]
mkp:lin-cd34+cd38+cd123-cd45ra-cd41+
[0109]
cmp:lin-cd34+cd38+cd123lowcd45ra-[0110]
mep:lin-cd34+cd38+cd123-cd45ra-[0111]
gmp:lin-cd34+cd38+cd123+cd45ra+
[0112]
ep:lin-cd34+cd38+cd123-cd45ra-cd71+cd150+。
[0113]
在分析和分选之前,使细胞通过70μm的粗滤器。在facs aria ii细胞分选仪(bd biosciences)上进行流式细胞术和细胞分选,并使用flowjo软件(bd biosciences)进行分析。
[0114]
rna分离和实时pcr。按照制造商的说明(qiagen),通过rneasy plus micro试剂盒和rneasy minelute cleanup试剂盒提取总rna。使用superscript
tm iii逆转录酶(thermofisher scientific)合成cdna。在7900快速实时pcr系统(applied biosystems)上使用fastgreen master mix(thermofisher scientific)进行实时pcr。在2%琼脂糖凝胶上对pcr产物进行分析。
[0115]
电生理学。全细胞电压钳记录由灌注于含氧acsf中的解离血细胞制成,其中含氧acsf含有以下物质(单位:mm):119nacl、26nahco3、10葡萄糖、1.25nah2po4、2.5kcl、2cacl2、1mgcl2、2丙酮酸钠和0.5抗坏血酸,ph 7.4。在红外微分干涉对比(ir-dic)视频显微镜(axioskop 2;zeiss)下观察细胞,细胞直径为5-10μm。使用硼硅玻璃(wpi)在两级垂直拉拔器(narishige)上拉拔贴片移液器(电阻为5-7mω)。细胞在范围为-80mv至60mv的不同膜电位水平下被电压钳制。移液器内部溶液含有(单位:mm):120cs-cl、20四乙铵-cl、20hepes、2egta、4mgatp、0.4nagtp、10磷酸肌酸。
[0116]
通过局部喷出饱和浓度为1mm的gaba来激活细胞上的所有功能性gabaar,从而诱发电流。以100ms的脉冲持续时间和5-10kpa的压力通过连接至picospritzer(美国俄亥俄州克利夫兰)的第二移液器(电阻为3-4mω)施加药物。
[0117]
gene expression commons。gene expression common拥有大量公开可用的微阵列数据,并针对特定微阵列平台进行探针组荟萃分析。gene expression commons小鼠造血干细胞和祖细胞中的gabrr1表达分析显示,在成年小鼠骨髓、脾脏和胸腺内的39个造血干细胞、祖细胞和成熟细胞群体中,gabrr1仅在巨核系祖细胞(mkp)中表达,这表明gabrr1可以在巨核细胞生成中发挥作用。
[0118]
免疫组化。根据我们斯坦福大学批准的aplac方案对骨骼成熟的8周龄雄性c57bl/6j小鼠(jax 000664)实施安乐死。立即分离股骨并在4℃下置于4%多聚甲醛中固定过夜。然后用pbs将股骨洗涤两次,并在4℃下置于4m edta中脱钙2周,每隔一天更换一次edta。脱
钙后,将股骨转移到30%蔗糖溶液中,在4℃下放置24小时。然后将组织包埋于oct化合物(scigen,4583)中并储存在-20℃下,直到进行低温切片。切取了8um组织切片。将组织切片储存在-20℃下,直到进行ihc。在室温下用0.25%triton x-100稀释于tbs形成的溶液将用于ihc的载玻片洗涤两次,每次5分钟。然后,在室温下,用5%抗驴抗体和5%抗山羊抗体封闭载玻片2小时,以减少二抗的非特异性结合。然后,将一抗(兔抗小鼠gad 65-67、abcam gr168030和大鼠抗小鼠cd31、bd pharmingen 558736)以1:250稀释于含有1%bsa的tbs形成的溶液加入组织切片中,并在4℃下孵育过夜。孵育后,在室温下用0.25%triton x-100稀释于tbs形成的溶液将载玻片洗涤两次,每次2分钟。然后,加入二抗(驴抗兔af594,life technologies,1256153;山羊抗大鼠af488,invitrogen,1156624)在室温下以1:500稀释于含1%bsa的tbs 1小时形成的溶液。在此期间,组织切片避光存放,以防止光致漂白。然后,在室温下用tbs将载玻片冲洗两次,每次5分钟。二次染色后,在室温下用dapi(dapi,biolegend,b222486)以1:1000稀释于tbs形成的溶液将载玻片染色10分钟。然后,在室温下用tbs将载玻片冲洗两次,每次5分钟。使用水性固定剂(fluoromount g,ebioscience,e099088)固定组织。使用sp8倒置共聚焦显微镜对载玻片进行成像。使用image j软件(fijitm)重建共焦图像。
[0119]
统计。所有实验至少重复3次。这些实验均未设盲。使用双尾student’s t检验进行成对比较,使用单向anova进行多重比较。p值小于0.05被视为具有显著意义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1