衍生自分拣蛋白的肽
衍生自分拣蛋白的肽
1.本发明涉及衍生自分拣蛋白的肽及其在与分拣蛋白失调相关的病理例如癌症特别是非小细胞肺癌、神经系统病症特别是帕金森病、阿尔茨海默病、冠心病和动脉粥样硬化中的用途。
2.分拣蛋白(ncbi,np-002950,2019年6月18日)或ntsr3(神经降压素受体3)最初是在神经系统中发现和表征的。其基因sort1(nm_002959)位于1号染色体的短臂上基因座1p13.21(109 309 568-109 397 951)处。与所述的前两种神经降压素受体ntsr1和ntsr2(分别位于20号和2号染色体上;nm_002531和nm_012344)——具有七个跨膜结构域的g蛋白偶联受体不同,分拣蛋白为i型受体。它的细胞外部分与四个其他成员:sorcs1(包含受体1的分拣蛋白相关的vps10结构域)、sorcs2(包含受体2的分拣蛋白相关的vps10结构域)、sorcs3(含受体3的分拣蛋白相关的vps10结构域)和sorla(分拣蛋白相关的受体1)共享vps10(液泡蛋白分选)结构域。该vps10家族的成员组既可作为高尔基体区室中的分选受体,又可作为可溶性液泡蛋白的转运体。
3.分拣蛋白表达无处不在,但在大脑、脊髓、睾丸和骨骼肌肉系统中保持较高。它在内质网(er)中以831个氨基酸(aa)的前体蛋白形式合成并对应于序列seq id no 1。在其n-端部分,使得可以将分拣蛋白运输通过er和高尔基体网络的信号肽先于44个aa的前肽。该前肽掩盖了结构域vps10,从而防止er与分拣蛋白的配体以其未成熟形式结合。在高尔基体中,弗林蛋白酶转化酶切割该前肽,从而释放其以及于vps10结构域并激活分拣蛋白的分选功能。释放的前肽对应于氨基酸1至44的残基,具有生物活性。生成衍生自该前肽(残基17至28)、通过添加aplrp残基修饰的分子并命名为“spadin”。后者通过抑制trek-1钾通道而具有抗抑郁作用(us2012322060和ep 3099313)。一旦成熟,分拣蛋白经由其vps10结构域与不同的配体结合,例如神经生长因子的前体(pro-ngf)或脑源性神经营养因子的前体(pro-bdnf)、颗粒蛋白前体、脂蛋白脂肪酶、4型葡萄糖转运体(glut4)、rap12并包括其自身的前肽。因此,分拣蛋白似乎通过将过量的神经营养因子引导至溶酶体来对分泌的神经营养因子的量起调节作用(pmid:21730062 evans s.f.et al.j.biol.chem.(2011),286(34),29556-29567)。
4.在细胞膜水平上,分拣蛋白可i)经由其细胞内部分中所含的基序再循环到内体或反式高尔基体,或ii)经由其vps10结构域确保其作为辅助受体的第二功能并与膜受体例如死亡结构域受体p75ntr或促进细胞信号传导激活的神经营养因子受体(trka、-b、-c)形成异二聚体。vps10结构域以保存在酵母和人类间的富含半胱氨酸的结构的形式构成分拣蛋白的整个管腔/细胞外结构域。其结晶结构(pdb:3f6k,https://www.rcsb.org/)在其天然配体神经降压素的存在下于中性ph下获得。vps10结构域分为三个结构域;n-末端部分(分拣蛋白残基45至576)形成由十个亚结构形成的螺旋结构,所述亚结构以β折叠形式组织,神经降压素的c-末端部分在其中心处结合,随后是两个称为10cca和10ccb的小结构域(分别为分拣蛋白残基577至633和634至716)。这两个结构域构成10cc模块,其包含很少的二级结构并与螺旋结构强烈相互作用。在其细胞内分选功能中,分拣蛋白暴露于不同亚细胞区室之间的ph变化,特别是在晚期内体中,其中后者的酸度允许与其受体相关的配体的释放。
vps10结构域在酸性ph(5.5)下的晶体结构揭示了螺旋结构的整体扭曲,然后是分拣蛋白的同二聚化,因此阻断了对配体的及于。
5.分拣蛋白的细胞内部分包含与甘露糖-6-磷酸(m6pr)受体的c-末端结构域的序列同源性,特别是不依赖阳离子的或阳离子非依赖性的甘露糖-6-磷酸受体(ci-m6pr)。事实上,ci-m6pr和分拣蛋白的c-末端序列共享八个共同的氨基酸(dd sdedll)。该八肽包含两个功能位点:酪蛋白激酶ii磷酸化位点(丝氨酸残基)和双亮氨酸基序(ll)。这两个位点代表了m6pr在高尔基体区室与晚期内体之间的转运的基本功能基序。尽管酪蛋白激酶ii磷酸化位点对于形成反式高尔基体囊泡所必需的衔接蛋白1(ap-1)的募集是必不可少的,但双亮氨酸基序参与了随后的分选机制。八肽内生成的突变改变ci-m6pr与高尔基体相关的、含γ衔接蛋白耳的、adp核糖基化因子结合蛋白(gga)的vhs结构域的相互作用。由于gga与特定转运所需的网格蛋白结合的事实,这些突变阻断ci-m6pr从高尔基体中的退出。另外,这些相同的突变将改变ci-m6pr在其逆行转运过程中从胞吞再循环区室(erc)到其他细胞内细胞器的分选,而不因此改变它们从细胞膜开始内化的速率。因此,该基序代表了一种主动分选/内化信号,该信号引导其处于不同细胞内转运水平下的的受体。除了双亮氨酸基序(蛋白质的残基829和830)外,分拣蛋白还包含至少两种其他分选信号:紧邻跨膜结构域的四肽ysvl和flvhry基序(分别位于分拣蛋白的792至795和787至792位)。四肽ysvl遵循共有基序yxxz,其中z代表庞大的或芳香族疏水残基。该序列参与膜蛋白例如lrp(脂蛋白受体相关蛋白)、反式高尔基体网络38/41(tgn 38/41)的膜蛋白和46kda m6pr 20-22的内化和快速分选。根据m6pr受体和lrp家族的受体的转运所必需的基序(f/y)xxxx(f/y),flvhry序列构成另一种分选/内化信号。
6.分拣蛋白,特别是人分拣蛋白,已知在阿尔茨海默病、帕金森病和糖尿病中具有不同的作用。其还牵涉在神经降压素对前列腺、胰腺或结肠来源的癌细胞的生长的影响中(dal farra c.et al.int j cancer,2001;92,503-9)并在脂蛋白代谢的控制中具有重要功能(current opinion in lipidology,2011,22(2),79-85)。
7.使得可以鉴定其组成的不同结构域的作用的基于分拣蛋白的人工敲除的大量研究已允许展示与淀粉样前体蛋白(app)相互作用的结构域。(miao yang et al.,plos one,8,no 5,2013年5月21日,页码e63049,xp055671832)。
8.支气管腺癌占非小细胞肺癌(nsclc)的最大比例(~80%),非小细胞肺癌仍然是法国和全世界癌症死亡的主要原因。与具有共同的临床特征的乳腺癌和结肠癌相比,nsclc属于具有有限的无进展生存期的最难治疗的癌症。鉴于这一观察结果,人们已投入大量的努力来提高对促进nsclc的发生和进展的机制的认识。因此,分子研究揭示,后者对酪氨酸激酶受体(rtk)活性的突变负荷率最高,例如表皮生长因子受体(egfr),其仍然是rtk的原型(archetype)。其酪氨酸激酶(tk)结构域中的体细胞突变会生成一种组成性活性形式的受体,独立于其配体固定,并异常地激活与细胞增殖相关的信号传导通路。因此,“细胞成瘾”开始了,将激活egfr的突变作为主要的致癌因子。
9.令人惊奇的是,早期或晚期nsclc之间在突变的频率或类型之间没有差异。因此,从治疗的角度出发,这些突变提供了精确地靶向egfr的机会并将临床策略导向称为“个性化”的疗法,例如酪氨酸激酶活性抑制剂(tki)。tki同时限制egfr的增殖信号的强度和持续时间,从而降低肿瘤的侵袭性和患者中疾病的进展。将tki纳入临床方案将提高患者的总生
存期;然而,到5年时其仍然低于15%。事实上,tki的临床优势会不可避免地下降,与疾病的阶段无关。主要原因在于egfr外显子20(t790m)中发生了继发突变,其抑制抑制剂的固定,从而重新激活其激酶活性和肿瘤进展。然而,关于这种被称为“获得性耐药性”突变的突变的出现或预先存在,仍然存在关键的问题。
10.似乎egfr具有在细胞表面处转导信号以外的功能,特别是转录因子(在细胞核中)的作用,它会诱导对治疗有耐药性的有丝分裂基因的表达。egfr转录程序将促进tki耐药性。因此,独立于其激酶活性的egfr受体将促进治疗逃逸。
11.在早期的研究(al-akhrass h.et al.,nat.commun.(2017);8(1):1182)中,发明人证实了分拣蛋白(一种属于vps10家族的蛋白质)对调节和稳定egfr的新作用。他们表明,分拣蛋白积极干预egfr的内化和降解。分拣蛋白抑制将导致egfr在过度活跃状态下积累,从而迫使肿瘤细胞增殖和存活。
12.发明人对一组72名患有支气管腺癌的患者进行的组织病理学和分子研究揭示,分拣蛋白的抑制随疾病的病理程度增加。事实上,分拣蛋白的表达与更好的患者生存期密切相关。其表达在弱活性(缓慢增殖)和分化的肿瘤中仍然高。换句话说,分拣蛋白表达表明腺癌预后良好,特别是在肿瘤具有高的egfr表达的情况下(al-akhrass h.博士论文“a new role of sortilin in the control of egfr retrograde trafficking to limit tumour growth”https://www.theses.fr/204476984)。
13.发明人还表明,在具有使egfr对tki敏感的突变的肿瘤中,分拣蛋白高度表达。相反,在具有使egfr对tki不敏感的突变t790m的肿瘤中,分拣蛋白表达弱。在表达突变的egfr t790m的细胞模型中,分拣蛋白的过表达会逆转这些细胞的耐药表型并使后者对tki“重新敏感”(上文引用的al-akhrass h.博士论文)。
14.发明人还表明,egfr和分拣蛋白通过它们的细胞外部分即分拣蛋白的vps10结构域与egfr的细胞外部分相互作用。分拣蛋白的截短形式(没有其细胞内部分,即没有氨基酸778至831)的表达将破坏egfr的内化,这表明分拣蛋白的细胞内部分将起到将egft运输到降解区室的作用。令人惊奇的是,该部分可在被γ-分泌酶切割、更准确地说被早老素1(psen1)切割后在细胞内释放。这种细胞机制不是分拣蛋白特有的并且对于已知蛋白质例如notch和app的细胞内部分的切割仍然很常见。与这两种蛋白质相关的肽具有生物活性并具有核功能。发明人的研究使得从分拣蛋白开始表征和分离具有细胞内生物活性的多肽成为可能。直接对来自患者的肿瘤片段进行的分析表明egfr的表达与称为sicd(分拣蛋白细胞内结构域)的所述多肽的表达呈负相关并表明sicd多肽可能在egfr的降解和/或表达中起作用。
15.因此,需要有可用的新化合物来治疗与分拣蛋白失调相关的病理状态。
16.还需要有可用的工具来预测牵涉分拣蛋白的病理状态,特别是其表达或甚至其生物活性的变化。
17.本发明的目的是满足这些需要。
18.发明人检测到了在分拣蛋白的蛋白水解切割后在细胞中自然生成的这种肽,将其分离并修饰以使其穿透到细胞中并靶向细胞核,并证实了其抗肿瘤作用。
19.根据第一个方面,本发明的主题在于对应于其c-末端部分的分离的分拣蛋白衍生多肽,其用作药物。本发明的另一个主题在于对应于与细胞穿透肽连接的其c-末端部分和
编码根据本发明的多肽的核苷酸序列的分离的分拣蛋白衍生多肽、包含所述核苷酸序列的表达载体和由所述表达载体转化的宿主细胞。
20.根据第二个方面,本发明的主题在于包含所述多肽或相应的核苷酸序列的药物组合物。
21.根据第三个方面,本发明的主题在于包含多肽或相应的核苷酸序列或药物组合物的药物,其用于治疗与分拣蛋白失调相关的疾病。
22.最后,根据第四个方面,本发明的主题在于多肽作为与分拣蛋白失调相关的至少一种病理特别是癌症(特别是非小细胞肺癌)、神经系统病症特别是帕金森病和阿尔茨海默病、冠心病和动脉粥样硬化的标记或预后剂的用途。
23.本发明的主题在于包含或组成为与序列seq id no 2具有至少80%同一性的氨基酸序列的分离的分拣蛋白衍生多肽,条件是多肽不包含序列seq id no 3或与所述序列seq id no 3具有至少80%同一性的序列或其药学上可接受的盐之一,其用作药物。
24.根据本发明,多肽的一个或多于一个氨基酸可被替换为非天然氨基酸或者天然或非天然氨基酸类似物,条件是尊重多肽的三维结构,除了20种天然氨基酸(ala、arg、asn、asn、asp、cys、gln、glu、gly、his、ile、leu、lys、met、phe、pro、ser、thr、trp、tyr和val)外,还有其他天然或非天然的,例如hunt s.(the non-protein amino acids:in chemistry and biochemistry of the amino acids,barrett,chapman and hall,1985)所述。因此,芳香族氨基酸例如苯丙氨酸可被替换为3,4-二羟基-l-苯丙氨酸、3-碘-l-酪氨酸、三碘甲状腺原氨酸、l-甲状腺氨酸、苯甘氨酸(phg)或去甲酪氨酸(nortyr)。phg和nortyr及其他氨基酸,包括phe和tyr,可被例如卤素、-ch3、-oh、-ch2nh3、-c(o)h、-ch2ch3、-cn、-ch2ch2ch3、-sh基团或另一基团所置换。任何氨基酸都可被d-型氨基酸所置换。
25.关于非天然氨基酸或天然和非天然氨基酸的类似物,可以单独地或组合地进行一定数量的置换。本领域技术人员将能够根据他们的常识进行这样的置换。因此,举例来说,谷氨酰胺残基(glu)可被γ-羟基-glu或γ-羧基-glu置换。酪氨酸残基可被α-置换的氨基酸例如l-α-甲基苯丙氨酸或被类似物如:3-氨基-tyr、tyr(ch3)、tyr(po3(ch3)2)、tyr(so3h)、β-环己基-ala、β-(1-环戊烯基)-ala、β-环戊基-ala、β-环丙基-ala、β-喹啉基-ala、β-(2-噻唑基)-ala、β-(三唑-1-基)-ala、β-(2-吡啶基)-ala、β-(3-吡啶基)-ala、氨基-phe、氟-phe、环己基-gly、tbu-gly、β-(3-苯并噻吩基)-ala、β-(2-噻吩基)-ala、5-甲基-trp和α-甲基-trp所取代。脯氨酸残基可被高脯氨酸(l-哌啶酸)、羟基-pro、3,4-脱氢-pro、4-氟-pro、或α-甲基-pro、或具有结构:n=0、1、2、3的环化n(α)-c(α)氨基酸类似物所置换。丙氨酸残基可被α-置换或n-甲基化的氨基酸例如α-氨基异丁酸(aib)、l/d-α-乙基丙氨酸(l/d-异缬氨酸)、l/d-甲基缬氨酸或l/d-α-甲基亮氨酸或非天然氨基酸例如β-氟-ala所置换。丙氨酸也可被:n=0、1、2、3所置换。甘氨酸残基可被α-氨基异丁酸(aib)或l/d-α-乙基丙氨酸(l/d-异缬氨酸)所置换。
26.在一些情况下,氨基酸可被替换为天然来源的非必需氨基酸例如牛磺酸。
27.术语“分拣蛋白”表示包含831个氨基酸并对应于序列seq id no 1的多肽或与所述序列seq id no 1具有至少80%同一性的多肽。
28.根据本发明,多肽衍生自人或动物来源的分拣蛋白。它们可以是天然或重组来源的。最后,它们可以是合成的。
29.术语“分离的多肽”表示通过本领域技术人员已知的方法、特别是通过重组途径或通过化学合成获得的多肽,然后通过部分或全部纯化将所述多肽自其初始环境分离。类似地,术语“分离的核酸”表示通过本领域技术人员已知的方法、特别是根据任何已知的基因工程方法或通过化学合成获得的核酸,然后纯化所述核酸。因此,根据本发明的分离的多肽不同于天然多肽,但不限于特定的制备或合成方法。类似地,根据本发明的分离的核酸不同于天然氨基酸,但不限于特定的合成方法。
30.优选地,根据专门从事该领域的本领域技术人员熟知的技术通过重组途径产生根据本发明的多肽。特别地,重组蛋白的生产包括选择意图用于生产的宿主,例如细菌、来自酵母或哺乳动物或来自转基因动物的真核细胞,和设计适合于所述生产的合成核苷酸序列,特别是通过选择生产载体并选择用以优化生产的密码子。重组蛋白可以以融合蛋白的形式产生,融合蛋白将目标蛋白与旨在允许所述目标蛋白的鉴定和/或纯化的“标签”结构域组合。然后根据本领域技术人员可用的众多方案中的方法进行目标蛋白的纯化。
31.在表达“与所述序列具有至少80%同一性”中,百分数纯粹是统计学的并且两个核苷酸序列之间或氨基酸之间的差异可在它们的整个长度上随机分布。两个序列之间的百分数序列同一性在待比较序列的比对之后定义。当一个序列中的某个位置被相同的碱基或相同的氨基酸占据时,分子在该位置处是相同的。两个序列之间的同一性程度为这两个序列之间的相同位置数量的函数。序列的比较可通过使用本领域技术人员已知的意图用于此目的的任何算法来进行。
32.根据本发明的多肽的一个特定方面,氨基酸序列与序列seq id no 2具有至少80%、优选至少85%、至少90%、91%、92%、93%、94%、95%、96%、97%、98%、至少99%或100%的同一性。
33.当根据本发明的多肽对应于seq id no 2时,则它对应于人分拣蛋白的氨基酸775至831。它属于分拣蛋白的细胞内结构域并被命名为sicd(分拣蛋白细胞内结构域)。
34.根据本发明的另一个特定方面,对应于seq id no 2的多肽与细胞穿透肽共价结合。该共价键可在肽的n-末端处或c-末端处形成。
35.根据本发明,细胞穿透肽(cpp)指的是可易位到细胞中而不损坏细胞膜的分子。举例来说,可提及borelli a.等人(molecules 2018,23,295)中所引述的cpp和guidotti g.等人(trends in pharmacological sciences,april 2017,38(4))所引述的那些,特别是hiv1 tat蛋白、细胞穿透肽、源自触角蛋白的同源结构域的肽、源自天青蛋白的p28、来自单纯疱疹病毒(hsv-1)的vp22或甚至合成的肽例如guidotti g.等人(trends in pharmacological sciences,april 2017,vol.38,no.4)所描述的序列seq id no 11的map(模型两亲性肽)或序列seq id no 12的dpv1047。这些肽可穿过细胞膜并到达细胞质和/或细胞的核。因此,它们可将广泛的生物活性分子转运到细胞中。此外,这些cpp中的一些具有其自身的活性,能够增强它们转运的分子的活性。
36.在本发明的一个有利的实施方案中,细胞穿透肽为tat蛋白并且根据本发明的多肽具有对应于序列seq id no 2的多肽的序列seq id no 4,其与序列seq id no 8的tat蛋白共价结合。hiv1 tat蛋白的存在提供了通过血脑屏障以及支气管和肠粘膜的机会。因此,肽的活性范围可扩展到局部晚期形式,到深层转移例如脑转移。
37.本发明的一个主题还在于选自以下多核苷酸的分离的核苷酸序列:
38.a.编码根据本发明的序列seq id no 2的多肽并由序列seq id no 5组成的多核苷酸,
39.b.与序列seq id no 5的多核苷酸具有至少80%或更多、至少85%或更高于85%、至少90%或高于90%、至少95%或高于95%同源性的多核苷酸,和
40.c.相对于多核苷酸a和b的简并的多核苷酸。
41.遗传密码是简并的(或冗余的),这意味着可以有若干密码子来表示同一个氨基酸。因此,简并的多核苷酸为具有不同的序列但适合于执行与对应于序列seq id no 2的初始多核苷酸相同的功能或产生与对应于序列seq id no 2的初始多核苷酸相同的结果的多核苷酸。简并的多核苷酸将具有与多核苷酸a和b的序列不同但对应于遗传密码简并规则的序列,所述规则可经由以下链接访问:https://people.bath.ac.uk/jm2219/biology/degenerate.htm。
42.在本发明的一个有利的实施方案中,对应于seq id no 5的多核苷酸与编码细胞穿透肽的多核苷酸共价结合。当多核苷酸编码hiv1 tat蛋白时,该多核苷酸具有序列seq id no 6。
43.本发明的又一个主题在于包含编码根据本发明的多肽的多核苷酸的表达载体。
44.根据本发明,“载体”表示能够转运与其结合的核苷酸序列或允许由与其可操作地结合的核苷酸序列编码的蛋白质的表达的核酸分子(表达载体)。
45.在本发明的一个有利的实施方案中,核苷酸载体包含序列seq id no 5或序列seq id no 6。
46.本发明的又一个主题在于包含编码根据本发明的多肽的多核苷酸或根据本发明的载体的宿主细胞。宿主细胞可以是任何常用的细胞,特别是选自细菌、酵母、人细胞系、动物细胞。
47.本发明的又一个主题在于药物组合物,其包含多肽或其药学上可接受的盐之一,或根据本发明的多核苷酸或其药学上可接受的盐之一,以及药学上可接受的赋形剂。该组合物还可包含另一种活性剂。
48.根据本发明,“药学上可接受的赋形剂”指的是除活性物质外的任何物质,旨在为药物提供稠度、味道、颜色,同时避免与活性成分的任何相互作用。根据本发明的药学上可接受的赋形剂将根据药物形式和所需的施用方式从本领域技术人员已知的常用赋形剂中按照它们对人或动物的施用来选择。
[0049]“活性剂”指的是除根据本发明的多肽或多核苷酸外并具有治疗作用的任何物质。举例来说,可特别提及常规的化疗分子(例如顺铂)或药理学受体酪氨酸激酶抑制剂(rtki)分子,或用在靶向治疗或受体抑制抗体或免疫抑制途径(t-淋巴细胞的检查点抑制剂)中的信号传导途径例如吉非替尼,或甚至厄洛替尼。本清单是非限制性的。
[0050]
根据本发明,药物组合物可以以适合于局部、区域、全身或连续施用的任何药物形式提供。举例来说,可提及以下施用途径:口服、舌下、皮下、肠胃外、肌内、静脉内、局部、气管内、鼻内、眼部、腹膜内途径,经由腔壁内、透皮或直肠扩散,或经由任何其他施用途径。适宜的施用形式包括经由口服途径的形式例如片剂、软胶囊或硬胶囊、散剂、颗粒剂和口服溶液剂或混悬剂;舌下、含服、气管内、眼内、鼻内施用形式;经由吸入;局部、透皮、皮下、肌内或静脉内施用形式;直肠施用形式和植入物。对于局部应用,可以在乳膏、水包油或油包水
乳液、凝胶、软膏、贴剂、溶液或洗剂中使用根据本发明的化合物。
[0051]
本发明的又一个主题为根据本发明的多肽或多核苷酸或药物组合物作为药物。根据本发明,它们可原样使用,或以药学上可接受的盐的形式使用。举例来说,可提及与有机或无机酸例如乙酸、琥珀酸和盐酸的酸加成盐、铵盐或碱金属盐例如钠盐或钾盐。
[0052]
在本发明的一个有利的实施方案中,根据本发明的多肽或根据本发明的药物组合物可用作与至少一种第二抗肿瘤治疗联用的药物,所述第二抗肿瘤治疗在多肽或多核苷酸或药物组合物之前、之后或与之同时施用。
[0053]
作为第二抗肿瘤治疗的实例,可提及手术、化疗(用具有抗肿瘤活性的分子治疗)、放疗(施用放疗剂)、激素疗法(施用激素衍生物)、毒素疗法、免疫疗法和冷冻疗法。
[0054]
根据本发明的多肽或其药学上可接受的盐之一或者根据本发明的多核苷酸或其盐之一或者根据本发明的药物组合物可用于与分拣蛋白失调相关的病理例如癌症特别是非小细胞肺癌、神经系统病症特别是帕金森病、阿尔茨海默病、冠心病和动脉粥样硬化中。
[0055]“分拣蛋白失调”指的是分拣蛋白的量的变化。
[0056]
本发明的又一个主题在于治疗与分拣蛋白失调相关的病理例如癌症特别是非小细胞肺癌、神经系统病症特别是帕金森病、阿尔茨海默病、冠心病和动脉粥样硬化的方法,其包括向需要它们的患者施用根据本发明的多肽或多核苷酸或它们的盐之一。
[0057]
根据本发明的包含或组成为与序列seq id no 2 val leu ile val lys lys tyr val cys gly gly arg phe leu val his arg tyr ser val leu gln gln his ala glu ala asn gly val asp gly val asp ala leu asp thr ala ser his thr asn lys ser gly tyr his asp asp ser asp glu asp leu leu glu具有至少80%同一性的氨基酸序列的多肽,条件是所述多肽不包含序列seq id no 3或与所述序列seq id no 3具有至少80%同一性的序列,无论其是否与细胞内穿透肽共价结合,也可用作与分拣蛋白失调相关的病理例如癌症特别是非小细胞肺癌、神经系统病症特别是帕金森病和阿尔茨海默病、冠心病和动脉粥样硬化的标记或预后剂。
[0058]
因此,本发明的主题在于体外或离体预后与分拣蛋白失调相关的病理状态例如癌症特别是非小细胞肺癌、神经系统病症特别是帕金森病和阿尔茨海默病、冠心病和动脉粥样硬化的方法,其包括对从所述患者获得的生物样本中存在的序列seq id no 2的多肽的表达进行第一次评估,将所述第一次评估与在健康对象群体中测得的所述多肽的表达评估进行比较,其中所述生物样本中所述多肽的表达相对于对健康对象测得的表达的变化指示病理状态的存在。
[0059]
根据本发明,可通过本领域技术人员已知的任何技术来进行多肽的检测;特别是其可直接在患者的病理组织例如肿瘤或活检或血液样本中进行。该检测可通过蛋白质印迹技术、排阻色谱与质谱相结合的技术、竞争性elisa技术、使用与酶或同位素示踪剂偶联或不偶联的特异性抗体以通过成像检测多肽来进行。
附图说明
[0060]
下图1至4和实施例1至3说明了本发明:
[0061]
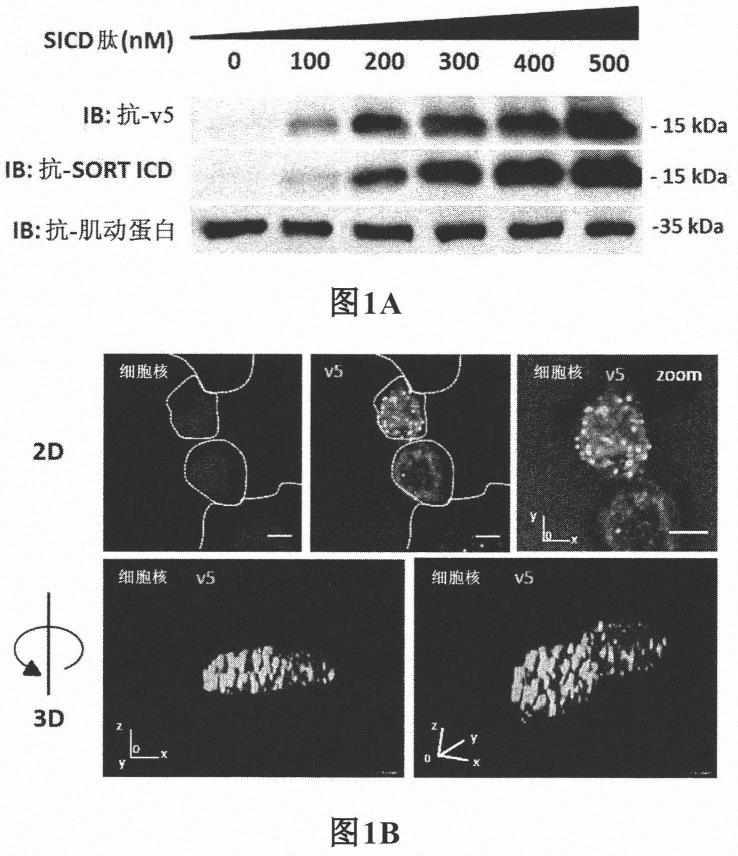
[图1.a]图1.a示出了根据实施例1在细胞内介质中根据本发明的序列seq id no 7的合成多肽的蛋白质印迹检测。“sicd肽”对应于根据实施例1使用的seq id no 7的肽(与
v5标签和tat偶联的sicd肽)的增加的浓度。“ib:抗-v5”:用抗-v5抗体测量的细胞内肽的量;“ib:抗sort-icd”:用针对分拣蛋白的细胞内部分的抗体测量的细胞内肽的量;“ib:抗-肌动蛋白”:内部对照。
[0062]
[图1.b]图1.b示出了根据实施例1的经由免疫荧光在细胞核水平上对该合成肽的可视化。dapi标记细胞核,而v5标签使得可视化合成肽的细胞内位置成为可能。事实上,在拍摄二维图像并将两个标记叠加时,v5的分布及因此合成肽的分布叠加在细胞核的分布上。此分布是点状的,呈位于细胞核水平的斑点形式。三维成像使得可以评估这些斑点在原子核深度上沿z轴的分布,而不仅仅是在如2d成像所允许的其表面上。因此,如图1.b中所示,合成肽形成分布在细胞核内的斑点。
[0063]
[图2]图2示出了根据实施例2的在不同浓度下在24、48和72小时孵育后在与v5标签和tat偶联并对应于序列seq id no 7的sicd肽的存在下通过xtt(细胞增殖试剂盒ii-roche)测量的细胞存活评估。
[0064]
[图3]图3示出了根据实施例3的由与v5标签和tat偶联并对应于序列seq id no 7的sicd肽的促凋亡作用诱导的膜联蛋白v的固定的实时定量。
[0065]
[图4]图4示出了根据实施例3的由与v5标签和tat偶联并对应于序列seq id no 7的sicd肽的促凋亡作用诱导的胱天蛋白酶3和7的活化的实时定量。
[0066]
所用技术的描述
[0067]
1.细胞和细胞培养
[0068]
胚肾细胞系hek293t(ccl-1573
tm
)和支气管腺癌细胞系a549(ccl-185
tm
)和h1975(ccl-5908
tm
)源自美国模式培养物保藏所(atcc)。细胞系h3255由madame sylvie gazzeri(dr2 inserm,u823,institut albert bonniot,grenoble)慷慨捐赠。细胞在由10%胎牛血清(参考号:9215-50,h2b)、1%丙酮酸盐(参考号:11360070,gibco,thermofisher scientific)和1%青霉素/链霉素(参考号:10378016,gibco,thermofisher scientific)组成的dmem(杜氏改良eagle培养基)培养基+glutamax(参考号:10566016,gibco,thermofisher scientific)中培养。如此组成的dmem+glutamax培养基在本技术中称为“完全培养基”。将细胞保存在37℃下包含5%co2(binder,thermofisher scientific)的培养箱中的潮湿气氛中。对于细胞的传代培养和每周维护,除去包含死细胞和碎屑的培养基,用pbs 1x(磷酸盐缓冲盐水)(参考号:14190144,gibco,thermofisher)冲洗细胞层,然后通过在37℃下包含5%co2的培养箱中的潮湿气氛中添加胰蛋白酶-edta(0.05%)(参考号:25300054,gibco,thermofisher)达5分钟来从其载体分离细胞。分离后,将细胞收集在15ml或50ml试管中(分别地,参考号:62554502;62547254,sarstedt)中并在显微镜(x40)下在“malassez”型计数室(参考号:631-0975;vwr)上计数。同时,在对用0.4%的台盼蓝溶液(参考号:15250061,gibco,thermofisher)稀释四分之一的细胞悬浮液样品着色后,在计数室中估计细胞活力。然后将细胞在20℃下于100x-g下离心(参考号:75004380,sorvall,thermofisher)10分钟。如此获得的细胞团块要么返回到悬浮液使得细胞在规划的各种实验的适宜密度下,或者在-80℃下干燥储存以备后用。本发明中使用的每种细胞亚型的接种通常使用10.103的细胞/cm2的浓度。将细胞接种在25cm2或75cm2的培养瓶(分别地,参考号:83.3910.002和83.39.11.502,sarstedt)中,或甚至在具有6或24个孔的培养板(分别地,参考号:83.3920和83.3922,sarstedt)中,具体取决于要进行的实验。
[0069]
2.长期细胞储存:冷冻/解冻
[0070]
如前所述,将培养的细胞分离、收集和离心。然后将它们悬浮在1ml由10%的冷冻保护剂二甲基亚砜(dmso)(参考号:d-8418,sigma-aldrich)组成的胎牛血清(fcs)中,比率为3x 106个细胞/冻存管(参考号:72380002,sarstedt)。将这些放置在包含异丙醇(参考号:563935,sigma-aldrich)的冷冻容器(参考号:479-0966,vwr)中24小时至1周以进行逐步冷冻,然后储存在-196℃的液氮容器中。解冻阶段必须快速以获得最佳细胞活力。然后,立即将其从液氮中取出,将冷冻管置于37℃的水浴中直至细胞悬浮液完全解冻。将细胞吸收在10ml完全培养基中并离心(300x-g,25℃下10分钟)以消除dmso。然后根据前述条件将它们返回培养。
[0071]
3.在变性条件下提取蛋白质
[0072]
在除去上清液并在pbs 1x中冲洗细胞后,直接对细胞层进行全蛋白的提取,或甚至对先前储存于-80℃下的细胞团块进行全蛋白的提取。其通过与laemmli溶胞缓冲液(62.5mm tris-hcl,参考号:11814273001,roche,ph 6.8;2%sds,参考号:l-4509,sigma-aldrich;25%甘油,参考号:g5516,sigma-aldrich)一起以1.106个细胞100μl缓冲液的比例在冰上孵育细胞30分钟来进行,该缓冲液由1%(v/v)的蛋白酶抑制剂混合物(参考号:p8340-1ml,sigma-aldrich)和1%(v/v)的磷酸酶抑制剂混合物(参考号:p0044-1ml,sigma-aldrich)组成。在对细胞层进行提取的情况下,使用刮刀(参考号:179693pk,nunc,thermofisher)将细胞收集在溶胞缓冲液中。然后通过以60hz、振幅2s为参数超声1分钟来完成溶胞(参考号:sonivcx-130-220,vwr)。然后将溶胞物在4℃下以17,000xg(参考号:75002442,sorvall,thermofisher)离心20分钟,将包含蛋白质的上清液转移到无菌的1.5ml试管(参考号:0030120086,eppendorf)中,并通过bradford方法测定蛋白质。
[0073]
4.蛋白质测定
[0074]
通过bradford方法(bradford 1976)评估各种样品的蛋白质浓度。该测试通过将稀释的样品(或不同浓度的牛白蛋白标准品(参考号:5000206,bio-rad))与来自试剂盒dc
tm
蛋白质测定试剂盒ii(参考号:5000112,bio-rad)的试剂一起按制造商的操作规程孵育来进行。在分光光度计(参考号:51119000,thermofisher)上于595nm下进行吸光度读数。每个样品的蛋白质浓度根据用bsa浓度范围(0μg/ml;125μg/ml;250μg/ml;500μg/ml;750μg/ml;1000μg/ml;1500μg/ml和2000μg/ml)获得的直线来估计。一旦通过这种方法确定了样品的浓度,就会对必要体积的蛋白质进行取样,然后作为每个样品的函数进行平衡,通常20μl。后者分别由0.01%的溴酚蓝和5%的β-巯基乙醇组成,然后在95℃下变性5分钟。
[0075]
5.蛋白质在聚丙烯酰胺凝胶中的电泳(sds-page)
[0076]
用sds-page电泳凝胶(十二烷基硫酸钠聚丙烯酰胺凝胶,来自bio-rad的mini-protean系统)分离蛋白质。聚丙烯酰胺凝胶的浓度随要分离和分析的蛋白质的分子量而异,从8%至15%不等。根据下表1,所有分离凝胶之前总是有4%的浓缩凝胶。
[0077][0078]
表1:分离和浓缩凝胶的组成。
[0079]
迁移在1x迁移缓冲液(参考号:1610732,bio-rad)中进行1小时30分钟(150v)。每次迁移都使用分子量标志物(参考号:26619 pageruler
tm plus prestained protein ladder,fermantas life science)。一旦通过电泳分离,蛋白质就转移到pvdf膜(聚偏二氟乙烯)(参考号:10600023)millipore)上。该膜事先在甲醇中孵育15秒,然后在水中冲洗,然后在转移缓冲液(参考号:161-0771,bio-rad)中平衡几分钟。聚丙烯酰胺凝胶也在转移缓冲液中平衡几分钟,然后与膜接触。根据使用whatman滤纸的设置,用transblotting id dryer设备(bio-rad)在20v下进行1小时的转移。pvdf膜和凝胶由之前用转移缓冲液浸泡过的2x 4 whatman纸组成(图1)。沉积、迁移和转移质量通过用丽春红(0.2%ponceau s,参考号:p3504-50 g,sigma-aldrich;3%tca,参考号:t8657-250g,sigma-aldrich)对pvdf膜着色数秒然后用叔丁基二甲基甲硅烷基(tbs)洗涤3次(每次5分钟)来验证。
[0080]
6.用抗体孵育膜
[0081]
然后将膜在环境温度下在包含0.1%吐温20(参考号:p1379)和5%脱脂牛奶(r
é
gilait)的tbs 1x中孵育1小时,以使非特异性固定位点饱和。通过与针对目标蛋白的特定表位的一抗一起孵育并按表2中描述的条件来进行免疫标记。
[0082][0083]
表2:蛋白质印迹中使用的一抗
[0084]-:不可用,na:未报告,(a):tbs 1x,吐温0.1%,牛奶5%,(b):tbs 1x-吐温0.1%,bsa 3%,(c):tbs 1x,bsa 5%,(d):tbs 1x,bsa 3%,wb:蛋白质印迹,if:免疫荧光。
[0085]
在tbs 1x-吐温20缓冲液(0.1%)中洗涤三次后,将膜与和过氧化物酶偶联的合适的二抗(表3)(在饱和溶液中以1/1000稀释)一起在环境温度下孵育1小时。然后将膜用tbs 1x-吐温20(0.1%)洗涤两次,然后用单独的tbs 1x洗涤两次以除去过量的吐温20。
[0086]
二抗宿主供应商稀释抗小鼠igg hrp兔dako1/1000抗兔igg hrp猪dako1/1000
[0087]
表3:用于蛋白质印迹hrp的二抗:辣根过氧化物酶
[0088]
7.通过化学发光反应可视化
[0089]
通过化学发光进行蛋白质印迹可视化。该系统基于过氧化物酶作用于h2o2所产生的o2对鲁米诺的氧化。形成不稳定的中间体发光化合物。以1∶1的比例使膜与“ecl”试剂盒(参考号:wbuls0500,millipore)的混合物接触1分钟。由g box数字系统(ozyme)收集化学发光。使用genesnap(syngene)和imagej(nih)图像分析软件处理从蛋白质印迹可视化获得的数字图像。
[0090]
8.间接免疫荧光
[0091]
将细胞接种在直径14mm载玻片上的24孔板上。在每种处理条件后,用包含3.7%的多聚甲醛(pfa)的完全培养基在4℃下固定细胞20分钟,或用甲醇在-20℃下固定5分钟。使用甲醇时,通过脱水(蛋白质的变性)进行固定,而使用醛(甲醛)时,蛋白质的3d结构被保留(通过桥接固定)。在用pfa固定后分析磷酸化。固定后,用500μl pbs洗涤细胞层3次,每次5分钟。在用pfa固定的情况下,细胞用0.1%的triton x-100/pbs在4℃下透性化10分钟,然后再次洗涤。就用甲醇固定而言,这具有同时固定和透性化细胞的优势。非特异性位点的饱和用1%的pbs-血清(与产生二抗的动物来源相同)或用5%的pbs-bsa在环境温度下进行1小时。从固定阶段开始,所有溶液都事先通过0.2μm过滤器过滤以消除荧光伪影和背景噪
声。针对目标蛋白的一抗(即v5标签(允许合成肽的可视化))在4℃下在包含3%bsa的pbs溶液中孵育过夜(表2)。然后,在pbs中进行三次5分钟的洗涤,之后在pbs-bsa溶液中于环境温度下将与alexa fluor(绿色荧光)偶联的二抗(表4)孵育1小时。在pbs中洗涤三次(每次5分钟)后,用包含1μm荧光染料dapi的pbs 1x溶液标记细胞核5分钟。此阶段结束时,在pbs中再次冲洗细胞,洗涤三次,每次5分钟。然后使用水性样品封固剂(dako)将载玻片置于目标载玻片上并于4℃下放置过夜。使用配备有氦/氖和氩激光的lsm 880型(zeiss)共聚焦显微镜(x63或x100放大倍数)对制备物可视化。图像使用zen(zeiss)或image j(nih)软件处理。
[0092][0093]
表4:免疫荧光中使用的二抗
[0094]
9.经由系统实时成像的细胞死亡分析。
[0095]
为了研究凋亡引起的细胞死亡,将细胞以每孔2000个细胞的浓度接种在96孔板中的100μl培养基中。24小时后,除去细胞培养基,然后用无菌pbs 1x冲洗细胞一次,之后加入包含不同处理剂(包括600nm的根据本发明的肽)和分析细胞死亡所需试剂的培养基。后者为:在培养基中稀释至1∶1000的胱天蛋白酶-3/7绿色试剂(参考号:4440;essenbio);在培养基中稀释至1∶200的膜联蛋白v绿色试剂(参考号:4642;essenbio)。然后通过将板置于incucyte系统(参考号:essenbio)中96小时来进行图像采集。然后用x10物镜和相位对比及绿色通道,每两小时获得每孔四张高清图像。这些采集自动且非侵入性地进行。使用incucyte活细胞分析系统(参考号:essenbio)自动处理数据。
[0096]
实施例1:通过蛋白质印迹和免疫荧光进行的细胞穿透试验
[0097]
这根据上述技术进行。序列seq id no 2(sicd或分拣蛋白细胞内结构域)的合成肽通过添加tat序列(反式转录激活因子)seq id no 8而被赋予穿透细胞的能力,seq id no 8属于人类免疫缺陷病毒(hiv)的细胞穿透肽家族。此外,v5标签(seq id no 10),经由特异性抗体或荧光分子易于检测的已知表位,被嫁接到肽上,然后产生序列seq id no 7的合成肽。用稀释在完全培养基中的0nm至500nm的浓度范围的与v5标签和序列seq id no 7的tat偶联的sicd肽处理细胞。处理24小时后,细胞被溶胞,用抗-v5抗体在细胞溶胞物(细胞内培养基)中检测到肽。在蛋白质印迹的不同阶段后,检测到细胞内肽的数量逐渐增加,在最高浓度(500nm)下有最大值,因此表明肽穿透是剂量依赖性的,如图1.a线ib:抗-v5所示。肌动蛋白充当沉积物的内部对照,证实在呈现的每个蛋白质轨道中已沉积相同数量的蛋白质(图1.a线ib:抗-肌动蛋白)。通过使用针对分拣蛋白的细胞内部分的抗体获得了类似的图谱(图1.a线ib:抗-sort icd)。这些结果一方面证实该肽事实上被细胞内化,另一方面证实这确实是衍生自分拣蛋白的细胞内部分的肽。
[0098]
合成肽的亚细胞分布通过免疫荧光可视化(图1.b)。图像显示了通过使用针对v5标签的抗体,序列seq id no 7的合成肽的点状核分布。此分布也通过使用序列seq id no 7的肽和抗-分拣蛋白抗体得到证实。标记物的叠加(dapi标记细胞核而v5标记合成肽)证实了细胞核中该肽的特定存在。以3d拍摄的图像证实这个位置在原子核内,而不是在其表面
上。该细胞区室中合成肽的存在是其在细胞核水平上的作用的证明。
[0099]
实施例2:通过测量细胞存活来测量抗肿瘤作用
[0100]
对a549细胞系(在edfr上没有突变的腺癌细胞系)测试包含tat和序列seq id no 7的v5标签的合成肽的抗肿瘤作用。将一系列浓度(0μm至10μm)的根据本发明的序列seq id no 7的合成肽在细胞培养基中孵育24小时、48小时和72小时并在每次孵育结束时即在24小时、48小时和72小时时测量(细胞增殖试剂盒ii(xtt)-roche)其脱氢酶活性(生存力的指标)。结果在图2中给出。对代表作为合成肽浓度的对数函数的活性的曲线图的分析使得可以确立ci
50
值,该值对应于肽导致细胞活性的50%抑制的浓度。对于24小时、48小时和72小时的孵育时间,后者分别等于1.42μm、1.52μm和0.57μm。
[0101]
实施例3:合成肽的促凋亡作用的测量
[0102]
使用incucyte系统实时测量序列seq id no 7的肽在1μm的浓度下对a549细胞系、对人成纤维细胞(非癌细胞)以及对两个腺癌细胞系h3255和h1975的促凋亡作用,测量持续96小时,这些细胞系分别呈现出经由两种凋亡标志物即膜联蛋白v及胱天蛋白酶3和7的激活而对临床中使用的酪氨酸激酶活性受体抑制剂(tki)敏感(l858r)和耐药(l858r/t790m)的egfr突变。结果表明,该肽似乎不会导致人成纤维细胞培养物中这两种凋亡标志物的激活(图3的膜联蛋白v及图4的胱天蛋白酶3和7)。事实上,在用肽处理的条件和对照条件下,这些标志物的表达水平是相同的。因此,该肽可能对癌细胞具有特异性毒性。
[0103]
相反,在受试的三个腺癌细胞系中,随着时间的推移观察到细胞中凋亡过程的增加。事实上,在所测试的三个腺癌细胞系中,膜联蛋白v(图3)或胱天蛋白酶3和7(图4)的表达水平增加,这反映了该肽在其抗肿瘤作用方面的作用机制。
[0104]
与常规化疗中可用的分子不同,根据本发明的合成肽产生自氨基酸组装以形成天然存在于人类细胞中的肽而不是来自化学分子。因此,设想生物体的耐受性得到改善。由于其易于合成、成本合理以及其特异性细胞内靶点,故不同于tki的那些,根据本发明的肽可以是用于二联疗法的良好候选物。在此情况下,其可允许减少施用的常规抗肿瘤药物的剂量,并降低相关的治疗费用。
[0105]
这些结果表明,在其施用后,根据本发明的肽实际上存在于细胞核内(图1)并且其能够抑制肿瘤细胞的活性(图2)以及具有促凋亡作用(图3)。因此,该肽可用于与分拣蛋白失调相关的疾病中,特别是在分拣蛋白被抑制的情况下。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1