修饰的环状RNA及其使用方法与流程
修饰的环状rna及其使用方法
1.相关申请的交叉引用本技术要求于2019年8月28日提交的美国临时申请号62/892,776的优先权利益,所述美国临时申请在此通过引用整体并入。
2.关于序列表的声明与本技术相关的序列表以文本格式代替纸质副本提供,并且在此通过引用并入说明书内。含有序列表的文本文件的名称是stdu2_37833_101_seqlist_st25.txt。该文件为~4kb,于2020年8月24日创建,且正以电子方式提交。
技术领域
3.本技术涉及修饰环状rna以减少或增加其免疫原性的方法,以及使用修饰的环状rna的方法。
背景技术:
4.数以万计的环状rna (circrna)已在真核生物中得到鉴定。病毒如丁型肝炎病毒和植物类病毒具有环状rna基因组,并且许多病毒产生环状rna作为其复制周期的正常部分。最近的研究提示了部分基于circrna的先天免疫系统正在出现的状况。某些外源性circrna的引入可以激活抗病毒和免疫基因表达程序,而内源性circrna可以共同抑制蛋白激酶r,并且对于病毒感染后的先天免疫设定阈值。
5.哺乳动物先天免疫系统依赖于识别病毒和细菌中常见的病原体相关分子模式(pamp)的模式识别受体(prr)。rig-i和mda5是在胞质溶胶中发现的感知外来核酸的prr。已知mda5检测长dsrna,而rig-i已显示识别短dsrna上的5'三磷酸。尽管用于rig-i激活的线性rna配体已得到广泛表征,但尚未调查rig-i与circrna的相互作用,尤其是在外来circrna检测的背景下。
6.n6-甲基腺苷(m6a)是最丰富的rna修饰之一。在mrna上,m6a已证实调控不同的功能,包括剪接、翻译和降解,所述功能可以具有细胞和组织范围的效应。先前的研究已提示m6a也存在于circrna上,并且具有启动不依赖于帽的翻译的潜力。然而,m6a对circrna功能的作用及其在circrna的rig-i检测中的作用尚不清楚。
7.仍然需要操纵环状rna的免疫原性的组合物和方法,以便在生物技术中使用环状rna平台。
技术实现要素:
8.本文提供的是用于操纵环状rna的免疫原性的组合物和方法,及其用途。
9.在一些实施方案中,本公开内容提供了疫苗组合物,其包含不含任何n6-甲基腺苷(m6a)残基的环状rna分子。
10.在一些实施方案中,本公开内容提供了包含编码环状rna的dna序列的组合物,其中所述环状rna不含任何n6-甲基腺苷(m6a)残基。
11.本公开内容还提供了用于在有需要的受试者中引发先天免疫应答的方法,该方法包括向受试者施用有效量的组合物,所述组合物包含编码如本文所述的环状rna的dna序列。
12.本公开内容还提供了用于在有需要的受试者中引发先天免疫应答的方法,该方法包括向受试者施用有效量的疫苗组合物,所述疫苗组合物包含不含任何m6a残基的环状rna分子。
13.本文还提供的是通过体外转录用于产生环状rna的方法,该方法包括提供编码环状rna分子的dna模板、核糖核苷三磷酸和rna聚合酶;从dna模板转录线性rna;和使线性dna环化,以形成环状rna;其中所述核糖核苷三磷酸不包括任何n6-甲基腺苷-5
’‑
三磷酸(m6atp);并且其中所述环状rna能够在受试者中产生先天免疫应答。
14.本文还提供的是通过体外转录用于产生环状rna分子的方法,该方法包括提供编码环状rna分子的dna模板、核糖核苷三磷酸和rna聚合酶;从dna模板转录线性rna;并且使线性dna环化,以形成环状rna;其中所述核糖核苷三磷酸包含n6-甲基腺苷-5
’‑
三磷酸(m6atp);并且其中与使用相同方法但不存在m6atp的情况下产生的环状rna相比,所述环状rna是较低免疫原性的。
15.本公开内容提供了将物质递送至细胞的方法,其中所述方法包括:(a)生成包含至少一个n6-甲基腺苷(m6a)的重组环状rna分子;(b)将物质附着到重组环状rna分子,以产生包含附着到物质的重组环状rna分子的复合物;并且(c)使细胞与复合物接触,由此将物质递送至细胞。
16.本公开内容还提供了在细胞中螯合rna结合蛋白的方法,其中所述方法包括(a)生成包含至少一个n6-甲基腺苷(m6a)和一个或多个rna结合蛋白结合结构域的重组环状rna分子;并且(b)使包含rna结合蛋白的细胞与重组环状rna分子接触,由此所述rna结合蛋白与一个或多个rna结合蛋白结合结构域结合,并且在细胞中被螯合。
17.本公开内容进一步提供了减少环状rna分子的先天免疫原性的方法,其中所述方法包括:(a)提供在受试者中诱导先天免疫应答的环状rna分子;并且(b)将至少一个n6-甲基腺苷(m6a)引入环状rna分子内,以提供具有减少的先天免疫原性的修饰的环状rna分子。
18.还提供的是增加环状rna分子在受试者中的先天免疫原性的方法,其中所述方法包括:(a)生成缺乏rrach基序(seq id no: 18)的环状rna分子;并且(b)用另一种碱基(例如u、c、g或肌苷)替换环状rna序列中的一个或多个腺苷,以提供具有增加的先天免疫原性的修饰的环状rna分子。
附图说明
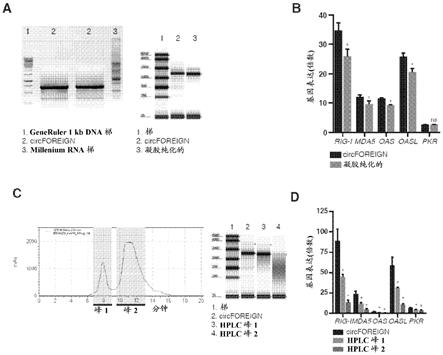
19.图1a包括描绘在凝胶纯化之前的circforeign的琼脂糖凝胶电泳(左)和所得到的纯化rna的tapestation分析(右)的图像。图1b是显示了在rna转染到hela细胞内之后24小时,先天免疫基因的基因表达的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,斯氏t检验,比较了circforeign与凝胶纯化的rna转染。图1c是circforeign纯化的hplc层析图。收集的级分在迹线(左)和纯化rna的tapestation分析(右)上指示。图1d是显示了在rna转染到hela细胞内之后24小时,先天免疫基因的基因表达的图。通过qrt-pcr测量指示mrna和
转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,斯氏t检验,比较了circforeign与用指示rna的转染。
20.图2a是描绘与ova结合的激动剂rna的皮下注射的图解。在初次免疫和二次免疫之后的指示时间,测量了t细胞ics和抗体滴度。图2b是说明在初次接种之后,不依赖于转染剂,circrna刺激抗ova t细胞应答的图。显示了平均值(n = 5),*p 《 0.05,kruskal-wallis检验。图2c是说明在二次接种之后,不依赖于转染剂,circrna刺激抗ova抗体滴度的图。显示了平均值(n = 5),*p 《 0.05,anova-tukey氏检验。图2d是描绘通过皮下注射递送的,与ova结合的circforeign疫苗接种的图解。14天后,表达ova的b16黑色素瘤细胞在右胁腹和左胁腹中建立。对肿瘤进行测量且成像。图2e包括显示了在肿瘤建立之前,对于用pbs或circforeign接种疫苗的小鼠,在左肿瘤和右肿瘤中的生物发光测量的定量的图像。通过威尔科克森符号秩检验计算p值。每组中n=5只小鼠。图2f包括显示了在肿瘤建立之前,对于用pbs或circforeign接种疫苗的小鼠,在左肿瘤和右肿瘤中的生物发光测量的定量的图。通过威尔科克森符号秩检验计算p值。每组中n=5只小鼠。图2g是显示了用circforeign接种疫苗的小鼠存活时间是阴性对照小鼠的两倍的图。该图显示了在肿瘤建立之前,用pbs或circforeign接种疫苗的小鼠的存活曲线。通过时序检验计算p值。每组中n=5只小鼠。
21.图3a包括显示了关于ifnγ + cd8 + t细胞的facs分析的门控策略的图。图3b是显示了在二次免疫后,不依赖于pei,circforeign刺激抗ova特异性t细胞应答的图。显示了平均值(n = 5),*p《0.05,anova-tukey氏检验。图3c是显示了在二次免疫后,不依赖于pei,circforeign刺激抗ova抗体滴度的图。显示了平均值(n = 5),*p《0.05,anova-tukey氏检验。图3d包括显示了关于cdc1和cdc2细胞的facs分析的门控策略的图。图3e包括说明circforeign免疫激活小鼠中的树突状细胞(dc)的图。图3f包括在用pbs或circforeign接种疫苗的小鼠中,左肿瘤和右肿瘤体积的测量的图。通过威尔科克森符号秩检验计算p值。图3g包括用pbs或阳性对照聚i:c接种疫苗的小鼠的存活曲线的图。通过时序检验计算p值。
22.图4a是来自circzkscan1、circself和circforeign的chirp-ms的肽计数的热图。酶分类为m6a写入器(writer)、读取器(reader)和擦除器(eraser)。图4b是显示了如通过chirp-ms指示的,m6a机制与circzkscan1和circself相关,但与circforeign无关的图。显示了相对于rna酶处理的对照的倍数富集。图4c是示意性模型,其显示了产生m6a修饰的circself的zkscan1内含子指导的蛋白质辅助剪接、以及形成未修饰的circforeign的噬菌体td内含子指导的自催化剪接。图4d是显示了m6a-irclip鉴定接近circrna剪接点的高可信m6a位置的图。与td内含子指导的circforeign相比,zkscan1内含子足以指导circself上的m6a修饰。将m6a-irclip读数的密度标准化为每百万读数。图4e是显示了hela细胞中,内源性人circrna的circrna剪接点附近的m6a-irclip读数密度的图。对于接近circrna剪接点的读数,将m6a-irclip读数的密度标准化为每百万读数。
23.图5a是显示了m6a-irclip鉴定circself或circforeign的高可信m6a位置的图。显示了富含circself或circforeign的rt终止点的费希尔氏精确检验。将m6a-irclip读数的密度标准化为每百万读数。图5b是显示了内源线性rna上的m6a频率的图。图5c是显示了体外转录的circforeign的tapestation分析的图像,所述circforeign具有指示水平的掺入的m6a修饰,并且伴随或不伴随rna酶r处理。图5d是在剪接点上的qrt-pcr的图像,其确认了在体外转录过程中,未修饰的和m6a修饰的circrna形成。该图显示了如指示的,在使用“倒
转”引物的qrt-pcr后,未修饰的和m6a修饰的circrna的琼脂糖凝胶。
24.图6a是说明未修饰的circforeign转染到野生型hela细胞内刺激免疫应答,但m6a修饰的circforeign则并非如此的图。该图显示了在rna转染之后24小时,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3),*p 《 0.05,斯氏t检验,比较了线性rna与指示rna的基因刺激。图6b是说明缺乏rrach m6a共有基序(seq id no: 17)的circforeign质粒的转染刺激比circforeign更高水平的免疫应答的图。rrach基序(n = 12个位点)在整个外显子序列中突变为rruch (seq id no: 19)。使在剪接点后的前200个碱基(n = 37个位点)内的每一个腺苷突变为尿嘧啶,进一步增加了免疫原性。该图显示了在dna质粒转染之后,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3),**p 《 0.01,***p 《 0.001,斯氏t检验,比较了circforeign与用指示rna的转染。图6c是说明用所有腺苷由尿嘧啶替换的circforeign质粒的转染导致免疫原性升高的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3),*p《0.01,斯氏t检验,比较了circforeign与指示rna转染。图6d是显示了在初次疫苗接种之后,m6a修饰的circforeign减弱抗ova t细胞应答的图。显示了平均值(n = 10),*p 《 0.05,anova-tukey氏检验。图6e是显示了在二次疫苗接种之后,m6a修饰的circrna减弱抗ova抗体滴度的图。显示了平均值(n = 10),*p 《 0.05,anova-tukey氏检验。
25.图7a是未修饰的和m6a修饰的circforeign对免疫原性的作用的示意性模型。图7b是显示了circforeign刺激抗ova特异性t细胞应答,并且1% m6a修饰的circforeign在二次免疫后减弱免疫的图。显示了平均值(n = 10),*p《0.05,anova-tukey氏检验。图7c是显示了circforeign刺激抗ova抗体滴度,并且1% m6a修饰的circrna在二次免疫后减弱免疫的图。显示了平均值(n = 5),*p《0.05,anova-tukey氏检验。
26.图8a是野生型hela细胞和两个ythdf2敲除(ko)克隆的蛋白质印迹的图像。图8b是显示了在rna转染到hela ythdf2
–
/
–
克隆#2内之后24小时,先天免疫基因的基因表达的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。图8c是所使用的ythdf1/2构建体的示意性图解。图8d是ythdf2-λ、ythdf2、ythdf2n、ythdf2n
‑ꢀ
λ、ythdf1n和ythdf1n-λ的蛋白质印迹的图像。图8e是显示了指示yth蛋白的rip-qpcr富集,随后为circrna-boxb或对照肌动蛋白rna的qrt-pcr的图。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,斯氏t检验。图8f是显示了栓系到ythdf2的c末端yth结构域的未修饰的circboxb转染到ythdf2 ko细胞内不足以减弱免疫应答的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p 《 0.05,斯氏t检验,比较了接受+/
–ꢀ
ythdf2转染的细胞。图8g是显示了栓系到rfp-yth结构域蛋白融合物的未修饰的circboxb转染到ythdf2 ko细胞内不足以减弱免疫应答的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p 《 0.05,斯氏t检验,比较了接受+/
–
ythdf2转染的细胞。图8h是显示了栓系到ythdf1的未修饰的circboxb的转染不足以减弱免疫应答的图。该图显示了在rna转染
到野生型hek 293t细胞内之后24小时,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对表达ythdf1n-λn的质粒转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。
27.图9a包括显示了对未修饰的或m6a修饰的circforeign的应答的示意性模型。未修饰的或m6a修饰的circforeign转染到ythdf2
–
/
–ꢀ
hela细胞内刺激免疫应答。图9a的右图是显示了在rna转染之后24小时,先天免疫基因的基因表达的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。使用斯氏t检验,比较了具有0% m6a的circforeign与指示rna转染。图9b显示了在ythdf2 ko hela细胞中,ythdf2的异位表达拯救了针对未修饰的相对于m6a修饰的circforeign的应答。图9b的左图是显示了在拯救之后,针对m6a修饰的circforeign的应答的示意性模型。图9b的右图是显示了在rna转染之后24小时,先天免疫基因的基因表达的图。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,使用斯氏t检验,比较了0% m6a circforeign与1% m6a circforeign。图9c说明了ythdf2与未修饰的circforeign的栓系掩蔽了circrna免疫。图9c的左图是示意性模型,其显示了蛋白质经由λn和boxb与rna的体内栓系,导致免疫原性的减弱。图9c的右上图是显示了具有和不具有λn栓系标签的全长野生型ythdf2的蛋白质结构域体系结构,以及具有和不具有λn栓系标签的ythdf2 n末端结构域的图解。图9c的右下图是显示了指示yth蛋白的rip-qpcr富集,随后为circrna-boxb或对照肌动蛋白rna的qrt-pcr的图。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,使用斯氏t检验,比较了具有λn栓系的ythdf2 n末端与没有栓系的ythdf2 n末端。图9d是显示了栓系到全长野生型ythdf2的未修饰的circboxb转染到野生型hela细胞内减弱免疫应答的图。该图显示了在rna转染之后24小时,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染进行标准化。野生型ythdf2-λn (灰色)作为免疫原性阴性对照异位表达。仅用circboxb的转染充当免疫原性阳性对照。显示了平均值
ꢀ±ꢀ
sem (n = 3)。*p《0.05,使用斯氏t检验,比较了具有含有λn栓系的野生型ythdf2与不含栓系的野生型ythdf2的circboxb。图9e是显示了栓系到ythdf2的n末端结构域的未修饰的circboxb转染到ythdf2 ko细胞内不足以减弱免疫应答的图。该图显示了在rna转染之后24小时,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,并且结果针对模拟转染进行标准化。ythdf2-λn (黑色)的n末端结构域作为免疫原性阴性对照异位表达。显示了平均值
ꢀ±ꢀ
sem (n = 3)。使用斯氏t检验,比较了具有含有λn栓系的ythdf2 n末端与不含栓系的ythdf2 n末端的circboxb。
28.图10a是显示了rig-i ko拯救通过m6a写入器mettl3的耗尽诱导的细胞死亡的图。该图显示了在指示rna转染之后,野生型或rig-i ko hela细胞中的细胞死亡的倍数变化。显示了平均值
ꢀ±ꢀ
sem (分析了n~50,000个细胞)。*p 《 0.05,***p《0.001,使用斯氏t检验,比较了模拟转染与指示rna转染。图10b是显示了来自图10a中描绘的facs分析的原始细胞计数的表。图10c是用mettl3 sirna或非靶向对照sirna转染的hela野生型或rig-i ko细胞中,mettl3敲减效率的蛋白质印迹验证的图像。图10d是hela野生型和rig-i ko细胞中的rig-i蛋白质表达的蛋白质印迹验证的图像。在与facs实验可比较的条件下,用mettl3 sirna或非靶向sirna转染细胞。
29.图11a是显示了circforeign并不诱导rig-i的atp酶活性的图。使rig-i和rna温育,并且加入atp。在指示的时间点淬灭反应并测量pi浓度。显示了平均值
ꢀ±ꢀ
sem (n = 2)。图11b包括在rig-i与指示rna一起温育后,rig-i细丝的代表性电子显微镜检查图像。图11c是描绘用纯化的rig-i、k63-聚泛素和指示的rna配体的体外rig-i结合测定法结果的图像。所描绘的非变性电泳凝胶迁移测定法显示了,rig-i结合并不区分未修饰的和m6a修饰的circforeign。图11d是描绘用纯化的rig-i、mavs、指示的rna配体以及k63-聚泛素的不存在或存在的体外重构结果的图像。所描绘的荧光标记的mavs 2card结构域的非变性凝胶显示了,circforeign启动的mavs丝化依赖于k63-聚泛素。图11e是显示了circrna介导的irf3二聚化诱导的体外重构的图像。使rig-i、irf3和指示的rna配体温育。显示了具有指示的rna配体的放射性标记的irf3的非变性凝胶。细胞质rna (cytorna)和指示rna各自以0.5 ng/μl添加。
30.图12a是描绘了用纯化的rig-i、mavs、k63-ubn和指示的rna配体的体外重构的图像。显示了荧光标记的mavs 2card结构域的非变性凝胶。图12b包括在用指示rna的mavs聚合测定法后,mavs细丝的代表性电子显微镜检查图像。比例尺指示600 nm。图12c是显示了在每种激动剂rna的五个电子显微镜检查图像中,所观察到的mavs细丝总数的定量的图。*p《0.05,斯氏t检验。图12d是描绘了circrna介导的irf3二聚化诱导的体外重构的图像。显示了具有指示的rna配体的放射性标记的irf3的非变性凝胶。s1是细胞提取物。
31.图13a包括显示了circforeign与rig-i和k63-聚泛素链共定位的免疫荧光图像。显示了代表性的视野。图13b是显示了与rig-i和k63-ubn共定位的circforeign (n = 152)的定量的图。跨越生物复制的10个视野并代表复制实验收集了焦点。图13c包括免疫荧光图像,其显示了10% m6a circforeign已增加了与ythdf2的共定位。显示了代表性的视野。跨越》10个视野并代表复制实验收集了焦点。图13d是显示了与ythdf2和rig-i共定位的circforeign和10% m6a circforeign的定量的图。*p《0.05,皮尔森χ
²
检验。
32.图14是说明了rig-i识别外来circrna的提议机制的示意性图解,所述机制依赖于k63-聚泛素。
33.图15是显示了未修饰的circrna (即,缺乏m6a修饰)转染到野生型hela细胞内刺激免疫应答的图。该图显示了在rna转染之后24小时,先天免疫基因的基因表达。通过qrt-pcr测量指示mrna和转染rna的相对表达,结果针对模拟转染之后的表达进行标准化。显示了平均值
ꢀ±ꢀ
sem (n = 3)。
具体实施方式
34.本公开内容至少部分基于以下发现:人环状rna分子(circrna)的n6-甲基腺苷(m6a) rna修饰减少了circrna的免疫原性。外来circrna是在体内诱导抗原特异性t细胞活化、抗体产生和抗肿瘤免疫的有力佐剂,并且已发现其m6a修饰取消免疫基因活化和佐剂活性。m6a读取器蛋白ythdf2螯合m6a-circrna,并且对于先天免疫的压制是重要的。
35.定义为了促进本技术的理解,下文定义了多个术语和短语。在整个详细描述中阐述了另外的定义。
36.如本文使用的,术语“核酸”、“多核苷酸”、“核苷酸序列”和“寡核苷酸”可互换使
用,并且指嘧啶和/或嘌呤碱基的聚合物或寡聚物,所述嘧啶和/或嘌呤碱基分别优选胞嘧啶、胸腺嘧啶和尿嘧啶,以及腺嘌呤和鸟嘌呤。该术语涵盖任何脱氧核糖核苷酸、核糖核苷酸或肽核酸组分,及其任何化学变体,例如这些碱基的甲基化、羟甲基化或糖基化形式。聚合物或寡聚物在组成方面可以是异质的或均质的,可以从天然存在的来源中分离,或者可以是人工或合成产生的。另外,核酸可以是dna或rna或其混合物,并且可以以单链或双链形式,包括同源双链体、异源双链体和杂合状态永久或过渡性存在。在一些实施方案中,核酸或核酸序列包含其它种类的核酸结构,例如dna/rna螺旋、肽核酸(pna)、吗啉代核酸(参见例如,braasch和corey,biochemistry,41 (14): 4503-4510 (2002)和美国专利5,034,506)、锁核酸(lna;参见wahlestedt等人,proc. natl. acad. sci. u.s.a.,97: 5633-5638 (2000))、环己烯基核酸(参见wang,j. am. chem. soc.,122: 8595-8602 (2000))、和/或核酶。术语“核酸”和“核酸序列”还可以涵盖包含非天然核苷酸、修饰的核苷酸和/或可以显示出与天然核苷酸相同功能的非核苷酸构件单元(例如,“核苷酸类似物”)的链。
37.如本文使用的,术语“核苷”指附着到核糖或脱氧核糖的嘌呤或嘧啶碱基。dna或rna中通常发现的核苷包括胞苷、胞嘧啶、脱氧核苷、胸苷、尿苷、腺苷、腺嘌呤脱氧核苷、鸟苷和鸟嘌呤脱氧核苷。如本文使用的,术语“核苷酸”指dna或rna聚合物由其构建的单体单元之一,其包含嘌呤或嘧啶碱基、戊糖和磷酸基。dna的核苷酸是脱氧腺苷酸、胸苷酸、脱氧鸟苷酸和脱氧胞苷酸。rna的相应核苷酸是腺苷酸、尿苷酸、鸟苷酸和胞苷酸。
38.术语“肽”、“多肽”和“蛋白质”在本文中可互换使用,并且指包含至少两个或更多个邻接氨基酸的氨基酸的聚合形式,其可以包括编码的和非编码的氨基酸、化学或生物化学修饰或衍生的氨基酸、以及具有修饰的肽主链的多肽。
39.本文使用的关于核苷酸、核酸、核苷和氨基酸的命名法与国际纯粹与应用化学联合会(international union of pure and applied chemistry) (iupac)标准(参见例如,bioinformatics.org/sms/iupac.html)一致。
40.如本文使用的,术语“rrach基序”指五核苷酸dna或rna基序,其中r可以是a或g,并且h可以是a、c或t/u。rrach基序具有在dna中的共有序列5
’‑
(a或g)-(a或g)-a-c-(a或c或t)-3
’ꢀ
(seq id no: 17),或在rna中的共有序列5
’‑
(a或g)-(a或g)-a-c-(a或c或u)-3
’ꢀ
(seq id no: 18)。m6a修饰通常在真核细胞的rrach基序内发生。在许多细胞类型中,m6a的添加由多组分甲基转移酶复合物催化,所述复合物包括mettl3、mettl14和wtap。在一些实施方案中,可以修饰rrach基序(seq id no: 17-18)以减少或消除m6a修饰。例如,rrach基序可以被修饰为rruch基序(seq id no: 19-20)。
[0041]“抗原”是在哺乳动物中触发免疫应答的分子。“免疫应答”可能需要例如抗体产生和/或免疫效应细胞的激活。在本公开内容的上下文中的抗原可以包含在哺乳动物中激发免疫应答的任何蛋白质或非蛋白质(例如碳水化合物或脂质)分子的任何亚基、片段或表位。“表位”意指由抗体或抗原受体识别的抗原序列。表位在本领域中也被称为“抗原决定簇”。抗原可以是病毒、细菌、寄生虫、真菌、原生动物、朊病毒、细胞或细胞外起源的蛋白质或肽,其在哺乳动物中激发免疫应答,优选导致保护性免疫。
[0042]
如本文使用的,术语“重组”意指特定核酸(dna或rna)是克隆、限制性、聚合酶链反应(pcr)和/或连接步骤的各种组合的产物,导致具有可与天然系统中发现的内源性核酸区分的结构编码或非编码序列的构建体。编码多肽的dna序列可以从cdna片段或一系列合成
寡核苷酸进行组装,以提供合成核酸,其能够从细胞或无细胞转录和翻译系统中包含的重组转录单位表达。包含相关序列的基因组dna也可以用于形成重组基因或转录单位。非翻译dna的序列可能存在于开放读码框的5'或3',其中此类序列并不干扰编码区的操纵或表达,并且可以通过各种机制起作用而调节所需产物的产生。可替代地,编码未翻译的rna的dna序列也可以被视为重组的。因此,术语“重组”核酸还指并非天然存在的核酸,例如,通过经由人为干预将两个否则分开的序列区段人工组合进行制备。这种人工组合经常通过化学合成手段,或例如通过遗传改造技术,通过分离的核酸区段的人工操纵来完成。通常这样做是为了将密码子替换为编码相同氨基酸、保守氨基酸或非保守氨基酸的密码子。可替代地,可以执行人工组合,以将具有所需功能的核酸区段连接在一起,以生成所需的功能组合。这种人工组合经常通过化学合成手段,或例如通过遗传改造技术,通过分离的核酸区段的人工操纵来完成。当重组多核苷酸编码多肽时,所编码多肽的序列可以是天然存在的(“野生型”)或可以是天然存在的序列的变体(例如,突变体)。因此,术语“重组”多肽不一定指其序列并非天然存在的多肽。相反,“重组”多肽由重组dna序列编码,但多肽的序列可以是天然存在的(“野生型”)或非天然存在的(例如,变体、突变体等)。因此,“重组”多肽是人为干预的结果,但可以包含天然存在的氨基酸序列。
[0043]
术语“结合结构域”指能够与另一个分子非共价结合的蛋白质结构域。结合结构域可以结合例如dna分子(dna结合蛋白)、rna分子(rna结合蛋白)和/或蛋白质分子(蛋白质结合蛋白)。在蛋白质结构域结合蛋白质的情况下,蛋白质可以结合自身(以形成同二聚体、同三聚体等),和/或它可以结合一种或多种不同蛋白质的一个或多个分子。
[0044]
环状rna环状rna (circrna)是头尾相连的单链rna,并且最初在致病性基因组如丁型肝炎病毒(hdv)和植物类病毒中发现。circrna已被公认为真核细胞中普遍存在的一类非编码rna。由于其非凡的稳定性,通过反向剪接生成的circrna已被假定在细胞间信息传递或记忆中发挥功能。
[0045]
尽管内源性circrna的功能尚不清楚,但它们的大量数目和病毒circrna基因组的存在需要circrna免疫系统,如通过经由nf90/nf110调控的病毒抗性的人circrna调节 (li等人,2017)和经由pkr调控的自身免疫(liu等人,2019)的最近发现所证明的。如本文证实的,circrna可以充当有力的佐剂来诱导特异性t和b细胞应答。另外,circrna可以诱导先天性和适应性免疫应答两者,并且具有抑制肿瘤建立和生长的能力。
[0046]
因为内含子身份决定了circrna免疫(chen等人,同上),但不是最终circrna产物的部分,所以已假设内含子可以指导一种或多种共价化学标记在circrna上的沉积。在超过100种已知的rna化学修饰中,m6a是线性mrna和长链非编码rna上最丰富的修饰,存在于哺乳动物多聚a加尾的转录物中的所有腺苷的0.2%至0.6%上(roundtree等人,cell,169: 1187-1200 (2017))。最近已在哺乳动物circrna上检测到m6a (zhou等人,cell reports,20: 2262-2276 (2017))。如本文所述,基于编程其反向剪接(back splicing)的内含子,人circrna似乎在产生时通过一种或多种共价m6a修饰进行标记。
[0047]
在一些实施方案中,本文所述的方法涉及生成包含至少一个n6-甲基腺苷(m6a)的重组环状rna分子。可以使用常规分子生物学技术生成或改造重组circrna。如上文公开的,重组circrna分子通常通过线性rna的反向剪接来生成。在一个实施方案中,通过下游5'剪
接位点(剪接供体)至上游3'剪接位点(剪接受体)的反向剪接,从线性rna产生环状rna。可以通过任何非哺乳动物剪接方法,以这种方式生成环状rna。例如,含有各种类型的内含子的线性rna可以进行环化,所述内含子包括自剪接i型内含子、自剪接ii型内含子、剪接体内含子和trna内含子。特别地,i型和ii型内含子具有的优点在于,它们可以容易地用于在体外以及在体内生产环状rna,因为由于其自催化核酶活性,它们经历自剪接的能力。
[0048]
可替代地,环状rna可以通过rna的5'和3'端的化学或酶促连接,在体外从线性rna产生。可以例如使用用于激活核苷酸磷酸单酯基的溴化氰(brcn)或乙基-3-(3'-二甲基氨基丙基)碳二亚胺(edc)来执行化学连接,以允许磷酸二酯键形成(sokolova,febs lett,232:153-155 (1988);dolinnaya等人,nucleic acids res.,19: 3067-3072 (1991);fedorova,nucleosides nucleotides nucleic acids,15: 1137-1147 (1996))。可替代地,酶促连接可以用于使rna环化。可以使用的示例性连接酶包括t4 dna连接酶(t4 dnl)、t4 rna连接酶1 (t4 rnl 1)和t4 rna连接酶2 (t4 rnl 2)。
[0049]
在其它实施方案中,夹板连接(splint ligation)可以用于使rna环化。夹板连接涉及使用与线性rna的两端杂交的寡核苷酸夹板,以将线性rna的端部聚集在一起用于连接。可以是脱氧核糖寡核苷酸或核糖寡核苷酸的夹板的杂交,使rna端部的5'-磷酸和3'-oh定向用于连接。如上所述,可以使用化学或酶促技术执行后续连接。例如,可以用t4 dna连接酶(需要dna夹板)、t4 rna连接酶1 (需要rna夹板)或t4 rna连接酶2 (dna或rna夹板)执行酶促连接。如果杂交的夹板-rna复合物的结构干扰酶促活性,则化学连接例如brcn或edc在一些情况下比酶促连接更有效(参见例如,dolinnaya等人nucleic acids res,21 (23): 5403-5407 (1993);petkovic等人,nucleic acids res,43 (4): 2454-2465 (2015))。
[0050]
包含一种或多种m6a修饰的环状rna分子可以使用本领域已知的用于将非天然核苷酸引入核酸序列内的任何合适方法来生成。在一些实施方案中,可以使用体外转录方法,例如在例如chen等人,同上所述的那些方法,将m6a引入rna序列内。说明性的体外转录反应需要纯化的含有启动子的线性dna模板、核糖核苷三磷酸、包括dtt和镁的缓冲系统、以及适当的噬菌体rna聚合酶(例如,sp6、t7或t3)。如本领域技术人员理解的,转录反应中使用的确切条件取决于特定应用所需的rna量。
[0051]
如本文所述生成的特定circrna分子中的任何数目的腺苷可以用相应数目的m6a进行修饰(例如,替换)。理想地,circrna分子中至少一个腺苷由m6a替换。在一些实施方案中,重组环状rna分子中至少1% (例如,1%、2%、3%、4%、5%、6%、7%、8%、9%或更多)的腺苷由n6-甲基腺苷(m6a)替换。在其它实施方案中,重组环状rna分子中至少10% (例如,10%、11%、12%、13%、14%、15%、20%、30%、40%、50%、60%、70%、80%、90%或更多)的腺苷由n6-甲基腺苷替换。例如,重组环状rna分子中的所有(即100%)腺苷可以由n6-甲基腺苷(m6a)替换。应了解,引入重组环状rna分子内的m6a修饰的数目将取决于环状rna的特定用途,如本文进一步描述的。
[0052]
在一些实施方案中,通过体外转录产生环状rna分子的方法包括提供编码环状rna分子的dna模板、核糖核苷三磷酸和rna聚合酶;从dna模板转录线性rna;并且使线性dna环化,以形成环状rna。在一些实施方案中,核糖核苷三磷酸不包括任何n6-甲基腺苷-5
’‑
三磷酸(m6atp)。在一些实施方案中,环状rna能够在受试者中产生先天免疫应答。在一些实施方案中,环状rna能够在受试者中产生先天免疫应答。
[0053]
在一些实施方案中,通过体外转录产生环状rna分子的方法包括提供编码环状rna分子的dna模板、核糖核苷三磷酸和rna聚合酶;从dna模板转录线性rna;并且使线性dna环化,以形成环状rna。在一些实施方案中,核糖核苷三磷酸包含n6-甲基腺苷-5
’‑
三磷酸(m6atp)。在一些实施方案中,与使用相同方法但不存在m6atp的情况下产生的环状rna相比,环状rna是较低免疫原性的。环状rna的免疫原性可以通过测量在用环状rna处理后的炎症应答来确定。在一些实施方案中,环状rna的免疫原性可以通过测量在用环状rna处理后所产生的i型或ii型干扰素应答、或者一种或多种促炎细胞因子的水平来确定。例如,环状rna的免疫原性可以通过测量在环状rna处理后的干扰素α (ifnα)、干扰素β (ifnβ)、干扰素γ (ifnγ)、干扰素ω (ifnω)、白细胞介素1-β (il-1β)、白细胞介素6 (il-6)、肿瘤坏死因子α (tnf-α)、白细胞介素12 (il-12)、白细胞介素23 (il-23)或白细胞介素17 (il-17)的水平来确定。在一些实施方案中,免疫原性可以通过测量维甲酸诱导基因1 (rig-i)、黑色素瘤分化相关蛋白5 (mda5)、2'-5'-寡腺苷酸合成酶(oas)、oas样蛋白(oasl)和双链rna依赖性蛋白激酶(pkr)中的一种或多种的表达或活性来确定。可以在体外或体内评价免疫原性。如果与用第二环状rna处理后的炎症应答相比,用第一环状rna处理后的炎症应答减少,则第一环状rna的免疫原性低于第二环状rna。
[0054]
在一些实施方案中,环状rna被设计为具有所需水平的免疫原性。例如,环状rna可以被设计为高度免疫原性的、轻度免疫原性的、基本上非免疫原性的或非免疫原性的。环状rna的免疫原性可以通过修饰环状rna中存在的rrach基序的数目来控制,其中更多数目的rrach基序导致免疫原性减少,而更少的rrach基序导致免疫原性增加。在一些实施方案中,环状rna或编码其的dna序列包含1-5、5-10、10-25、25-100、100-250、250-500个或大于500个rrach基序。
[0055]
在一些实施方案中,重组环状rna分子中至少1%的腺苷是n6-甲基腺苷(m6a)。在一些实施方案中,重组环状rna分子中至少10%的腺苷是n6-甲基腺苷(m6a)。在一些实施方案中,重组环状rna分子中的所有腺苷都是n6-甲基腺苷(m6a)。
[0056]
在一些实施方案中,重组环状rna分子中小于1%的腺苷是n6-甲基腺苷(m6a)。例如,重组环状rna分子中小于0.9%、小于0.8%、小于0.7%、小于0.5%、小于0.4%、小于0.3%、小于0.2%或小于0.1%的腺苷可以是m6a。在一些实施方案中,重组环状rna包含1-5、5-10、10-25、25-100、100-250、250-500个或大于500个m6a残基。
[0057]
虽然环状rna一般比其线性对应物更稳定,主要是由于不存在外切核酸酶介导的降解所必需的游离端部,但可以对本文所述的m6a修饰的环状rna进行另外的修饰,以进一步改善稳定性。另外其它种类的修饰可以改善环化效率、circrna的纯化和/或来自circrna的蛋白质表达。例如,重组circrna可以被改造为包括“同源臂”(即,在前体rna的5'和3'端处放置的长度9-19个核苷酸,目的是使5'和3'剪接位点彼此接近)、间隔区序列和/或硫代磷酸酯(ps)帽(wesselhoeft等人,nat. commun.,9: 2629 (2018))。重组circrna还可以被改造为包括2'-o-甲基-、-氟-或-o-甲氧基乙基缀合物,硫代磷酸酯主链或2',4'-环状2'-o-乙基修饰,以增加其稳定性(holdt等人,front physiol.,9: 1262 (2018);kr
ü
tzfeldt等人,nature,438(7068): 685-9 (2005);以及crooke等人,cell metab.,27 (4): 714-739 (2018))。
[0058]
在一些实施方案中,环状rna分子包含至少一个内含子和至少一个外显子。如本文
使用的,术语“外显子”指存在于基因中的核酸序列,其在转录过程中切除内含子后以成熟形式的rna分子表示。外显子可以翻译成蛋白质(例如,在信使rna (mrna)的情况下)。如本文使用的,术语“内含子”指存在于给定基因中的核酸序列,其在最终rna产物成熟过程中通过rna剪接去除。内含子一般在外显子之间发现。在转录过程中,内含子从前体信使rna (mrna前体)中去除,并且外显子经由rna剪接进行连接。
[0059]
在一些实施方案中,环状rna分子包含核酸序列,其包括一个或多个外显子和一个或多个内含子。在一些实施方案中,环状rna分子包含一个或多个外显子。在一些实施方案中,环状rna分子不包含任何内含子。
[0060]
在一些实施方案中,环状rna分子可以包含人工序列。人工序列可以赋予有利的性质,例如期望的结合性质。例如,人工序列可以与一种或多种rna结合蛋白结合,或者可以与一种或多种微小rna互补。在一些实施方案中,人工序列可以是基因序列的乱序形式或来自天然存在的环状rna的序列。乱序序列通常具有与它由其衍生的序列相同的核苷酸组成。用于生成乱序核酸的方法是本领域技术人员已知的。在一些实施方案中,环状rna包含人工序列,但不包含外显子。在一些实施方案中,环状rna包含人工序列,并且还包含至少一个外显子。
[0061]
相应地,可以用内源或外源内含子生成环状rna,如wo 2017/222911中所述。来自各种各样的生物体和病毒的众多内含子序列是已知的,并且包括衍生自编码蛋白质、核糖体rna (rrna)或转移rna (trna)的基因的序列。代表性内含子序列可在各种数据库中获得,所述数据库包括i型内含子序列和结构数据库(rna.whu.edu.cn/gissd/)、细菌ii型内含子数据库(webapps2.ucalgary.ca/~groupii/index.html)、移动ii型内含子数据库(fp.ucalgary.ca/group2introns)、酵母内含子数据库(embls16 heidelberg.de/externalinfo/seraphin/yidb.html)、ares lab酵母内含子数据库(compbio.soe.ucsc.edu/yeast_introns.html)、u12内含子数据库(genome.crg.es/cgibin/u12db/u12db.cgi)和外显子-内含子数据库(bpg.utoledo.edu/~afedorov/lab/eid.html)。
[0062]
在某些实施方案中,重组环状rna分子由包含自剪接i型内含子的核酸编码。i型内含子是一类独特的rna自剪接内含子,其催化其自身从广泛范围的生物体中的mrna、trna和rrna前体中的切除。存在于真核细胞核中的所有已知的i型内含子都中断定位于核糖体dna基因座中的功能性核糖体rna基因。核i型内含子在真核微生物中普遍存在,并且原生质体粘菌(粘菌)含有丰富的自剪接内含子。包括在环状rna分子中的自剪接i型内含子可以得自或衍生自任何合适的生物体,例如细菌、细菌噬菌体和真核病毒。自剪接i型内含子也可能在某些细胞器例如线粒体和叶绿体中发现,并且此类自剪接内含子可以掺入编码环状rna分子的核酸内。
[0063]
在某些实施方案中,重组环状rna分子由包含噬菌体t4胸苷酸合酶(td)基因的自剪接i型内含子的核酸编码。噬菌体t4胸苷酸合酶(td)基因的i型内含子充分表征为当外显子线性剪接在一起时环化(chandry和belfort,genes dev.,1: 1028-1037 (1987);ford和ares,proc. natl. acad. sci. usa,91: 3117
–
3121 (1994);以及perriman和ares,rna,4: 1047-1054 (1998))。当侧接任何外显子序列的td内含子次序被置换(即,5'一半置于3'位置处,且反之亦然)时,外显子经由两个自催化酯交换反应进行环化(ford和ares,同上;
puttaraju和been,nucleic acids symp. ser.,33: 49-51 (1995))。
[0064]
在一些实施方案中,本文所述的重组环状rna可以包含内部核糖体进入位点(ires),其可以可操作地连接至编码多肽的rna序列。ires的包括允许来自环状rna的一个或多个开放读码框的翻译。ires元件吸引真核核糖体翻译起始复合物并促进翻译起始(参见例如,kaufman等人,nuc. acids res.,19: 4485-4490 (1991);gurtu等人,biochem. biophys. res. comm,229: 295-298 (1996);rees等人,biotechniques,20: 102-110 (1996);kobayashi等人,biotechniques,21: 399-402 (1996);以及mosser等人,biotechniques,22: 150-161 (1997))。
[0065]
许多ires序列是本领域已知的,并且可以包括在环状rna分子中。例如,ires序列可以衍生自各种各样的病毒,例如微小核糖核酸病毒(例如,脑心肌炎病毒(emcv) utr)的前导序列(jang等人,j. virol.,63: 1651-1660 (1989))、脊髓灰质炎前导序列、甲型肝炎病毒前导区、丙型肝炎病毒ires、人鼻病毒2型ires (dobrikova等人,proc. natl. acad. sci.,100 (25): 15125-15130 (2003))、来自口蹄疫病毒的ires元件(ramesh等人,nucl. acid res.,24: 2697-2700 (1996))和贾第虫病毒ires (garlapati等人,j. biol. chem.,279(5): 3389-3397 (2004))。各种非病毒ires序列也可以包括在环状rna分子中,包括但不限于来自酵母的ires序列、人血管紧张素ii 1型受体ires (martin等人,mol. cell endocrinol., 212: 51-61 (2003))、成纤维细胞生长因子ires (例如,fgf-1 ires和fgf-2 ires,martineau等人,mol. cell. biol.,24 (17): 7622-7635 (2004))、血管内皮生长因子ires (baranick等人,proc. natl. acad. sci. u.s.a.,105 (12): 4733-4738 (2008);stein等人,mol. cell. biol.,18(6): 3112-3119 (1998);bert等人,rna,12 (6): 1074-1083 (2006))、以及胰岛素样生长因子2 ires (pedersen等人,biochem. j.,363 (pt 1): 37-44 (2002))。
[0066]
在一些情况下,重组环状rna包含可操作地连接到ires的编码蛋白质或多肽的序列。可以设计包含ires的重组环状rna,以产生适当大小的任何目的多肽。例如,环状rna可以包含可操作地连接至编码免疫原性多肽的rna序列的ires,所述免疫原性多肽例如来自细菌、病毒、真菌、原生生物或寄生虫的抗原。可替代地,环状rna可以包含可操作地连接至编码治疗性多肽的rna序列的ires,所述治疗性多肽例如用于治疗遗传病症、癌症或其它疾病的酶、激素、神经递质、细胞因子、抗体、肿瘤抑制蛋白或细胞毒素剂。
[0067]
ires元件是本领域已知的,并且编码其的核苷酸序列和载体从各种来源商购可得,所述来源例如clontech (mountain view,ca)、invivogen (san diego,ca)、addgene (cambridge,ma)和genecopoeia (rockville,md),以及iresite:实验验证的ires结构数据库(iresite.org)。
[0068]
可以使用标准分子生物学技术制备编码用于本公开内容中的所需rna、多肽、内含子和ires的多核苷酸。例如,可以使用重组方法制备多核苷酸序列,例如通过从细胞中筛选cdna和基因组文库、或通过从已知包括其的载体中切除多核苷酸。基于已知序列,多核苷酸也可以合成而不是克隆产生。完整序列可以从通过标准方法制备的重叠寡核苷酸进行组装,然后组装并连接成完整序列(参见例如,edge,nature,292: 756 (1981);nambair等人,science,223: 1299 (1984);以及jay等人,j. biol. chem.,259: 6311 (1984))。用于获得或合成核酸序列的其它方法包括但不限于定点诱变和聚合酶链反应(pcr)技术(公开于
例如greene,m.r.和sambrook,j.,molecular cloning: a laboratory manual,cold spring harbor laboratory press;第4版(2012年6月15日))、自动化多核苷酸合成仪(参见例如,jayaraman等人,proc. natl. acad. sci. usa,88: 4084-4088 (1991))、寡核苷酸定向合成(jones等人,nature,54: 75-82 (1986))、预先存在的核苷酸区域的寡核苷酸定向诱变(riechmann等人,nature 332: 323-327 (1988);以及verhoeyen等人,science,239: 1534-1536 (1988))、以及有缺口的寡核苷酸使用t4 dna聚合酶的酶促填入(queen等人,proc. natl. acad. sci. usa,86: 10029-10033 (1989))。
[0069]
重组环状rna分子可以具有任何合适的长度或大小。例如,重组环状rna分子可以包含约200个核苷酸至约6,000个核苷酸(例如,约300、400、500、600、700、800、900、1,000、2,000、3,000、4,000、5,000个核苷酸,或由前述值中的任何两个限定的范围)。在一些实施方案中,重组环状rna分子包含约500至约3,000个核苷酸(约550、650、750、850、950、1,100、1,200、1,300、1,400、1,500、1,600、1,700、1,800、1,900、2,100、2,200、2,300、2,400、2,500、2,600、2,700、2,800、2,900个核苷酸,或由前述值中的任何两个限定的范围)。在一个实施方案中,重组环状rna分子包含约1,500个核苷酸。
[0070]
作为佐剂的circrna不含m6a的circrna分子可以用于在受试者中激发免疫应答。因此,在一些实施方案中,缺乏m6a的circrna可以用作佐剂,例如用作疫苗组合物的部分。
[0071]
在一些实施方案中,将免疫原性环状rna施用于有需要的受试者。在一些实施方案中,免疫原性环状rna不含任何m6a残基。
[0072]
在一些实施方案中,环状rna包含编码多肽的序列。多肽可以是例如抗原性多肽。在一些实施方案中,多肽包含多重(即,至少两种)抗原。抗原可以具有病毒、细菌、寄生虫、真菌、原生动物、朊病毒、细胞或细胞外起源。在一些实施方案中,至少一种抗原是肿瘤抗原。在一些实施方案中,疫苗组合物的环状rna包含可操作地连接到编码多肽的序列的内部核糖体进入位点(ires)。
[0073]
在一些实施方案中,环状rna在施用于受试者之前离体合成。在一些实施方案中,环状rna使用体外转录产生。
[0074]
在一些实施方案中,环状rna作为裸露rna施用于受试者。在一些实施方案中,环状rna与纳米颗粒例如聚乙烯亚胺(pei)纳米颗粒复合。
[0075]
在一些实施方案中,将包含编码环状rna的dna序列的载体施用于受试者。在一些实施方案中,编码环状rna的dna序列包含阻止环状rna的m6a修饰的特征。例如,dna序列可能不包含rrach基序(seq id no: 17)。载体可以是例如非病毒载体如质粒。在一些实施方案中,载体是病毒载体,例如腺病毒载体、腺伴随病毒载体、逆转录病毒载体、慢病毒载体或疱疹病毒载体。
[0076]
在一些实施方案中,载体靶向一种或多种特异性细胞类型。例如,载体可以特异性或优先结合一种细胞类型,而不是另一种细胞类型。在一些实施方案中,载体靶向癌细胞。
[0077]
在一些实施方案中,疫苗组合物包含环状rna。在一些实施方案中,疫苗组合物包含不含任何n6-甲基腺苷(m6a)残基的环状rna分子。在一些实施方案中,环状rna缺乏rrach基序(seq id no: 18)。在一些实施方案中,环状rna包含一个或多个rruch基序(seq id no: 20)。
(2): 138-147 (2010)中进一步描述。
[0085]
在形成包含附着到重组环状rna分子的物质的复合物之后,该方法包括使细胞与复合物接触,由此将物质递送至细胞。任何合适的原核细胞或真核细胞都可以与复合物接触。合适的原核细胞的实例包括但不限于来自芽孢杆菌属(bacillus) (例如枯草芽孢杆菌(bacillus subtilis)和短芽孢杆菌(bacillus brevis))、埃希氏菌属(escherichia) (例如大肠杆菌)、假单胞菌属(pseudomonas)、链霉菌属(streptomyces)、沙门氏菌属(salmonella)和欧文氏菌属(erwinia)的细胞。特别有用的原核细胞包括各种大肠杆菌菌株(例如,k12、hb101 (atcc编号33694)、dh5α、dh10、mc1061 (atcc编号53338)和cc102)。
[0086]
合适的真核细胞是本领域已知的,并且包括例如酵母细胞、昆虫细胞和哺乳动物细胞。合适的酵母细胞的实例包括来自汉逊酵母属(hansenula)、克鲁维酵母属(kluyveromyces)、毕赤酵母属(pichia)、鼻孢子菌属(rhinosporidium)、酵母属(saccharomyces)和裂殖酵母属(schizosaccharomyces)的那些细胞。合适的昆虫细胞包括sf-9和his细胞(invitrogen,carlsbad,calif.),并且在例如kitts等人,biotechniques,14: 810-817 (1993);lucklow,curr. opin. biotechnol.,4: 564-572 (1993);以及lucklow等人,j. virol.,67: 4566-4579 (1993)中进行描述。
[0087]
在某些实施方案中,细胞是哺乳动物细胞。许多合适的哺乳动物细胞是本领域已知的,其中许多可从美国典型培养物保藏中心(atcc,manassas,va.)获得。合适的哺乳动物细胞的实例包括但不限于中国仓鼠卵巢细胞(cho) (atcc编号ccl61),cho dhfr-细胞(urlaub等人,proc. natl. acad. sci. usa,97: 4216-4220 (1980))、人胚肾(hek) 293或293t细胞(atcc编号crl1573)和3t3细胞(atcc编号ccl92)。其它合适的哺乳动物细胞系是猴cos-1 (atcc编号crl1650)和cos-7细胞系(atcc编号crl1651),以及cv-1细胞系(atcc编号ccl70)。进一步的示例性哺乳动物宿主细胞包括灵长类动物细胞系和啮齿类动物细胞系,包括转化细胞系。正常二倍体细胞、衍生自原代组织的体外培养的细胞株以及原代外植体也是合适的。其它合适的哺乳动物细胞系包括但不限于小鼠神经母细胞瘤n2a细胞、hela、小鼠l-929细胞和bhk或hak仓鼠细胞系,所有这些都可从atcc获得。用于选择合适的哺乳动物宿主细胞的方法,以及用于转化、培养、扩增、筛选和纯化此类细胞的方法是本领域众所周知的(参见例如,ausubel等人,编辑,short protocols in molecular biology,第5版,john wiley & sons,inc.,hoboken,n.j. (2002))。
[0088]
优选地,哺乳动物细胞是人细胞。例如,哺乳动物细胞可以是人免疫细胞,特别是可以将抗原或表位呈递给免疫系统的细胞。人免疫细胞的实例包括淋巴细胞(例如,b或t淋巴细胞)、单核细胞、巨噬细胞、嗜中性粒细胞和树突状细胞。在一个实施方案中,细胞是巨噬细胞。
[0089]
包含附着至物质的重组环状rna分子的复合物可以通过任何合适的方法引入细胞内,所述方法包括例如通过转染、转化或转导。术语“转染”、“转化”和“转导”在本文中可互换使用,并且指通过使用物理或化学方法将一种或多种外源多核苷酸引入宿主细胞内。许多转染技术是本领域已知的,并且包括例如磷酸钙dna共沉淀;deae-葡聚糖;电穿孔;阳离子脂质体介导的转染;钨粒促进的微粒轰击;和磷酸锶dna共沉淀。
[0090]
在一些实施方案中,复合物可以以与物质缀合的裸露rna的形式递送至细胞。在一些实施方案中,复合物可以与纳米颗粒例如聚乙烯亚胺(pei)纳米颗粒复合用于递送至细
胞。
[0091]
在一些实施方案中,组合物包含与物质缀合的rna,并且可以任选地包含药学上可接受的载体。载体的选择将部分由特定的环状rna分子和环状rna分子引入其内的细胞(或多种细胞)类型确定。相应地,各种合适的组合物制剂是可能的。例如,组合物可以含有防腐剂,例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。可以任选地使用两种或更多种防腐剂的混合物。另外,缓冲剂可以用于组合物中。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾以及各种其它酸和盐。可以任选地使用两种或更多种缓冲剂的混合物。用于制备用于药物用途的组合物的方法是本领域技术人员已知的,并且在例如remington: the science and practice of pharmacy,lippincott williams & wilkins;第21版(2005年5月1日)中更详细地描述。
[0092]
在其它实施方案中,含有包含附着到物质的重组环状rna分子的复合物的组合物可以配制为包合络合物,例如环糊精包合络合物,或脂质体。脂质体可以用于靶向宿主细胞或增加环状rna分子的半衰期。用于制备脂质体递送系统的方法在例如szoka等人,ann. rev. biophys. bioeng.,9: 467 (1980),以及美国专利4,235,871;4,501,728;4,837,028;和5,019,369中进行描述。复合物也可以配制为纳米颗粒。
[0093]
用于螯合rna结合蛋白的circrna本公开内容还提供了在细胞中螯合rna结合蛋白的方法,其包括(a)生成包含至少一个n6-甲基腺苷(m6a)和一个或多个rna结合蛋白结合基序的重组环状rna分子;并且(b)使包含rna结合蛋白的细胞与重组环状rna分子接触,由此所述rna结合蛋白与一个或多个rna结合蛋白结合基序结合,并且在细胞中被螯合。如上所述的重组环状rna分子、m6a修饰、生成重组环状rna分子的方法、使细胞与环状rna接触的方法及其组分的描述也适用于在细胞中螯合rna结合蛋白的方法的那些相同方面。
[0094]
rna结合蛋白在rna代谢,协调rna-蛋白质和蛋白质-蛋白质相互作用网络,以及调控rna剪接、成熟、翻译、转运和周转中起主要作用。rna结合蛋白的异常表达、功能障碍和聚集已在几个主要类别的人疾病中得到鉴定,所述疾病包括神经障碍、肌肉萎缩和癌症。因此,特别是当在细胞中异常表达时,rna结合蛋白可能与疾病相关。
[0095]
rna结合蛋白通常含有一个或多个rna识别基序(rrm) (也被称为“rna结合基序”)。众多rrm因各种不同的rna结合蛋白而已知。核糖核蛋白(rnp)结构域(也称为“rna识别基序(rrm)”和“rna结合结构域(rbd)”)是真核生物中最丰富的蛋白质结构域之一。rnp结构域含有大约90个氨基酸的rna结合结构域,其包括两个共有序列:rnp-1和rnp-2。rnp-1包含主要是芳族且带正电荷的八个保守残基,而rnp-2是由六个氨基酸残基组成的较不保守的序列。rnp结构域已显示对于结合具有广泛特异性和亲和力的rna分子是必要和充分的。其它rna结合结构域包括但不限于锌指结构域、hnrnp k同源性(kh)结构域和双链rna结合基序(dsrbm) (参见例如,cl
é
ry a,h.-t. allain f.,from structure to function of rna binding domains. in: madame curie bioscience database,austin (tx): landes bioscience (2000-2013))。生成重组环状rna分子,以含有由rrm或rna结合基序识别的一个或多个结构域(即,“rna结合蛋白结合结构域”)。包括在重组circrna分子中的rna结合蛋白结合结构域的选择将取决于靶向用于在细胞中螯合的特异性rna结合蛋白。可以使用常规分子生物学和/或重组dna技术生成重组环状rna分子,以包括一个或多个rna结合蛋白结
合结构域。
[0096]
在某些实施方案中,rna结合蛋白在与重组circrna分子接触的细胞中异常表达。如上文提到的,rna结合蛋白的异常表达已与疾病如神经障碍、肌肉萎缩和癌症相关。rna结合蛋白的表达是“异常的”,因为它是不正常的。在这点上,编码rna结合蛋白的基因可能在细胞中异常表达,导致异常量的rna结合蛋白。可替代地,基因表达可能是正常的,但rna-蛋白质的产生是失调或功能失调的,以便导致细胞中异常量的蛋白质。异常表达包括但不限于过表达、表达不足、表达的完全缺乏或表达的时间失调(例如,基因在细胞中在不适当的时间表达)。细胞中以正常水平的突变体或变体rna结合蛋白的表达也可以被视为rna结合蛋白的异常表达。因此,在一些实施方案中,rna结合蛋白由包含至少一种突变(例如缺失、插入或取代)的核酸序列编码。
[0097]
在一些实施方案中,环状rna可以以裸露rna的形式递送至细胞中。在一些实施方案中,环状rna可以与纳米颗粒例如聚乙烯亚胺(pei)纳米颗粒复合,用于递送至细胞。
[0098]
circrna先天免疫原性的调节取决于其最终应用,可能期望调节环状rna分子的先天免疫原性。术语“先天免疫原性”和“先天免疫”在本文中可互换使用,并且指在暴露于抗原后立即或数小时内出现的非特异性防御机制。这些机制包括物理屏障例如皮肤、血液中的化学制品以及攻击生物体内的外来细胞的免疫系统细胞。例如,当circrna分子用于在细胞中螯合rna结合蛋白时,可以减少由circrna分子诱导的先天免疫原性,以便减少其清除率且使蛋白质螯合的功效达到最大。在这点上,本公开内容提供了减少环状rna分子在受试者中的先天免疫原性的方法,其中所述方法包括:(a)提供在受试者中诱导先天免疫应答的环状rna分子;并且(b)将选自n6-甲基腺苷(m6a)、假尿苷和肌苷的至少一种核苷引入环状rna分子内,以提供具有减少的先天免疫原性的修饰的环状rna分子。如上所述的环状rna分子、m6a修饰、生成重组环状rna分子的方法及其组分的描述也适用于减少环状rna在受试者中的先天免疫原性的方法的那些相同方面。
[0099]
假尿苷(也称为“psi”或“ψ”),rna中发现的最丰富的修饰核苷之一,存在于广泛范围的细胞rna中,并且跨越物种是高度保守的。假尿苷经由通过ψ合成酶催化的碱基特异性异构化而衍生自尿苷(u)。肌苷是当次黄嘌呤经由β-n9-糖苷键与核糖环(也称为呋喃核糖)附着时形成的核苷。肌苷通常在trna中发现,并且对于摆动碱基对中的遗传密码的正确翻译是必要的。图15证实了将肌苷或假尿苷引入环状rna内影响环状rna免疫。不受任何理论束缚,认为将肌苷或假尿苷引入环状rna内阻止其m6a修饰。理想地,至少1% (例如,1%、2%、3%、4%、5%、6%、7%、8%、9%或更多)的环状rna分子含有m6a、假尿苷和/或肌苷。在其它实施方案中,至少10% (例如,10%、11%、12%、13%、14%、15%、20%、30%、40%、50%、60%、70%、80%、90%或更多)的环状rna分子含有m6a、假尿苷和/或肌苷。
[0100]
可替代地,在其中使用circrna将抗原蛋白(例如,肿瘤或癌症抗原)递送至细胞的实施方案中,可以增加circrna分子的先天免疫原性。为此,本公开内容还提供了增加环状rna分子在受试者中的先天免疫原性的方法,所述方法包括:(a)生成缺乏rrach基序(seq id no: 18)的环状rna分子;和/或(b)用另一种碱基(例如u、g、c或肌苷)替换至少一个外显子中的一个或多个腺苷,以提供具有增加的先天免疫原性的修饰的环状rna分子。如上所述的环状rna分子、生成重组环状rna分子的方法及其组分的描述也适用于增加环状rna在受
试者中的先天免疫原性的方法的那些相同方面。
[0101]
如下文实施例中讨论的,rrach (seq id no: 17-18)是用于m6a修饰的共有基序。因此,在一些实施方案中,可以通过将基序中的“a”替换为另一种碱基或碱基组合,例如尿嘧啶(“u”)、鸟嘌呤(“g”)或胞嘧啶(“c”),将环状 rna 分子改造为缺少 rrach 基序(seq id no: 18);然而,rrach基序中的任何核苷酸都可以由另一种碱基或碱基组合替换。理想地,环状rna分子中至少1% (例如,1%、2%、3%、4%、5%、6%、7%、8%、9%或更多)的腺苷由另一种碱基(例如,尿嘧啶)或碱基组合替换。在其它实施方案中,环状rna分子中至少10% (例如,10%、11%、12%、13%、14%、15%、20%、30%、40%、50%、60%、70%、80%、90%或更多)的腺苷由另一种碱基(例如,尿嘧啶)或碱基组合替换。例如,环状rna分子中的所有(即100%)腺苷可以由另一种碱基(例如,尿嘧啶)或碱基组合替换。
[0102]
减少或增加环状rna分子的先天免疫原性的方法可以进一步包括将修饰的环状rna施用于受试者。可以使用标准施用技术,包括经口、静脉内、腹膜内、皮下、肺部、经皮、肌内、鼻内、颊、舌下、阴道或栓剂施用,将修饰的环状rna或包含其的组合物施用于受试者(例如哺乳动物)。
[0103]
在一些实施方案中,环状rna可以以裸露rna的形式递送至细胞。在一些实施方案中,环状rna可以与纳米颗粒例如聚乙烯亚胺(pei)纳米颗粒复合,用于递送至细胞。
[0104]
下述实施例进一步说明本发明,但当然不应解释为以任何方式限制其范围。
实施例
[0105]
在实施例中描述的实验中使用了下述材料和方法。
[0106]
质粒编码通过自催化剪接表达circrna的噬菌体内含子的质粒先前在(chen等人,同上)中进行描述。in-fusion
®ꢀ
hd组装(takara bio,638910)用于构建编码噬菌体内含子的质粒,所述内含子表达具有掺入的boxb基序的外来circgfp。表达具有和不具有λn的ythdf1n和ythdf2n的质粒由dr. chuan he (university of chicago)提供。用in-fusion
®ꢀ
hd构建表达ythdf2蛋白结构域截短的质粒。所有质粒都在lb培养基中生长的neb
®ꢀ
turbo感受态大肠杆菌细胞(new england biolabs,c2984h)中繁殖,并且使用zymopure ii
™ꢀ
plasmid prep kits (zymo research,d4200)进行纯化。
[0107]
rna合成和纯化遵循制造商的说明书,使用megascript t7转录试剂盒(ambion,am1334),通过体外转录合成rna,并且在37
°
c下温育过夜或至少8小时。使用megascript
®ꢀ
t7转录试剂盒(ambion,am1334),并且以与转录试剂盒的atp的指定比率添加m6atp (trilink,n-1013),通过体外转录以相同的方式合成m6a标记的rna。转录的circforeign通过rneasy
®ꢀ
mini柱(qiagen,74106)进行纯化,然后用rna酶r (epicenter,rnr07250)以下述方式进行处理:circforeign二级结构在72
°
c下变性5分钟,随后为在冰上2分钟;以1u:1 μg rna的比率添加rna酶r,并在37
°
c下温育2-3小时。circrnalinear rna未用rna酶r进行处理。circforeign然后通过rneasy
®
柱进行纯化。circforeign或线性rna然后通过fastap
™
以下述方式进行磷酸酶处理:以1u:1μg circforeign的比率添加fastap
™
,在37
°
c下温育2小时,然后通过rneasy
®
柱进行纯化。通过tapestation分析(agilent,5067-5576)评价rna质
量。
[0108]
通过在72
°
c下用凝胶上样缓冲液ii (thermo fisher scientific,am8547)使rna变性3分钟,随后为在冰上2分钟,使circforeign凝胶纯化,然后加载到1%低熔点琼脂糖上。在蓝光透射仪(clare chemical)上完成凝胶提取,随后为遵循制造商的说明书的zymoclean
™ꢀ
gel recovery kit (zymo research,r1011)纯化,除了在室温下旋转10分钟完成的熔化之外。
[0109]
hplc分级分离用4.6
×
300mm尺寸排阻柱(sepax technologies,215980p-4630)执行,所述柱具有5 μm的粒度和2000
ꢀå
的孔径。无核酸酶te缓冲液以0.3 ml/分钟的流速用作流动相。在后续质量控制和实验使用之前,将rna级分手动收集,冻干,然后用rna clean & concentrator-5 (zymo research,r1013)净化。
[0110]
m6a-irclip通过使用poly(a)purist mag kit (thermo fisher scientific,am1922)去除mrna (多聚a-),并且使用ribominus
™ꢀ
eukaryote system v2试剂盒(thermo fisher scientific,a15026)去除核糖体rna (核糖-),使10 μg总rna富含circrna。然后使用rna片段化缓冲液(rna)在75
°
c下12分钟,将所得的多聚a-/核糖-rna片段化至35-100 nt大小。使片段化的rna变性,然后与抗m6a抗体(synaptic systems,202003)一起在4℃下在ipp缓冲液(50 mm tris-hcl,ph 7.4;100 mm nacl;0.05% np-40;5 mm edta)中温育两小时。然后使用以0.15j (stratalinker 2400)的两轮交联,使用uv光(254 nm),使rna和抗体交联。然后使交联的rna和抗体与protein a dynabeads (thermo fisher scientific,10002d)一起在4
°
c下温育2小时。珠然后用ipp缓冲液在4
°
c下伴随旋转洗涤一次共10分钟,用低盐缓冲液(50 mm tris,ph 7.4;50 mm nacl;1 mm edta;0.1% np-40)在4
°
c下伴随旋转洗涤一次共10分钟,用高盐缓冲液(50 mm tris
–
hcl ph 7.4、1m nacl、1% np-40、0.1% sds)在4
°
c下伴随旋转洗涤一次共10分钟,转移到新的1.5 ml管中,并且用pnk缓冲液(20 mm tris-hcl,ph 7.4;10 mm mgcl2;0.2% tween 20)洗涤两次。然后使用irclip方法(zarnegar等人,2016)制备文库。文库通过bioanalyzer检查质量,并且提交用于用定制测序引物p6_seq在nextseq500上的测序,如irclip方法中所述。将读数映射到hg38,随后映射到circgfp序列的定制组装,并且使用umi工具(smith等人,2017)去除pcr重复。使用fast-iclip管线(flynn等人,2015)鉴定了可重复的rt终止点。
[0111]
m6a-rip-seq通过使用poly(a)purist mag kit (thermo fisher scientific,am1922)去除mrna (多聚a-),并且使用ribominus
™ꢀ
eukaryote system v2试剂盒(thermo fisher scientific,a15026)去除核糖体rna (核糖-),使10 μg总rna富含circrna。然后用rna酶r处理剩余的rna,以去除残留的线性rna。然后用rna片段化缓冲液(thermo fisher scientific,am8740)在75
°
c下将多聚a-/核糖
‑ꢀ
rna酶r+ rna片段化12分钟。3
ꢀµ
g抗m6a (synaptic systems,202003)在室温下与protein a dynabeads结合2小时。抗体结合的珠然后用ipp缓冲液(50mm tris-hcl,ph 7.4;100mm nacl;0.05% np-40;5mm edta)进行洗涤,并且重悬浮于具有1
ꢀµ
l ribolock
™ꢀ
(thermo fisher scientific,eo0382)的ipp中。使ipp缓冲液中的片段化rna与抗体和珠一起在4
°
c下伴随旋转温育2小时。rna结合的珠然后用ipp缓冲液在4
°
c下伴随旋转洗涤一次共10分钟,用低盐缓冲液(50 mm tris,ph 7.4;
50 mm nacl;1 mm edta;0.1% np-40)在4
°
c下伴随旋转洗涤一次共5分钟,用高盐缓冲液(50 mm tris
–
hcl ph 7.4、1m nacl、1% np-40、0.1% sds)在4
°
c下伴随旋转洗涤一次共5分钟。然后将珠重悬浮于300
ꢀµ
l高盐缓冲液中,并且转移到新的1.5 ml管中。珠用pnk缓冲液(20 mm tris-hcl,ph 7.4;10 mm mgcl2;0.2% tween 20)进行洗涤,然后重悬浮于500
ꢀµ
l trizol中,并且在25
°
c下温育5分钟。加入150
ꢀµ
l氯仿:异戊醇并混合,然后在25
°
c下温育2分钟。在4
°
c下以13,000xg旋转10分钟后,将水层转移到新的1.5 ml管中,并且用rna clean & concentrator-5 (zymo research,r1013)提纯。rna在10
ꢀµ
l无核酸酶水中洗脱。向洗脱的rna和10%的输入rna加入10
ꢀµ
l末端修复混合物(4
ꢀµ
l 5x pnk缓冲液;1
ꢀµ
l ribolock
™
,1
ꢀµ
l fastap
™
;2
ꢀµ
l t4 pnk,2
ꢀµ
l无核酸酶水)。使反应在37
°
c下温育1小时。加入20
ꢀµ
l接头连接混合物(2
ꢀµ
l 10x rna连接缓冲液;2
ꢀµ
l 100 mm dtt;2
µ
l l3接头(zarnegar等人,2016);2
ꢀµ
l t4 rna连接酶缓冲液;12
ꢀµ
l peg8000 50% w/v)。使反应在25
°
c下温育3小时,然后用rna clean & concentrator-5柱提纯。加工的rna在10
ꢀµ
l无核酸酶水中洗脱。使用irclip方法(zarnegar等人,2016)制备文库,并且使用定制测序引物(p6_seq (zarnegar等人,2016))在nextseq 500上进行测序。读数与hg38和circgfp序列进行比对。bam文件针对基因组映射读数进行标准化。
[0112]
逆转录和实时pcr分析(rt-qpcr)遵照制造商的说明书,使用trizol
®ꢀ
(invitrogen,15596018)和direct-zol
®ꢀ
rna miniprep (zymo research,r2052),伴随柱上dna酶i消化,从细胞中分离总rna。使用brilliant ii sybr green qrt-pcr master mix (agilent,600825)和lightcycler 480 (roche),一式三份地执行rt-qpcr分析。使用的引物显示于表1中。mrna水平针对肌动蛋白或gapdh值进行标准化。用于circrna转染的指示mrna基因的相对表达通过转染的rna水平进行标准化,并且绘制为针对具有模拟或线性rna转染的细胞表达水平的倍数变化。
[0113]
表1. qrt-pcr引物寡核苷酸名称序列seqidno:hactb1qrt-pcrfgaggcactcttccagcctt1hactb1qrt-pcrraaggtagtttcgtggatgcc2hrig-i qrt-pcrftgtgggcaatgtcatcaaaa3hrig-iqrt-pcrrgaagcacttgctacctcttgc4hmda5qrt-pcrfggcaccatgggaagtgatt5hmda5qrt-pcrratttggtaaggcctgagctg6hoas1 qrt-pcrfgctcctaccctgtgtgtgtgt7hoas1qrt-pcrrtggtgagagtactgaggaaga8hoasl qrt-pcrfagggtacagatgggacatcg9hoaslqrt-pcrraagggttcacgatgaggttg10hpkr qrt-pcrftcttcatgtatgtgacactgc11hpkrqrt-pcrrcacacagtcaaggtcctt12circrna-连接qrt-pcrfgataagcttgccacctcagtagatg13circrna-连接qrt-pcrratccatcacactggcatatgac14linrnaqrt-pcrfactacctgagcacccagtcc15
linrnaqrt-pcrrcttgtacagctcgtccatgc16细胞系和维持人hela (宫颈腺癌,atcc ccl-2)和hek 293t(胚肾,atcc crl-3216)细胞在达尔贝科改良伊格尔培养基(dmem,invitrogen,11995-073)中生长,所述培养基补充有100单位/ml青霉素-链霉素(gibco,15140-163)和10% (v/v)胎牛血清(invitrogen,12676-011)。细胞生长维持在37
°
c下在5% co2大气中。
[0114]
细胞培养和瞬时转染在转染前24小时将细胞铺平板。细胞处于70%至80%汇合的,并且使用lipofectamine 3000 (thermo fisher scientific,l3000008)用rna进行转染。使用lipofectamine 3000 (thermo fisher scientific,l3000008),将500 ng线性rna或circforeign转染到24孔板的一个孔内。按照制造商的说明书,在opti-mem (invitrogen,31985-088)中稀释具有p3000和lipofectamine 3000的核酸,并在室温下温育5分钟。然后将核酸和lipofectamine 3000混合在一起,在室温下温育15分钟,然后将核酸-lipofectamine 3000复合物逐滴施加到单层培养物中。在异位蛋白质表达的情况下,按照制造商的说明书,用neon
™ꢀ
transfection system (thermo fisher scientific mpk5000s)对细胞进行电穿孔。在大多数情况下,细胞以2 x 107/ml重悬浮于缓冲液r中,并且用100 μl neon
™
吸头,对5 μg dna质粒进行电穿孔。12小时后,将细胞传代并铺平板,使得24小时后,它们将是70%至80%汇合的。24小时后,然后如上所述用rna与lipofectamine转染细胞。转染24小时后,细胞用pbs洗涤一次,并且每24孔加入300 μl trizol
®
试剂。用direct-zol
®ꢀ
rna miniprep收获rna。
[0115]
蛋白质印迹分析在转染后24小时,将hela细胞收集并裂解,以提取总蛋白。ripa缓冲液(150 mm nacl、1% triton x-100、0.5%脱氧胆酸钠、0.1% sds、50 mm tris,ph 8.0)用于裂解细胞。蛋白质通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)进行分级分离,转移到硝酸纤维素膜,在含有5% (wt/vol)脱脂乳的磷酸盐缓冲盐水中在室温下封闭1小时,然后在4℃下与表2中所示的一抗一起温育过夜。根据制造商的说明书,使用irdye 800cw山羊抗兔igg (li-cor,926-32211)或irdye 680cw驴抗山羊igg (li-cor,926-68074)二抗。使用odyssey红外成像系统(li-cor)完成蛋白质印迹检测和定量。
[0116]
表2
ythdf2拯救和ythdf1/2栓系到circboxb如上所述,经由neon
™
transfectionsystem,将表达具有和不具有λ肽(λn)(即boxb结合蛋白)的ythdf1n或ythdf2n的质粒电穿孔到细胞内。在12小时后,将细胞传代并铺平板,使得24小时后,它们将是70%至80%汇合的。在此之后24小时,用lipofectamine3000转染500ngcircboxb(具有5个boxb位点的circrna)。如上所述,收获rna,并且用brilliantiisybrgreenqrt-pcrmastermix和lightcycler480执行qrt-pcr。额外的重复被留出用于蛋白质裂解物收集,并且经由蛋白质印迹同时确认在这些条件下的异位蛋白质表达。
[0117]
rna免疫沉淀-qpcr经由neon
™
transfectionsystem,将表达具有和不具有λn的加上flag标签的ythdf1n或ythdf2n的质粒电穿孔到细胞内,然后在上述时间线中传代到6孔形式内。用0.25%胰蛋白酶-edta(thermofisherscientific,25200056)收获大约300万个细胞,然
后用pbs洗涤。然后通过具有下述设置的covaris ultrasonicator,在细胞裂解缓冲液(50 mm tris ph 8.0、100 mm nacl、5 mm edta、0.5% np-40,具有蛋白酶抑制剂)中裂解细胞:填充水平10、占空比5%、峰值入射功率140 w,周期/脉冲200,时间/管300s。细胞裂解物以16,000 rcf沉淀15分钟。收集上清液并且与100 μl抗flag
®ꢀ
m2磁珠(sigma-aldrich,st. louis,mo)一起在室温下旋转温育两小时,以pull down ythdf1n或ythdf2n。珠用细胞裂解缓冲液洗涤3次,并且用pbs洗涤1次。将珠重悬浮于500 μl trizol
®
中,并且使用rneasy
®ꢀ
mini试剂盒(qiagen,74106)提取总rna。如上所述,用brilliant ii sybr green qrt-pcr master mix和lightcycler 480执行qrt-pcr。rna水平被标准化为每个生物复制内的输入百分比。结果呈现为circrna超过肌动蛋白的富集倍数变化。
[0118]
facs分析将细胞以60,000个细胞/孔接种到24孔形式内的不含抗生素而含fbs的dmem中。在24小时后,按照制造商的建议,用sirna转染细胞。dharmafect
®ꢀ
smartpool on-targetplus mettl3 sirna (dharmacon,l-005170-02-0005)用作敲减sirna,并且on-targetplus非靶向对照sirna (dharmacon,d-001810-01-05)用作非靶向sirna。在转染之后12和36小时更新培养基。在转染后48小时,经由0.25%胰蛋白酶-edta收集细胞,并且在膜联蛋白结合缓冲液中用膜联蛋白v-647 (thermo fisher scientific,a23204)染色15分钟。然后将细胞向下旋转,并且重悬浮于膜联蛋白结合缓冲液(bd biosciences,556454)中的dapi内5分钟。将细胞重悬浮于不含染剂的膜联蛋白结合缓冲液中,并且通过具有细胞滤器盖的圆底管(corning,352235)。流动分析在特殊订单facs aria ii (bd biosciences)上完成。收集经受与上文相同的转染的细胞并收集蛋白质裂解物。使用抗mettl3抗体,经由蛋白质印迹确认mettl3敲减。
[0119]
小鼠的免疫购自jackson laboratories的8至12周龄的雌性c57bl/6小鼠在尾巴的基部处用以下进行皮下免疫:100
ꢁµ
g/小鼠的由25 μg hmw疫苗级聚i:c (invivogen,vac-pova)佐剂化的ova (invivogen,vac-pova)、单独或具有体内-jetpei (polyplus transfection,201-10g)的25
ꢀµ
g环状rna、单独或具有体内-jet pei的25
ꢀµ
g修饰的rna。根据制造商的说明书配制pei/rna复合物。如图中所示的,每隔一定时间经由侧尾静脉或面静脉对小鼠取血,用于分析在疫苗接种后的cd8+ t细胞和抗体应答。在初次疫苗接种5周后,在指示时给予加强疫苗接种。对于肿瘤建立和增殖研究,在单次rna疫苗接种后14天,将50万个表达ova的b16黑色素瘤细胞与基质胶一起递送到小鼠的右胁腹和左胁腹中。每周测量两次肿瘤,并且每周测量一次生物发光。通过腹膜内注射每20 g小鼠3 mg的d-萤光素来测量生物发光,并且使用ami ht成像仪(spectral instruments)在20秒至1分钟的曝光范围内成像。所有动物程序都按照由stanford大学机构动物护理和使用委员会指南制定的指南执行。
[0120]
cd8+ t细胞测定法在初次免疫和二次免疫后的第7天,评估初次和记忆cd8+ t细胞应答。简言之,外周血单核细胞(pbmc)使用蔗糖密度梯度分离(histopaque,1083;sigma aldrich 10831)进行富集,并且在bd golgi plug tm的存在下,与用于离体再刺激的以1
ꢁµ
g/ml的ova特异性mhc i类限制性肽 (siinfekl) (invivogen,vac-sin)一起培养5小时。首先对受刺激的细胞进行表面标记物抗小鼠cd8α (biolegend,克隆53-6.7)、抗小鼠cd3 (biolegend,克隆
17a2)、抗小鼠cd4 (biolegend,克隆rm4-5)染色,随后为在bd cytofix/cytoperm中的固定,以及在bd cytoperm缓冲液中,用抗小鼠ifn-γ (bd bioscience,克隆xmg1.2)的细胞内染色。使用活/死水性染剂(invitrogen)排除死细胞。在facs lsr-ii细胞仪上获得标记的细胞,并使用flow jo软件(treestar)分析数据。
[0121]
抗体elisa96孔板(nunc maxisorp,442404-21)在4
°
c下用100 μl的20 μg/ml ova蛋白(invivogen)包被过夜。使用bio-rad自动洗板机,用pbs/0.5% tween-20将板洗涤3次,并且在室温下用200 μl 4% bsa (sigma aldrich)封闭2小时。在指示时间点来自免疫小鼠的血清样品在pbs/0.5% tween-20中的0.1% bsa中连续稀释,并且在室温下在封闭的板上温育2小时。将孔洗涤,并且与抗小鼠igg-hrp (1:5000)、抗小鼠igg1-hrp缀合物(1:5000)和抗小鼠igg2c-hrp缀合物(1:2000)一起在pbs/0.5% tween-20中在室温下温育2小时。检测抗体得自southern biotech。将板洗涤且使用每孔100 μl的四甲基联苯胺(tmb)底物(thermo fisher scientific,34028)进行显色,随后为使用终止溶液(thermo fisher scientific,n600)来终止反应。使用bio-rad板阅读分光光度计,在450 nm处分析板,伴随在595 nm处的校正。抗体滴度表示为在450 nm处产生》0.3的光密度(od)值的血清倒数稀释度。
[0122]
rig-i atp酶测定法将0.1 μm rig-i在缓冲液b (20 mm hepes ph 7.5、150 mm nacl、1.5 mm mgcl2)中与指定的环状rna或512 bp 5
’ ppp dsrna (0.4 ng/μl)一起预温育。通过在37
°
c下添加2 mm atp启动反应。在atp添加后2、4或8分钟取出等分试样(10 μl),并立即用100 mm edta淬灭。使用green
™ꢀ
reagent (enzo life sciences)测量atp水解活性。将green
™ꢀ
reagent (90 μl)以9:1的比率加入淬灭反应中,并且使用synergy
™ꢀ
2板阅读器(biotek)测量od
650
。
[0123]
rig-i非变性凝胶迁移测定法使rna (1 ng/μl)与rig-i (500nm)一起在缓冲液a (20 mm hepes ph 7.5、50 mm nacl、1.5 mm mgcl2、2 mm atp和5 mm dtt)中在室温下温育15分钟。然后以指示浓度添加聚泛素并在室温下温育5分钟。复合物在bis-tris非变性page凝胶(life technologies)上进行分析,并且用sybr
®ꢀ
gold染剂(life technologies)进行染色。使用扫描仪fla9000 (fuji)记录sybr
®ꢀ
gold荧光,并且用multigauge (ge healthcare)进行分析。
[0124]
rig-i聚合测定法使0.4 μm rig-i与指定的环状rna (1 ng/μl)一起在缓冲液a (20 mm hepes ph 7.5、50 mm nacl、1.5 mm mgcl2、2 mm atp和5 mm dtt)中在室温下温育15分钟。将制备的样品吸附到碳包被网格(tedpella)上,并且用0.75%甲酸铀酰进行染色。使用tecnai
™ꢀ
g2 spirit biotwin透射电子显微镜,在30,000x或49,000x放大率下收集图像。
[0125]
蛋白质制备人rig-i如先前报道的(peisley等人,2013)进行表达。简言之,在用0.5 mm iptg诱导之后,使蛋白质在bl21 (de3)中在20
˚
c下表达16-20小时。使用emulsiflex c3 (avestin)将细胞匀浆化,并且使用包括ni-nta、肝素亲和层析和尺寸排阻层析(sec)的三步方案,在20 mm hepes ph 7.5、150 mm nacl和2 mm dtt中纯化蛋白质。
[0126]
k63-ubn如先前报道的(dong等人,2011)进行合成。简言之,从bl21 (de3)细胞中
11037)、以及山羊抗小鼠igg高度交叉吸附的alexa647 (thermo fisher scientific,a-21236)一起在室温下温育2小时。载玻片用pbs进行洗涤,使用具有dapi的vectashield
®ꢀ
(vector labs,h-1200)进行固定,并且用zeiss lsm 880共聚焦显微镜(stanford microscopy facility)进行成像。如果焦点与fitc-circrna和/或彼此直接重叠,则计数rig-i和k63-polyub的共定位。
[0131]
抗rig-1兔多克隆一抗(cell signaling technology,3743s)和抗ythdf2小鼠多克隆抗体(usbiological,135486)在抗体稀释剂中各自以1:200进行稀释。如上文详述的执行剩余的免疫荧光步骤,包括二次染色、固定和成像。如果焦点与fitc-circrna和/或彼此直接重叠,则计数rig-i和ythdf2的共定位。
[0132]
irf3二聚化测定法如先前所述(ahmad等人,cell,172: 797-810;e713 (2018))执行二聚化测定法。简言之,将hek 293t细胞在低渗缓冲液(10 mm tris ph 7.5、10 mm kcl、0.5 mm egta、1.5 mm mgcl2、1 mm原钒酸钠、1x哺乳动物protease arrest (gbiosciences))中匀浆化,并且以1000g离心5分钟以使核沉淀。含有胞质溶胶和线粒体级分的上清液(s1)用于体外irf3二聚化测定法。使含有10 ng/μl rig-i和2.5 ng/μl k63-ubn的刺激混合物,连同指示量的rna一起,在4
°
c下在20 mm hepes ph 7.4、4 mm mgcl2和2 mm atp中预温育30分钟。根据制造商的说明书,使用t7 tnt
®ꢀ
coupled reticulocyte lysate system (promega),通过体外翻译制备35s-irf3。通过将1.5 μl预温育的刺激混合物加入含有10 μg/μl s1、0.5 μl 35s-irf3 (在20 mm hepes ph 7.4、4 mm mgcl2和2 mm atp中)的15 μl反应中,来启动irf3活化反应,并且在30
°
c下温育1小时。随后,将样品以18,000g离心5分钟,并且使上清液经受非变性page分析。通过放射自显影术和磷光成像(fuji,fla9000)显现irf3二聚化。
[0133]
树突状细胞活化小鼠用pbs (对照)或环状rna (25 μg/小鼠)在尾巴的基部处在皮下进行免疫。免疫后24小时,对小鼠实施安乐死并切除皮肤引流腹股沟淋巴结。皮肤引流腹股沟淋巴结用3 ml注射器柱塞拇指托轻轻挤破,并且在37
°
c下用1 mg/ml 4型胶原酶消化20-25分钟。
[0134]
用2 mm edta终止反应,并且通过经过40 μm细胞滤器来制备单细胞悬浮液。
[0135]
统计分析所有统计分析都用软件graphpad prism (graphpad software,la jolla,ca)执行。适当时使用斯氏t检验、kruskal-wallis检验或anova-tukey检验。小于0.05的p值被视为统计学显著的。
[0136]
实施例1该实施例证实了免疫原性circrna的体外生产和表征。
[0137]
含有来自t4细菌噬菌体的置换td内含子的环化的绿色荧光蛋白(gfp) mrna,下文称为“circforeign”,在培养的哺乳动物细胞中是高度免疫原性的(chen等人,同上)。td内含子在体外转录过程中编程自催化剪接,以形成circforeign。circforeign用核酸外切酶rna酶r的延长处理(》2小时)降解线性rna副产物,并且产生富集的circrna (chen等人,同上)。后续碱性磷酸酶处理从游离端中去除5'磷酸。将外来circrna递送到哺乳动物细胞内有力地刺激免疫基因表达,并且保护免受后续病毒感染(chen等人,同上)。最近的报道提示了,外源性circrna不是免疫刺激性的,但由于不完全的rna酶r消化的5'三磷酸化的线性
rna污染物触发免疫应答(wesselhoeft等人,mol cell.,74 (3): 508-520 (2019))。wesselhoeft等人使用短暂(30分钟)的rna酶r处理,然后执行hplc,以从circrna中去除线性rna。先前显示了,通过体外合成并用rna酶r处理2小时的circforeign的免疫刺激与用第二轮磷酸酶处理以去除污染性线性rna上的三磷酸的circforeign可比较,而用磷酸酶处理的线性rna极大地减少了免疫激活(chen等人,同上)。因此,circforeign刺激不依赖于样品中的异常5'三磷酸的存在。然而,为了确认5'三磷酸并不刺激免疫基因表达,本文描述的所有circforeign分子都在磷酸酶的存在下进行合成。
[0138]
调查了用rna酶r处理的circforeign的凝胶纯化是否改变circforeign免疫刺激。假设如果存在促成circforeign的免疫原性的污染性线性rna组分,则凝胶提取将消除具有不同分子量的这些污染物。凝胶中的带切口的环状rna产物并非免疫刺激性的,因为它们变成线性的。为此,将用rna酶r和碱性磷酸盐处理的凝胶纯化的circforeign与经历凝胶纯化的相同circforeign制剂进行比较。将每种rna制剂转染到hela细胞内,随后为24小时后,先天免疫基因的qrt-pcr分析。与仅rna酶r的circrna相比,凝胶纯化的circforeign以几乎相同的效力(~80-90%活性)刺激先天免疫基因(图1a和1b)。
[0139]
用rna酶r处理的合成circrna也经受hplc分级分离。尺寸排阻层析将rna酶r处理的circrna拆分成两个级分(图1c)。每个级分的浓度和tapestation分析反映了hplc峰1反映来自rna酶r处理的circforeign的凝胶电泳的结果(图1c),而峰2是降解的rna。由于仪器使用中的差异,所得到的hplc纯化层析图和级分不同于先前报道的分离(wesselhoeft等人,同上)。将每个级分转染到hela细胞内,随后为qrt-pcr揭示了具有circrna的级分保留了免疫应答,但具有较低的活性(图1d)。尽管峰2包括较小的降解rna和未消化的内含子,但该级分并非免疫原性的。这个结果与在整个样品制备中的磷酸酶处理已使免疫原性线性rna失活的解释一致。因此,凝胶纯化的circforeign中的刺激的适度降低(图1b)并非由于这些rna种类的丧失。circforeign的完整性在凝胶纯化中保存得比hplc纯化更好,其中在前者中更少降解成更小的rna片段,这与circforeign免疫原性的更好保存相关联。
[0140]
起因于不完全的rna酶r消化的较小的线性rna并不导致上述制剂中的circrna免疫原性。上述酶促纯化过程似乎最佳地保存circforeign的完整性。
[0141]
实施例2该实施例证实了circforeign在体内充当疫苗佐剂。
[0142]
circforeign先前已显示了在体外有力地刺激免疫基因表达(chen等人,同上),但其在体内的行为尚不清楚。假设circforeign具有激活先天免疫的潜力,并且因此充当疫苗佐剂以增加疫苗的功效。circforeign在体外进行转录,纯化,并且通过皮下注射与鸡卵白蛋白(ova)组合递送到c57bl/6j小鼠内。聚i:c充当rna佐剂的阳性对照。circforeign作为裸露rna或在转染剂聚乙烯亚胺(pei)中包装后进行递送。收集t细胞,并且在初次疫苗接种或二次疫苗接种后7天,执行细胞内细胞因子染色(ics)。还收集了血清,并且在疫苗接种五周后测量抗体应答(图2a)。所测量的抗体显示于表3中。
[0143]
表3抗体克隆荧光染料cd11cn418bv421cd11bm1/70bv650
cd1032e7pe/bb710mhciim5/114.15.alexa700cd86po3fitccd4530-f11bv610ova特异性、干扰素γ阳性(ifnγ+)活化的cd8t细胞的诱导需要佐剂如聚i:c,如预计的(图2b和图3a-3c)。值得注意的是,circforeign与裸露的circrna (与模拟相比,p=0.0088,anova-tukey氏检验)或在pei纳米颗粒中(与模拟相比,p=0.0039,anova-tukey氏检验,图2b)的共注射,诱导与通过聚i:c诱导的水平可比较的有力的抗ova t细胞。ova特异性抗体的测量揭示了,单独的circforeign刺激抗体产生至与阳性对照聚i:c可比较的水平(图2c和3b)。circforeign并不需要转染试剂以便刺激ova特异性cd8+ t细胞和抗体。事实上,在不含pei的注射中,cd8+ t细胞应答更高,并且在后续实验中省略了pei。
[0144]
在小鼠用circforeign或对照免疫后,从引流淋巴结中分离树突状细胞(dc)。circforeign佐剂激活了cdc1和cdc2亚群两者,如通过共刺激分子cd86的细胞表面表达相对于对照增加来判断的(图3d和3e)。
[0145]
这些结果提供了circrna接种激活dc的直接体内证据。dc激活原则上可以促进抗原交叉呈递和cd4+ t滤泡辅助性(fh)细胞和cd8+ t细胞的激活。然而,circrna也可能直接影响t细胞和其它免疫细胞类型。
[0146]
实施例3该实施例证实了circforeign可以诱导抗肿瘤免疫。
[0147]
因为circforeign的递送诱导cd8+ t细胞应答,所以假设暴露于circforeign和ova的小鼠将具有针对表达ova的肿瘤的适应性免疫。因此,小鼠用circforeign和ova进行疫苗接种,并且两周后,将表达ova的b16黑色素瘤细胞植入小鼠的右胁腹和左胁腹内(图2d)。ova-b16黑色素瘤模型在很大程度上通过cd8+效应t细胞进行免疫限制(budhu等人,j exp med.,207 (1): 223-35 (2010))。与接受pbs的阴性对照小鼠相比,接受circforeign的小鼠显示出更低的肿瘤生长(图2e、2f和3f)。每只小鼠中的左肿瘤和右肿瘤彼此相关联,证实了存在来自疫苗接种的全身范围效应。与阴性对照小鼠相比,仅用circforeign接种疫苗一次的小鼠显示出几乎加倍的总体存活(p=0.0173,时序检验,图2g),并且与接受阳性对照聚i:c hmw的小鼠可比较(图3g)。
[0148]
该实施例的结果指示了circrna免疫可以用于潜在的治疗目标。
[0149]
实施例4该实施例证实了内源性circrna与m6a机制相关。
[0150]
鉴于哺乳动物细胞具有内源性circrna,它们对circforeign的免疫应答提示了它们区分自身和非自身circrna。如上文讨论的,circrna通过反向剪接将rna外显子的3'和5'端共价连接而产生。因为内含子身份决定了circrna免疫(chen等人,同上),但不是最终circrna产物的部分,所以假设内含子可以指导一种或多种共价化学标记在circrna上的沉积。
[0151]
circzkscan1是由其内源性内含子产生的人circrna,并且当在人细胞中表达时,并非免疫原性的。zkscan1内含子用于编程称为“circself”的circgfp的产生。将编码通过蛋白质辅助(circself)或自催化剪接(circforeign)生成的circrna的dna质粒转染到hela
细胞内,并且通过质谱法(chirp-ms)执行rna结合蛋白的综合鉴定(chen等人,同上)。共价m6a修饰的写入器、读取器和擦除器(roundtree等人,同上)与circrna相关进行分析(图4a)。发现circzkscan1,而不是circforeign,与m6a写入器复合物的组分例如wtap和virma (也称为virilizer同源物或kiaa1429),以及m6a读取器蛋白ythdf2、hnrnpc和hnrnpa2b1相关(图4a)。两种circrna都与假定的m6a去甲基化酶(“擦除器”)例如fto和alkbh5无关。重要的是,circself包含与circforeign相同的circrna序列,但不再是免疫原性的(chen等人,同上),并且与m6a写入器和读取器蛋白相关(图4a)。由人内含子编程的两种不同的circrna (circself和circzkscan1)达到与m6a写入器和读取器蛋白(包括wtap、virma和ythdf2)类似的相关水平(图4b)。
[0152]
该实施例的结果提示了,m6a修饰机制被转移到外显子circrna作为介导其生物发生的内含子的记忆,其不依赖于circrna序列而发生。
[0153]
实施例5该实施例证实了自身和外来的circrna具有不同的m6a修饰模式,并且m6a修饰将circrna标记为“自身的”。
[0154]
限定了人和外来circrna的m6a修饰模式。在编程为表达适当circrna的人细胞中,使用rna酶r处理来富集circrna,然后执行m6a-uv-c交联和m6a免疫沉淀(m6a-irclip) (zarnegar等人,nat. meth.,13: 489-492 (2016)),以高灵敏度绘制m6a修饰的位点(图4c)。circself相对于circforeign的m6a-irclip揭示了,circself在环化连接的3'侧获得了在50-100个核苷酸(nt)内的m6a修饰(图4d)。在转录物的剩余部分中并未观察到修饰的显著差异(图5a)。因为circself和circforeign是由人(自身)或噬菌体(外来)内含子环化的相同外显子序列,所以这一结果指示了人内含子足以将m6a修饰置于所得到的circrna上。此外,经受m6a-irclip的内源性circrna与模型人编程的circrna的比较指示了,两者均具有相似的m6a修饰模式(图4e)。m6a在内源性circrna转录组范围上的反向剪接点3'的+40-100 nt窗口中富集(图4e)。已知m6a在线性mrna和长链非编码rna (lncrna)的最后一个外显子处富集(图5b) (dominissini等人,nature,485: 201-206 (2012);ke等人,genes & development,29: 2037-2053 (2015));meyer等人,cell,149: 1635-1646 (2012))。反向剪接点3'的m6a修饰的发现与此模式一致。剪接从5'到3'共转录发生,并且3'到5'的反向剪接是circrna上预计的最后一个剪接事件(即没有内含子待剪接掉)。
[0155]
然后假设本身或与通过rna结合蛋白的m6a识别组合的化学修饰允许标记“自身
”ꢀ
circrna。通过检查将m6a掺入circforeign内是否掩蔽“非自身”身份并降低circforeign的免疫原性来测试这一点。为此,通过体外转录合成未修饰的circforeign或m6a修饰的circforeign (chen等人,同上),并且通过rna酶r处理纯化circrna。将m6a修饰掺入circrna内并不影响剪接以形成circrna,并且rna酶r处理使circrna富集(图5c和5d)。然后将circforeign转染到受体细胞内,并且测量抗病毒基因表达。细胞中的circrna m6a修饰集中在沿着转录物的特定位置处,而在体外转录过程中的m6a掺入是随机的。因此,所有腺苷都由m6a替换(100% m6a),或者只有1% m6a被掺入circrna内,以对于每种circrna产生平均三个m6a修饰。100% m6a很可能是超生理性的,但模拟了在体内观察到的m6a的连续发生。1% m6a模拟了内源性rna上的m6a比率的总体水平,而不是修饰模式。circforeign有力地诱导了一组抗病毒基因,包括rig-i、mda5、oas、oasl和pkr,并且当所有腺苷都由m6a修饰替换
时,抗病毒基因诱导被完全取消(图6a,100% m6a)。1% m6a掺入显著减少但并未消除抗病毒基因诱导(图6a)。因此,m6a修饰足以减少培养细胞中的外来circrna的免疫原性。
[0156]
然后通过使gfp外显子中的所有出现(n = 12)的序列rrach (seq id no: 17)和rruch (seq id no: 19)突变,来修饰circforeign质粒以消除m6a共有基序(dominissini等人,同上)。假设当circforeign在人细胞的核中转录时,mettl3/14可能在低水平下修饰circforeign,这在δrrach突变体中被取消。将编码野生型或突变型circrna的质粒转染到hela细胞内,并且通过qrt-pcr定量circrna水平和先天免疫基因诱导。然后将基因诱导针对测量的circrna水平进行标准化。
[0157]
rrach位点突变使抗病毒基因的circrna诱导显著增加到大约两倍(图6b)。因为m6a在rrach基序(seq id no: 18)上富集但并非专一地存在于rrach基序处,因此构建了修饰的circforeign质粒,其中gfp外显子中的所有腺苷都突变为尿嘧啶(a较少的circforeign,图6c)。编码a较少的circrna的质粒的转染导致抗病毒基因诱导相对于circforeign的约100倍增加。
[0158]
该实施例的结果提供了特定circrna外显子序列影响免疫的第一个证据,并且具体提示了内源性m6a修饰阻碍了先天免疫。
[0159]
实施例6该实施例证实了circrna的m6a修饰减弱了体内的疫苗接种应答,并且m6a读取器蛋白ythdf2是掩蔽circrna免疫所必需的。
[0160]
circrna的m6a修饰也降低了circrna作为体内佐剂的免疫原性。当1% m6a修饰的circforeign以与未修饰的circforeign相同的佐剂方案使用时,发现1% m6a修饰显著减少了活化的cd8t细胞应答(图6d相对于图2b)和抗体滴度(图6e相对于图2c)两者。用1% m6a修饰的circforeign的重复免疫诱导了减弱但并非无效的免疫应答(图7)。这些结果显示了,circforeign在体内是有力的免疫刺激剂,并且1%的m6a修饰足以减弱circrna免疫。
[0161]
然后检查了m6a抑制circrna免疫的机制。m6a被一系列读取器蛋白识别,其中最突出的是含有yth结构域的rna结合蛋白(dominissini等人,同上;和edupuganti等人,nature structural & molecular biology,24: 870 (2017))。集中于ythdf2是因为:(i)它是与内源性circrna或circself相关检测到的主要m6a读取器(图4a和4b),并且(ii) ythdf2是细胞质的,与内源性和转染的circrna一样(chen等人,同上;rybak-wolf等人,molecular cell,58: 870-885 (2015);salzman等人,plos one,7: e30733 (2012))。circforeign转染到ythdf2-/
‑ꢀ
hela细胞内(图8a)导致抗病毒基因的有力诱导(图9a)。此外,将1%或10% m6a掺入circforeign内不再压制ythdf2-/-细胞中的抗病毒基因诱导(图9a)。独立的ythdf2-/-克隆给出了非常相似的结果(图8b)。此外,ythdf2在ythdf2-/-细胞中的异位表达拯救了响应m6a修饰的circforeign的免疫基因诱导的压制(图9b),指示了ythdf2是介导m6a标记的circrna的“自身”身份所需的。
[0162]
接下来测试了ythdf2的哪些结构域对于压制通过circforeign的免疫刺激是必需的。将全长ythdf2 (图9c)人工栓系到未修饰的circforeign,并且确定m6a读取器蛋白的接近是否可以绕过压制circrna免疫的m6a修饰的需要。将五个连续的boxb rna元件引入circforeign内紧在剪接点后,其称为“circboxb”。另外,将c末端λn肽标签克隆到蛋白质内,并且经由蛋白质印迹确认表达(图8c和8d)。这允许募集与λn肽融合的yth蛋白,如通过
rip-qpcr确认的(图9c和8e)。单独的编码rna种类circboxb的质粒的转染强烈刺激抗病毒基因,并且全长ythdf2的栓系显著降低了抗病毒基因诱导(图9d)。
[0163]
为了确定ythdf2的n末端结构域(ythdf2n)对于circforeign的免疫逃避是否足够,将ythdf2 n末端栓系到未修饰的circforeign-boxb。n末端不足以压制针对circforeign的免疫应答(图9e)。由于n末端结构域负责ythdf2-rna复合物的细胞定位,并且c末端结构域选择性地结合m6a修饰的rna (wang等人,nature,505: 117-120 (2014)),因此c末端结构域很可能是降低通过circforeign的抗病毒基因诱导所需的。
[0164]
然后检查了通过将yth连接到未修饰的circrna,yth结构域是否能够将circforeign标记为自身的(图8f)。无论circforeign是否栓系到yth结构域,rig-i基因表达不存在显著变化。然而,将circforeign和yth连接显著增加了mda5和oas1的表达。由于全长ythdf2蛋白大于每个分开的结构域,因此测试了将circforeign栓系到红色荧光蛋白(rfp)对未修饰circrna的细胞识别的作用(图8g)。rig-i基因表达的刺激存在适度降低,但其它测试的免疫传感器无一显示出表达变化。这提示了circforeign免疫原性的完全压制需要所有的ythdf2结构域,而另一种蛋白质和circrna之间的相互作用是不充分的。
[0165]
为了测试yth家族的其它成员是否涉及circforeign的免疫压制,检查了使用boxb基序将ythdf1 (另一种细胞质m6a读取器蛋白)栓系到circforeign的效应。ythdf1的n末端也未能降低抗病毒基因诱导,类似于ythdf2 (图8h)。总之,这些结果证实了,全长m6a读取器蛋白是掩蔽circrna免疫所必需的,并且circrna需要m6a化学修饰或m6a读取器蛋白来区分“自身”和“外来
”ꢀ
circrna。
[0166]
实施例7该实施例证实了m6a写入器蛋白mettl3是circrna的自身/非自身识别所需的。
[0167]
为了探究m6a在circrna上传递“自身”标记的必要性,调查了mettl3 (写入器复合物的催化亚基)对于安装m6a修饰的作用。由于m6a在及时rna周转中的关键作用,mettl3对于胚胎发育是必要的(batista等人,cell stem cell,15: 707-719 (2014))。许多人癌细胞系中的mettl3耗尽导致细胞死亡。mettl3耗尽的一个可能后果是内源性circrna的m6a修饰缺陷,导致免疫激活。rig-i是一种rna结合和信号传导蛋白,其感知病毒rna用于免疫基因激活(wu和hur,current opinion in virology,12: 91-98 (2015))。外来circrna已显示在人细胞中与rig-i共定位,并且rig-i对于circrna免疫是必需和充分的(chen等人,同上)。因此,如果需要m6a来阻止细胞将自己的circrna识别为外来的并启动免疫应答,则伴随的rig-i失活应该改善应答。事实上,野生型hela细胞中的mettl3耗尽导致广泛的细胞死亡,但hela细胞中的rig-i失活(chen等人,同上)拯救了细胞死亡(图10)。
[0168]
该实施例的结果提示了m6a阻止通过自身rna的rig-i激活;然而,不能排除由于mettl3的其它rna靶的间接效应。
[0169]
实施例8该实施例证实了rig-i识别circforeign不同于线性rna,并且circforeign直接结合rig-i和k63-聚泛素链并区别m6a。
[0170]
为了探究circrna如何刺激先天免疫应答的机制,采用纯化组分进行生物化学重构。首先,评价了circforeign通过rig-i诱导atp水解的能力。当rig-i识别5
’ ppp dsrna激动剂时,蛋白质的解旋酶结构域水解atp (hornung等人,science,314: 994-997 (2006);
schlee等人,immunity,31: 25-34 (2009))。rig-i暴露于circforeign或5'羟基线性rna并不刺激其atp酶活性,而512碱基对5'-三磷酸dsrna诱导通过rig-i的atp水解(图11a)。接下来,通过直接在circforeign上形成细丝,来测试circforeign激活纯化rig-i的能力。rig-i、circforeign和atp的电子显微镜检查成像并未揭示明显的细丝形成,而阳性对照5
’ ppp dsrna诱导rig-i聚合(图11b)。因此,如预计的,circforeign并不以与5
’ ppp rna配体相同的方式与rig-i相互作用,也不激活rig-i。
[0171]
rig-i激活的替代机制涉及赖氨酸63 (k63)-连接的聚泛素链(k63-ubn),其与rig-i2 card结构域寡聚体相互作用并使其稳定(jiang等人,immunity,36: 959-973 (2012);peisley等人,nature,509: 110 (2014);zeng等人,cell,141: 315-330 (2010))。评价了rig-i结合未修饰的和m6a修饰的circforeign的能力,以及相互作用对k63-聚泛素链的依赖性。对于纯化的rig-i和circforeign,使用非变性凝胶迁移结合测定法,发现rig-i在k63-聚泛素的不存在(图11c,泳道2)和存在(图11c,泳道3-4)下,均结合阳性对照5
’ ppp 162bp dsrna。rig-i还与未修饰的和m6a修饰的circforeign两者结合(图11c,泳道5-16)。尽管k63-聚泛素链看起来对于rig-i与circforeign结合并非必需的,但当k63-聚泛素链的浓度较高时,存在rig-i与circforeign的更多结合(图11c,泳道7相对于泳道8,泳道11相对于泳道12,泳道15相对于泳道16)。这些结果提示了,rig-i在构象变化,而不是结合水平下区别未修饰的和m6a修饰的circrna。这些结果也支持了rig-i与circrna的结合不同于5
’ ppp dsrna配体。
[0172]
prr如同rig-1和mda5调查了许多rna,但仅在与免疫原性rna配体相互作用时,选择性地经历用于寡聚化的构象变化(ahmad等人,cell,172 (4): 797-810.e13 (2018))。类似地,rig-i对于5'三磷酸(存在于病毒rna上)的选择性超过m7gppp帽(存在于所有mrna上)是由于构象变化而不是配体结合(devarkar等人,proc natl acad sci usa,113 (3): 596-601 (2016)。因此,评估了在结合相对于构象变化水平下,rig-i区别m6a 修饰的circrna的能力。
[0173]
当rig-i被激活时,寡聚化的rig-i使线粒体抗病毒信号传导蛋白(mavs,也称为ips-1、cardif和visa)聚合模板化成细丝,为后续信号转导创造了平台,其最终导致irf3转录因子的激活和二聚化。纯化的circforeign、rig-i、k63-聚泛素和mavs在体外进行重构,并且通过凝胶迁移(图12a)或电子显微镜检查(图12b)监测mavs从单体到细丝的转变。在k63-聚泛素的存在下,未修饰的circforeign以浓度依赖性方式强烈刺激mavs聚合(图12b)。重要的是,当m6a修饰以1%或100%掺入circforeign内时,mavs丝化分别基本上降低或完全取消(图12b和12c)。在不存在k63-聚泛素的情况下,circrna底物无一诱导mavs聚合,指示了聚泛素对于稳定活化的rig-i构象是必需的,以便于后续的mavs聚合和信号传导发生(图11d)。通过电子显微镜检查定量mavs细丝确认了,未修饰的circforeign强烈诱导mavs丝化,而circforeign的m6a修饰压制了mavs寡聚化的能力(图12b和12c)。
[0174]
关于纯化组分的这些体外结果证实了,未修饰的circforeign可以在k63-聚泛素的存在下直接激活rig-i,并且在任何其它酶或rna结合蛋白的不存在下激活mavs。尽管rig-i结合未能区分未修饰的和m6a修饰的circrna (图11c),但仅未修饰的circforeign在k63-聚泛素的存在下启动了mavs丝化(图12a-12c)。这些结果提示了m6a区分在mavs单体到细丝的转变中发生,并且依赖于rig-i构象变化而不是rig-i结合。
[0175]
实施例9该实施例证实了circforeign激活irf3二聚化。
[0176]
在mavs丝化之后,下游转录因子irf3的二聚化完成了对基因组的先天免疫信号传导。为了测试circforeign激活irf3的能力,通过首先形成rig-i、rna、k63-聚泛素复合物,然后在含有胞质溶胶和线粒体级分两者的细胞提取物(s1)的存在下,与放射性标记的irf3一起温育,来执行无细胞测定法。circforeign以浓度依赖性方式强烈诱导irf3二聚化,而m6a修饰的circforeign导致基本上更少的irf3二聚化(图12d,泳道5-7相对于泳道8-10)。当以亚化学计量的量存在时,已知的激动剂5
’ ppp 162 bp dsrna更好地刺激rig-i介导的irf3二聚化,并且增加的dsrna阻止了rig-i在rna上的有效寡聚化(图11d)。如阴性对照所预计的,5'-羟基线性rna并不刺激irf3二聚化(图12d,泳道2-4)。
[0177]
实施例10该实施例证实了circforeign在激活之前需要适当的复合物形成。
[0178]
为了理解rig-i寡聚化和活化的需求,检查了用于体外测定法的特定组分的添加次序。在s1裂解物补充之前,当与rig-i和k63-聚泛素一起预温育时,5
’ ppp rna显示了更有力的应答。然而,在s1裂解物引入之后添加5
’ ppp dsrna导致减少,尽管显著的刺激活性(图11e,泳道2和5相对于泳道8和9)。在s1阶段添加k63-聚泛素没有活性,因为在聚泛素的存在或不存在之间不存在差异(图11e,泳道2和5相对于泳道10和11)。当将circforeign加入s1细胞裂解物中,然后与rig-i和聚泛素混合时,并未导致irf3二聚化活性(图12d,泳道11-13)。这一结果提示了,聚泛素首先需要在激动剂circrna的存在下与rig-i相互作用并使其稳定,这可能是由于细胞裂解物中的游离k63-聚泛素链的快速降解或不稳定。因此,需要在s1细胞裂解物添加之前形成信号传导复合物。另外的实验排除了内源性rna在circforeign介导的irf3激活中的作用(图11f)。
[0179]
上述生物化学重构实验一起证实了circforeign、rig-i和k63-ubn形成用于免疫信号传导的三组分信号传导能力复合物。
[0180]
实施例11该实施例描述了未修饰的相对于m6a标记的circrna在细胞中的不同定位为了验证rig-i直接感知circforeign的体外测定法,执行了免疫荧光显微镜检查。hela细胞用fitc标记的circforeign进行转染,用甲醛固定,并且标记rig-i和k63-聚泛素(图13a)。绝大多数的circforeign-fitc与rig-i和k63-聚泛素两者共定位(图13b,85.5%)。当k63-聚泛素存在于复合物中时,与未修饰的circforeign的相互作用激活rig-i,其允许mavs丝化的后续刺激。
[0181]
由于rig-i活化区别未修饰的和m6a修饰的circrna,假设ythdf2参与抑制rig-i活化或降低rig-i结合的复合物。先前对circrna使用1%的m6a修饰,但预料在rrach共有基序(seq id no: 18)处的m6a水平远低于1%,因为m6a是随机掺入的。ythdf2结合在rrach基序(seq id no: 18)处的m6a (dominissini等人,同上;meyer等人,同上)。因此,将10%的m6a掺入circforeign内用于更好地模拟m6a在共有序列处的放置。用未修饰的或10% m6a修饰的circforeign、rig-i和ythdf2执行免疫荧光显微镜检查(图13c)。当m6a修饰存在于circforeign上时,circrna与rig-i和ythdf2共定位的百分比增加了多于一倍(33.8%至65.3%),而与单独的rig-i相互作用的circforeign的百分比降低(图13d,61.9%至29.3%)。
和“一种(an)”和“该/所述”和“至少一个/种”以及类似的指示物的使用,应解释为覆盖单数和复数两者,除非本文另有说明或与上下文明显矛盾。术语“至少一个”随后为一个或多个项目的列表(例如,“a和b中的至少一个”)的使用,应解释为意指选自所列项目的一个项目(a或b)、或者两个或更多个所列项目的任何组合(a和b),除非本文另有说明或与上下文明显矛盾。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应解释为开放式术语(即,意指“包括但不限于”)。除非本文另有说明,否则本文中数值范围的叙述仅仅预期充当个别地提及落入该范围内的每个分开值的速记方法,并且每个分开的值被并入说明书内,如同它在本文中个别地叙述一样。除非本文另有说明或与上下文明显矛盾,否则本文所述的所有方法都可以以任何合适的次序执行。本文提供的任何和所有实例或示例性语言(如,“例如”)的使用仅仅预期更好地阐明本发明,并且不对本发明的范围构成限制,除非另有声明。说明书中的任何语言都不应该解释为指示任何未请求保护的要素对于本发明的实践是必需的。
[0188]
本文描述了本发明的优选实施方案,包括本发明人已知的用于实施本发明的最佳模式。在阅读上述说明书后,那些优选实施方案的变化对于本领域普通技术人员可以变得显而易见。本发明人期望技术人员适当地采用此类变化,并且本发明人预期以不同于本文具体描述的方式来实践本发明。相应地,本发明包括如适用法律允许的,所附权利要求中叙述的主题的所有修改和等价物。此外,除非本文另有说明或与上下文明显矛盾,否则本发明涵盖以其所有可能变化的上述要素的任何组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1