阳离子脂质及其用途的制作方法
阳离子脂质及其用途
1.优先权
2.本技术要求于2019年7月3日提交的美国临时申请号62/870,245、2019年7月30日提交的美国临时申请号62/880,435和2020年5月12日提交的美国临时申请号63/023,654的优先权,所述申请的内容以引用的方式整体并入本文。
发明领域
3.本发明部分涉及各种新型脂质,包括用于将核酸递送至细胞的方法、组合物和产品。
4.以电子方式提交的文本文件的说明
5.本技术含有序列表,所述序列表已以ascii格式通过efs-web提交并且据此以引用的方式整体并入。2020年7月3日创建的所述ascii副本被命名为fab-012pc_st25.txt,并且大小为1,441,597字节。
背景技术:
6.基于脂质的材料(诸如脂质体)被用作用于药物和其他生物学应用的生物载剂,例如以将剂引入到培养的细胞系中。脂质通常用于例如在转染中在低血清或无血清条件下将核酸递送至体外细胞。然而,血清组分会抑制许多脂质的活性,这限制了所述脂质在存在血清的情况下的体外和体内使用。
7.需要改进的脂质递送系统,例如,以在体外和体内实现更高水平的转染。具体地说,需要在存在血清的情况下具有活性的脂质递送系统。提高的转染水平将允许治疗疾病状态,对于所述疾病状态,高于当前用脂质递送系统可达到的表达水平的表达水平是治疗效果所需要的。可选地,更高的转染水平将允许使用更少量的材料来实现可比的表达水平,从而减少潜在的毒性并减少成本。
8.本领域需要新型脂质、脂质样材料和基于脂质的递送系统。
技术实现要素:
9.因此,本发明涉及新的脂质,所述脂质尤其可用于改善生物有效载荷例如核酸向细胞的递送。
10.在多个方面,本发明涉及式(i)的化合物:
11.12.其中:q1、q2、q3和q4独立地是能够带正电荷的原子或基团;
13.a1和a2独立地是空、h或任选取代的c
1-c6烷基;
14.l1、l2和l3独立地是空、键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基或上述任选地通过醚、酯、酸酐、酰胺、氨基甲酸酯、仲胺、叔胺、季铵、硫醚、脲、羰基或亚胺中的一种或多种连接的任何组合;
15.r1、r2、r3、r4、r5、r6、r7和r8独立地是空、h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r1、r2、r3、r4、r5、r6、r7和r8中的至少一个包含至少两个不饱和键;并且x、y和z独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
16.在多个方面,本发明涉及式(ii)的化合物:
[0017][0018]
其中:r9、r10、r11、r12、r13、r14、r15、r16、r17、r18、r19、r20、r21、r22、r23、r24、r25、r26、r27和r28独立地是h、卤基、oh、(c1-c6)烷基、(卤基)(c1-c6)烷基、(羟基)(c1-c6)烷基、(烷氧基)(c1-c6)烷基、芳基、杂芳基、环烷基或杂环基;并且
[0019]
i、j、k、m、s和t独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0020]
在多个方面,本发明涉及式(iii)的化合物:
[0021][0022]
其中l4、l5、l6和l7独立地是键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基、-(ch2)
v1-c(o)-、-((ch2)
v1-o)
v2-或
–
((ch2)
v1-c(o)-o)
v2-;
[0023]r29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少一个包含至少两个不饱和键;
[0024]
v、v1和v2独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0025]
在实施方案中,本发明涉及式(iv)的化合物:
[0026][0027]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0028]
在实施方案中,本发明涉及式(v)的化合物:
[0029][0030]
在实施方案中,本发明涉及式(vi)的化合物:
[0031][0032]
在实施方案中,本发明涉及式(vii)的化合物:
[0033][0034]
在实施方案中,本发明涉及式(viii)的化合物:
[0035][0036]
在实施方案中,本发明涉及式(ix)的化合物:
[0037][0038]
在实施方案中,本发明涉及式(x)的化合物:
[0039][0040]
在实施方案中,本发明涉及式(xi)的化合物:
[0041][0042]
在实施方案中,本发明涉及式(xii)的化合物:
[0043][0044]
在实施方案中,本发明涉及式(xiii)的化合物:
[0045]
在实施方案中,本发明涉及式(xiv)的化合物:
[0046][0047]
在实施方案中,本发明涉及式(xv)的化合物:
[0048][0049]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0050]
在实施方案中,本发明涉及式(xvi)的化合物:
[0051]
[0052]
在实施方案中,本发明化合物(例如式i-xvi的化合物)是药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分。
[0053]
在实施方案中,本发明化合物(例如式i-xvi的化合物)是不需要额外脂质或辅助脂质的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分。在实施方案中,本发明化合物(例如式i-xvi的化合物)是还包含中性脂质(例如二油酰基磷脂酰乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)或胆固醇)和/或另外的阳离子脂质(例如n-[1-(2,3-二油酰基氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、1,2-双(油酰基氧基)-3-3-(三甲基铵)丙烷(dotap)或1,2-二油酰基-3-二甲基铵-丙烷(dodap))的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分。
[0054]
在实施方案中,本发明化合物(例如式i-xvi的化合物)是具有规定粒径的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分。在一些实施方案中,对包含本发明化合物(例如式i-xvi的化合物)的颗粒进行表征以确定平均粒径和多分散性。在一些实施方案中,包含本发明化合物的颗粒具有《50nm、50-100nm、100-150nm、150-200nm、200-250nm、250-500nm或》500nm的平均流体动力学半径。在一些实施方案中,平均粒径取决于颗粒形成过程的条件(例如但不限于温度、孵育时间、溶液ph或溶液离子强度)。在一些实施方案中,本发明化合物(例如式i-xvi的化合物)是平均粒径取决于溶液的离子强度或溶液的ph的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分。
[0055]
在实施方案中,本发明化合物(例如式i-xvi的化合物)是药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分,其包含核酸诸如dna(例如但不限于质粒、粘粒、噬菌体、重组病毒或其他载体)或rna(例如但不限于sirna、微小rna(mirna)、长链非编码rna(lncrna)、体外转录的rna、合成rna和/或mrna,在每种情况下都包含一种或多种赋予稳定性的非典型核苷酸、避免被一种或多种核酸酶降解,和/或避免实质性细胞毒性的非典型核苷酸,或不包含非典型核苷酸)。在实施方案中,rna编码目标蛋白,例如但不限于一种或多种重编程因子或基因编辑蛋白。在实施方案中,rna编码激发免疫反应的抗原。
[0056]
在实施方案中,本发明涉及能够诱导对编码的蛋白免疫耐受的合成rna分子(例如但不限于包含微小rna结合位点(诸如例如mir142微小rna结合位点)的合成rna分子)的递送,此类微小rna结合位点任选地存在于合成rna分子的3'-utr中(任选地以一个或多个拷贝)。在实施方案中,本发明涉及能够通过共同递送诱导耐受的因子(例如但不限于il2、il10和/或tgf-β)来诱导对编码的蛋白质的免疫耐受的合成rna分子的递送。在某些实施方案中,共同递送的因子由合成rna分子表达。在实施方案中,合成rna分子编码一种或多种本文所述的基因编辑蛋白。在一个实施方案中,合成rna分子诱导一种或多种基因编辑蛋白的免疫耐受。在另一个实施方案中,合成的rna分子编码正常在受试者中不存在的蛋白质。在一些实施方案中,受试者患有营养不良性大疱性表皮松解症。在其他实施方案中,合成rna分子编码一种或多种产生双链断裂的基因编辑蛋白,在所述双链断裂中插入了遗传有效载荷。在一些实施方案中,遗传有效载荷包含表达盒。在其他实施方案中,表达盒诱导细胞表达治疗蛋白。在又其他实施方案中,治疗蛋白是免疫耐受的。在其他实施方案中,一种或多
种基因编辑蛋白诱导细胞表达蛋白质的功能或半功能型式。在一个实施方案中,蛋白质是胶原蛋白7。某些实施例涉及一种用于治疗疾病、病症或疾患的组合物,其中所述组合物包含本发明的合成rna分子。在一个实施方案中,疾病、病症或疾患是营养不良性大疱性表皮松解症。
[0057]
在实施方案中,药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒适合于通过注射来施用,例如但不限于皮下注射、皮内注射、真皮下注射、肌肉内注射和/或静脉内、鞘内、肿瘤内、玻璃体内、视网膜下、脑室内和/或局部施用和/或输注。在实施方案中,药物组合物和/或脂质聚集体和/或脂质载剂适合于作为含有少于约10ng的rna或约10ng至约2000ng的rna的一种或多种注射剂来施用。
[0058]
在多个方面,本发明涉及用核酸转染细胞的方法,其包括使所述细胞与核酸和本文所述的化合物(例如式i-xvi的化合物)的复合物接触,其中核酸和本文所述的化合物(例如式i-xvi的化合物)的复合物任选地在与所述细胞接触之前形成。
[0059]
在多个方面,本发明涉及用于将分化细胞重编程为分化程度较低状态的方法,其包括(a)提供分化细胞;(b)培养分化细胞;以及(c)用一种或多种合成rna分子和本文所述化合物(例如式i-xvi的化合物)的复合物转染分化细胞,其中一种或多种合成rna分子包括至少一种编码一种或多种重编程因子的rna分子并且其中转染使得细胞表达一种或多种重编程因子,使得细胞被重编程为分化程度较低的状态。在实施方案中,步骤(c)在存在含有支持分化细胞重编程为分化程度较低的状态的成分的培养基的情况下进行。在实施方案中,还包括在连续5天内重复步骤(c)至少两次。在实施方案中,在一种或多种较晚转染中转染的一种或多种合成rna分子的量大于在一种或多种较早转染中转染的量。在实施方案中,步骤(a)-(c)不使用饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,步骤(c)不使用辐射的人新生儿成纤维细胞饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,合成rna分子编码一种或多种选自以下的重编程因子:oct4、sox2、klf4、c-myc、l-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
[0060]
在多个方面,本发明涉及用于重编程非多能细胞的方法,其包括(a)提供非多能细胞;(b)培养所述细胞;以及(c)用一种或多种合成rna分子和本文所述化合物(例如式i-xvi的化合物)的复合物转染所述细胞,其中一种或多种合成rna分子包括至少一种编码一种或多种重编程因子的rna分子并且其中转染使得细胞表达一种或多种重编程因子,使得细胞被重编程。在实施方案中,步骤(c)在存在含有支持非多能细胞重编程的成分的培养基的情况下进行。在实施方案中,还包括在连续5天内重复步骤(c)至少两次。在实施方案中,在一种或多种较晚转染中转染的一种或多种合成rna分子的量大于在一种或多种较早转染中转染的量。在实施方案中,步骤(a)-(c)不使用饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,步骤(c)不使用辐射的人新生儿成纤维细胞饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,合成rna分子编码一种或多种选自以下的重编程因子:oct4、sox2、klf4、c-myc、l-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
[0061]
在多个方面,本发明涉及用于基因编辑细胞的方法,其包括用一种或多种合成rna
分子与本文所述的化合物(例如式i-xvi的化合物)的复合物转染细胞,其中一种或多种合成rna分子包括至少一种编码选自以下的一种或多种基因编辑蛋白的rna分子:核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、wo2014/071219a1中公开的基因编辑蛋白(所述专利的全部内容以引用的方式并入本文)、成簇规律间隔短回文重复序列(crispr)相关蛋白、crispr/cas9、cas9、xcas9、cas12a(cpf1)、cas13a、cas14、casx、casy、1类cas蛋白、2类cas蛋白和mad7,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。
[0062]
在多个方面,本发明涉及用于重编程和/或基因编辑细胞的方法,其包括使细胞与核酸和本文所述的化合物(例如式i-xvi的化合物)和/或在us2009/0143583a1中公开的化合物的复合物接触,所述参考的全部内容以引用的方式并入本文。
[0063]
在多个方面,本发明涉及包含本发明的核酸和本文所述的化合物(例如式i-xvi的化合物)和/或公开于us2009/0143583a1中的化合物的药物制剂,所述参考全部内容以引用的方式并入本文。
[0064]
在实施方案中,新的脂质可用于疫苗的递送。在多个方面,本发明涉及针对传染病(但不限于冠状病毒感染,例如covid-19)的疫苗接种方法,其包括使细胞与编码感染原抗原的核酸和本文所述的化合物(例如式i-xvi的化合物)的复合物接触。
[0065]
在多个方面,本发明涉及用于从含有氢化铝锂和溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述溶剂;(c)去除多余的水;以及(d)用醇(任选异丙醇)提取所述有机化合物;以得到提取的有机化合物。
[0066]
在多个方面,本发明涉及用于从含有水反应性化合物和第一溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述第一溶剂;(c)去除多余的水;以及(d)用第二溶剂提取所述有机化合物;以得到提取的有机化合物。
[0067]
在多个方面,本发明涉及用于从有机化合物和邻苯二甲酰亚胺或邻苯二甲酰亚胺衍生物(任选地邻苯二甲肼)的混合物中纯化有机化合物的方法,其包括:(a)将所述混合物溶解在丙酮中以形成沉淀;(b)通过离心去除所述沉淀;以及(c)去除所述丙酮;以得到纯化的有机化合物。
[0068]
在以下所附具体实施方式中陈述本发明的细节。虽然在本发明的实践或测试中可以使用与本文所描述的那些方法和材料类似或等效的方法和材料,但现在描述说明性的方法和材料。由具体实施方式和权利要求中将显而易见本发明的其他特征、目的和优点。在说明书和所附权利要求中,除非上下文另有明确规定,否则单数形式还包括复数。除非另外定义,否则本文所使用的所有技术和科学术语都具有与本发明所属领域中普通技术人员通常所理解的相同的含义。
[0069]
本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
附图说明
[0070]
图1描绘了在24孔板中培养,并用每孔400ng的体外转录的编码绿色荧光蛋白(gfp)的rna转染的原代人表皮角质形成细胞,所述rna与指定的脂质复合并且具有指定的脂质与rna的质量比。在dmem中进行复合,并在100%胎牛血清(fbs)中进行转染。转染后八小时拍摄图像。
[0071]
图2描绘了图1的实验,在使用dhdlins转染后的指定时间点测量荧光。
[0072]
图3描绘了如图1中进行的实验的结果,但具有指定的rna量(以纳克为单位)和指定的脂质与rna质量比(以微克脂质每微克rna为单位)。转染后16小时拍摄图像。如图所示,所有测试的rna量和脂质与rna的质量比都产生了荧光信号。
[0073]
图4描绘了如在图1中进行的实验的结果,但是用人外周血单核细胞(hpbmc)而不是角质形成细胞。转染后16小时拍摄图像。“lf3000”表示用lipofectamine 3000商业转染试剂转染的细胞。“neg.”表示与用dhdlins转染的细胞相比未转染的细胞。
[0074]
图5a描绘了如在图4中进行的实验的结果,但用原代人表皮角质形成细胞的融合层而不是hpbmc。转染后24小时拍摄图像。
[0075]
图5b描绘了图5a的实验,以更高的放大倍数显示。
[0076]
图6描绘了如在图4中进行的实验的结果,但用原代成人真皮成纤维细胞而不是hpbmc。转染后16小时拍摄图像。
[0077]
图7描绘了图6的实验,以更高的放大倍数显示。
[0078]
图8描绘了如在图3中进行的实验的结果,但用如实施例6中所述通过用丙酮提取纯化的dhdlins。
[0079]
图9描绘了实验的结果,其中用体外转录的编码基因编辑蛋白的与dhdlins复合的rna转染原代人表皮角质形成细胞。
[0080]
图10描绘了实验的结果,其中原代人表皮角质形成细胞用体外转录的编码gfp的并与dlindhs复合的rna转染。将rna-dlindhs复合物添加至无血清培养基(0%胎牛血清(fbs))或50%fbs中的20,000个人表皮角质形成细胞中。转染后16小时拍摄图像。“mc3 lnp”表示利用使用微流体装置配制的gfp rna转染成脂质纳米颗粒的细胞,所述脂质纳米颗粒由dlin-mc3-dma、dope、胆固醇和dmpe-peg组成,摩尔比为30:30:38.5:1.5。
[0081]
图11a说明了实验的结果,其中原代人真皮成纤维细胞用体外转录的编码gfp的并与dlindhs复合的rna转染。在gfp编码rna中,20%用cy5标记。将rna-dlindhs复合物添加至10%fbs中的20,000个人真皮成纤维细胞中。在转染后50分钟、100分钟、150分钟、200分钟、250分钟和300分钟拍摄图像。
[0082]
图11b说明了实验的结果,其中原代人真皮成纤维细胞用体外转录的编码gfp并与dlindhs复合的rna转染。在dlindhs中,10%用bodipy荧光标签标记。将rna-dlindhs复合物添加至10%fbs中的20,000个人真皮成纤维细胞中。在转染时(“0min”)和转染后20分钟、40分钟、60分钟、80分钟、100分钟、120分钟和140分钟,在bodipy通道中拍摄图像。
[0083]
图12说明了dlindhs的合成示意图。
[0084]
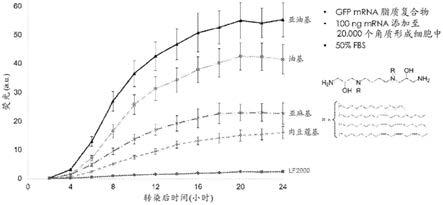
图13说明了实验的结果,其中原代人表皮角质形成细胞用体外转录的编码gfp的并与本发明的化合物复合的rna转染,所述化合物包含缀合至不同脂肪酸衍生尾部(包括肉豆蔻基、油基、亚油基和亚麻基)的二羟基精胺头基。此图说明了所研究的复合物和与lipofectamine 2000复合的rna的荧光(a.u.)与转染后时间(小时)的关系。
[0085]
图14说明了实验的结果,其中原代人表皮角质形成细胞用体外转录的编码gfp的并与本发明的化合物复合的rna转染,所述化合物包含二亚油基脂肪酸衍生的尾部结构。如图所示,测试化合物的结构是双-(2-羟基-3-氨基丙基)-n,n'-二亚油基-二胺,其中标记表示头基的中央氨基间碳链的长度(结构上的n)。此图说明了所研究的复合物和与
lipofectamine 2000复合的rna的荧光(a.u.)与转染后时间(小时)的关系。
[0086]
图15描绘了说明几种dlindhs/rna复合物的z均粒径(nm)和多分散性指数(pdi)对复合培养基的离子强度([nacl],mm)的图。复合物是通过将脂质稀释到复合培养基中形成的,所述复合培养基是一种具有指定离子强度的水性rna溶液。
[0087]
图16描绘了说明稀释到滴定至指定ph的20mm缓冲液中的dlindhs/rna复合物的ζ电位(mv)的图。
[0088]
图17说明了未用rna酶a处理的dlindhs/rna复合物(“未处理”)、在复合后用rna酶a处理的dlindhs/rna复合物(“复合后rna酶”)以及与在复合前用rna酶a处理的rna复合的dlindhs(“复合前rna酶”)的图像。
[0089]
图18说明了体外转录的编码gfp的rna在原代人真皮成纤维细胞、活化的人外周血单核细胞(pbmc)、人肺腺癌细胞、多能干细胞(ips细胞)和大鼠胚胎皮质神经元中与dlindhs复合的转染结果。
[0090]
图19描绘了实验的结果,其中体外转录的rna与dlindhs复合并通过皮内注射施用于大鼠。将注射部位处的组织固定并安装在载玻片上,然后用苏木精(蓝色)和兔抗gfp抗体(棕色)染色。示出了同一组织的两种不同放大倍数。
[0091]
图20a描绘了通过皮内注射施用与dlindhs复合的编码gfp的rna 48小时后通过荧光共聚焦显微镜成像的活检人皮肤。
[0092]
图20b描绘了通过皮内注射将mrna体内递送至人受试者的实验结果。
具体实施方式
[0093]
本发明部分基于新型脂质的发现,其尤其表现出例如在转染期间支持将核酸递送至细胞的卓越能力。本发明提供此类组合物、制备所述组合物的方法和使用所述组合物以将核酸引入到细胞中的方法,其包括用于治疗疾病。
[0094]
化合物和合成方法
[0095]
在多个方面,本发明涉及式(i)的化合物:
[0096][0097]
其中:q1、q2、q3和q4独立地是能够带正电荷的原子或基团;
[0098]
a1和a2独立地是空、h或任选取代的c
1-c6烷基;
[0099]
l1、l2和l3独立地是空、键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基或上述任选地通过醚、酯、酸酐、酰胺、氨基甲酸酯、仲胺、叔胺、季铵、硫醚、脲、羰基或亚胺中的一种或多种连接的任何组合;
[0100]
r1、r2、r3、r4、r5、r6、r7和r8独立地是空、h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟
基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r1、r2、r3、r4、r5、r6、r7和r8中的至少一个包含至少两个不饱和键;并且
[0101]
x、y和z独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0102]
在实施方案中,q1、q2、q3和q4独立地是n、b、p或fe。
[0103]
在实施方案中,q1、q2、q3和q4是n。
[0104]
在实施方案中,q1、q2、q3和q4独立地是伯胺、仲胺或叔胺。
[0105]
在实施方案中,q1和q4是伯胺,并且q2和q3是叔胺。
[0106]
在实施方案中,l1、l2和l3独立地是(c
1-c6)烷二基或(羟基)(c
1-c6)烷二基。
[0107]
在实施方案中,l1和l3独立地是(羟基)(c
1-c6)烷二基,并且l2是(c
1-c6)烷二基。
[0108]
在实施方案中,l1和l3是2-羟基丙二基,并且l2是(c
1-c6)烷二基。
[0109]
在实施方案中,l1和l3是2-羟基丙二基,并且l2是丁二基。
[0110]
在实施方案中,r1、r2、r3、r4、r5、r6、r7和r8中的一个或多个独立地选自h、亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0111]
在实施方案中,r1、r2、r3、r4、r5、r6、r7和r8中的两个或更多个独立地选自h、亚油酰基、α-亚麻酰基、γ-亚麻酰基、亚麻油酰基、花生四烯酰基、二十碳五烯酰基和二十二碳六烯酰基。
[0112]
在实施方案中,r1、r2、r3、r4、r5、r6、r7和r8中的一个或多个独立地选自h、肉豆蔻油基、棕榈油基、十六碳烯基(sapienyl)、油基、反油基(elaidyl)、十八碳烯基(vaccenyl)、芥基(erucyl)、辛基(caprylyl)、己基(capryl)、月桂基(lauryl)、肉豆蔻基(myristyl)、棕榈基(palmityl)、硬脂基(stearyl)、花生基(arachidyl)、山嵛基(behenyl)、木蜡基(lignoceryl)和蜡油基(cerotyl)。
[0113]
在实施方案中,r1、r2、r3、r4、r5、r6、r7和r8中的两个或更多个独立地选自h、肉豆蔻油酰基、棕榈油酰基、十六碳烯酰基(sapienoyl)、油酰基、反油酰基(elaidoyl)、十八碳烯酰基(vaccenoyl)、芥酰基(erucoyl)、辛酰基(capryloyl)、己酰基(caproyl)、月桂酰基(lauroyl)、肉豆蔻酰基(myristoyl)、棕榈酰基(palmitoyl)、硬脂酰基(stearoyl)、花生酰基(arachidoyl)、山萮酰基(behenoyl)、木蜡酰基(lignoceroyl)和蜡油酰基(cerotoyl)。
[0114]
在实施方案中,r1、r2、r3、r5、r7、r8是h,并且r4和r6独立地选自亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0115]
在实施方案中,r1、r2、r3、r5、r7和r8是h,并且r4和r6是α-亚麻基。
[0116]
在实施方案中,r1、r2、r3、r5、r7和r8是h,并且r4和r6是亚油基。
[0117]
在实施方案中,x和z独立地是0或1,并且y是1。
[0118]
在实施方案中,q1和q4是伯胺;q2和q3是叔胺;l1和l3是2-羟基丙二基;l2是丁二基;r1、r2、r3、r5、r7和r8是h,并且r4和r6是亚油基;并且x、y和z是1。
[0119]
在实施方案中,l1、l2和l3中的一个或多个包含至少一个酯部分。
[0120]
在实施方案中,r2和r4中的一个或多个包含至少一个酯部分。
[0121]
在实施方案中,a1和a2是h。
[0122]
在多个方面,本发明涉及式(ii)的化合物
[0123][0124]
其中:r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、r
21
、r
22
、r
23
、r
24
、r
25
、r
26
、r
27
和r
28
独立地是h、卤基、oh、(c
1-c6)烷基、(卤基)(c
1-c6)烷基、(羟基)(c
1-c6)烷基、(烷氧基)(c
1-c6)烷基、芳基、杂芳基、环烷基或杂环基;
[0125]
i、j、k、m、s和t独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0126]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h或(c
1-c6)烷基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0127]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h或(c
1-c6)烷基;r
27
和r
28
是甲基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0128]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0129]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0130]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是9;i是9;s是1;j是1;k是4;并且t是4。
[0131]
在实施方案中,r
15
、r
16
、r
17
、r
18r19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是9;i是9;s是1;j是1;k是3;并且t是3。
[0132]
在多个方面,本发明涉及式(iii)的化合物:
[0133][0134]
其中l4、l5、l6和l7独立地是键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基、-(ch2)
v1-c(o)-、或-((ch2)
v1-o)
v2-、或
–
((ch2)
v1-c(o)-o)
v2-;
[0135]r29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少一个包含至少两个不饱和键;
[0136]
v、v1和v2独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0137]
在实施方案中,l4、l5、l6和l7是-(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0138]
在实施方案中,l4和l5是
–
(ch2)
3-;l6和l7是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0139]
在实施方案中,l4和l6是
–
(ch2)
3-;l5和l7是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0140]
在实施方案中,l4和l7是
–
(ch2)
3-;l5和l6是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0141]
在实施方案中,l4和l6是
–
(ch2)
3-;l5和l7是
–
(ch2)
5-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0142]
在实施方案中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0143]
在实施方案中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0144]
在实施方案中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0145]
在实施方案中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
5-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0146]
在实施方案中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
6-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0147]
在实施方案中,r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的两个或更多个独立地选自h、肉豆蔻油酰基、棕榈油酰基、十六碳烯酰基(sapienoyl)、油酰基、反油酰基(elaidoyl)、十八碳烯酰基(vaccenoyl)、二十二碳烯酰基(erucoyl)、辛酰基(capryloyl)、己酰基(caproyl)、月桂酰基(lauroyl)、肉豆蔻酰基(myristoyl)、棕榈酰基(palmitoyl)、硬脂酰基(stearoyl)、花生酰基(arachidoyl)、山萮酰基(behenoyl)、木蜡酰基(lignoceroyl)和蜡
油酰基(cerotoyl)。
[0148]
在实施方案中,r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的两个或更多个独立地选自h、亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0149]
在实施方案中,l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
3-;并且v是1。
[0150]
在实施方案中,l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
4-;并且v是1。
[0151]
在实施方案中,l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
5-;并且v是1。
[0152]
在实施方案中,l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
6-;并且v是1。
[0153]
在实施方案中,本发明涉及式(iv)的化合物:
[0154][0155]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0156]
在实施方案中,本发明涉及式(v)的化合物:
[0157][0158]
在实施方案中,本发明涉及式(vi)的化合物:
[0159]
[0160]
在实施方案中,本发明涉及式(vii)的化合物:
[0161][0162]
在实施方案中,本发明涉及式(viii)的化合物:
[0163][0164]
在实施方案中,本发明涉及式(ix)的化合物:
[0165][0166]
在实施方案中,本发明涉及式(x)的化合物:
[0167][0168]
在实施方案中,本发明涉及式(xi)的化合物:
[0169]
在实施方案中,本发明涉及式(xii)的化合物:
[0170]
在实施方案中,本发明涉及式(xiii)的化合物:
[0171][0172]
在实施方案中,本发明涉及式(xiv)的化合物:
[0173][0174]
在实施方案中,本发明涉及式(xv)的化合物:
[0175][0176]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0177]
在实施方案中,本发明涉及式(xvi)的化合物:
[0178]
[0179]
本发明还涉及用于制备本发明的化合物(例如式i-xvi的化合物)和组合物的中间体和合成方法。
[0180]
在实施方案中,化合物(例如式i-xvi的化合物),和/或包含化合物(例如式i-xvi的化合物)的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒,在室温(例如约20-25℃)下和/或在低温(例如约0℃、或约-10℃、或约-20℃、或约-30℃、或约-40℃、或约-50℃、或约-60℃、或约-70℃、或约-80℃)下可溶于醇(例如乙醇)。
[0181]
已发现某些合成方法,例如可用于制备本文所述的化合物(例如式i-xvi的化合物)的合成方法。某些实施方案涉及用于从含有锂和/或铝化合物的反应中提取有机化合物的方法。其他实施方案涉及用于从含有还原剂的反应中提取有机化合物的方法。在一个实施方案中,还原剂是金属氢化物。在另一个实施方案中,还原剂是氢化铝锂。在一些实施方案中,将反应用水猝灭以产生猝灭的反应。在其他实施方案中,例如通过蒸发从淬灭的反应中去除一种或多种溶剂。在一个实施方案中,例如在加热情况下和/或在减压下将猝灭的反应干燥。在另一个实施方案中,将干燥的、淬灭的反应用溶剂提取。在一些实施方案中,溶剂是醇。在一个实施方案中,醇是异丙醇。在另一个实施方案中,将异丙醇加热至约80℃。在另一个实施方案中,倾析和/或过滤含有有机化合物的溶剂。在又一个实施方案中,例如通过蒸发去除溶剂以产生有机化合物。
[0182]
还发现了用于纯化本发明的化合物(例如式i-xvi的化合物)的方法。因此,某些实施方案涉及用于纯化化合物(例如式i-xvi的化合物)的方法。在一个实施方案中,将含有化合物(例如式i-xvi的化合物)和一种或多种杂质的样品悬浮在溶剂中。在一个实施方案中,溶剂是丙酮。在另一个实施方案中,将溶剂加热。在一些实施方案中,化合物可溶于溶剂。在其他实施方案中,一种或多种杂质中的至少一种不溶于溶剂。在一个实施方案中,一种或多种杂质包含邻苯二甲酰亚胺衍生物。在一个实施方案中,一种或多种杂质包括邻苯二甲肼。在另一个实施方案中,将样品悬浮在丙酮中,将化合物溶解,并且一种或多种杂质中的至少一种形成沉淀。在又一个实施方案中,通过倾析、过滤和/或离心去除沉淀。在又一实施方案中,例如通过蒸发去除溶剂以产生纯化的化合物。
[0183]
在多个方面,本发明涉及用于从含有氢化铝锂和溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述溶剂;(c)去除多余的水;以及(d)用醇(任选异丙醇)提取所述有机化合物;以得到提取的有机化合物。
[0184]
在多个方面,本发明涉及用于从含有水反应性化合物和第一溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述第一溶剂;(c)去除多余的水;以及(d)用第二溶剂提取所述有机化合物;以得到提取的有机化合物。
[0185]
在多个方面,本发明涉及用于从有机化合物和邻苯二甲酰亚胺或邻苯二甲酰亚胺衍生物(任选地邻苯二甲肼)的混合物中纯化有机化合物的方法,其包括:(a)将所述混合物溶解在丙酮中以形成沉淀;(b)通过离心去除所述沉淀;以及(c)去除所述丙酮;以得到纯化的有机化合物。
[0186]
药物组合物、脂质聚集体、脂质载剂
[0187]
在实施方案中,本发明涉及药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒,其包含本文所述的化合物(例如式i-xvi的
化合物)。
[0188]
在实施方案中,药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒是任何物理形式,其包括例如脂质纳米颗粒、脂质体、胶束、交错双分子层等。
[0189]
在实施方案中,药物组合物和/或脂质聚集体和/或脂质载剂是脂质体。在实施方案中,脂质体是大单层脂囊(luv)、多层脂囊(mlv)或小单层脂囊(suv)。在实施方案中,脂质体具有至多约50至80nm的直径。在实施方案中,脂质体具有大于约80至1000nm或更大的直径。在实施方案中,脂质体的直径为约50至1000nm,例如约200nm或更小。尺寸表示形成的颗粒的尺寸(直径)。尺寸可替代地表示形成的颗粒的流体动力学半径。尺寸分布可在nicomp 370型亚微米粒径分析仪上使用准弹性光散射(qels)来确定。
[0190]
在某些实施方案中,本发明涉及用于生产脂质包封的核酸颗粒的方法和组合物,其中核酸被包封在脂质层内。此类核酸-脂质颗粒(包括但不限于掺入rna的核酸-脂质颗粒)使用多种生物物理参数来表征,所述参数包括:药物与脂质比;包封效率;粒径和多分散性指数(pdi)。高药物与脂质比、高包封效率、良好的核酸酶抗性和血清稳定性以及可控的粒径,通常直径小于200nm是期望的(但不限于)。
[0191]
在某些实施方案中,可影响转染效率的粒径取决于复合培养基的离子强度。在其他实施方案中,粒径可取决于体液的离子强度。在实施方案中,粒径取决于复合培养基的ph,或取决于体液的ph。在多个实施方案中,粒径取决于复合时间或温度,或取决于药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒的组分的混合速率。在一些实施方案中,可将粒径测量为z均粒径,其报告颗粒分布的平均尺寸。在一些实施方案中,颗粒的期望尺寸为约100nm至约200nm、或约150nm至约200nm、或约150nm至约175nm、或约155nm至约165nm。
[0192]
根据本发明的脂质纳米颗粒的另一个物理属性是多分散性指数(pdi),这是所述脂质纳米颗粒的尺寸分布的指示。术语“多分散性”(或“分散性”)用于描述颗粒尺寸分布的不均匀程度。pdi是无量纲的,并按比例缩放,使得小于0.15的值被认为是单分散的。danaei等人,pharmaceutics.2018年5月18日;10(2):57。pdi值大于0.7表明样品具有非常宽的粒径分布,并可能适合通过动态光散射(dls)技术来进行分析。同上。在使用基于脂质的载剂的药物递送应用中,低于0.3的pdi值被认为是可以接受的,而对于各种基于聚合物的纳米颗粒,低于0.2的值通常被认为在实践中是可以接受的。同上;另见badran等人,digest j.nanomater.biostruct.2014,9,83
–
91;chen等人,int.j.pharm.2011,408,223-234;putri等人,j.pharm.sci.commun.2017,14,79-85。
[0193]
在一些实施方案中,粒径的量度(例如,测量为z均粒径(nm))和pdi的量度代表脂质纳米颗粒对于转染的适用性。在实施方案中,根据本发明的脂质载剂具有小于200nm的直径尺寸和小于0.2的pdi。
[0194]
在一些实施方案中,根据本发明的脂质载剂具有ph依赖性ζ电位。针对纳米颗粒的表征来确定以伏特(v)或毫伏(mv)为单位的ζ电位以估计表面电荷,这可用于理解纳米悬浮液的物理稳定性。ζ电位是胶态分散体稳定性的关键指标。ζ电位是双层(dl)边界处的电位或颗粒的剪切面,并具有通常为+100至-100mv的值。小于负20mv或大于正20mv的ζ电位值通常是静电稳定悬浮液所需要的。ζ电位受培养基ph的影响。其他因素包括离子强度、添加剂
浓度和温度。
[0195]
在一些实施方案中,包含脂质颗粒的药物组合物的ζ电位在大于7.0的ph下小于-20mv、或在大于7.1的ph下小于-20mv、或在大于7.2的ph下小于-20mv、或在大于7.3的ph下小于-20mv、或在大于7.4的ph下小于-20mv、或在大于7.5的ph下小于-20mv。
[0196]
在实施方案中,根据本公开的化合物、药物组合物或脂质聚集体具有约50nm至约2000nm、或约700nm至约1500nm的z均粒径。在一些实施方案中,z均粒径为约750nm。在一些实施方案中,z均粒径小于约200nm。在一些实施方案中,需要可滴定的粒径来确定化合物或药物组合物或脂质聚集体从施用部位在体内渗透的能力,但不限于此。
[0197]
在一些实施方案中,在其中形成根据本公开的化合物、药物组合物或脂质聚集体的培养基的特性用于控制z均粒径。
[0198]
在实施方案中,在其中形成根据本公开的化合物、药物组合物或脂质聚集体的培养基的离子强度用于控制z均粒径。
[0199]
在实施方案中,通过控制脂质聚集体形成的培养基中的任何一种或多种溶质(例如但不限于氯化钠、或氯化钙、或氯化钾、或磷酸钠)的浓度来确定粒径。在实施方案中,脂质聚集体在不添加溶质的去离子水中形成,所述去离子水可任选地用于控制粒径。
[0200]
在实施方案中,在其中形成根据本公开的化合物、药物组合物或脂质聚集体的培养基的离子强度用于保持小于或等于200nm的粒径。
[0201]
在实施方案中,在其中形成根据本公开的化合物、药物组合物或脂质聚集体的培养基的ph用于控制z均粒径。
[0202]
在实施方案中,根据本公开的化合物、药物组合物或脂质聚集体包含稳定的颗粒分散体。在一些实施方案中,稳定的分散体具有约7.0至约8.0的ph、或约7.4的ph。
[0203]
在一些实施方案中,核酸(例如,小干扰rna(sirna)、微小rna(mirna)、信使rna(mrna)、长链非编码rna(lncrna)、质粒dna等)与脂质纳米颗粒的复合赋予核酸酶抗性。在一些实施方案中,核酸酶是rna酶,任选地是rna酶a。在一些实施方案中,rna酶是体内天然存在的。
[0204]
核酸与脂质的比率是指规定体积的制剂中的核酸量除以相同体积中的脂质量。这可基于摩尔/摩尔、或基于重量/重量、或基于重量/摩尔、或基于摩尔/重量。对于最终的即用型制剂,核酸:脂质比可以任选地在渗析后计算,色谱法和/或酶(例如,核酸酶)消化已被用于去除尽可能多的外部核酸。
[0205]
包封效率是指起始混合物的药物(包括核酸)与脂质的比率除以最终的施用感受态(competent)制剂的药物(包括核酸)与脂质的比率。这是相对效率的量度。对于绝对效率的量度,也可以计算添加至最终在施用感受态制剂中的起始混合物中的核酸总量。还可计算在配制过程中损失的脂质量。效率是对制剂浪费和费用的量度。
[0206]
转染
[0207]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂在将大分子和其他化合物递送到细胞中的脂质聚集体中有用。在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂可用于将核酸递送到细胞中。
[0208]
在实施方案中,提供了用核酸转染细胞的方法,其包括使细胞与核酸和本发明化
technologies))的内体逃逸的约5倍、或10倍、或15倍、或20倍、或30倍。
[0214]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂是抗血清的。在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂在血清中基本上稳定。在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂是抗血清的。在实施方案中,本发明转染方法可在存在血清的情况下起作用且/或不需要血清灭活和/或培养基改变。在实施方案中,血清中的稳定性和/或抗血清可经由体外测定进行测量。可使用在不同量的血清中的转染效率来评估转染大分子(例如但不限于dna或rna)的能力,任选地与可商购获得的产品(例如lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000(life technologies))进行比较。
[0215]
在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂或具有低或降低的毒性作用的转染方法。在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂或与可商购获得的产品(例如lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000(life technologies))相比具有降低的毒性作用的转染方法。在多个实施方案中,本发明组合物和方法使细胞在转染后具有大于约50%、或约60%、或约70%、或约80%、或约90%、或约95%的活力。在多个实施方案中,与可商购获得的产品(例如,lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000(life technologies))相比,本发明组合物和方法使细胞在转染后具有5倍、或10倍、或15倍、或20倍、或30倍的活力。在实施方案中,毒性作用包括细胞形态和/或活力的破坏或一个或多个基因的失调。
[0216]
在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂或允许由被转染的核酸(例如dna或rna)表达高水平的蛋白质的转染方法。在多个实施方案中,本发明组合物和方法的蛋白质表达比未转染的高约30%、或高约40%、或高约50%、或高约60%、或高约70%、或高约80%、或高约90%、或高约95%。在多个实施方案中,本发明组合物和方法的所得蛋白质表达高于可商购获得的产品(例如lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000(life technologies))的所得蛋白质表达。在多个实施方案中,本发明组合物和方法的的所得蛋白质表达是可商购获得的产品(例如lipofectin、lipofectamine、lipofectamine2000、lipofectamine 3000(life technologies))的所得蛋白质表达的约5倍、或10倍、或15倍、或20倍、或30倍。
[0217]
在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂,或允许在各种细胞类型中进行转染,包括如本文所述的有效转染的转染方法。在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂,或允许在已建立的细胞系、难以转染的细胞、原代细胞、干细胞和血细胞中转染,包括如本文所述的有效转染的转染方法。在实施方案中,细胞类型是角质形成细胞、成纤维细胞或pbmc。
[0218]
在实施方案中,本发明化合物(例如式i-xvi的化合物)、药物组合物和/或脂质聚集体和/或脂质载剂适用于体外或体内转染或化合物至靶细胞的递送。
[0219]
在实施方案中,本发明涉及用于转染的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂,或不需要额外转染试剂例如lipofectamine plus试剂(life technologies)的转染方法。
[0220]
在实施方案中,本发明化合物是不需要额外或辅助脂质(例如用于有效转染)的药物组合物和/或脂质聚集体和/或脂质载剂的组分。例如,在实施方案中,不需要dope、dopc、胆固醇和聚乙二醇(peg)修饰的脂质(包括但不限于,或dope、dopc和/或胆固醇的peg化)中的一种或多种(例如来有效转染)的药物组合物和/或脂质聚集体和/或脂质载剂。
[0221]
在实施方案中,本发明化合物是还包含额外或辅助脂质的药物组合物和/或脂质聚集体和/或脂质载剂的组分。
[0222]
在实施方案中,额外或辅助脂质选自以下类别中的一种或多种:阳离子脂质;阴离子脂质;中性脂质;多价带电脂质;和两性离子脂质。在一些情况下,阳离子脂质可以用于促进与核酸的电荷-电荷相互作用。
[0223]
在实施方案中,额外或辅助脂质是中性脂质。在实施方案中,中性脂质是二油酰基磷脂酰乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)或胆固醇。在实施方案中,胆固醇来源于植物来源。在其他实施方案中,胆固醇来源于动物、真菌、细菌或古细菌来源。
[0224]
在实施方案中,额外或辅助脂质是另外的阳离子脂质。在实施方案中,阳离子脂质是n-[1-(2,3-二油酰基氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、1,2-双(油酰基氧基)-3-3-(三甲基铵)丙烷(dotap)或1,2-二油酰基-3-二甲基铵-丙烷(dodap)。
[0225]
在实施方案中,磷脂18:0pc、18:1pc、18:2pc、18:2pe、dspe、dope、18:2pe、dmpe或它们的组合用作辅助脂质。在实施方案中,额外的或辅助脂质是dotma和dope,任选地比率为约1:1。在实施方案中,额外或辅助脂质是dhdos和dope,任选地比率为约1:1。
[0226]
在实施方案中,额外或辅助脂质是可商购获得的产品(例如lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000life technologies)。
[0227]
在实施方案中,额外或辅助脂质是具有式(a)的化合物:
[0228][0229]
其中,r1和r4是具有17个碳原子的直链烯基;r2和r5是-(ch2)p-nh2,其中p是1-4;l是1-10;并且xa是生理上可接受的阴离子。
[0230]
在实施方案中,额外或辅助脂质是peg化脂质。在实施方案中,peg化脂质具有与其共价连接的peg分子,其中peg具有约10kda至约400kda的平均分子量。在实施方案中,适用于在本发明中使用的聚乙二醇是平均分子量为至少10,000道尔顿至40,000道尔顿的那些聚乙二醇。在实施方案中,peg的平均分子量为20,000道尔顿,诸如在20,000至700,000道尔
顿的范围内,例如在20,000至600,000道尔顿的范围内,诸如在35,000至500,000道尔顿的范围内,例如在35,000至400,000道尔顿的范围内,诸如在35,000至350,000道尔顿的范围内,例如在50,000至350,000道尔顿的范围内,诸如在100,000至300,000道尔顿的范围内,例如在150,000至350,000道尔顿的范围内,诸如在200,000至300,000道尔顿的范围内。在某些实施方案中,适合于与本文所述的组合物和方法一起使用的聚乙二醇是平均分子量选自以下的那些聚乙二醇:大约10,000道尔顿、大约15,000道尔顿、大约20,000道尔顿、大约25,000道尔顿、大约30,000道尔顿、大约35,000道尔顿、大约50,000道尔顿、大约75,000道尔顿、大约100,000道尔顿、大约150,000道尔顿、大约200,000道尔顿、大约250,000道尔顿、大约300,000道尔顿、大约400,000道尔顿、150,000道尔顿、200,000道尔顿、250,000道尔顿、300,000道尔顿、400,000道尔顿。在本上下文中,提及聚乙二醇的平均分子量时,“大约”表示+/-30%。在实施方案中,与本文所述的组合物和方法共价连接的peg的平均分子量为10kda、20kda或40kda。在实施方案中,peg是支链peg、星形peg或梳形peg。
[0231]
在一个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包括一个或多个聚乙二醇(peg)链,任选地选自peg200、peg300、peg400、peg600、peg800、peg1000、peg1500、peg2000、peg3000和peg4000。在实施方案中,peg是peg2000。在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(dspe)或其衍生物。在一个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含peg化脂质1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-peg);在另一个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dmpe-peg);在又一实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含1,2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(dmg-peg)。在其他实施方案中,本发明的化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含peg化脂质或游离peg链的混合物。
[0232]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含n-(羰基-乙氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mpeg2000-dspe)、全氢化磷脂酰胆碱、胆固醇、lipofectamine 3000、阳离子脂质、聚阳离子脂质和1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叶酸(聚乙二醇)-5000](fa-mpeg5000-dspe)。
[0233]
在一些实施方案中,将一种或多种peg化辅助脂质掺入包含本发明化合物(例如式i-xvi的化合物)的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质体和/或脂质纳米颗粒中。在一些实施方案中,使用peg化辅助脂质的浓度、或peg化辅助脂质与本发明化合物(例如式i-xvi的化合物)中的任何一种或多种的比率、或peg化辅助脂质与核酸的比率来影响粒径。在一些实施方案中,粒径由其他因素(例如但不限于,含有颗粒的溶液的离子强度、向含有粒子的溶液中添加盐、向含有粒子的溶液中添加其他小分子、调整含有颗粒的溶液的ph)决定。在一些实施方案中,通过其他因素的粒径控制与一种或多种peg化辅助脂质结合使用,或代替一种或多种peg化辅助脂质使用。
[0234]
在一个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含约3.2mg/ml n-(羰基-乙氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(mpeg2000-dspe)、约9.6mg/ml全氢化磷脂酰胆碱、约3.2mg/ml胆固醇、约2mg/ml硫酸铵和作为缓冲剂的组氨酸,以及添加至脂质混合物中的约0.27mg/ml 1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叶酸(聚乙二醇)-5000](fa-mpeg5000-dspe)。在另一个实施方案中,核酸通过每约1μg核酸组合1μl lipofectamine 3000并在室温下孵育至少约5分钟进行复合。在一个实施方案中,lipofectamine 3000是包含浓度为约1mg/ml的脂质的溶液。在实施方案中,核酸通过每约1μg核酸组合约10μg本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂并在室温下孵育约5分钟进行包封。
[0235]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含一种或多种纳米颗粒。在一个实施方案中,纳米颗粒使聚合物纳米颗粒。在多个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含二嵌段共聚物、三嵌段共聚物、四嵌段共聚物和多嵌段共聚物中的一种或多种。在多个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含聚合物纳米颗粒中的一种或多种,所述聚合物纳米颗粒包含聚乙二醇(peg)-修饰的聚乳酸(pla)二嵌段共聚物(pla-peg)、peg-聚丙二醇-peg-修饰的pla-四嵌段共聚物(pla-peg-ppg-peg)和聚(乳酸-共-乙醇酸)共聚物。在另一个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含统计的、或交替的、或周期性的共聚物,或聚合物的任何其他种类。
[0236]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含描述于wo/2000/027795中的一种或多种脂质,所述参考的全部内容在此以引用的方式并入。
[0237]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含如美国专利号5,627,159中所述的polybrene
tm
(溴化己二甲胺),所述专利的全部内容以引用的方式并入本文。
[0238]
在多个实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂包含一种或多种聚合物。聚合物的实例包括溴化己二甲胺(polybrene
tm
)、deae-葡聚糖、鱼精蛋白、硫酸鱼精蛋白、聚-l-赖氨酸或聚-d-赖氨酸。这些聚合物可与阳离子脂质组合使用以产生对细胞摄取、本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂稳定性的协同作用,其包括血清稳定性(例如,体内血清稳定性)、内体逃逸、细胞活力和蛋白质表达。
[0239]
在实施方案中,本发明化合物是还包含一种或多种选自表1的额外脂质或聚合物的药物组合物和/或脂质聚集体和/或脂质载剂的组分。在其他实施方案中,本发明的核酸是还包含一种或多种选自表1的脂质或聚合物的药物组合物和/或脂质聚集体和/或脂质载剂的组分。
[0240]
在多个实施方案中,表1的脂质中的一种或多种、或两种或更多种、或三种或更多种、或四种或更多种、或五种或更多种与本发明化合物在制剂中组合并且是药物组合物和/或脂质聚集体和/或脂质载剂的组分。
[0241]
表1.说明性生物相容性脂质和聚合物
[0242]
[0243]
[0244][0245]
可能存在于本发明的药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质核酸复合物和/或脂质体和/或脂质纳米颗粒中的额外组分包括双层稳定组分,诸如聚酰胺低聚物(参见例如,美国专利号6,320,017)、肽、蛋白质、洗涤剂、脂质衍生物,诸如与磷脂酰乙醇胺偶联的peg和与神经酰胺缀合的peg(参见,美国专利号5,885,613)。
[0246]
在实施方案中,本发明的脂质包括另外的阳离子脂质、中性脂质、甾醇和脂质,所述脂质被选择以减少形成过程中脂质颗粒的聚集,这可能是颗粒的空间稳定性防止形成过程中电荷诱导的聚集引起的。在形成过程中减少颗粒聚集的脂质的实例包括聚乙二醇(peg)修饰的脂质、单唾液酸神经节苷脂gm1和聚酰胺低聚物(“pao”),诸如(描述于美国专利号6,320,017的聚酰胺低聚物)。具有不带电荷的、亲水的、空间位阻部分的,在配制过程中防止聚集的其他化合物,如peg、gm1或atta,也可与脂质偶联以用于本发明的方法和组合物中。atta-脂质描述于例如,美国专利号6,320,017中,并且peg-脂质缀合物描述于例如美国专利号5,820,873、5,534,499和5,885,613中。典型地,为减少聚集而选择的脂质组分的浓度为约0.1%至15%(按脂质的摩尔百分比计)。如果颗粒在配制后稳定,peg或atta可在施用于受试者之前渗析掉。
[0247]
在实施方案中,期望靶向使用对细胞类型或组织具有特异性的靶向部分的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂。先前已经描述了使用多种靶向部分,诸如配体、细胞表面受体、糖蛋白、维生素(例如核黄素)和单克隆抗体来靶向脂质颗粒(参见例如美国专利号4,957,773和4,603,044)。靶向部分可包含整个蛋白质或其片段。靶向机制通常要求靶向剂以靶标部分可用于与靶标例如细胞表面受体相互作用的方式定位在脂质颗粒的表面上。多种不同的靶向剂和方法是本领域已知和可用的,包括描述于例如sapra和allen,prog.lipid res.42(5):439-62(2003);和abra等人,j.liposome res.12:1-3,(2002)中的那些靶向剂和方法。可使用用于偶联靶标剂的标准方法。例如,可使用可被激活以连接靶标剂的磷脂酰乙醇胺,或衍生的亲脂性化合物,诸如脂质衍生的博来霉素。可使用例如掺入蛋白a的脂质体构建抗体靶向脂质体(参见,renneisen等人,j.bio.chem.,265:16337-16342(1990)和leonetti等人,proc.natl.acad.sci.(usa),87:2448-2451(1990))。抗体缀合的其他实例公开于美国专利号6,027,726中,所述专利的教导以引用的方式并入本文。靶向部分的实例还可包括对细胞成分具有特异性的其他蛋白质,包括与赘生物或肿瘤相关的抗原。用作靶向部分的蛋白质可经由共价键连接至
脂质体(参见,heath,covalent attachment of proteins to liposomes,149methods in enzymology 111-119(academic press,inc.1987))。其他靶向方法包括生物素-亲和素系统。
[0248]
在实施方案中,本发明组合物和方法采用复合培养基。在一个实施方案中,复合培养基的ph大于约7、或大于约7.2、或大于约7.4、或大于约7.6、或大于约7.8、或大于约8.0、或大于约8.2、或大于约8.4、或大于约8.6、或大于约8.8、或大于约9.0。在一个实施方案中,复合培养基包含转铁蛋白。在另一个实施方案中,复合培养基包含dmem。在又一个实施方案中,复合培养基包含dmem/f12。
[0249]
核酸
[0250]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂适合于与核酸,包括例如任何寡核苷酸或多核苷酸缔合。
[0251]
在实施方案中,核酸是rna、小干扰rna(sirna)、微小rna(mirna)、信使rna(mrna)、长链非编码rna(lncrna)、反义寡核苷酸、核酶、质粒、免疫刺激核酸、反义、微小rna拮抗剂(antagomir)、反义微小rna(antimer)、微小rna模拟物、超级微小rna(supermir)、u1衔接子或适体。
[0252]
在实施方案中,核酸完全包封在本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂内。在其他实施方案中,核酸部分包封在本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂内。在再其他实施方案中,核酸和本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂均存在且核酸未包封在本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂内。
[0253]
完全包封表明本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂中的核酸在暴露于血清或会显著降解游离核酸的核酸酶测定后不会显著降解。在完全包封的系统中,实施方案中小于约25%的颗粒核酸在正常会降解约100%游离核酸的处理中被降解。在实施方案中,小于约10%或小于约5%的颗粒核酸被降解。
[0254]
包封的程度可通过oligreen测定来确定。oligreen是用于定量溶液中的寡核苷酸和单链dna的超灵敏荧光核酸染色剂(购自invitrogen corporation,carlsbad,ca)。
[0255]
完全包封还表明本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂是血清稳定的,也就是说其在体内施用时不会迅速分解成其组成部分。
[0256]
在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂本发明的脂质载体根据靶标细胞类型以不同比率与核酸(例如dna或rna)复合,通常范围为约1:16至约25:1ng脂质:ng rna。说明性的脂质:rna比率为约1:1至约10:1,例如但不限于,约2.5:1或约5:1。
[0257]
额外的参数(诸如核酸浓度、缓冲液类型和浓度等)将对转染效率产生影响,并且可由本领域普通技术人员通过常规实验来改变。
[0258]
在实施方案中,核酸选自rna或dna。
[0259]
在实施方案中,dna是质粒、粘粒、噬菌体、重组病毒或其他载体。在实施方案中,载体(或质粒)是指用于例如将异源核酸引入细胞以用于其表达或复制的离散元件。载体可保
持游离或可设计成实现基因或其部分整合到基因组的染色体中。还涵盖人工染色体(诸如酵母人工染色体和哺乳动物人工染色体)的载体。此类媒介物的选择和使用是本领域技术人员众所周知的。包括能够表达与调控序列诸如启动子区域可操作地连接的dna的载体,所述调控序列能够实现此类dna片段(例如表达载体)的表达。因此,载体是指重组dna或rna构建体,诸如质粒、噬菌体、重组病毒或其他载体,其在引入合适的宿主细胞后引起dna的表达。适当的载体是本领域技术人员众所周知的并且包括可在真核细胞和/或原核细胞中复制的那些载体和保持游离的那些载体或整合到宿主细胞基因组中的那些载体。
[0260]
在实施方案中,rna是合成rna。在实施方案中,rna是化学合成的rna。在实施方案中,rna是体外转录的rna。
[0261]
在实施方案中,rna选自sirna、lncrna、反义寡核苷酸、微小rna、antagomir、适体、核酶和mrna。
[0262]
在实施方案中,合成rna(包括但不限于mrna)不包含非典型核苷酸。
[0263]
在实施方案中,合成rna(包括但不限于mrna)包含一种或多种非典型核苷酸。
[0264]
在实施方案中,一种或多种非典型核苷酸避免了实质性细胞毒性。在实施方案中,一种或多种非典型核苷酸基本上避免了体内细胞毒性。在实施方案中,一种或多种非典型核苷酸基本上避免了人受试者中的免疫反应。例如,免疫反应可以是由先天免疫系统介导的免疫反应。可使用本领域已知的标记物(例如细胞因子、干扰素、tlr)监测免疫反应。在实施方案中,有效剂量排除了用用于缓和残留毒性的免疫抑制剂(例如b18r)治疗人受试者的需要。
[0265]
在实施方案中,与由对应的未修饰核酸诱导的免疫反应相比,免疫反应降低约约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约99%、约99.9%或大于约99.9%。在实施方案中,与由对应的未修饰核酸诱导的一种或多种免疫反应标记物的上调相比,一种或多种免疫反应标记物的上调降低约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约99%、约99.9%或大于约99.9%。在实施方案中,免疫反应标记物包含干扰素基因的mrna或蛋白质产物,其包括干扰素α基因、ifnb1、tlr3、rarres3、eif2ak2、stat1、stat2、ifit1、ifit2、ifit3、ifit5、oas1、oas2、oas3、oasl、isg20或其片段、变体、类似物或家族成员。在实施方案中,免疫反应标记物包含tnf基因的mrna或蛋白质产物,其包括tnfα基因、tnfrsf1a;tnfrsf1b;ltbr;tnfrsf4;cd40;fas;tnfrsf6b;cd27;tnfrsf8;tnfrsf9;tnfrsf10a;tnfrsf10b;tnfrsf10c;tnfrsf10d;tnfrsf11a;tnfrsf11b;tnfrsf12a;tnfrsf13b;tnfrsf13c;tnfrsf14;ngfr;tnfrsf17;tnfrsf18;tnfrsf19;tnfrsf21;tnfrsf25;和eda2r或其片段、变体、类似物或家族成员。在实施方案中,免疫反应标记物包含白介素基因的mrna或蛋白质产物,其包括il-6基因、il-1;il-2;il-3;il-4;il-5;il-6;il-7;il-8或cxcl8;il-9;il-10;il-11;il-12;il-13;il-14;il-15;il-16;il-17;il-18;il-19;il-20;il-21;il-22;il-23;il-24;il-25;il-26;il-27;il-28;il-29;il-30;il-31;il-32;il-33;il-35;il-36或其片段、变体、类似物或家族成员。
[0266]
在实施方案中,细胞死亡比用对应的未修饰核酸观察到的细胞死亡少约10%、约25%、约50%、约75%、约85%、约90%、约95%或超过约95%。此外,细胞死亡可影响小于约50%、约40%、约30%、约20%、约10%、约5%、约1%、约0.1%、约0.01%或小于约0.01%与
修饰核酸接触的细胞。
[0267]
当掺入到rna分子中时,某些非典型核苷酸可通过干扰检测外源核酸的蛋白质(例如蛋白激酶r、rig-1和寡腺苷酸合成酶家族的蛋白质)的结合来部分降低rna分子的毒性,但不希望受理论的约束。已经报道的当掺入其中时降低rna分子的毒性的非典型核苷酸包括:假尿苷、5-甲基尿苷、2-硫代尿苷、5-甲基胞苷、n6-甲基腺苷以和它们的某些组合。然而,可以使它们能够实现降低合成rna分子的体内毒性的非典型核苷酸的化学特性直到此时仍未知。此外,掺入大量的大多数非典型的核苷酸(例如,5-甲基尿苷、2-硫代尿苷、5-甲基胞苷以及n6-甲基腺苷)可降低rna分子可以翻译成蛋白质的效率,在要求蛋白质表达的应用中限制含有这些核苷酸的rna分子的效用。另外,虽然在rna分子中假尿苷可完全取代尿苷而不会降低合成rna分子可以翻译成蛋白质的效率,但是在某些情况下,例如当进行频繁的重复转染时,仅含有腺苷、鸟苷、胞苷和假尿苷的合成rna分子可表现出过量的毒性。
[0268]
在实施方案中,非典型核苷酸在选自嘧啶的2c、4c和5c位置或选自嘌呤的6c、7n和8c位置的位置处具有一个或多个取代。
[0269]
在实施方案中,非典型核苷酸包含5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷中的一种或多种,任选地占非典型核苷酸的量的至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或100%。
[0270]
在实施方案中,至少约50%的胞苷残基是非典型核苷酸,并且所述非典型核苷酸选自5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷和5-甲氧基胞苷。
[0271]
在实施方案中,至少约75%或至少约90%的胞苷残基是非典型核苷酸,并且所述非典型核苷酸选自5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷和5-甲氧基胞苷。
[0272]
在实施方案中,至少约20%的尿苷,或至少约40%、或至少约50%、或至少约75%、或至少约90%的尿苷残基是非典型核苷酸,并且所述非典型核苷酸选自假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。
[0273]
在实施方案中,至少约40%、或至少约50%、或至少约75%、或至少约90%的尿苷残基是非典型核苷酸,并且所述非典型核苷酸选自假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。
[0274]
在实施方案中,至少约10%的鸟嘌呤残基是非典型核苷酸,并且非典型核苷酸任选地是7-脱氮鸟苷。
[0275]
在实施方案中,合成rna包含不超过约50%的7-脱氮鸟苷代替鸟苷残基。
[0276]
在实施方案中,合成rna不包含代替腺苷残基的非典型核苷酸。
[0277]
在实施方案中,含有在嘧啶的情况下在2c和/或4c和/或5c位置处或在嘌呤的情况下在6c和/或7n和/或8c位置处包括一个或多个取代的一个或多个非典型核苷酸的合成rna分子可以比仅含有典型核苷酸的合成rna分子毒性小,部分由于这些位置处的取代干扰由检测外源核酸的蛋白质识别合成rna分子的能力,并且此外,在这些位置处的取代可对合成
5-氮杂胞苷、2-硫代-n4-甲基-5-甲基假异胞苷、2-硫代-n4-甲基-5-氨基假异胞苷、2-硫代-n4-甲基-5-羟基假异胞苷、2-硫代-n4-氨基-5-氮杂胞苷、2-硫代-n4-氨基假异胞苷、2-硫代-n4-氨基-5-甲基胞苷、2-硫代-n4-氨基-5-氨基胞苷、2-硫代-n4-氨基-5-羟基胞苷、2-硫代-n4-氨基-5-甲基-5-氮杂胞苷、2-硫代-n4-氨基-5-氨基-5-氮杂胞苷、2-硫代-n4-氨基-5-羟基-5-氮杂胞苷、2-硫代-n4-氨基-5-甲基假异胞苷、2-硫代-n4-氨基-5-氨基假异胞苷、2-硫代-n4-氨基-5-羟基假异胞苷、2-硫代-n4-羟基-5-氮杂胞苷、2-硫代-n4-羟基假异胞苷、2-硫代-n4-羟基-5-甲基胞苷、n4-羟基-5-氨基胞苷、2-硫代-n4-羟基-5-羟基胞苷、2-硫代-n4-羟基-5-甲基-5-氮杂胞苷、2-硫代-n4-羟基-5-氨基-5-氮杂胞苷、2-硫代-n4-羟基-5-羟基-5-氮杂胞苷、2-硫代-n4-羟基-5-甲基假异胞苷、2-硫代-n4-羟基-5-氨基假异胞苷、2-硫代-n4-羟基-5-羟基假异胞苷、n6-甲基腺苷、n6-氨基腺苷、n6-羟基腺苷、7-脱氮腺苷、8-氮杂腺苷、n6-甲基-7-脱氮腺苷、n6-甲基-8-氮杂腺苷、7-脱氮-8-氮杂腺苷、n6-甲基-7-脱氮-8-氮杂腺苷、n6-氨基-7-脱氮腺苷、n6-氨基-8-氮杂腺苷、n6-氨基-7-脱氮-8-氮杂腺苷、n6-羟基腺苷、n6-羟基-7-脱氮腺苷、n6-羟基-8-氮杂腺苷、n6-羟基-7-脱氮-8-氮杂腺苷、6-硫代鸟苷、7-脱氮鸟苷、8-氮鸟苷、6-硫代-7-脱氮鸟苷、6-硫代-8-氮鸟苷、7-脱氮-8-氮鸟苷、6-硫代-7-脱氮-8-氮鸟苷和5-甲氧基尿苷。
[0280]
在实施方案中,本发明涉及一种或多种选自以下的非典型核苷酸:5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、5-羟基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、假尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。在实施方案中,至少50%、或至少55%、或至少60%、或至少65%、或至少70%、或至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或100%的非典型核苷酸是以下中的一种或多种:5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、假尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷、5-甲氧基假尿苷。
[0281]
在实施方案中,至少约50%、或至少约55%、或至少60%、或至少65%、或至少70%、或至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或100%的胞苷残基是选自以下的非典型核苷酸:5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷。
[0282]
在实施方案中,至少约20%、或约30%、或约40%、或约50%、或至少约55%、或至少60%、或至少65%、或至少70%、或至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或100%的尿苷残基是选自以下的非典型核苷酸:5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、假尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。
[0283]
在实施方案中,至少约10%(例如10%、或约20%、或约30%、或约40%、或约50%)的鸟苷残基是非典型核苷酸,并且所述非典型核苷酸任选地是7-脱氮鸟苷。在实施方案中,rna含有不超过约50%的7-脱氮鸟苷代替鸟苷残基。
[0284]
在实施方案中,rna不含有代替腺苷残基的非典型核苷酸。
[0285]
注意到,针对某些非典型核苷酸存在替代的命名方案。例如,在某些情况下,5-甲基假尿苷可称为“3-甲基假尿苷”或“n3-甲基假尿苷”或“1-甲基假尿苷”或“n1-甲基假尿
苷”。
[0286]
含有前缀“氨基”的核苷酸可指含有与核苷酸的指定位置上的原子结合的氮原子的任何核苷酸,例如5-氨基胞苷可指5-氨基胞苷、5-甲基氨基胞苷和5-硝基胞苷。类似地,含有前缀“甲基”的核苷酸可指含有与核苷酸的指定位置上的原子结合的碳原子的任何核苷酸,例如5-甲基胞苷可指5-甲基胞苷、5-乙基胞苷和5-羟甲基胞苷,含有前缀“硫代”的核苷酸可指含有与核苷酸的给定位置上的原子结合的硫原子的任何核苷酸,并且含有前缀“羟基”的核苷酸可指含有与核苷酸的给定位置上的原子结合的氧原子的任何核苷酸,例如5-羟基尿苷可指5-羟基尿苷和甲基与氧原子结合的尿苷,其中所述氧原子与尿苷的5c位置处的原子结合。
[0287]
因此,某些实施方案涉及包含一种或多种非典型核苷酸的rna,其中所述rna分子含有在嘧啶的情况下在2c和/或4c和/或5c位置处或在嘌呤的情况下在6c和/或7n和/或8c位置处包括一个或多个取代的一种或多种非典型核苷酸。
[0288]
在实施方案中,非典型核苷酸包括以下中的至少一种:假尿苷、2-硫代尿苷、4-硫代尿苷、5-氮杂尿苷、5-羟基尿苷、5-甲基尿苷、5-氨基尿苷、2-硫代假尿苷、4-硫代假尿苷、5-羟基假尿苷、5-甲基假尿苷、5-氨基假尿苷、假异胞苷、n4-甲基胞苷、2-硫代胞苷、5-氮杂胞苷、5-羟基胞苷、5-氨基胞苷、5-甲基胞苷、n4-甲基假异胞苷、2-硫代假异胞苷、5-羟基假异胞苷、5-氨基假异胞苷、5-甲基假异胞苷、7-脱氮腺苷、7-脱氮鸟苷、6-硫代鸟苷以及6-硫代-7-脱氮鸟苷。在另一个实施方案中,一种或多种核苷酸包括以下中的至少一种:假尿苷、2-硫代尿苷、4-硫代尿苷、5-氮杂尿苷、5-羟基尿苷、5-甲基尿苷、5-氨基尿苷、2-硫代假尿苷、4-硫代假尿苷、5-羟基假尿苷、5-甲基假尿苷和5-氨基假尿苷;以及以下中的至少一种:假异胞苷、n4-甲基胞苷、2-硫代胞苷、5-氮杂胞苷、5-羟基胞苷、5-氨基胞苷、5-甲基胞苷、n4-甲基假异胞苷、2-硫代假异胞苷、5-羟基假异胞苷、5-氨基假异胞苷和5-甲基假异胞苷。在再一实施方案中,一种或多种核苷酸包括以下中的至少一种:假尿苷、2-硫代尿苷、4-硫代尿苷、5-氮杂尿苷、5-羟基尿苷、5-甲基尿苷、5-氨基尿苷、2-硫代假尿苷、4-硫代假尿苷、5-羟基假尿苷和5-甲基假尿苷、5-氨基假尿苷以及以下中的至少一种:假异胞苷、n4-甲基胞苷、2-硫代胞苷、5-氮杂胞苷、5-羟基胞苷、5-氨基胞苷、5-甲基胞苷、n4-甲基假异胞苷、2-硫代假异胞苷、5-羟基假异胞苷、5-氨基假异胞苷和5-甲基假异胞苷以及以下中的至少一种:7-脱氮鸟苷、6-硫代鸟苷、6-硫代-7-脱氮鸟苷和5-甲氧基尿苷。在又一实施方案中,一种或多种核苷酸包括5-甲基胞苷和7-脱氮鸟苷。在另一个实施方案中,一种或多种核苷酸还包括假尿苷或4-硫代尿苷或5-甲基尿苷或5-氨基尿苷或4-硫代假尿苷或5-甲基假尿苷或5-氨基假尿苷。在再一实施方案中,一种或多种核苷酸还包括7-脱氮腺苷。在另一个实施方案中,一种或多种核苷酸包括假异胞苷和7-脱氮鸟苷以及4-硫代尿苷。在又一实施方案中,一种或多种核苷酸包括假异胞苷或7-脱氮鸟苷和假尿苷。在再一实施方案中,一种或多种核苷酸包括5-甲基尿苷和5-甲基胞苷以及7-脱氮鸟苷。在另一个实施方案中,一种或多种核苷酸包括假尿苷或5-甲基假尿苷和5-甲基胞苷以及7-脱氮鸟苷。在另一个实施方案中,一种或多种核苷酸包括假异胞苷和7-脱氮鸟苷以及假尿苷。在一个实施方案中,包含一种或多种非典型核苷酸的rna在体内存在。
[0289]
通过通常用于体外转录的rna聚合酶,某些非典型核苷酸可以比其他非典型核苷酸更有效地掺入到rna分子中,部分由于这些特定的非典型核苷酸参与标准碱基配对相互
作用和碱基堆积相互作用,并以类似于其中对应的典型核苷酸与rna聚合酶相互作用的方式与rna聚合酶相互作用的倾向。因此,含有一种或多种非典型核苷酸的某些核苷酸混合物可以是有益的,部分因为含有这些核苷酸混合物的体外转录反应可产生大量的rna。因此,某些实施方案涉及核苷酸混合物,其含有在嘧啶的情况下在2c和/或4c和/或5c位置处或在嘌呤的情况下在6c和/或7n和/或8c位置处包括一个或多个取代的一种或多种核苷酸。核苷酸混合物包括,但不限于(每种核苷酸前面的数字指明体外转录反应中的非典型核苷三磷酸的说明性部分,例如,0.2假异胞苷是指含有腺苷-5'-三磷酸、鸟苷-5'-三磷酸、尿苷-5'-三磷酸、胞苷-5'-三磷酸和假异胞苷-5'-三磷酸的反应,其中假异胞苷-5'-三磷酸以大约等于存在于反应中的假异胞苷-5'-三磷酸+胞苷-5'-三磷酸的总量的0.2倍的量存在于反应中,其中量是基于摩尔或质量而测量的,并且其中核苷酸前面的多于一个数字指明说明性部分的范围):1.0假尿苷、0.1-0.8 2-硫代尿苷、0.1-0.8 5-甲基尿苷、0.2-1.0 5-羟基尿苷、0.2-1.0 5-甲氧基尿苷、0.1-1.0 5-氨基尿苷、0.1-1.0 4-硫代尿苷、0.1-1.0 2-硫代假尿苷、0.1-1.0 4-硫代假尿苷、0.1-1.0 5-羟基假尿苷、0.2-1 5-甲基假尿苷、0.2-1.0 5-甲氧基假尿苷、0.1-1.0 5-氨基假尿苷、0.2-1.0 2-硫代胞苷、0.1-0.8假异胞苷、0.2-1.0 5-甲基胞苷、0.2-1.05-羟基胞苷、0.2-1.0 5-羟甲基胞苷、0.2-1.0 5-甲氧基胞苷、0.1-1.0 5-氨基胞苷、0.2-1.0n4-甲基胞苷、0.2-1.0 5-甲基假异胞苷、0.2-1.0 5-羟基假异胞苷、0.2-1.0 5-氨基假异胞苷、0.2-1.0n4-甲基假异胞苷、0.2-1.0 2-硫代假异胞苷、0.2-1.0 7-脱氮鸟苷、0.2-1.0 6-硫代鸟苷、0.2-1.0 6-硫代-7-脱氮鸟苷、0.2-1.0 8-氮杂鸟苷、0.2-1.0 7-脱氮-8-氮杂鸟苷、0.2-1.0 6-硫代-8-氮杂鸟苷、0.1-0.5 7-脱氮腺苷和0.1-0.5n6-甲基腺苷。
[0290]
在实施方案中,包含一种或多种非典型核苷酸组合物或合成多核苷酸组合物的rna(例如,其可通过体外转录制备)在遗传密码中的具有腺嘌呤或“a”的位置处基本上或完全含有典型核苷酸。在这种情形下,术语“基本上”是指至少90%。在这些实施方案中,rna组合物或合成多核苷酸组合物还可在遗传密码中的具有“g”的位置处含有(例如,由其组成)7-脱氮鸟苷以及对应的典型核苷酸“g”,并且在具有g的位置处的典型和非典型核苷酸可在5:1至1:5的范围内,或者在实施方案中在2:1至1:2的范围内。在这些实施方案中,rna组合物或合成多核苷酸组合物还可在遗传密码中的具有“c”的位置处含有(例如,由其组成)一种或多种(例如,两种、三种或四种)5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷以及典型核苷酸“c”,并且具有c的位置处的典型和非典型核苷酸可在5:1至1:5的范围内,或者在实施方案中在2:1至1:2的范围内。在实施方案中,“c”位置处的非典型核苷酸的水平如前一段所述。在这些实施方案中,rna组合物或合成多核苷酸组合物还可在遗传密码中的具有“u”的位置处含有(例如,由)一种或多种(例如,两种、三种或四种)5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、假尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷以及典型核苷酸“u”,并且具有“u”的位置处的典型和非典型核苷酸可在5:1至1:5的范围内,或者在一些实施方案中在2:1至1:2的范围内。在实施方案中,“u”位置处的非典型核苷酸的水平如前一段所述。
[0291]
结合某些非典型核苷酸可以是有益的,部分因为非典型核苷酸对降低rna分子毒性的贡献是加性的。因此,实施方案涉及核苷酸混合物,其中核苷酸混合物含有以上所列的
非典型核苷酸中的多于一种,例如核苷酸混合物含有假异胞苷和7-脱氮鸟苷,或者核苷酸混合物含有n4-甲基胞苷和7-脱氮鸟苷等。在一个实施方案中,核苷酸混合物含有以上所列的非典型核苷酸中的多于一种,并且每种非典型核苷酸以以上所列的部分存在于混合物中,例如核苷酸混合物含有0.1-0.8假异胞苷和0.2-1.0 7-脱氮鸟苷,或者核苷酸混合物含有0.2-1.0n4-甲基胞苷和0.2-1.0 7-脱氮鸟苷等。
[0292]
在某些情况下,例如当可以不需要或不期望使体外转录反应的产率最大化时,可使用核苷酸部分而不是以上给定的那些。以上列出的说明性部分和部分的范围涉及具有典型纯度(大于90%纯度)的核苷酸-三磷酸溶液。可以通过使用具有更大纯度的核苷酸-三磷酸溶液来使用这些和其他核苷酸的更大部分,所述更大纯度例如大于约95%纯度或大于约98%纯度或大于约99%纯度或大于约99.5%纯度,所述纯度可例如通过使用现有的化学纯化技术诸如高压液相色谱法(hplc)或通过其他方式纯化核苷三磷酸溶液来实现。在一个实施方案中,纯化具有多种异构体的核苷酸以富集所需的异构体。
[0293]
其他实施方案涉及用于通过使细胞与本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂以及rna分子接触来诱导体内细胞表达目标蛋白的方法,所述rna分子含有在嘧啶的情况下在2c和/或4c和/或5c位置处或在嘌呤的情况下在6c和/或7n和/或8c位置处包括一个或多个取代的一种或多种非典型核苷酸。还其他的实施方案涉及用于通过使细胞与本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂以及rna分子接触来转染、重编程和/或基因编辑体内细胞的方法,所述合成rna分子含有在嘧啶的情况下在2c和/或4c和/或5c位置处或在嘌呤的情况下在6c和/或7n和/或8c位置处包括一个或多个取代的一种或多种非典型核苷酸。在一个实施方案中,rna分子由体外转录产生。在一个实施方案中,rna分子编码一种或多种重编程因子。在另一个实施方案中,一种或多种重编程因子包括oct4蛋白。在另一个实施方案中,还使细胞与编码sox2蛋白的rna分子接触。在又一实施方案中,还使细胞与编码klf4蛋白的rna分子接触。在又一实施方案中,还使细胞与编码c-myc蛋白的rna分子接触。在又一实施方案中,还使细胞与编码lin28蛋白的rna分子接触。
[0294]
在含有典型核苷酸和非典型核苷酸的体外转录反应中,诸如t7rna聚合酶的酶可优选掺入典型核苷酸。因此,含有某一级分的非典型核苷酸的体外转录反应可产生含有与存在于反应中的非典型核苷酸的级分不同(通常更低)级分的非典型核苷酸的rna。在某些实施方案中,提到核苷酸掺入级分(例如,“含有50%假异胞苷的合成rna分子”或“0.1-0.8假异胞苷”)因此可指含有指定级分的核苷酸的rna分子和在含有指定级分的核苷酸(或核苷酸衍生物,例如核苷酸-三磷酸)的反应中合成的rna分子,即使此类反应可产生含有与存在于反应中的非典型核苷酸的级分不同的级分的核苷酸的rna。
[0295]
不同的核苷酸序列可通过使用替代的密码子来编码相同的蛋白质。在某些实施方案中,提到核苷酸掺入级分因此可指含有指定级分的核苷酸的rna分子和编码与不同rna分子相同的蛋白质的rna分子,其中不同rna分子含有指定级分的核苷酸。
[0296]
当掺入合成rna时,5-甲基胞苷去甲基化途径的非典型核苷酸成员可增加合成rna在体内可以翻译成蛋白质的效率,并可减少合成rna的体内毒性。这些非典型核苷酸包括例如:5-甲基胞苷、5-羟甲基胞苷、5-甲酰基胞苷和5-羧基胞苷(又名“胞苷-5-羧酸”)。因此某些实施方案涉及核酸。在实施方案中,核酸存在于体内。在一个实施方案中,核酸是合成rna
分子。在另一个实施方案中,核酸包含一个或多个非典型核苷酸。在一个实施方案中,核酸包含5-甲基胞苷去甲基化途径中的一个或多个非典型核苷酸成员。在另一个实施方案中,核酸包含5-甲基胞苷、5-羟甲基胞苷、5-甲酰基胞苷和5-羧基胞苷中的至少一种或其衍生物。在另一个实施方案中,核酸包含假尿苷、5-甲基假尿苷、5-羟基尿苷、5-甲基尿苷、5-甲基胞苷、5-羟甲基胞苷、n4-甲基胞苷、n4-乙酰基胞苷和7-脱氮鸟苷中的至少一种或其衍生物。
[0297]
5-甲基胞苷去甲基化途径
[0298][0299]
非典型核苷酸的某些组合可特别有效地增加合成rna可以在体内翻译成蛋白质的效率,并减少合成rna的体内的毒性,例如组合:5-甲基尿苷和5-甲基胞苷、5-羟基尿苷和5-甲基胞苷、5-羟基尿苷和5-羟甲基胞苷、5-甲基尿苷和7-脱氮鸟苷、5-甲基胞苷和7-脱氮鸟苷、5-甲基尿苷、5-甲基胞苷和7-脱氮鸟苷和5-甲基尿苷、5-羟甲基胞苷和7-脱氮鸟苷。某些实施方案因此涉及包含5-甲基尿苷、5-甲基胞苷、5-羟甲基胞苷和7-脱氮鸟苷中的至少两种或其一种或多种衍生物的核酸。其他实施方案涉及包含5-甲基尿苷、5-甲基胞苷、5-羟甲基胞苷和7-脱氮鸟苷中的至少三种或其一种或多种衍生物的核酸。其他实施方案涉及包含5-甲基尿苷、5-甲基胞苷、5-羟甲基胞苷和7-脱氮鸟苷全部或其一种或多种衍生物的核酸。在一个实施方案中,核酸包含一个或多个5-甲基尿苷残基、一个或多个5-甲基胞苷残基和一个或多个7-脱氮鸟苷残基或一个或多个5-甲基尿苷残基、一个或多个5-羟甲基胞苷残基和一个或多个7-脱氮鸟苷残基。
[0300]
含有某些非典型核苷酸的某些部分和它们的组合的合成rna分子在体内可表现出特别高的翻译效率和低毒性。某些实施方案因此涉及包含一个或多个尿苷残基、一个或多个胞苷残基和一个或多个鸟苷残基中的至少一者并且包含一个或多个非典型核苷酸的核酸。在一个实施方案中,约20%至约80%的尿苷残基是5-甲基尿苷残基。在另一个实施方案中,约30%至约50%的尿苷残基是5-甲基尿苷残基。
[0301]
在另一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基。在一个实施方案中,约60%至约80%的胞苷残基是5-甲基胞苷残基。在另一个实施方案中,约80%至约100%的胞苷残基是5-甲基胞苷残基。
[0302]
在另一个实施方案中,约100%的胞苷残基是5-甲基胞苷残基。在又一个实施方案
中,约20%至约100%的胞苷残基是5-羟甲基胞苷残基。在一个实施方案中,约20%至约80%的鸟苷残基是7-脱氮鸟苷残基。在另一个实施方案中,约40%至约60%的鸟苷残基是7-脱氮鸟苷残基。在另一个实施方案中,约50%的鸟苷残基是7-脱氮鸟苷残基。在一个实施方案中,约20%至约80%或约30%至约60%或约40%的胞苷残基是n4-甲基胞苷残基和/或n4-乙酰基胞苷残基。在另一个实施方案中,每个胞苷残基是5-甲基胞苷残基。在另一个实施方案中,约100%的胞苷残基是5-甲基胞苷残基和/或5-羟甲基胞苷残基和/或n4-甲基胞苷残基和/或n4-乙酰基胞苷残基和/或其一种或多种衍生物。在又一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基,约20%至约100%的胞苷残基是n4-甲基胞苷残基和/或n4-乙酰基胞苷残基,并且约50%的鸟苷残基是7-脱氮鸟苷残基。在一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基并且约100%的胞苷残基是5-甲基胞苷残基。在另一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基并且约50%的鸟苷残基是7-脱氮鸟苷残基。在另一个实施方案中,约100%的胞苷残基是5-甲基胞苷残基并且约50%的鸟苷残基是7-脱氮鸟苷残基。在另一个实施方案中,约100%的尿苷残基是5-羟基尿苷残基。在一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基,约100%的胞苷残基是5-甲基胞苷残基,并且约50%的鸟苷残基是7-脱氮鸟苷残基。在另一个实施方案中,约40%的尿苷残基是5-甲基尿苷残基,约20%至约100%的胞苷残基是5-羟甲基胞苷残基,并且约50%的鸟苷残基是7-脱氮鸟苷残基。在实施方案中,小于100%的胞苷残基是5-甲基胞苷残基。在其他实施方案中,小于100%的胞苷残基是5-羟甲基胞苷残基。在一个实施方案中,合成rna分子中的每个尿苷残基是假尿苷残基或5-甲基假尿苷残基。在另一个实施方案中,约100%的尿苷残基是假尿苷残基和/或5-甲基假尿苷残基。在另一个实施方案中,约100%的尿苷残基是假尿苷残基和/或5-甲基假尿苷残基,约100%的胞苷残基是5-甲基胞苷残基,并且约50%的鸟苷残基是7-脱氮鸟苷残基。
[0303]
可代替5-甲基尿苷或与5-甲基尿苷组合使用的其他非典型核苷酸包括但不限于假尿苷、5-羟基尿苷、5-羟基假尿苷、5-甲氧基尿苷、5-甲氧基假尿苷、5-羧基尿苷、5-羧基假尿苷、5-甲酰基尿苷、5-甲酰基假尿苷、5-羟甲基尿苷、5-羟甲基假尿苷和5-甲基假尿苷(“1-甲基假尿苷”、“n1-甲基假尿苷”)或其一种或多种衍生物。可代替或与5-甲基胞苷和/或5-羟甲基胞苷组合使用的其他非典型核苷酸包括但不限于假异胞苷、5-甲基假异胞苷、5-羟甲基胞苷、5-甲酰基胞苷、5-羧基胞苷、5-甲氧基胞苷、n4-甲基胞苷、n4-乙酰基胞苷或其一种或多种衍生物。在某些实施方案中,例如当仅进行单次转染、注射或递送时,或者当被转染、注射或递送的细胞、组织、器官或患者对转染相关毒性或先天免疫信号传导不是特别敏感时,可降低非典型核苷酸的级分。降低非典型核苷酸的级分可能是有益的,部分因为降低非典型核苷酸的级分可降低核酸的成本。在某些情况下,例如当需要核酸的最小免疫原性时,可增加非典型核苷酸的级分。
[0304]
在含有典型核苷酸和非典型核苷酸的体外转录反应中,诸如t7rna聚合酶的酶可优选掺入典型核苷酸。因此,含有某一级分的非典型核苷酸的体外转录反应可产生含有与存在于反应中的非典型核苷酸的级分不同(通常更低)级分的非典型核苷酸的rna。在某些实施方案中,提到核苷酸掺入级分(例如,“50%5-甲基尿苷”)因此可指含有指定级分的核苷酸的核酸和在含有指定级分的核苷酸(或核苷酸衍生物,例如核苷酸-三磷酸)的反应中合成的核酸,即使此类反应可产生含有与存在于反应中的非规范核苷酸的级分不同的级分
的核苷酸的核酸。另外,不同的核苷酸序列可通过使用替代的密码子来编码相同的蛋白质。在某些实施方案中,提到核苷酸掺入级分因此可指含有指定级分的核苷酸的核酸和编码与不同核酸相同的蛋白质的核酸,其中不同核酸含有指定级分的核苷酸。
[0305]
某些实施方案涉及包含选自cap 0、cap 1、cap 2和cap 3的5'-帽结构或其衍生物的核酸。在一个实施方案中,核酸包含一个或多个utr。在另一个实施方案中,一个或多个utr增加核酸的稳定性。在另一个实施方案中,一个或多个utr包含α-珠蛋白或β-珠蛋白5'-utr。在又一个实施方案中,一个或多个utr包含α-珠蛋白或β-珠蛋白3'-utr。在又一个实施方案中,合成rna分子包含α-珠蛋白或β-珠蛋白5'-utr和α-珠蛋白或β-珠蛋白3'-utr。某些实施方案涉及包含转录后调控元件的核酸。在一个实施方案中,转录后调控元件选自土拨鼠肝炎病毒(whp)转录后调控元件(wpre)、乙型肝炎病毒转录后调控元件(hpre)、鸡溶菌酶核基质结合区(cmar)和5'-dna酶i-超敏感位点4(chs4)。在另一个实施方案中,一个或多个utr包括wpre。在另一个实施方案中,合成rna分子包含α-珠蛋白或β-珠蛋白5'-utr和包含wpre的3'-utr。在又一个实施方案中,合成rna分子包含除了α-珠蛋白或β-珠蛋白5'-utr和α-珠蛋白或β-珠蛋白3'-utr之外的一个或多个wpre拷贝。本发明的说明性wpre元件是seq id no:813、seq id no:814、seq id no:815、seq id no:816、seq id no:817和seq id no:818。
[0306]
在一个实施方案中,5'-utr包含与kozak共有序列基本上类似的kozak序列。在另一个实施方案中,核酸包含3'-多聚(a)尾。在另一个实施方案中,3'-多聚(a)尾的长度在约20nt与约250nt之间或在约120nt与约150nt之间。在另一个实施方案中,3'-多聚(a)尾长约20nt、或约30nt、或约40nt、或约50nt、或约60nt、或约70nt、或约80nt,或约90nt、或约100nt、或约110nt、或约120nt、或约130nt、或约140nt、或约150nt、或约160nt、或约170nt、或约180nt、或约190nt、或约200nt、或约210nt、或约220nt、或约230nt、或约240nt、或约250nt。
[0307]
由多聚(a)聚合酶产生的多聚(a)尾的长度可根据反应条件(包括反应时间和酶活性)而变化,并且酶法加尾反应可产生具有不同长度的多聚(a)尾的rna分子的混合物。某些实施方案涉及含有约10个、约20个、约30个、约40个、约50个、约75个、约100个、约125个、约150个、约175个、约200个、约225个、约250个、约275个、约300个、约325个、约350个、或约400个、或超过约400个核苷酸的尾部的合成rna分子。在一个实施方案中,所述尾部是多聚(a)尾。其他实施方案涉及含有少于约10个核苷酸的尾部。
[0308]
使用编码尾部的模板来合成rna可增加对尾部长度的控制,并降低反应内或反应之间的变异性。某些实施方案因此涉及编码尾部的模板。在某些实施方案中,所述尾部含有约10、约20、约30、约40、约50、约75、约100、约125、约150、约175、约200、约225、约250、约275、约300、约325、约350或约400个核苷酸。其他实施方案涉及使用编码尾部的模板合成的合成rna分子。
[0309]
在尾部内包含除腺苷以外的核苷酸可增强合成rna分子稳定性和/或的翻译效率,并提高细菌中模板dna生产的保真性。一些实施方案因此涉及包含尾部的合成rna分子,其中所述尾部包含腺苷核苷酸和一个或多个其他核苷酸。其他实施方案涉及编码尾部的模板,其中所述尾部包含脱氧腺苷核苷酸和一个或多个其他核苷酸。在一个实施方案中,尾部包括鸟苷核苷酸。在另一个实施方案中,尾部包括胞嘧啶核苷酸。在另一个实施方案中,尾
部包括尿苷核苷酸。在又一个实施方案中,尾部包括一个或多个化学修饰的核苷酸和/或非典型核苷酸。在多个实施方案中,其他核苷酸以规率间隔、或随机间隔、或成对或成组的由一个或多个腺苷核苷酸隔开的相邻核苷酸掺入。在一个实施方案中,尾部包括脱氧鸟苷核苷酸。在另一个实施方案中,尾部包括脱氧胞嘧啶核苷酸。在另一个实施方案中,尾部包括脱氧尿苷核苷酸。在多个实施方案中,其他核苷酸以规率间隔、或随机间隔、或成对或成组的由一个或多个脱氧腺苷核苷酸隔开的相邻核苷酸掺入。在实施方案中,尾区由约2%-10%非尿苷核苷酸、约10%-20%非尿苷核苷酸、约20%-35%非尿苷核苷酸构成。
[0310]
在尾部之前或之后包含茎环结构可增强合成rna分子的稳定性和/或翻译效率。一些实施方案因此涉及包含尾部和茎环结构的合成rna分子。在多个实施方案中,茎环结构出现在尾部之前、尾部之后、或尾部之前或之后。在某些实施方案中,茎环结构是组蛋白3'utr茎环。在某些实施方案中,茎环结构的序列是a(g(y(y(y(uuyuna)r)r)r)c)a或m(g(g(c(y(c(uuuuma)g)r)g)c)c)a或a(g(g(y(y(y(uhhuha)r)r)r)c)c)a。
[0311]
本发明的一个方面是包含dna模板的组合物,所述模板包含:(a)编码蛋白质的序列,(b)包含脱氧腺苷核苷酸和一个或多个其他核苷酸的尾区,和(c)限制酶结合位点。
[0312]
在实施方案中,尾区的长度在约80个碱基对与约120个碱基对之间、约120个碱基对与约160个碱基对之间、约160个碱基对与约200个碱基对之间、约200个碱基对与约240个碱基对之间、约240个碱基对与约280个碱基对之间、或约280个碱基对与约320个碱基对之间。
[0313]
在实施方案中,尾区的长度大于320个碱基对。
[0314]
在实施方案中,尾区包含约1%、约2%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%的鸟苷残基。
[0315]
在实施方案中,尾区包含约1%、约2%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%的胞苷残基。
[0316]
在实施方案中,尾区包含约1%、约2%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%的尿苷残基。
[0317]
在前述实施例和方面中的任一个中,尾区包含约99%、约98%、约95%、约90%、约85%、约80%、约75%、约70%、约65%、约60%、约55%、或约50%的腺苷残基。
[0318]
在实施方案中,合成rna包含约200个核苷酸至约5000个核苷酸。
[0319]
在实施方案中,合成rna包含约500至约2000个核苷酸、或约500至约1500个核苷酸、或约500至约1000个核苷酸。
[0320]
目标蛋白
[0321]
在实施方案中,本文所述的化合物、药物组合物或脂质聚集体与核酸(例如dna或rna,例如mrna)复合或缔合,并且所述核酸编码目标重组蛋白。
[0322]
在实施方案中,目标重组蛋白是可溶性蛋白质。
[0323]
在实施方案中,目标蛋白选自表2b。
[0324]
在实施方案中,可溶性蛋白质是一种或多种重编程因子。在实施方案中,一种或多种重编程因子选自oct4、sox2、klf4、c-myc、l-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
id no:834)、gphd(seq id no:835)、ghgp(seq id no:836)、phgg(seq id no:837)、phgp(seq id no:838)、ahga(seq id no:839)、lhga(seq id no:840)、vhga(seq id no:841)、ivhg(seq id no:842)、ihgm(seq id no:843)、rdhg(seq id no:845)、rhge(seq id no:846)、hrge(seq id no:847)、rhgd(seq id no:848)、hrgd(seq id no:849)、gpye(seq id no:850)、nhgg(seq id no:851)、thgg(seq id no:852)、gthg(seq id no:853)、gsgs(seq id no:854)、gsgg(seq id no:855)、gggg(seq id no:856)、grgg(seq id no:857)和gkgg(seq id no:858)。
[0333]
在实施方案中,基因编辑蛋白包含有包含多个重复序列的dna结合结构域,并且重复序列中的至少一个包含氨基酸序列:ltpvqvvaiawxyzghgg(seq id no:629)并且长度在36与39个氨基酸之间,其中:“v”是q、d或e,“w”是s或n,“x”是h、n或i,“y”是d、a、i、n、g、h、k、s或空,并且“z”是ggkqaletvqrllpvlcqd(seq id no:630)或ggkqaletvqrllpvlcqa(seq id no:631)。
[0334]
在实施方案中,基因编辑蛋白还包含有包含核酸酶催化结构域的核酸酶结构域。
[0335]
在实施方案中,基因编辑蛋白能够在基因中产生单链或双链断裂。
[0336]
在实施方案中,单链或双链断裂引起持续改变的基因剪接。
[0337]
现已发现,在合成rna分子序列中掺入微小rna结合位点可使编码的蛋白质免疫耐受。某些实施方案因此涉及包含微小rna结合位点的合成rna分子。在一个实施方案中,微小rna结合位点是mir223微小rna结合位点。在另一个实施方案中,微小rna结合位点是mir142微小rna结合位点(mir-142具有seq id no:810的序列)。在一些实施方案中,微小rna结合位点存在于合成rna分子的3'-utr中。在其他实施方案中,合成rna分子的3'-utr包含多个微小rna结合位点。在其他实施方案中,合成rna分子的3'-utr包含多个mir142微小rna结合位点。在某些实施方案中,合成rna分子的3'-utr包含多个mir223微小rna结合位点。在一个实施方案中,mir142微小rna结合位点是tccataaagtaggaaacactaca(seq id no:811)。在另一个实施方案中,合成rna分子的3'-utr包含mir142微小rna结合位点(seq id no:812)的四个拷贝。在另一个实施方案中,微小rna结合位点被两个或更多个核苷酸隔开。在一个实施方案中,编码的蛋白质是基因编辑蛋白。在另一个实施方案中,编码的蛋白质优选在非造血细胞中表达。在某些实施方案中,使编码的蛋白质免疫耐受。在其他实施方案中,编码的蛋白质在受试者中不存在或以低于正常水平的水平存在。在其他实施方案中,编码的蛋白质是基因编辑蛋白质,并且将用于修复或插入基因的载体递送至细胞。在一些实施方案中,使基因产物免疫耐受。
[0338]
一些实施方案涉及免疫反应的激发和/或刺激和/或传播。在一些实施方案中,目标重组蛋白是抗原。在一些实施方案中,目标重组蛋白提供对一种或多种疾病,任选地感染性疾病的获得性免疫。在一些实施方案中,免疫系统对目标重组蛋白产生反应。在一些实施方案中,目标重组蛋白来源于病原体或毒素;在一些其他实施方案中,目标重组蛋白是病原体或毒素的合成模拟物。在一些实施方案中,目标重组蛋白是融合蛋白,其任选地独立地包含来源于或模拟病原体或毒素的序列,和/或已知刺激免疫反应的序列。在一些实施方案中,在施用编码目标抗原的合成rna之后,使受试者对某些病原体或毒素具有免疫性或抗性。
[0339]
在多个实施方案中,病原体是冠状病毒。冠状病毒(cov)是冠状病毒科的成员,其
包括β冠状病毒和α冠状病毒呼吸道病原体。
[0340]
在实施方案中,冠状病毒蛋白是β冠状病毒蛋白或α冠状病毒蛋白。在一些实施方案中,β冠状病毒蛋白选自sars-cov-2、sars-cov、mers-cov、hcov-hku1和hcov-oc43蛋白,或其抗原性片段。在一些实施方案中,α冠状病毒蛋白选自hcov-nl63和hcov-229e蛋白,或其抗原性片段。
[0341]
在一些实施方案中,冠状病毒是β冠状病毒或α冠状病毒。在一些实施方案中,β冠状病毒选自sars-cov-2、sars-cov、mers-cov、hcov-hku1和hcov-oc43。在实施方案中,α冠状病毒选自hcov-nl63和hcov-229e。在实施方案中,冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。
[0342]
在一些实施方案中,目标重组蛋白是冠状病毒蛋白。在多个实施方案中,冠状病毒蛋白是来自sars-cov-2的蛋白,诸如例如sars-cov-2刺突蛋白。在实施方案中,sars-cov-2蛋白选自刺突表面糖蛋白、膜糖蛋白m、包膜蛋白e和核衣壳磷蛋白n,或其抗原性片段。在实施方案中,选自刺突表面糖蛋白的sars-cov-2蛋白包括s1、s2和s2'。
[0343]
在一些实施方案中,sars-cov-2刺突蛋白包含以下氨基酸序列:
[0344]
mfvflvllplvssqcvnlttrtqlppaytnsftrgvyypdkvfrssvlhstqdlflpffsnvtwfhaihvsgtngtkrfdnpvlpfndgvyfasteksniirgwifgttldsktqsllivnnatnvvikvcefqfcndpflgvyyhknnkswmesefrvyssannctfeyvsqpflmdlegkqgnfknlrefvfknidgyfkiyskhtpinlvrdlpqgfsaleplvdlpiginitrfqtllalhrsyltpgdsssgwtagaaayyvgylqprtfllkynengtitdavdcaldplsetkctlksftvekgiyqtsnfrvqptesivrfpnitnlcpfgevfnatrfasvyawnrkrisncvadysvlynsasfstfkcygvsptklndlcftnvyadsfvirgdevrqiapgqtgkiadynyklpddftgcviawnsnnldskvggnynylyrlfrksnlkpferdisteiyqagstpcngvegfncyfplqsygfqptngvgyqpyrvvvlsfellhapatvcgpkkstnlvknkcvnfnfngltgtgvltesnkkflpfqqfgrdiadttdavrdpqtleilditpcsfggvsvitpgtntsnqvavlyqdvnctevpvaihadqltptwrvystgsnvfqtragcligaehvnnsyecdipigagicasyqtqtnsprrarsvasqsiiaytmslgaensvaysnnsiaiptnftisvtteilpvsmtktsvdctmyicgdstecsnlllqygsfctqlnraltgiaveqdkntqevfaqvkqiyktppikdfggfnfsqilpdpskpskrsfiedllfnkvtladagfikqygdclgdiaardlicaqkfngltvlpplltdemiaqytsallagtitsgwtfgagaalqipfamqmayrfngigvtqnvlyenqklianqfnsaigkiqdslsstasalgklqdvvnqnaqalntlvkqlssnfgaissvlndilsrldkveaevqidrlitgrlqslqtyvtqqliraaeirasanlaatkmsecvlgqskrvdfcgkgyhlmsfpqsaphgvvflhvtyvpaqeknfttapaichdgkahfpregvfvsngthwfvtqrnfyepqiittdntfvsgncdvvigivnntvydplqpeldsfkeeldkyfknhtspdvdlgdisginasvvniqkeidrlnevaknlneslidlqelgkyeqyikwpwyiwlgfiagliaivmvtimlccmtsccsclkgccscgscckfdeddsepvlkgvklhyt(seq id no:100)。
[0345]
在一些实施方案中,包膜蛋白包含以下氨基酸序列:
[0346]
mysfvseetgtlivnsvllflafvvfllvtlailtalrlcayc cnivnvslvkpsfyvysrvknlnssrvpdllv(seq id no:101)。
[0347]
在一些实施方案中,膜蛋白包含以下氨基酸序列:madsngtitveelkklleqwnlvigflfltwicllqfayanrnrflyiikliflwllwpvtlacfvlaavyrinwitggiaiamaclvglmwlsyfiasfrlfartrsmwsfnpetnillnvplhgtiltrplleselvigavilrghlriaghhlgrcdikdlpkeitvatsrtlsyyklgasqrvagdsgfaaysryrignyklntdhssssdniallvq(seq id no:102)。
[0348]
在一些实施方案中,核衣壳磷蛋白n包含以下氨基酸序列:
[0349]
msdngpqnqrnapritfggpsdstgsnqngersgarskqrrpqglpnntaswftaltqhgkedlkfprgqgvpintnsspddqigyyrratrrirggdgkmkdlsprwyfyylgtgpeaglpygankdgiiwvategalntpkdhigtrnpannaaivlqlpqgttlpkgfyaegsrggsqassrsssrsrnssrnstpgssrgtsparmagnggdaalalllldrlnqleskmsgkgqqqqgqtvtkksaaeaskkprqkrtatkaynvtqafgrrgpeqtqgnfgdqelirqgtdykhwpqiaqfapsasaffgmsrigmevtpsgtwltytgaiklddkdpnfkdqvillnkhidayktfpptepkkdkkkkadetqalpqrqkkqqtvtllpaadlddfskqlqqsmssadstqa(seq id no:103)。
[0350]
在实施方案中,刺突表面糖蛋白包含seq id no:100的氨基酸序列,膜糖蛋白前体m包含seq id no:101的氨基酸序列,包膜蛋白e包含seq id no:102的氨基酸序列,并且核衣壳磷蛋白n包含seq id no:103的氨基酸序列,或与前述任一项具有至少约90%、或至少约95%、或至少约97%、或至少约98%、或至少约99%同一性的氨基酸序列,或前述任一项的抗原性片段。
[0351]
在多个实施方案中,sars-cov-2蛋白可包含与sars-cov-2蛋白的任何已知野生型氨基酸序列或本文所公开的sars-cov-2氨基酸序列(例如相对于seq id no:100、101、102、103中的任一个)具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或在至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性的氨基酸序列(例如,约60%、或约61%、或约62%、或约63%、或约64%、或约65%、或约66%、或约67%、或约68%、或约69%、或约70%、或约71%、或约72%、或约73%、或约74%、或约75%、或约76%、或约77%、或约78%、或约79%、或约80%、或约81%、或约82%、或约83%、或约84%、或约85%、或约86%、或约87%、或约88%、或约89%、或约90%、或约91%、或约92%、或约93%、或约94%、或约95%、或约96%、或约97%、或约98%、或约99%的序列同一性),或其抗原性片段。
[0352]
在实施方案中,提供了编码冠状病毒蛋白或其抗原性片段的核酸。冠状病毒蛋白可以是冠状病毒蛋白中的任一种,其包括β冠状病毒蛋白或α冠状病毒蛋白。核酸包括但不限于rna,诸如但不限于mrna。在一些实施方案中,核酸包括但不限于dna。dna可与编码冠状病毒蛋白或其抗原性片段的aav相关联。
[0353]
在一些实施方案中,核酸包含载体,所述载体可包含任何类型的核苷酸,包括但不限于dna和rna,其可以是单链或双链的、合成的或部分从天然来源获得的,并且其在示例性方面含有天然、非天然或改变的核苷酸。
[0354]
在实施方案中,提供了针对一种或多种疾病、病原体或毒素的疫苗。在一些实施方案中,根据本公开的实施方案的疫苗产生保护性抗体滴度和/或对编码的抗原的t细胞反应。编码的抗原可以是例如感染剂抗原,例如sars-cov-2抗原。在一些实施方案中,根据本公开的实施方案的疫苗产生对编码的抗原具有特异性的抗原特异性抗体滴度(例如,igg、igm和/或iga),所述抗原可以是感染剂抗原,例如sars-cov-2抗原。
[0355]
现已发现,某些因子与蛋白质一起表达可使编码的蛋白质免疫耐受。在实施方案中,本发明涉及通过共同递送诱导耐受的因子来递送能够诱导对编码的蛋白质的免疫耐受的合成rna分子。在某些实施方案中,共同递送的因子由合成rna分子表达。在一些实施方案中,共同递送的因子是il2(seq id no:548)。在一些实施方案中,共同递送的因子是il10(seq id no:272或seq id no:273)(例如,但不限于il2、il10和/或tgf-β)。在一些实施方案中,共同递送的因子是tgfβ-1(seq id no:190)。在一些实施方案中,共同递送的因子是tgfβ-2(seq id no:191)。
[0356]
基因编辑
[0357]
在多个方面,本发明涉及一种或多种合成rna分子与本文所述的化合物(例如式i-xvi的化合物)的复合物转染细胞,其中一种或多种合成rna分子包括至少一种编码一种或多种基因编辑蛋白的rna分子,所述基因编辑蛋白选自核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、成簇规律间隔短回文重复序列(crispr)相关蛋白、crispr/cas9、cas9、xcas9、cas12a(cpf1)、cas13a、cas14、casx、casy、1类cas蛋白、2类cas蛋白和mad7,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。
[0358]
在多个方面,本发明涉及用于基因编辑细胞的方法,其包括用一种或多种合成rna分子与本文所述的化合物(例如式i-xvi的化合物)的复合物转染细胞,其中一种或多种合成rna分子包括至少一种编码一种或多种基因编辑蛋白的rna分子,所述基因编辑蛋白选自核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、成簇规律间隔短回文重复序列(crispr)相关蛋白、crispr/cas9、cas9、xcas9、cas12a(cpf1)、cas13a、cas14、casx、casy、1类cas蛋白、2类cas蛋白和mad7,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。
[0359]
若干天然存在的蛋白质含有dna结合结构域,所述dna结合结构域可识别特定dna序列,例如锌指(zf)和转录激活因子样效应子(tale)。含有这些dna结合结构域中的一个或多个和foki核酸内切酶裂解结构域的融合蛋白可以用于在细胞中dna的所需区域产生双链断裂(参见例如,美国专利申请公布号us 2012/0064620、美国专利申请公布号us 2011/0239315、美国专利号8,470,973、美国专利申请公布号us 2013/0217119、美国专利号8,420,782、美国专利申请公布号us 2011/0301073、美国专利申请公布号us 2011/0145940、美国专利号8,450,471、美国专利号8,440,431、美国专利号8,440,432和美国专利申请公布号2013/0122581,所述所有专利的内容在此以引用的方式并入)。其他基因编辑蛋白包括成簇规律间隔短回文重复序列(crispr)相关蛋白。然而,目前用于基因编辑细胞的方法效率低下,并且带有不受控制的诱变的风险,使其不适用于研究、治疗或美容用途。
[0360]
一些实施方案涉及采用本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的基因编辑和/或基因校正的方法。例如,在实施方案中,本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂与编码基因编辑蛋白的合成rna相关联,并且所得组合物用于例如离体或体内基因编辑和/或基因校正细胞。
[0361]
一些实施方案涵盖合成的基于rna的基因编辑和/或基因校正,例如用包含非典型核苷酸的rna,例如编码以下中的一种或多种的rna:核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、成簇规律间隔短回文重复序列(crispr)相关
蛋白、dna修复蛋白、dna修饰蛋白、碱基修饰蛋白、dna甲基转移酶、引起dna去甲基化的蛋白质、以dna为底物的酶,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。在实施方案中,基因编辑和/或基因校正的效率高,例如高于基于dna的基因编辑和/或基因校正。在实施方案中,本发明的基因编辑和/或基因校正方法对于体内应用足够有效。在实施方案中,本发明的基因编辑和/或基因校正方法足够有效以不需要细胞选择(例如选择已被编辑的细胞)。
[0362]
在实施方案中,本方法的基因编辑效率为约1%、或约2%、或约3%、或约4%、或约5%、或约6%、或约7%、或约8%、或约9%、或约10%、或约20%、或约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约100%。在多个实施方案中,本方法的基因校正效率为约1%、或约2%、或约3%、或约4%、或约5%、或约6%、或约7%、或约8%、或约9%、或约10%、或约20%、或约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约100%。
[0363]
一些实施方案涉及包含工程化核酸酶裂解或dna修饰结构域的高效基因编辑蛋白。其他实施方案涉及包含工程化核酸酶裂解或dna修饰结构域的高保真基因编辑蛋白。多个实施方案涉及包含工程化dna结合结构域的高效基因编辑蛋白。其他实施方案涉及包含工程化dna结合结构域的高保真基因编辑蛋白。其他实施方案涉及包含工程化重复序列的基因编辑蛋白。一些实施方案涉及包含一个或多个crispr相关家族成员的基因编辑蛋白。一些实施方案涉及用于通过用基因编辑蛋白转染细胞或诱导细胞表达基因编辑蛋白来改变细胞的dna序列的方法。其他实施方案涉及用于改变存在于体外培养物中的细胞的dna序列的方法。再其他实施方案涉及用于改变存在于体内的细胞的dna序列的方法。
[0364]
包含stsi核酸内切酶裂解结构域(seq id no:1)的基因编辑蛋白在体内表现出比先前公开的基因编辑蛋白明显更低的脱靶活性,同时在体内保持高水平的在靶活性。还发现了其他新型工程化蛋白,当它们用作基因编辑蛋白的核酸酶结构域(stsi-ha(seq id no:2)、stsi-ha2(seq id no:3)、stsi-uha(seq id no:4)、stsi-uha2(seq id no:5)、stsi-hf(seq id no:6)和stsi-uhf(seq id no:7))时,它们可表现出高体内在靶活性、低体内脱靶活性、小尺寸、溶解性和其他期望特性。stsi-ha、stsi-ha2(高活性)、stsi-uha和stsi-uha2(超高活性)在体内表现出比野生型stsi和野生型foki更高的在靶活性,部分由于n端区域内34和61位的特定氨基酸取代,而stsi-hf(高保真)和stsi-uhf(超高保真)在体内表现出比野生型stsi和野生型foki更低的脱靶活性,部分由于c端区域内141和152位的特定氨基酸取代。
[0365]
某些实施方案因此涉及蛋白质。在实施方案中,蛋白质存在于体内。在其他实施方案中,蛋白质包含核酸酶结构域。在一个实施方案中,核酸酶结构域包含foki核酸内切酶的裂解结构域(seq id no:53)、stsi核酸内切酶的裂解结构域(seq id no:1)、stsi-ha(seq id no:2)、stsi-ha2(seq id no:3)、stsi-uha(seq id no:4)、stsi-uha2(seq id no:5)、stsi-hf(seq id no:6)和stsi-uhf(seq id no:7)或其生物活性片段或变体中的一个或多个。
[0366]
包含有包含某些新型重复序列的dna结合结构域的工程化基因编辑蛋白在体内表现出比先前公开的基因编辑蛋白更低的脱靶活性,同时在体内保持高水平的在靶活性。这些工程化基因编辑蛋白中的某些可提供优于先前公开的基因编辑蛋白的若干优势,包括例
如连接重复序列的接头区域的灵活性增加,这可引起结合效率增加。某些实施方案因此涉及包含多个重复序列的蛋白质。在一个实施方案中,重复序列中的至少一个含有氨基酸序列:gabg,其中“a”和“b”各自代表任何氨基酸。在一个实施方案中,蛋白质是基因编辑蛋白。在另一个实施方案中,重复序列中的一个或多个存在于dna结合结构域中。在另一个实施方案中,“a”和“b”各自独立地选自以下的组:h和g。在又一个实施方案中,“a”和“b”分别是h和g。在一个实施方案中,氨基酸序列存在于重复序列的c端的约5个氨基酸内。在另一个实施方案中,氨基酸序列存在于重复序列的c端处。在实施方案中,氨基酸序列gabg中的一个或多个g被一个或多个除g之外的氨基酸(例如a、h或gg)替换。在一个实施方案中,重复序列的长度在约32与约40个氨基酸之间或在约33与约39个氨基酸之间或在约34与38个氨基酸之间或在约35与约37个氨基酸之间或为约36个氨基酸或大于约32个氨基酸或大于约33个氨基酸或大于约34个氨基酸或大于约35个氨基酸。其他实施方案涉及包含一个或多个转录激活因子样效应子结构域的蛋白质。在一个实施方案中,转录激活因子样效应子结构域中的至少一个包含重复序列。其他实施方案涉及一种蛋白质,其包含通过在转录激活因子样效应子结构域的重复序列中的至少两个之间插入一个或多个氨基酸而产生的多个重复序列。在一个实施方案中,一个或多个氨基酸从至少一个重复序列的c端插入约1个或约2个或约3个或约4个或约5个氨基酸。其他实施方案涉及包含多个重复序列的蛋白质,其中约每隔一个重复序列具有与紧接在所述重复序列之前或之后的重复序列不同的长度。在一个实施方案中,每隔一个重复序列的长度约为36个氨基酸。在另一个实施方案中,每隔一个重复序列的长度为36个氨基酸。其他实施方案涉及包含多个重复序列的蛋白质,其中多个重复序列包含至少两个重复序列,每个重复序列的长度至少为36个氨基酸,并且其中至少两个长度至少为36个氨基酸的重复序列被至少一个长度小于36个氨基酸的重复序列隔开。一些实施方案涉及包含一个或多个序列的蛋白质,所述序列选自例如seq id no:54、seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59和seq id no:60。
[0367]
其他实施方案涉及包含dna结合结构域的蛋白质。在实施方案中,dna结合结构域包含多个重复序列。在一个实施方案中,多个重复序列能够高特异性识别靶dna分子中的结合位点。在另一个实施方案中,至少两个重复序列彼此具有至少约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约98%、或约99%的同源性。在另一个实施方案中,重复序列中的至少一个包含一个或多个能够与靶dna分子中的结合位点结合的区域。在又一个实施方案中,结合位点包含长度在约1至约5个碱基之间的确定序列。在一个实施方案中,dna结合结构域包含锌指。在另一个实施方案中,dna结合结构域包含转录激活因子样效应子(tale)。在另一个实施方案中,多个重复序列包括至少一个与tale具有至少约50%或约60%或约70%或约80%或约90%或约95%或约98%或约99%同源性的重复序列。在又一个实施方案中,基因编辑蛋白包含成簇规律间隔短回文重复序列(crispr)相关蛋白。在一个实施方案中,基因编辑蛋白包含核定位序列。在另一个实施方案中,核定位序列包含氨基酸序列:pkkkrkv(seq id no:471)。在一个实施方案中,基因编辑蛋白包含线粒体定位序列。在另一个实施方案中,线粒体定位序列包含氨基酸序列:lgrviprkiasraslm(seq id no:472)。在一个实施方案中,基因编辑蛋白包含接头。在另一个实施方案中,接头将dna结合结构域连接到核酸酶结构域。在另一个实施方案中,接头的长度在约1与约10个氨基酸之间。在实施方案中,接头的长度为约1、约2、或约3、或约4、或约5、或约6、或约7、或约8、或约
9、或约10个氨基酸。在一个实施方案中,基因编辑蛋白能够在靶dna分子中产生切口或双链断裂。
[0368]
在实施方案中,基因编辑蛋白包含:(a)包含多个重复序列的dna结合结构域,并且重复序列中的至少一个包含氨基酸序列:ltpvqvvaiawxyzghgg(seq id no:629),其中“v”是q、d或e,“w”是s或n,“x”是h、n或i,“y”是d、a、i、n、g、h、k、s或空,并且“z”是ggkqaletvqrllpvlcqd(seq id no:630)或ggkqaletvqrllpvlcqa(seq id no:631);以及任选地,(b)包含核酸酶的催化结构域的核酸酶结构域。在实施方案中,核酸酶结构域能够与另一个核酸酶结构域形成二聚体。在实施方案中,核酸酶结构域包含有包含氨基酸序列seq id no:632的蛋白质的催化结构域。在实施方案中,包含氨基酸序列ltpvqvvaiawxyzghgg(seq id no:629)的重复序列中的至少一个的长度在36与39个氨基酸之间。
[0369]
某些实施方案涉及用于修饰体内细胞基因组的方法,所述方法包括将编码非天然存在的融合蛋白的核酸分子引入体内细胞中,所述融合蛋白包含有包含一个或多个长度为36个氨基酸的重复单元和核酸内切酶结构域的人工转录激活因子样(tal)效应子重复结构域,其中所述重复结构域被工程改造用于识别预定的核苷酸序列,并且其中融合蛋白识别预定的核苷酸序列。在一个实施方案中,细胞是真核细胞。在另一个实施方案中,细胞是动物细胞。在另一个实施方案中,细胞是哺乳动物细胞。在又一个实施方案中,细胞是人细胞。在一个实施方案中,细胞是植物细胞。在另一个实施方案中,细胞是原核细胞。在实施方案中,融合蛋白在细胞的核酸中引入核酸内切裂解,由此修饰细胞的基因组。
[0370]
某些实施方案涉及用于改变体内细胞的dna序列的包含核酸的组合物,其中所述核酸编码基因编辑蛋白。其他实施方案涉及用于改变体内细胞的dna序列的包含核酸混合物的组合物,其中所述核酸混合物包含:编码第一基因编辑蛋白的第一核酸,和编码第二基因编辑蛋白的第二核酸。在一个实施方案中,第一基因编辑蛋白的结合位点和第二基因编辑蛋白的结合位点存在于同一靶dna分子中。在另一个实施方案中,第一基因编辑蛋白的结合位点与第二基因编辑蛋白的结合位点相隔小于约50个碱基、或小于约40个碱基、或小于约30个碱基、或小于约20个碱基、或小于约10个碱基、或约10个碱基至约25个碱基或约15个碱基。在一个实施方案中,第一基因编辑蛋白的核酸酶结构域和第二基因编辑蛋白的核酸酶结构域能够形成二聚体。在另一个实施方案中,二聚体能够在靶dna分子中产生切口或双链断裂。
[0371]
某些实施方案涉及治疗组合物。其他实施方案涉及美容组合物。在实施方案中,组合物包含修复模板。在另一个实施方案中,修复模板是单链dna分子或双链dna分子。
[0372]
其他实施方案涉及用于合成蛋白质或编码蛋白质的核酸的制品。在一个实施方案中,制品是核酸。在另一个实施方案中,蛋白质包含dna结合结构域。在另一个实施方案中,核酸包含编码dna结合结构域的核苷酸序列。在一个实施方案中,蛋白质包含核酸酶结构域。在另一个实施方案中,核酸包含编码核酸酶结构域的核苷酸序列。在一个实施方案中,蛋白质包含多个重复序列。在另一个实施方案中,核酸编码多个重复序列。在另一个实施方案中,核酸酶结构域选自foki、stsi、stsi-ha、stsi-ha2、stsi-uha、stsi-uha2、stsi-hf和stsi-uhf或其天然或工程化变体或生物活性片段。在一个实施方案中,核酸包含rna聚合酶启动子。在另一个实施方案中,rna聚合酶启动子是t7启动子或sp6启动子。在另一个实施方案中,核酸包含病毒启动子。在一个实施方案中,核酸包含非翻译区。在另一个实施方案中,
核酸是体外转录模板。
[0373]
某些实施方案涉及用于诱导细胞在体内表达蛋白质的方法。其他实施方案涉及改变体内细胞的dna序列的方法,其包括用基因编辑蛋白转染体内细胞或诱导细胞在体内表达基因编辑蛋白。其他实施方案涉及用于降低体内细胞中目标蛋白的表达的方法。在一个实施方案中,细胞被诱导表达基因编辑蛋白,其中所述基因编辑蛋白能够在靶dna分子中产生切口或双链断裂。在另一个实施方案中,切口或双链断裂导致基因失活。其他实施方案涉及用于在体内产生无活性、活性降低或显性失活形式的蛋白质的方法。在一个实施方案中,蛋白质是存活蛋白。其他实施方案涉及用于修复体内细胞中的一个或多个突变的方法。在一个实施方案中,细胞与修复模板接触。在另一个实施方案中,修复模板是dna分子。在另一个实施方案中,修复模板不含有基因编辑蛋白的结合位点。在又一个实施方案中,修复模板编码由包含基因编辑蛋白结合位点的dna序列编码的氨基酸序列。
[0374]
在多个实施方案中,修复模板为约20个核苷酸、或约30个核苷酸、或约40个核苷酸、或约50个核苷酸、或约60个核苷酸、或约70个核苷酸、或约80个核苷酸、或约90个核苷酸、或约100个核苷酸、或约150个核苷酸、或约200个核苷酸、或约300个核苷酸、或约400个核苷酸、或约500个核苷酸、或约750个核苷酸、或约1000个核苷酸。在多个实施方案中,修复模板为约20-1000个核苷酸、或约20-500个核苷酸、或约20-400个核苷酸、或约20-200个核苷酸、或约20-100个核苷酸、或约80-100个核苷酸、或约50-100个核苷酸。
[0375]
在多个实施方案中,rna(例如编码基因编辑蛋白的合成rna)与修复模板的质量比为约1:10、或约1:9、或约1:8、或约1:7、或约1:6、或约1:5、或约1:4、或约1:3、或约1:2、或约1:1、或约2:1、或约3:1、或约4:1、或约5:1、或约6:1、或约7:1、或约8:1、或约9:1、或约10:1。
[0376]
在多个实施方案中,rna(例如编码基因编辑蛋白的合成rna)与修复模板的摩尔比为约1:10、或约1:9、或约1:8、或约1:7、或约1:6、或约1:5、或约1:4、或约1:3、或约1:2、或约1:1、或约2:1、或约3:1、或约4:1、或约5:1、或约6:1、或约7:1、或约8:1、或约9:1、或约10:1。
[0377]
在多个实施方案中,修复模板具有双重功能,引起对基因编辑的靶序列的修复以及阻止基因编辑蛋白的进一步结合,从而降低或消除进一步的基因编辑(例如经由修复模板引起修复,使基因编辑蛋白结合位点不再适合于基因编辑蛋白结合)。因此,在一些实施方案中,本发明基因编辑方法是可调的以确保每个靶位点的单一基因编辑。
[0378]
重编程
[0379]
在多个方面,本发明涉及用于将分化细胞重编程为分化程度较低状态的方法,其包括(a)提供分化细胞或非多能细胞;(b)培养分化细胞或非多能细胞;以及(c)用一种或多种合成rna分子和本文所述化合物(例如式i-xvi的化合物)的复合物转染分化细胞或非多能细胞,其中一种或多种合成rna分子包括至少一种编码一种或多种重编程因子的rna分子并且其中所述转染使得细胞表达一种或多种重编程因子,使得细胞被重编程为分化程度较低的状态。在实施方案中,步骤(c)在存在含有支持分化细胞重编程为分化程度较低的状态的成分的培养基的情况下进行。在实施方案中,还包括在连续5天内重复步骤(c)至少两次。在实施方案中,在一种或多种较晚转染中转染的一种或多种合成rna分子的量大于在一种或多种较早转染中转染的量。在实施方案中,步骤(a)-(c)不使用饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,步骤(c)不使用辐射的人新生儿成纤维细胞饲养细胞而在存在饲养细胞条件培养基的情况下进行。在实施方案中,合成rna分子编码一种
或多种选自以下的重编程因子:oct4、sox2、klf4、c-myc、l-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
[0380]
在实施方案中,分化的或非多能细胞来源于活检。在实施方案中,分化的或非多能细胞来自人受试者。在实施方案中,分化的或非多能细胞来源于皮肤打孔活检样品。在实施方案中,分化的或非多能细胞是角质形成细胞、成纤维细胞或pbmc。
[0381]
在实施方案中,用于重编程的方法还包括使细胞与以下组中的至少一个成员接触:多聚-l-赖氨酸、多聚-l-鸟氨酸、rgd肽、纤连蛋白、玻连蛋白、胶原蛋白和层粘连蛋白。
[0382]
在实施方案中,用于重编程的方法使用基本上不含免疫抑制剂的培养基。
[0383]
可通过将它们暴露于特定胞外信号(cue)和/或通过异位表达特定蛋白质、微小rna等来重编程细胞。虽然先前已描述了若干重编程方法,但是依靠异位表达的大多数方法需要引入外源dna,这会存在突变风险。已经报道了基于直接递送重编程蛋白的无dna重编程方法。然而,这些方法对于商业用途来说效率太低且不可靠。另外,已经描述了基于rna的重编程方法(参见例如,angel mit thesis.2008.1-56;angel等人plos one.2010.5,107;warren等人cell stem cell.2010.7,618-630;angel mit thesis.2011.1-89;和lee等人,cell.2012.151,547-558;所述所有文献的内容在此以引用的方式并入)。然而,现有的基于rna的重编程方法在成人细胞上进行时速度慢、不可靠且效率低下,需要多次转染(导致大量费用和出错机会),仅能重编程有限数量的细胞类型,仅能将细胞重编程为有限数量的细胞类型,需要使用免疫抑制剂,并需要使用多种人源性组分,其包括血液源性hsa和人成纤维细胞饲养层。先前公开的基于rna的重编程方法的许多缺点使其不适用于研究、治疗或美容用途。
[0384]
重编程可通过用一种或多种编码一种或多种重编程因子的核酸转染细胞来进行。重编程因子的实例包括但不限于oct4蛋白、sox2蛋白、klf4蛋白、c-myc蛋白、l-myc蛋白、tert蛋白、nanog蛋白、lin28蛋白、utf1蛋白、aicda蛋白、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。某些实施方案因此涉及用于重编程体内细胞的方法。在一个实施方案中,通过用编码一种或多种重编程因子的一种或多种核酸转染细胞来重编程体内细胞。在一个实施方案中,一种或多种核酸包括编码oct4蛋白的rna分子。在另一个实施方案中,一种或多种核酸还包括编码sox2蛋白、klf4蛋白和c-myc蛋白的一种或多种rna分子。在又一实施方案中,一种或多种核酸还包括编码lin28蛋白的rna分子。在一个实施方案中,细胞是人皮肤细胞,并且人皮肤细胞被重编程为多能干细胞。在另一个实施方案中,细胞是人皮肤细胞,并且人皮肤细胞被重编程为葡萄糖反应性胰岛素产生细胞。可被重编程的其他细胞和细胞可被重编程为其他细胞的其他细胞的实例包括但不限于皮肤细胞、多能干细胞、间质干细胞、β-细胞、视网膜色素上皮细胞、造血细胞、心脏细胞、气道上皮细胞、神经干细胞、神经元、神经胶质细胞、骨细胞、血细胞和牙髓干细胞。在一个实施方案中,细胞与支持重编程细胞的培养基接触。在一个实施方案中,培养基还支持细胞。
[0385]
重要的是,已经报道了用编码oct4、sox2、klf4和c-myc的病毒感染皮肤细胞、组合在支持心肌细胞生长的培养基中培养细胞可引起皮肤细胞重编程为心肌细胞,而不首先将皮肤细胞重编程为多能干细胞(参见efs等人,nat cell biol.2011;13:215-22,所述文献
的内容在此以引用的方式并入)。在某些情况下,直接重编程(重编程一种体细胞为另一种体细胞而不首先重编程体细胞为多能干细胞,又称为“转分化”)可以是可取的,部分因为培养多能干细胞会是耗时和昂贵的,在建立和表征稳定的多能干细胞系中所涉及的额外处理会存在增加的污染风险,并且与首先产生多能干细胞相关的培养中的额外时间会存在增加的基因组不稳定性和获得突变(包括点突变、拷贝数变异和核型异常)的风险。某些实施方案因此涉及用于重编辑体内体细胞的方法,其中细胞被重编程为体细胞,并且其中不产生表征的多能干细胞系。
[0386]
在某些情况下,根据本发明的方法重编程细胞可比根据其他方法需要更少的总转染。某些实施方案因此涉及用于重编程体内细胞的方法,其中在连续约20天期间进行约1次与约12次之间的转染,或在连续约15天期间进行约4次与约10次之间的转染,或在连续约10天期间进行约4次与约8次之间的转染。认识到当细胞与含有核酸分子的培养基接触时,所述细胞可能会同时或在不同时间接触到和/或内化多于一种核酸分子。即使当细胞仅与含有核酸的培养基接触一次时,细胞也可因此与核酸接触多于一次,例如重复接触。
[0387]
值得注意的是,核酸可含有一个或多个如本文所述的非典型的或“修饰的”残基。例如,本文所述的非典型核苷酸中的任一种均可用于本发明重编程方法。在一个实施方案中,假尿苷-5'-三磷酸可在体外转录反应中取代尿苷-5'-三磷酸以产生合成rna,其中合成rna的至多100%的尿苷残基可被假尿苷残基替换。即使当假尿苷和5-甲基胞苷分别完全取代尿苷和胞苷时,体外转录也能产生具有残留免疫原性的rna(参见例如,angel reprogramming human somatic cells to pluripotency using rna[doctoral thesis].cambridge,ma:mit;2011,所述文献的内容在此以引用的方式并入)。出于这个原因,当用rna转染细胞时,通常会在转染培养基中添加免疫抑制剂。在某些情况下,在转染培养基中添加免疫抑制剂可能不是可取的,部分因为最常见用于此目的的重组免疫抑制剂b18r会是昂贵的并且难以制造。可根据本发明的方法转染和/或重编程体内细胞,而不使用b18r或任何其他免疫抑制剂。根据本发明的方法重编程体内细胞而不使用免疫抑制剂可以是快速、有效和可靠的。因此,某些实施方案涉及用于转染体内细胞的方法,其中转染培养基不含有免疫抑制剂。其他实施方案涉及用于重编程体内细胞的方法,其中转染培养基不含有免疫抑制剂。在某些情况下,例如当使用高细胞密度时,向转染培养基中添加免疫抑制剂可以是有益的。因此,某些实施方案涉及用于转染体内细胞的方法,其中转染培养基含有免疫抑制剂。其他实施方案涉及用于重编程体内细胞的方法,其中转染培养基含有免疫抑制剂。在一个实施方案中,免疫抑制剂是b18r或其生物活性片段、类似物、变体或家族成员或地塞米松或其衍生物。在一个实施方案中,转染培养基不含有免疫抑制剂,并且选择核酸剂量以防止过量毒性。在另一个实施方案中,核酸剂量小于约1mg/cm2组织或小于约1mg/100,000细胞或小于约10mg/kg。
[0388]
根据本发明的某些实施方案产生的重编程细胞适用于治疗和/或美容应用,因为它们不含有不期望的外源dna序列,并且它们不暴露于动物源性或人源性产品,所述产品可以是未定义的,并且所述产品可含有毒性污染物和/或致病污染物。此外,本发明的某些实施方案的高速度、高效率和可靠性可降低获得和积累突变和其他染色体异常的风险。本发明的某些实施方案可因此用于产生具有适合在治疗和/或美容应用中使用的安全性特征的细胞。例如,使用rna和本发明的培养基重编程细胞,其中培养基不含有动物或人源性组分,
可产生未暴露于同种异体材料的细胞。某些实施方案因此涉及具有期望安全特性的重编程细胞。在一个实施方案中,重编程细胞具有正常核型。在另一个实施方案中,重编程细胞相对于患者基因组具有小于约5个拷贝数变异(cnv),诸如相对于患者基因组小于约3个拷贝数变异,或相对于患者基因组没有拷贝数变异。在又一实施方案中,重编程细胞相对于患者基因组在编码区具有正常核型和小于约100个单核苷酸变体,或相对于患者基因组在编码区中具有小于约50个单核苷酸变体,或相对于患者基因组在编码区中具有小于约10个单核苷酸变体。
[0389]
内毒素和核酸酶可共同纯化和/或变为与其他蛋白质(诸如血清白蛋白)缔合。具体地说,重组蛋白可通常具有高水平的缔合内毒素和核酸酶,部分由于在其产生过程中发生的细胞裂解。可通过本发明的许多方法降低、去除、替换或以其他方式灭活内毒素和核酸酶,所述方法包括例如通过乙酰化;通过添加稳定剂诸如辛酸钠,接着通过热处理;通过将核酸酶抑制剂添加至白蛋白溶液和/或培养基中;通过结晶;通过与一种或多种离子交换树脂接触;通过与木炭接触;通过制备型电泳或通过亲和色谱法。使内毒素和/或核酸酶从培养基和/或从培养基的一种或多种组分中部分或完全降低、去除、替换或以其他方式灭活可增加可以被转染和重编程的细胞的效率。某些实施方案因此涉及用于使用一种或多种核酸转染体内细胞的方法,其中处理转染培养基以部分或完全降低、去除、替换或以其他方式灭活一种或多种内毒素和/或核酸酶。其他实施方案涉及引起核酸最小程度降解的培养基。在一个实施方案中,培养基含有小于约1eu/ml、或小于约0.1eu/ml或小于约0.01eu/ml。
[0390]
在某些情况下,基于蛋白质的脂质载剂诸如血清白蛋白可被基于非蛋白质的脂质载剂诸如甲基-β-环糊精替换。本发明的培养基还可在没有脂质载剂的情况下使用,例如当使用可以不需要或可以不受益于脂质载剂的存在的方法,例如使用一种或多种基于脂质的转染试剂、基于聚合物的转染试剂或基于肽的转染试剂或使用电穿孔进行转染时。许多蛋白质缔合分子(诸如金属)可以是对体内细胞高毒性的。这种毒性会导致活力下降以及获得突变。某些实施方案因此具有产生不含毒性分子的细胞的额外益处。
[0391]
可以通过将蛋白质悬浮在溶液中并测量溶液的电导率来测量蛋白质的缔合分子组分。某些实施方案因此涉及含有蛋白质的培养基,其中约10%的蛋白质水溶液的电导率小于约500μmho/cm。在一个实施方案中,溶液的电导率小于约50μmho/cm。在另一个实施方案中,小于约0.65%的蛋白质干重包含脂质且/或小于约0.35%的蛋白质干重包含游离脂肪酸。
[0392]
可增加递送至体内细胞的核酸的量以增加核酸的所需作用。然而,增加递送至体内细胞的核酸的量超过某一点会导致细胞的存活力降低,部分由于转染试剂的毒性。当将核酸递送至处于固定体积的体内细胞群(例如,组织区域中的细胞)时,递送至每个细胞的核酸量可取决于递送至所述细胞群的核酸的总量和细胞的密度,其中更高的细胞密度导致递送至每个细胞的核酸更少。在某些实施方案中,用一种或多种核酸转染体内细胞多于一次。在某些条件下,例如当细胞正在增殖时,细胞密度可能在一次转染至下一次转染之间变化。某些实施方案因此涉及用于用核酸转染体内细胞的方法,其中转染细胞多于一次,并且其中对于两次转染而言递送至细胞的核酸的量不同。在一个实施方案中,细胞在两次转染之间增殖,并且对于两次转染中的第二次而言递送至细胞的核酸的量比对于两次转染中的第一次而言更大。在另一个实施方案中,转染细胞超过两次,并且对于三次转染中的第二次
而言递送至细胞的核酸的量比对于相同的三次转染中的第一次而言更大,并且对于相同的三次转染中的第三次而言递送至细胞的核酸的量比对于相同的三次转染中的第二次而言更大。在又一实施方案中,转染细胞多于一次,并且对于至少两次连续的转染而言,在每次转染过程中递送至细胞的核酸的最大量足够低以产生至少约80%活力。
[0393]
调节一系列转染中的递送至体内增殖细胞群的核酸的量可引起核酸的作用增加和细胞的活力增加。在某些情况下,当在一系列转染中使体内细胞与编码一种或多种重编程因子的一种或多种核酸接触时,对于一系列转染的至少部分而言当在后面的转染中递送的核酸的量大于在前面的转染中递送的核酸的量时,重编程的效率可以有所增加。某些实施方案因此涉及用于重编程体内细胞的方法,其中在一系列转染中将一种或多种核酸重复地递送至细胞,并且对于至少一次后面的转染而言递送至细胞的核酸的量比对于至少一次前面的转染而言更大。在一个实施方案中,转染细胞约2次与约10次之间、或约3次与约8次之间、或约4次与约6次之间。在另一个实施方案中,一种或多种核酸包括至少一个rna分子,转染细胞约2次与约10次之间,并且在每次转染中递送至细胞的核酸的量与先前最近转染中递送至细胞的核酸的量相同或比其更大。在又一实施方案中,在第一次转染中递送至细胞的核酸的量介于约20ng/cm2与约250ng/cm2、或100ng/cm2与600ng/cm2。在又一实施方案中,在约12小时与约48小时之间的间隔下转染细胞约5次,并且对于第一次转染而言递送至细胞的核酸的量为约25ng/cm2,对于第二次转染而言约50ng/cm2,对于第三次转染而言约100ng/cm2,对于第四次转染而言约200ng/cm2,并且对于第五次转染而言约400ng/cm2。在又一实施方案中,在第五次转染之后进一步转染细胞至少一次,并且递送至细胞的核酸量为约400ng/cm2。
[0394]
某些实施方案涉及用于用核酸转染体内细胞的方法,其中通过测量细胞密度并基于细胞密度的测量值选择核酸的量来转染而确定核酸的量。在一个实施方案中,细胞密度通过光学方式测量。在另一个实施方案中,重复地转染细胞,细胞密度在两次转染之间有所增加,并且对于两次转染中的第二次而言转染的核酸的量比对于两次转染中的第一次而言更大。
[0395]
通过在多个施用部位向患者施用核酸,可增加患者中产生的循环蛋白的量。在某些实施方案中,相对于通过在单一注射部位向患者施用核酸而在患者中产生的循环蛋白的量,循环蛋白的量增加。在一个实施方案中,施用是通过注射进行的。在另一个实施方案中,注射是皮内注射。在再一实施方案中,注射是皮下或肌肉内注射。在实施方案中,多个施用部位包括皮肤中的施用部位。在其他实施方案中,多个施用部位是至少约1个或至少约2个或至少约5个或至少约10个或至少约20个或至少约50个或至少约100个施用部位。在一个实施方案中,施用在至少约5分钟或至少约10分钟或至少约30分钟或至少约1小时或至少约2小时或至少约5小时或至少约12小时或至少约1天内进行。在某些实施方案中,循环蛋白的量增加至少约10%或至少约20%或至少约50%或至少约100%或至少约3倍或至少约5倍或至少约10倍或至少约20倍或至少约50倍或至少约100倍或至少约500倍或至少约1000倍或大于1000倍。
[0396]
在某些情况下,与本发明的培养基接触的细胞的体内转染效率和活力可通过调节培养基来提高。某些实施方案因此涉及用于调节培养基的方法。其他实施方案涉及被调节的培养基。在一个实施方案中,饲养层是成纤维细胞,并且培养基被调节大约24小时。其他
实施方案涉及用于转染体内细胞的方法,其中转染培养基被调节。其他实施方案涉及用于重编程和/或基因编辑体内细胞的方法,其中培养基被调节。在一个实施方案中,有丝分裂灭活饲养层,例如通过暴露于诸如丝裂霉素-c的化学品或通过暴露于γ辐射。在某些实施方案中,仅使用自体材料以部分地(例如并且不希望受理论约束)避免从饲养层至细胞或患者的疾病传播的风险可以是有益的。某些实施方案因此涉及用于转染体内细胞的方法,其中转染培养基被调节,并且其中饲养层来源于与被转染的细胞相同的个体。其他实施方案涉及用于重编程和/或基因编辑体内细胞的方法,其中培养基被调节,并且其中饲养层来源于与被重编程和/或基因编辑的细胞相同的个体。
[0397]
可通过调节将若干分子添加至培养基中。某些实施方案因此涉及补充有存在于条件培养基中的一种或多种分子的培养基。在一个实施方案中,培养基补充有wnt1、wnt2、wnt3、wnt3a或其生物活性片段、类似物、变体、激动剂或家族成员。在另一个实施方案中,培养基补充有tgf-β或其生物活性片段、类似物、变体、激动剂或家族成员。在又一实施方案中,根据本发明的方法重编程体内细胞,其中培养基没有在约1天与约5天之间补充tgf-β,并且然后补充tgf-β持续至少约2天。在又一实施方案中,培养基补充有il-6、il-6r或其生物活性片段、类似物、变体、激动剂或家族成员。在又一实施方案中,培养基补充有鞘脂或脂肪酸。在再一实施方案中,鞘脂是溶血磷脂酸、溶血神经鞘氨酯(lysosphingomyelin)、鞘氨醇-1磷酸酯或其生物活性类似物、变体或衍生物。
[0398]
除了有丝分裂灭活细胞之外,在某些条件下,辐射可改变细胞的基因表达,引起细胞产生比非辐射细胞更少的某些蛋白质和更多的某些其他蛋白质,例如wnt蛋白质家族的成员。另外,wnt蛋白质家族的某些成员可促进细胞的生长和转化。在某些情况下,通过使体内的细胞与使用辐射饲养层而不是丝裂霉素-c处理的饲养层进行调节的培养基接触,可大大增加重编程的效率。当使用辐射的饲养层时观察到的重编程效率的增加部分地由饲养层分泌的wnt蛋白引起。某些实施方案因此涉及用于重编程体内细胞的方法,其中使细胞与wnt1、wnt2、wnt3、wnt3a或其生物活性片段、类似物、变体、家族成员或激动剂(包括wnt蛋白的下游靶标的激动剂和/或模拟wnt蛋白的一种或多种生物作用的剂(例如2-氨基-4-[3,4-(亚甲基二氧基)苄基氨基]-6-(3-甲氧基苯基)嘧啶))接触。
[0399]
由于许多基于dna的重编程方法效率低下,这些方法可能难以或不可能与来源于患者样品的细胞一起使用,所述患者样品可能仅含有少量的细胞。相比之下,本发明某些实施方案的高效率可允许对少量细胞(包括单细胞)进行可靠的重编程。某些实施方案涉及用于重编程少量细胞的方法。其他实施方案涉及用于重编程单细胞的方法。在一个实施方案中,使细胞与一种或多种酶接触。在另一个实施方案中,酶是胶原酶。在又一实施方案中,胶原酶不含动物组分。在一个实施方案中,胶原酶以介于约0.1mg/ml与约10mg/ml、或约0.5mg/ml与约5mg/ml之间的浓度存在。在另一个实施方案中,细胞是血细胞。在又一实施方案中,使细胞与含有一种或多种来源于患者血液的蛋白质的培养基接触。在再一实施方案中,使细胞与包含以下物质的培养基接触:dmem/f12+2mm l-丙氨酰基-l-谷氨酰胺+约5%与约25%之间的患者源性血清或约10%与约20%之间的患者源性血清或约20%患者源性血清。
[0400]
在某些情况下,使用本发明的培养基用编码oct4、sox2、klf4和c-myc的rna的混合物转染体内细胞可引起细胞增殖速率增加。当递送至细胞的rna的量太低而不能确保所有
细胞被转染时,仅一部分细胞可显示出增加的增殖速率。在某些情况下,诸如当产生个性化治疗剂时,增加细胞的增殖速率可以是可取的,部分因为这样做可降低产生治疗剂所需要的时间,并且因此可以减少治疗剂的成本。某些实施方案因此涉及用于用编码oct4、sox2、klf4和c-myc的rna混合物转染体内细胞的方法。在一个实施方案中,细胞表现出增加的增殖速率。在另一个实施方案中,细胞被重编程。
[0401]
还提供了用于同时或依序基因编辑和重编程如本文所述的体细胞的方法。
[0402]
治疗方法
[0403]
在实施方案中,本发明涉及通过递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的治疗剂来治疗疾病或病症的方法。
[0404]
在实施方案中,本发明涉及通过递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的核酸治疗剂来治疗疾病或病症的方法。
[0405]
在实施方案中,本发明涉及通过递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的rna(例如合成rna)治疗剂来治疗疾病或病症的方法。
[0406]
在实施方案中,本发明涉及通过以表达具有治疗效果的目标蛋白的方法递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的治疗剂(例如核酸,例如rna(例如合成rna)治疗剂)来治疗疾病或病症的方法。
[0407]
在实施方案中,本发明涉及通过以表达具有治疗效果的基因编辑蛋白(例如基因编辑或基因校正,例如体内和/或离体)的方法递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的治疗剂(例如核酸,例如rna(例如合成rna)治疗剂)来治疗疾病或病症的方法。
[0408]
在实施方案中,本发明涉及通过以表达具有治疗效果的重编程因子(例如离体)的方法递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的治疗剂(例如核酸,例如rna(例如合成rna)治疗剂)来治疗疾病或病症的方法。
[0409]
在实施方案中,本发明涉及通过以表达具有治疗效果的基因编辑蛋白(例如基因编辑或基因校正,例如体内和/或离体)和表达具有治疗效果的重编程因子(例如离体)的方法递送具有本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的治疗剂(例如核酸,例如rna(例如合成rna)治疗剂)来治疗疾病或病症的方法。
[0410]
某些实施方案涉及用于治疗患者的方法,其包括:a.通过用编码目标蛋白的核酸转染体内细胞来诱导细胞表达目标蛋白和/或b.重编程体内细胞。在一个实施方案中,细胞被重编程为分化程度较低的状态。在另一个实施方案中,通过用编码一种或多种重编程蛋白的一种或多种合成rna分子转染细胞来重编程细胞。在另一个实施方案中,细胞是分化的。在又一个实施方案中,细胞分化为皮肤细胞、葡萄糖反应性胰岛素产生细胞、造血细胞、心脏细胞、视网膜细胞、肾细胞、神经细胞、基质细胞、脂肪细胞、骨细胞、肌肉细胞、卵母细胞和精子细胞。其他实施方案涉及用于治疗患者的方法,其包括:a.通过用编码基因编辑蛋白的核酸转染体内细胞来诱导细胞表达基因编辑蛋白和/或b.重编程体内细胞。
[0411]
在实施方案中,治疗引起患者的一种或多种症状得到改善。
[0412]
某些实施方案涉及用于治疗罕见疾病的方法和组合物。在实施方案中,罕见疾病是以下疾病中的一种或多种:罕见代谢疾病、罕见心血管疾病、罕见皮肤病、罕见神经系统疾病、罕见发育疾病、罕见遗传疾病、罕见肺部疾病、罕见肝脏疾病中、罕见肾脏疾病、罕见精神疾病、罕见生殖系统疾病、罕见肌肉骨骼疾病、罕见骨科疾病、先天性代谢异常、溶酶体贮积病和罕见眼科疾病。
[0413]
可用本发明治疗的疾病的实例包括但不限于阿尔茨海默氏病(alzheimer’s disease)、脊髓损伤、肌萎缩性侧索硬化症、囊性纤维化、心脏病,包括缺血性和扩张性心肌病、黄斑变性、帕金森氏病(parkinson’s disease)、亨廷顿氏病(huntington’s disease)、糖尿病、镰状细胞贫血、地中海贫血、范科尼贫血(fanconi anemia)、色素性皮肤干燥症、肌营养不良、严重联合免疫缺陷、遗传性感觉神经病、癌症以及hiv/aids。
[0414]
可用本发明治疗的疾病的其他实例包括但不限于1型糖尿病、心脏病,包括缺血性和扩张型心肌病、黄斑变性、帕金森氏病、囊性纤维化、镰状细胞贫血、地中海贫血、范科尼贫血、严重联合免疫缺陷、遗传性感觉神经病、色素性皮肤干燥症、亨廷顿氏病、肌营养不良、肌萎缩性侧索硬化症、阿尔茨海默氏病、癌症以及传染病,包括肝炎和hiv/aids。
[0415]
在实施方案中,可用本发明治疗的疾病的实例包括传染病。在一些实施方案中,传染病是病原体感染,所述病原体任选地选自细菌、病毒、真菌或寄生虫。在一些实施方案中,病毒是:(a)流感病毒,任选地选自a型、b型、c型和d型流感病毒,或(b)冠状病毒科的成员,任选地选自β冠状病毒,任选地选自严重急性呼吸综合征冠状病毒2(sars-cov-2)、sars-cov、中东呼吸综合征冠状病毒(mers-cov)、hcov-hku1和hcov-oc43或α冠状病毒,任选地选自hcov-nl63和hcov-229e。在一些实施方案中,病毒是sars-cov-2。在一些实施方案中,如本文其他各处所述,目标蛋白是诸如2019-ncov蛋白的抗原、其抗原性片段或编码其的核酸,所述目标蛋白任选地选自刺突表面糖蛋白、膜糖蛋白m、包膜蛋白e和核衣壳磷蛋白n。在一些实施方案中,如本文其他各处所述,目标蛋白是诸如刺突表面糖蛋白的s1或s2亚基的抗原,或其抗原性片段。
[0416]
在多个实施方案中,受试者罹患冠状病毒病2019(covid-19)。在另外的实施方案中,受试者是老年人且/或罹患一种或多种合并症,其包括但不限于高血压和/或糖尿病。罹患冠状病毒感染的受试者会出现症状,其包括但不限于发烧、疲倦、干咳、疼痛、气短和其他呼吸困难、腹泻、上呼吸道症状(例如打喷嚏、流鼻涕、鼻塞、咳嗽、喉咙痛)、肺炎、肺炎呼吸衰竭、肝肾功能不全、急性呼吸窘迫综合征(ards)和细胞因子失衡。
[0417]
在一些实施方案中,病毒是流感病毒。在一些实施方案中,如本文其他各处所述,目标蛋白是诸如流感病毒抗原的抗原,任选地选自血凝素(ha)蛋白、基质2(m2)蛋白和神经氨酸酶、或其抗原性片段、或编码它们的核酸。
[0418]
在实施方案中,疾病或病症选自白喉、破伤风、百日咳、流感、肺炎、甲型肝炎、乙型肝炎、脊髓灰质炎、黄热病、人乳头瘤病毒(human papillomavirus)(hpv)感染、炭疽、狂犬病、日本脑炎(japanese encephalitis)、脑膜炎、麻疹、腮腺炎、风疹、胃肠炎、天花、伤寒、水痘(varicella)(水痘(chickenpox))、轮状病毒和带状疱疹。在一些实施方案中,本发明涉及肝炎的治疗。可治疗的说明性肝炎包括但不限于甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、自身免疫性肝炎、酒精性肝炎、急性肝炎和慢性肝炎。
[0419]
在实施方案中,疾病或病症是代谢病症。在实施方案中,代谢病症选自碳水化合物代谢病症、氨基酸代谢病症、尿素循环病症、脂肪酸代谢病症、卟啉代谢病症、溶酶体贮积病症、过氧化物酶体生物发生病症以及嘌呤或嘧啶代谢病症。
[0420]
在实施方案中,代谢病症是碳水化合物代谢病症并且其中疾病是半乳糖血症并且缺陷基因任选地是galt、galk1或gale;其中疾病是原发性果糖尿症并且缺陷基因任选地是khk;其中疾病是遗传性果糖不耐症并且缺陷基因任选地是aldob;其中疾病是糖原累积病i型并且缺陷基因任选地是g6pc、slc37a4或slc17a3;其中疾病是糖原累积病ii型并且缺陷基因任选地是gaa;其中疾病是糖原累积病iii型并且缺陷基因任选地是agl;其中疾病是糖原累积病iv型并且缺陷基因任选地是gbe1;其中疾病是糖原累积病v型并且缺陷基因任选地是pygm;其中疾病是糖原累积病vi型并且缺陷基因任选地是pygl;其中疾病是糖原累积病vii型并且缺陷基因任选地是pygm;其中疾病是糖原累积病ix型并且缺陷基因任选地是phka1、phka2、phkb、phkg1或phkg2;其中所述疾病是糖原累积病xi型并且缺陷基因任选地是slc2a2;其中疾病是糖原累积病xii型并且缺陷基因任选地是aldoa;其中疾病是糖原累积病xiii型并且缺陷基因任选地是eno1、eno2或eno3;其中疾病是糖原累积病0型并且缺陷基因任选地是gys1或gys2;其中疾病是丙酮酸羧化酶缺乏症并且缺陷基因任选地是pc;其中疾病是丙酮酸激酶缺乏症并且缺陷基因任选地是pklr;其中所述疾病是转醛醇酶缺乏症并且缺陷基因任选地是taldo1;其中疾病是磷酸丙糖异构酶缺乏症并且缺陷基因任选地是tpi1;其中疾病是果糖双磷酸酶缺乏症并且缺陷基因任选地是fbp1;其中疾病是高草酸尿症并且缺陷基因任选地是agxt或grhpr;其中疾病是己糖激酶缺乏症并且缺陷基因任选地是hk1;其中疾病是葡萄糖-半乳糖吸收不良并且缺陷基因任选地是slc5a1;或者其中疾病是葡萄糖-6-磷酸脱氢酶缺乏症并且缺陷基因任选地是g6pd。
[0421]
在实施方案中,代谢病症是氨基酸代谢病症,其中疾病是黑尿症并且缺陷基因任选地是hgd;其中疾病是天冬氨酰基葡萄糖胺尿症并且缺陷基因任选地是aga;其中疾病是甲基丙二酸血症并且缺陷基因任选地是mut、mcee、mmaa、mmab、mmachc、mmadhc或lmbrd1;其中疾病是枫糖尿病并且缺陷基因任选地是bckdha、bckdhb、dbt或dld;其中疾病是高胱氨酸尿症并且缺陷基因任选地是cbs;其中疾病是酪氨酸血症并且缺陷基因任选地是fah、tat或hpd;其中疾病是臭鱼症(trimethylaminuria)并且缺陷基因任选地是fmo3;其中所述疾病是哈特纳普病(hartnup disease)并且缺陷基因任选地是slc6a19;其中疾病是生物素酰胺酶缺乏症并且缺陷基因任选地是btd;其中疾病是鸟氨酸氨基甲酰基转移酶缺乏症并且缺陷基因任选地是otc;其中疾病是氨基甲酰磷酸合酶i缺乏症并且缺陷基因任选地是cps1;其中疾病是瓜氨酸血症并且缺陷基因任选地是ass或slc25a13;其中疾病是高精氨酸血症并且缺陷基因任选地是arg1;其中疾病是高同型半胱氨酸血症并且缺陷基因任选地是mthfr;其中疾病是高蛋氨酸血症并且缺陷基因任选地是mat1a、gnmt或ahcy;其中疾病是高赖氨酸血症并且缺陷基因任选地是aass;其中疾病是非酮症性高甘氨酸血症并且缺陷基因任选地是gldc、amt或gcsh;其中疾病是丙酸血症并且缺陷基因任选地是pcca或pccb;其中疾病是高脯氨酸血症并且缺陷基因任选地是aldh4a1或prodh;其中疾病是胱氨酸尿症并且缺陷基因任选地是slc3a1或slc7a9;其中疾病是二羧酸氨基酸尿症并且缺陷基因任选地是slc1a1;其中疾病是戊二酸血症2型并且缺陷基因任选地是etfa、etfb或etfdh;其中疾病是异戊酸血症并且缺陷基因任选地是ivd;或者其中疾病是2-羟基戊二酸尿症并且缺陷基因
任选地是l2hgdh或d2hgdh。
[0422]
在实施方案中,代谢病症是尿素循环病症,其中疾病是n-乙酰谷氨酸合成酶缺乏症并且缺陷基因任选地是nags;其中疾病是精氨琥珀酸尿症并且缺陷基因任选地是asl;或者其中疾病是精氨酸血症并且缺陷基因任选地是arg1。
[0423]
在实施方案中,代谢病症是脂肪酸代谢病症,其中疾病是极长链酰基辅酶a脱氢酶缺乏症并且缺陷基因任选地是acadvl;其中疾病是长链3-羟酰基辅酶a脱氢酶缺乏症并且缺陷基因任选地是hadha;其中疾病是中链酰基辅酶a脱氢酶缺乏症并且缺陷基因任选地是acadm;其中疾病是短链酰基辅酶a脱氢酶缺乏症并且缺陷基因任选地是acads;其中疾病是3-羟酰基辅酶a脱氢酶缺乏症并且缺陷基因任选地是hadh;其中疾病是2,4二烯酰辅酶a还原酶缺乏症并且缺陷基因任选地是nadk2;其中所述疾病是3-羟基-3-甲基戊二酰辅酶a裂解酶缺乏症并且缺陷基因任选地是hmgcl;其中疾病是丙二酰辅酶a脱羧酶缺乏症并且缺陷基因任选地是mlycd;其中所述疾病是全身性原发性肉毒碱缺乏症并且缺陷基因任选地是slc22a5;其中所述疾病是肉毒碱-酰基肉毒碱转位酶缺乏症并且缺陷基因任选地是slc25a20;其中疾病是肉毒碱棕榈酰转移酶i缺乏症并且缺陷基因任选地是cpt1a;其中疾病是肉毒碱棕榈酰转移酶ii缺乏症并且缺陷基因任选地是cpt2;其中疾病是溶溶酶体酸性脂肪酶缺乏症并且缺陷基因任选地是lipa;或者其中疾病是戈谢病(gaucher's disease)并且缺陷基因任选地是gba。
[0424]
在实施方案中,代谢病症是卟啉代谢病症,其中疾病是急性间歇性卟啉症并且缺陷基因任选地是hmbs;其中疾病是冈瑟病(gunther disease)并且缺陷基因任选地是uros;其中疾病是迟发性皮肤卟啉症并且缺陷基因任选地是urod;其中所述疾病是肝红细胞生成性卟啉症并且缺陷基因任选地是urod;其中所述疾病是遗传性粪卟啉症并且缺陷基因任选地是cpox;其中疾病是杂色卟啉症并且缺陷基因任选地是ppox;其中疾病是红细胞生成性原卟啉症并且缺陷基因任选地是fech;或者其中疾病是氨基乙酰丙酸脱水酶缺乏性卟啉症并且缺陷基因任选地是alad。
[0425]
在实施方案中,代谢病症是溶酶体贮积病症,其中疾病是法伯病(farber disease)并且缺陷基因任选地是asah1;其中疾病是克拉伯病(krabbe disease)并且缺陷基因任选地是galc;其中疾病是半乳糖唾液酸中毒并且缺陷基因任选地是ctsa;其中所述疾病是法布里病(fabry disease)并且所述缺陷基因任选地是gla;其中疾病是辛德勒病(schindler disease)并且缺陷基因任选地是naga;其中疾病是gm1神经节苷脂贮积症并且缺陷基因任选地是glb1;其中疾病是泰-萨克斯病(tay
–
sachs disease)并且缺陷基因任选地是hexa;其中疾病是山德霍夫氏病(sandhoff disease)并且缺陷基因任选地是hexb;其中疾病是gm2-神经节苷脂贮积症,ab变体并且缺陷基因任选地是gm2a;其中疾病是尼曼-皮克病(niemann
–
pick disease)并且缺陷基因任选地是smpd1、npc1或npc2;其中疾病是异染性脑白质营养不良并且缺陷基因任选地是arsa或psap;其中疾病是多硫酸酯酶缺乏症并且缺陷基因任选地是sumf1;其中疾病是赫尔勒综合征(hurler syndrome)并且缺陷基因任选地是idua;其中疾病是亨特综合征(hunter syndrome)并且缺陷基因任选地是ids;其中所述疾病是圣菲利波综合征(sanfilippo syndrome)并且缺陷基因任选地是sgsh、naglu、hgsnat或gns;其中疾病是莫尔基奥综合征(morquio syndrome)并且缺陷基因任选地是galns或glb1;其中疾病是马-拉综合征(maroteaux
–
lamy syndrome)并且缺陷基因任选地
是arsb;其中疾病是斯莱综合征(sly syndrome)并且缺陷基因任选地是gusb;其中疾病是唾液酸中毒并且缺陷基因任选地是neu1、neu2、neu3或neu4;其中疾病是i细胞疾病并且缺陷基因任选地是gnptab或gnptg;其中所述疾病是黏脂贮积症iv型并且缺陷基因任选地是mcoln1;其中所述疾病是婴儿神经元蜡样脂褐质沉着症并且缺陷基因任选地是ppt1或ppt2;其中疾病是詹-比二氏病(jansky
–
bielschowsky disease)并且缺陷基因任选地是tpp1;其中疾病是巴顿病(batten disease)并且缺陷基因任选地是cln1、cln2、cln3、cln5、cln6、mfsd8、cln8或ctsd;其中疾病是库夫斯病(kufs disease),a型并且缺陷基因任选地是cln6或ppt1;其中疾病是库夫斯病,b型并且缺陷基因任选地是dnajc5或ctsf;其中疾病是α-甘露糖苷贮积症并且缺陷基因任选地是man2b1、man2b2或man2c1;其中疾病是β-甘露糖苷贮积症并且缺陷基因任选地是manba;其中疾病是岩藻糖苷贮积症并且缺陷基因任选地是fuca1;其中疾病是胱氨酸病并且缺陷基因任选地是ctns;其中所述疾病是致密性成骨不全症并且缺陷基因任选地是ctsk;其中疾病是萨拉病(salla disease)并且缺陷基因任选地是slc17a5;其中疾病是婴儿游离唾液酸贮积症并且缺陷基因任选地是slc17a5;或者其中疾病是达农病(danon disease)并且缺陷基因任选地是lamp2。
[0426]
在实施方案中,代谢病症是过氧化物酶体生物发生病症,其中疾病是齐薇格综合征(zellweger syndrom)并且缺陷基因任选地是pex1、pex2、pex3、pex5、pex6、pex12、pex14或pex26;其中疾病是婴儿雷夫叙姆病(infantile refsum disease)并且缺陷基因任选地是pex1、pex2或pex26;其中疾病是新生儿肾上腺脑白质营养不良并且缺陷基因任选地是pex5、pex1、pex10、pex13或pex26;其中疾病是rcdp 1型并且缺陷基因任选地是pex7;其中疾病是哌可酸血症并且缺陷基因任选地是pahx;其中疾病是无触酶症并且缺陷基因任选地是cat;其中疾病是高草酸尿症1型并且缺陷基因任选地是agxt;其中疾病是酰基辅酶a氧化酶缺乏症并且缺陷基因任选地是acox1;其中疾病是d-双功能蛋白缺乏症并且缺陷基因任选地是hsd17b4;其中疾病是磷酸二羟丙酮酰基转移酶缺乏症并且缺陷基因任选地是gnpat;其中疾病是x连锁肾上腺脑白质营养不良并且缺陷基因任选地是abcd1;其中疾病是α-甲基酰基辅酶a消旋酶缺乏症并且缺陷基因任选地是amacr;其中疾病是rcdp 2型并且缺陷基因任选地是dhapat;其中疾病是rcdp 3型并且缺陷基因任选地是agps;其中所述疾病是成人雷夫叙姆病-1并且缺陷基因任选地是phyh;或者其中疾病是穆利布瑞侏儒症(mulibrey nanism)并且缺陷基因任选地是trim37。
[0427]
在实施方案中,代谢病症是嘌呤或嘧啶代谢病症,其中疾病是莱齐-尼汉综合征(lesch
–
nyhan syndrome)并且缺陷基因任选地是hprt;其中疾病是腺嘌呤磷酸核糖基转移酶缺乏症并且缺陷基因任选地是aprt;其中疾病是腺苷脱氨酶缺乏症并且缺陷基因任选地是ada;其中所述疾病是单磷酸腺苷脱氨酶缺乏症1型并且缺陷基因任选地是ampd1;其中疾病是腺苷酸琥珀酸裂解酶缺乏症并且缺陷基因任选地是adsl;其中疾病是二氢嘧啶脱氢酶缺乏症并且缺陷基因任选地是dpyd;其中疾病是米勒综合征(miller syndrome)并且缺陷基因任选地是dhodh;其中疾病是乳清酸尿症并且缺陷基因任选地是umps;其中疾病是嘌呤核苷磷酸化酶缺乏症并且缺陷基因任选地是pnp;或者其中疾病是黄嘌呤尿症并且缺陷基因任选地是xdh、mocs1或mocs2、geph。
[0428]
在实施方案中,本发明涉及用于调节转甲状腺素蛋白(ttr)的方法。所述方法包括向受试者施用有效量的编码ttr的合成rna的步骤,其中合成rna包含一种或多种避免实质
性细胞毒性的非典型核苷酸。
[0429]
在实施方案中,调节引起受试者中ttr的数量增加。
[0430]
在实施方案中,调节引起受试者中ttr的数量减少。
[0431]
在实施方案中,调节引起治疗淀粉样疾病、老年全身性淀粉样变性(ssa)、家族性淀粉样多发性神经病(fap)和家族性淀粉样心肌病(fac)中的一种或多种。
[0432]
在实施方案中,非典型核苷酸在选自嘧啶的2c、4c和5c位置或选自嘌呤的6c、7n和8c位置的位置处具有一个或多个取代。
[0433]
在实施方案中,本发明通过向有需要的受试者施用有效量的编码基因编辑蛋白的合成rna来治疗或降低疼痛,例如手术后疼痛和/或慢性疼痛,所述基因编辑蛋白能够在电压门控钠通道1型(nav1)基因(例如nav1.3、nav1.7、nav1.8和/或nav1.9)中产生双链断裂。
[0434]
在实施方案中,施用针对中枢神经系统(cns)或外周神经系统(pns),例如针对cns或pns的神经元和神经胶质细胞。
[0435]
在实施方案中,疾病或病症是肺疾病或病症。在实施方案中,疾病或病症是与肺疾病或病症相关的炎症。在实施方案中,肺疾病或病症选自石棉肺(asbestosis)、哮喘、支气管扩张、支气管炎、慢性咳嗽、慢性阻塞性肺病(copd)、普通感冒、哮吼、囊性纤维化、汉坦病毒、特发性肺纤维化、流感、肺癌、大流行流感、百日咳、胸膜炎、肺炎、肺栓塞、肺动脉高压、呼吸道合胞病毒(rsv)、结节病、睡眠呼吸暂停、肺活量测定、婴儿猝死综合征(sids)和肺结核。
[0436]
此外,在一些实施方案中,本发明组合物可用于治疗、控制或预防疾病、病症和/或疾患且/或可改变、修改或更改罹患诸如但不限于以下的疾病、病症和/或疾患的受试者的外皮系统成员的外观:寻常痤疮、夏季痤疮、聚合性痤疮、化妆品性痤疮、暴发性痤疮、颈部瘢痕疙瘩性痤疮、机械性痤疮、药物性痤疮、粟粒性坏死性痤疮、坏死性痤疮、玫瑰痤疮、光化性角化病、寻常痤疮、夏季痤疮、聚合性痤疮、化妆品性痤疮、暴发性痤疮、颈部瘢痕疙瘩性痤疮、机械性痤疮、药物性痤疮、粟粒性坏死性痤疮、坏死性痤疮、玫瑰痤疮、急性荨麻疹、过敏性接触性皮炎、斑秃、血管性水肿、香港脚、特应性皮炎、自体湿疹、婴儿痤疮、秃顶、芽生菌病、黑头、胎记和其他皮肤色素沉着问题、疖子、瘀伤、虫咬和蜇伤、烧伤、蜂窝织炎、恙螨、氯痤疮、胆碱能性或应激性荨麻疹、慢性荨麻疹、冷型荨麻疹、融合性和网状乳头状瘤病、鸡眼、囊肿、头皮屑、疱疹样皮炎、皮肤划痕症、多汗性湿疹、尿布疹、皮肤干燥、多汗、外胚层发育不良(诸如多汗性外胚层发育不良和x连锁多汗性外胚层发育不良)、湿疹、疣状表皮发育不良、结节性红斑、剥脱性痤疮、运动性过敏性毛囊炎、皮肤油脂过多、毛囊炎、雀斑、冻伤、真菌指甲、毛发密度、毛发生长速度、卤素痤疮、脱发、痱子、血肿、单纯疱疹感染(例如非生殖器单纯疱疹感染)、化脓性汗腺炎、荨麻疹、多汗症、色素沉着过度、少汗性外胚层发育不良、色素减退、脓疱病、毛发向内生长、热型荨麻疹、脚趾甲向内生长、婴儿痤疮或新生儿痤疮、瘙痒、刺激性接触性皮炎、股癣、瘢痕疙瘩、毛发角化病、扁平苔藓、硬化性苔藓、面斑狼疮、黄褐斑、痣、传染性软疣、指甲生长速度、指甲健康、神经性皮炎、钱币状湿疹、职业性痤疮、油性痤疮、甲真菌病、物理性荨麻疹、藏毛囊肿、玫瑰糠疹、花斑癣、毒藤、油性痤疮、须假性毛囊炎或颈部瘢痕疙瘩性痤疮、银屑病、银屑病关节炎、压力性或延迟性压力性荨麻疹、刺伤(诸如割伤和擦伤)、皮疹、罕见或水型荨麻疹、隆鼻、癣、酒渣鼻、罗斯蒙德-汤姆逊综合征(rothmund-thomson syndrome)、皮肤下垂、疥疮、瘢痕、皮脂溢、脂溢性皮炎、铰链、
皮肤癌、皮赘、日光型荨麻疹、蜘蛛咬伤、妊娠纹、晒伤、焦油痤疮、热带痤疮、皮肤变薄、鹅口疮、花斑癣、暂时性棘层松解性皮肤病、大亨帽或坏死性粟粒痤疮、肤色不均、静脉曲张、静脉性湿疹、振动性血管性水肿、白癜风、疣、韦一克二氏病(weber-christian disease)、皱纹、x-连锁少汗性外胚层发育不良、干燥性湿疹、酵母菌感染和一般衰老迹象。
[0437]
本发明的说明性癌症和/或肿瘤包括但不限于基底细胞癌,胆道癌;膀胱癌;骨癌;脑和中枢神经系统癌症;乳腺癌;腹膜癌;宫颈癌;绒毛膜癌;结直肠癌;结缔组织癌;消化系统的癌症;子宫内膜癌;食道癌;眼癌;头颈癌;胃癌(gastric cancer)(包括胃肠癌);胶质母细胞瘤;肝癌(hepatic carcinoma);肝细胞瘤;上皮内肿瘤;肾癌;喉癌;白血病;肝癌(liver cancer);肺癌(例如小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞癌);黑色素瘤;骨髓瘤;神经母细胞瘤;口腔癌(唇、舌、口和咽);卵巢癌;胰腺癌;前列腺癌;视网膜母细胞瘤;横纹肌肉瘤;直肠癌;呼吸系统癌症;唾液腺癌;肉瘤;皮肤癌;鳞状细胞癌;胃癌(stomach cancer);睾丸癌;甲状腺癌;子宫或子宫内膜癌;泌尿系统癌症;外阴癌;淋巴瘤包括霍奇金淋巴瘤(hodgkin'slymphoma)和非霍奇金淋巴瘤(non-hodgkin's lymphoma)以及b细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(nhl)、小淋巴细胞(sl)nhl;中级/滤泡性nhl;中级弥漫性nhl;高级免疫母细胞nhl;高级淋巴细胞nhl;高级小非裂解细胞nhl;巨大肿块nhl;套细胞淋巴瘤;艾滋病相关淋巴瘤;和华氏巨球蛋白血症(waldenstrom'smacroglobulinemia);慢性淋巴细胞白血病(cll);急性淋巴细胞白血病(all);毛细胞白血病;慢性成髓细胞白血病;以及其他癌和肉瘤;和移植后淋巴组织增生性病症(ptld)以及与斑痣性错构瘤病、水肿(诸如与脑肿瘤相关的水肿)和麦格综合征(meigs'syndrome)相关的异常血管增生。
[0438]
在实施方案中,用本发明组合物治疗、控制或预防一种或多种罕见疾病,其包括例如红细胞生成性原卟啉症、海利-海利病(hailey-hailey disease)、大疱性表皮松解症(eb)、色素性皮肤干燥症、埃勒斯-当洛斯综合征(ehlers-danlos syndrome)、皮肤松弛症(cutis laxa)、蛋白c&蛋白s缺乏症、奥尔波特综合征(alport syndrome)、纹状掌跖角化病、致死性棘层松解性eb、弹性假黄瘤(pxe)、寻常型鱼鳞病、寻常型天疱疮和基底细胞痣综合征。
[0439]
在实施方案中,本发明组合物用于治疗、控制或预防一种或多种炎性疾病或疾患,诸如炎症、急性炎症、慢性炎症、呼吸系统疾病、动脉粥样硬化、再狭窄、哮喘、过敏性鼻炎、特应性皮炎、感染性休克、类风湿性关节炎、炎性肠病、炎性盆腔疾病、疼痛、眼部炎性疾病、乳糜泻、利氏综合征(leigh syndrome)、甘油激酶缺乏症、家族性嗜酸性粒细胞增多症(fe)、常染色体隐性痉挛性共济失调、喉部炎性疾病;肺结核、慢性胆囊炎、支气管扩张、矽肺病和其他尘肺病。
[0440]
在实施方案中,本发明组合物用于治疗、控制或预防一种或多种自身免疫疾病或疾患,诸如多发性硬化症、糖尿病(diabetes mellitus)、狼疮、乳糜泻、克罗恩氏病(crohn's disease)、溃疡性结肠炎、格林-巴利综合征(guillain-barre syndrome)、硬皮病、古德帕斯彻氏综合征(goodpasture's syndrome)、韦格纳肉芽肿病(wegener'sgranulomatosis)、自身免疫性癫痫、拉斯穆森脑炎(rasmussen'sencephalitis)、原发性胆汁硬化、硬化性胆管炎、自身免疫性肝炎、艾迪生氏病(addison's disease)、桥本氏甲状腺炎(hashimoto'sthyroiditis)、纤维肌痛、梅尼尔综合征(menier's syndrome);移植排
斥(例如,预防同种异体移植排斥反应)恶性贫血、类风湿性关节炎、系统性红斑狼疮、皮肌炎、干燥综合征、红斑狼疮、多发性硬化症、重症肌无力、赖特氏综合征(reiter's syndrome)、格雷夫氏病(grave'sdisease)和其他自身免疫疾病。
[0441]
在实施方案中,本发明组合物用于治疗、控制或预防一种或多种神经系统疾病,包括adhd、aids-神经系统并发症、透明隔缺失、获得性癫痫样失语症、急性播散性脑脊髓炎、肾上腺脑白质营养不良、胼胝体发育不全、失认症、艾卡迪综合征(aicardi syndrome)、亚历山大病(alexander disease)、阿尔珀斯病(alpers'disease)、交替性偏瘫、阿尔茨海默氏病、肌萎缩性侧索硬化症、无脑畸形、动脉瘤、天使综合征(angelman syndrome)、血管瘤病、缺氧症、失语症、失用症、蛛网膜囊肿、蛛网膜炎、小脑扁桃体下疝畸形(arnold-chiari malformation)、动静脉畸形、阿斯巴甜、阿斯伯格综合征(asperger syndrome)、共济失调毛细血管扩张症、共济失调、注意力缺陷多动障碍、自闭症、自主神经功能失调、背痛、巴氏综合征(barth syndrome)、巴顿病(batten disease)、白塞氏病(behcet's disease)、贝尔麻痹(bell's palsy)、良性原发性眼睑痉挛、良性局灶性肌萎缩、良性颅内高压、伯-罗二氏综合征(bernhardt-roth syndrome)、宾斯万格氏病(binswanger's disease)、眼睑痉挛、布-苏二氏综合征(bloch-sulzberger syndrome)、臂丛神经产伤、臂丛神经损伤、布-埃二氏综合征(bell's palsy)、脑动脉瘤、脑损伤、脑和脊髓肿瘤、脊髓半切综合征(brown-sequard syndrome)、球脊髓性肌萎缩症、卡纳文病(canavan disease)、腕管综合征、灼痛、海绵状瘤、海绵状血管瘤、海绵状血管畸形、中央颈髓综合征、中央脊髓综合征、中枢性疼痛综合征、头部病症、小脑变性、小脑发育不全、脑动脉瘤、脑动脉硬化、脑萎缩、脑脚气病、脑巨人症、脑缺氧、脑瘫、脑-眼-面-骨骼综合征、腓骨肌萎缩症(charcot-marie-tooth disorder)、下疝畸形(chiari malformation)、舞蹈病、舞蹈病棘红细胞增多症、慢性炎症性脱髓鞘性多发性神经病(cidp)、慢性直立性不耐受、慢性疼痛、科克因综合征ii型(cockayne syndrome type ii)、科芬-劳里综合征(coffin lowry syndrome)、昏迷(包括持续植物状态)、复杂区域疼痛综合征、先天性面部双瘫、先天性肌无力、先天性肌病、先天性血管海绵状血管畸形、皮质基底节变性、颅动脉炎、颅缝早闭、克雅氏病(creutzfeldt-jakob disease)、累积性创伤病症、库兴氏综合征(cushing's syndrome)、巨细胞包涵体病(cibd)、巨细胞病毒感染、舞眼舞足综合征、丹迪沃克综合征(dandy-walker syndrome)、道森病(dawson disease)、德摩西埃综合征(de morsier's syndrome)、克隆普克氏麻痹(dejerine-klumpke palsy)、多发梗塞性痴呆、皮质下痴呆、路易体痴呆(dementia with lewy bodies)、皮肌炎、发育性使用障碍、德维克氏综合征(devic'ssyndrome)、糖尿病性神经病、弥漫性硬化症、德拉维特综合征(dravet'ssyndrome)、自主神经功能障碍、书写障碍、阅读障碍、吞咽困难、运动障碍、肌张力障碍、婴儿早期癫痫性脑病、空蝶鞍综合征、嗜睡性脑炎、脑炎和脑膜炎、脑膨出、脑病、脑三叉神经血管瘤病、癫痫、欧勃氏麻痹(erb's palsy)、埃尔布-杜氏(erb-duchenne)和克隆普克氏麻痹(dejerine-klumpke palsies)、法布里病(fabry's disease)、法尔综合征(fahr's syndrome)、昏厥、家族性自主神经功能障碍、家族性血管瘤、家族性特发性基底神经节钙化、家族性痉挛性麻痹、热性惊厥(例如gefs和gefs plus)、费雪综合征(fisher syndrome)、软婴儿综合征、弗里德赖希共济失调(friedreich's ataxia)、戈谢病(gaucher's disease)、格斯特曼综合征(gerstmann's syndrome)、格斯特曼-斯特劳斯勒-申克病(gerstmann-straussler-scheinker disease)、
巨细胞动脉炎、巨细胞包涵体病、球状细胞脑白质营养不良、舌咽神经痛、格林-巴利综合征(guillain-barre syndrome)、htlv-1相关脊髓病、哈勒沃登-施帕茨病(hallervorden-spatz disease)、头部损伤、头痛、连续偏头痛、面肌痉挛、交替性偏瘫、遗传性神经病、遗传性痉挛性截瘫、无定形遗传病、耳带状疱疹、带状疱疹、平山综合征(hirayama syndrome)、前脑畸形、亨廷顿氏病、脑积水、正常压力脑积水、脑积水、脊髓积水、皮质醇增多症、嗜睡症、肌张力亢进、张力减退、缺氧、免疫介导的脑脊髓炎、包涵体肌炎、色素失禁、婴儿张力减退、婴儿植烷酸贮积病、婴儿呕吐病、婴儿痉挛症、炎症性肌病、肠脂肪代谢障碍、颅内囊肿、颅内高压、艾萨克综合征(isaac's syndrome)、杰伯特综合征(joubert syndrome)、卡恩斯-塞尔综合征(kearns-sayre syndrome)、肯尼迪病(kennedy's disease)、金斯伯恩综合征(kinsbourne syndrome)、克莱恩-莱文综合征(kleine-levin syndrome)、克-弗二氏综合征(kinsbourne syndrome)、克-特综合征(klippel-trenaunay syndrome)(kts)、克-布二氏综合征(kl
ü
ver-bucy syndrome)、科萨柯夫遗忘综合征(korsakoffs amnesic syndrome)、克拉伯病(krabbe disease)、库格尔贝格-韦兰德病(kugelberg-welander disease)、苦鲁病(kuru)、兰伯特-伊顿肌无力综合征(lambert-eaton myasthenic syndrome)、蓝道-克里夫纳综合征(landau-kleffner syndrome)、股外侧皮神经卡压、外侧延髓综合征、学习障碍、利氏病(leigh's disease)、林-戈二氏综合征(lennox-gastaut syndrome)、莱施-尼汉综合征(lesch-nyhan syndrome)、脑白质营养不良、莱-克二氏综合征(levine-critchley syndrome)、路易体痴呆(lewy body dementia)、无脑畸形、闭锁综合征、卢伽雷病(lou gehrig'sdisease)、神经系统后遗症狼疮、神经系统并发症莱姆病(lyme disease—neurological complications)、马查多-约瑟夫病(machado-joseph disease)、巨脑畸形、巨脑症、梅-罗二氏综合征(machado-joseph disease)、脑膜炎、门克斯病(menkes disease)、感觉异常后肢痛、异染性脑白质营养不良、小头畸形、偏头痛、米勒费雪综合征(miller fisher syndrome)、小中风、线粒体肌病、莫比乌斯综合征(mobius syndrome)、单体性肌萎缩、运动神经元疾病、烟雾病、黏脂贮积症、粘多糖贮积症、多梗塞性痴呆、多灶性运动神经病、多发性硬化、多系统萎缩伴直立性低血压、多系统萎缩、肌肉萎缩症、先天性肌无力、重症肌无力、髓鞘弥漫性硬化症、婴儿肌阵挛性脑病、肌阵挛、先天性肌病、甲状腺毒症肌病、肌病、先天性肌强直、肌强直、发作性睡病、神经棘细胞增多症、脑铁积累的神经变性、神经纤维瘤病、神经阻滞剂恶性综合征、艾滋病的神经系统并发症、庞贝病(pompe disease)的神经学表现、视神经脊髓炎、神经性肌强直、神经元蜡样脂褐质沉积症、神经元移行异常、神遗传性经病、神经结节病、神经毒性、海绵状痣、尼曼-匹克病(niemann-pick disease)、奥沙利文-麦克劳德综合征(o'sullivan-mcleod syndrome)、枕神经痛、隐匿性脊柱功能障碍序列、大田原综合征(ohtahara syndrome)、橄榄桥脑小脑萎缩、眼阵挛性肌阵挛、直立性低血压、过度使用综合征、慢性疼痛、副肿瘤综合征、感觉异常、帕金森氏病、先天性肌强直、阵发性舞蹈手足徐动症、阵发性偏头痛、帕-罗二氏病(parry-romberg)、佩梅病(pelizaeus-merzbacher disease)、舒凯尔ii型综合征(pena shokeir ii syndrome)、神经周围囊肿、周期性麻痹、周围神经病变、脑室周围白质软化、持续植物状态、广泛性发育障碍、植烷酸贮积病、皮克氏病(pick's disease)、梨状肌综合征、垂体瘤、多发性肌炎、庞贝病、脑脓肿、脊髓灰质炎后综合征、带状疱疹后神经痛、感染后脑脊髓炎、体位性低血压、体位性直立性心动过速综合征、体位性心动过速综合征、原发性侧索硬化、朊病
毒病、进行性面肌萎缩、进行性运动性共济失调、进行性多灶性白质脑病、进行性硬化性脊髓灰质炎、进行性核上性麻痹、假性脑瘤、吡哆醇依赖性和吡哆醇反应性癫痫症、拉姆齐-亨特综合征i型(ramsay hunt syndrome type i)、拉姆齐-亨特综合征ii型(ramsay hunt syndrome type ii)、拉斯穆森脑炎(rasmussen'sencephalitis)和其他自身免疫性癫痫、反射性交感神经营养不良综合征、婴儿雷夫叙姆病、雷夫叙姆病、重复性运动障碍、重复性压力损伤、不宁腿综合征、逆转录病毒相关脊髓病、雷特综合征(rett syndrome)、雷氏综合征(reye's syndrome)、赖利-戴综合征(riley-day syndrome)、伴有结膜充血及流泪的单侧短暂持续性神经痛样头痛(sunct headache)、骶神经根囊肿、圣维特斯舞蹈病(saint vitus dance)、唾液腺病、山德霍夫氏病、希尔德病(schilder's disease)、精神分裂症、癫痫症、视神经发育不良、婴儿严重肌阵挛性癫痫(smei)、摇晃婴儿综合征、带状疱疹、夏伊-德雷格综合征(shy-drager syndrome)、干燥综合征、睡眠呼吸暂停、昏睡病、索托综合征、痉挛、脊柱裂、脊髓梗塞、脊髓损伤、脊髓肿瘤、脊髓性肌肉萎缩症、脊髓小脑萎缩症、斯蒂尔-理查森-奥尔谢夫斯基综合征(steele-richardson-olszewski syndrome,stiff-person syndrome)、僵硬人综合征、纹状体黑质变性、中风、斯特奇-韦伯综合征(sturge-weber syndrome)、亚急性硬化性全脑炎、皮层下动脉硬化性脑病、吞咽障碍、西登哈姆舞蹈病(sydenham chorea)、晕厥、梅毒性脊髓硬化、脊髓空洞症、脊髓空洞症、系统性红斑狼疮、脊髓痨、迟发性运动障碍、塔洛夫囊肿(tarlov cysts)、戴萨克斯病(tay-sachs disease)、颞动脉炎、脊髓栓系综合征、汤姆森(thomsen disease)、胸廓出口综合征、甲状腺毒性肌病、痛性痉挛(tic douloureux)、托德氏麻痹(todd'sparalysis)、抽动秽语综合征、短暂性脑缺血发作、传染性海绵状脑病、横贯性脊髓炎、外伤性脑损伤、震颤、三叉神经痛、热带痉挛性截瘫、结节性硬化症、血管性勃起瘤、血管炎(包括颞动脉炎)、埃科诺莫病(von economo's disease)、希佩尔-林道病(von hippel-lindau disease)(vhl)、雷克林豪森氏病(von recklinghausen's disease)、瓦伦伯格氏综合征(wallenberg's syndrome)、韦-霍二氏病(werdnig-hoffman disease)、韦尼克-科萨科夫综合征(wernicke-korsakoff syndrome)、韦斯特综合征(west syndrome)、惠普耳氏病(whipple's disease)、威廉斯综合征(williams syndrome)、威尔森氏病(wilson's disease)、x连锁脊髓和延髓肌萎缩症、以及齐薇格综合征。
[0442]
在实施方案中,本发明组合物用于治疗和降低疼痛,例如手术后疼痛或慢性疼痛。
[0443]
在实施方案中,本发明组合物用于治疗亨廷顿氏病。
[0444]
在实施方案中,本发明组合物用于治疗镰状细胞贫血或地中海贫血。
[0445]
在实施方案中,本发明组合物改变与疾病或病症相关的外显子的rna剪接。在实施方案中,疾病或病症选自奥尔波特综合征、阿尔茨海默氏病、贝特莱姆肌病(bethlem myopathy)和乌尔里希硬化性肌营养不良症(ullrich scleroatonic muscular dystrophy)、杜氏肌营养不良症(duchenne muscular dystrophy)、营养不良性大疱性表皮松解症、弗里德赖希共济失调、亨廷顿氏病、交界型大疱性表皮松解症、莱伯氏先天性黑蒙症(leber's congenital amaurosis)(lca)以及各种肌病和营养不良。
[0446]
在实施方案中,本发明组合物用于治疗一种或多种呼吸系统疾病,诸如哮喘、慢性阻塞性肺病(copd)、支气管扩张、过敏性鼻炎、鼻窦炎、肺血管收缩、炎症、过敏、呼吸障碍、呼吸窘迫综合征、囊性纤维化、肺动脉高压、肺血管收缩、肺气肿、汉坦病毒肺综合征(hps)、
吕弗勒氏综合征(loeffler's syndrome)、古德帕斯彻氏综合征(goodpasture's syndrome)、胸膜炎、肺炎、肺水肿、肺纤维化、结节病、呼吸道合胞病毒感染相关的并发症和其他呼吸系统疾病。
[0447]
在实施方案中,本发明组合物用于治疗、控制或预防心血管疾病,诸如影响心脏和脉管系统的疾病或疾患,包括但不限于冠心病(chd)、脑血管疾病(cvd)、主动脉瓣狭窄、外周血管疾病、动脉粥样硬化、动脉硬化、心肌梗塞(心脏病发作)、脑血管疾病(中风)、短暂性脑缺血发作(tia)、心绞痛(稳定和不稳定)、心房颤动、心律失常、瓣膜病和/或充血性心力衰竭。
[0448]
在实施方案中,本发明的组合物用于治疗、控制或预防一种或多种代谢相关病症。在实施方案中,本发明可用于治疗、控制或预防糖尿病,包括1型和2型糖尿病和与肥胖相关的糖尿病。本发明的组合物和方法可用于治疗或预防糖尿病相关病症,包括但不限于糖尿病肾病、高血糖症、葡萄糖耐量降低、胰岛素抵抗、肥胖、脂质紊乱、血脂异常、高脂血症、高甘油三酯血症、高胆固醇血症、低hdl水平、高ldl水平、动脉粥样硬化及其后遗症、血管再狭窄、肠易激综合征、炎性肠病,包括克罗恩氏病和溃疡性结肠炎、其他炎性疾患、胰腺炎、腹部肥胖、神经退行性疾病、视网膜病、肿瘤性疾病、脂肪细胞瘤、脂肪细胞癌,诸如脂肪肉瘤、前列腺癌和其他癌症,包括胃癌、乳腺癌、膀胱癌和结肠癌、血管生成、阿尔茨海默氏病、银屑病、高血压、代谢综合征(例如,一个人患有以下病症中的三种或更多种:腹部肥胖、高甘油三酯血症、低hdl胆固醇、高血压和高空腹血糖)、卵巢高雄激素血症(多囊卵巢综合征)、以及其他胰岛素抵抗是一种因素的疾病,诸如睡眠呼吸暂停。本发明的组合物和方法可用于治疗、控制或预防肥胖,包括遗传性肥胖或环境性肥胖,以及与肥胖相关的病症。本文的肥胖相关的病症与肥胖相关联,由肥胖导致或由肥胖引起。肥胖相关的病症的实例包括肥胖、糖尿病、暴食、狂食和贪食症、高血压、血浆胰岛素浓度升高和胰岛素抵抗、血脂异常、高脂血症、子宫内膜癌、乳腺癌、前列腺癌、肾癌和结肠癌、骨关节炎、阻塞性睡眠呼吸暂停、胆结石、心脏病、心律不齐和心律失常、心肌梗塞、充血性心力衰竭、冠心病、猝死、中风、多囊卵巢疾病、颅咽管瘤、普拉德-威利综合征(prader-willi syndrome)、弗勒赫利希综合征(frohlich's syndrome)、gh缺乏症受试者、正常变异身材矮小、特纳氏综合征(turner's syndrome)和显示代谢活动降低或静息能量消耗占总非脂肪质量的百分比减少的其他病理状况,例如患有急性淋巴细胞白血病的儿童。肥胖相关的病症的进一步实例是代谢综合征、胰岛素抵抗综合征、生殖激素异常、性和生殖功能障碍,诸如生育能力受损、不育、雄性性腺功能减退和女性多毛症、与母亲肥胖相关的胎儿缺陷、胃肠动力障碍,诸如肥胖相关的胃食管反流、呼吸系统病症,诸如肥胖-通气不足综合征(匹克威克综合征(pickwickian syndrome))、呼吸困难、心血管疾病、炎症,诸如脉管系统性全身炎症、动脉硬化、高胆固醇血症、腰痛、胆囊疾病、高尿酸血症、痛风和肾癌、以及麻醉风险增加。本发明的组合物和方法还可用于治疗阿尔茨海默氏病。
[0449]
核酸,包括含有核酸的脂质体制剂,在体内递送时,可在肝脏和/或脾脏中积聚。现已发现,编码蛋白质的核酸可调节肝脏和脾脏中的蛋白质表达,并且以这种方式使用的核酸可构成治疗肝脏和脾脏疾病的有效治疗剂。某些实施方案因此涉及用于通过向患者递送编码目标蛋白的核酸来治疗肝脏和/或脾脏疾病的方法。其他实施方案涉及包含编码目标蛋白的核酸的治疗组合物,用于治疗肝脏和/或脾脏疾病。可治疗的肝脏和/或脾脏的疾病
和疾患包括但不限于:肝炎、酒精性肝病、药物性肝病、爱泼斯坦巴尔病毒感染(epstein barr virus infection)、腺病毒感染、巨细胞病毒感染、弓形体病、洛基山斑疹热(rocky mountain spotted fever)、非酒精性脂肪肝、血色素沉着症、威尔森氏病、吉耳伯氏病(gilbert's disease)和肝癌和/或脾脏癌。
[0450]
在一些实施方案中,本发明组合物和方法涉及治疗1型糖尿病、心脏病,包括缺血性和扩张型心肌病、黄斑变性、帕金森氏病、囊性纤维化、镰状细胞贫血、地中海贫血、范科尼贫血、严重联合免疫缺陷、遗传性感觉神经病、色素性皮肤干燥症、亨廷顿氏病、肌营养不良、肌萎缩性侧索硬化症、阿尔茨海默氏病、癌症以及传染病,包括肝炎和艾滋病毒/艾滋病。
[0451]
在实施方案中,本发明方法和组合物可用于治疗或预防一种或多种代谢疾病或病症。在实施方案中,本发明方法和组合物可用于治疗或预防一种或多种碳水化合物代谢疾病或病症、氨基酸代谢疾病或病症、尿素循环疾病或病症、脂肪酸代谢疾病或病症、卟啉代谢疾病或病症、溶酶体贮积病症、过氧化物酶体生物发生病症以及嘌呤或嘧啶代谢疾病或病症。
[0452]
在实施方案中,本发明方法和组合物可用于治疗或预防一种或多种眼科疾病或病症,包括但不限于糖尿病视网膜病变、干眼症、白内障、视网膜静脉阻塞、黄斑水肿、黄斑变性(湿性&干性)、屈光和调节病症、圆锥角膜、弱视、青光眼、斯塔加特病(stargardt disease)、眼内炎、结膜炎、葡萄膜炎、视网膜脱离、角膜溃疡、泪囊炎、眼球后退综合征(duane retraction syndrome)和视神经炎。
[0453]
在实施方案中,眼科疾病或病症是中央浆液性视网膜病(csr)、成人卵黄样疾病、葡萄膜炎,其为全身性疾病的原发性和继发性(例如作为非限制性实例,肉瘤、类风湿病、关节炎等)、白点综合征(包括mewds(多发性过性白点综合征))、匐行性脉络膜病变、amppe(急性多灶性后路乳突上皮病)、pohs(拟眼组织胞浆菌综合征)或匐行性脉络膜视网膜病变。在一些实施方案中,疾病可以是黄斑病或视锥细胞营养不良,诸如作为非限制性实例,斯塔加特病。在一些实施方案中,疾病可以是遗传性退行性疾病,诸如视网膜色素病变(rp)。在一些实施方案中,眼部疾病可以是眼部黑色素瘤、眼部肿瘤或浸润性肿瘤。
[0454]
在实施方案中,眼科疾病或病症是富克斯角膜内皮营养不良(fuch’s corenal dystrophy)。在实施方案中,眼科疾病或病症是莱伯氏先天性黑蒙症。
[0455]
在实施方案中,本发明方法和组合物可用于靶向表2a、表2b和/或表2c的蛋白质中的任一种或治疗表2a、表2b和/或表2c的疾病或病症中的任一种。
[0456]
在多个实施方案中,本发明方法和组合物包括在诊断、治疗、预防或改善本文所述的疾病、病症和/或疾患中使用核酸药物,包括合成rna。在多个实施方案中,本发明方法和组合物包括在改变、修改和/或更改组织(例如美容方面)中使用核酸药物,包括合成rna。
[0457]
一般而言,在多个实施方案中,如本文所述的合成rna以本文所述的特定剂量施用于人,并且合成rna包含编码目标蛋白的序列,有时称为靶序列,所述目标蛋白可以是治疗蛋白。
[0458]
仅包含典型核苷酸的合成rna可与模式识别受体结合,可被识别为病原体相关分子模式,并可在细胞中触发有效的免疫反应,从而导致翻译阻滞、炎性细胞因子的分泌和细胞死亡。包含某些非典型核苷酸的合成rna可逃避先天免疫系统的检测,并可高效地翻译成
蛋白质,包括在人类中。包含本文所述的非典型核苷酸中的至少一种的合成rna,包括例如以下组的成员:5-甲基胞苷、5-羟基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲氧基尿苷、5-甲酰基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲氧基假尿苷和5-甲酰基假尿苷可逃避先天免疫系统的检测,并可高效地翻译成蛋白质,包括在人类中。某些实施方案因此涉及用于诱导细胞表达目标蛋白的方法,其包括使细胞与合成rna接触。其他实施方案涉及用于用合成rna转染细胞的方法,其包括使细胞与包含一种或多种合成rna分子的溶液接触。其他实施方案涉及用于治疗患者的方法,其包括向患者施用合成rna。在一个实施方案中,合成rna包含本文所述的非典型核苷酸中的至少一种,包括例如以下组的成员:5-甲基胞苷、5-羟基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲氧基尿苷、5-甲酰基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲氧基假尿苷和5-甲酰基假尿苷。在另一个实施方案中,合成rna编码目标蛋白。说明性rna可含有如本文其他各处所述的非典型和非典型核苷酸的组合和水平。在实施方案中,所述方法引起目标蛋白的表达。在实施方案中,所述方法引起患者皮肤中的目标蛋白的表达。
[0459]
其他实施方案涉及用于将核酸递送至体内细胞的方法。其他实施方案涉及用于诱导体内细胞表达目标蛋白的方法。其他实施方案涉及用于治疗患者的方法。在一个实施方案中,所述方法包括破坏角质层。在另一个实施方案中,所述方法包括使细胞与核酸接触。在又一实施方案中,所述方法引起细胞内化核酸。在另一个实施方案中,所述方法引起细胞表达目标蛋白。在又一个实施方案中,所述方法引起患者中的目标蛋白表达。在又一个实施方案中,所述方法引起患者症状中的一种或多种的改善。在又一个实施方案中,患者需要目标蛋白。在又一个实施方案中,患者缺乏目标蛋白。
[0460]
其他实施方案涉及用于治疗患者的方法,其包括向患者递送组合物。在另一个实施方案中,所述组合物包含一个或多个核酸分子。在又一实施方案中,一个或多个核酸分子中的至少一个编码目标蛋白。在实施方案中,核酸是合成rna。在其他实施方案中,所述方法引起患者症状中的一种或多种的改善。其他实施方案涉及用于通过向细胞或患者递送编码蛋白质或肽的核酸来治疗适应症的方法。其他实施方案涉及包含编码蛋白质或肽的核酸的组合物。可使用本发明的方法和组合物治疗的适应症以及可由本发明的组合物编码的蛋白质和肽列示于表2a、表2b和/或表2c中,并且是作为实例给出的,而非限制。在一个实施方案中,适应症选自表2a、表2b和/或表2c。在另一个实施方案中,蛋白质或肽选自表2a、表2b和/或表2c。在又一实施方案中,适应症和蛋白质或肽选自表2a、表2b和/或表2c的同一行。在另一个实施方案中,蛋白质是基因编辑蛋白。在又一实施方案中,基因编辑蛋白靶向至少部分地导致疾病表型的基因。在又一实施方案中,基因编辑蛋白靶向编码选自表2a、表2b和/或表2c的蛋白质的基因。在再一实施方案中,基因编辑蛋白单独或与一种或多种其他分子或基因编辑蛋白组合校正或消除至少部分地导致疾病表型的突变。
[0461]
在多个实施方案中,本发明涉及靶向表2a、表2b和/或表2c中所公开的蛋白质中的任一种和此类蛋白质的前体形式和/或成熟形式和/或同工型和/或突变体。在实施方案中,前体形式和/或成熟形式和/或同工型和/或突变体中的任一种相对于对应的野生型蛋白具有增强的分泌。在实施方案中,前体形式和/或成熟形式和/或同工型和/或突变体中的任一
种改变了半衰期(例如血清、血浆、胞内)——例如,更长或更短的半衰期。在实施方案中,这是相对于野生型的。
[0462]
[0463]
[0464]
[0465]
[0466]
[0467]
[0468]
[0469]
[0470]
[0471]
[0472]
[0473]
[0474]
[0475]
[0476]
[0477]
[0478]
[0479]
[0480]
[0481]
[0482]
[0483]
[0484]
[0485]
[0486]
[0487]
[0488]
[0489]
[0490]
[0491]
[0492]
[0493]
[0494]
[0495]
[0496]
[0497]
[0498]
[0499]
[0500]
[0501]
[0502]
[0503]
[0504]
[0505][0506]
在多个实施方案中,本发明方法和组合物可用于治疗或预防下表中的疾病或病症中的一种或多种。在多个实施方案中,本发明方法和组合物可用于治疗或预防下表中的疾
病或病症中的一种或多种,例如通过调节与下表中的疾病相关联的基因。在实施方案中,本发明方法和组合物可用于使用本发明组合物来基因编辑下表2c中描述的基因。
[0507]
表2c
[0508]
[0509]
[0510]
[0511]
[0512]
[0513][0514]
上表中列出的entrez条目在此以引用的方式整体并入。
[0515]
本发明的另外的说明性靶标包括在国际专利公布号wo2013/151671的表6中列出的美容靶标,所述公布的内容在此以引用的方式整体并入。
[0516]
此外,在一些实施方案中,本发明方法和组合物可用于靶向表2a、表2b和/或表2c的蛋白质中的任一种或治疗表2a、表2b和/或表2c的疾病或病症中的任一种。在多个实施方
案中,本发明涉及靶向表2b中所公开的蛋白质中的任一种的全长和/或截短形式。在多个实施方案中,本发明涉及靶向表2a、表2b和/或表2c中所公开的蛋白质中的前体形式和/或成熟形式和/或同工型。
[0517]
在多个实施方案中,本发明涉及靶向与本文所公开的蛋白质序列中的任一种(例如表2a、表2b和/或表2c中的蛋白质序列中的任一种)具有约60%(例如约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%)序列同一性的蛋白质。
[0518]
在多个实施方案中,本发明涉及靶向包含相对于本文所述的蛋白质序列中的任一种(例如表2a、表2b和/或表2c中的蛋白质序列中的任一种)具有一个或多个氨基酸突变的氨基酸序列的蛋白质。例如,本发明涉及靶向包含相对于本文所述的蛋白质序列中的任一种(例如表2a、表2b和/或表2c中的蛋白质序列中的任一种)具有1、或2、或3、或4、或5、或6、或7、或8、或9、或10、或11个、或12个氨基酸突变的氨基酸序列的蛋白质。在实施方案中,一个或多个氨基酸突变可以独立地选自取代、插入、缺失和截短。
[0519]
在实施方案中,氨基酸突变是氨基酸取代,并且可包括保守和/或非保守取代。
[0520]
例如,“保守取代”可基于所涉及的氨基酸残基的极性、电荷、大小、溶解度、疏水性、亲水性和/或两亲性质的相似性来完成。20种天然存在的氨基酸可分为以下六个标准氨基酸组:(1)疏水性:met、ala、val、leu、ile;(2)中性亲水的:cys、ser、thr;asn、gln;(3)酸性的:asp、glu;(4)碱性的:his、lys、arg;(5)影响链取向的残基:gly、pro;和(6)芳族的:trp、tyr、phe。
[0521]
如本文所用,“保守取代”定义为氨基酸被上文所示的六个标准氨基酸组的相同组中列出的另一种氨基酸交换。例如,由glu交换asp在如此修饰的多肽中保留一个负电荷。另外,甘氨酸和脯氨酸可基于它们破坏α-螺旋的能力而彼此替代。
[0522]
如本文所用,“非保守取代”定义为氨基酸被上文所示的六个标准氨基酸组(1)至(6)的不同组中列出的另一种氨基酸交换。
[0523]
在各种实施方案中,取代还可包括非经典氨基酸(例如,硒代半胱氨酸、吡咯赖氨酸、n-甲酰基蛋氨酸β-丙氨酸、gaba和δ-氨基乙酰丙酸、4-氨基苯甲酸(paba)、共同氨基酸的d-异构体、2,4-二氨基丁酸、α-氨基异丁酸、4-氨基丁酸、abu、2-氨基丁酸、γ-abu、ε-ahx、6-氨基己酸、aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、环己基丙氨酸、β-丙氨酸、氟-氨基酸、设计者氨基酸如β-甲基氨基酸、cα-甲基氨基酸、nα-甲基氨基酸及一般氨基酸类似物)。
[0524]
制造方法
[0525]
本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂的化学合成方法描述于本文其他各处。
[0526]
本发明的方法和组合物利用某些阳离子脂质,其合成、制备和表征在本文其他各处和所附实施例中进行了描述。另外,本发明提供制备脂质聚集体和/或脂质载剂,包括与治疗剂例如核酸相关联的那些脂质聚集体和/或脂质载剂的方法。
[0527]
在实施方案中,本发明脂质聚集体和/或脂质载剂例如脂质体,是使用微流体产生的。在实施方案中,本发明脂质聚集体和/或脂质载剂是使用nanoassemblr仪器(precision nanosystems)制造的。在实施方案中,使用注射泵来以指定的流速混合有机溶液和水溶液。任选地,水溶液的流速与有机溶液的流速之比可选自约1:1、约2:1、约3:1、约4:1、约5:1、约6:1、约8:1、或约10:1。在实施方案中,有机溶液包含乙醇、丙酮、乙腈、二甲基亚砜、甲苯和氯仿中的一种或多种,或它们的混合物。在其他实施方案中,使用其他溶剂。
[0528]
在实施方案中,本发明脂质聚集体和/或脂质载剂是通过将一种溶液逐滴混合到另一种溶液中来制造的。在实施方案中,本发明的脂质聚集体和/或脂质载剂是用喷雾机制、或通过溶剂蒸发、或通过超声处理、或通过一个或多个膜挤出、或通过自组装过程、或通过多种方法的组合制造的。
[0529]
在本文所述的方法中,将脂质的混合物与核酸的缓冲水溶液组合以产生含有包封在脂质颗粒中的核酸的中间混合物,其中所述包封的核酸以约3重量%至约25重量%,例如5重量%至15重量%的核酸/脂质比存在。中间混合物可任选地调整大小以获得脂质包封的核酸颗粒,其中脂质部分是例如具有30至150nm例如约40至90nm直径的单层囊泡。然后升高ph以中和脂质-核酸颗粒上表面电荷的至少一部分,从而提供至少部分表面中和的脂质包封的核酸组合物。
[0530]
若干阳离子脂质是在低于氨基的pka的ph下带电并且在高于pka的ph下基本上呈中性的氨基脂质。这些阳离子脂质被称为可滴定阳离子脂质并且可使用两步法在本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂中使用。首先,脂质囊泡可在较低的ph下用可滴定阳离子脂质和其他囊泡组分在存在核酸的情况下形成。以这种方式,囊泡将包封和包埋所述核酸。其次,新形成的囊泡的表面电荷可通过将培养基的ph增加到高于存在的可滴定阳离子脂质的pka的水平(即生理ph或更高)来中和。这种方法的特别有利的方面包括容易去除任何表面吸附的核酸和所得的具有中性表面的核酸递送媒介物。预期具有中性表面的本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂和/或脂质体和/或脂质颗粒能避免从循环中快速清除并避免与阳离子脂质体制剂相关联的某些毒性。关于此类可滴定阳离子脂质在核酸-脂质颗粒的制剂中的这些用途的另外细节在美国专利号6,287,591和美国专利号6,858,225中提供,所述专利以引用的方式并入本文。
[0531]
以这种方式形成的囊泡提供了具有高核酸含量的均匀囊泡大小的制剂。另外,囊泡的大小范围为约30至约150nm,例如约30至约90nm。
[0532]
无意受任何特定理论的约束,据信非常高效率的核酸包封是低ph下静电相互作用的结果。在酸性ph(例如ph 4.0)下,囊泡表面带电并通过静电相互作用结合核酸的一部分。当外部酸性缓冲液更换为更中性的缓冲液(例如,ph 7.5)时,脂质颗粒或脂质体的表面被中和,允许去除任何外部核酸。在各种公布(例如,美国专利号6,287,591和美国专利号6,858,225)中提供了关于配制过程的更详细信息。
[0533]
本发明在实施方案中提供了制备脂质/核酸制剂的方法。在本文所述的方法中,将脂质的混合物与核酸的缓冲水溶液组合以产生含有包封在脂质颗粒中的核酸的中间混合物,例如其中所述包封的核酸以约10重量%至约50重量%的核酸/脂质比存在。中间混合物可任选地调整大小以获得脂质包封的核酸颗粒,其中脂质部分是例如具有30至150nm或约
40至90nm直径的单层囊泡。然后升高ph以中和脂质-核酸颗粒上表面电荷的至少一部分,从而提供至少部分表面中和的脂质包封的核酸组合物。
[0534]
在实施方案中,脂质的混合物包括至少两种脂质组分:本发明的第一脂质组分,其选自具有pka的脂质,使得所述脂质在低于pka的ph下是阳离子的并且在高于pka的ph下是中性的,以及第二脂质组分,其选自脂质-核酸颗粒形成期间防止颗粒聚集的脂质。在实施方案中,氨基脂质是本发明的新型阳离子脂质。
[0535]
在制备本发明的核酸-脂质颗粒时,脂质的混合物通常是脂质在有机溶剂中的溶液。然后可将这种脂质的混合物干燥以形成薄膜或冻干以形成粉末,然后与水性缓冲液水合以形成脂质体。可选地,在一种方法中,可使脂质混合物溶解在水溶性醇(诸如乙醇)中,并且将这种乙醇溶液添加至水性缓冲液中,引起脂质体自发形成。在实施方案中,所述醇以其可商购获得的形式使用。例如,乙醇可用作无水乙醇(100%)或95%乙醇,其余为水。此方法在美国专利号5,976,567中有更详细的描述,所述专利的全部内容以引用的方式并入本文。
[0536]
在实施方案中,脂质的混合物是阳离子脂质、中性脂质(除了阳离子脂质)、甾醇(例如,胆固醇)和peg修饰的脂质(例如,peg-dmg或peg-dma)在醇溶剂中的的混合物。在实施方案中,脂质混合物基本上由在醇例如乙醇中的阳离子脂质、中性脂质、胆固醇和peg修饰的脂质组成。在实施方案中,第一溶液由摩尔比为约20-70%阳离子脂质:5-45%中性脂质:20-55%胆固醇:0.5-15%peg修饰脂质的上述脂质混合物组成。在实施方案中,第一溶液基本上由选自表1的脂质、dspc、chol和peg-dmg或peg-dma组成,例如摩尔比为约20-60%阳离子脂质:5-25%dspc:25-55%chol:0.5-15%peg-dmg或peg-dma。在实施方案中,脂质摩尔比为大约40/10/40/10(mol%阳离子脂质/dspc/chol/peg-dmg或peg-dma)、35/15/40/10(mol%阳离子脂质/dspc/chol/peg-dmg或peg-dma)或52/13/30/5(mol%阳离子脂质/dspc/chol/peg-dmg或peg-dma)。在实施方案中,这些组合物中的中性脂质被替换为popc、dppc、dope或sm。
[0537]
在实施方案中,脂质混合物与可含有核酸的缓冲水溶液组合。缓冲水溶液通常是溶液中缓冲液的ph小于脂质混合物中可质子化脂质的pka的溶液。合适的缓冲液的实例包括柠檬酸盐、磷酸盐、乙酸盐和mes。缓冲液将处于1-1000mm的阴离子范围内,这取决于被包封的核酸的化学性质,并且缓冲液浓度的优化对于实现高负载水平可能是重要的(参见例如,美国专利号6,287,591和美国专利号6,858,225)。可选地,用氯化物、硫酸盐等酸化至ph 5-6的纯水可能是有用的。在这种情况下,添加5%葡萄糖或另一种非离子溶质可能是合适的,当对颗粒进行渗析以去除乙醇、增加ph或与药学上可接受的载剂诸如生理盐水混合时,这将平衡跨颗粒膜的渗透势。缓冲液中核酸的量可以变化,但通常为约0.01mg/ml至约200mg/ml,例如约0.5mg/ml至约50mg/ml。
[0538]
将脂质的混合物和治疗性核酸的缓冲水溶液组合以提供中间混合物。中间混合物通常是具有包封核酸的脂质颗粒的混合物。另外,由于脂质颗粒表面上的带负电荷的核酸和带正电荷的脂质的离子吸引力,中间混合物还可含有某些核酸的一部分,所述核酸的部分附着在脂质颗粒(脂质体或脂质囊泡)的表面(构成可质子化的第一脂质组分的氨基脂质或其他脂质在ph小于脂质上可质子化基团的pka的缓冲液中带正电荷)。在实施方案中,脂质的混合物是脂质的醇溶液,并且调节每种溶液的体积以便在组合时,所得醇含量按体积
记为约20%至约45%。组合混合物的方法可包括多种方法中的任一种,通常取决于所生产的制剂的规模。例如,当总体积为约10-20ml或更少时,可将溶液在试管中组合并使用涡旋混合器一起搅拌。可在合适的生产规模的玻璃器具中进行大规模工艺。
[0539]
任选地,通过组合脂质混合物和治疗剂(例如核酸)的缓冲水溶液而产生的脂质包封的治疗剂(例如核酸)复合物的大小可被设定以达到所需的大小范围和脂质颗粒大小的相对窄分布。在实施方案中,本文提供的组合物的大小将被设定为约70至约200nm,例如约90至约130nm的平均直径。若干技术可供用于将脂质体的大小设定为所需的大小。一种设定大小的方法在美国专利号4,737,323中有所描述,所述专利的全部内容以引用的方式并入本文。通过水浴或探针超声法对脂质体悬浮液进行超声处理会产生大小逐渐减小至大小小于约0.05微米的小单层囊泡(suv)。均质化是依赖于剪切能量将大脂质体破碎成更小的颗粒的另一种方法。在典型的均质化过程中,多层囊泡通过标准乳液均化器再循环,直到观察到所选的脂质体大小,通常在约0.1与0.5微米之间。在这两种方法中,都可通过常规的激光束粒径测定来监测粒径分布。对于本文的某些方法,挤出用于获得均匀的囊泡大小。
[0540]
通过小孔聚碳酸酯膜或不对称陶瓷膜挤出脂质体组合物产生相对明确的尺寸分布。典型地,悬浮液循环通过膜一次或多次直到实现所需的脂质体复合物尺寸分布。可通过孔连续减小的膜挤出脂质体来实现脂质体大小逐渐减小。在一些情况下,所形成的脂质-核酸组合物可在没有任何尺寸设定的情况下使用。
[0541]
在实施方案中,本发明的方法还包括中和脂质-核酸组合物的脂质部分上表面电荷中的至少一些的步骤。通过至少部分地中和表面电荷,未包封的核酸从脂质颗粒表面释放并且可使用常规技术从组合物中去除。在实施方案中,未包封的和表面吸附的核酸通过缓冲溶液的交换从所得组合物中去除。例如,用hepes缓冲盐水(hbs ph约7.5)溶液替换柠檬酸盐缓冲液(ph约4.0,用于形成组合物)会引起脂质体表面的中和以及核酸从所述表面释放。然后可使用标准方法经由色谱法去除释放的核酸,然后将其转换到ph高于所使用的脂质pka的缓冲液中。
[0542]
任选地,脂质囊泡(即脂质颗粒)可通过在水性缓冲液中水合形成,并在添加核酸之前使用上述方法中的任一种设定大小。如上所述,水性缓冲液的ph应低于氨基脂质的pka。然后可将核酸的溶液添加至这些设定过大小的、预先形成的囊泡中。为了将核酸包封到此类预先形成的囊泡中,混合物应该含有醇,诸如乙醇。在乙醇的情况下,其应该以约20%(w/w)至约45%(w/w)的浓度存在。另外,可能需要将水性缓冲液-乙醇混合物中的预先形成的囊泡和核酸的混合物升温至约25℃至约50℃的温度,这取决于脂质囊泡的组成和核酸的性质。对本领域普通技术人员显而易见的是,优化包封工艺以实现脂质囊泡中所需的核酸水平将需要操纵变量,诸如乙醇浓度和温度。一旦核酸被包封在预先形成的囊泡内,就可增加外部ph以至少部分地中和表面电荷。然后可以去除未包封的和表面吸附的核酸。
[0543]
疫苗和佐剂
[0544]
在一些实施方案中,本发明的化合物和组合物与蛋白质或核酸抗原组合物相关联。例如,本发明的脂质(例如式i-xvi中的任一种)可与蛋白质或核酸疫苗抗原(例如本文所述的目标蛋白中的任一种)缔合。例如,本发明可涉及通过施用与蛋白质或核酸抗原组合物(例如本文所述的目标蛋白中的任一种)缔合的本发明脂质(例如式i-xvi中的任一种)来针对包括本文所述传染病中的任一种在内的疾病接种疫苗的方法。
[0545]
在实施方案中,蛋白质或核酸抗原是β冠状病毒蛋白或α冠状病毒蛋白,或其抗原性片段,或编码它们的核酸(例如rna(例如mrna)或dna)。在一些实施方案中,β冠状病毒蛋白选自sars-cov-2、sars-cov、mers-cov、hcov-hku1和hcov-oc43蛋白,或其抗原性片段,或编码它们的核酸(例如rna(例如mrna)或dna)。在一些实施方案中,α冠状病毒蛋白选自hcov-nl63和hcov-229e蛋白,或其抗原性片段,或编码它们的核酸(例如rna(例如mrna)或dna)。
[0546]
在一些实施方案中,蛋白质或核酸抗原是冠状病毒蛋白,或其抗原性片段,或编码它们的核酸(例如rna(例如mrna)或dna)。在多个实施方案中,冠状病毒蛋白是来自sars-cov-2的蛋白,诸如例如sars-cov-2刺突蛋白。在实施方案中,sars-cov-2蛋白选自刺突表面糖蛋白、膜糖蛋白m、包膜蛋白e和核衣壳磷蛋白n,或其抗原性片段,或编码它们的核酸(例如rna(例如mrna)或dna)。在实施方案中,选自刺突表面糖蛋白的sars-cov-2蛋白包括s1、s2和s2'。
[0547]
在一些实施方案中,冠状病毒是β冠状病毒或α冠状病毒。在一些实施方案中,β冠状病毒选自sars-cov-2、sars-cov、mers-cov、hcov-hku1和hcov-oc43。在实施方案中,α冠状病毒选自hcov-nl63和hcov-229e。在实施方案中,冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。
[0548]
在实施方案中,蛋白质或核酸抗原是流感病毒抗原,任选地选自血凝素(ha)蛋白、基质2(m2)蛋白和神经氨酸酶、或其抗原性片段、或编码它们的核酸(例如rna(例如mrna)或dna)。
[0549]
在实施方案中,接种疫苗所针对的疾病或病症选自白喉、破伤风、百日咳、流感、肺炎、甲型肝炎、乙型肝炎、脊髓灰质炎、黄热病、人乳头瘤病毒(hpv)感染、炭疽、狂犬病、日本脑炎、脑膜炎、麻疹、腮腺炎、风疹、胃肠炎、天花、伤寒、水痘(varicella)(水痘(chickenpox))、轮状病毒和带状疱疹。在一些实施方案中,本发明涉及肝炎的治疗。可治疗的说明性肝炎包括但不限于甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、自身免疫性肝炎、酒精性肝炎、急性肝炎和慢性肝炎。
[0550]
在一些实施方案中,本发明的化合物、组合物或疫苗还包含佐剂,任选地选自铝凝胶或铝盐。在实施方案中,铝凝胶或铝盐选自氢氧化铝、磷酸铝和硫酸铝。在一些实施方案中,佐剂是编码如本文所述的嵌合蛋白或嵌合蛋白复合物的核酸。
[0551]
在一些实施方案中,另外的佐剂选自水包油乳液制剂、皂苷佐剂、卵清蛋白、弗氏佐剂(freunds adjuvant)、细胞因子和壳聚糖。说明性另外的佐剂包括但不限于:(1)卵清蛋白(例如endofit),其常用于生化研究;(2)水包油乳液制剂(含有或不含有其他特异性免疫刺激剂,诸如胞壁酰肽或细菌细胞壁组分),诸如例如(a)mf59(pct公布号wo 90/14837),含有5%角鲨烯(squalene)、0.5%tween 80和0.5%span 85(任选地含有不同量的mtp-pe),使用微流化器诸如例如model hoy微流化器(microfluidics,newton,mass.)配制成亚微米颗粒,(b)saf,含有10%角鲨烷(squalane)、0.4%tween 80、5%普朗尼克(pluronic)封闭的聚合物l121和thr-mdp,或者微流化成亚微米乳液或涡旋以产生更大粒径的乳液,(c)ribi佐剂系统(ras),(ribi immunochem,hamilton,mo.),含有2%角鲨烯、0.2%tween 80,以及任选地选自单磷脂a(mpl)、海藻糖二霉菌酸酯(tdm)和细胞壁骨架(cws)的组的一种或多种细菌细胞壁组分,包括mpl+cws(detoxtm);(d)addavax(invitrogen);(3)可使用
皂苷佐剂,诸如stimulon(cambridge bioscience,worcester,mass.)或由其产生的颗粒,诸如iscom(免疫刺激复合物);(4)弗氏完全佐剂(cfa)和弗氏不完全佐剂(ifa);(5)细胞因子,诸如白细胞介素(作为非限制性实例,il-1、il-2、il-4、il-5、il-6、il-7、il-12等)、干扰素(例如γ干扰素)、巨噬细胞集落刺激因子(m-csf)、肿瘤坏死因子(tnf)等;(6)壳聚糖和其他几丁质或聚-n-乙酰基-d-葡糖胺的衍生物,其中较大比例的n-乙酰基已通过水解去除(参见例如欧洲专利申请ep0460020,所述专利申请在此以引用的方式整体并入,公开了包括壳聚糖作为粘膜吸收促进剂的药物制剂);以及(7)充当免疫刺激剂以增强组合物有效性的其他物质,例如单磷酰脂a。在其他实施方案中,另外的佐剂是铝盐或铝凝胶、模式识别受体(prr)激动剂、cpg odn和咪唑喹啉中的一种或多种。在一些实施方案中,另外的佐剂是以下中的一种或多种:环状[g(3',5')pa(3',5')p](例如3'3'-cgamp vaccigrade);环状[g(2',5')pa(3',5')p]2'3'(例如2'3'cgamp vaccigrade);环状[g(2',5')pa(2',5')p](例如2'2'-cgamp vaccigrade)、环状二腺苷酸单磷酸酯(例如c-di-amp vaccigrade);环状二鸟苷酸单磷酸酯(例如c-di-gmp vaccigrade);tlr7激动剂-咪唑喹啉化合物(例如tlr7激动剂,诸如例如嘎德莫特(gardiquimod)vaccigrade、咪喹莫特(imiquimod)vaccigrade、r848 vaccigrade);脂多糖(例如tlr4激动剂),诸如来自大肠杆菌0111:b4菌株的脂多糖(例如lps-eb vaccigrade);单磷酰脂质a(例如mpla-sm vaccigrade和mpla合成vaccigrade);n-乙醇酰化胞壁酰二肽(例如n-羟乙酰基-mdp vaccigrade);cpg odn,a类和/或cpg odn,b类和/或cpg odn,c类(例如odn 1585vaccigrade、odn 1826vaccigrade、odn 2006vaccigrade、odn 2395vaccigrade),三酰化脂蛋白(例如pam3csk4 vaccigrade);聚肌苷-聚胞苷酸(例如poly(i:c)(hmw)vaccigrade);和索状因子(即分枝杆菌细胞壁组分海藻糖6,6'二霉菌酸酯(tdm))或其类似物(例如tdb vaccigrade、tdb-hs15vaccigrade)。在一些实施方案中,另外的佐剂是tlr激动剂(例如tlr1和/或tlr2和/或tlr3和/或tlr4和/或tlr5和/或tlr6和/或tlr7和/或tlr8和/或tlr9和/或tlr10和/或tlr11和/或tlr12和/或tlr13)、核苷酸结合寡聚化结构域(nod)激动剂、干扰素基因刺激剂(sting)配体或相关剂。
[0552]
在一些实施方案中,另外的佐剂是以下中的一种或多种:矿物佐剂、基于凝胶的佐剂、张力活性剂、细菌产物、油乳剂、微粒佐剂、融合蛋白和脂肽。除了其他各处描述的铝佐剂之外,其他矿物盐佐剂包括钙盐(例如磷酸钙)、铁盐和锆盐。除了其他各处描述的基于铝凝胶的佐剂外,其他基于凝胶的佐剂包括乙酰甘露聚糖(acemannan)。张力活性剂包括quil a,来源于皂树的水提物的皂苷;皂甙、含有疏水核的三萜结构的表面活性糖苷和与核相连的碳水化合物链,以及qs-21。细菌产物包括革兰氏阴性菌(例如来自分枝杆菌、短小棒状杆菌、肉芽肿棒状杆菌、百日咳博德特氏菌和脑膜炎奈瑟菌)的细胞壁肽聚糖或脂多糖、n-乙酰胞壁酰-l-丙氨酰-d-异谷氨酰胺(mdp)、来源于mdp(例如苏氨酰-mdp)的不同化合物、脂多糖(lps)(例如来自革兰氏阴性菌的细胞壁)、海藻糖二霉菌酸酯(tdm)和含有cpg基序的dna。油乳剂包括fia、montanide、助剂65、lipovant、montanide家族的油基佐剂和各种脂质体。在微粒和聚合物系统中,聚(dl-丙交酯-共乙交酯)微球已被广泛研究并可用于本文中。
[0553]
在一些实施方案中,另外的佐剂描述于jennings等人adjuvants and delivery systems for viral vaccines-mechanisms and potential。in:brown f,haaheim lr,(编辑).modulation of the immune response to vaccine antigens.dev.biol.stand,第92卷basel:karger 1998;19
–
28和/或sayers等人j biomed biotechnol.2012;2012:831486
和/或petrovsky和aguilar,immunology and cell biology(2004)82,488-496,所述文献的内容在此以引用的方式整体并入。
[0554]
施用/剂量/赋形剂
[0555]
根据本发明施用这些组合物可经由任何常见途径,只要靶组织可经由此途径达到。这包括口服、经鼻或含服。可选地,可通过皮内、皮下、肌肉内、腹膜内、门静脉内或静脉内注射,或通过直接注射到患病的例如癌症组织中来施用。本文所公开的剂还可通过导管系统施用。这样的组合物正常将作为如本文中所描述的药学上可接受的组合物施用。
[0556]
在实施方案中,本发明组合物胃肠外,例如关节内、静脉内、腹膜内、皮下或肌肉内施用。在实施方案中,药物组合物通过弹丸注射静脉内或腹膜内施用。
[0557]
在一些实施方案中,脂质-核酸组合物可以吸入肺部的气雾剂形式(参见,brigham等人,am.j.sci.298(4):278-281(1989)),任选地通过使用振动筛网式雾化器(例如但不限于,aerogen solo(galway,ireland))施用。在一些实施方案中,脂质-核酸组合物可通过在疾病部位直接注射施用(culver,human gene therapy,maryann liebert,inc.,publishers,new york.第70-71页(1994))。
[0558]
本文所述组合物的施用可以是例如通过注射、局部施用、眼部施用和鼻内施用。注射在一些实施方案中可与电力相关联(例如电穿孔,包括可用于电化学疗法的装置(例如cliniporator,igea srl,carpi[mo],italy))。局部施用可以是但不限于乳膏、洗剂、软膏、凝胶、喷雾剂、溶液等。局部施用还可包括渗透促进剂,诸如但不限于表面活性剂、脂肪酸、胆汁盐、螯合剂、非螯合非表面活性剂、聚氧乙烯-9-月桂基醚、聚氧乙烯-20-十六烷基醚、脂肪酸和/或与胆汁酸和/或胆汁盐组合的盐、与月桂酸、癸酸和udca组合的钠盐等。局部施用还可包括芳香剂、着色剂(colorant)、防晒剂、抗菌剂和/或保湿剂。本文所述的组合物可施用于至少一个部位,诸如但不限于前额、头皮、毛囊、头发、上眼睑、下眼睑、眉毛、睫毛、眶下区域、眶周区域、太阳穴、鼻子、鼻梁、脸颊、舌、鼻唇沟、嘴唇、眼周区域、下颌轮廓、耳朵、颈部、乳房、前臂、上臂、手掌、手、手指、指甲、背部、腹部、侧面、臀部、大腿、小腿、脚、脚趾等。
[0559]
施用途径包括例如:皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外、口服、舌下、脑内、阴道内、经皮、门静脉内、直肠、通过吸入、或局部,特别是耳、鼻、眼、或皮肤。在实施方案中,施用通过口服或通过胃肠外注射实现。
[0560]
在配制时,溶液可以可与剂量配制相容的方式并且以如治疗有效的量施用,如本文所述。制剂可容易以多种剂型,诸如可注射溶液、药物释放胶囊等施用。对于呈水溶液形式胃肠外施用,例如,溶液通常适当地经缓冲并且首先用例如足够的盐水或葡萄糖使液体稀释剂等渗。例如,此类水溶液可用于静脉内、肌肉内、皮下和腹膜内施用。优选地,采用本领域技术人员已知的,特别是根据本公开的无菌水性培养基。
[0561]
在实施方案中,局部施用核酸和本发明脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且将有效剂量施用至约4mm2至约150mm2(例如约或不超过约4mm2、或约5mm2、或约6mm2、或约7mm2、或约8mm2、或约10mm2、或约20mm2、或约50mm2、或约100mm2、或约150mm2)的表面积。在多个实施方案中,局部施用核酸和本发明脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且将有效剂量施用至不超过约4mm2、或约5mm2、或约6mm2、或约7mm2、或约8mm2、或约10mm2、或约
20mm2、或约50mm2、或约100mm2、或约150mm2的表面积。在多个实施方案中,局部施用核酸和本发明脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且将有效剂量施用至约4mm2、或约5mm2、或约6mm2、或约7mm2、或约8mm2、或约10mm2、或约20mm2、或约50mm2、或约100mm2、或约150mm2的表面积。
[0562]
在多个实施方案中,局部施用核酸和存在的脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且有效剂量(重量rna/注射表面积)为约35ng/cm2至约7000ng/cm2。在多个实施方案中,局部施用核酸和本发明脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且有效剂量(重量rna/注射表面积)不超过约35ng/cm2、或约50ng/cm2、或约75ng/cm2、或约100ng/cm2、或约125ng/cm2、或约150ng/cm2、或约175ng/cm2、或约200ng/cm2、或约225ng/cm2、或约250ng/cm2、或约500ng/cm2、或约1000ng/cm2、或约2000ng/cm2、或约5000ng/cm2、或约7000ng/cm2。在多个实施方案中,局部施用核酸和本发明脂质,任选地通过皮下注射、皮内注射、真皮下注射和肌肉内注射中的一种或多种,并且有效剂量(重量rna/注射表面积)为约35ng/cm2、或约50ng/cm2、或约75ng/cm2、或约100ng/cm2、或约125ng/cm2、或约150ng/cm2、或约175ng/cm2、或约200ng/cm2、或约225ng/cm2、或约250ng/cm2、或约500ng/cm2、或约1000ng/cm2、或约2000ng/cm2、或约5000ng/cm2、或约7000ng/cm2。
[0563]
在一些实施方案中,有效剂量为约100ng至约5000ng(例如,约或不超过约100ng、或200ng、或300ng、或400ng、或500ng、或600ng、或700ng、或800ng、或900ng、或1000ng、或1100ng、或1200ng、或1300ng、或1400ng、或1500ng、或1600ng、或1700ng、或1800ng、或1900ng、或2000ng、或3000ng、或4000ng、或5000ng)。在其他实施方案中,有效剂量小于约100ng。在某些实施方案中,有效剂量为约10ng至约100ng(例如,约或不超过约10ng、或20ng、或30ng、或40ng、或50ng、或60ng、或70ng、或80ng、或90ng、或100ng)。
[0564]
在一些实施方案中,有效剂量为约1.4ng/kg至约30ng/kg(例如,约或不超过约1.4ng/kg、或2.5ng/kg、或5ng/kg、或10ng/kg、或15ng/kg、或20ng/kg、或25ng/kg、或30ng/kg)。在其他实施方案中,有效剂量小于约1.5ng/kg。在某些实施方案中,有效剂量为约0.14ng/kg至约1.4ng/kg(例如,约或不超过约0.14ng/kg、或0.25ng/kg、或0.5ng/kg、或0.75ng/kg、或1ng/kg、或1.25ng/kg、或1.4ng/kg)。
[0565]
在一些实施方案中,有效剂量为约350ng/cm2至约7000ng/cm2(例如,约或不超过约350ng/cm2、或500ng/cm2、或750ng/cm2、或1000ng/cm2、或2000ng/cm2、或3000ng/cm2、或4000ng/cm2、或5000ng/cm2、或6000ng/cm2、或7000ng/cm2)。在其他实施方案中,有效剂量小于约350ng/cm2。在某些实施方案中,有效剂量为约35ng/cm2至约350ng/cm2(例如,约或不超过约35ng/cm2、或50ng/cm2、或75ng/cm2、或100ng/cm2、或150ng/cm2、或200ng/cm2、或250ng/cm2、或300ng/cm2、或350ng/cm2)。
[0566]
在一些实施方案中,包括合成rna的核酸药物的有效剂量为约1ng至约2000ng、或约10ng至约2000ng、或约100ng至约2000ng、或约200ng至约1900ng、或约300ng至约1800ng、或约400ng至约1700ng、或约500ng至约1600ng、或约600ng至约1500ng、或约700ng至约1400ng、或约800ng至约1300ng、或约900ng至约1200ng、或约1000ng至约1100ng、或约500ng至约2000ng、或约500ng至约1500ng、或约500ng至约1000ng、或约1000ng至约1500ng、或约1000ng至约2000ng、或约1500ng至约2000ng、或约100ng至约500ng、或约200ng至约400ng、
或约10ng至约100ng、或约20ng至约90ng、或约30ng至约80ng、或约40ng至约70ng、或约50ng至约60ng。
[0567]
在一些实施方案中,包括合成rna的核酸药物的有效剂量不超过约1ng、不超过约10ng、不超过约30ng、不超过约50ng、或约100ng、或约200ng、或约300ng、或约400ng、或约500ng、或约600ng、或约700ng、或约800ng、或约900ng、或约1000ng、或约1100ng、或约1200ng、或约1300ng、或约1400ng、或约1500ng、或约1600ng、或约1700ng、或约1800ng、或约1900ng、或约2000ng、或约3000ng、或约4000ng、或约5000ng。
[0568]
在一些实施方案中,包括合成rna的核酸药物的有效剂量为约1ng、或约10ng、或约30ng、或约50ng、或约100ng、或约200ng、或约300ng、或约400ng、或约500ng、或约600ng、或约700ng、或约800ng、或约900ng、或约1000ng、或约1100ng、或约1200ng、或约1300ng、或约1400ng、或约1500ng、或约1600ng、或约1700ng、或约1800ng、或约1900ng、或约2000ng、或约3000ng、或约4000ng、或约5000ng。
[0569]
在一些实施方案中,包括合成rna的核酸药物的有效剂量为约0.028pmol、或约0.05pmol、或约0.1pmol、或约0.2pmol、或约0.3pmol、或约0.4pmol、或约0.5pmol、或约0.6pmol、或约0.7pmol、或约0.8pmol、或约0.9pmol、或约1.0pmol、或约1.2pmol、或约1.4pmol、或约1.6pmol、或约1.8pmol、或约2.0pmol、或约2.2pmol、或约2.4pmol、或约2.6pmol、或约2.8pmol、或约3.0pmol、或约3.2pmol、或约3.4pmol、或约3.6pmol、或约3.8pmol、或约4.0pmol、或约4.2pmol、或约4.4pmol、或约4.6pmol、或约4.8pmol、或约5.0pmol、或约5.5pmol、或约5.7pmol。
[0570]
在一些实施方案中,包括合成rna的核酸药物以以下浓度施用:约0.1nm、或约0.25nm、或约0.5nm、或约0.75nm、或约1nm、或约2.5nm、或约5nm、或约7.5nm、或约10nm、或约20nm、或约30nm、或约40nm、或约50nm、或约60nm、或约70nm、或约80nm、或约90nm、或约100nm、或约110nm、或约120nm、或约150nm、或约175nm、或约200nm。
[0571]
在一些实施方案中,核酸药物的有效剂量为约350ng/cm2、或约500ng/cm2、或约750ng/cm2、或约1000ng/cm2、或约2000ng/cm2、或约3000ng/cm2、或约4000ng/cm2、或约5000ng/cm2、或约6000ng/cm2、或约7000ng/cm2。在其他实施方案中,有效剂量小于约350ng/cm2。在某些实施方案中,有效剂量为约35ng/cm2、或约50ng/cm2、或约75ng/cm2、或约100ng/cm2、或约150ng/cm2、或约200ng/cm2、或约250ng/cm2、或约300ng/cm2、或约350ng/cm2。
[0572]
在一些实施方案中,核酸药物的有效剂量为约35ng/cm2至约7000ng/cm2、或约50ng/cm2至约5000ng/cm2、或约100ng/cm2至约3000ng/cm2、或约500ng/cm2至约2000ng/cm2、或约750ng/cm2至约1500ng/cm2、或约800ng/cm2至约1200ng/cm2、或约900ng/cm2至约1100ng/cm2。
[0573]
在一些实施方案中,核酸药物的有效剂量为约1皮摩尔/cm2、或约2皮摩尔/cm2、或约3皮摩尔/cm2、或约4皮摩尔/cm2、或约5皮摩尔/cm2、或约6皮摩尔/cm2、或约7皮摩尔/cm2、或约8皮摩尔/cm2、或约9皮摩尔/cm2、或约10皮摩尔/cm2、或约12皮摩尔/cm2、或约14皮摩尔/cm2、或约16皮摩尔/cm2、或约18皮摩尔/cm2、或约20皮摩尔/cm2。在其他实施方案中,有效剂量小于约1皮摩尔/cm2。在某些实施方案中,有效剂量为约0.1皮摩尔/cm2、或约0.2皮摩尔/cm2、或约0.3皮摩尔/cm2、或约0.4皮摩尔/cm2、或约0.5皮摩尔/cm2、或约0.6皮摩尔/cm2、或约0.7皮摩尔/cm2、或约0.8皮摩尔/cm2、或约0.9皮摩尔/cm2、或约1皮摩尔/cm2。
[0574]
在一些实施方案中,核酸药物的有效剂量为约0.1皮摩尔/cm2至约20皮摩尔/cm2、或约0.2皮摩尔/cm2至约15皮摩尔/cm2、或约0.5皮摩尔/cm2至约10皮摩尔/cm2、或约0.8皮摩尔/cm2至约8皮摩尔/cm2、或约1皮摩尔/cm2至约5皮摩尔/cm2、或约2皮摩尔/cm2至约4皮摩尔/cm2。
[0575]
例如,本发明组合物可以呈药学上可接受的盐的形式。此类盐包括列于例如,j.pharma.sci.66,2-19(1977)和the handbook of pharmaceutical salts;properties,selection,and use.p.h.stahl和c.g.wermuth(编辑),verlag,zurich(switzerland)2002中的那些盐,所述文献在此以引用的方式整体并入。药学上可接受的盐的非限制性实例包括:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐(tartrate)、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡萄糖酸盐、葡萄糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐(methanesulfonate)、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、樟脑磺酸盐、双羟萘酸盐、苯乙酸盐、三氟乙酸盐、丙烯酸盐、氯苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、甲基苯甲酸盐、邻乙酰氧基苯甲酸盐、萘-2-苯甲酸盐、异丁酸盐、苯基丁酸盐、α-羟基丁酸盐、丁炔-1,4-二羧酸盐、己炔-1,4-二羧酸盐、癸酸盐、辛酸盐、肉桂酸盐、乙醇酸盐、庚酸盐、马尿酸盐、苹果酸盐、羟基马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐(mesylate)、烟酸盐、邻苯二甲酸盐、对苯二甲酸盐、丙炔酸盐、丙酸盐、苯丙酸盐、癸二酸盐、辛二酸盐、对溴苯磺酸盐、氯苯磺酸盐、乙基磺酸盐、2-羟乙基磺酸盐、甲基磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、1,5-萘磺酸盐、二甲苯磺酸盐、酒石酸盐(tartarate salt)、诸如钠、钾、锂的碱金属的氢氧化物;诸如钙和镁的碱土金属的氢氧化物;诸如铝和锌的其他金属的氢氧化物;氨和有机胺,诸如未取代或羟基取代的单、二或三烷基胺、二环己胺;三丁胺;吡啶;n-甲胺、n-乙胺;二乙胺;三乙胺;单、双或三(2-oh-低级烷基胺),诸如单、双或三(2-羟乙基)胺、2-羟基-叔丁胺、或三(羟甲基)甲胺、n,n-二-低级烷基-n-(羟基-低级烷基)-胺,诸如n,n-二甲基-n-(2-羟乙基)胺或三(2-羟乙基)胺;n-甲基-d-葡糖胺;以及氨基酸,诸如精氨酸、赖氨酸等。
[0576]
本发明药物组合物可包含赋形剂,其包括液体诸如水和油,其包括石油、动物、植物或合成来源的那些油,诸如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可以是例如盐水、阿拉伯树胶、明胶、淀粉糊、滑石、角蛋白、胶体二氧化硅、尿素等。另外,可以使用助剂、稳定剂、增稠剂、润滑剂以及着色剂(coloring agent)。在一个实施方案中,药学上可接受的赋形剂在施用于受试者时是无菌的。合适的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、乙二醇、水、乙醇等。如需要,本文所述的任何剂还可以包含少量的润湿剂或乳化剂或ph缓冲剂。
[0577]
受试者/患者/宿主
[0578]
说明性受试者或患者或宿主是指任何脊椎动物,包括但不限于人和其他灵长类动物(例如黑猩猩和其他猿和猴物种)、农场动物(例如牛、绵羊、猪、山羊和马)、家养哺乳动物(例如狗和猫)、实验室动物(例如啮齿动物,诸如小鼠、大鼠和豚鼠)和鸟类(例如家禽、野生鸟类和猎禽,诸如鸡、火鸡和其他鹑鸡类鸟、鸭、鹅等)。在实施方案中,受试者是哺乳动物。在实施方案中,受试者是人。在某些实施方案中,受试者是无脊椎动物。在其他实施方案中,
受试者是植物。
[0579]
试剂盒
[0580]
本发明还提供了可简化本文所述核酸转染的试剂盒。本发明的说明性试剂盒包含本发明化合物(例如式i-xvi的化合物)和/或药物组合物和/或脂质聚集体和/或脂质载剂中的一种或多种。所述试剂盒还可包括转染培养基、转染试剂和/或用于培养细胞的各种容器。
[0581]
定义
[0582]
如本文所用,术语“一种(个)”和“所述”通常被解释为涵盖单数和复数形式。
[0583]
术语“h”表示单个氢原子。例如,这种自由基可连接至氧原子以形成羟基。
[0584]
在单独使用术语“烷基”或在诸如“卤代烷基”或“烷基氨基”的其他术语中使用术语“烷基”时,其涵盖具有一至约二十个碳原子的直链或支链基团,表示为c
1-c
20
烷基。此类基团的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基等。术语“亚烷基(alkylenyl)”、“亚烷基(alkylene)”或“烷二基”包括桥连二价烷基,例如亚甲基或亚乙基。
[0585]
术语“烯基”涵盖具有至少一个碳-碳双键的二至约六十个碳原子的直链或支链基团。在某些情况下,“烯基”基团具有两个碳-碳双键,它们可以是共轭的或不共轭的。在一些情况下,“烯基”基团具有超过两个碳-碳双键,它们可独立地是共轭的或不共轭的。在一些情况下,“烯基”基团具有至少一个碳-碳双键和至少一个碳-碳三键,它们可以是共轭的或不共轭的。烯基的实例包括乙烯基、丙烯基、烯丙基、丙烯基、丁烯基和4-甲基丁烯基。术语“烯基”涵盖具有“顺式”和“反式”取向,或者,可选地“e”和“z”取向的基团。
[0586]
术语“炔基”表示具有至少一个碳-碳三键并具有两个至约六十个碳原子的直链或支链基团。此类基团的实例包括炔丙基和丁炔基等。
[0587]
烷基、亚烷基、烯基和炔基可任选地被一种或多种官能团取代,诸如卤基、羟基、硝基、氨基、氰基、卤代烷基、芳基、杂芳基和杂环基等。
[0588]
术语“卤基”意指卤素,诸如氟、氯、溴或碘原子。
[0589]
术语“卤代烷基”涵盖其中烷基碳原子中的任何一个或多个被如上定义的卤基取代的基团。具体涵盖单卤代烷基、二卤代烷基和多卤代烷基,其包括全卤代烷基。例如,单卤代烷基可在基团内具有碘、溴、氯或氟原子。二卤代和多卤代烷基可具有相同的卤原子中的两个或更多个或不同卤基的组合。甚至更优选的是具有一至三个碳原子的低级卤代烷基。卤代烷基的实例包括氟甲基、二氟甲基、三氟甲基、氯甲基、二氯甲基、三氯甲基、五氟乙基、七氟丙基、二氟氯甲基、二氯氟甲基、二氟乙基、二氟丙基、二氯乙基和二氯丙基。
[0590]
术语“羟基烷基”涵盖具有一至约十个碳原子的直链或支链烷基,其中任一个可被一个或多个羟基取代。此类基团的实例包括羟甲基、羟乙基、羟丙基、羟丁基和羟己基。
[0591]
术语“烷氧基”包括直链或支链的含氧基基团,每个基团具有一至约二十个碳原子的烷基部分。此类基团的实例包括甲氧基、乙氧基、丙氧基、丁氧基和叔丁氧基。甚至更优选的是具有一至十二个碳原子的低级烷氧基。烷氧基可进一步被一个或多个诸如氟、氯或溴的卤原子取代,以提供“卤代烷氧基”基团。此类基团的实例包括氟甲氧基、氯甲氧基、三氟甲氧基、三氟乙氧基、氟乙氧基和氟丙氧基。
[0592]
单独或组合中的术语“芳基”意指含有一个或两个环的碳环芳族体系,其中此类环
可以稠合方式连接在一起。术语“芳基”涵盖芳族基团,诸如苯基、萘基、茚基、四氢萘基和茚满基。更优选的芳基是苯基。“芳基”基团可具有1个或多个取代基,诸如烷基、羟基、卤基、卤代烷基、硝基、氰基、烷氧基和烷基氨基等。术语“亚芳基”涵盖桥连二价芳基,诸如亚苄基、亚苯基等。
[0593]
术语“杂环基(heterocyclyl)”(或“杂环基(heterocyclo)”)涵盖饱和的、部分饱和的和不饱和的含杂原子的环基,其中所述杂原子可选自氮、硫和氧。“杂环基”基团可具有1至4个取代基,诸如羟基、boc、卤基、卤代烷基、氰基、低级烷基、低级芳烷基、氧代、低级烷氧基、氨基和低级烷基氨基。
[0594]
饱和杂环基团的实例包括,含有1至4个氮原子的饱和3至6元杂单环基团[例如吡咯烷基、咪唑烷基、哌啶基、吡咯啉基、哌嗪基];含有1至2个氧原子和1至3个氮原子的饱和3至6元杂单环基团[例如吗啉基];含有1至2个硫原子和1至3个氮原子的饱和3至6元杂单环基团[例如噻唑烷基]。部分饱和的杂环基的实例包括二氢噻吩基、二氢吡喃基、二氢呋喃基和二氢噻唑基。
[0595]
不饱和杂环基团(也称为“杂芳基”基团)的实例包括含有1至4个氮原子的不饱和5至6元杂单环基,例如吡咯基、咪唑基、吡唑基、2-吡啶基、3-吡啶基、4-吡啶基、嘧啶基、吡嗪基、哒嗪基、三唑基[例如4h-1,2,4-三唑基、1h-1,2,3-三唑基、2h-1,2,3-三唑基];含有氧原子的不饱和5至6元杂单环基团,例如吡喃基、2-呋喃基、3-呋喃基等;含有硫原子的不饱和5至6元杂单环基团,例如2-噻吩基、3-噻吩基等;含有1至2个氧原子和1至3个氮原子的不饱和5至6元杂单环基团,例如噁唑基、异噁唑基、噁二唑基[例如1,2,4-噁二唑基、1,3,4-噁二唑基、1,2,5-噁二唑基];含有1至2个硫原子和1至3个氮原子的不饱和5至6元杂单环基团,例如噻唑基、噻二唑基[例如1,2,4-噻二唑基、1,3,4-噻二唑基、1,2,5-噻二唑基]。
[0596]
术语杂环基(或杂环)还涵盖其中杂环基团与芳基稠合/缩合的基团:含有1至5个氮原子的不饱和稠合杂环基,例如,吲哚基、异吲哚基、吲哚嗪基、苯并咪唑基、喹啉基、异喹啉基、吲唑基、苯并三唑基、四唑并哒嗪基[例如四唑并[1,5-b]哒嗪基];含有1至2个氧原子和1至3个氮原子的不饱和稠合杂环基[例如苯并噁唑基、苯并噁二唑基];含有1至2个硫原子和1至3个氮原子的不饱和稠合杂环基[例如苯并噻唑基、苯并噻二唑基];以及含有1至2个氧或硫原子的饱和、部分不饱和和不饱和稠合杂环基[例如苯并呋喃基、苯并噻吩基、2,3-二氢-苯并[1,4]二氧杂环己二烯基和二氢苯并呋喃基]。优选的杂环基团包括五至十元稠合或非稠合基团。杂芳基的更优选实例包括喹啉基、异喹啉基、咪唑基、吡啶基、噻吩基、噻唑基、噁唑基、呋喃基和吡嗪基。其他优选的杂芳基是含有一个或两个选自硫、氮和氧的杂原子的5或6元杂芳基,其选自噻吩基、呋喃基、吡咯基、吲唑基、吡唑基、噁唑基、三唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、吡啶基、哌啶基和吡嗪基。
[0597]
不含氮的杂芳基的具体实例包括吡喃基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、苯并呋喃基和苯并噻吩基等。
[0598]
部分饱和和饱和杂环基的具体实例包括吡咯烷基、咪唑烷基、哌啶基、吡咯啉基、吡唑烷基、哌嗪基、吗啉基、四氢吡喃基、噻唑烷基、二氢噻吩基、2,3-二氢-苯并[1,4]二噁烷基、吲哚啉基、异吲哚啉基、二氢苯并噻吩基、二氢苯并呋喃基、异色原烷基、色原烷基、1,2-二氢喹啉基、1,2,3,4-四氢-异喹啉基、1,2,3,4-四氢-喹啉基、2,3,4,4a,9,9a-六氢-1h-3-氮杂-芴基、5,6,7-三氢-1,2,4-三唑并[3,4-a]异喹啉基、3,4-二氢-2h-苯并[1,4]噁嗪
基、苯并[1,4]二噁烷基、2,3-二氢-1h-1λ'-苯并[d]异噻唑-6-基、二氢吡喃基、二氢呋喃基和二氢噻唑基等。
[0599]
术语“杂环基”因此涵盖以下环系:
[0600]
[0601]
[0602][0603]
等。
[0604]
术语“羰基”,无论是单独使用还是与其他术语一起使用(诸如“氨基羰基”),均表示-(c=o)-。
[0605]
术语“杂环基亚烷基”和“杂环基烷基”涵盖杂环取代的烷基。更优选的杂环基烷基是具有一至六个碳原子的烷基部分和5或6元杂芳基的“5或6元杂芳基烷基”基团。甚至更优选的是具有一至三个碳原子的烷基部分的低级杂芳基亚烷基。实例包括如吡啶基甲基和噻吩基甲基的此类基团。
[0606]
术语“环烷基”包括饱和碳环基团。优选的环烷基包括c
3-c6环。更优选的化合物包括环戊基、环丙基和环己基。
[0607]
术语“环烯基”包括具有一个或多个碳-碳双键的碳环基团,其包括“环烷基二烯基”化合物。优选的环烯基包括c
3-c6环。更优选的化合物包括例如环戊烯基、环戊二烯基、环己烯基和环庚二烯基。
[0608]
术语“脂质”涵盖但不限于不溶于水但溶于有机溶剂、来源于天然来源和/或合成生产的生物分子,以及这种生物分子的非天然类似物和衍生物。脂质的实例包括但不限于另外描述为“类脂质(lipid-like)”或“类脂质(lipidoid)”的化合物,以及式i-xvi的化合物。脂质的其他实例包括但不限于包含天然脂质的合成分子、其衍生物及其类似物,即使所述合成分子本身是水溶性的。脂质的其他实例包括但不限于包含一个或多个c
5-c
20
烷基、甾醇、脂肪酸的分子及其类似物和衍生物。
[0609]“分子”意指分子实体(分子、离子、复合物等)。
[0610]“rna分子”意指包含rna的分子。
[0611]“合成rna分子”意指在细胞外产生或使用生物工程在细胞内产生的rna分子,作为非限制性实例,在体外转录反应中产生的rna分子、通过直接化学合成产生的rna分子或在基因工程化的大肠杆菌细胞中产生的rna分子。
[0612]“转染”意指使细胞与分子接触,其中分子被细胞内化。
[0613]“转染时”意指转染期间或之后。
[0614]“培养基”意指溶剂或包含溶剂和溶质的溶液,作为非限制性实例,达尔伯克氏改良伊格尔培养基(dulbecco’s modified eagle’smedium)(dmem)、dmem+10%胎牛血清(fbs)、盐水或水。
[0615]“复合培养基”意指向其中添加转染试剂和待转染的分子并且其中转染试剂与待转染的分子缔合的培养基。
[0616]“转染培养基”意指可用于转染的培养基,作为非限制性实例,达尔伯克氏改良伊格尔培养基(dmem)、dmem/f12、盐水或水。
[0617]“重组蛋白”意指不是在动物或人中产生的蛋白质或肽。非限制性的实例包括在细菌中产生的人转铁蛋白、在小鼠细胞的体外培养物中产生的人纤连蛋白以及在稻米植物中产生的人血清白蛋白。
[0618]“oct4蛋白”意指由pou5f1基因编码的蛋白或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体,作为非限制性实例,人oct4蛋白(seq id no:8)、小鼠oct4蛋白、oct1蛋白、pou5f1假基因2编码的蛋白、oct4蛋白的dna结合结构域或oct4-gfp融合蛋白。在实施方案中,oct4蛋白包含与seq id no:8具有至少70%同一性的氨基酸序列,或在其他实施方案中,与seq id no:8具有至少75%、80%、85%、90%、或95%的同一性。在实施方案中,oct4蛋白包含相对于seq id no:8具有1至20个氨基酸插入、缺失或取代(总起来说)的氨基酸序列。或者在其他实施方案中,oct4蛋白包含相对于seq id no:8具有1至15个或1至10个氨基酸插入、缺失或取代(总起来说)的氨基酸序列。
[0619]“sox2蛋白”意指由sox2基因编码的蛋白或其天然或工程化的变体、家族成员、直向同源物、片段或融合构建体,作为非限制性实例,人sox2蛋白(seq id no:9)、小鼠sox2蛋白、sox2蛋白的dna结合结构域或sox2-gfp融合蛋白。在实施方案中,sox2蛋白包含与seq id no:9具有至少70%同一性的氨基酸序列,或者在其他实施方案中,与seq id no:9具有至少75%、80%、85%、90%、或95%的同一性。在实施方案中,sox2蛋白包含相对于seq id no:9具有1至20个氨基酸插入、缺失或取代(总计)的氨基酸序列。或者在其他实施方案中,sox2蛋白包含相对于seq id no:9具有1至15个或1至10个氨基酸插入、缺失或取代(总计)的氨基酸序列。
[0620]“klf4蛋白”意指由klf4基因编码的蛋白或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体,作为非限制性实例,人klf4蛋白(seq id no:10)、小鼠klf4蛋白、klf4蛋白的dna结合结构域或klf4-gfp融合蛋白。在实施方案中,klf4蛋白包含与seq id no:10具有至少70%同一性的氨基酸序列,或者在其他实施方案中,与seq id no:10具有至少75%、80%、85%、90%、或95%的同一性。在实施方案中,klf4蛋白包含相对于seq id no:10具有1至20个氨基酸插入、缺失或取代(总计)的氨基酸序列。或者在其他实施方案中,klf4蛋白包含相对于seq id no:10具有1至15个或1至10个氨基酸插入、缺失或取代(总计)的氨基酸序列。
[0621]“c-myc蛋白”意指由myc基因编码的蛋白或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体,作为非限制性实例,人c-myc蛋白(seq id no:11)、小鼠c-myc蛋白、l-myc蛋白、c-myc(t58a)蛋白、c-myc蛋白的dna结合结构域或c-myc-gfp融合蛋白。在
实施方案中,c-myc蛋白包含与seq id no:11具有至少70%同一性的氨基酸序列,或者在其他实施方案中,与seq id no:11具有至少75%、80%、85%、90%、或95%的同一性。在实施方案中,c-myc蛋白包含相对于seq id no:11具有1至20个氨基酸插入、缺失或取代(总计)的氨基酸。或者在其他实施方案中,c-myc蛋白包含相对于seq id no:11具有1至15个或1至10个氨基酸插入、缺失或取代(总计)的氨基酸序列。
[0622]“重编程”意指引起细胞的表型变化,作为非限制性实例,引起β-细胞祖细胞分化为成熟β-细胞、引起成纤维细胞去分化为多能干细胞、引起角质形成细胞转分化为心脏干细胞、引起细胞的端粒延长或引起神经元的轴突生长。
[0623]“重编程因子”意指当细胞与分子接触和/或细胞表达所述分子时,可单独或与其他分子组合引起重编程的分子,作为非限制性实例,oct4蛋白、tert蛋白或促红细胞生成素。
[0624]“生殖细胞”意指精细胞或卵细胞。
[0625]“多能干细胞”意指在体内可分化为具有所有三个胚层(内胚层、中胚层和外胚层)的细胞的细胞。
[0626]“体细胞”意指不是多能干细胞或生殖细胞的细胞,作为非限制性实例,皮肤细胞。
[0627]“造血细胞”意指血细胞或可分化为血细胞的细胞,作为非限制性实例,造血干细胞或白细胞。
[0628]“心脏细胞”意指心脏细胞或可分化为心脏细胞的细胞,作为非限制性实例,心脏干细胞或心肌细胞。
[0629]“视网膜细胞”意指视网膜的细胞或可分化为视网膜的细胞的细胞,作为非限制性实例,视网膜色素上皮细胞。
[0630]“皮肤细胞”意指常见于皮肤中的细胞,作为非限制性实例,成纤维细胞、角质形成细胞、黑色素细胞、脂肪细胞、间质干细胞、脂肪干细胞或血细胞。
[0631]“免疫抑制剂”意指可抑制免疫系统的一个或多个方面的物质,并且所述物质通常不存在于哺乳动物中,作为非限制性实例,b18r或地塞米松。
[0632]“单链断裂”意指其中连接核苷酸的共价键中的一个或多个在一个或两个链之一中断裂的单链或双链dna的区域。
[0633]“双链断裂”意指其中连接核苷酸的共价键中的一个或多个在两个链的每个链中断裂的双链dna的区域。
[0634]“核苷酸”意指核苷酸或其片段或衍生物,作为非限制性实例,核碱基、核苷、核苷酸-三磷酸等。
[0635]“核苷”意指核苷酸或其片段或衍生物,作为非限制性实例,核碱基、核苷、核苷酸-三磷酸等。
[0636]“基因编辑”意指作为非限制性实例,通过用引起细胞dna突变的蛋白质转染细胞或通过用引起细胞dna化学变化的蛋白质转染细胞来改变细胞的dna序列。
[0637]“基因编辑蛋白”意指可单独或与一个或多个其他分子组合改变细胞dna序列的蛋白质,作为非限制性实例,核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、wo2014/071219a1中公开的基因编辑蛋白(所述专利的全部内容以引用的方式并入本文),成簇规律间隔短回文重复序列(crispr)相关蛋白、dna修复蛋白、dna
修饰蛋白、碱基修饰蛋白、dna甲基转移酶、引起dna去甲基化的蛋白质、以dna为底物的酶或其天然或工程化变体、家族成员、直向同源物、结构域、片段或融合构建体。
[0638]“修复模板”意指含有与距离基因编辑蛋白的靶位点10kb以内的序列具有至少约70%同源性的区域的核酸。
[0639]“重复序列”意指在蛋白质中以多于一个拷贝存在的氨基酸序列,同源性在至少约10%以内,作为非限制性实例,转录激活因子样效应子的单体重复。
[0640]“dna结合结构域”意指能够结合dna分子的分子区域,作为非限制性实例,包含一个或多个锌指的蛋白质结构域、包含一个或多个转录激活因子样(tal)效应子重复序列的蛋白质结构域或能够与dna分子结合的小分子的结合口袋。
[0641]“结合位点”意指能够被基因编辑蛋白、dna结合蛋白、dna结合结构域或其生物活性片段或变体识别的核酸序列,或基因编辑蛋白、dna结合蛋白、dna结合结构域或其生物活性片段或变体对其具有高亲和力的核酸序列,作为非限制性实例,人birc5基因的外显子1中的约20个碱基对的dna序列。
[0642]“靶标”意指含有结合位点的核酸。
[0643]“脂质体”意指含有两亲分子、疏水分子或它们的混合物的实体,其在水性环境中至少暂时稳定,作为非限制性实例,胶束、具有水性内部的单层双层、多层双层、脂质纳米颗粒、与一种或多种核酸复合的前述物质中的任一种、或稳定的核酸脂质颗粒。
[0644]“peg化”意指与任何长度或任何分子量的聚(乙二醇)链共价或以其他方式稳定结合。
[0645]
lipofectin是n-[1-(2,3-二油氧基)丙基]-n,n,n-三甲基氯化铵(dotma)和二油酰基磷脂酰乙醇胺(dope)的1:1(w/w)混合物。
[0646]
lipofectamine是聚阳离子脂质、2,3-二油氧基-n-[2(精胺羧酰胺基)乙基]-n,n-二甲基-1-丙胺三氟乙酸盐(dospa)和dope的3:1(w/w)混合物。
[0647]
lipofectamine 2000是聚阳离子脂质n1,n
4-二肉豆蔻基-n1,n
4-二-(2-羟基-3-氨基丙基)-二氨基丁烷(dhdms)和胆固醇的2:3混合物。
[0648]
lipofectamine 3000是聚阳离子脂质(dhdms)和二油酰基磷脂酰乙醇胺(dope)的1:1混合物。
[0649]“dlindhs”或“dhdlins”意指n1,n
4-二亚油基-n1,n
4-二-(2-羟基-3-氨基丙基)-二氨基丁烷。
[0650]
本发明还通过以下非限制性实施例进行说明。
[0651]
编号的实施方案
[0652]
实施方案1:式(i)化合物
[0653]
[0654]
其中:q1、q2、q3和q4独立地是能够带正电荷的原子或基团;
[0655]
a1和a2独立地是空、h或任选取代的c
1-c6烷基;
[0656]
l1、l2和l3独立地是空、键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基或上述任选地通过醚、酯、酸酐、酰胺、氨基甲酸酯、仲胺、叔胺、季铵、硫醚、脲、羰基或亚胺中的一种或多种连接的任何组合;
[0657]
r1、r2、r3、r4、r5、r6、r7和r8独立地是空、h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r1、r2、r3、r4、r5、r6、r7和r8中的至少一个包含至少两个不饱和键;并且
[0658]
x、y和z独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0659]
实施方案2:实施方案1的化合物,其中q1、q2、q3和q4独立地是n、b、p或fe。
[0660]
实施方案3:实施方案2的化合物,其中q1、q2、q3和q4是n。
[0661]
实施方案4:实施方案3的化合物,其中q1、q2、q3和q4独立地是伯胺、仲胺或叔胺。
[0662]
实施方案5:实施方案4的化合物,其中q1和q4是伯胺,并且q2和q3是叔胺。
[0663]
实施方案6:实施方案1的化合物,其中l1、l2和l3独立地是(c
1-c6)烷二基或(羟基)(c
1-c6)烷二基。
[0664]
实施方案7:实施方案6的化合物,其中l1和l3独立地是(羟基)(c
1-c6)烷二基,并且l2是(c
1-c6)烷二基。
[0665]
实施方案8:实施方案7的化合物,其中l1和l3是2-羟基丙二基,并且l2是(c
1-c6)烷二基。
[0666]
实施方案9:实施方案8的化合物,其中l1和l3是2-羟基丙二基,并且l2是丁二基。
[0667]
实施方案10:实施方案1的化合物,其中r1、r2、r3、r4、r5、r6、r7和r8中的一个或多个独立地选自h、亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0668]
实施方案11:实施方案1的化合物,其中r1、r2、r3、r4、r5、r6、r7和r8中的两个或更多个独立地选自h、亚油酰基、α-亚麻酰基、γ-亚麻酰基、亚麻油酰基、花生四烯酰基、二十碳五烯酰基和二十二碳六烯酰基。
[0669]
实施方案12:实施方案1的化合物,其中r1、r2、r3、r4、r5、r6、r7和r8中的一个或多个独立地选自h、肉豆蔻油基、棕榈油基、十六碳烯基(sapienyl)、油基、反油基(elaidyl)、十八碳烯基(vaccenyl)、芥基(erucyl)、辛基(caprylyl)、己基(capryl)、月桂基(lauryl)、肉豆蔻基(myristyl)、棕榈基(palmityl)、硬脂基(stearyl)、花生基(arachidyl)、山嵛基(behenyl)、木蜡基(lignoceryl)和蜡油基(cerotyl)。
[0670]
实施方案13:实施方案1的化合物,其中r1、r2、r3、r4、r5、r6、r7和r8中的两个或更多个独立地选自h、肉豆蔻油酰基、棕榈油酰基、十六碳烯酰基(sapienoyl)、油酰基、反油酰基(elaidoyl)、十八碳烯酰基(vaccenoyl)、芥酰基(erucoyl)、辛酰基(capryloyl)、己酰基(caproyl)、月桂酰基(lauroyl)、肉豆蔻酰基(myristoyl)、棕榈酰基(palmitoyl)、硬脂酰基(stearoyl)、花生酰基(arachidoyl)、山萮酰基(behenoyl)、木蜡酰基(lignoceroyl)和
蜡油酰基(cerotoyl)。
[0671]
实施方案14:实施方案10的化合物,其中r1、r2、r3、r5、r7、r8是h,并且r4和r6独立地选自亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0672]
实施方案15:实施方案14的化合物,其中r1、r2、r3、r5、r7和r8是h,并且r4和r6是α-亚麻基。
[0673]
实施方案16:实施方案14的化合物,其中r1、r2、r3、r5、r7和r8是h,并且r4和r6是亚油基。
[0674]
实施方案17:如实施方案1所述的化合物,其中x和z独立地是0或1,并且y是1。
[0675]
实施方案18:实施方案1的化合物,其中q1和q4是伯胺;q2和q3是叔胺;l1和l3是2-羟基丙二基;l2是丁二基;r1、r2、r3、r5、r7和r8是h,并且r4和r6是亚油基;并且x、y和z是1。
[0676]
实施方案19:实施方案1的化合物,其中l1、l2和l3中的一个或多个包含至少一个酯部分。
[0677]
实施方案20:实施方案1的化合物,其中r2和r4中的一个或多个包含至少一个酯部分。
[0678]
实施方案21:实施方案1的化合物,其中a1和a2是h。
[0679]
实施方案22:式(ii)化合物
[0680][0681]
其中:r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、r
21
、r
22
、r
23
、r
24
、r
25
、r
26
、r
27
和r
28
独立地是h、卤基、oh、(c
1-c6)烷基、(卤基)(c
1-c6)烷基、(羟基)(c
1-c6)烷基、(烷氧基)(c
1-c6)烷基、芳基、杂芳基、环烷基或杂环基;
[0682]
i、j、k、m、s和t独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0683]
实施方案23:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h或(c
1-c6)烷基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0684]
实施方案24:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r12
、r
13
和r
14
独立地是h或(c
1-c6)烷基;r
27
和r
28
是甲基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0685]
实施方案25:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0686]
实施方案26:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是8;i是8;s是1;j是1;k是4;并且t是4。
[0687]
实施方案27:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是9;i是9;s是1;j是1;k是4;并且t是4。
[0688]
实施方案28:实施方案22的化合物,其中r
15
、r
16
、r
17
、r
18
、r
19
和r
20
是h;r9、r
10
、r
11
、r
12
、r
13
和r
14
独立地是h;r
27
和r
28
是甲基;r
21
、r
22
、r
23
、r
24
、r
25
和r
26
是h;m是9;i是9;s是1;j是1;k是3;并且t是3。
[0689]
实施方案29:式(iii)化合物:
[0690][0691]
其中l4、l5、l6和l7独立地是键、(c
1-c
20
)烷二基、(卤基)(c
1-c
20
)烷二基、(羟基)(c
1-c
20
)烷二基、(烷氧基)(c
1-c
20
)烷二基、亚芳基、杂亚芳基、环烷二基、杂环-二基、-(ch2)
v1-c(o)-、-((ch2)
v1-o)
v2-或
–
((ch2)
v1-c(o)-o)
v2-;
[0692]r29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h、(c
1-c
60
)烷基、(卤基)(c
1-c
60
)烷基、(羟基)(c
1-c
60
)烷基、(烷氧基)(c
1-c
60
)烷基、(c
2-c
60
)烯基、(卤基)(c
2-c
60
)烯基、(羟基)(c
2-c
60
)烯基、(烷氧基)(c
2-c
60
)烯基、(c
2-c
60
)炔基、(卤基)(c
2-c
60
)炔基、(羟基)(c
2-c
60
)炔基、(烷氧基)(c
2-c
60
)炔基,其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少一个包含至少两个不饱和键;
[0693]
v、v1和v2独立地是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0694]
实施方案30:实施方案29的化合物,其中l4、l5、l6和l7是
–
(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0695]
实施方案31:实施方案29的化合物,其中l4和l5是
–
(ch2)
3-;l6和l7是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0696]
实施方案32:实施方案29的化合物,其中l4和l6是
–
(ch2)
3-;l5和l7是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0697]
实施方案33:实施方案29的化合物,其中l4和l7是
–
(ch2)
3-;l5和l6是
–
(ch2)
4-;r
29
、r30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0698]
实施方案34:实施方案29的化合物,其中l4和l6是
–
(ch2)
3-;l5和l7是
–
(ch2)
5-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0699]
实施方案35:实施方案29的化合物,其中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少两个包含至少两个不饱和键。
[0700]
实施方案36:实施方案29的化合物,其中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
3-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0701]
实施方案37:实施方案29的化合物,其中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
4-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0702]
实施方案38:实施方案29的化合物,其中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
5-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0703]
实施方案39:实施方案29的化合物,其中,l4和l7是(羟基)(c
1-c
20
)烷二基;l5和l6是
–
(ch2)
6-;r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
独立地是h或(c
2-c
60
)烯基;v是1;其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的至少三个包含至少两个不饱和键。
[0704]
实施方案40:实施方案29的化合物,其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的两个或更多个独立地选自h、肉豆蔻油酰基、棕榈油酰基、十六碳烯酰基、油酰基、反油酰基、十八碳烯酰基、芥酰基、辛酰基、己酰基、月桂酰基、肉豆蔻酰基、棕榈酰基、硬脂酰基、花生酰基、山萮酰基、木蜡酰基和蜡油酰基。
[0705]
实施方案41:实施方案29的化合物,其中r
29
、r
30
、r
31
、r
32
、r
33
、r
34
和r
35
中的两个或更多个独立地选自h、亚油基、α-亚麻基、γ-亚麻基、亚麻油基、花生四烯基、二十碳五烯基和二十二碳六烯基。
[0706]
实施方案42:实施方案中29的化合物,其中l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
3-;并且v是1。
[0707]
实施方案43:实施方案中29的化合物,其中l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
4-;并且v是1。
[0708]
实施方案44:实施方案中29的化合物,其中l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
5-;并且v是1。
[0709]
实施方案45:实施方案中29的化合物,其中l4和l7是2-羟基丙二基;l2是丁二基;r
29
、r
30
、r
31
和r
32
是h;r
33
、r
34
和r
35
是亚油基;l5和l6是
–
(ch2)
6-;并且v是1。
[0710]
实施方案46:一种式(iv)化合物:
[0711][0712]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0713]
实施方案47:式(v)化合物:
[0714][0715]
实施方案48:式(vi)化合物:
[0716][0717]
实施方案49:式(vii)化合物:
[0718][0719]
实施方案50:式(viii)化合物:
[0720][0721]
实施方案51:式(ix)化合物:
[0722][0723]
实施方案52:式(x)化合物:
[0724][0725][0726]
实施方案53:式(xi)化合物:
[0727][0728]
实施方案54:式(xii)化合物:
[0729][0730]
实施方案55:式(xiii)化合物:
[0731][0732]
实施方案56:式(xiv)化合物:
[0733][0734]
实施方案57:式(xv)化合物:
[0735][0736]
其中n是1、2、3、4、5、6、7、8、9、10、11、12、13、14或15。
[0737]
实施方案58:式(xvi)化合物:
[0738]
[0739]
实施方案59:一种药物组合物,其包含如实施方案1-58中任一项所述的化合物和药学上可接受的载剂或赋形剂。
[0740]
实施方案60:一种脂质聚集体,其包含如实施方案1-58中任一项所述的化合物或如实施方案59所述的药物组合物。
[0741]
实施方案61:如实施方案60所述的脂质聚集体,其中所述脂质聚集体不包含一种或多种额外脂质或聚合物。
[0742]
实施方案62:如实施方案60所述的脂质聚集体,其还包含一种或多种选自表1的额外脂质或聚合物。
[0743]
实施方案63:如实施方案60或61所述的脂质聚集体,其中所述一种或多种额外脂质是中性脂质。
[0744]
实施方案64:如实施方案63所述的脂质聚集体,其中所述中性脂质是二油酰基磷脂酰乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)或胆固醇。
[0745]
实施方案65:如实施方案63所述的脂质聚集体,其中所述中性脂质包含dope或胆固醇。
[0746]
实施方案66:如实施方案63所述的脂质聚集体,其中所述中性脂质包含dope和胆固醇。
[0747]
实施方案67:如实施方案63所述的脂质聚集体,其中所述化合物包含式(iv)。
[0748]
实施方案68:如实施方案60-67中任一项所述的脂质聚集体,其中所述一种或多种额外脂质是阳离子脂质。
[0749]
实施方案69:如实施方案68所述的脂质聚集体,其中阳离子脂质是n-[1-(2,3-二油酰基氧基)丙基]-n,n,n-三甲基氯化铵(dotma)、1,2-双(油酰基氧基)-3-3-(三甲基铵)丙烷(dotap)或1,2-二油酰基-3-二甲基铵-丙烷(dodap)。
[0750]
实施方案70:如实施方案60-69中任一项所述的脂质聚集体,其还包含比率为约1:1的dotma和dope和/或比率约为1:1的n1,n4-二油酰基-n1,n4-二-(2-羟基-3-氨基丙基)-二氨基丁烷(dhdos)和dope。
[0751]
实施方案71:如实施方案60所述的脂质聚集体,其还包含具有式(a)的化合物:
[0752][0753]
其中
[0754]
r1和r4是具有17个碳原子的直链烯基;
[0755]
r2和r5是-(ch2)p-nh2,其中p是1-4;
[0756]
l是1-10;并且
[0757]
xa是生理上可接受的阴离子。
[0758]
实施方案72:如实施方案1-71中任一项所述的化合物、药物组合物或脂质聚集体,其还包含peg化脂质。
[0759]
实施方案73:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中z均粒径为约50nm至约2000nm。
[0760]
实施方案74:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中z均粒径为约700nm至约1500nm。
[0761]
实施方案75:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中z均粒径为约750nm。
[0762]
实施方案76:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中z均粒径小于约200nm。
[0763]
实施方案77:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中形成所述化合物、药物组合物或脂质聚集体的培养基的参数用于控制z均粒径。
[0764]
实施方案78:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中形成所述化合物、药物组合物或脂质聚集体的培养基的离子强度用于控制z均粒径。
[0765]
实施方案79:如实施方案1-72中任一项所述的化合物、药物组合物或脂质聚集体,其中形成此类化合物、药物组合物或脂质聚集体的培养基的ph用于控制z均粒径。
[0766]
实施方案80:如实施方案1-71中任一项所述的化合物、药物组合物或脂质聚集体,其中形成所述化合物、药物组合物或脂质聚集体的培养基的离子强度用于保持粒径小于或等于200nm。
[0767]
实施方案81:如实施方案1-80中任一项所述的化合物、药物组合物或脂质聚集体,其还包含稳定的颗粒分散体。
[0768]
实施方案82:如实施方案81所述的化合物、药物组合物或脂质聚集体,其中所述稳定的分散体具有约7.0至约8.0的ph,或约7.4的ph。
[0769]
实施方案83:如实施方案1-82中任一项所述的药物组合物或脂质聚集体,其还包含胰岛素、转铁蛋白和/或白蛋白。
[0770]
实施方案84:如实施方案1-83中任一项所述的化合物、药物组合物或脂质聚集体,其还包含核酸。
[0771]
实施方案85:如实施方案4所述的化合物、药物组合物或脂质聚集体,其中所述核酸是dna或rna。
[0772]
实施方案86:如实施方案85所述的化合物、药物组合物或脂质聚集体,其中rna是合成rna。
[0773]
实施方案87:如实施方案86所述的化合物、药物组合物或脂质聚集体,其中所述合成rna不包含非典型核苷酸。
[0774]
实施方案88:如实施方案86所述的化合物、药物组合物或脂质聚集体,其中所述合成rna包含任选地避免实质性细胞毒性的非典型核苷酸的组合。
[0775]
实施方案89:如实施方案88所述的化合物、药物组合物或脂质聚集体,其中所述非典型核苷酸在选自嘧啶的2c、4c和5c位置或选自嘌呤的6c、7n和8c位置的位置处具有一个
或多个取代。
[0776]
实施方案90:如实施方案89所述的化合物、药物组合物或脂质聚集体,其中所述非典型核苷酸包含5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷、5-甲氧基胞苷、假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷中的一种或多种,任选地占所述非典型核苷酸的量的至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或100%。
[0777]
实施方案91:如实施方案88-90中任一项所述的化合物、药物组合物或脂质聚集体,其中至少约50%的胞苷残基是非典型核苷酸,并且所述非典型核苷选自5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷和5-甲氧基胞苷。
[0778]
实施方案92:如实施方案88-91中任一项所述的化合物、药物组合物或脂质聚集体,其中至少约75%或至少约90%的胞苷残基是非典型核苷酸,并且所述非典型核苷酸选自5-羟基胞苷、5-甲基胞苷、5-羟甲基胞苷、5-羧基胞苷、5-甲酰基胞苷和5-甲氧基胞苷。
[0779]
实施方案93:如实施方案88-92中任一项所述的化合物、药物组合物或脂质聚集体,其中至少约20%的尿苷,或至少约40%、或至少约50%、或至少约75%、或至少约90%的尿苷残基是非典型核苷酸,并且所述非典型核苷酸选自假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。
[0780]
实施方案94:如实施方案88-93中任一项所述的化合物、药物组合物或脂质聚集体,其中至少约40%、或至少约50%、或至少约75%、或至少约90%的尿苷残基是非典型核苷酸,并且所述非典型核苷酸选自假尿苷、5-羟基尿苷、5-甲基尿苷、5-羟甲基尿苷、5-羧基尿苷、5-甲酰基尿苷、5-甲氧基尿苷、5-羟基假尿苷、5-甲基假尿苷、5-羟甲基假尿苷、5-羧基假尿苷、5-甲酰基假尿苷和5-甲氧基假尿苷。
[0781]
实施方案95:如实施方案88-94中任一项所述的化合物、药物组合物或脂质聚集体,其中至少约10%的鸟嘌呤残基是非典型核苷酸,并且所述非典型核苷酸任选地是7-脱氮鸟苷。
[0782]
实施方案96:如实施方案88-95中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna含有不超过约50%的7-脱氮鸟苷代替鸟苷残基。
[0783]
实施方案97:如实施方案88-96中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna不含有代替腺苷残基的非典型核苷酸。
[0784]
实施方案98:如实施方案88-97中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna包含5'帽结构。
[0785]
实施方案99:如实施方案88-98中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna 5'-utr包含kozak共有序列。
[0786]
实施方案100:如实施方案88-99中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna 5'-utr包含增加体内rna稳定性的序列,并且所述5'-utr可包含α-珠蛋白或β-珠蛋白5'-utr。
[0787]
实施方案101:如实施方案88-100中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna 3'-utr包含增加体内rna稳定性的序列,并且所述3'-utr可包含α-珠蛋白
或β-珠蛋白3'-utr。
[0788]
实施方案102:如实施方案88-101中任一项所述的化合物、药物组合物或脂质聚集体,其中所述合成rna分子包含微小rna结合位点,所述微小rna结合位点任选地是:mir142微小rna结合位点(任选地是seq id no:811和seq id no:812之一)或其变体和/或以一个或多个拷贝存在于所述合成rna分子的所述3'-utr中。
[0789]
实施方案103:如实施方案88-102中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna包含3’多聚(a)尾并且任选地其中所述rna 3’多聚(a)尾的长度为约20个核苷酸至约250个核苷酸。
[0790]
实施方案104:如实施方案88-103中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna的长度为约200个核苷酸至约5000个核苷酸。
[0791]
实施方案105:如实施方案88-104中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna的长度为约500至约2000个核苷酸,或长度为约500至约1500个核苷酸,或长度为约500至约1000个核苷酸。
[0792]
实施方案106:如实施方案88-105中任一项所述的化合物、药物组合物或脂质聚集体,其中所述rna通过体外转录制备。
[0793]
实施方案107:如实施方案1-106中任一项所述的化合物、药物组合物或脂质聚集体,其中所述组合物适合于通过皮下注射、皮内注射、皮下注射、肌肉内注射、静脉内、鞘内、肿瘤内和局部施用来施用。
[0794]
实施方案108:如实施方案1-107中任一项所述的化合物、药物组合物或脂质聚集体,其中所述组合物适合于作为含有约1ng至约2000ng的rna的一种或多种注射剂来施用。
[0795]
实施方案109:如实施方案88-108中任一项所述的化合物、药物组合物或脂质聚集体,其中所述合成rna是mrna。
[0796]
实施方案110:如实施方案109所述的化合物、药物组合物或脂质聚集体,其中所述mrna编码目标蛋白。
[0797]
实施方案111:如实施方案110所述的化合物、药物组合物或脂质聚集体,其中所述目标蛋白是可溶性蛋白质,任选地选自表2b。
[0798]
实施方案112:如实施方案111所述的化合物、药物组合物或脂质聚集体,其中所述可溶性蛋白质是一种或多种重编程因子。
[0799]
实施方案113:如实施方案112所述的化合物、药物组合物或脂质聚集体,其中所述一种或多种重编程因子选自oct4、sox2、klf4、c-myc、l-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
[0800]
实施方案114:如实施方案110所述的化合物、药物组合物或脂质聚集体,其中所述目标蛋白是基因编辑蛋白。
[0801]
实施方案115:如实施方案114所述的化合物、药物组合物或脂质聚集体,其中所述基因编辑蛋白选自核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、成簇规律间隔短回文重复序列(crispr)相关蛋白、crispr/cas9、cas9、xcas9、cas12a(cpf1)、cas13a、cas14、casx、casy、1类cas蛋白、2类cas蛋白和mad7,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。
[0802]
实施方案116:如实施方案115所述的化合物、药物组合物或脂质聚集体,其中所述基因编辑蛋白包含有包含多个重复序列的dna结合结构域,并且所述重复序列中的至少一个包含氨基酸序列:ltpvqvvaiawxyzghgg(seq id no:629)并且长度在36与39个氨基酸之间,其中:“v”是q、d或e,“w”是s或n,“x”是h、n或i,“y”是d、a、i、n、g、h、k、s或空,并且“z”是ggkqaletvqrllpvlcqd(seq id no:630)或ggkqaletvqrllpvlcqa(seq id no:631)。
[0803]
实施方案117:如实施方案116所述的化合物、药物组合物或脂质聚集体,其中所述基因编辑蛋白还包含有包含核酸酶的催化结构域核酸酶结构域。
[0804]
实施方案118:如实施方案114-117中任一项所述的化合物、药物组合物或脂质聚集体,其中所述基因编辑蛋白能够在基因中产生单链或双链断裂。
[0805]
实施方案119:如实施方案118所述的化合物、药物组合物或脂质聚集体,其中所述单链或双链断裂引起持续改变的基因剪接。
[0806]
实施方案120:如实施方案114-119中任一项所述的化合物、药物组合物或脂质聚集体,其还包含基因的功能拷贝。
[0807]
实施方案121:一种用于用核酸转染细胞的方法,其包括使所述细胞与所述核酸和上述实施方案中的任一项所述的化合物、药物组合物或脂质聚集体的复合物接触。
[0808]
实施方案122:如实施方案121所述的方法,其中在与所述细胞接触之前形成所述复合物。
[0809]
实施方案123:如实施方案121或122所述的方法,其中所述方法提供以下特征之一:(a)高转染效率,(b)高水平的内体逃逸,(c)抗血清、低毒性作用,(d)高水平的蛋白质表达,(e)在各种细胞类型中的转染性,以及(f)无需用于转染的额外脂质或试剂的转染性。
[0810]
实施方案124:如实施方案121-123中任一项所述的方法,其中所述特征与用所述核酸与dotma、dotma、dodap和dope以及胆固醇和它们的组合的复合物转染细胞的方法有关。
[0811]
实施方案125:如实施方案121-124中任一项所述的方法,其中所述特征与用所述核酸与lipofectin、lipofectamine、lipofectamine 2000、lipofectamine 3000的复合物转染细胞的方法有关。
[0812]
实施方案126:一种用于将分化或非多能细胞重编程为分化程度较低的状态的方法,其包括:(a)提供分化或非多能细胞;(b)培养分化或非多能细胞;(c)用一种或多种合成rna分子与上述实施方案中的任一项所述的化合物、药物组合物或脂质聚集体的复合物转染分化或非多能细胞,其中所述一种或多种合成rna分子包括至少一种编码一种或多种重编程因子的rna分子,并且其中所述转染使得所述细胞表达所述一种或多种重编程因子,使得所述细胞被重编程为分化程度较低的状态。
[0813]
实施方案127:如实施方案126所述的方法,其中步骤(c)在存在含有支持所述分化或非多能重编程为分化程度较低的状态的成分的培养基的情况下发生。
[0814]
实施方案128:如实施方案126或127所述的方法,其还包括在连续5天内重复步骤(c)至少两次。
[0815]
实施方案129:如实施方案128所述的方法,其中在一种或多种较晚转染中转染的一种或多种合成rna分子的量大于在一种或多种较早转染中转染的量。
[0816]
实施方案130:如实施方案126-129中任一项所述的方法,其中步骤(a)-(c)不使用
饲养细胞而在存在饲养细胞条件培养基的情况下进行。
[0817]
实施方案131:如实施方案126-130中任一项所述的方法,其中步骤(c)不使用辐射的人新生儿成纤维细胞饲养细胞而在存在饲养细胞条件培养基的情况下进行。
[0818]
实施方案132:如实施方案126-131中任一项所述的方法,其中所述合成rna分子编码一种或多种选自以下的重编程因子:oct4、sox2、klf4、c-myc、1-myc、tert、nanog、lin28、utf1、aicda、mir200微小rna、mir302微小rna、mir367微小rna、mir369微小rna及其生物活性片段、类似物、变体和家族成员。
[0819]
实施方案133:如实施方案126所述的方法,其中所述分化的或非多能细胞来源于活检。
[0820]
实施方案134:如实施方案126所述的方法,其中所述分化的或非多能细胞来自人受试者。
[0821]
实施方案135:如实施方案126所述的方法,其中所述分化的或非多能细胞来源于皮肤打孔活检样品。
[0822]
实施方案136:如实施方案126所述的方法,其中所述分化的或非多能细胞是皮肤细胞。
[0823]
实施方案137:如实施方案126所述的方法,其还包括使所述细胞与以下组中的至少一个成员接触:多聚-l-赖氨酸、多聚-l-鸟氨酸、rgd肽、纤连蛋白、玻连蛋白、胶原蛋白和层粘连蛋白。
[0824]
实施方案138:如实施方案126所述的方法,其中所述合成rna分子含有至少一种非典型核苷酸。
[0825]
实施方案139:如实施方案126所述的方法,其中所述合成rna分子缺乏任何非典型核苷酸。
[0826]
实施方案140:如实施方案126所述的方法,其中所述培养基基本上不含免疫抑制剂。
[0827]
实施方案141:一种用于基因编辑细胞的方法,其包括用一种或多种合成rna分子与上述实施方案中的每一项所述的化合物、药物组合物或脂质聚集体的复合物转染细胞,其中所述一种或多种合成rna分子包括至少一种编码一种或多种基因编辑蛋白的rna分子,所述基因编辑蛋白选自核酸酶、转录激活因子样效应子核酸酶(talen)、锌指核酸酶、大范围核酸酶、切口酶、成簇规律间隔短回文重复序列(crispr)相关蛋白、crispr/cas9、cas9、xcas9、cas12a(cpf1)、cas13a、cas14、casx、casy、1类cas蛋白、2类cas蛋白和mad7,或其天然或工程化变体、家族成员、直向同源物、片段或融合构建体。
[0828]
实施方案142:如实施方案141所述的方法,其中所述基因编辑蛋白包含有包含多个重复序列的dna结合结构域,并且所述重复序列中的至少一个包含氨基酸序列:ltpvqvvaiawxyzghgg(seq id no:629),其中:“v”是q、d或e,“w”是s或n,“x”是h、n或i,“y”是d、a、i、n、g、h、k、s或空,并且“z”是ggkqaletvqrllpvlcqd(seq id no:630)或ggkqaletvqrllpvlcqa(seq id no:631)。
[0829]
实施方案143:如实施方案141或142所述的方法,其中所述基因编辑蛋白的长度在36与39个氨基酸之间。
[0830]
实施方案144:如实施方案141-143中任一项所述的方法,其中所述基因编辑蛋白
包含有包含核酸酶催化结构域的核酸酶结构域。
[0831]
实施方案145:如实施方案141-144中任一项所述的方法,其中所述核酸酶选自stsi和foki。
[0832]
实施方案146:一种用于从含有氢化铝锂和溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述溶剂;(c)去除多余的水;以及(d)用醇提取所述有机化合物;以得到提取的有机化合物。
[0833]
实施方案147:如实施方案146所述的方法,其中所述醇是异丙醇。
[0834]
实施方案148:一种用于从含有水反应性化合物和第一溶剂的反应中提取有机化合物的方法,其包括:(a)用水淬灭所述反应;(b)去除所述第一溶剂;(c)去除多余的水;以及(d)用第二溶剂提取所述有机化合物;以得到提取的有机化合物。
[0835]
实施方案149:一种用于从有机化合物和邻苯二甲酰亚胺或邻苯二甲酰亚胺衍生物的混合物中纯化有机化合物的方法,其包括:(a)将所述混合物溶解在丙酮中以形成沉淀;(b)通过离心去除所述沉淀;以及(c)去除所述丙酮;以得到纯化的有机化合物。
[0836]
实施方案150:如实施方案149所述的方法,其中所述邻苯二甲酰亚胺或邻苯二甲酰亚胺衍生物是邻苯二甲肼。
[0837]
实施例
[0838]
实施例1:亚油酰氯的合成(1)
[0839][0840]
在n2气氛下在0℃下将草酰氯(47.0ml,555mmol)添加至亚油酸(70.0g,250mmol)在580ml无水二氯甲烷中的溶液中。使反应升温至室温并剧烈搅拌24小时。在减压下去除溶剂和草酰氯以得到呈棕色油状物的亚油酰氯,其无需进一步纯化即可使用。
[0841]
实施例2:α-亚麻酰氯的合成(2)
[0842][0843]
根据实施例1的方案,将草酰氯(3.36ml,50.4mmol)添加至35ml无水二氯甲烷中的α-亚麻酸(5.00g,18.0mmol)中。24小时后,去除溶剂和草酰氯以到4.1g呈黄棕色油状物的α-亚麻酰氯。
[0844]
实施例3:n1,n
4-二亚油酰基-二氨基丁烷(3)的合成
[0845]
在0℃的冰浴中,将1,4-二氨基丁烷(0.428g,4.86mmol)和三乙胺(2.03ml,14.6mmol)在1ml无水二氯甲烷中的溶液缓慢添加至亚油酰氯(2.98g,10.0mmol)在30ml无水二氯甲烷中的溶液中。用磁力搅拌棒剧烈搅拌反应混合物。添加完成后,去除冰浴并将混合物在室温下搅拌2.5天。将反应冷却至4℃,并从溶液中沉淀出白色固体。通过真空过滤去除过量的亚油酰氯。用10ml二氯甲烷洗涤沉淀两次。浓缩母液,并且沉淀出更多产物。过滤此沉淀物并与先前的沉淀物合并。将所得固体真空干燥4小时。获得总计1.9g的所需产物n1,n
4-二亚油酰基-二氨基丁烷的白色固体。
[0846]
实施例4:n1,n
4-二亚油基-二氨基丁烷(4)的合成
[0847]
在0℃下将氢化铝锂(0.6g,95%,16mmol)小心地添加至n1,n
4-二亚油酰基-二氨基丁烷(1.8g,2.9mmol)在50ml无水乙醚中的悬浮液中。添加完成后,去除冰浴。将反应混合物缓慢升温至室温,然后用适当的冷凝装置逐渐加热至回流并搅拌12小时。将反应混合物冷却并在0℃下用5ml水小心地淬灭。在减压下去除乙醚,并且将反应混合物在真空下干燥。将干燥的反应混合物在80℃下用25ml异丙醇提取三次。去除异丙醇以得到1.6g无色油状n1,n
4-二亚油基-二氨基丁烷。
[0848]
实施例5:n1,n
4-二亚油基-n1,n
4-二-[2-羟基-3-(n-邻苯二甲酰氨基)丙基]-二氨基丁烷(5)的合成
[0849]
将二异丙基乙胺(1.15ml,12.0mmol)添加至n1,n
4-二亚油基-二氨基丁烷(1.6g,2.7mmol)和n-(2,3-环氧丙基)-邻苯二甲酰亚胺(1.6g,7.9mmol)在12ml无水n,n-二甲基甲酰胺中的悬浮液中。用氮气吹扫后,将反应混合物密封在圆底烧瓶中并加热至约90℃持续24小时。去除n,n-二甲基甲酰胺和二异丙基乙胺,并且得到黄色油状物。无需另外纯化即可继续合成。
[0850]
实施例6:n1,n
4-二亚油基-n1,n
4-二-(2-羟基-3-氨基丙基)-二氨基丁烷(6)的合成
[0851]
将n1,n
4-二亚油基-n1,n
4-二-[2-羟基-3-(n-邻苯二甲酰氨基)丙基]-二氨基丁烷
的全部粗油溶解在25ml无水乙醇中。在室温下添加肼(0.5ml,64-65%水溶液,10.3mmol)。用适当的冷凝装置,将反应混合物加热至回流。油浴温度设定为85℃。15分钟后,从溶液中沉淀出白色固体。将反应混合物在回流下搅拌4小时,然后冷却至-20℃。通过重力过滤去除白色固体。将残余物用冷乙醇洗涤两次。将合并的乙醇溶液浓缩并在真空下干燥过夜。将粗产物用丙酮提取。将合并的丙酮溶液浓缩并在真空下干燥过夜。获得1.0g油,n1,n
4-二亚油基-n1,n
4-二-(2-羟基-3-氨基丙基)-二氨基丁烷(以下称为dhdlins或dlindhs)。图12示意性地示出了dlindhs的合成过程。
[0852]
实施例7脂质的合成
[0853]
以下化合物通过实施例1至6的方法使用对应的胺和酰氯合成:
[0854]
n1,n
4-二亚麻基-n1,n
4-二-(2-羟基-3-氨基丙基)-二氨基丁烷(7);
[0855]
n1,n
2-二亚油基-n1,n
2-二-(2-羟基-3-氨基丙基)-二氨基乙烷(8);
[0856]
n1,n
3-二亚油基-n1,n
3-二-(2-羟基-3-氨基丙基)-二氨基丙烷(9);
[0857]
n1,n
5-二亚油基-n1,n
5-二-(2-羟基-3-氨基丙基)-二氨基戊烷(10);
[0858]
n1,n
6-二亚油基-n1,n
6-二-(2-羟基-3-氨基丙基)-二氨基己烷(11);
[0859]
亚油基-双(n-亚油基-n-(2-羟基-3-氨基丙基)-2-氨基乙基)胺(12);
[0860]
n1,n
3-二亚油基-n
1-(n-亚油基-n-[2-羟基-3-氨基丙基]-2-氨基乙基)-n
3-[2-羟基-3-氨基丙基]-1,3-二氨基丙烷(13);
[0861]
亚油基-双(n-亚油基-n-(2-羟基-3-氨基丙基)-2-氨基丙基)胺(14);
[0862]
n1,n
4-二亚油基-n
1-(n-亚油基-n-[2-羟基-3-氨基丙基]-3-氨基丙基)-n
4-[2-羟基-3-氨基丙基]-1,4-二氨基丁烷(15);
[0863]
n1,n
4-双(n-亚油基-n-[2-羟基-3-氨基丙基]-氨基丙基)-1,4-二氨基丁烷(16)。
[0864]
实施例8:用本发明脂质的转染
[0865]
以20mg/ml和5mg/ml制备脂质在乙醇中的储备溶液,并储存在-20℃。为了进行转染,首先将核酸稀释在dmem中(1μg核酸在50μl dmem中),然后添加所需量的脂质储备溶液。添加脂质后,将溶液彻底混合,并且在添加细胞前使复合物形成约5分钟至25分钟。对于图1至图6中描绘的实验,脂质在没有实施例6中所描述的丙酮纯化的情况下使用。
[0866]
图1描绘了用与各种脂质复合的体外转录的编码绿色荧光蛋白(gfp)的rna转染原代人表皮角质形成细胞。如图所示,dhdlins高效转染细胞。
[0867]
图2描绘了图1的实验的时间进程,即在使用dhdlins转染后的指定时间点测量的荧光。转染后一小时检测到荧光信号,并且转染后数小时信号强度和荧光细胞数量均增加。
[0868]
图3描绘了用各种指定量的rna(以纳克计)和脂质与rna的质量比(以微克脂质每微克rna计)的转染。如图所示,测试的所有rna量和脂质与rna的质量比均产生荧光信号。一般而言,更大量的rna会产生更强的信号和/或更大数量的荧光细胞,而在脂质与rna的质量比大于5μg/μg时观察到荧光信号的增加最小。
[0869]
图4描绘了用人外周血单核细胞(hpbmc)而不是角质形成细胞的转染实验。如图所示,dhdlins在测试的两种脂质与rna质量比下均有效转染hpbmc,而使用商业转染试剂lipofectamine 3000(“lf3000”)未观察到转染。
[0870]
图5a将转染结果扩展到原代人表皮角质形成细胞的融合层,而不是hpbmc。如图所示,dhdlins在测试的两种脂质与rna质量比下均有效转染融合的原代人表皮角质形成细
胞,而用lipofectamine 3000处理的细胞没有被有效转染。图5b以更高的放大倍数描绘了这一点。如图所示,dhdlins在测试的两种脂质与rna质量比下均有效转染融合的原代人表皮角质形成细胞,而用lipofectamine 3000处理的细胞没有被有效转染。
[0871]
图6描绘了如在图4中进行的实验的结果,但是用原代成人真皮成纤维细胞而不是hpbmc。如图所示,dhdlins在测试的两种脂质与rna质量比下均有效转染了原代成人真皮成纤维细胞,而用lipofectamine 3000处理的细胞没有被有效转染。图7以更高的放大倍数描绘了此实验。如图所示,dhdlins在测试的两种脂质与rna质量比下均有效转染了原代成人真皮成纤维细胞,而用lipofectamine 3000处理的细胞没有被有效转染。
[0872]
图8描绘了如图3中进行的实验的结果,但是用如实施例6中所描述的通过用丙酮提取纯化的dhdlins。如图所示,在脂质与rna质量比大于2μg/μg时,观察到荧光信号的增加最小。
[0873]
图9描绘了实验的结果,其中用体外转录的编码基因编辑蛋白的与dhdlins复合的rna转染原代人表皮角质形成细胞。基因编辑效率是通过将含有靶序列和由转染细胞的基因组dna产生的扩增子与由未经处理的细胞产生的相同制备的扩增子杂交,随后用t7e1核酸内切酶消化来测量的。如图所示,细胞被高效基因编辑。每个泳道上方的数字表示转染的细胞数量和转染的rna量。
[0874]
图10描绘了实验的结果,其中用如实施例8中所描述的体外转录的编码gfp的、与dlindhs复合的rna以2.5μg/μg的脂质与rna质量比转染人原代表皮角质形成细胞。将mrna-dlindhs复合物添加至无血清培养基(0%fbs)或50%fbs中的20,000个人表皮角质形成细胞中。转染后16小时拍摄图像。测量荧光的结果显示在右图中,说明dlindhs在50%血清中有效递送mrna。为了比较,左图说明血清使用lnp抑制mrna递送。具体地说,将gfp编码mrna配制成由dlin-mc3-dma、dope、胆固醇、dmpe-peg(摩尔比30:30:38.5:1.5)组成的lnp。将mrna-lnp(300ng最终mrna)添加至无血清培养基(0%fbs)或50%fbs中的20,000个人表皮角质形成细胞中。转染后16小时拍摄图像。
[0875]
图11a说明了实验的结果,其中用如实施例8中所描述的体外转录的、编码gfp的并与dlindhs复合的rna以2.5μg/μg的脂质与rna质量比转染原代人真皮成纤维细胞。将100ng的gfp编码mrna(其中20%用cy5标记)添加至10%fbs中的20,000个人真皮成纤维细胞中。在转染后10小时内每隔10分钟拍摄一次荧光图像,其中cy5标记的rna和gfp在不同的通道中分辨。图11a中的图像显示出在与dlindhs脂质复合物接触50分钟内在细胞质中检测到mrna,并且蛋白质表达在转染后2.5小时内开始。
[0876]
图11b说明了实验的结果,其中原代人真皮成纤维细胞用体外转录的编码gfp的并与标记的dlindhs复合的rna转染。dlindhs与bodipy-nhs酯荧光团(molecular probes,eugene,or)以10:1的dlindhs与荧光团摩尔比缀合,并且如实施例8中所描述与rna复合。将200ng的gfp编码mrna添加至细胞中。在转染后4小时内以20分钟的间隔拍摄荧光图像,包括在施用复合物后立即(“0分钟”),其中bodipy标记的dlindhs和gfp在不同的通道中分辨。图11b中的图像显示出dlindhs在转染后几分钟内接触细胞,并且大多数细胞被多个脂质复合物接触。
[0877]
实施例9:探究dlindhs的脂肪酸尾部中头基大小和不饱和度的影响
[0878]
进行了一项研究,以部分评估dlindhs的二羟基精胺(dhs)头基大小,以及dlindhs
脂肪酸尾部中不饱和度的影响。
[0879]
图13说明了实验的结果,其中原代人表皮角质形成细胞用体外转录的编码gfp的并与本发明的化合物复合的rna转染,所述化合物包含缀合至不同脂肪酸衍生尾部(包括肉豆蔻基、油基、亚油基和亚麻基)的二羟基精胺头基。在此实验中,将与上述脂质和与lipofectamine 2000(作为对照)复合的100ng gfp编码rna添加至50%fbs中的20,000个角质形成细胞中。结果以荧光(a.u.)与转染后时间(小时)的关系示出在图13的图中。
[0880]
图14说明了实验的结果,其中原代人表皮角质形成细胞用体外转录的编码gfp的并与本发明的化合物复合的rna转染,所述化合物包含二亚油基脂肪酸衍生的尾部结构。如图所示,测试化合物的结构是双-(2-羟基-3-氨基丙基)-n,n'-二亚油基-二胺,其中标记表示头基的中央氨基间碳链的长度(c2、c4、c5、c6、c8、c10和c12)。lipofectamine 2000用作对照。在此实验中,将与本发明的脂质或与lipofectamine 2000复合的100ng gfp编码mrna添加至50%fbs中的20,000个角质形成细胞中。结果示于图14的图中,显示出荧光(a.u.)与转染后时间(小时)的关系。
[0881]
实施例10:探究dlindhs/mrna脂质复合物表现出离子强度依赖性粒径和ph依赖性ζ电位的能力
[0882]
图15说明dlindhs脂质复合物的粒径是离子强度依赖性的。dlindhs/rna复合物是通过将乙醇原液中的脂质稀释到含有不同浓度氯化钠的水性mrna溶液中而形成的。通过动态光散射(dls)测量粒径。图15中的图说明了在九种不同复合培养基中形成的dlindhs/rna复合物的z均粒径(nm)和多分散性指数(pdi)。
[0883]
图16说明dlindhs脂质复合物具有ph依赖性ζ电位。将如实施例8中所描述体外转录的、编码gfp的rna与dlindhs以2.5μg/μg的脂质与rna质量比复合,然后稀释成20mm柠檬酸盐,ph3.0-6.0,或20mm磷酸盐,ph 7.4。此图描绘了ζ电位(mv)与稀释缓冲液ph的函数关系。在此研究中,ph 7.4时-22.1mvζ电位意味着稳定的分散。
[0884]
实施例11:探究dlindhs保护mrna免于rna酶a降解的能力
[0885]
进行这项研究是为了评估dlindhs是否能保护mrna免于rna酶a降解。用如实施例8中所描述的体外转录的、编码gfp的并以2.5μg/μg的脂质与rna质量比与dlindhs复合的rna转染原代人表皮角质形成细胞。对于此实验,gfp编码mrna在与dlindhs复合之前或之后与rna酶a一起孵育。将复合物添加至无血清培养基中的20,000个角质形成细胞中。图17描绘了用未用rna酶a处理的dlindhs/rna复合物(“未处理”)、在复合后用rna酶a处理的dlindhs/rna复合物(“复合后rna酶”)以及与在复合前用rna酶a处理的rna复合的dlindhs(“复合前rna酶”)转染的细胞的荧光显微镜图像。如图所示,对于复合后用rna酶处理的dlindhs/mrna复合物,rna被保护免于降解,使得gfp表达类似于未用rna酶处理的dlindhs/mrna复合物的gfp表达。
[0886]
实施例12:mrna向各种类型细胞递送的探究
[0887]
进行此项研究以评估使用报告蛋白在各种细胞类型中递送与dlindhs复合的mrna的效率。用如实施例8中所描述的体外转录的、编码gfp的并以2.5μg/μg的脂质与rna质量比与dlindhs复合的rna转染原代人真皮成纤维细胞、活化的人外周血单核细胞(pbmc)、人肺腺癌细胞、诱导多能干细胞(ips细胞)和大鼠胚胎皮质神经元。图18描绘了(上图,“gfp”)用与dlindhs脂质复合物复合的体外转录的gfp编码rna转染的五种类型的细胞的结果。图18
的下图(“阴性”)描绘了其中没有递送rna的阴性对照实验。
[0888]
实施例13:mrna向大鼠的多个组织递送的探究
[0889]
进行了一项研究,以部分评估与本发明的脂质复合的mrna在大鼠中通过多种途径递送后的摄取。根据研究参数,将如实施例8中所描述的体外转录的、编码gfp并以2.5μg/μg的脂质与rna质量比与dlindhs复合的rna施用于大鼠:
[0890][0891][0892][0893]
收集的载玻片用苏木精和兔抗gfp抗体染色,以确定收集的目标组织中报告蛋白表达的定位和程度。
[0894]
图19示出了(左图)80μm尺度的大鼠组织图像,以及(右图)20μm尺度的大鼠组织图像。如图19所示,皮内注射与编码报告蛋白(gfp)的mrna复合的dlindhs在真皮层产生局部表达。
[0895]
实施例14:通过皮内注射向人受试者体内递送mrna的探究
[0896]
进行此研究以评估与本发明的脂质复合的mrna在皮内注射至人受试者后的摄取。将如实施方案8中所描述的体外转录的、编码红色荧光蛋白(rfp)的、以2.5μg/μg脂质与rna的质量比与dlindhs复合的rna经由皮内注射(400ng rna,总体积为20μl)施用于人类男性
的前臂腹侧。48小时后,对注射部位的皮肤进行活检并通过共聚焦荧光显微镜成像。图20a示出了(上图)向其中注射了dlindhs/mrna复合物的皮肤和(下图)阴性对照的图像。图20b示出了放大图像,图上的箭头指示具有与成纤维细胞一致的形态的rfp阳性细胞。
[0897]
等效方案
[0898]
仅使用常规实验,本领域技术人员将认识到或能够确定本文特别描述的特定实施方案的许多等效方案。此类等效方案旨在涵盖在以下权利要求书的范围中。
[0899]
以引用的方式并入
[0900]
本文引用的所有专利和出版物在此以引用的方式整体并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1