载体
载体
发明领域
1.本发明涉及重组病毒载体领域。具体地,本发明涉及适用于体内递送治疗基因的重组病毒载体。
2.发明背景
3.额颞叶痴呆(frontotemporal dementia,ftd)是表现出症状的小于65岁的人群中第二常见的痴呆形式。它的特征在于行为、性格和语言的变化,并且对患者、他们的家人和朋友来说非常痛苦。约30%的ftd患者具有痴呆的家族史,其中约20%携带编码蛋白颗粒蛋白前体(progranulin)的grn基因的功能丧失(loss of function,lof)突变。grn突变纯合的儿童会发展为溶酶体贮积症(lysosomal storage disorder)神经元蜡样质脂褐质沉积症(neuronal ceroid lipofuscinosis,ncl11),其特征在于神经退行性和失明(rohrer jd等人,(2015b)lancet neurol.14:253
–
262)。lof突变杂合的成人会发展为成年发病的ftd,伴有额叶和颞叶皮质神经元中的溶酶体贮积病变(lysosomal storage lesion)和tdp-43包涵体(inclusion)。症状前grn突变携带者的mri扫描显示了在预期的临床发作前约15年的颞叶和顶叶中的结构差异(rohrer等人,如上所述)。
4.目前没有有效的显著改变任何形式的ftd、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,als)或任何形式的神经退行性疾病的疾病进展的治疗方法。为ftd开具的唯一药物被设计为减轻抑郁症(抗抑郁药)或问题行为(强镇静剂(major tranquiliser))的影响,并且这些通常具有显著有害的短期和长期副作用。
5.颗粒蛋白前体(pgrn)是一种分泌型糖蛋白,其对神经元具有重要的营养作用、抑制炎症并在自噬中起关键作用(chitramuthu bp等人,(2017)brain.140(12):3081-3104)。颗粒蛋白前体由小神经胶质细胞和神经元产生,但被所有的细胞类型摄取(take up)。一旦它与其细胞膜上的受体分拣蛋白(sortilin)结合,它就会被内体(endosome)导入并递送至溶酶体,在那里它被降解成多个颗粒蛋白(holler cj等人,(2017)eneuro.18:4)。这些颗粒蛋白的一者充当蛋白酶组织蛋白酶d(cathepsin d)的伴侣蛋白(chaperone),以促进溶酶体酸化和有效的蛋白水解。溶酶体缺陷抑制自噬,并且tdp-43在核和细胞质包涵体中积累。
6.grn-\-小鼠表现出不易察觉的行为表型(社会优势降低),并且尽管发展了脂褐质沉积症、反应性神经胶质增生(reactive gliosis)和异常溶酶体,但它们不会发展tdp-43蛋白病(tdp-43proteinopathy)或神经元丧失(arrant aw等人,(2018)j.neurosci.38(9):2341-2358)。从小鼠神经元中选择性敲除grn(petkau tl等人,(2017)neurobiol dis.106:14-22)或从小神经胶质细胞中部分敲除(petkau tl等人,(2017)j.neuroinflammation.14(1):225)使pgrn水平降低了约50%,但不会导致表型或可检测的病理学。这表明这两种细胞类型均能够分泌足够的颗粒蛋白前体以递送组织广度的交叉校正(cross-correction)。
7.尽管不存在好的动物模型,但使用病毒载体递送pgrn的先前研究已显示出前景。由腺相关病毒1(aav1)递送的小鼠grn基因向12个月龄grn-\-小鼠的实质内(intraparenchymal)输注可减少脂褐质沉积症和炎症,表明了补充颗粒蛋白前体可以逆转病理方面(arrant ae等人,(2017)brain.140(5):1447-1465;arrant ae等人,(2018)如上
所述)。然而,另一项使用由aav9和aav4递送的高约33倍剂量的人类grn的研究报告了3个月后显著的海马体退行和t细胞在grn-/-小鼠和非转基因小鼠中的浸润(amado da等人,doi:https://doi.org/10.1101/308692)。
8.最近一项aav9-smn在1型脊髓性肌肉萎缩症(spinal muscular atrophy,sma)中的试验的显著成功刺激了对神经病症的基因治疗的研究。sma由存活运动神经元基因(survival motor neuron gene,smn)的纯合缺失引起。这些儿童生来就软弱无力(floppy),并且逐渐变得更虚弱,以至于他们从不坐下、爬行、站立或说话,因为95%的孩子在两岁之前就已经被供氧。在1至7个月龄间被给予单次注射aav9-smn的15名患者中,没有人需要供氧,并且14/15的肌肉力量显著增加,以至于他们可以无需帮助即可站立和行走并且所有人都能够说话(mendell jr等人,(2017)n.engl.j.med.377(18):1713-1722)。
9.然而,据报道,非人类灵长类动物和小型猪中的高剂量静脉内aav9-smn具有毒性(hinderer c等人,(2018)hum.gene ther.29:285-298),因此应仔细考虑在任何临床试验中使载体剂量最小化。此外,aav载体生产是一个极其昂贵的过程,目前估计每位患者高达~100万美元。
10.因为grn过表达可以使表达tdp-43突变形式(其模拟肌萎缩侧索硬化症(als)和ftd)的转基因小鼠的存活加倍(beel s等人,(2018)mol.neurodegener.13(1):55),归因于与grn突变无关的tdp-43积累,aav-grn治疗可以是针对als和ftd的成功治疗。通过向阿尔茨海默病转基因小鼠模型施用慢病毒递送的grn还增强了脑中淀粉样蛋白β沉积的清除(minami ss等人,(2014)nat.med.20(10):1157-64),并且颗粒蛋白前体基因递送已在帕金森病的mtpt毒素模型中显示出具有神经保护作用(van kampen jm等人,(2014)plos one.9(5):e97032)。由于grn能够增强自噬并减少炎症,aav-grn还可以为许多其他其中积累了错误折叠蛋白的神经退行性病症提供治疗益处。
11.许多研究小组已经在研究各种方法来为ftd-grn患者寻找合适的治疗方法,包括使用aav载体递送颗粒蛋白前体。例如,passage bio已获得大量资金来开发aav递送的治疗以治疗罕见的单基因cns疾病,包括ftd(https://www.passagebio.com/investors-and-media/news-and-events/press-releases/press-release-details/2019/passage-bio-launches-with-1155-million-series-a-to-develop-aav-delivered-therapeutics-to-treat-rare-monogenic-cns-diseases/default.aspx)。wo 2017/151884还描述了包含编码颗粒蛋白前体的核酸的载体的用途,其中所述载体转导与脑脊液(cerebrospinal fluid,csf)接触的细胞以表达颗粒蛋白前体。具体地,所述载体包含aav衣壳蛋白并且颗粒蛋白前体核酸插入在一对aav反向末端重复之间。
12.然而,鉴于高剂量aav载体的已知毒性,确实需要优化此类载体中携带的颗粒蛋白前体蛋白的表达,从而使得施用此类载体导致携带grn基因中的功能丧失(lof)突变的受试者以及具有降低的、抑制的或低的颗粒蛋白前体水平的受试者中的脑颗粒蛋白前体水平回到接近生理水平。事实上,对治疗蛋白表达的优化可以应用于并扩展到许多其原因是遗传缺陷或生理系统无法产生低于生理正常水平的蛋白的疾病。
13.因此,需要显示出脑中异源基因如颗粒蛋白前体的表达增加的改进的aav载体。
技术实现要素:
14.在一个方面,本发明提供了一种腺相关病毒(aav)载体,其包含核酸,所述核酸包含与编码感兴趣的多肽的多核苷酸序列有效连接的人生长激素内含子3(human growth hormone intron 3,hghi3)序列。
15.在另一个方面,本发明提供了一种腺相关病毒(aav)载体,其包含与编码感兴趣的多肽的多核苷酸序列有效连接的突触蛋白(synapsin)启动子序列。优选地,感兴趣的多肽是颗粒蛋白前体。
16.在另一个方面,本发明提供了一种腺相关病毒(aav)载体,其包含与编码感兴趣的多肽的多核苷酸序列有效连接的颗粒蛋白前体3
′
非翻译区(utr)序列。优选地,感兴趣的多肽是颗粒蛋白前体。
17.在另一个方面,本发明提供了一种腺相关病毒(aav)载体,其包含编码颗粒蛋白前体的多核苷酸序列,其中所述多核苷酸序列与seq id no:4具有至少95%的序列同一性。
18.在一个示例中,hghi3序列可以包含seq id no:7的序列或其变体、片段或同源物。例如,合适的变体可以包含与seq id no:7,如seq id no:7的至少30、50、70、80、90个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
19.优选地,多核苷酸序列编码异源多肽或转基因蛋白,例如非aav蛋白。在一些实施方案中,多核苷酸序列可以编码哺乳动物多肽,例如人类多肽或蛋白。在一个实施方案中,多核苷酸序列可以包含感兴趣的多肽的完整编码序列或其编码序列的一部分。例如,编码序列可以衍生自grn并编码颗粒蛋白前体(pgrn),例如人颗粒蛋白前体。优选的是多核苷酸序列包含pgrn的完整编码序列。
20.因此,多核苷酸序列优选编码如seq id no:16中所定义的氨基酸序列,或其片段、同源物或变体。在一个优选的实施方案中,编码的氨基酸序列可以与seq id no:16,如seq id no:16的至少50、100、200、300、500个残基或全长具有至少85%、90%、95%或99%序列同一性。
21.在一个实施方案中,多核苷酸序列可以包含人颗粒蛋白前体(seq id no:1)的野生型编码序列,或其变体、片段或同源物。
22.在一个优选的实施方案中,多核苷酸序列可以经密码子优化,例如经优化以在人类中表达。在一个优选的实施方案中,经密码子优化的序列对人类具有至少0.8、更优选至少0.9的密码子适应指数(codon adaptation index,cai)。最优选地,经密码子优化的序列对人类和小鼠的cai为至少0.9。优选地,经密码子优化的序列具有30至70%,最优选60至65%的gc含量。在一个实施方案中,经密码子优化的序列与野生型颗粒蛋白前体序列具有至少50%、60%、70%、75%或最优选至少80%的序列相似性或序列同一性。
23.密码子优化可以引入新的或不同的增强蛋白生产的调控元件。此类调控元件可以另外将表达限制在特定的组织和/或器官,例如脑。在一个示例中,经密码子优化的序列可以包含seq id no:2、seq id no:3或seq id no:4的序列,或其变体、片段或同源物。在一个特别优选的实施方案中,经密码子优化的序列可以包含seq id no:4的序列或其变体、片段或同源物,即,基于本文示例中描述的候选iii(pgrn-gs)。
24.合适的变体可以包含与seq id no:1、seq id no:2、seq id no:3或seq id no:4,如seq id no:1、seq id no:2、seq id no:3或seq id no:4的至少100、200、300、500、1000
或1500个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。在一个特别优选的实施方案中,多核苷酸序列可以包含与seq id no:4,如seq id no:4的至少100、200、300、500、1000或1500个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
25.通常,合适的片段可包含本文所述的任何一种多核苷酸或氨基酸序列的至少20、30、50、100、200、300、500、1000或1500个残基,例如,seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:7、seq id no:14、seq id no:15、seq id no:16或seq id no:17的至少20、30、50、100、200、300、500、1000或1500个残基。
26.在另一个实施方案中,aav载体可以进一步包含外显子剪接元件(exonic splicing element,ese)。ese可以在多核苷酸编码序列的上游,例如在5
′
侧翼序列中。应当理解,ese可以是侧翼序列的一部分或插入到侧翼序列中。这样的5
′
侧翼序列可以是引导序列(guide sequence),例如衍生自野生型多核苷酸序列的5
′
侧翼序列。例如,5
′
侧翼序列可以是衍生自野生型grn基因的5
′
引导序列。在这样的示例中,野生型grn 5
′
引导序列包含约300至500个碱基对,例如350至450个或约392个碱基对。
27.在一个优选的实施方案中,aav载体可以进一步包含来自颗粒蛋白前体的3
′
非翻译区(utr)。pgrn的3
′
utr可以作为外显子增强元件(exonic enhancing element)起作用,以增强和潜在地调控pgrn表达。pgrn的3
′
utr可以例如位于多核苷酸编码序列下游的盒或载体中,即在3
′
区域中。优选地,所述盒或载体包含人类pgrn的3
′
utr,或其变体、片段或同源物。例如,所述盒或载体可以包含seq id no:14的序列,或与seq id no:14,如seq id no:14的至少100、200、250个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
28.在另一个实施方案中,多核苷酸序列可以包含衍生自人生长激素(hgh)的信号(signalling)序列(即编码信号肽的序列)。hgh信号序列可以包含seq id no:9的序列或其变体或同源物。在一些实施方案中,信号序列可以替换存在于编码感兴趣的多肽的序列中的信号序列。在一个具体示例中,hgh信号序列替换了grn的残基1至51。
29.在另一个实施方案中,aav载体可以进一步包含给蛋白表达赋予组织或细胞类型特异性的序列。例如,神经元特异性启动子,例如衍生自突触蛋白的启动子,可以包含在表达盒中。例如,启动子可以包含seq id no:15的序列,或其变体、片段或同源物。例如,盒或载体可以包含seq id no:15的序列,或与seq id no:15,如seq id no:15的至少50、100、200、300或400个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
30.在另一个实施方案中,本发明提供了包含人突触蛋白启动子、hghi3和颗粒蛋白前体3
′
utr的aav载体,所述颗粒蛋白前体3
′
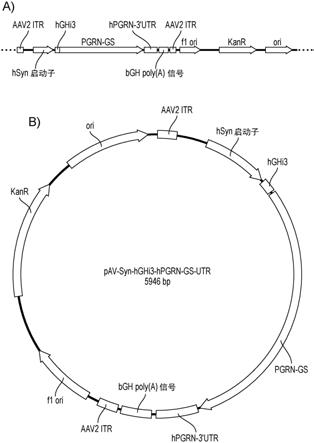
utr与编码感兴趣的多肽的多核苷酸序列有效连接。优选地,多核苷酸序列可以经密码子优化,例如,经优化以在人类中表达。甚至更优选地,感兴趣的多肽是颗粒蛋白前体。aav载体可以,例如,包含seq id no:17的序列,或其变体、片段或同源物。例如,aav载体可以包含seq id no:17的序列,或与seq id no:17,如seq id no:17的至少100、200、300、500、1000、1500、2000、2500或3000个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
31.在另一个示例中,所述序列可以另外或可选地将感兴趣的多肽的表达限制于分裂或非分裂细胞,例如非分裂神经元。通过这种方式,可以降低任何致癌风险。
32.因此,在一个具体示例中,本发明提供了一种aav载体盒,其用于递送grn基因以有
效表达和分泌颗粒蛋白前体,从而补充患有als、ftd和ncl11以及相关神经退行性病症的受试者脑中的pgrn水平。此类受试者的颗粒蛋白前体水平可能低于正常生理水平,具有grn突变,或部分或全部缺乏这种蛋白。
33.尽管应当理解,本发明涵盖使用任何合适的aav血清型,但血清型aav9是优选示例。
34.在第二个方面,本发明在于i)包含如本文所述的aav载体的药物组合物或药物和ii)一种或多种药学或生理学上可接受的载体、赋形剂和/或稀释剂。
35.在一个实施方案中,药物组合物或药物可以被配制用于直接或间接地施用或递送至脑或脑的特定区域,例如额叶、颞叶和/或顶叶。
36.在第三个方面,如本文所述的药物组合物或药物可用于治疗疾病,优选神经疾病或病症。通常,要治疗的疾病是神经退行性疾病。在具体的实施方案中,神经病症包括额颞叶痴呆(ftd)、神经元蜡样质脂褐质沉积症(ncl11)、肌萎缩侧索硬化症(als)、亨廷顿病、帕金森病或阿尔茨海默病。
37.药物组合物或药物可用于治疗任何患有所述疾病的患者或这些患者的子组。在一些实施方案中,如本文所述的药物组合物或药物用于治疗(i)grn突变杂合(heterozygous)、纯合(homozygous)或复合杂合(compound heterozygous)的受试者,(ii)患有散发性神经疾病的受试者和/或(iii)pgrn水平低于生理正常水平的受试者。“散发性疾病”通常意指不知晓有其他家庭成员受累或没有与所述疾病相关的功能丧失grn突变的受试者。
38.换言之,使用如本文所述的药物组合物或药物可以是为了制备用于治疗神经病症的药物,例如用于治疗grn突变杂合的额颞叶痴呆(ftd-grn)患者或用于治疗grn突变纯合或复合杂合的神经元蜡样质脂褐质沉积症(ncl11)患者的药物。所述药物也可以用于pgrn水平不低于生理正常水平的人群的其他神经病症,例如:没有grn突变的额颞叶痴呆(ftd)患者、肌萎缩侧索硬化症(als)、亨廷顿病、帕金森病或阿尔茨海默病,以及患有其他散发性神经疾病的受试者。
39.本发明的药物组合物或药物还可用于治疗方法中,其中可以将治疗有效量的包含如本文所述的aav载体的药学或生理学上可接受的组合物施用给有此需要的受试者以治疗神经病症,例如额颞叶痴呆(ftd)、神经元蜡样质脂褐质沉积症(ncl11)、肌萎缩侧索硬化症(als)、亨廷顿病、帕金森病或阿尔茨海默病,例如在患有散发性神经疾病的受试者和/或pgrn水平低于生理正常水平的受试者中。例如,本发明的药物组合物或药物可以作为基因治疗施用给最近出现症状的ftd和als患者,从而阻止退行性过程。此类治疗甚至可以挽救功能失调但仍然存活的神经元。即使是痴呆症状的些许(modest)改善和对进展的预防也将显著减轻他们的家庭和社区的护理负担。
40.应当理解,可以预防性地施用组合物或药物以预防或限制疾病的发作,尤其是对处于最大风险中的受试者。
41.在另一个方面,本发明提供了如上所述的核酸,例如包含以下的核酸(例如多核苷酸):(i)人生长激素内含子3(hghi3)序列,(ii)突触蛋白启动子序列,和/或(iii)颗粒蛋白前体3
′
非翻译区(utr)序列,其与编码感兴趣的多肽(例如除人生长激素以外的多肽)的异源多核苷酸序列有效连接。优选地,感兴趣的多肽包含颗粒蛋白前体。多肽的编码序列可以
经密码子优化,例如如本文所述。
42.在另一个方面,本发明提供了核酸序列,其包含与seq id no:4,如seq id no:4的至少100、200、300、500、1000或1500个残基或全长具有至少85%、90%、95%或99%序列同一性的序列。
43.核酸序列可以进一步包含一种或多种调控元件(例如启动子),或如上文关于包含此类核酸的aav载体所述的其他元件。因此,在一个实施方案中,核酸包含神经元特异性启动子(例如,突触蛋白启动子)。核酸可以例如包含适合用于aav载体中的表达盒,并且因此可以例如包含一个或多个aav反向末端重复。
44.附图简要说明
45.图1:筛选经密码子优化的候选者的分泌型pgrn表达。图1a:合成了在cmv启动子下的12个经密码子优化的pgrn序列。hek-293细胞用于转染(250ng/2e+10细胞)。48小时后收集培养基并进行蛋白质印迹(western blot)分析。图1b:通过imagej测定每个候选者的pgrn表达强度。图1c:双重密码子优化(double codon optimisation)(人类和其他物种)前后的cai得分。
46.图2:hpgrn融合的克隆策略。图2a:通过不同算法密码子优化的hpgrn的候选者i、ii、iii的示意图。图2b:bamh1和bstb1用于切割野生型人类pgrn的5
′
序列。将经消化的dna片段替换为经密码子优化的pgrn候选者以产生融合质粒。
47.图3:对细胞培养基中由经密码子优化的构建体分泌的pgrn进行定量。图3a:将pgrn密码子优化的和融合构建体转染到hek-293细胞中。48小时后,对细胞培养基进行取样并通过蛋白质印迹测定pgrn的水平。图3b:通过imagej测定每个候选者分泌的pgrn水平,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。将三个生物学重复和四个独立实验的结果绘制在散点图中并进行单向anova统计学分析(*《0.05)。
48.图4:对细胞培养裂解物中经密码子优化的构建体表达的pgrn进行定量。图4a:将pgrn密码子优化的和融合构建体转染到hek-293细胞中。48小时后,将细胞培养物裂解并通过蛋白质印迹测定pgrn的水平。图4b:通过imagej测定每个候选者表达的pgrn水平,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。将三个生物学重复和四个独立实验的结果绘制在散点图中并进行单向anova统计学分析(*《0.05)。
49.图5:检测人生长激素对pgrn蛋白表达的内含子介导的增强作用。图5a:位于基因组序列中的人生长激素内含子序列示意图。图5b:将hgh内含子1、2或3克隆至人类pgrn-wt的5
′
utr。图5c:将人类pgrn信号序列(18个氨基酸的肽)替换为人生长激素信号序列,以检测它是否能增强pgrn的分泌。
50.图6:通过hgh内含子3和hgh的信号序列增强pgrn的分泌。图6a:将pgrn内含子和信号肽序列转染到hek-293细胞中。48小时后,对细胞培养基进行取样并通过蛋白质印迹测定pgrn的水平。图6b:通过imagej测定每个候选者分泌的pgrn水平,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。将三个生物学重复和四个独立实验的结果绘制在散点图中并进行单向anova统计学分析(*《0.05,***《0.0005)。
51.图7:pgrn表达由hgh内含子3增强,但不由细胞裂解物中的hgh信号增强。图7a:将pgrn内含子和信号肽序列转染到hek-293细胞中。48小时后,将细胞培养物裂解并通过蛋白质印迹测定pgrn的水平。图7b:通过imagej测量每个候选者表达的pgrn水平,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。将三个生物学重复和四个独立实验的结果绘制在散点图中并进行单向anova统计学分析(***《0.0001)。
52.图8:hghi3没有增强经密码子优化的pgrn-gs的grn表达。图8a:将插入有hgh内含子3的pgrn-gs转染到hek-293细胞中。48小时后,收集培养基并用于grn表达的蛋白质印迹。图8b:使用image-j和image studio对表达水平进行定量,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。图8c:通过ese finder 2.0分析pgrn野生型序列的ese元件和经密码子优化的pgrn-gw。将sr蛋白结合评分绘制为条形图。每种颜色代表不同类型的sr剪接蛋白。
53.图9:hghi3-pgrn-融合构建体增强了原代神经元中的grn表达。图9a:hghi3-pgrn-融合构建体的hghi3克隆的示意图。图9b:产生携带hghi3-pgrn-ga的aav,并将其转导至7日龄的大鼠原代皮质神经元。孵育五天后,收集培养基用于pgrn表达水平的蛋白质印迹分析。图9c:通过imagej测量每个候选者表达的pgrn水平,并将该值首先相对于细胞数(蛋白gapdh)进行归一化,并且随后相对于盒拷贝数(cmv/gapdh的qpcr)进行归一化。将三个生物学重复和四个独立实验的结果绘制在散点图中,并进行单向anova统计学分析。
54.图10:突触蛋白启动子增加了大鼠皮质神经元的pgrn分泌。图10a:克隆在aav穿梭载体中的cmv和突触蛋白启动子下的野生型pgrn。在第7天将质粒转染至大鼠皮质神经元5天,然后对培养基进行取样和处理以进行蛋白质印迹分析。图10b:通过imagej测量pgrn表达的强度。
55.图11:携带syn-pgrnwt的aav9增强了培养的大鼠神经元中的pgrn表达。图11a:使用神经元特异性aav9衣壳产生病毒颗粒。然后在第7天使用1e+6病毒颗粒将aav颗粒转导至大鼠原代皮质神经元5天。所述培养基用于蛋白质印迹。图11b:通过elisa测定法测量pgrn蛋白水平(0.001)。
56.图12:aav9-pgrn转导在小鼠器官中的生物分布。图12a:通过双侧icv注射(1e+12gc/kg)施用aav9-cmv-pgrn-wt和aav9-syn-pgrn-wt。图12b:在基因组dna上进行人类pgrn的qpcr以确定组织生物分布。
57.图13:携带syn-pgrnwt的aav9增强了小鼠皮质中的pgrn表达。通过双侧icv注射(1e+12gc/kg)递送携带cmv-pgrn-wt和syn-pgrn-wt的aav9载体。图13a:商业elisa试剂盒(adipogen)用于定量分析血清、csf和皮质中的pgrn表达水平。图13b:将血清以1:300稀释并用于elisa(n=3)。图13c:将csf以1:200稀释度稀释并用于elisa(n=1)。图13d:将皮质的ripa裂解物以1:300稀释并然后用于elisa(n=3)。
58.图14:适用于基因治疗的pgrn载体的示例。图14a:由cmv启动子驱动的在5
′
utr中包含hgh3内含子3的pgrn密码子优化构建体的示意图。图14b:由突触蛋白启动子驱动的在5
′
utr中包含hgh3内含子3的pgrn密码子优化构建体的示意图。
59.图15:aav9-syn-pgrnwt的icv递送显示出pgrn在小鼠脑中的广泛分布。a)4周龄小鼠脑切片用于ihc以检测人grn表达。图像由nikon a1r共聚焦拍摄。为了重建全脑图像,将
扫描的图像在nic软件的自动设置中以20%的重叠进行拼接。人grn(绿色),neun(红色)。b)对未经注射的脑切片进行ihc,其显示未检测到grn。c)皮质,d)海马体,e)丘脑。
60.图16:携带syn-pgrnwt的aav9增强了小鼠海马体中的pgrn表达。通过双侧icv注射(2.5e+10)递送携带cmv-pgrn-wt和syn-pgrn-wt的aav9载体。a)商业elisa试剂盒(adipogen)用于定量分析血清、csf和皮质中的pgrn表达水平。b)aav9-syn-egfp、aav9-syn-pgrnwt、aav9-cmv-egfp和aav9-cmv-pgrnwt的pgrn elisa(n=3)。c)aav9-syn-egfp和aav9-syn-pgrnwt的pgrn蛋白质印迹。仅从经aav9-syn-pgrnwt注射的海马体裂解物中检测到约68kda的pgrn。d)aav9-cmv-egfp和aav9-cmv-pgrnwt的pgrn蛋白质印迹。
61.图17:syn-hghi3-pgrn-gs-utr的示意图。a).由syn启动子驱动的pgrn密码子优化构建体的示意图,其包含hgh3内含子3和3
′
utr。b).人类pgrn-utr的dna序列。
62.图18:携带syn-pgrn-gs、syn-hghi3-pgrn-gs和syn-hghi3-pgrn-gs-utr的aav9增强了小鼠皮质中的pgrn表达。通过双侧it注射递送携带syn-pgrn-gs、syn-hghi3-pgrn-gs和syn-hghi3-pgrn-gs-utr的aav9载体。对皮质组织的细胞裂解物进行pgrn eslisa测定和蛋白质印迹。a)商业elisa试剂盒(adipogen)用于定量分析皮质中的pgrn表达水平。b)将皮质的ripa裂解物以1:300稀释,并然后用于elisa(n=3)。c)来自低(6.2e+10)、中(1.2e+11)和高(2.5e+11)的皮质的ripa裂解物用于elisa(n=3)。
63.图19:aav9-pgrn-gs和aav9-hghi3-pgrn-gs-utr的免疫组织化学。在it注射后4周收获小鼠。以30um的厚度将游离(free)冷冻组织切片,并用人特异性山羊抗grn抗体(绿色)免疫染色过夜。dapi用作复染(蓝色)。a,a’)aav-egfp,b,b’)aav9-pgrn-gs和c,c’)aav9-pgrn-gs-utr。
64.图20:小鼠脑中pgrn的高功率(high power)和3d渲染图像。通过免疫荧光研究了人类pgrn在小鼠皮质中的分布,以确定pgrn是否被其他细胞分泌和摄取。(a)许多皮质神经元(用neun染成红色)对人类pgrn(绿色)呈阳性,在3d渲染图像(c)中也可见。一些neun阴性细胞,表明由神经元分泌的pgrn被神经胶质细胞摄取。(b)一些用iba1标记的小神经胶质细胞(b中红色)显示grn阳性局灶(绿色),在3d渲染图像(d)中也可见,表明它们能够摄取由神经元分泌的pgrn。将脑切片用2光子显微镜成像(a,b)或通过a1r共聚焦连续扫描。通过使用imaris 8.3对堆叠的图像进行3d渲染处理以显示grn颗粒。在神经元(c)和小神经胶质细胞(d)中。比例尺=2μm。
65.图21:aav pgrn载体的质粒图谱。将人生长激素内含子插入突触蛋白启动子和hpgrn之间。在hpgrn的3
′
末端添加hpgrn utr的天然序列。将itr至itr克隆到新合成的卡那霉素抗性骨架质粒中。a)线性形式。b)环状质粒形式。aav2 itr=腺相关病毒2型反向末端重复;hsyn启动子=人突触蛋白启动子;hghi3=人生长激素内含子2;pgrn-gs=密码子优化的人颗粒蛋白前体;hpgrn-3
′
utr=人颗粒蛋白前体3
′
非翻译区;bgh poly(a)信号=牛生长激素聚腺苷酸化信号;f1 ori=f1复制起点;kanr=卡那霉素抗性基因。
66.序列列表
67.seq id no:1
–
人类pgrn野生型(pgrn-wt)dna编码序列;
68.seq id no:2
–
候选者i(pgrn-idt)经人工密码子优化的pgrn dna编码序列;
69.seq id no:3
–
候选者ii(pgrn-ga)经人工密码子优化的pgrn dna编码序列;
70.seq id no:4
–
候选者iii(pgrn-gs)经人工密码子优化的pgrn dna编码序列;
71.seq id no:5
–
人生长激素内含子1序列;
72.seq id no:6
–
人生长激素内含子2序列;
73.seq id no:7
–
人生长激素内含子3序列;
74.seq id no:8
–
人生长激素内含子4序列;
75.seq id no:9
–
人生长激素的常规dna信号序列;
76.seq id no:10
–
人生长激素的常规信号序列的翻译的氨基酸序列;
77.seq id no:11
–5′
ese侧翼序列rpl41;
78.seq id no:12
–5′
ese侧翼序列uchl1;
79.seq id no:13
–5′
ese侧翼序列rpl38。
80.seq id no:14
–
人类pgrn 3
′
utr序列
81.seq id no:15
–
突触蛋白启动子序列
82.seq id no:16
–
人类pgrn氨基酸序列
83.seq id no:17
–
syn-hghi3-pgrn-gs-utr dna盒序列(从itr至itr)
84.seq id no:18
–
牛生长激素(bgh)poly(a)信号
85.seq id no:19
–5′
aav2 utr序列
86.seq id no:20
–3′
aav2 utr序列
87.发明详述
88.在一个实施方案中,本发明涉及一种腺相关病毒(aav)载体,其包含(i)人生长激素内含子3(hghi3)序列,(ii)突触蛋白启动子序列,和/或(iii)颗粒蛋白前体3
′
非翻译区(utr)序列,其与编码感兴趣的多肽的多核苷酸序列有效连接。
89.本发明涵盖一个具体的实施方案,其中aav载体盒含有显著增加颗粒蛋白前体蛋白的产生和分泌的经密码子优化的pgrn基因。通过将所述序列置于hgh内含子3的5
′
调控控制下可以进一步增加pgrn分泌。使用神经元特异性启动子,突触蛋白,在体外和体内将颗粒蛋白前体表达限制于神经元,从而降低周围器官毒性和致癌的风险。来自pgrn的3
′
utr也可以包含在盒中以进一步增强和调控pgrn表达。
90.自1970年代后期以来,已经知晓含有内含子和无内含子版本的其他相同的基因可以表现出显著不同的表达谱。hghi3是一种内含子剪接元件(ise)。然而,hghi3在增加aav载体中的转基因表达/分泌方面的具体作用是先前未知的。此外,发明人发现了hgh内含子2和4具有相反的作用。因此,来自包含hghi3序列的aav载体的转基因表达/分泌的增加是令人惊讶和有利的结果。
91.如本文所用,单数形式“一”和“所述”包括单数和复数指示物,除非上下文另有明确规定。
92.如本文所用,术语“包含”与“包括”或“含有”同义,并且是包容性或开放式的,并且不排除额外的、未列举的成员、要素或方法步骤。所述术语还涵盖“由
……
组成”和“基本上由
……
组成”。
93.由端点引用的数值范围包含归入相应范围内的所有数字和分数,以及所引用的端点。
94.如本文所用的术语“约”,当指可测量的值如参数、量、持续时间等时,意指涵盖与
指定值的变化,尤其是与指定值的+/-10%或更小,优选+/-5%或更小,更优选+/-1%或更小,并且还更优选+/-0.1%或更小的变化,只要此类变化适合在所公开的发明中进行。应当理解,修饰语“约”所指的值本身也是具体地且优选地公开的。
95.尽管通过进一步举例说明的方式,术语“一或多”,例如一组成员中的一个或多个成员本身是清楚的,但所述术语尤其涵盖对所述成员中的任何一个或所述成员的任何两个或更多个的提及,例如,所述成员中的任何≥3、≥4、≥5、≥6或≥7等,以及直至所有所述成员。
96.术语“核酸”或“多核苷酸”是指任何长度的核苷酸的(例如聚合的)形式,包括脱氧核糖核苷酸或核糖核苷酸或其类似物。多核苷酸可以包括修饰的核苷酸,例如甲基化核苷酸和核苷酸类似物,并且可以被非核苷酸组分中断。如果存在,可以在聚合物组装之前或之后赋予对核苷酸结构的修饰。如本文所用,术语多核苷酸可互换地指双链和单链分子。除非另有说明或要求,否则本文所述的本发明的任何是多核苷酸的实施方案均涵盖双链形式和已知或预测构成双链形式的两个互补单链形式中的每一种。
97.术语“多肽”、“肽”和“蛋白”在本文中可互换使用,以指代任何长度的氨基酸聚合物。所述术语还涵盖已经修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、磷酸化或与标记组分的缀合。当在将基因产物递送至哺乳动物受试者的上下文中讨论时,多肽如抗血管生成多肽、神经保护多肽等及其组合物是指相应的完整多肽或其任何片段或基因工程化衍生物,其保留了完整蛋白所需的生物化学功能。类似地,对编码抗血管生成多肽的核酸、编码神经保护多肽的核酸和用于将基因产物递送至哺乳动物受试者的其他此类核酸(其可被称为“转基因”以递送至接受细胞(recipient cell))的提及,包括编码完整多肽或具有所需生物化学功能的任何片段或基因工程化衍生物的多核苷酸。
98.一个多核苷酸或多肽与另一多核苷酸或多肽具有一定百分比的“序列同一性”,这意味着,当比对时,在比较两个序列时此百分比的碱基或氨基酸相同。序列相似性可以以多种不同方式确定。为了确定序列同一性,可以使用可从万维网(world wide web)于ncbi.nlm.nih.gov/blast/上获得的方法和计算机程序(包括blast)来比对序列。另一种比对算法是fasta,其可从美国威斯康星州麦迪逊市的oxford molecular group,inc.的一个全资子公司的遗传学计算组(genetics computing group,gcg)包中获得。其他用于比对的技术描述在methods in enzymology,vol.266:computer methods for macromolecular sequence analysis(1996),ed.doolittle,academic press,inc.,a division of harcourt brace&co.,san diego,california,usa中。尤其感兴趣的是允许序列中存在空位(gap)的比对程序。smith-waterman是一种允许序列中出现空位的比对算法。参见meth.mol.biol.70:173-187(1997)。此外,使用needleman和wunsch比对方法的gap程序可用于比对序列。参见j.mol.biol.48:443-453(1970)。
99.感兴趣的是使用smith和waterman的局部同源算法(advances in applied mathematics 2:482-489(1981))的bestfit程序来确定序列同一性。空位生成罚分通常在1至5,一般在2至4的范围内,并且在许多实施方案中将是3。空位延伸罚分通常在约0.01至0.20的范围内,并且在许多情况下将是0.10。所述程序具有由被输入以进行比较的序列确定的默认参数。优选地,使用由所述程序确定的默认参数来确定序列同一性。该程序也可从美国威斯康星州麦迪逊市的遗传计算组(gcg)包中获得。
100.另一个感兴趣的程序是fastdb算法。fastdb描述在current methods in sequence comparison and analysis,macromolecule sequencing and synthesis,selected methods and applications,pp.127-149,1988,alan r.liss,inc.中。百分比序列同一性由fastdb基于以下参数计算得到:
101.错配罚分:1.00;
102.空位罚分:1.00;
103.空位大小罚分:0.33;和
104.加入罚分(joining penalty):30.0。
105.本公开提供了(重组)腺相关病毒(aav)载体。“aav”是腺相关病毒的缩写,并且可用于指病毒本身或其衍生物。除非另有要求,否则所述术语涵盖所有亚型以及天然存在形式和重组形式两者。缩写“raav”是指重组腺相关病毒,也称为重组aav载体(或“raav载体”)。术语“aav”包括例如aav 1型(aav-1)、aav 2型(aav-2)、aav 3型(aav-3)、aav 4型(aav-4)、aav 5型(aav-5)、aav 6型(aav-6)、aav 7型(aav-7)、aav 8型(aav-8)、aav 9型(aav-9)、aav 10型(aav-10,包括aavrh10)、aav 12型(aav-12)、禽aav、牛aav、犬aav、马aav、灵长类动物aav、非灵长类动物aav和绵羊aav。“灵长类动物aav”是指感染灵长类动物的aav,“非灵长类动物aav”是指感染非灵长类哺乳动物的aav,“牛aav”是指感染牛哺乳动物的aav,以此类推。
106.各种aav血清型的基因组序列,以及天然末端重复(tr)、rep蛋白和衣壳亚基的序列是本领域已知的。此类序列可在文献或公共数据库例如genbank中找到。参见,例如,genbank登录号nc-002077(aav-1)、af063497(aav-1)、nc-001401(aav-2)、af043303(aav-2)、nc-001729(aav-3)、nc-001829(aav-4)、u89790(aav-4)、nc-006152(aav-5)、af513851(aav-7)、af513852(aav-8)和nc-006261(aav-8);其公开内容通过引用并入本文。另参见,例如,srivistava等人(1983)j.virology 45:555;chiorini等人(1998)j.virology 71:6823;chiorini等人(1999)j.virology 73:1309;bantel-schaal等人(1999)j.virology 73:939;xiao等人(1999)j.virology 73:3994;muramatsu等人(1996)virology 221:208;shade等人,(1986)j.virol.58:921;gao等人(2002)proc.nat.acad.sci.usa 99:11854;moris等人(2004)virology 33:375-383;国际专利公开wo 00/28061、wo 99/61601、wo 98/11244;和美国专利号6,156,303。
107.本文所述的aav载体通常是重组aav载体(raav)。如本文所用,“raav载体”是指包含非aav来源的多核苷酸序列(即,与aav异源的多核苷酸)的aav载体,所述多核苷酸序列通常是用于细胞的遗传转化目的的序列。在一些实施方案中,异源多核苷酸的侧翼可以是至少一个,且有时是两个aav反向末端重复序列(itr)。优选地,itr衍生自aav血清型2,即raav载体包含aav2 itr。在一些实施方案中,载体包含以下aav2 itr序列或其同源物或变体的之一或两者:
108.seq id no:19:
[0109][0110]
seq id no:20:
[0111][0112]
其他合适的aav itr序列在例如wilmott等人(2019),human gene therapy methodsvol.30,no.6:206-213中讨论并可以从可公开访问的数据库中获得。
[0113]
术语raav载体涵盖raav载体颗粒和raav载体质粒两者。raav载体可以是单链(ssaav)或自互补(scaav)的任一者。包含可用于本发明载体的其他序列元件的合适克隆载体是rs540-aav-erbb-raser1c-ofpbidbh3,其公开于genbank登录号mk801287.1中。
[0114]“aav病毒”或“aav病毒颗粒”或“raav载体颗粒”是指包含至少一种aav衣壳蛋白(通常是野生型aav的所有衣壳蛋白)和包在壳内的多核苷酸raav的病毒颗粒。如果所述颗粒包含异源多核苷酸(即,除野生型aav基因组之外的多核苷酸,例如待递送至哺乳动物细胞的转基因),则通常将其称为“raav载体颗粒”或简称为“raav载体”。因此,raav颗粒的产生必然包括raav载体的产生,因为这样的载体包含在raav颗粒中。
[0115]
如本文所用,“重组”意指载体、多核苷酸、多肽或细胞是克隆、限制或连接步骤(例如涉及其中包含的多核苷酸或多肽)和/或产生与自然界中发现的产物不同的构建体的其他过程的多种组合的产物。重组病毒或载体是包含重组多核苷酸的病毒颗粒。所述术语分别包括原始多核苷酸构建体的复制品和原始病毒构建体的后代。
[0116]
在本发明的实施方案中,aav载体包含编码基因产物的核酸序列,例如编码异源多肽的异源核苷酸序列。“基因”是指含有至少一个开放阅读框的多核苷酸,其能够在被转录和翻译后编码特定蛋白。“基因产物”是由特定基因的表达产生的分子。基因产物包括例如多肽、适体、干扰rna、mrna等。
[0117]“异源”意指衍生自基因型上不同的实体,其与与之比较的实体的其余部分不同。例如,通过基因工程技术引入衍生自不同物种的质粒或载体中的多核苷酸是异源多核苷酸。从其天然编码序列中去除并与天然不与之相连的编码序列有效连接的启动子是异源启动子。因此,例如,包含编码异源基因产物的异源核酸的raav是包含通常不包含在天然存在的野生型aav中的核酸的raav,并且编码的异源基因产物是通常不是由天然存在的野生型aav编码的基因产物。
[0118]
在一个实施方案中,基因产物(感兴趣的多肽)是治疗蛋白。“治疗”肽或蛋白是可以减轻或减少由细胞或受试者中的蛋白缺乏或缺陷引起的症状的肽或蛋白。或者,“治疗”肽或蛋白是另外赋予受试者益处如抗退行作用的肽或蛋白。
[0119]
当基因产物是多肽时,所述多肽通常是增强细胞,如存在于神经元组织中的细胞如神经元、神经胶质细胞或感光细胞,的功能的多肽。示例性多肽包括神经保护多肽(例如,gdnf、cntf、nt4、ngf和ntn);抗血管生成多肽(例如,可溶性血管内皮生长因子(vegf)受体;vegf结合抗体;vegf结合抗体片段(例如,单链抗vegf抗体);内皮细胞抑制素(endostatin);抑瘤蛋白(tumstatin);血管抑素(angiostatin);可溶性fit多肽(lai等人(2005)mol.ther.12:659);包含可溶性fit多肽的fc融合蛋白(参见例如pechan等人(2009)gene ther.16:10);色素上皮-衍生因子(pigment epithelium-derived factor,pedf);可溶性tie-2受体;等);金属蛋白酶-3的组织抑制剂(tissue inhibitor of metalloproteinases-3,timp-3);光响应视蛋白(light-responsive opsin),例如视紫红
质(rhodopsin);抗凋亡多肽(例如,bcl-2、bcl-xl);等等。合适的多肽包括但不限于胶质细胞衍生的神经营养因子(glial derived neurotrophic factor,gdnf);成纤维细胞生长因子2;神经营养因子(neurturin,ntn);睫状神经营养因子(ciliary neurotrophic factor,cntf);神经生长因子(nerve growth factor,ngf);神经营养蛋白-4(neurotrophin-4,nt4);脑源性神经营养因子(brain derived neurotrophic factor,bdnf);表皮生长因子;视紫红质;x连锁凋亡抑制剂;和音猬因子(sonic hedgehog)。合适的多肽在例如wo2012/145601中公开。然而,在一个优选的实施方案中,编码的多肽包含颗粒蛋白前体。
[0120]
在本发明的实施方案中,多核苷酸序列与以下有效连接:(i)人生长激素内含子3(hghi3)序列,(ii)突触蛋白启动子序列,和/或(iii)颗粒蛋白前体3
′
非翻译区(utr)序列。在一些实施方案中,编码多肽的多核苷酸序列与启动子如组成型启动子或诱导型启动子有效连接。在一些情况下,编码感兴趣的多肽的核苷酸序列与组织特异性或细胞类型特异性调控元件有效连接。
[0121]
例如,在一些情况下,编码感兴趣的基因产物的核苷酸序列与神经元特异性调控元件(例如神经元特异性启动子)如赋予有效连接基因在神经元中的选择性表达的调控元件有效连接。合适的神经元特异性启动子包括神经元特异性烯醇化酶(neuron-specific enolase,nse)启动子,andersen等人cell.mol.neurobiol.,13:503-15(1993;神经丝轻链基因启动子,piccioli等人,proc.natl.acad.sci.usa,88:561 1-5(1991);和神经元特异性vgf基因启动子,piccioli等人,neuron,15:373-84(1995)];以及其他。然而,神经元特异性启动子优选是突触蛋白启动子。
[0122]“控制元件”或“控制序列”是参与分子的相互作用的核苷酸序列,其有助于多核苷酸的功能调控,包括多核苷酸的复制(replication)、复现(duplication)、转录、剪接、翻译或降解。所述调控可以影响过程的频率、速度或特异性,并且可以在本质上是增强或抑制的。本领域已知的控制元件包括例如转录调控序列,例如启动子和增强子。启动子是在某些条件下能够结合rna聚合酶并启动通常位于启动子下游(在3
′
方向)的编码区的转录的dna区域。
[0123]“有效连接”(
″
operatively linked
″
或
″
operably linked
″
)是指遗传元件的并置(juxtaposition),其中元件处于允许它们以预期方式操作的关系中。例如,如果启动子有助于启动编码序列的转录,则启动子与编码区有效连接。启动子和编码区之间可以存在中间残基(intervening residue),从而保持这种功能关系。
[0124]
如本文所用,术语“启动子”可以指与编码重组产物的dna序列位置相邻的dna序列。启动子优选与相邻的dna序列有效连接。与不存在启动子时表达的重组产物的量相比,启动子通常增加从dna序列表达的重组产物的量。来自一种生物体的启动子可用于增强源自另一种生物体的dna序列的重组产物表达。例如,脊椎动物启动子可用于在脊椎动物中表达水母gfp。此外,一个启动子元件可以增加针对串联连接的多个dna序列表达的重组产物的量。因此,一个启动子元件可以增强一种或多种重组产物的表达。多个启动子元件是本领域普通技术人员公知的。
[0125]
如本文所用,术语“增强子”可以指与编码重组产物的dna序列位置相邻的dna序列。增强子元件通常位于启动子元件的上游或可以位于编码dna序列(例如,被转录或翻译成一种或多种重组产物的dna序列)的下游或之内。因此,增强子元件可以位于编码重组产
物的dna序列上游或下游的100个碱基对、200个碱基对或300个或更多碱基对。增强子元件可以使从dna序列表达的重组产物的量增加至高于由启动子元件提供的表达量增加。多种增强子元件是本领域普通技术人员容易获得的。
[0126]
在一些实施方案中,aav载体可以进一步包含聚腺苷酸化信号。例如,poly(a)信号通常可以存在于包含编码感兴趣的多肽的多核苷酸的盒的3
′
末端。在一个实施方案中,poly(a)信号存在于颗粒蛋白前体3
′
非翻译区的下游,即,在3
′
utr序列和盒侧翼的itr之一的之间。在一个实施方案中,poly(a)序列包含牛生长激素(bgh)poly(a)信号或由其组成。合适的聚腺苷酸化信号(包括bgh poly(a))是已知的,并且描述在例如choi等人molecular brain 2014,7:17;goodwin ec,j biol chem.1992;267:16330
–
16334和美国5,122,458中。在一个实施方案中,bgh poly(a)信号包含seq id no:18的序列,或其同源物或变体:
[0127]
seq id no:18
[0128][0129]
本公开提供了一种药物组合物或药物,其包含:a)如本文所述的aav载体;和b)药学上可接受的载体、稀释剂、赋形剂或缓冲剂。在一些实施方案中,药学上可接受的载体、稀释剂、赋形剂或缓冲剂可适用于人类。
[0130]“药学上可接受的”意指在生物学或其他方面不是不合需要的物质,例如,所述物质可以被施用给受试者而不引起任何不合需要的生物学效应。因此,此类药物组合物可用于例如离体转染细胞或将病毒颗粒或细胞直接施用给受试者。
[0131]
此类赋形剂、载体、稀释剂和缓冲剂包括可以被施用而没有过度毒性的任何药剂。药学上可接受的赋形剂包括但不限于液体,例如水、盐水、甘油和乙醇。
[0132]
如本文所用,术语“一种或多种生理学或药学上可接受的载体、赋形剂和/或稀释剂”旨在包括任何和所有溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等,其与向人类或其他脊椎动物宿主施用相容。通常,药学上可接受的稀释剂、赋形剂和/或载体是由联邦、州政府的监管机构或其他监管机构批准或列于美国和/或欧洲药典或其他公认的用于动物(包括人类以及非人类哺乳动物)的药典中的稀释剂、赋形剂和/或载体。术语稀释剂、赋形剂和/或“载体”是指与药物组合物一起施用的稀释剂、佐剂、赋形剂或媒介物。此类药物稀释剂、赋形剂和/或载体可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些油。水、盐水溶液以及右旋糖和甘油水溶液可以用作液体稀释剂、赋形剂和/或载体,尤其是用于可注射溶液。合适的药物稀释剂和/或赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、二醇、水、乙醇等。如果需要,所述组合物还可以含有少量润湿剂、膨胀剂(bulking agent)、乳化剂或ph缓冲剂。这些组合物可以采用溶液、悬浮剂、乳剂、缓释制剂等形式。合适的药物稀释剂、赋形剂和/或载体的示例描述在e.w.martin的“remington
′
s pharmaceutical sciences”中。制剂应当适合于施用方式。合适的稀释剂、赋形剂和/或载体对本领域技术人员来说将是显而易见的并且将在很大程度上取决于施用途径。
[0133]
其中可以包括药学上可接受的盐,例如,矿物酸盐如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;以及有机酸的盐,例如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。另外,辅助物质
(auxiliary substance),例如润湿剂或乳化剂、ph缓冲物质等,可以存在于此类媒介物中。多种多样的药学上可接受的赋形剂是本领域已知的并且不需要在本文中详细讨论。药学上可接受的赋形剂已在多种出版物中得到充分描述,包括例如a.gennaro(2000)
″
remington:the science and practice of pharmacy,
″
20th edition,lippincott,williams,&wilkins;pharmaceutical dosage forms and drug delivery systems(1999)h.c.ansel等人,编,第7版,lippincott,williams,&wilkins;和handbook of pharmaceutical excipients(2000)a.h.kibbe等人,编,第3版amer.pharmaceutical assoc。
[0134]
可注射制备物,例如无菌可注射水性或油质(oleaginous)悬浮液,可以根据已知技术使用合适的分散剂或润湿剂和悬浮剂来制备。无菌可注射制备物也可以是在无毒的胃肠外可接受的稀释剂或溶剂中的无菌可注射溶液、悬浮液或乳剂,例如在1,3-丁二醇中的溶液。可以使用的可接受的媒介物和溶剂包括水、林格溶液和等渗氯化钠溶液。此外,无菌的不挥发油通常用作溶剂或悬浮介质。为了这个目的,可以使用任何温和的不挥发油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸如油酸用于制备注射剂。可注射制剂可被灭菌,例如,通过细菌截留过滤器(bacteria-retaining filter)过滤,或通过加入无菌固体组合物形式的灭菌剂,其可在使用前溶解或分散在无菌水或其他无菌可注射介质中。
[0135]
用于经口施用的固体剂型包括胶囊、片剂、丸剂、粉末和颗粒剂(granule)。在此类固体剂型中,将包封或未包封的组合物与以下混合:至少一种惰性的药学上可接受的赋形剂或载体如柠檬酸钠或磷酸二钙和/或(a)填充剂(filler)或增剂(extender),例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸,(b)粘合剂,例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯胶(acacia),(c)保湿剂(humectant),例如甘油,(d)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐和碳酸钠,(e)溶液阻滞剂(solution retarding agent),例如石蜡,(f)吸收促进剂,例如季铵化合物,(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯,(h)吸收剂,例如高岭土和膨润土,和(i)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,及其混合物。在胶囊、片剂和丸剂的情况下,剂型还可以包含缓冲剂。
[0136]
本文所述的药物可以作为试剂盒提供,所述试剂盒包含至少一个容器和包装插页。所述容器含有至少一个剂量的包含如本文所述的组合物的药物。包装插页或标签包括使用本文所述的药物治疗患者的说明。试剂盒可以进一步包含可用于施用药物的其他材料,例如稀释剂、过滤器、iv袋和管线、针头和注射器。
[0137]
本发明的方法提供了将核酸序列递送至宿主组织或细胞中的方法。本发明的载体和其他试剂、方法和药物制剂还可用于将蛋白或肽施用给有此需要的受试者的方法(作为治疗方法或其他方法)中。以这种方式,蛋白或肽可因此在受试者体内产生。受试者可能需要蛋白或肽作为治疗方法或其他方法,因为受试者缺乏蛋白或肽,如下文进一步解释的。
[0138]
如本文所用,术语“治疗”等是指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防或逆转疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或可归因于该疾病的不良反应而言可以是治疗性的。如本文所用,“治疗”涵盖对哺乳动物,尤其是人类的疾病的任何治疗,并且包括:(a)预防疾病在可能易患疾病或处于患上疾病的风险中但尚未被诊断为患有疾病的受试者中发生;(b)抑制疾病,即阻止其发展;(c)缓解疾病,即导致疾病消退。
[0139]
通常,本发明可用于递送任何具有以下生物学效应的外来核酸:治疗或改善关于与任何器官、组织或细胞中基因表达相关的任何病症(尤其是与例如脑相关的那些)的症状。
[0140]
基因转移(gene transfer)在理解疾病状态和对其提供治疗方面具有巨大的潜在用途。有许多其中有缺陷的基因是已知的并且已被克隆的遗传性疾病。在一些情况下,这些克隆基因的功能是已知的。通常,上述疾病状态分为两类:缺陷状态,通常是酶,其通常以隐性方式遗传;和不平衡状态,至少有时涉及调控或结构蛋白,其以显性方式遗传。对于缺陷状态的疾病,基因转移可用于将正常基因带入受影响的组织以进行代替治疗(replacement therapy),以及使用反义突变创建所述疾病的动物模型。对于不平衡状态的疾病,基因转移可用于在模型系统中创建疾病状态,其随后可尝试用于对抗疾病状态。因此,本发明的方法允许治疗遗传性疾病。如本文所用,疾病状态通过部分或全部补救导致疾病或使其更严重的缺陷或失衡来治疗。使用核酸序列的位点特异性整合来产生突变或纠正缺陷也是可能的。
[0141]
在一个方面,本发明提供了一种将基因产物递送至受试者的组织或细胞(例如,神经元组织或细胞)的方法,该方法包括向受试者施用如上所述的aav载体。基因产物可以是多肽,例如如上所述。例如,细胞可以是血细胞、干细胞、骨髓(例如造血)细胞、肝细胞、癌细胞、血管细胞、胰腺细胞、神经细胞、神经胶质细胞、上皮或内皮细胞、树突细胞、成纤维细胞、肺细胞、肌肉细胞、心肌细胞、肠细胞或肾细胞。同理,组织可以例如选自血液、骨髓、肌肉组织(例如,骨骼肌、心肌或平滑肌,包括血管平滑肌)、中枢或周围神经系统组织(例如,脑、神经元组织或视网膜组织)、胰腺组织、肝组织、肾组织、肺组织、肠组织或心脏组织。
[0142]
将基因产物递送至神经元组织或细胞可提供神经病症的治疗。可以将基因产物递送至神经元组织中存在的各种细胞类型,例如,神经元或神经胶质细胞(例如,星形胶质细胞、少突胶质细胞等)。
[0143]
本公开提供了一种治疗疾病(例如神经疾病)的方法,所述方法包括向有此需要的个体施用有效量的如上所述的aav载体。受试aav载体可以通过颅内注射、脑内注射、眼内注射、静脉内注射或通过任何其他方便的施用方式或途径进行施用。
[0144]
其他示例性施用方式包括经口、经直肠、透粘膜、外用、透皮、吸入、胃肠外(例如,静脉内、皮下、皮内、肌内和关节内)施用等,以及直接组织或器官注射,或者,鞘内、直接肌内、心室内、静脉内、腹膜内、鼻内或眼内注射。可将注射剂制备成常规形式,作为液体溶液或悬浮液、适合在注射前溶解或悬浮在液体中的固体形式,或者作为乳液。另外,可以以局部而非全身方式施用病毒,例如以贮库(depot)或缓释形式。
[0145]
优选以足以导致异源核酸序列在受试者的细胞(例如神经元细胞)中感染(或转导)和表达的量向受试者施用重组病毒载体。优选地,靶细胞是神经细胞(包括中枢和周围神经系统的细胞,尤其是脑细胞)。
[0146]
优选地,载体以治疗有效量施用。如本文所用,“治疗有效”量是足以减轻(例如,缓解、减少、降低)至少一种与疾病状态相关的症状或原因的量。或者说,“治疗有效”量是足以使受试者的病况有一些改善的量。“治疗有效量”将落入可通过实验和/或临床试验确定的相对宽的范围内。例如,对于体内注射,治疗有效剂量可以是约106至约10
15
个aav病毒体,例如约108至10
12
个aav病毒体的量级。对于体外转导,待递送至细胞的有效量的aav病毒体将
是约108至约10
13
个aav病毒体的量级。其他有效剂量可由本领域普通技术人员通过常规试验建立剂量反应曲线来容易地建立。如本领域普通技术人员将理解的,包含如本文所述的aav载体的组合物或药物的有效量可以根据诸如期望的生物学终点、待递送的药物、靶组织、施用途径等因素而变化。可以考虑的其他因素包括疾病严重程度;正在治疗的患者的年龄、体重和性别;饮食、施用时间和频率;药物组合;反应敏感性;和对治疗的耐受性/反应。
[0147]
在一些实施方案中,可以采用多于一次施用(例如,两次、三次、四次或更多次施用)以在不同间隔的时间段内实现所需的基因表达水平,例如每天、每周、每月、每年等。
[0148]
本发明可用于兽医和医学应用。合适的受试者包括禽类和哺乳动物,优选哺乳动物。如本文所用,术语“禽类”包括但不限于鸡、鸭、鹅、鹌鹑、火鸡和野鸡。如本文所用,术语“哺乳动物”包括但不限于人类、牛、绵羊、山羊、马、猫、犬、兔类等。最优选人类受试者。人类受试者包括胎儿、新生儿、婴幼儿、青少年和成人受试者。
[0149]
除非另有说明,否则用于公开本发明的所有术语,包括技术和科学术语,具有本发明所属领域的普通技术人员通常理解的含义。通过进一步指导的方式,可以包括术语定义以更好地理解本发明的教导。
[0150]
应当理解,为了清楚起见,在单独实施方案的上下文中描述的本发明的某些特征也可以在单个实施方案中组合地提供。反过来,为了简洁起见,在单个实施方案的上下文中描述的本发明的各种特征也可以单独提供或以任何合适的子组合提供。属于本发明的实施方案的所有组合均被本发明具体涵盖并且在本文中公开,就好像各个和每个组合均被单独地且明确地公开一样。此外,各种实施方案及其要素的所有子组合也均被本发明具体涵盖并在本文中公开,就好像各个和每个这样的子组合在本文中单独且明确地公开一样。
[0151]
提供以下实施例以说明本发明的某些实施方案。不旨在以任何方式限制本发明。
实施例
[0152]
实施例1:通过密码子优化算法提高pgrn翻译的效率
[0153]
通过改变密码子以使用对特定物种最佳的密码子可以提高从rna转录物翻译蛋白的速率,并且可以增加特定细胞类型中的基因表达。通过优化每个转录物的蛋白产生,使用的病毒载体数量更少,从而降低了毒性风险和成本。使用三个开源程序(idt、geneart和genscript:参见材料和方法中的详细信息)对野生型pgrn转录物的优化进行了建模。使用稀有密码子分析工具验证密码子适应指数(cai;https://www.genscript.com/tools/rare-codon-analysis)。cai为1.0被认为是理想的,而cai》0.8被评为在目标表达生物体中表达良好。数字越低,基因表达不佳的可能性就越高。
[0154]
1.1密码子优化设计
[0155]
使用市面上可获得的密码子优化算法(https://eu.idtdna.com/codonopt)、(https://www.thermofisher.com/order/geneartgenes/projectmgmt)和(https://www.genscript.com/tools/rare-codon-analysis))。密码子适应指数(cai,genescript)用于对修饰的grn序列进行评分。cai》0.8被评为适合在目标生物体中表达,且使用不同算法生成的序列和cai如图1a和1b所示。为了开发最佳密码子优化的pgrn,使用了针对人类和其他物种的算法(图1c)。设计和合成了14种新构建体。将共有kozak序列(gccacc)插入在atg起始密码子之前,并分别由idt、geneart
和genscript制备并命名为pgrn-idt、pgrn-ga和pgrn-gs。
[0156]
1.1.1 pgrn密码子优化
[0157]
为了确定最佳密码子优化的pgrn序列,使用genscript算法(https://www.genscript.com/codon_opt_pr.html)服务来应用双重密码子优化,以确保经密码子优化的序列在动物模型以及人类细胞系和人类中都是可行的:针对人类的pgrn密码子优化可能不适用于其他物种,例如小鼠或大型动物(绵羊或猴子)。因此,设计了十二种经双重密码子优化的人类pgrn转基因,其显著提高了人类和其他物种两者的cai得分(参见图1c)。然而,通过蛋白质印迹测试的pgrn表达和分泌水平并没有显著改善pgrn蛋白表达,除了针对人类和小鼠进行优化的一种转基因(codop12,pgrn-gs;图1a和1b)。因此,使用针对人类pgrn的其他算法以创建pgrn-idt和pgrn-ga。然后测试所有三种构建体(pgrn-gs、pgrn-ga和pgrn-idt)的最佳表达水平。
[0158]
1.1.2使用三种不同算法设计的经密码子优化的pgrn的序列
[0159]
a)人类pgrn野生型(pgrn-wt)dna编码序列(编码序列(cds)长度:1782bp)[seq id no:1]:
[0160]
[0161][0162]
[0163]
野生型人类pgrn的密码子适应指数(cai)为0.83,且gc含量为63.22%。gc含量的理想百分比范围在30%到70%之间。
[0164]
b)候选者i(pgrn-idt)人工密码子优化的pgrn dna编码序列(cds长度:1782bp)[seq id no:2]:
[0165]
[0166][0167]
经密码子优化的候选者i(pgrn-idt)的cai为0.73,且gc含量为59.33%。该密码子优化序列与野生型有76.11%的同源性。
[0168]
c)候选者ii(pgrn-ga)人工密码子优化的pgrn dna编码序列(cds长度:1782bp)[seq id no:3]:
[0169]
[0170][0171]
经密码子优化的候选者ii(pgrn-ga)的cai为0.9,且gc含量为56.23%。经密码子优化的序列与野生型有78.81%的同源性。
[0172]
d)候选者iii(pgrn-gs)人工密码子优化的pgrn dna编码序列(cds长度:1782bp)[seq id no:4]:
[0173]
[0174][0175]
经密码子优化的候选者iii(pgrn-gs)的cai在人类中为0.92,且在小鼠中为0.94。候选者3的gc含量为63.23%。经密码子优化的序列与野生型有81.34%的同源性。
[0176]
使用不同公司算法的经密码子优化的hpgrn的候选者i、ii、iii的示意图如图2a所示。
[0177]
候选者i至iii和野生型编码序列(seq id no:1至4)中的每一个均编码颗粒蛋白前体的氨基酸序列(seq id no:16):
[0178][0179]
1.2.pgrn-融合候选者的产生
[0180]
由于pgrn是分泌蛋白,所以5
′
引导序列对于分泌信号是重要的。推测rna序列可能在将mrna引导至内质网进行翻译中起关键作用。因此,使用bamh1和bstb1限制位点,将经密码子优化的序列的5
′
区域替换为经密码子优化的蛋白编码序列上游的野生型5
′
grn序列(392bp)。这产生了paav-cmv-pgrn-idt-融合体、paav-cmv-pgrn-ga-融合体和paav-cmv-pgrn-gs-融合体。
[0181]
图2b)是三个经密码子优化的候选者的融合质粒的示意图,其中经密码子优化的序列的5
′
序列已被替换为野生型人类pgrn的5
′
序列。
[0182]
1.3.经密码子优化的和pgrn融合候选者的完全表征
[0183]
将经密码子优化的pgrn的表达水平与野生型人类pgrn进行比较。在细胞培养基和细胞裂解物中直接测量分泌的pgrn水平,并将其相对于细胞计数进行归一化,作为相对于管家蛋白gapdh的比率。为了直接比较每个pgrn盒的pgrn生产的相对效率,通过cmv的定量qpcr(作为相对于相同管家基因gapdh的比率(cmv/gapdh),其代表有效的hek-293细胞转导)来定量每个细胞的载体基因组拷贝数量。这用作归一化和准确定量每个盒的pgrn水平的分母(denominator)。
[0184]
将人肾细胞系(hek-293)系于37℃保持在co2(5%)的加湿室中,并保存在供有10%胎牛血清和1%青霉素-链霉素的达尔伯克改良培养基(dulbecco’smodified medium)(dmem,thermo scientific)中。细胞每三天传代一次。
[0185]
根据制造商的方案,使用lipofectamine 2000(life technologies)将hek-293细胞于80%汇合度时转染在24孔板中以进行蛋白质印迹。将总共250ng dna转染或共转染在40,000个细胞中。paav-cmv-egfp或paav-syn-egfp用作转染效率对照。为了检查pgrn的分泌水平,将培养基更换为不含血清的培养基,在第二天向其补充胰岛素转铁蛋白硒(insulin transferrin selenium,its)。48小时后,收集培养基并立即用于蛋白质印迹分析。用温和的裂解缓冲液(np40)裂解细胞,然后以10,000xg离心10分钟。收集转染孔的上清液用于pgrn elisa中,并将沉淀储存在-80c用于基因组dna提取。
[0186]
将蛋白样品加载到具有mops sds运行缓冲液(thermo fisher)的预制novex
tm 10%bis-tris midi凝胶上,并在恒定100v下运行。将凝胶短暂浸于nupage转移缓冲液(thermo fisher)中,然后使用iblot 2
tm
(thermo fisher)转移蛋白。使用含有磷酸盐缓冲盐水(pbs)的封闭试剂(roche,10%)以封闭蛋白膜1小时。之后,将膜在稀释于5%封闭缓冲液中的一抗中于4℃下孵育过夜。用含有tween 20的tris缓冲盐水(tbs-t)洗涤3次后,将膜与二抗孵育1小时。洗涤3次后,在clx红外成像系统(biosciences)上扫描膜。使用imagej和imagestudio
tm-light测量每个蛋白条带的强度。用于蛋白质印迹检测的一抗是grn(abcam,ab191211)和gapdh(abcam,ab82485)。用于蛋白质印迹检测的二抗是山羊抗小鼠igg(h+l)680/800缀合物(thermo fisher,25518,sa535521,1:5,000)和山羊抗兔(h+l)dylight 680/800缀合物(thermo fisher,35568,sa535571,1:5,000)。
[0187]
培养基中pgrn的蛋白质印迹显示,低cai候选者i(idt)表现出显著降低的表达(参见图3a)。然而,高cai候选者ii(ga)和iii(gs)的pgrn表达和分泌与野生型pgrn相当或高于野生型pgrn。在四个独立实验中测试和进行三个生物学重复。与野生型相比,pgrn-gs显著增加了72%的pgrn表达(p=0.0327)。
[0188]
还测试了几种“融合构建体”。这些融合构建体保留了野生型基因组信号序列和侧翼区域,直至bstb1限制位点与经密码子优化的pgrn序列融合(参见图2b,黄色)。不幸的是,pgrn-融合盒的pgrn蛋白分泌与野生型pgrn相似或低于野生型pgrn(参见图3a和3b)。最初的结论是,在仅cmv启动子下,野生型pgrn的392bp 5
′
常规侧翼dna序列没有显著改善经密
码子优化的pgrn分泌。然而,随后的结果显示,当与5
′
内含子增强序列组合时,融合构建体的表达增强(见下文)。
[0189]
hek细胞裂解物的蛋白质印迹显示了与分泌的pgrn相似的结果,其中经密码子优化的pgrn-ga和gs分别使pgrn表达提高了39.55%(不显著)和127.7%(p=0.0014)。然而,pgrn-idt和其他“融合”构建体再次未能增加pgrn表达(参见图4a和4b)。
[0190]
实施例2:开发内含子增强元件以增加pgrn表达。
[0191]
为了进一步增加pgrn的表达和分泌,探索了在pgrn的5
′
序列中添加内含子以查看是否可以增强基因表达。内含子可以通过影响转录速率、核输出(nuclear export)、转录物稳定性或mrna翻译效率来提高转录水平,这种现象称为内含子介导的增强(intron-mediated enhancement,ime)(shaul o.int j biochem cell biol.2017oct;91(pt b):145-155)。对小于300bp的可用于测试内含子介导的增强的内含子序列进行了搜索。将人类生长激素(hgh)基因内的内含子选为合适的候选者(参见图5a)。
[0192]
基因合成野生型grn序列并使用bamh1和xho1限制位点克隆至paav质粒(addgene;99280)中。这些构建体用作主载体(master vector)(paav-cmv-pgrnwt)以亚克隆先前经密码子优化的构建体。对于paav-syn-pgrnwt,使用pci1和bamh1限制位点从addgene载体(58881)替换人突触蛋白启动子序列。
[0193]
突触蛋白启动子的多核苷酸序列如(seq id no:15)中所示:
[0194][0195]
使用人类生长激素(hgh1)的内含子序列改善pgrn表达。hgh1包含四个内含子,这些内含子由genscript合成并使用bamh1和age1限制位点克隆至paav-cmv-pgrn质粒中,以生成paav-cmv-hghi1-pgrn、paav-cmv-hghi2-pgrn、paav-cmv-hghi3-pgrn和paav-cmv-hghi4-pgrn。结构元件对于内含子介导的增强(ime)是重要的。因此,通过外显子剪接增强子(ese)-finder(ese 3.0,http://krainer01.cshl.edu/cgi-bin/tools/ese3/esefinder.cgi)和在grn上预测的ese高频来分析野生型pgrn编码序列。为了进一步增强pgrn表达,将hghi3内含子引入保留野生型pgrn的5
′
ese元件的融合构建体中,以产生paav-cmv-hghi3-pgrn-ga-融合体和paav-cmv-hghi3-pgrn-gs-融合体。使用bamh1和age1限制位点以生成神经元特异性表达构建体paav-syn-hghi3-pgrn-ga-融合体和paav-syn-hghi3-pgrn-gs。
[0196]
seq id no:5是人类生长激素内含子1的序列(261bp):
[0197][0198]
seq id no:6是人类生长激素内含子2的序列(209bp):
[0199][0200]
seq id no:7是人类生长激素内含子3的序列(92bp):
[0201][0202]
seq id no:8是人类生长激素内含子4的序列(253bp):
[0203][0204]
paav-cmv-pgrnwt和paav-cmv-pgrn-gs中位于限制位点bamh1和bstb1侧翼的区域(1-392bp)用于信号序列替换。将pgrn信号序列的n末端区域(1-51bp)用78bp的hgh1取代以用于基因合成。使用bamh1和bstb1限制位点将这些亚克隆至paav-cmv-pgrnwt和paav-cmv-pgrn-gs中,以生成paav-cmv-hghs-pgrnwt和paav-cmv-hghs-pgrn-gs。
[0205]
seq id no:9是人类生长激素的常规dna信号序列,其替换了pgrn信号序列:
[0206][0207]
seq id no:10是人类生长激素的常规信号序列翻译的氨基酸序列:
[0208]
matgsrtslllafgllclpwlqegsa(seq id no:10)
[0209]
为了测试对pgrn表达的影响,将hgh内含子2、3和4序列克隆至pgrn-wt的5
′
utr区域(参见图5b)。此外,将pgrn的野生型信号序列用hgh信号序列取代(参见图5c)。
[0210]
2.1内含子增强子元件的添加
[0211]
通过蛋白质印迹评估每个hgh内含子对pgrn表达和分泌的效率(方法见上文),其证明内含子3极大增加了分泌的pgrn(105%,p=0.0004),而内含子4减少了分泌,且内含子2消除了分泌(参见图6a和6b)。此外,如图6a和6b所示,用hgh信号肽替换野生型pgrn信号肽也显示分泌的pgrn显著增加(71%,p=0.0088)。
[0212]
在hek-293细胞裂解物中测量的pgrn表达水平证实,内含子3使pgrn表达显著增加(148%,p=0.0009)(参见图7a和7b),而内含子4使pgrn的pgrn表达降低了40%,且内含子2消除了表达。如图7a和7b所示,用hgh信号序列取代野生型使pgrn表达增加了23%,这并不显著。
[0213]
这些结果表明内含子3增强了pgrn翻译,这转而增加了pgrn向培养基中的分泌。用hgh的信号肽进行取代些许增加了pgrn分泌但不增加表达。
[0214]
实施例3:将内含子和外显子增强子元件组合。
[0215]
为了测试hghi3对经密码子优化的pgrn-gs的内含子介导的增强,将hghi3元件亚克隆至pgrn-gs的5
′
位置。
[0216]
令人惊讶的是,hghi3对pgrn-gs表达没有增强作用(参见图8a和8b),因为包含内含子3些许降低了pgrn。这表明hghi3的作用可能需要野生型pgrn序列内的外显子剪接元件(ese)以对剪接产生协同作用。使用软件ese finder 3.0搜寻野生型pgrn和经密码子优化的pgrn-gs序列中的ese元件(参见图8c)。与野生型pgrn相比,经密码子优化的pgrn-gs中的ese分布模式显著改变。因此,对pgrn进行密码子优化的尝试由于包含hghi3而无意中去除了提供增强所需的ese。
[0217]
因此,将内含子增强子hghi3与携带与pgrn-ga密码子优化序列融合的野生型grn的初始392bp序列的pgrn融合构建体组合(参见图9a)。将其包装到aav9载体中,并以1e6的moi递送至培养中的大鼠原代皮质神经元中。
[0218]5′
ese侧翼序列如下:
[0219]
rpl41:
[0220][0221]
uchl1:
[0222][0223]
rpl38:
[0224][0225]
上述5
′
ese侧翼序列可用于本发明的一些实施方案中。然而,在以下实施例中,这些序列没有被进一步研究。
[0226]
对于每种病毒,低传代(≤p30)hek-293t细胞的10
×
145cm2平板在转染当天以约80%的汇合度使用。将细胞在37℃、5%co2下在含10%热灭活fbs的达尔伯克改良伊格尔氏培养基(dmem,gibco)中培养。对于转染混合物,将800μl的1mg/ml pei添加到15ml无血清dmem中。在一个单独的试管中,将240μg adeno辅助质粒(含有来自腺病毒基因组的必需基因,其支持aav基因组的挽救和复制)、80μg rep2/cap9质粒和80μg含有单链转基因的质粒添加到无血清dmem中,以使最终体积为30ml。然后将含有dna的混合物通过0.45μm的聚醚砜(pes,sartorius,epsom,uk)注射器过滤器过滤到含有pei的混合物中。将溶液混合并在室温下孵育15分钟。然后将转染溶液逐滴添加到每个145cm2培养皿中。
[0227]
在转染72小时后收获aav病毒颗粒。收集汤(soup)和沉淀(pellet)并进行冻融循环。所有上清液和沉淀均用benzonase(50unit/ml,37c,30分钟)处理,然后在18℃下以2000xg离心30分钟。用0.45μm孔径过滤器过滤上清液,并随后上样到akta系统上的预平衡aavx poros亲和柱(thermo fisher)以进行aav纯化。将纯化的aav保持在-80℃。
[0228]
在胚胎第18天(e18)(sprague-dawley大鼠)从皮质组织中分离出神经元细胞。将100,000个细胞铺板在pdl包被的24孔板上。将细胞在补充有青霉素/链霉素(0.5%)、glutamax(1%)和b27(2%,thermo fisher)的神经元基础培养基(neurobasal media)中生长。在体外第7天(div)以1e6的感染复数(multiplicity of infection,moi)用aav转导细胞。在div12收获神经元,并进行蛋白质印迹(方法见上文)和elisa。
[0229]
按照制造商的方案,在转染后48小时使用dneasy血液和组织试剂盒(qiagen)分离基因组dna。使用nanodrop
tm
测量dna浓度。
[0230]
使用adipogen life sciences颗粒蛋白前体(人)elisa试剂盒(ag-45a-0018yek-ki01)评估样品的pgrn含量。夹心elisa试剂盒使用预包被在微量滴定板上的多克隆抗体捕获样品中的人类颗粒蛋白前体,并使用生物素化的第二多克隆抗体检测蛋白。将strep-hrp溶液添加到孔中,并使用tmb底物10分钟,添加酸性终止溶液并测量每个孔在450nm处的吸光度来检测pgrn信号。使用重组人pgrn标准在0.063-4ng/ml的范围内计算pgrn的浓度。测定所需的标准品和所有其他试剂均包含在试剂盒中。
[0231]
如图9b和9c所示,由hghi3-pgrn-ga构建体转导的皮质神经元的pgrn分泌大于单独的hghi3-野生型pgrn的pgrn分泌。
[0232]
这些结果证明,hghi3产生的表达和分泌增加是因为hghi3作为内含子剪接元件(ise)起作用。优选地,hghi3与存在于野生型pgrn的初始392bp序列中的外显子剪接元件(ese)组合起作用。因此,hghi3可能携带一个隐秘的ise序列,其可能需要野生型pgrn序列中存在一个ese来增强剪接(mccarthy和philips(1998)human molecular genetics.7;1491
–
1496)。不希望受到理论的束缚,预测的机制是这种组合促进了富含丝氨酸和精氨酸(sr)的剪接蛋白的结合,其加速了rna加工和随后的翻译。
[0233]
实施例4:使用神经元特异性启动子突触蛋白限制表达。
[0234]
pgrn被许多细胞类型使用。然而,在脑中,其表达和分泌主要由小神经胶质细胞和神经元决定,且这两种细胞类型都受到pgrn缺陷的影响。使用病毒载体转导小神经胶质细胞非常困难,因此重点在于最大化pgrn向有丝分裂后神经元的转导和表达,这也避免了pgrn加速小神经胶质细胞和星形胶质细胞的细胞分裂的风险(其可能是致癌的)。将泛哺乳动物(pan-mammalian)常规启动子cmv下的野生型pgrn表达与人类神经元特异性启动子突触蛋白进行比较。如图10所示,在具有突触蛋白启动子的大鼠皮质神经元培养物中,表达受到限制并且pgrn分泌显著增加。
[0235]
为了测试aav9载体中pgrn盒的包装是否支持来自质粒转染的初步发现,产生了携带cmv-pgrnwt或syn-pgrnwt任一者的aav9。将大鼠原代皮质神经元培养7天并用aav9-grn载体转导。五天后,对细胞培养基进行取样并进行蛋白质印迹。与cmv相比,突触蛋白启动子使grn表达增加了5.4倍,这通过pgrn elisa得到证实(参见图11)。
[0236]
为了在体内验证这些研究,通过双侧脑室内(intra-cerebroventricular,icv)将aav9-cmv-pgrnwt和aav9-syn-pgrn载体注射到8周龄c57bl\6j雄性小鼠中(图12a)。用异氟醚对小鼠进行深度麻醉,并将其固定在安装有数字立体定向控制面板的立体定向框架中。使用hamilton注射器双侧注射到小鼠的前脑室或后丘脑中。每只小鼠接受3μl的总剂量5e+10vg,以0.5μl/min的速率输注,在输注后等待时间为2分钟,然后取出转子(trochanter)。在8周龄时对小鼠进行注射,并在12周龄时在注射后4周处死。收集一半的脑和脊髓、脾脏、心脏、肝脏、肾脏、肺、睾丸、血液和脑脊液(csf),并在液氮中新鲜冷冻。将脑的另一半进行多聚甲醛(pfa)后固定,并针对组织学和免疫细胞化学(ihc)进行加工。
[0237]
对于脑、血浆和器官收集,用戊巴比妥(pentobarbital)(100mg/kg,fatal plus,vortech pharmaceuticals,dearborn,mi)麻醉小鼠,并通过心脏穿刺在含有edta(250mm)的注射器中收集血液以防止凝血。将血液保持在冰上,并随后在4℃下以1000xg离心10分钟以分离血浆。然后用pbs对小鼠进行透心灌注。将脑取出并平分成半球,将其中一个显微解剖为前额叶皮质、纹状体、海马体、小脑、皮质下区域和皮质,并在液氮中快速冷冻以用于生物化学分析,且将其中一个在4%多聚甲醛中后固定24小时以用于组织学分析。取出脊髓、脾脏、心脏、肝脏、肾脏、肺、睾丸、血液和脑脊液并立即在液氮中冷冻,以用于elisa和蛋白质印迹分析。
[0238]
通过利用qpcr从基因组dna扩增人pgrn,测量每个组织中cmv-pgrn和syn-pgrn转导的分布和定量。在无核酸酶h2o中将基因组dna稀释至7.5ng/ul。qpcr使用powerup
tm
green master mix按照标准方案进行。对于每组反应,还使用已知浓度的dna绘制标准曲线。
[0239]
将固定的半球在30%蔗糖中冷冻保护,并在滑动切片机(leica biosystems)上切成30μm切片。然后对切片进行免疫染色。为了进行病理学分析和颗粒蛋白前体免疫反应性的定性评估,将切片在一抗(pgrn,神经元(neun)或小神经胶质细胞(iba1)的标志物)中孵育过夜,并在第二天将其与针对pgrn的物种匹配的二抗-488-缀合抗体和针对neun和iba1的物种匹配的alexafluor-647-缀合抗体一同孵育。
[0240]
用玻片扫描仪(olympus vs120)获得低倍率、高分辨率的颗粒蛋白前体免疫染色图像,以进行图像分析。
[0241]
在大脑皮质、肺和脾脏中检测到低水平的cmv-pgrn和syn-pgrn。然而,在肝脏中检测到相对较高拷贝数的病毒(参见图12)。
[0242]
使用elisa以定量经转导的小鼠的血清、csf和皮质组织的pgrn表达水平。注射了aav9-cmv-pgrn的小鼠表现出高血清pgrn水平,这在注射了aav9-syn-pgrn的小鼠中几乎检测不到(参见图13)。相反地,皮质和csf中的pgrn水平在注射了aav9-syn-pgrn的小鼠中比在注射了aav9-cmv-pgrn的小鼠中要高得多(参见图13c和13d),这证实了突触蛋白在体内的神经元特异性。
[0243]
实施例5:icv注射后aav9-syn-pgrnwt的广泛pgrn表达
[0244]
在4周后收获通过icv注射而注射了aav9-syn-pgrn-wt的小鼠(图15)。将后pfa固定的脑切片并用于ihc。山羊抗人特异性pgrn抗体(绿色)在皮质(图15c)、海马体(图15d)和丘脑(图15e)中显示出广泛的grn表达。使用兔抗神经元特异性抗体neun进行复染。在未经注射的小鼠脑组织中未检测到人pgrn,而在海马体中有强烈染色,并且在注射了aav-syn-pgrnwt的小鼠的丘脑和皮质中有较小程度的染色(图15d)。海马体组织裂解物的pgrn elisa证实了突触蛋白启动子产生的pgrn表达比cmv启动子增加3倍(图16b)。蛋白质印迹证实了在约68kda处检测到强pgrn条带(图16c、d)。
[0245]
实施例6:组合内含子序列hghi3和3
′
utr元件。
[0246]
然后我们试验了3
′
utr是否可以用作外显子增强元件(ese)以增强和潜在地调控pgrn表达。我们合成了284bp的野生型pgrn 3
′
utr并将其克隆至3
′
区域(除了内含子增强子hghi3和我们的经密码子优化的pgrn-gs之外)以生成syn-hghi3-pgrn-gs-utr(图17)。
[0247]
野生型pgrn的3
′
utr序列(284bp)如图17b及下文所示(seq id no:14):
[0248]
包含5
′
pme1和3
′
xhoi的该序列是使用来自genscript的基因合成服务合成的。将utr序列克隆至aav-syn-hghi3-pgrn-gs中以形成aav-syn-hghi3-pgrn-gs-utr。显示了包含图17所示的盒的质粒的载体图谱如图21所示。syn-hghi3-pgrn-gs-utr载体盒(从itr到itr)的dna序列如下所示(seq id no:17)。
[0249]
[0250]
[0251][0252]
seq id no:17包含以下序列元件:
[0253]
aav2 itr
–
残基1-130
[0254]
hsyn启动子
–
残基341-788
[0255]
hghi3
–
残基801-892
[0256]
pgrn-gs
–
残基905-2686
[0257]3’
utr
–
残基2702-2985
[0258]
bgh poly(a)信号
–
残基3015-3222
[0259]
aav2 itr
–
残基3245-3385
[0260]
实施例7:丘脑内注射后aav9-syn-pgrn-gs、aav9-syn-hghi3-pgrn-gs和aav9-syn-hghi3-pgrn-gs-utr的广泛pgrn表达。
[0261]
通过丘脑内注射将优化剂量的含有最终pgrn盒(图2、5、9、14和17)的aav颗粒注射到小鼠脑中,以比较载体的效率。aav-pgrn病毒的转导效率利用elisa和ihc通过pgrn蛋白表达来检测。我们选择了丘脑内(it)施用途径,因为这会提供更好的egfp和pgrnwt皮质表达。hghi3内含子增强元件的添加始终使pgrn水平增加约27%,且3
′
utr外显子增强元件的添加使pgrn表达增加约37%(图18b和19)。在it注射低(6.2e+10)、中(1.2e+11)和高(2.5e+11)剂量的载体后,通过elisa和ihc来定量pgrn的皮质水平,这证实了靶组织中的剂量丰度效应(图18c)。
[0262]
皮质神经元中有大量的颗粒状pgrn阳性局灶(图20a和c)。由于在小神经胶质细胞和神经元中可见病理变化,我们力图确定由神经元分泌的pgrn是否被包括小神经胶质细胞在内的非神经元细胞摄取。突触蛋白启动子下的pgrn仅在神经元中表达,但在许多neun阴性细胞中检测到(图20a),并且可以在iba1阳性小神经胶质细胞中检测到pgrn的小局灶(图20b和d)。
[0263]
实施例8:使用体内模型的grn生物分布、毒理学和功效
[0264]
将优化剂量的含有图2、5、9、14或17所示的pgrn盒的aav颗粒通过实质内和脑室内注射注射到非转基因(ntg)小鼠中,以比较不同施用途径的效率。aav-pgrn的转导功效通过qpcr以及利用elisa和ihc确定的蛋白表达进行检测。
[0265]
在非转基因(ntg)和pgrn敲除(pgrn+/-和-/-)小鼠中检测了aav-pgrn的生物分布和毒理学(立体定向手术程序见上文)。此外,通过将aav-pgrn注射到野生型绵羊中来研究生物分布,所述野生型绵羊的脊髓长度与人类相同,并且其脑是另一种常见非人灵长类动物模型猕猴(macaque)的两倍。
[0266]
通过将aav-pgrn注射到pgrn+/-和-/-、tdp-43q331k和tdp-43q331kxwt转基因小鼠中来进行功效研究。tdp-43转基因小鼠发展缓慢的(q331k)或更快速的疾病进展(tdp-43q331k xwt)。他们的行为使用用于评估运动功能的转棒仪(rotarod)和握力试验以及用于短期社交工作记忆认知试验的高架十字迷宫来监控。如上所述收集和处理组织。对于pgrn和tdp-43q331k转基因小鼠,在8周龄(it或icv)时对动物进行注射,或在tdp-43q331kxwt转基因小鼠的情况下,由于它们的侵袭性表型(aggressive phenotype),在2周龄时对动物进行注射。将动物饲养4周或6个月,并使用上述试验每月监测行为。从绵羊和小鼠两者采集的组织经过ihc、elisa、ddpcr和蛋白质印迹处理,以测量pgrn的表达和蛋白水平,以定量pgrn mrna水平和确定载体基因组水平。tdp-43转基因动物的治疗效果通过使用蛋白质印迹和ihc定量不溶性tdp-43水平以及小神经胶质细胞和星形胶质细胞的激活来确定。对pgrn和对照载体之间疾病进展速度和病理学严重程度的差异进行了统计学分析。
[0267]
aav-pgrn在pgrn+/-和-/-小鼠中的功效研究更加困难,因为小鼠在试管试验(test tube test)中仅表现出非常轻微的社会优势降低的表型,并且没有神经元丧失。-/-小鼠确实显示出容易定量的脂褐质和激活的小神经胶质细胞的积累。靶标参与将通过定量脂褐质减少以及小神经胶质细胞和星形胶质细胞激活水平来衡量。此外,将验证pgrn在溶酶体上的定位以建立正确的细胞靶向。将对pgrn和对照载体之间病理严重程度的差异进行统计学分析。
[0268]
实施例9:使用不同aav衣壳血清型的grn表达
[0269]
将图2、5、9、14或17中所示的pgrn盒包装到aav血清型9和5中,以确定增强的prgrn表达是否对aav9特异或是否与其他aav血清型相关。在体内和体外对akta纯化的aav进行了测试。
[0270]
总体而言,上述实验表明,经密码子优化的aav9-syn-pgrn-gs、aav9-syn-hghi3-pgrn-gs和aav-syn-hghi3-pgrn-gs-utr表达盒显著提高了表达水平、转导效率和pgrn蛋白表达的细胞特异性。预计这些盒能够减少给予ftd、ncl11和als患者的载体剂量,从而降低毒性风险和载体生产成本。
[0271]
本技术要求于2019年9月27日提交的英国专利申请号1913974.0的优先权,其内容通过引用并入本文。上述说明书中提及的所有出版物均通过引用并入本文。在不背离本发明的范围和精神的情况下,本发明的所述实施方案的各种修改和变化对于本领域技术人员来说将是显而易见的。尽管已经结合具体的优选实施方案描述了本发明,但是应当理解,所要求保护的本发明不应被过度地限制于此类具体的实施方案。实际上,对本领域技术人员来说显而易见的用于实施本发明的所述方式的各种修改旨在落入以下权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1