化合物的盐及其晶型的制作方法
化合物的盐及其晶型
1.相关申请的交叉参考
2.本技术要求了于2019年10月14日提交的中国专利申请no.201910973785.3的优先权,将其完整地合并入本文用于所有目的。
技术领域
3.本发明属于药学领域,提供了化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的药学上可接受的盐及其晶型,以及它们的药物组合物、制备方法和应用。
背景技术:
4.成纤维细胞生长因子(fgf)已被公认为是许多生理过程中的重要调节物。受体酪氨酸激酶的成纤维细胞生长因子受体家族由四个成员(fgfr1、fgfr2、fgfr3和fgfr4)组成。成纤维细胞生长因子(fgf)及其受体(fgfr)在细胞增殖、细胞分化、细胞迁移、细胞存活、蛋白质合成和血管生成中发挥重要作用。有许多证据表明fgf信号发放与癌症直接相关。fgfr信号发放的失调牵涉在许多癌症中,包括鳞状非小细胞肺癌(鳞状nsclc)、小细胞肺癌(sclc)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌和膀胱癌,例如,已经发现fgfr1在22%的鳞状nsclc中扩增,fgfr2扩增已经在高达10%的胃癌中被报道,已经在约50-60%的非肌层浸润和17%的高度恶性膀胱癌中发现了fgfr3突变。因此,抑制fgfr的活性可以用来治疗增殖性疾病,例如癌症。
5.pct专利申请wo2014/139465a1首次公开了化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(即,wo2014/139465a1中的化合物78)及其制备方法。该化合物的结构如下:
[0006][0007]
研究表明,化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺可有效抑制fgfr活性,因此可用于预防和治疗对抑制fgfr活性有响应的疾病,例如癌症。
[0008]
很多化合物能够以多种晶体形式存在,也可以以无定形形式存在。但是,针对给定的化合物,很难预测:(1)该化合物是否存在多晶型现象;(2)如何制得未知的晶型;(3)这些晶型的性质是怎样的,例如稳定性、溶解度、流动性、药代动力学参数和体内生物利用度等会因为晶型的不同而有差异。参见j.bernstein
″
polymorphism in molecular crystals
″
,oxford university press,(2002)。
[0009]
通过成盐不会改变化合物本身的生物活性,但是可以改变化合物的理化性质。针
对给定的化合物,很难预测该化合物的哪些盐具有比游离化合物更好的理化性质,鉴于晶体形成和晶体性质的不可预测性,更无法进一步预测哪些盐能形成具有有利性质的晶型。
[0010]
由于固体的特性取决于化合物本身及固体的微观结构,因此,化合物的不同固体形式经常表现出不同的理化性质以及不同的生物药剂学性质。理化性质以及生物药剂学性质的差异可以通过多种技术手段来测定,并且最终可以用来区分这些不同的固体形态。例如,物理性质如溶解度、稳定性等以及生物药剂学性质如c
max
、t
max
、生物利用度等的差异在描述化合物的固体形态时很重要。
[0011]
因此,在化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的开发中,需要研究该化合物的盐及其结晶形式。
[0012]
发明概述
[0013]
经过大量探索研究,发明人发现化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(在本技术的上下文中也称为“化合物78”)可以被制备成多种药学上可接受的盐,其化学结构例如如式a所示。与游离形式的化合物78相比,式a的盐(例如半酒石酸盐)的溶解度明显增加,有利于改善化合物78的药物动力学性质,提高该化合物在体内的生物利用度。发明人还发现式a的盐可以存在不同的晶型,并且可以与某些溶剂形成溶剂合物。发明人对式a的盐的多晶型进行了大量研究,确定并制备得到了符合药用需求的晶型。基于这些研究,本发明提供了如式a所示的化合物78的药学上可接受的盐及其多种晶型,例如晶型a-iii、晶型b-ii、晶型b-iii和晶型c-i。
[0014]
一方面,本发明提供了4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的药学上可接受的盐,其如式a所示:
[0015][0016]
其中,n为0.5或1;且m为药学上可接受的酸。
[0017]
在一个实施方案中,本发明提供了式a的盐,其中m为盐酸、酒石酸或对甲苯磺酸。
[0018]
在另一个实施方案中,本发明提供了式a的盐,其中n为1且m为盐酸(也称为化合物78的一盐酸盐)、n为0.5且m为酒石酸(也称为化合物78的半酒石酸盐)、或者n为1且m为对甲苯磺酸(也称为化合物78的一对甲苯磺酸盐)。
[0019]
在又一个实施方案中,本发明提供了式a的盐,其中n为1且m为盐酸,并且是晶型a-iii(也称为化合物78的一盐酸盐的晶型a-iii,简称晶型a-iii)。
[0020]
在又一个实施方案中,本发明提供了式a的盐,其中n为0.5且m为酒石酸,并且是晶型b-ii(也称为化合物78的半酒石酸盐的晶型b-ii,简称晶型b-ii)。
[0021]
在又一个实施方案中,本发明提供了式a的盐,其中n为0.5且m为酒石酸,并且是晶
型b-iii(也称为化合物78的半酒石酸盐的晶型b-iii,简称晶型b-iii)。
[0022]
在又一个实施方案中,本发明提供了式a的盐,其中n为1且m为对甲苯磺酸,并且是晶型c-i(也称为化合物78的一对甲苯磺酸盐的晶型c-i,简称晶型c-i)。
[0023]
另一方面,本发明提供了式a的盐及其晶型(例如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i)的制备方法,这些制备方法是可重复的,并且易于操作。
[0024]
另一方面,本发明提供了药物组合物,所述的药物组合物包含有效量的式a的盐及其晶型(例如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i),并且任选地包含药学上可接受的载体。
[0025]
另一方面,本发明还提供了一种预防或治疗对抑制fgfr活性有响应的疾病如癌症的方法,该方法包括向有需要的个体施用有效量的式a的盐及其晶型,例如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i。
[0026]
另一方面,本发明还提供了式a的盐及其晶型(如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i)在制备药物中的用途,所述药物用于治疗对抑制fgfr活性有响应的疾病,例如癌症。
[0027]
另一方面,本发明提供了式a的盐及其晶型(例如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i),其用于治疗。
[0028]
在一个实施方案中,本发明提供了式a的盐及其晶型(例如晶型a-iii、晶型b-ii、晶型b-iii或晶型c-i),其用于治疗对抑制fgfr活性有响应的疾病,例如癌症。
[0029]
所述癌症包括但不限于肺癌(如鳞状非小细胞肺癌和小细胞肺癌)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌、膀胱癌、尿路上皮癌、食道癌、胆管癌、结肠癌、直肠癌、头颈癌、宫颈癌、胰腺癌、肾上腺癌、神经胶质瘤、间皮瘤和血液肿瘤(如骨髓增殖性肿瘤)。
附图说明
[0030]
图1给出了化合物78的一盐酸盐的晶型a-iii的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0031]
图2给出了化合物78的一盐酸盐的晶型a-iii的差示扫描量热图,横轴(x-轴)是温度(℃),纵轴(y-轴)是热流(mw)。
[0032]
图3给出了化合物78的一盐酸盐的晶型a-iii的热重分析图,横轴(x-轴)是温度(℃),纵轴(y-轴)是重量百分数(%)。
[0033]
图4给出了化合物78的半酒石酸盐的晶型b-ii的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0034]
图5给出了化合物78的半酒石酸盐的晶型b-ii的差示扫描量热图,横轴(x-轴)是温度(℃),纵轴(y-轴)是热流(mw)。
[0035]
图6给出了化合物78的半酒石酸盐的晶型b-ii的热重分析图,横轴(x-轴)是温度(℃),纵轴(y-轴)是重量百分数(%)。
[0036]
图7给出了化合物78的半酒石酸盐的晶型b-iii的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0037]
图8给出了化合物78的半酒石酸盐的晶型b-iii的差示扫描量热图,横轴(x-轴)是温度(℃),纵轴(y-轴)是热流(mw)。
[0038]
图9给出了化合物78的半酒石酸盐的晶型b-iii的热重分析图,横轴(x-轴)是温度(℃),纵轴(y-轴)是重量百分数(%)。
[0039]
图10给出了化合物78的半酒石酸盐的晶型b-iii的动态气体吸附等温曲线图,横轴(x-轴)是相对湿度(%),纵轴(y-轴)是重量变化百分数(%)。
[0040]
图11给出了化合物78的半酒石酸盐的晶型b-ii的动态气体吸附等温曲线图,横轴(x-轴)是相对湿度(%),纵轴(y-轴)是重量变化百分数(%)。
[0041]
图12给出了化合物78的一对甲苯磺酸盐的晶型c-i的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0042]
图13给出了化合物78的一对甲苯磺酸盐的晶型c-i的差示扫描量热图,横轴(x-轴)是温度(℃),纵轴(y-轴)是热流(mw)。
[0043]
图14给出了化合物78的一对甲苯磺酸盐的晶型c-i的热重分析图,横轴(x-轴)是温度(℃),纵轴(y-轴)是重量百分数(%)。
[0044]
图15给出了化合物78的一盐酸盐的晶型a-iii在高湿条件(25℃,相对湿度为92.5%
±
5%)下放置5天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0045]
图16给出了化合物78的一盐酸盐的晶型a-iii在高湿条件(25℃,相对湿度为92.5%
±
5%)下放置10天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0046]
图17给出了化合物78的半酒石酸盐的晶型b-ii在高湿条件(25℃,相对湿度为92.5%
±
5%)下放置3天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0047]
图18给出了化合物78的半酒石酸盐的晶型b-ii在水中打浆2天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0048]
图19给出了化合物78的半酒石酸盐的晶型b-ii在水中打浆4天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0049]
图20给出了化合物78的半酒石酸盐的晶型b-iii在水中打浆2天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0050]
图21给出了化合物78的半酒石酸盐的晶型b-iii在水中打浆4天后的x-射线粉末衍射图,横轴(x-轴)是衍射角度2θ,纵轴(y-轴)是衍射强度。
[0051]
图22给出了按照wo2014/139465a1的实施例9制备的游离形式的化合物78的显微镜照片,显示其为针状晶体。
[0052]
图23给出了化合物78的半酒石酸盐的晶型b-iii的显微镜照片,显示其为板状晶体。
[0053]
发明详述
[0054]
定义
[0055]
除非另有说明,否则本技术(包括说明书和权利要求书)中所用的下列术语具有下文所给出的定义。需要注意的是,本说明书和所附权利要求书中所用的单数形式也包括复数形式,除非上下文清楚显示并非如此。
[0056]
本文所使用的术语“本发明的盐”、“4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌
嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的药学上可接受的盐”、“4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的盐”、“化合物78的盐”、“化合物78的药学上可接受的盐”和“式a的盐”可以互换使用,均是指本文所述的式a的盐,即,化合物78与本文所述的“药学上可接受的酸”形成的酸加成盐。
[0057]
本文所使用的术语“本发明的晶型”是指化合物78的一盐酸盐的晶型a-iii、化合物78的半酒石酸盐的晶型b-ii、化合物78的半酒石酸盐的晶型b-iii或化合物78的一对甲苯磺酸盐的晶型c-i,或其任意比例的混合物。
[0058]
本文所用的术语“晶型”、“晶体形式”、“结晶形式”和“多晶型物”可以互换使用。
[0059]
本文所用的术语“药学上可接受的酸”是指能与化合物78形成酸加成盐并且对动物或人应用而言不具有不需要的性质的酸,包括但不限于:无机酸,例如盐酸、氢溴酸、磷酸、亚磷酸、硫酸、亚硫酸、硝酸等;有机酸,例如苹果酸、马来酸、扁桃酸、富马酸、酒石酸、琥珀酸、柠檬酸、天冬氨酸、谷氨酸、2-羟基-2-苯丙酸、葡糖酸、乳酸、樟脑磺酸、甲磺酸、乙磺酸、萘磺酸、对甲苯磺酸、2-羟基乙磺酸、β-羟基丁酸、苯甲酸、水杨酸、乙酸、丙酸、丁酸、戊酸、己酸、硬脂酸、hooc-(ch2)
n-cooh(其中n是0-4)等。
[0060]
本文所使用的“不多于八个碳原子的有机酸酯”是指r1coor2,其中r1和r2独立地是饱和或不饱和的、直链或支链的烃基,且r1和r2中的碳原子总数小于或等于7。优选地,其中r1和r2独立地是饱和的、直链或支链的烃基,且r1和r2中的碳原子总数是1、2、3、4、5、6或7。不多于八个碳原子的有机酸酯的实例包括但不限于乙酸甲酯、乙酸乙酯、乙酸正丙酯。
[0061]
本文所用的术语“约”与数值联用时表示将所给出的数值调整至高于或低于该数值10%。例如,约50%意指45%至55%的范围。
[0062]
本文所用的术语“基本上纯的”是指所述晶型的纯度以重量计为至少50%、至少60%、至少70%,优选至少80%,更优选至少90%,甚至更优选至少95%,例如所述晶型的纯度以重量计为95%、96%、97%、98%、99%或100%。
[0063]
本文所用的术语“基本不含有其它晶型”是指所述其它晶型的含量以重量计占晶型总重量的小于50%,优选小于40%,优选小于30%,优选小于20%,优选小于10%,优选小于5%,优选小于1%。
[0064]
本文所用的术语“溶液”是指一种或多种溶质在一种或多种溶剂中形成的均相混合物。
[0065]
本文所用的术语“溶解溶剂”是指一种物质在适当条件下可以部分或全部溶解于其中的有机溶剂。本文所用的术语“反溶解溶剂”是指任何恰当的有机溶剂,所述物质在其中的溶解度小于在溶解溶剂中的溶解度。
[0066]
本文所用的术语“水互溶性有机溶剂”是指能与水以任意比例混溶的有机溶剂。其实例包括但不限于c
1-6
烷基醇、丙酮、四氢呋喃、乙腈、二噁烷、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲亚砜等。
[0067]
本文所使用的术语“c
1-6
烷基醇”是指具有1、2、3、4、5或6个碳原子的完全饱和的直链或支链烷基醇。其实例包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇、叔丁醇、正戊醇、异戊醇、正己醇等。
[0068]
本文所用的术语“有效量”是指本发明的盐或本发明的晶型在体外能有效抑制
fgfr活性的量或者在施用于个体后能有效地预防或治疗对抑制fgfr活性有响应的疾病的量。本发明的盐或本发明的晶型的有效量将随着所使用的具体盐类型、所治疗的疾病及其严重程度、个体的年龄和相关健康状况、施用途径和形式、主治医师或兽医从业者的判断等多种因素而变化。
[0069]
本文所用的术语“对抑制fgfr活性有响应的疾病”是指能通过抑制fgfr活性而被预防或治疗的疾病,例如癌症,包括但不限于肺癌(如鳞状非小细胞肺癌和小细胞肺癌)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌、膀胱癌、尿路上皮癌、食道癌、胆管癌、结肠癌、直肠癌、头颈癌、宫颈癌、胰腺癌、肾上腺癌、神经胶质瘤、间皮瘤和血液肿瘤(如骨髓增殖性肿瘤)等。
[0070]
本文所使用的“个体”意指哺乳动物和非哺乳动物。哺乳动物意指哺乳动物类的任何成员,包括但不限于人;非人灵长类动物如黑猩猩和其它猿类和猴类;农场动物如牛、马、绵羊、山羊和猪;家养动物如兔、犬和猫;实验室动物,包括啮齿动物,如大鼠、小鼠和豚鼠;等。非哺乳动物的实例包括但不限于鸟类等。术语“个体”并不表示特定的年龄或性别。
[0071]
本文所用的术语“治疗”是指减轻不希望的生理变化或障碍,例如癌症的形成或扩散。对于本发明的目的,有益的或所需的临床结果包括但不限于症状的缓解、疾病的程度减轻、保持疾病稳定、疾病进展减缓。“治疗”也意味着,与如果不接受治疗的个体相比,存活期延长。
[0072]
本文所用的术语“预防”是指在具有罹患疾病风险的个体中防止或推迟所述疾病的发生。
[0073]
实施方案
[0074]
实施方案1.式a的盐:
[0075][0076]
其中,n为0.5或1;且
[0077]
m为药学上可接受的酸。
[0078]
实施方案2.根据实施方案1所述的式a的盐,其中m为盐酸、酒石酸或对甲苯磺酸。
[0079]
实施方案3.根据实施方案2所述的式a的盐,其中n为1且m为盐酸;n为0.5且m为酒石酸;或者n为1且m为对甲苯磺酸。
[0080]
实施方案4.根据实施方案3所述的式a的盐,其中n为1且m为盐酸,并且是晶型a-iii,其具有x-射线粉末衍射特征性衍射角(2θ)5.8
±
0.2
°
、6.2
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、23.1
±
0.2
°
和24.1
±
0.2
°
;
[0081]
优选地,所述的晶型a-iii具有x-射线粉末衍射特征性衍射角(2θ)5.8
±
0.2
°
、6.2
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、16.2
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
和26.4
±
0.2
°
;
[0082]
更优选地;所述的晶型a-iii具有x-射线粉末衍射特征性衍射角(2θ)5.8
±
0.2
°
、
6.2
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、20.2
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
和27.8
±
0.2
°
;
[0083]
进一步优选地,所述的晶型a-iii具有x-射线粉末衍射特征性衍射角(2θ)5.8
±
0.2
°
、6.2
±
0.2
°
、7.9
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
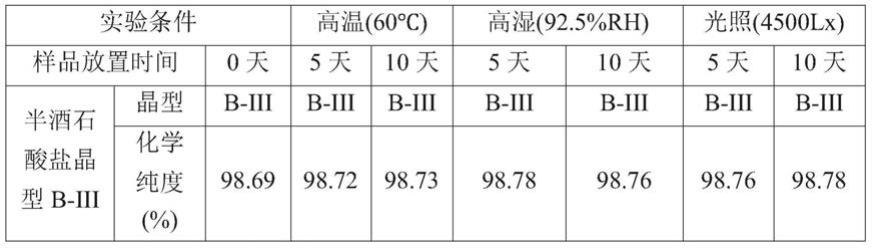
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、16.8
±
0.2
°
、17.4
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、19.6
±
0.2
°
、20.2
±
0.2
°
、21.0
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、24.8
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
和27.8
±
0.2
°
;
[0084]
最优选地,所述的晶型a-iii具有如图1所示的x-射线粉末衍射谱图。
[0085]
实施方案5.根据实施方案4所述的式a的盐,其中所述的晶型a-iii的差示扫描量热曲线在约290.2-295.4℃具有吸热峰。
[0086]
实施方案6.根据实施方案3所述的式a的盐,其中n为0.5且m为酒石酸,并且是晶型b-ii,其具有x-射线粉末衍射特征性衍射角(2θ)7.5
±
0.2
°
、11.3
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、18.0
±
0.2
°
和20.6
±
0.2
°
;
[0087]
优选地,所述的晶型b-ii具有x-射线粉末衍射特征性衍射角(2θ)3.8
±
0.2
°
、7.5
±
0.2
°
、11.3
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.7
±
0.2
°
和23.0
±
0.2
°
;
[0088]
更优选地,所述的晶型b-ii具有x-射线粉末衍射特征性衍射角(2θ)3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.7
±
0.2
°
、23.0
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
;
[0089]
进一步优选地,所述的晶型b-ii具有x-射线粉末衍射特征性衍射角(2θ)3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、11.8
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.1
±
0.2
°
、21.7
±
0.2
°
、23.0
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
;
[0090]
最优选地,所述的晶型b-ii具有如图4所示的x-射线粉末衍射谱图。
[0091]
实施方案7.根据实施方案6所述的式a的盐,其中所述的晶型b-ii的差示扫描量热曲线在约54.8-92.2℃、166.9-174.4℃和263.3-265.3℃具有吸热峰,并且在约194.2-202.7℃具有放热峰。
[0092]
实施方案8.根据实施方案6至7中任意一项所述的式a的盐,其中所述的晶型b-ii具有如图6所示的热重分析曲线,其显示在30-100℃区间有约4.3%失重。
[0093]
实施方案9.根据实施方案3所述的式a的盐,其中n为0.5且m为酒石酸,并且是晶型b-iii,其具有x-射线粉末衍射特征性衍射角(2θ)13.1
±
0.2
°
、14.6
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
和26.3
±
0.2
°
;
[0094]
优选地,所述的晶型b-iii具有x-射线粉末衍射特征性衍射角(2θ)12.4
±
0.2
°
、13.1
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、16.5
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
和26.3
±
0.2
°
;
[0095]
更优选地,所述的晶型b-iii具有x-射线粉末衍射特征性衍射角(2θ)7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、
14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
和26.3
±
0.2
°
;
[0096]
进一步优选地,所述的晶型b-iii具有x-射线粉末衍射特征性衍射角(2θ)7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、19.6
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
、24.6
±
0.2
°
、26.3
±
0.2
°
、27.6
±
0.2
°
和29.2
±
0.2
°
;
[0097]
最优选地,所述的晶型b-iii具有如图7所示的x-射线粉末衍射谱图。
[0098]
实施方案10.根据实施方案9所述的式a的盐,其中所述的晶型b-iii的差示扫描量热曲线在约269.2-271.3℃具有吸热峰。
[0099]
实施方案11.根据实施方案9至10中任意一项所述的式a的盐,其中所述的晶型b-iii具有如图9所示的热重分析曲线。
[0100]
实施方案12.根据实施方案3所述的式a的盐,其中n为1且m为对甲苯磺酸,并且是晶型c-i,其具有x-射线粉末衍射特征性衍射角(2θ)7.8
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
和24.0
±
0.2
°
;
[0101]
优选地,所述的晶型c-i具有x-射线粉末衍射特征性衍射角(2θ)5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、22.2
±
0.2
°
、24.0
±
0.2
°
和26.1
±
0.2
°
;
[0102]
更优选地,所述的晶型c-i具有x-射线粉末衍射特征性衍射角(2θ)5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、24.0
±
0.2
°
、26.1
±
0.2
°
和27.4
±
0.2
°
;
[0103]
进一步优选地,所述的晶型c-i具有x-射线粉末衍射特征性衍射角(2θ)5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、12.2
±
0.2
°
、12.9
±
0.2
°
、13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、23.5
±
0.2
°
、24.0
±
0.2
°
、25.0
±
0.2
°
、26.1
±
0.2
°
、27.4
±
0.2
°
和32.8
±
0.2
°
;
[0104]
最优选地,所述的晶型c-i具有如图12所示的x-射线粉末衍射谱图。
[0105]
实施方案13.根据实施方案12所述的式a的盐,其中所述的晶型c-i的差示扫描量热曲线在约289.77-291.04℃具有吸热峰。
[0106]
实施方案14.根据实施方案12至13中任意一项所述的式a的盐,其中所述的晶型c-i具有如图14所示的热重分析曲线。
[0107]
实施方案15.药物组合物,其包含有效量的实施方案1至14中任意一项所述的式a的盐,并且任选地包含药学上可接受的载体。
[0108]
实施方案16.预防或治疗对抑制fgfr活性有响应的疾病的方法,其包括给有需要的个体施用有效量的实施方案1至14中任意一项所述的式a的盐。
[0109]
实施方案17.实施方案1至14中任意一项所述的式a的盐在制备药物中的用途,所述药物用于预防或治疗对抑制fgfr活性有响应的疾病,例如癌症。
[0110]
实施方案18.根据实施方案17所述的用途,其中所述癌症选自肺癌(如鳞状非小细
胞肺癌和小细胞肺癌)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌、膀胱癌、尿路上皮癌、食道癌、胆管癌、结肠癌、直肠癌、头颈癌、宫颈癌、胰腺癌、肾上腺癌、神经胶质瘤、间皮瘤和血液肿瘤(如骨髓增殖性肿瘤)。
[0111]
实施方案19.根据实施方案1至14中任意一项所述的式a的盐,其用于治疗。
[0112]
实施方案20.根据实施方案1至14中任意一项所述的式a的盐,其用于治疗对抑制fgfr活性有响应的疾病,如癌症。
[0113]
实施方案21.根据实施方案20所述的式a的盐,其中所述癌症选自肺癌(如鳞状非小细胞肺癌和小细胞肺癌)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌、膀胱癌、尿路上皮癌、食道癌、胆管癌、结肠癌、直肠癌、头颈癌、宫颈癌、胰腺癌、肾上腺癌、神经胶质瘤、间皮瘤和血液肿瘤(如骨髓增殖性肿瘤)。
[0114]
实施方案22.制备实施方案4至5中任意一项所述的式a的盐的方法,其包括:
[0115]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与盐酸在加热和搅拌下混合于溶解溶剂中或混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐;
[0116]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0117]
(3)分离析出的固体,为晶型a-iii;
[0118]
(4)任选地,干燥步骤(3)所得的固体。
[0119]
实施方案23.根据实施方案22所述的方法,其中所述盐酸为浓盐酸,以重量计浓度为36%-38%。
[0120]
实施方案24.根据实施方案22至23中任意一项所述的方法,其中所述盐酸与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1,例如为约1∶1或1.2∶1。
[0121]
实施方案25.根据实施方案22至24中任意一项所述的方法,其中所述溶解溶剂或所述混合溶剂的体积与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量之比不小于约10ml/g,例如为约20ml/g或约60ml/g。
[0122]
实施方案26.根据实施方案22至25中任意一项所述的方法,其中所述溶解溶剂选自c1-6烷基醇,优选地,所述溶解溶剂选自甲醇、乙醇、异丙醇、叔丁醇及其混合物,更优选地,所述溶解溶剂是乙醇。
[0123]
实施方案27.根据实施方案22至26中任意一项所述的方法,其中所述水互溶性有机溶剂选自c1-6烷基醇,优选地,所述水互溶性有机溶剂选自甲醇、乙醇、异丙醇、叔丁醇及其混合物,更优选地,所述水互溶性有机溶剂选自乙醇、异丙醇及其混合物。
[0124]
实施方案28.根据实施方案22至27中任意一项所述的方法,其中所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,优选地,所述水互溶性有机溶剂占所述混合溶剂的体积百分数为95%、90%或80%。
[0125]
实施方案29.根据实施方案22至28中任意一项所述的方法,其中,在任选的步骤(4)中,干燥温度为50-80℃。
[0126]
实施方案30.制备实施方案6至8中任意一项所述的式a的盐的方法,其包括:
[0127]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧
啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与l-酒石酸在加热和搅拌下混合于乙醇中,反应形成盐;
[0128]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0129]
(3)分离析出的固体,为晶型b-ii;
[0130]
(4)任选地,干燥步骤(3)所得的固体。
[0131]
实施方案31.根据实施方案30所述的方法,其中所述l-酒石酸与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1:2,优选地,为约4:5或约3.4∶1。
[0132]
实施方案32.根据实施方案30至31中任意一项所述的方法,其中所述乙醇的体积与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量之比不小于约10ml/g,例如为约72ml/g或约75ml/g。
[0133]
实施方案33.根据实施方案30至32中任意一项所述的方法,其中在任选的步骤(4)中,干燥温度为50-85℃。
[0134]
实施方案34.制备实施方案9至11中任意一项所述的式a的盐的方法,其包括:
[0135]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与l-酒石酸在加热和搅拌下混合于溶解溶剂中、混合于水中或者混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐,得到第一溶液;条件是,所述溶解溶剂不是单一溶剂乙醇;
[0136]
(2)任选地,向所述第一溶液中加入反溶解溶剂,得到第二溶液;
[0137]
(3)冷却所述第一溶液或第二溶液,使固体充分析出;
[0138]
(4)分离析出的固体,为晶型b-iii;
[0139]
(5)任选地,干燥步骤(4)所得的固体。
[0140]
实施方案35.根据实施方案34所述的方法,其中所述l-酒石酸与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1,优选地,摩尔比为约1∶1或约1.5∶1。
[0141]
实施方案36.根据实施方案34至35中任意一项所述的方法,其中所述的溶解溶剂、水或由水互溶性有机溶剂和水组成的混合溶剂的体积与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量之比不小于约10ml/g,例如为约20ml/g、约30ml/g、约33ml/g、约50ml/g、约65ml/g、约98ml/g或约286ml/g。
[0142]
实施方案37.根据实施方案34至36中任意一项所述的方法,其中所述溶解溶剂选自c
1-6
烷基醇、丙酮、甲苯、不多于八个碳原子的有机酸酯及其混合物,优选地,所述溶解溶剂选自甲醇、乙醇、异丙醇、叔丁醇、正丁醇、丙酮、甲苯、乙酸正丙酯、乙酸乙酯及其混合物,更优选地,所述溶解溶剂选自甲醇、乙醇、异丙醇、丙酮、甲苯、乙酸正丙酯、乙酸乙酯及其混合物。
[0143]
实施方案38.根据实施方案37所述的方法,其中所述溶解溶剂选自由甲醇、乙醇、甲苯、乙酸正丙酯和乙酸乙酯中的两种溶剂组成的混合溶剂,例如乙酸正丙酯/甲醇(体积比为约3∶2)、甲苯/乙醇(体积比为约1∶1)或乙酸乙酯/乙醇(体积比为约11∶15)。
[0144]
实施方案39.根据实施方案34至38中任意一项所述的方法,其中所述水互溶性有机溶剂选自c
1-6
烷基醇、丙酮及其混合物,优选地,所述水互溶性有机溶剂选自甲醇、乙醇、异丙醇、叔丁醇、丙酮及其混合物,更优选地,所述水互溶性有机溶剂选自乙醇、异丙醇、丙酮及其混合物。
[0145]
实施方案40.根据实施方案34至39中任意一项所述的方法,其中所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,例如95%、90%、80%。
[0146]
实施方案41.根据实施方案34至40中任意一项所述的方法,其中所述反溶解溶剂选自甲苯、不多于八个碳原子的有机酸酯及其混合物,优选地,所述反溶解溶剂选自甲苯、乙酸乙酯、乙酸正丙酯及其混合物,更优选地,所述反溶解溶剂选自甲苯、乙酸乙酯及其混合物。
[0147]
实施方案42.根据实施方案34至41中任意一项所述的方法,其中在步骤(3)中,所述冷却是自然冷却或控温冷却。
[0148]
实施方案43.根据实施方案34至42中任意一项所述的方法,其中在步骤(5)中,干燥温度为50-85℃。
[0149]
实施方案44.制备实施方案12至14中任意一项所述的式a的盐的方法,其包括:
[0150]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与对甲苯磺酸一水合物在加热和搅拌下混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐;
[0151]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0152]
(3)分离析出的固体,为晶型c-i;
[0153]
(4)任选地,干燥步骤(3)所得的固体。
[0154]
实施方案45.根据实施方案44所述的方法,其中所述对甲苯磺酸一水合物与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1,例如为约1.5:1。
[0155]
实施方案46.根据实施方案44至45中任意一项所述的方法,其中所述步骤(1)中的由水互溶性有机溶剂和水组成的混合溶剂的体积与所述化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量之比不小于约10ml/g,例如为约36ml/g或约43ml/g。
[0156]
实施方案47.根据实施方案44至46中任意一项所述的方法,其中所述水互溶性有机溶剂选自c1-6烷基醇、丙酮及其混合物,优选地,所述水互溶性有机溶剂选自异丙醇、丙酮及其混合物。
[0157]
实施方案48.根据实施方案44至47中任意一项所述的方法,其中所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,例如为80%。
[0158]
实施方案49.根据实施方案44至48中任意一项所述的方法,其中在步骤(1)反应结束后添加反溶解溶剂(如异丙醇),然后进行步骤(2)。
[0159]
实施方案50.根据实施方案44至49中任意一项所述的方法,其中在步骤(2)中,所述冷却是自然冷却或控温冷却。
[0160]
实施方案51.根据实施方案44至50中任意一项所述的方法,其中在任选的步骤(4)中,干燥温度为50-60℃。
[0161]
本发明的盐和本发明的晶型具有结晶性好、溶解度高、吸湿性小和稳定性好的特性。本发明的盐和本发明的晶型的生产重现性好,易于实现放大生产,可持续生产出高质量产品,满足药物的质量要求。
[0162]
例如,按照wo2014/139465a1的实施例9制备得到的游离形式的化合物78为黄色固体,其是一种针状晶体,而本发明的晶型b-iii是板状晶体,其比针状晶体的长径小,颗粒性更好,因此具有更小的休止角,即,具有更好的流动性。这些特点使得晶型b-iii在后续制剂生产中更有利于与辅料混合均匀,可以简化制剂生产的工艺流程,提高生产效率,节约生产成本。
[0163]
此外,本发明的盐和本发明的晶型具有更好的溶解度性质。例如,与游离形式的化合物78相比,本发明的盐在不同ph值下的溶解度差异更小,这使得本发明的盐在体内具有不同ph的体液中的溶解度更为平稳。此外,本发明的晶型b-iii在胃酸条件下比游离形式的化合物78和其它盐具有更高的溶解度,有利于其在胃内的迅速溶解。同时,在胃肠道较高的ph条件下,本发明的盐和本发明的晶型仍有较高且较平稳的溶解度,这有利于其充分吸收,从而产生较高的生物利用度,并且使药物在体内的吸收不受进食的影响。
[0164]
本发明的晶型b-iii吸湿性小,稳定性好,特别方便制剂的生产、储存、运输和治疗疾病时使用。
[0165]
另外,本发明的晶型纯度高,溶剂残留少,符合原料药质量要求,例如符合ich q3a的要求。
[0166]
本领域技术人员可以用本领域已知的方法例如各国药典中公开的测试方法或其变通方法对本发明的盐和本发明的晶型的以上特点进行验证。例如,本发明的晶型可以通过x-射线粉末衍射、单晶衍射、傅里叶红外光谱、差示扫描量热法和/或热重分析法进行鉴定。
[0167]
本领域技术人员知道,x-射线粉末衍射峰的强度和/或位置可能会因为实验条件的不同而有差异。例如,不同的仪器、不同的测试条件和/或优先取向等可能会导致测得的2θ值略有不同。此外,已知的是峰的相对强度比峰的位置更容易受到所测定的样品的影响,例如样品中晶体的尺寸、结晶的取向作用和被分析的材料的纯度等,因此峰强度的偏差可以高达约
±
20%或者更大。尽管存在试验误差、仪器误差和优先取向等,根据x-射线粉末衍射的主要峰,甚至进一步结合其它表征数据,本领域技术人员能够获取足够的信息来鉴定晶型a-iii、晶型b-ii、晶型b-iii和晶型c-i。
[0168]
晶型a-iii的鉴定
[0169]
本发明提供了晶型a-iii。
[0170]
在一些实施方案中,晶型a-iii可以通过x-射线粉末衍射进行鉴定。在一些实施方案中,晶型a-iii的x-射线粉末衍射特征性衍射角(2θ)包括5.8
±
0.2
°
、6.2
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、23.1
±
0.2
°
和24.1
±
0.2
°
。
[0171]
在一些实施方案中,晶型a-iii的x-射线粉末衍射特征性衍射角(2θ)包括5.8
±
0.2
°
、6.2
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、16.2
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
和26.4
±
0.2
°
。
[0172]
在一些实施方案中,晶型a-iii的x-射线粉末衍射特征性衍射角(2θ)包括5.8
±
0.2
°
、6.2
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、20.2
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
和27.8
±
0.2
°
。
[0173]
在一些实施方案中,晶型a-iii的x-射线粉末衍射特征性衍射角(2θ)包括5.8
±
0.2
°
、6.2
±
0.2
°
、7.9
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、16.8
±
0.2
°
、17.4
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、19.6
±
0.2
°
、20.2
±
0.2
°
、21.0
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、24.8
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
和27.8
±
0.2
°
。
[0174]
在一些实施方案中,晶型a-iii的x-射线粉末衍射特征性衍射角(2θ)包括5.8
±
0.2
°
、6.2
±
0.2
°
、7.9
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、16.8
±
0.2
°
、17.4
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、19.6
±
0.2
°
、20.2
±
0.2
°
、21.0
±
0.2
°
、21.4
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、24.8
±
0.2
°
、25.2
±
0.2
°
、26.0
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
、27.8
±
0.2
°
、29.8
±
0.2
°
、31.5
±
0.2
°
和32.7
±
0.2
°
。
[0175]
在一些实施方案中,晶型a-iii具有如图1所示的x-射线粉末衍射谱图。
[0176]
在一些实施方案中,晶型a-iii可用差示扫描量热分析进行鉴定。在一些实施方案中,晶型a-iii具有如图2所示的差示扫描量热分析曲线。在dsc谱图中,晶型a-iii的吸热峰在约290.2-295.4℃。
[0177]
在一些实施方案中,晶型a-iii可用热重分析进行鉴定。在一些实施方案中,晶型a-iii具有如图3所示的热重分析曲线,其显示晶型a-iii是无水物或纯晶。
[0178]
在一些实施方案中,所述的晶型a-iii是基本上纯的。
[0179]
在一些实施方案中,所述的晶型a-iii基本不含有其它晶型。例如晶型a-iii的含量以重量计为至少99%,至少95%,至少90%,至少80%,至少70%,至少60%或至少50%。
[0180]
晶型a-iii的制备方法
[0181]
本文提供了制备晶型a-iii的方法,其包括:
[0182]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与盐酸在加热和搅拌下混合于溶解溶剂中或混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐;
[0183]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0184]
(3)分离得到固体,为晶型a-iii;
[0185]
(4)任选地,干燥步骤(3)所得的固体。
[0186]
在一些实施方案中,所述盐酸为浓盐酸,以重量计浓度为36%-38%。
[0187]
在一些实施方案中,所述盐酸与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1。在一些实施方案中,所述摩尔比为约1∶1。在一些实施方案中,所述摩尔比为约1.2∶1。
[0188]
在一些实施方案中,所述溶解溶剂或所述混合溶剂的体积(毫升)与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量(克)之比不小于约10ml/g,例如约20ml/g、约60ml/g等。
[0189]
在一些实施方案中,所述溶解溶剂选自c
1-6
烷基醇。在一些实施方案中,所述溶解溶剂选自甲醇、乙醇、异丙醇、叔丁醇及其混合物。在一些实施方案中,所述溶解溶剂选自乙
醇。
[0190]
在一些实施方案中,所述水互溶性有机溶剂选自c1-6烷基醇。在一些实施方案中,所述水互溶性有机溶剂选自甲醇、乙醇、异丙醇、叔丁醇及其混合物。在一些实施方案中,所述水互溶性有机溶剂选自乙醇、异丙醇及其混合物。
[0191]
在一些实施方案中,所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,例如所述水互溶性有机溶剂占所述混合溶剂的体积百分数为95%、90%、80%等。
[0192]
在一些实施方案中,在所述步骤(1)中,加热温度应不高于溶剂体系沸点,例如75-80℃、75-85℃等。
[0193]
在一些实施方案中,在所述步骤(2)中,所述的冷却是自然冷却或控温冷却,冷却至室温或更低的温度,例如20-25℃、15-25℃等。
[0194]
在一些实施方案中,在所述步骤(2)中,冷却反应物后,将反应物搅拌1-120小时,例如2小时、20小时等,以使固体充分析出。
[0195]
在一些实施方案中,在所述任选的步骤(4)中,干燥温度和干燥时间是本领域技术人员可以常规确定的,其使固体得到充分干燥并保持所要的晶型。在一些实施方案中,干燥温度为50-80℃,例如60℃。在一些实施方案中,干燥时间为1-24小时,例如2小时、18小时等。
[0196]
晶型b-ii的鉴定
[0197]
本发明提供了晶型b-ii。
[0198]
在一些实施方案中,晶型b-ii可以通过x-射线粉末衍射进行鉴定。在一些实施方案中,晶型b-ii的x-射线粉末衍射特征性衍射角(2θ)包括7.5
±
0.2
°
、11.3
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、18.0
±
0.2
°
和20.6
±
0.2
°
。
[0199]
在一些实施方案中,晶型b-ii的x-射线粉末衍射特征性衍射角(2θ)包括3.8
±
0.2
°
、7.5
±
0.2
°
、11.3
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.7
±
0.2
°
和23.0
±
0.2
°
。
[0200]
在一些实施方案中,晶型b-ii的x-射线粉末衍射特征性衍射角(2θ)包括3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.7
±
0.2
°
、23.0
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
。
[0201]
在一些实施方案中,晶型b-ii的x-射线粉末衍射特征性衍射角(2θ)包括3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、11.8
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.6
±
0.2
°
、21.1
±
0.2
°
、21.7
±
0.2
°
、23.0
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
。
[0202]
在一些实施方案中,晶型b-ii的x-射线粉末衍射特征性衍射角(2θ)包括3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、11.8
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、17.6
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.3
±
0.2
°
、20.6
±
0.2
°
、21.1
±
0.2
°
、21.7
±
0.2
°
、22.4
±
0.2
°
、23.0
±
0.2
°
、23.4
±
0.2
°
、23.9
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
。
[0203]
在一些实施方案中,晶型b-ii具有如图4所示的x-射线粉末衍射谱图。
[0204]
在一些实施方案中,晶型b-ii可用差示扫描量热分析进行鉴定。在一些实施方案
中,晶型b-ii具有如图5所示的差示扫描量热分析曲线。在dsc谱图中,晶型b-ii在约54.8-92.2℃、166.9-174.4℃和263.3-265.3℃出现吸热峰,在约194.2-202.7℃出现放热峰。
[0205]
在一些实施方案中,晶型b-ii可用热重分析进行鉴定。在一些实施方案中,晶型b-ii具有如图6所示的热重分析曲线,其显示在30-100℃区间有约4.3%失重,表明该晶型b-ii含有较多吸附水分,结合图5的差示扫描量热分析曲线可以得知,晶型b-ii为具有吸湿性的亚稳定晶型。
[0206]
在一些实施方案中,所述的晶型b-ii是基本上纯的。
[0207]
在一些实施方案中,所述的晶型b-ii基本不含有其它晶型。例如,晶型b-ii的含量以重量计为至少99%,至少95%,至少90%,至少80%,至少70%,至少60%,或至少50%。
[0208]
晶型b-ii的制备方法
[0209]
本文提供了制备晶型b-ii的方法,其包括:
[0210]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与l-酒石酸在加热和搅拌下混合于乙醇中,反应形成盐;
[0211]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0212]
(3)分离析出的固体,为晶型b-ii;
[0213]
(4)任选地,干燥步骤(3)中所得的固体。
[0214]
在一些实施方案中,所述l-酒石酸与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1:2。在一些实施方案中,摩尔比为约4∶5。在一些实施方案中,摩尔比为约3.4∶1。
[0215]
在一些实施方案中,所述乙醇的体积(毫升)与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量(克)之比不小于约10ml/g(体积重量比),例如约72ml/g、约75ml/g等。
[0216]
在一些实施方案中,在所述步骤(1)中,加热温度应不高于溶剂体系沸点,例如70-75℃。
[0217]
在一些实施方案中,在所述步骤(2)中,所述冷却是自然冷却或控温冷却,冷却至室温或更低的温度,例如20-25℃。
[0218]
在一些实施方案中,在所述步骤(2)中,冷却反应物后搅拌1-120小时,例如18小时,以使固体充分析出。
[0219]
在一些实施方案中,在所述步骤(4)中,干燥温度和干燥时间是本领域技术人员可以常规确定的,其使固体得到充分干燥并保持所要的晶型。在一些实施方案中,干燥温度为50-85℃,例如50℃、65℃、82℃等。在一些实施方案中,干燥时间为1-24小时,例如1小时、18小时、19小时等。
[0220]
晶型b-iii的鉴定
[0221]
本发明提供了晶型b-iii。
[0222]
在一些实施方案中,晶型b-iii可以通过x-射线粉末衍射进行鉴定。在一些实施方案中,晶型b-iii的x-射线粉末衍射特征性衍射角(2θ)包括13.1
±
0.2
°
、14.6
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
和26.3
±
0.2
°
。
[0223]
在一些实施方案中,晶型b-iii的x-射线粉末衍射特征性衍射角(2θ)包括12.4
±
0.2
°
、13.1
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、16.5
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
和26.3
±
0.2
°
。
[0224]
在一些实施方案中,晶型b-iii的x-射线粉末衍射特征性衍射角(2θ)包括7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
和26.3
±
0.2
°
。
[0225]
在一些实施方案中,晶型b-iii的x-射线粉末衍射特征性衍射角(2θ)包括7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、19.6
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.7
±
0.2
°
、24.6
±
0.2
°
、26.3
±
0.2
°
、27.6
±
0.2
°
和29.2
±
0.2
°
。
[0226]
在一些实施方案中,晶型b-iii的x-射线粉末衍射特征性衍射角(2θ)包括7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、17.9
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、19.6
±
0.2
°
、20.8
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.2
±
0.2
°
、23.7
±
0.2
°
、24.6
±
0.2
°
、26.3
±
0.2
°
、27.1
±
0.2
°
、27.6
±
0.2
°
、27.8
±
0.2
°
和29.2
±
0.2
°
。
[0227]
在一些实施方案中,晶型b-iii具有如图7所示的x-射线粉末衍射谱图。
[0228]
在一些实施方案中,晶型b-iii可用差示扫描量热分析进行鉴定。在一些实施方案中,晶型b-iii具有如图8所示的差示扫描量热分析曲线。在dsc谱图中,晶型b-iii的吸热峰在约269.2-271.3℃。
[0229]
在一些实施方案中,晶型b-iii可用热重分析进行鉴定。在一些实施方案中,晶型b-iii具有如图9所示的热重分析曲线,其显示该晶型b-iii是无水物或纯晶。
[0230]
在一些实施方案中,所述的晶型b-iii是基本上纯的。
[0231]
在一些实施方案中,所述的晶型b-iii基本不含有其它晶型。例如,晶型b-iii的含量以重量计为至少99%,至少95%,至少90%,至少80%,至少70%,至少60%,或至少50%。
[0232]
晶型b-iii的制备方法
[0233]
本文涉及制备晶型b-iii的方法,其包括:
[0234]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与l-酒石酸于加热并搅拌下混合于溶解溶剂中、混合于水中或者混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐,得到第一溶液;条件是,所述溶解溶剂不是单一溶剂乙醇(即,其可以是其它溶解溶剂,也可以是乙醇和其它溶解溶剂组成的混合溶剂);
[0235]
(2)任选地,向所述第一溶液中加入反溶解溶剂,得到第二溶液;
[0236]
(3)冷却所述第一溶液或第二溶液,使固体充分析出;
[0237]
(4)分离析出的固体,为晶型b-iii;
[0238]
(5)任选地,干燥步骤(4)所得的固体。
[0239]
在一些实施方案中,所述l-酒石酸与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1。在一些实施方案中,摩尔比为约1∶1。在一些实施方案中,摩尔比为约1.5∶1。
[0240]
在一些实施方案中,在步骤(1)中,所述溶解溶剂、水或由水互溶性有机溶剂和水组成的混合溶剂的体积(毫升)与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量(克)之比不小于约10ml/g(体积重量比),例如约20ml/g、约30ml/g、约33ml/g、约50ml/g、约65ml/g、约98ml/g、约286ml/g等。
[0241]
在一些实施方案中,所述溶解溶剂选自c
1-6
烷基醇、丙酮、甲苯、不多于八个碳原子的有机酸酯及其混合物。在一些实施方案中,所述溶解溶剂选自甲醇、乙醇、异丙醇、叔丁醇、正丁醇、丙酮、甲苯、乙酸正丙酯、乙酸乙酯及其混合物。在一些实施方案中,所述溶解溶剂选自甲醇、乙醇、异丙醇、丙酮、甲苯、乙酸正丙酯、乙酸乙酯及其混合物。
[0242]
在一些实施方案中,所述溶解溶剂选自由甲醇、乙醇、甲苯、乙酸正丙酯和乙酸乙酯中的两种溶剂组成的混合溶剂,例如乙酸正丙酯/甲醇(体积比为约3∶2),甲苯/乙醇(体积比为约1∶1),乙酸乙酯/乙醇(体积比为约11∶15)等。
[0243]
在一些实施方案中,所述水互溶性有机溶剂选自c
1-6
烷基醇、丙酮及其混合物。在一些实施方案中,所述的水互溶性有机溶剂选自甲醇、乙醇、异丙醇、叔丁醇、丙酮及其混合物。在一些实施方案中,所述的水互溶性有机溶剂选自乙醇、异丙醇、丙酮及其混合物。
[0244]
在一些实施方案中,所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,例如95%、90%、80%等。
[0245]
在一些实施方案中,所述反溶解溶剂选自甲苯、不多于八个碳原子的有机酸酯及其混合物。在一些实施方案中,所述反溶解溶剂选自甲苯、乙酸乙酯、乙酸正丙酯及其混合物。在一些实施方案中,所述反溶解溶剂选自甲苯、乙酸乙酯及其混合物。
[0246]
在一些实施方案中,在所述步骤(1)中,加热温度应不高于溶剂体系沸点,例如55-60℃、70-72℃、75-85℃、90-95℃等。
[0247]
在一些实施方案中,在所述步骤(3)中,所述冷却是自然冷却或控温冷却,冷却至室温或更低的温度,例如20-25℃、25-30℃等。
[0248]
在一些实施方案中,在所述步骤(3)中,冷却第一溶液或第二溶液后搅拌1-120小时,例如2小时、16小时、17小时、18小时、20小时等,以使固体充分析出。
[0249]
在一些实施方案中,在所述步骤(5)中,干燥温度和干燥时间是本领域技术人员可以常规确定的,其使固体得到充分干燥并保持所要的晶型。在一些实施方案中,干燥温度为50-85℃,例如55℃、60℃、65℃等。在一些实施方案中,干燥时间为1-24小时,例如2小时、3小时、5小时、6小时、16小时等。
[0250]
晶型c-i的鉴定
[0251]
本发明提供了晶型c-i。
[0252]
在一些实施方案中,晶型c-i可以通过x-射线粉末衍射进行鉴定。在一些实施方案中,晶型c-i的x-射线粉末衍射特征性衍射角(2θ)包括7.8
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
和24.0
±
0.2
°
。
[0253]
在一些实施方案中,晶型c-i的x-射线粉末衍射特征性衍射角(2θ)包括5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、22.2
±
0.2
°
、24.0
±
0.2
°
和26.1
±
0.2
°
。
[0254]
在一些实施方案中,晶型c-i的x-射线粉末衍射特征性衍射角(2θ)包括5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、24.0
±
0.2
°
、26.1
±
0.2
°
和27.4
±
0.2
°
。
[0255]
在一些实施方案中,晶型c-i的x-射线粉末衍射特征性衍射角(2θ)包括5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、12.2
±
0.2
°
、12.9
±
0.2
°
、13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、23.5
±
0.2
°
、24.0
±
0.2
°
、25.0
±
0.2
°
、26.1
±
0.2
°
、27.4
±
0.2
°
和32.8
±
0.2
°
。
[0256]
在一些实施方案中,晶型c-i的x-射线粉末衍射特征性衍射角(2θ)包括5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、12.2
±
0.2
°
、12.9
±
0.2
°
、13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、22.7
±
0.2
°
、23.5
±
0.2
°
、24.0
±
0.2
°
、24.4
±
0.2
°
、26.1
±
0.2
°
、27.4
±
0.2
°
、28.8
±
0.2
°
、32.8
±
0.2
°
和33.6
±
0.2
°
。
[0257]
在一些实施方案中,晶型c-i具有如图12所示的x-射线粉末衍射谱图。
[0258]
在一些实施方案中,晶型c-i可用差示扫描量热分析进行鉴定。在一些实施方案中,晶型c-i盐具有如图13所示的差示扫描量热分析曲线。在dsc谱图中,晶型c-i的吸热峰在约289.77-291.04℃。
[0259]
在一些实施方案中,晶型c-i可用热重分析进行鉴定。在一些实施方案中,晶型c-i具有如图14所示的热重分析曲线,其显示该晶型c-i是无水物或纯晶。
[0260]
在一些实施方案中,所述的晶型c-i是基本上纯的。
[0261]
在一些实施方案中,所述的晶型c-i基本不含有其它晶型。例如,晶型c-i的含量以重量计为至少99%,至少95%,至少90%,至少80%,至少70%,至少60%,或至少50%。
[0262]
晶型c-i的制备方法
[0263]
本文提供了制备晶型c-i的方法,其包括:
[0264]
(1)将化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺与对甲苯磺酸一水合物在加热和搅拌下混合于由水互溶性有机溶剂和水组成的混合溶剂中,反应形成盐;
[0265]
(2)冷却步骤(1)所得的反应物,使固体充分析出;
[0266]
(3)分离析出的固体,为晶型c-i;
[0267]
(4)任选地,干燥步骤(3)所得的固体。
[0268]
在一些实施方案中,所述对甲苯磺酸一水合物与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的摩尔比不小于约1∶1。在一些实施方案中,摩尔比为约1.5∶1。
[0269]
在一些实施方案中,所述步骤(1)中的由水互溶性有机溶剂和水组成的混合溶剂的体积(毫升)与化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺的重量(克)之比不小于约10ml/g(体积/重量比),例如约36ml/g、约43ml/g等。
[0270]
在一些实施方案中,所述水互溶性有机溶剂选自c
1-6
烷基醇、丙酮及其混合物。在一些实施方案中,所述水互溶性有机溶剂选自异丙醇、丙酮及其混合物。
[0271]
在一些实施方案中,所述水互溶性有机溶剂占所述混合溶剂的体积百分数不大于约95%,例如80%等。
[0272]
在一些实施方案中,在所述步骤(1)中,加热温度应不高于溶剂体系沸点,例如55-60℃、75-85℃等。
[0273]
在一些实施方案中,任选地,在步骤(1)反应结束后添加至少一种反溶解溶剂(如异丙醇),然后进行步骤(2)。
[0274]
在一些实施方案中,在所述步骤(2)中,所述冷却是自然冷却或控温冷却,冷却至室温或更低的温度。
[0275]
在一些实施方案中,在所述步骤(2)中,冷却后搅拌1-120小时,例如15小时等,以使固体充分析出。
[0276]
在一些实施方案中,在所述任选的步骤(4)中,干燥温度和干燥时间是本领域技术人员可以常规确定的,其使固体得到充分干燥并保持所要的晶型。在一些实施方案中,干燥温度为50-60℃,例如50℃等。在一些实施方案中,干燥时间为1-24小时,例如4小时、20小时等。
[0277]
以上针对同一种晶型所述的制备方法的各个实施方案中的特征可以任意进行组合,从而得到新的技术方案,这些相互组合得到的新的技术方案也包括在本发明的范围内,就如同在本文中具体地且逐一地列出这些技术方案一样。
[0278]
药物组合物和用途
[0279]
本发明的盐和本发明的晶型可用于在体内和体外抑制fgfr活性。
[0280]
本发明的盐和本发明的晶型可用于预防或治疗对抑制fgfr活性有响应的疾病。相应地,本发明提供了预防或治疗对抑制fgfr活性有响应的疾病的方法,其包括给有需要的个体施用本发明的盐和本发明的晶型,并且任选地施用一种或多种其它活性成分。此外,本发明还提供了本发明的盐和本发明的晶型在制备用于预防或治疗对抑制fgfr活性有响应的疾病的药物中的用途。所述对抑制fgfr活性有响应的疾病是例如癌症,所述癌症包括但不限于肺癌(如鳞状非小细胞肺癌和小细胞肺癌)、胃癌、肝癌、乳腺癌、卵巢癌、子宫内膜癌、膀胱癌、尿路上皮癌、食道癌、胆管癌、结肠癌、直肠癌、头颈癌、宫颈癌、胰腺癌、肾上腺癌、神经胶质瘤、间皮瘤和血液肿瘤(如骨髓增殖性肿瘤)。
[0281]
本发明的盐和本发明的晶型可以以任意适合的方式施用,包括口服、局部(包括口含和舌下)、直肠、阴道、透皮、肌内、静脉内、动脉内、腹膜内、肺内、真皮内、皮下、鞘内、硬膜外和鼻内施用等。
[0282]
本发明的盐和本发明的晶型的达到预期生理作用的给药量取决于多种因素,例如所治疗的疾病、施用途径和方式以及个体的临床状况等。日剂量可以是例如0.01mg至3g/天,例如0.05mg至2g/天或100mg至1g/天。所述日剂量可以一次给予或者分多次(例如分2-4次)给予。
[0283]
为达到以上预防或治疗目的,本发明的盐和本发明的晶型可以以其本身的形式给药,但是通常将其用药学上可接受的载体配制成药物组合物的形式来使用。
[0284]
本发明的药物组合物可以是任何方便施用的形式,例如片剂、散剂、胶囊剂、溶液、分散剂、混悬剂、糖浆、喷雾剂、栓剂、凝胶剂、乳剂、贴剂等。用于配制药物组合物的药学上可接受的载体可以是药物制剂领域的常规组分,例如稀释剂、崩解剂、润滑剂、ph调节剂、矫
味剂、填充剂、防腐剂、渗透压调节剂、着色剂、乳化剂、助悬剂、表面活性剂等。所述药学上可接受的载体应该是与药物组合物中其它成分相容的,并且不会危害施用对象的健康。其可以是固体或液体,或是这两者。本发明的盐和本发明的晶型可以占药物组合物总重量的0.05%到95%。
[0285]
所述药物组合物可以通过混合本发明的盐或本发明的晶型与药学上可接受的载体来制备。针对每种剂型适合的载体是本领域技术人员公知的,例如在以下文献中有详细描述:ansel,howard c.等人,ansel’s pharmaceutical dosage forms and drug delivery systems.philadelphia:lippincott,williams&wilkins,2004;gennaro,alfonso r.等人remington.:the science and practice of pharmacy.philadelphia:lippincott,williams&wilkins,2000;和rowe,r.c.handbook of pharmaceutical excipients.chicago,pharmaceutical press,2005。
[0286]
在一些实例中,本发明的晶型在用药学上可接受的载体制成制剂时不会发生转化。在另一些实例中,本发明的晶型在用药学上可接受的载体制成制剂时可能会发生转化,全部或部分地转化成一种或多种其它形式,但是,本领域技术人员可以根据需要用已知的技术手段保持晶型的稳定。在一些实例中,本发明的晶型在制成药物组合物时可以被溶解,从而在药物组合物中不再以它们各自的晶型存在。
[0287]
本发明的盐和本发明的晶型可以与一种或多种其它活性成分组合使用,以实现相加或协同治疗作用,或者降低副作用。当被组合使用时,本发明的盐或本发明的晶型与所述一种或多种其它活性成分可以在不同的单位剂型中通过相同或不同的施用途径同时或相继施用,或者在同一个单位剂型中同时施用。
[0288]
可以与本发明的盐和本发明的晶型组合使用的其它活性成分可以是抗肿瘤药和/或抗肿瘤疗法。实例包括但不限于:放疗、免疫疗法制剂、化疗剂如dna损伤的化疗剂和干扰细胞复制的化疗剂。
[0289]
dna损伤的化疗剂的非限定性例子包括拓扑异构酶i抑制剂(例如依立替康、托泊替康、喜树碱及其类似物或代谢物、以及阿霉素);拓扑异构酶ii抑制剂(例如依托泊苷、替尼泊苷、米托蒽醌、去甲氧基柔红霉素和道诺霉素);烷化剂(例如美法仑、苯丁酸氮芥、白消安、噻替派、异环磷酰胺、亚硝基脲氮芥、环己亚硝脲、甲基环己亚硝脲、链脲霉素、氨烯咪胺、甲氨喋呤、丝裂霉素c和环磷酰胺);dna嵌入剂(例如顺铂、奥沙利铂和卡波铂);dna嵌入剂和自由基产生剂如博来霉素;以及核苷类似物(例如5-氟尿嘧啶、卡培他滨、吉西他滨、氟达拉滨、阿糖胞苷、阿扎胞苷、巯基嘌呤、硫鸟嘌呤、喷司他丁和羟基脲)。
[0290]
干扰细胞复制的化疗剂的非限定性例子包括:紫杉醇、紫杉萜及有关的类似物;长春新碱、长春碱及有关的类似物;沙利度胺及有关的类似物(例如cc-5013和cc-4047);蛋白酪氨酸激酶抑制剂(例如甲磺酸伊马替尼和吉非替尼);蛋白酶体抑制剂(例如硼替佐米);nf-κb抑制剂,包括iκb激酶抑制剂;与癌症中过度表达的蛋白结合从而下调细胞复制的抗体(例如曲妥单抗、利妥昔单抗、西妥昔单抗和贝伐单抗);以及其它的蛋白或酶抑制剂,已知这些蛋白或酶在癌症中会被上调、过度表达或激活,并且对它们的抑制能够下调细胞复制。
实施例
[0291]
以下实施例用于对本发明进行举例说明,不限制权利要求中所定义的范围。
[0292]
实验部分
[0293]
实施例中所用的化合物4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺原料是根据wo2014/139465a1的实施例9中的方法制备得到的,为黄色针状晶体,其显微镜照片如图22所示。
[0294]
本发明所用的所有试剂(除了中间体)均为商业市场购得。所有化合物的名称(除了试剂)由软件chemdraw professional 16.0产生。
[0295]
除非另有注明,否则x-射线粉末衍射图是用德国bruker d8 advance(靶:cu,电压:40kv,电流:40ma,扫描速度:4度/分钟,步长:0.02度,测定范围:3-45度)测定的。
[0296]
除非另有注明,否则差示扫描量热分析测定是用德国耐驰公司的dsc 204f1(吹扫气体:氮气,流速:20-60ml min-1
,升温速度:10℃/分钟,测定范围:30℃
→
300/350℃)测定的,样品测量使用了轧孔铝盘,使用铟进行温度校正。
[0297]
除非另有注明,否则热重分析是用德国耐驰公司的tga 209f1(吹扫气体:氮气,升温速度:10℃/分钟)测定的。
[0298]
除非另有注明,否则显微镜照片是用尼康ci-l显微镜获得的。
[0299]
实施例1-晶型a-iii的制备
[0300]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.51g,1mmol)混悬在10ml 95%乙醇(即,体积比95:5的乙醇:水混合物)中,在搅拌下加热至75-85℃;向混悬液中加入100μl盐酸(以重量计浓度36%-38%),得到澄清溶液;将该溶液冷却到15-25℃,搅拌20小时,滤出固体,60℃真空干燥2小时,得到样品。测得样品的氯离子含量为6.48%,从氯离子含量可以判断所得样品为一盐酸盐(理论含量6.69%)。
[0301]1h nmr(400mhz,cd3od)δ8.11(2h,s),7.48-7.42(2h,m),7.36(1h,d,j=2.0),7.29(1h,d,j=2.0),7.00(2h,dd,j=9.6,2.8),3.91(3h,s),3.73(2h,dd,j=13.3,2.4),3.48(2h,ddd,j=9.9,6.6,3.2),3.05(2h,t,j=7.5),2.89(3h,s),2.82(2h,t,j=7.5),2.69(2h,dd,j=13.3,11.3),1.38(6h,d,j=6.6)。
[0302]
所得粉末样品是晶型a-iii,其x-射线粉末衍射图如图1所示,其包括衍射峰(2θ):5.8
±
0.2
°
、6.2
±
0.2
°
、7.9
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、15.8
±
0.2
°
、16.2
±
0.2
°
、16.8
±
0.2
°
、17.4
±
0.2
°
、18.3
±
0.2
°
、18.5
±
0.2
°
、19.6
±
0.2
°
、20.2
±
0.2
°
、21.0
±
0.2
°
、21.4
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
、24.8
±
0.2
°
、25.2
±
0.2
°
、26.0
±
0.2
°
、26.4
±
0.2
°
、27.1
±
0.2
°
、27.8
±
0.2
°
、29.8
±
0.2
°
、31.5
±
0.2
°
和32.7
±
0.2
°
,其中特征峰为5.8
±
0.2
°
、6.2
±
0.2
°
、10.3
±
0.2
°
、12.3
±
0.2
°
、13.3
±
0.2
°
、15.0
±
0.2
°
、16.2
±
0.2
°
、22.2
±
0.2
°
、23.1
±
0.2
°
、24.1
±
0.2
°
和26.4
±
0.2
°
。其dsc测试结果如图2所示,显示晶型a-iii的吸热峰在约290.2-295.4℃。
[0303]
实施例2-晶型a-iii的制备
[0304]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.51g,1mmol)混悬在30ml无水乙醇中,在搅拌下加热至75-85℃以溶解;向溶液中加入100μl盐酸(以重量计浓度36%-38%),在75-85℃继续搅拌5
分钟;将溶液冷却到15-25℃,搅拌2小时;滤出固体,60℃真空干燥18小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例1中所得的晶型a-iii样品一致。
[0305]
实施例3-晶型a-iii的制备
[0306]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(2.04g,4mmol)混悬在40ml体积比9∶1的异丙醇:水混合物中,在搅拌下加热至75-80℃;向混悬液中加入352μl盐酸(以重量计浓度36%-38%);将得到的混合物冷却到20-25℃,搅拌2小时;滤出固体,60℃真空干燥2小时,得到1.6g样品。经检测,所得样品的x-射线粉末衍射图与实施例1中所得的晶型a-iii样品一致。
[0307]
实施例4-晶型b-ii的制备
[0308]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(1g,1.96mmol)与60ml无水乙醇混合,加热至70-74℃以溶解;向其中加入l-酒石酸(0.24g,1.6mmol)的乙醇(12ml)溶液,固体立即析出;在70-74℃搅拌30分钟;降温至50-55℃,搅拌1小时;降温至20-25℃,搅拌18小时;固体滤出,60℃真空干燥2小时,再65℃真空干燥16小时,然后82℃真空干燥1小时,得到1.15g样品。
[0309]1h nmr(400mhz,dmso)δ9.22(1h,s),8.48(1h,q,j=4.4),8.22(2h,s),7.53(2h,dd,j=9.7,2.7),7.43(1h,d,j=1.9),7.40(1h,d,j=1.9),6.88(2h,dd,j=9.7,2.7),3.88(3h,s),3.83(1h,s),3.53(2h,d,j=9.8),3.09(2h,d,j=6.6),2.97(2h,dd,j=9.1,6.5),2.80-2.70(5h,m,j=14.4,5.7),2.30(2h,t,j=11.4),1.12(6h,d,j=6.4)。
[0310]
所得粉末样品为晶型b-ii,其x-射线粉末衍射图如图4所示,其包括衍射峰(2θ):3.8
±
0.2
°
、7.5
±
0.2
°
、10.1
±
0.2
°
、11.3
±
0.2
°
、11.8
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、15.7
±
0.2
°
、17.6
±
0.2
°
、18.0
±
0.2
°
、19.8
±
0.2
°
、20.3
±
0.2
°
、20.6
±
0.2
°
、21.1
±
0.2
°
、21.7
±
0.2
°
、22.4
±
0.2
°
、23.0
±
0.2
°
、23.4
±
0.2
°
、23.9
±
0.2
°
、25.1
±
0.2
°
和27.8
±
0.2
°
,其中特征峰为7.5
±
0.2
°
、11.3
±
0.2
°
、13.9
±
0.2
°
、15.1
±
0.2
°
、18.0
±
0.2
°
和20.6
±
0.2
°
。其dsc测试结果如图5所示,显示晶型b-ii在约54.8-92.2℃、166.9-174.4℃和263.3-265.3℃出现吸热峰,在约194.2-202.7℃出现放热峰。
[0311]
实施例5-晶型b-ii的制备
[0312]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(1g,1.96mmol)与60ml无水乙醇混合,加热至70-75℃,热过滤去除少量不溶物;向其中加入l-酒石酸(1g,6.66mmol)的乙醇(15ml)溶液,添加过程中固体析出;在70-75℃搅拌1小时;降温至24℃,滤出固体,50℃真空干燥17小时,再82℃真空干燥1小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例4中所得的晶型b-ii样品一致。
[0313]
实施例6-晶型b-iii的制备
[0314]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(1g,1.96mmol)与15ml体积比8∶2的异丙醇:水混合物混合,加热至70℃以溶解;向其中加入l-酒石酸(0.29g,1.93mmol)在体积比8∶2的异丙醇:水混合物(5ml)中的溶液,得到澄清反应溶液;在70-72℃搅拌10分钟,固体析出,保温30分钟;然后降温至50-55℃搅拌1小时,降温至40-45℃搅拌1小时,降温至20-25℃搅拌17小时;滤出固体,60℃真空干燥30分钟,再65℃真空干燥16小时,得到0.97g样品。
[0315]1h nmr(400mhz,dmso)δ9.22(1h,s),8.48(1h,q,j=4.3),8.22(2h,s),7.55-7.50(2h,m),7.43(1h,d,j=1.9),7.40(1h,d,j=1.9),6.88(2h,dd,j=9.7,2.7),3.88(3h,s),3.84(1h,s),3.57-3.48(2h,m),3.09(2h,dd,j=11.6,4.9),2.97(2h,dd,j=9.1,6.5),2.82-2.69(5h,m,j=14.6,5.8),2.30(2h,t,j=11.4),1.13(6h,d,j=6.4)。
[0316]
所得粉末样品为晶型b-iii,其x-射线粉末衍射图如图7所示,其包括衍射峰(2θ):7.6
±
0.2
°
、8.9
±
0.2
°
、10.0
±
0.2
°
、11.0
±
0.2
°
、12.4
±
0.2
°
、13.1
±
0.2
°
、13.4
±
0.2
°
、13.7
±
0.2
°
、14.6
±
0.2
°
、15.9
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、17.9
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
、19.6
±
0.2
°
、20.8
±
0.2
°
、21.4
±
0.2
°
、22.6
±
0.2
°
、23.2
±
0.2
°
、23.7
±
0.2
°
、24.6
±
0.2
°
、26.3
±
0.2
°
、27.1
±
0.2
°
、27.6
±
0.2
°
、27.8
±
0.2
°
和29.2
±
0.2
°
,其中特征峰为13.1
±
0.2
°
、14.6
±
0.2
°
、18.3
±
0.2
°
、18.9
±
0.2
°
、19.4
±
0.2
°
和26.3
±
0.2
°
。其dsc测试结果如图8所示,显示晶型b-iii的吸热峰在约269.2-271.3℃。
[0317]
显微镜检查显示晶型b-iii是板状晶体,其显微镜照片如图23所示。
[0318]
实施例7-晶型b-iii的制备
[0319]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.26g,0.51mmol)于加热回流和搅拌下溶解于7ml体积比8∶2的丙酮∶水混合物中;向其中加入l-酒石酸(0.08g,0.53mmol)在体积比8∶2的丙酮:水混合物(1.5ml)中的溶液;降温至40℃,搅拌1小时;降温至25℃,搅拌2小时;将析出的固体滤出,55℃真空干燥2小时,得0.21g样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0320]
实施例8-晶型b-iii的制备
[0321]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(51mg,0.1mmol)于55-60℃溶解于1.5ml甲醇中,趁热过滤;向滤液中加入l-酒石酸(23mg,0.15mmol),继续在55-60℃搅拌30分钟,然后将反应体系冷却到20-25℃,搅拌18小时;将析出的固体滤出,55℃真空干燥5小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0322]
实施例9-晶型b-iii的制备
[0323]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(51mg,0.1mmol)于75-85℃溶解于3ml乙酸正丙酯中;向其中加入l-酒石酸(23mg,0.15mmol)的甲醇(1ml)溶液;补加1ml甲醇,在75-85℃搅拌50分钟;冷却到25-30℃,搅拌16小时;将析出的固体滤出,55℃真空干燥6小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0324]
实施例10-晶型b-iii的制备
[0325]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(21mg,0.041mmol)于90-95℃溶解于3ml甲苯中;向其中加入l-酒石酸(9.3mg,0.062mmol)的乙醇(0.5m1)溶液,补加2.5ml乙醇,在80-90℃搅拌30分钟;冷却到20-25℃,搅拌18小时;将析出的固体滤出,55℃真空干燥2小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0326]
实施例11-晶型b-iii的制备
[0327]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)
乙基)-5-甲氧基-n-甲基苯甲酰胺(0.26g,0.51mmol)于加热回流下溶解于6ml体积比9:1的乙醇∶水混合物中;向其中加入l-酒石酸(0.08g,0.53mmol)在体积比9∶1的乙醇:水混合物(1.5ml)中的溶液,5分钟后固体析出;停止加热,冷却到25-30℃,搅拌20小时;将析出的固体滤出,55℃真空干燥3小时,得到0.27克样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0328]
实施例12-晶型b-iii的制备
[0329]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.26g,0.51mmol)于75-80℃溶解于11ml混合溶剂(乙醇/乙酸乙酯,体积比1∶1)中;向其中加入l-酒石酸(0.08g,0.53mmol)的乙醇(2ml)溶液,两分钟内析出固体;在75-80℃搅拌1小时;停止加热,冷却到25-30℃,搅拌16小时;将析出的固体滤出,55℃真空干燥16小时,得到0.30g样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0330]
实施例13-晶型b-iii的制备
[0331]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.26g,0.51mmol)于加热回流下溶解于6ml体积比9∶1的异丙醇:水混合物中;向其中加入l-酒石酸(0.08g,0.53mmol)在体积比9∶1的异丙醇:水混合物(2ml)中的溶液;降温至25-30℃,搅拌17小时;固体滤出,55℃真空干燥6小时,得到0.24g样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0332]
实施例14-晶型b-iii的制备
[0333]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(0.26g,0.51mmol)混悬在15ml水中,加热至75-85℃未溶解;向混悬液中加入l-酒石酸(0.08g,0.53mmol)的水(2m1)溶液,得到澄清溶液后析出固体;在75-85℃搅拌2小时;降温至25-30℃,搅拌19-20小时;将析出的固体滤出,55℃真空干燥3小时,得到0.23g样品。经检测,所得样品的x-射线粉末衍射图与实施例6中所得的晶型b-iii样品一致。
[0334]
实施例15-晶型c-i的制备
[0335]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(300mg,0.59mmol)于加热回流条件下溶于12ml体积比8∶2的丙酮:水混合物中;向其中加入对甲苯磺酸一水合物(168mg,0.89mmol)在体积比8∶2的丙酮:水混合物(1ml)中的溶液;搅拌约5分钟后析出固体;将反应液降至室温,继续搅拌约15小时;滤出固体,50℃真空干燥4小时,得到样品。
[0336]1h nmr(400mhz,dmso)δ:9.29(s,1h),8.90(d,j=9.7hz,1h),8.49(q,j=4.3hz,1h),8.34-8.24(m,1h),8.23(s,2h),7.57(t,j=6.1hz,2h),7.46(d,j=8.0hz,2h),7.41(dd,j=13.0,1.8hz,2h),7.09(dd,j=7.9,0.5hz,2h),6.91(d,j=9.1hz,2h),3.87(s,3h),3.69(d,j=10.9hz,2h),3.38(d,j=6.5hz,2h),3.00-2.92(m,2h),2.74(dd,j=11.5,5.8hz,5h),2.51(dd,j=19.2,7.7hz,2h),2.26(s,3h),1.23(d,j=6.5hz,6h)。
[0337]
所得粉末样品为晶型c-i,其x-射线粉末衍射图如图12所示,其包括衍射峰(2θ):5.5
±
0.2
°
、7.8
±
0.2
°
、9.7
±
0.2
°
、11.1
±
0.2
°
、11.7
±
0.2
°
、12.2
±
0.2
°
、12.9
±
0.2
°
、
13.5
±
0.2
°
、13.8
±
0.2
°
、14.3
±
0.2
°
、14.7
±
0.2
°
、16.6
±
0.2
°
、17.9
±
0.2
°
、18.2
±
0.2
°
、19.2
±
0.2
°
、20.0
±
0.2
°
、20.6
±
0.2
°
、22.2
±
0.2
°
、22.7
±
0.2
°
、23.5
±
0.2
°
、24.0
±
0.2
°
、24.4
±
0.2
°
、26.1
±
0.2
°
、27.4
±
0.2
°
、28.8
±
0.2
°
、32.8
±
0.2
°
和33.6
±
0.2
°
。其dsc测试结果如图13所示,显示晶型c-i的吸热峰在约289.77-291.04℃。
[0338]
实施例16-晶型c-i的制备
[0339]
将4-氯-3-(2-(2-((4-((3s,5r)-3,5-二甲基哌嗪-1-基)苯基)氨基)嘧啶-5-基)乙基)-5-甲氧基-n-甲基苯甲酰胺(4.3g,8.44mmol)于加热回流条件下溶于155ml体积比8∶2的异丙醇:水混合物中,热过滤去除不溶物;滤液再加热至回流,向其中加入对甲苯磺酸一水合物(2.4g,12.67mmol)的水(2m1)溶液;添加50ml异丙醇,搅拌约5分钟后固体析出;将反应液降至室温,继续搅拌约15小时;滤出固体,50℃真空干燥20小时,得到样品。经检测,所得样品的x-射线粉末衍射图与实施例15中所得的晶型c-i样品一致。
[0340]
实施例17-本发明的盐在高温、高湿、光照条件下的稳定性
[0341]
测定方法:分别将化合物78的半酒石酸盐的晶型b-iii和化合物78的一盐酸盐的晶型a-iii供试品置于培养皿中,开口裸露放置于密封洁净容器中,分别在60℃温度下、在25℃且相对湿度为92.5%
±
5%的条件下、在照度为45001x
±
5001x的条件下放置10天;分别对各试验样品取样,测定样品的纯度和晶型,结果见表1。
[0342]
表1晶型b-iii和晶型a-iii的稳定性试验结果
[0343][0344][0345]
由表1中的数据可见,化合物78的半酒石酸盐的晶型b-iii和化合物78的一盐酸盐的晶型a-iii在高温、高湿和光照条件下放置10天后,化学纯度均没有发生明显改变;晶型a-iii在高湿条件下放置后,晶型发生改变(如图15、图16所示);在高温和光照条件下放置,晶型没有发生明显改变;晶型b-iii在所有测试条件下都没有发生明显改变,稳定性良好。
[0346]
实施例18一晶型b-ii和晶型b-iii的稳定性
[0347]
测定方法一:将化合物78的半酒石酸盐的晶型b-ii和晶型b-iii供试品置于培养皿中,开口裸露放置于密封洁净容器中,在25℃且相对湿度为92.5%
±
5%条件下放置3天或5天,检测晶型,结果见表2。
[0348]
测定方法二:将化合物78的半酒石酸盐的晶型b-ii和晶型b-iii供试品混悬在水中室温搅拌,分别于第二天和第四天取样检测晶型,结果见表2。
[0349]
表2化合物78的半酒石酸盐的晶型b-ii和晶型b-iii的稳定性试验结果
[0350][0351]
由表2中的数据可见,化合物78的半酒石酸盐的晶型b-ii在两种测试条件下都不稳定,水分的存在诱发该晶型发生改变(如图17-19所示)。相反,化合物78的半酒石酸盐的晶型b-iii在高湿条件下放置以及在水中打浆晶型都保持不变(如图20和21所示),稳定性良好。
[0352]
实施例19-式a的盐与游离形式的化合物78在不同缓冲液中的溶解度比较
[0353]
测定方法:分别将过量的化合物78的半酒石酸盐的晶型b-iii、化合物78的一对甲苯磺酸盐的晶型c-i和游离形式的化合物78样品混悬于不同ph缓冲液和水中,在37℃恒温搅拌30分钟,离心,过滤,取滤液测定溶解度。溶解度结果均以游离形式计,结果如表3所示。其中不同ph缓冲液是根据美国药典(usp40-nf35)配制的。
[0354]
表3式a的盐与游离形式的化合物78在不同介质中的溶解度
[0355][0356]
由表3中的数据可见,化合物78的半酒石酸盐的晶型b-iii在ph 1.2的介质中溶解度很好,在纯水中也有较好的溶解度,显著高于晶型c-i和游离形式;化合物78的一对甲苯磺酸盐的晶型c-i在所有测试介质中溶解度都较低,但比较平稳;游离形式的化合物78在不同介质中溶解度差异巨大,在ph 4.5的缓冲液中具有高达12.6mg/ml的溶解度,但在其它介质和纯水中的溶解度较低。
[0357]
这说明,本发明的盐和本发明的晶型具有更好的溶解度性质。一方面,与游离形式的化合物78相比,本发明的盐在不同ph值下的溶解度差异更小,这使得本发明的盐在体内具有不同ph的体液中的溶解度更为平稳。另一方面,在胃肠道较高的ph条件下,本发明的盐和本发明的晶型仍有较高且较平稳的溶解度,这有利于其充分吸收,从而产生较高的生物利用度,并且使药物在体内的吸收不受进食的影响。
[0358]
实施例20-式a的盐的吸湿性
[0359]
测定方法:分别取化合物78的半酒石酸盐的晶型b-iii和晶型b-ii供试品置于动态水分吸附仪(dvs-intrinsic)的样品皿中,于25℃下在相对湿度0-95%范围内测试样品的吸湿增重。结果见图10和图11。
[0360]
由图10的曲线可见,化合物78的半酒石酸盐的晶型b-iii在环境湿度低于85%rh时,没有吸湿性;在环境湿度高于85%rh时,略有吸湿性。
[0361]
由图11的曲线可见,化合物78的半酒石酸盐的晶型b-ii在0至80%rh下持续吸湿,当环境湿度高于85%rh时,吸湿性进一步增大;样品吸湿后,吸收的水分在解吸附过程中有滞后现象。
[0362]
实施例21-式a的盐在犬体内的药动学研究
[0363]
给药制剂的配制
[0364]
静脉给药制剂:将71.48mg化合物78的半酒石酸盐的晶型b-iii溶于10%聚乙二醇-15羟基硬脂酸酯(solutol)、10%乙醇和80%生理盐水的混合物(60.7m1)中,获得澄清的溶液,用于静脉内给药。
[0365]
口服给药制剂(0.5mg/ml,以游离形式计算的浓度):将71.54mg化合物78的半酒石酸盐的晶型b-iii混悬于121.5ml去离子水中,得到混悬液,用于1mg/kg剂量组犬口服给药。
[0366]
给药和采样
[0367]
实验设计如下表4所示。
[0368][0369]
采血时间点如下表5所示:
[0370][0371]
生物样品分析方法
[0372]
采用液质联用方法(lc-ms/ms)测定游离形式的化合物78在犬血浆中的浓度。
[0373]
数据处理
[0374]
采用非房室模型统计矩方法,应用药代动力学软件phoenix(版本号6.2.1.51)进行数据分析,计算各剂量组药代动力学参数。c
max
和t
max
为实测值。绝对生物利用度(f%)根
据如下公式计算:
[0375]
(auc
0-∞,po
×
剂量
iv
)/(auc
0-∞,iv
×
剂量
po
)
[0376]
其中auc
0-∞,po
是指口服给药后游离形式的化合物78在犬体内的暴露量(auc
0-∞
),auc
0-∞,iv
是指静脉内给药后游离形式的化合物78在犬体内的暴露量(auc
0-∞
),剂量
iv
是指静脉内给药的剂量,剂量
po
是指口服给药的剂量。
[0377]
结果及讨论
[0378]
化合物78的半酒石酸盐的晶型b-iii在犬体内主要药物代谢动力学参数的平均值如表6和表7所示。
[0379]
犬接受静脉内给予的化合物78的半酒石酸盐的晶型b-iii(含游离形式的化合物78的量为1.0mg/kg)后,在犬体内的总体平均暴露量(auc
0-∞
)为1880
±
349h
·
ng/ml;总体平均清除率(cl)为9.09
±
1.51ml/min/kg;总体平均血浆消除半衰期(t
1/2
)为5.90
±
0.645h;总体平均稳态分布容积(vss)为2.95
±
0.399l/kg。
[0380]
犬灌胃给予化合物78的半酒石酸盐的晶型b-iii(含游离形式的化合物78的量为1.0mg/kg,禁食)后,在犬体内的血浆浓度总体平均达峰时间(t
max
)为0.792
±
0.459h;总体最大平均浓度(c
max
)为141
±
68.8ng/ml;总体平均暴露量(auc0-∞)为665
±
276 h
·
ng/ml;总体平均血浆消除半衰期(t
1/2
)为5.36
±
1.69h;总体平均绝对生物利用度(f%)为35.4%。
[0381]
[0382][0383]
结论
[0384]
比格犬以1mg/kg的剂量单次灌胃给予化合物78的半酒石酸盐的晶型b-iii后,在犬体内显示了较好的口服吸收,绝对口服生物利用度约为35.4%。化合物78的半酒石酸盐的晶型b-iii在犬体内吸收较快,达峰时间约为1小时。以1mg/kg的单剂量静脉内注射化合
物78的半酒石酸盐的晶型b-iii后,在犬体内清除率为9.09
±
1.51ml/min/kg,属于低清除药物。稳态表观分布容积为2.95
±
0.40l/kg,提示分布较为广泛。综上,化合物78的半酒石酸盐的晶型b-iii在犬体内表现出良好的药代动力学特征。
[0385]
应当理解的是,本文所述的实施例和实施方案仅用于解释说明目的,本技术的公开内容已经提示了本领域技术人员本发明的技术方案的各种可行的改进或变型,它们均包括在本技术的主旨和范围以及所附权利要求的范围内。通过引用的方式将本文所引用的所有出版物、专利和专利申请整体合并入本文并用于所有目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1