分枝杆菌属物种的检测
分枝杆菌属物种的检测
1.由于传染病已变为危及全世界数百万人生命的问题,因此病原菌的检测已成为人们最感兴趣的领域。
2.分枝杆菌属为放线菌的一个属。在这个属中识别出超过190种物种。这个属包括已知在动物和人类中引起严重疾病的病原体,包括结核(结核分枝杆菌(mycobacterium tuberculosis)、牛分枝杆菌(mycobacterium bovis))、鸟分枝杆菌(mycobacterium avium)类结核亚种(约氏病(johne's disease))和麻疯病(麻风分枝杆菌(mycobacterium leprae))。
3.优选的分枝杆菌属物种为病原性的。
4.病原性分枝杆菌属物种包括但不限于:
5.·
缓慢生长(鲁尼恩氏组i、ii和iii)物种,如结核分枝杆菌复合群(mtbc)成员是人类和动物结核的病原体。这个复合群中的物种包括:非洲分枝杆菌(m.africanum)、牛分枝杆菌、牛分枝杆菌bcg、卡内蒂分枝杆菌(m.canetti)、羊分枝杆菌(m.caprae)、微小分枝杆菌(m.microti)、芒吉分枝杆菌(m.mungi)、稻分枝杆菌(m.orygis)、海豹分枝杆菌(m.pinnipedii)、苏氏分枝杆菌(m.suricattae)、结核分枝杆菌,人类结核的主要原因;
6.·
鸟分枝杆菌复合群-一种在播散性感染中但非肺感染中曾经是aids患者死亡的重要原因的物种组。这个复合群中的物种包括:鸟分枝杆菌鸟亚种(m.aviumsubsp.avium);鸟分枝杆类菌结核亚种(m.aviumsubsp.paratuberculosis),其已涉及人类的克罗恩氏病(crohn's disease)且是反刍动物的约氏病(johne's disease)的病原体,所述反刍动物如牛和绵羊;鸟分枝杆菌唾液亚种(m.avium subsp.silvaticum);鸟分枝杆菌人亚种(m.avium subsp.hominissuis);哥伦比亚分枝杆菌(m.colombiense);印度分枝杆菌(m.indicus pranii);胞内分枝杆菌(m.intracellulare);
7.·
产生细菌内酯的分枝杆菌,如溃疡分枝杆菌(m.ulcerans),其引起“布路里(buruli)”或“拜恩斯代尔(bairnsdale)”溃疡;
8.·
未分组的,如麻风分枝杆菌,其引起麻疯病;弥漫型麻风分枝杆菌(m.lepromatosis)(2008年描述的另一(不太重要的)麻疯病原因);海分枝杆菌(m.marinum)(引起一种称为水族馆肉芽肿的罕见疾病)。
9.本发明涉及一种用于检测活分枝杆菌属物种的方法,所述分枝杆菌属物种如但不限于鸟分枝杆菌复合群,包括鸟分枝杆菌和鸟分枝杆菌类结核亚种,以及牛分枝杆菌和结核分枝杆菌。本发明还涉及一种用于所述方法中的试剂盒。
10.已知鸟分枝杆菌类结核亚种(map)在动物中引起疾病且可在人类中引起疾病。map是分枝杆菌属的革兰氏阳性细菌。所述细菌是非运动的且是杆状的,其平均长度为大致1.5微米。所述细菌基因组含于单一环状染色体内,其长度大约为5mbp。这种细菌是反刍动物中约氏病(jd,也被称为类结核病)的病原体。约氏病可引起产奶减少、牛体重持续减轻和难治性腹泻且甚至死亡。
11.感染最初在摄入被污染的食物或水之后在胃肠道的淋巴组织中发生。感染在长达10年不呈现临床症状,且可仅在免疫响应开始时诊断出。由于较长的潜伏期,仅降低疾病速
率并非提供针对感染的免疫性的疫苗接种已被认为是不可行的。
12.研究也已显示,在人类中,map与克罗恩氏病相关,且潜在地与其它慢性疾病,如1型糖尿病、多发性硬化、桥本氏甲状腺炎(hashimoto’s thyroiditis)相关。map导致牛和绵羊以及其它反刍动物的主要感染。此外,map还可从原生动物、动物(如兔、马鹿、野牛)和其它野生动物中分离。其存在已在食肉鸟类、灵长类动物和人体中报告。感染的动物显示顽固腹泻伴持续腹泻症状,患病动物呈现贫血伴随渐进性体重减轻。map感染潜伏期是长且缓慢的过程,其可在无症状宿主中出现,所述宿主在其粪便中排出活细菌,导致其它健康动物感染。
13.检测人或动物中分枝杆菌属物种的存在对于诊断分枝杆菌感染是有意义的。分枝杆菌属物种感染的快速且可靠的检测对于控制疾病而言是很重要的,且使用高通量技术的能力允许筛选大量样品。举例来说,非常有价值的是提供高通量筛选,可快速且可靠地测试来自牛群内的个体动物的样品的牛分枝杆菌(牛tb)或鸟分枝杆菌类结核亚种(约氏病),所述两者均为在英国的地方性牛疾病。两种分枝杆菌属物种可在暴露于牛分枝杆菌或map的动物血液中检测到,即使在它们处于疾病的亚临床阶段时。畜群内的这些生物体的快速且可靠检测在控制疾病中是极其重要的步骤。
14.目前用于检测活分枝杆菌属物种的快速方法能够检测和计数两天或三天内的血液中的活map。然而,所使用的方法是劳动密集型的,且将难以放大以用于高通量测定样品。在其中需要测试来自整个畜群的动物的兽医学环境中,通常需要同时测试数百个样品,且目前方法太昂贵且劳动密集而无法进行大规模测试。
15.tb和约氏病的目前临床标准测试是基于抗体的(免疫响应)测试。基于抗体的测试检测宿主免疫系统对于生物体的响应并非检测活生物体。已知这些测试的灵敏度在用作诊断法时很低,从而在得到明确的阳性结果之前需要重复结果或晚期感染。基于抗体的测试的特定缺点是,这些测试还不能区分已感染动物和疫苗接种动物。在用于检测分枝杆菌属物种的先前基于pcr的方法中,测定的灵敏度受到从在物理上稳健且难以裂解的分枝杆菌属物种回收dna的能力限制。此外,先前基于pcr的方法不容易区分活细胞和死细胞。尤其在食品工业中,区分活的和死分枝杆菌属物种的能力是极其重要的,这是因为加工食物可能仍含有不活化细胞的dna。潜在地,区分活的和死的分枝杆菌属物种的能力在使用血液样品的临床诊断中也是很重要的,因为巨噬细胞内的死细胞也将被检测到,即使动物或人类正在从感染恢复。
16.许多主要引起疾病的分枝杆菌属物种,如鸟分枝杆菌类结核亚种(map)、结核分枝杆菌和牛分枝杆菌是缓慢生长的,且因此难以培养。培养这些物种所花费的时长使得难以使用培养作为感染的诊断测试。
17.近年来,对于基于噬菌体的方法作为培养的潜在替代方案以用于快速检测和计数活map的关注增加。用于检测map的基于噬菌体的测定首次由stanley等人(2007)报告,他们证实,用于检测痰中结核分枝杆菌的fastplaquetb噬菌体扩增测定(那时可从biotec laboratories,ipswich,uk商购)可改用作检测牛奶中的活map。foddai等人(2009)随后优化fastplaquetb测定条件以确保精确定量奶中存在的活map数量。引入的主要变化是在噬菌体感染之后更长的孵育时间(3.5h,而非1h),之后涂铺耻垢分枝杆菌(mycobacterium smegmatis)和熔融7h9琼脂,且在此孵育期内2h点处而非恰好在涂铺前的1h进行杀病毒剂
(硫酸亚铁铵,fas)处理。随后证实优化的噬菌体测定作为在热处理期间监测奶中map的失活动力学的工具的能力(foddai等人2010a)。之后,相同研究人员将优化的噬菌体扩增测定与肽介导的磁性分离(pms)组合,其采用最初由stratmann等人(2002,2006)描述的涂布有两种生物素化肽amp3和amptd的myone甲苯磺酰基活化的戴诺珠粒(myone tosylactivated dynabeads)。优化pms-噬菌体测定以便最大化map检测的灵敏度(foddai等人2010b),且随后用于检测牛科动物奶和粪便中的活map(foddai等人2011)。pms在噬菌体扩增测定之前实现两个重要事情:(1)从存在的其它微生物选择性捕获分枝杆菌细胞;和(2)从复合奶样品基质中物理分离map细胞。这意指,d29噬菌体在样品中可更容易地遇到map细胞,这是因为很大程度上消除了奶组分。如果在pms之后将珠粒再悬浮于较小体积(0.1ml而非1ml)培养液中,那么奶样品中的map细胞也有可能浓缩10倍。
18.在贝尔法斯特女王大学(queen’s university belfast;qub),多年来,我们一直使用主要在奶样品制备方面具有一些修改的pms-噬菌体测定(foddai和grant 2015),主要以测试奶(foddai和grant 2017,o’brien等人2018)和小牛代奶(grant等人2017)中的活map。我们的研究已不断地显示,pms-噬菌体测定是一种用于检测活map的极其灵敏的测试和一种map培养的有前景的快速替代方案;其花费较长时间来返回结果,但仍被视为用于证实兽医学样品中活map存在的黄金标准方法。在我们的手中,pms-噬菌体测定一直表现良好,因为我们已精通其应用且辨识在测定内需要正确地执行以避免假阳性或假阴性结果的关键步骤。然而,当其它实验室中的研究人员尝试采用优化的噬菌体测定或pms-噬菌体测定时,技术转移一般不是一个平滑过程(例如butot等人2019),且需要从qub研究人员进行大量的培训和故障排除。我们前段时间已确认(foddai和grant 2017),pms-噬菌体测定具有复杂的多步骤方案,其自身并不适合高通量测试奶样品。pms-噬菌体测定方案存在几个必须小心进行的关键部分,否则由于非失活种子噬菌体(作为低效杀病毒剂处理的结果)或在涂铺于琼脂中之前释放后代噬菌体(由于不遵守规定的孵育时间),而可能产生假阳性空斑。假阴性结果也可能出现,因为空斑pcr未确认最大10个所收获空斑内map dna的存在(与所存在的空斑数量无关)。
19.如果用于活map的基于噬菌体的测定将具有任何用于jd诊断的未来应用,那么例如将需要简单许多的、用户友好的测试方案。此迫切需要促使我们开发一种用于活map的新型的基于噬菌体的一日测试。
20.本发明提供一种检测活分枝杆菌属物种的特异性且灵敏的方法,且确切地说,一种可以
‘
单管’型式进行的方法,其具有自动化以允许快速且经济的测试大量样品的潜能。将特别有利的是,提供一种可区分已感染和疫苗接种个体的测试。
21.根据本发明的第一方面,提供一种用于检测样品中的所需分枝杆菌属物种的方法,所述方法包含以下步骤:
22.a)将分枝杆菌噬菌体偶联的顺磁粒子与所述样品在适合于准许所述分枝杆菌噬菌体与所述样品中存在的任何分枝杆菌噬菌体灵敏的分枝杆菌属物种结合的条件下混合,以形成反应混合物;
23.b)向所述样品施加磁场以收集和分离具有结合的所需分枝杆菌属物种的分枝杆菌属噬菌体偶联是顺磁粒子;
24.c)在准许所述分枝杆菌属噬菌体在活分枝杆菌属物种细胞内复制且裂解所述活
分枝杆菌属物种细胞的条件下,孵育所述具有结合的分枝杆菌属物种的所分离顺磁粒子的悬浮液;
25.d)从孵育的悬浮液回收裂解的分枝杆菌属物种的核苷酸,任选地dna;和
26.e)分析从裂解的分枝杆菌属物种释放的核苷酸,任选地dna,以鉴定所需分枝杆菌属物种中存在的标志核苷酸序列。
27.本发明的第一方面的方法以不同方式采用分枝杆菌噬菌体偶联的顺磁粒子,如d29分枝杆菌噬菌体。将分枝杆菌噬菌体与顺磁珠偶联以准许物理捕获分枝杆菌噬菌体灵敏的分枝杆菌物种(下文map细胞作为一实例),且随后在map特异性qpcr之前,map细胞自然裂解,而非map细胞内的噬菌体扩增和空斑测定终点。本研究的目标是:(1)将d29噬菌体成功地涂布到顺磁珠上且使用这些噬菌体涂布的珠粒用于从奶中噬菌体磁性分离(phms)map细胞;(2)确定用于收获从通过d29噬菌体作用裂解的活map细胞释放的dna的最佳方案;和(3)将phms和dna收获步骤与定量is900 pcr(qpcr)组合以产生一种针对奶中的活map的快速、灵敏且特异性的phms-qpcr测定。从一开始,我们就知道快速测试的存在,其是一种可从pbd biotech limited(thurston,uk)商购的、基于英国诺丁汉大学(university of nottingham,uk)的drs cath rees和ben swift开发的技术(swift等人2019)的基于噬菌体的快速测试。我们在本文中描述的phms-qpcr测试可类似于快速测试表现,但其具有不同的做法。
28.任选地,在步骤c)之前,洗涤所收集的具有结合的分枝杆菌属物种的顺磁粒子(第一体积),以去除不是具有结合的所需分枝杆菌属物种的顺磁粒子的残余样品,且再悬浮于较小(或第二)体积中。举例来说,第一体积与第二体积的比率可为10到30:1,任选地,约20:1(所有均为v/v)。
29.任选地,进行步骤c)孵育到细胞裂解终点。
30.任选地,在步骤c)中,将所分离的具有结合的分枝杆菌属物种的顺磁粒子的悬浮液在37℃下孵育1到5小时,任选地约4小时,以允许分枝杆菌噬菌体在活分枝杆菌属物种细胞内复制和裂解所述活分枝杆菌属物种细胞。
31.任选地,步骤e)包含基于探针的qpcr。
32.任选地,在步骤c)之后,使孵育的悬浮液经受热激条件。这类热激条件可包括在40到70℃范围内的温度持续至少15秒到1分钟的时间段;任选地约55℃持续约1分钟,以确保从因为内部分枝杆菌噬菌体的作用而裂解或减弱的细胞最大释放分枝杆菌属物种dna。
33.任选地,分枝杆菌噬菌体选自barnyard分枝杆菌噬菌体、black raspberry分枝杆菌噬菌体、bxz2分枝杆菌噬菌体、che8分枝杆菌噬菌体、l5分枝杆菌噬菌体、omega分枝杆菌噬菌体、pbi1分枝杆菌噬菌体、pg2分枝杆菌噬菌体、rosebush分枝杆菌噬菌体、sb1分枝杆菌噬菌体、cooper分枝杆菌噬菌体、wildcat分枝杆菌噬菌体、tm4分枝杆菌噬菌体和d29分枝杆菌噬菌体;任选地d29分枝杆菌噬菌体。
34.任选地,分枝杆菌属物种是鸟分枝杆菌类结核亚种,且所述分枝杆菌噬菌体选自bxz2分枝杆菌噬菌体、l5分枝杆菌噬菌体、pbi1分枝杆菌噬菌体和d29分枝杆菌噬菌体;任选地d29分枝杆菌噬菌体。
35.任选地,顺磁粒子的直径在0.25到1.5μm范围内;任选地约1μm。进一步任选地,顺
磁粒子选自myone 1μm甲苯磺酰基活化的戴诺珠粒、bcmag 1μm甲苯磺酰基活化的珠粒和羧基-阿德姆珠粒(carboxyl-adembeads)(300nm);任选地bcmag 1μm甲苯磺酰基活化的珠粒。
36.任选地,将约5到25个,进一步任选地约10个分枝杆菌噬菌体与每一个顺磁粒子偶联。
37.任选地,当样品是奶时,约2.5
×
107个d29噬菌体涂布的珠粒存在于步骤a)反应混合物中。
38.任选地,分枝杆菌属物种是鸟分枝杆菌类结核亚种;进一步任选地用于检测和监测如牛和绵羊的反刍动物中的约氏病。
39.任选地,所述方法用于检测和监测人类中的map感染或存在。举例来说,map感染或存在可能与克罗恩氏病相关。
40.任选地,分枝杆菌属物种是牛分枝杆菌;进一步任选地用于检测和监测如牛的反刍动物中的牛结核。
41.任选地,分枝杆菌属物种是结核分枝杆菌;进一步任选地用于检测和监测人类中的结核。
42.可选择所使用的分枝杆菌噬菌体,因为其特异性感染待检测所需分枝杆菌属物种。替代地,可选择所使用的分枝杆菌噬菌体,因为其是宽泛宿主范围噬菌体且感染一系列分枝杆菌属物种,包括所需分枝杆菌属物种。
43.分枝杆菌噬菌体仅能够裂解活细胞(也被称为复制感受态细胞)。样品中的活分枝杆菌属物种允许分枝杆菌噬菌体复制,这最终导致宿主细胞裂解。然而,无活性分枝杆菌属物种无法支持分枝杆菌噬菌体复制且不会被分枝杆菌噬菌体裂解。这允许所述方法区分含有活分枝杆菌属物种的样品和含有无活性分枝杆菌属物种的样品。
44.噬菌体在一系列包括ph和温度的严格条件下具有极强的抗性,且甚至可在存在核酸酶或蛋白水解酶的情况下使用而不会降解。此后,噬菌体测定的优点在于其能够快速检测活分枝杆菌细胞。噬菌体具有与靶标细菌结合的极强且特异性的能力。噬菌体磁性分离技术(本发明的)是使用涂布有适当分枝杆菌噬菌体以捕获分枝杆菌细胞的磁珠。
45.使用噬菌体磁性分离代替免疫磁性分离的主要优点依赖于使用噬菌体用于生物识别。与抗体产生相比,噬菌体是无动物的、通过细菌感染经济有效地产生,仅花费数小时。使其适用作生物识别元件的另一特征是其突出的稳定性。
46.在d)步骤,从反应混合物去除未裂解的分枝杆菌属物种细胞。可通过任何合适方法,从反应混合物去除未裂解的分枝杆菌属物种。可通过离心、过滤或通过如旋转柱的屏障方法,从反应混合物去除未裂解的分枝杆菌属物种。举例来说,将孵育的悬浮液离心以从上清相回收裂解的分枝杆菌属物种的核苷酸,任选地dna。
47.样品可以是疑似含有分枝杆菌属物种的任何样品。举例来说,样品可以是奶或粪便、血液或组织样品、或食物或动物饲料样品。样品可以通过将疑似含有分枝杆菌的样品混合或分散于缓冲溶液中来制成。
48.所需分枝杆菌属物种细胞可以是属于分枝杆菌属属的任何物种,例如鸟分枝杆菌类结核亚种(map)、结核分枝杆菌、牛分枝杆菌、麻风分枝杆菌、鸟分枝杆菌。分枝杆菌属物种细胞可以属于所关注的任何分枝杆菌属物种。所需分枝杆菌属物种细胞可以是鸟分枝杆菌类结核亚种;任选地是来自k10或b4菌株。
49.分枝杆菌噬菌体可以是能够感染和裂解所需分枝杆菌属物种的任何裂解性分枝杆菌噬菌体。分枝杆菌噬菌体可以对所需分枝杆菌属物种具有特异性。分枝杆菌噬菌体可以是能够感染和裂解所需分枝杆菌属物种的任何宽宿主范围的分枝杆菌噬菌体。举例来说,分枝杆菌噬菌体可以是d29或tm4分枝杆菌噬菌体。替代地,分枝杆菌噬菌体是bxz2或l5。
50.d29和tm4分枝杆菌噬菌体具有宽宿主范围(参见rybniker等人,journal of medical microbiology(2006),55,37-42的表2,以引用的方式并入本文中)。
51.分枝杆菌噬菌体仅裂解活的所需分枝杆菌属物种。分枝杆菌噬菌体可能不裂解死或无活性分枝杆菌属物种。
52.可以通过任何合适的技术来测定来自裂解的分枝杆菌属物种的核苷酸,任选地dna,以鉴定所需分枝杆菌属物种细胞中存在的标志序列。可以分析反应混合物,以鉴定来自一种或超过一种不同所需分枝杆菌属物种,例如来自一种或两种不同所需分枝杆菌属物种,或三种、四种、五种、六种、七种、八种、九种、十种、十一种或十二种或更多种不同所需分枝杆菌属物种的标志序列。可以通过使用引物的pcr测定核苷酸,任选地dna,所述引物特异性地与所需分枝杆菌属物种细胞或所需分枝杆菌属物种中的每一个中存在的标志核苷酸序列退火,允许扩增。
53.可以通过使用引物的pcr分析核苷酸,任选地dna,所述引物特异性地与所需分枝杆菌属物种细胞或分枝杆菌属物种中的每一个或所需类型中存在的标志核苷酸,任选地dna序列退火。为了增加特定性,对于每一种待检测的分枝杆菌属物种,可以考虑超过一个、超过两个、超过三个、超过四个、超过五个、超过六个、超过七个或超过八个标志序列。
54.标志dna序列可选自插入元件is900、鸟分枝杆菌类结核亚种(map)的独特基因序列f57(参见下表)或靶标251(map2765c)。
55.合适的正向和反向引物包括is900qf和is900qr,探针是is900qp。
56.applied biosystems taqman tamra探针是使用taqman化学物质的用于实时pcr应用的双重标记探针。taqman tamra探针包含5’荧光报告染料(fam、vic或tet)和3’荧光猝灭剂(tamra,一种可与至多三种染料复用的荧光染料)。
57.替代地,applied biosystems taqman mgb(小沟结合物)探针是使用taqman化学物质的用于实时pcr应用的双重标记探针。taqman mgb探针包含5'荧光报告染料和3'非荧光猝灭剂(nonfluorescent quencher;nfq)。nfq提供较低背景信号的优点,这产生较好的定量精确度。taqman mgb探针可与fam、vic、tet和ned报告染料一起使用。
58.taqman系统在每一个延伸循环期间使用荧光dna探针上的taq dna聚合酶的5核酸酶活性来检测pcr产物。taqman探针在5端用荧光报告染料标记且在3端用荧光猝灭染料标记。当探针完好时,猝灭染料降低报告染料的发射强度。如果存在所需序列,那么探针与靶标退火,且在引物延伸进行时通过taq dna聚合酶的5核酸酶活性裂解。在探针的裂解将报告染料与猝灭染料分离时,报告染料荧光作为循环数的函数而增加。阈值循环(c
t
)定义为报告荧光通过高于基线的固定阈值时的循环数。所需dna的初始浓度越大,越早观测到荧光显著增加。使用以已知拷贝数的所需dna序列产生的标准曲线,可确定未知样品中的所需dna的起始量。定量pcr相对于常规终点pcr具有若干优点:qpcr通过包括内部杂交探针增加特异性,通过包括ung(dutp n-糖基化酶)和消除pcr后加工降低交叉污染,确定样品中的所
需序列的起始浓度,且对pcr抑制剂不太灵敏。
59.其它替代的合适正向和反向引物包括f57qf和f57qr,探针是f57qp。
60.适合扩增鸟分枝杆菌类结核亚种的多拷贝元件is900和单拷贝元件f57的pcr引物和探针序列包括:
[0061][0062]
fam荧光报告染料6-羧基荧光素;
[0063]
tamra猝灭染料n
′
,n
′
,n
′
,n
′‑
四甲基-6-羧基罗丹明。
[0064]
其它适合用于检测鸟分枝杆菌类结核亚种的引物和taqman探针包括:
[0065][0066]
[0067]
另外替代地,标志dna序列可以是用于鸟分枝杆菌类结核亚种(map)的插入元件is900和基因序列f57(换句话说使用is900和f57两者作为所需基因),以用于筛选和确认map dna的存在。此方法和试剂盒意图用于牛、绵羊和山羊,针对如粪便、器官、细菌菌落和培养液培养的样品类型。
[0068]
可使用sidoti等人引物(参见上表2)和taqman探针(参见上表2)来分析dna,如上文所陈述,其靶向鸟分枝杆菌类结核亚种(map)基因组的is900基因:这是设计用于活体外定量map基因组。试剂盒被设计成具有可能的最广的检测概况,同时仍对map基因组具有特异性。此试剂盒中的引物和探针序列与广泛范围的map序列具有100%同源性。f57序列是此菌株的良好表征标记,且引物和探针与当前ncbi数据库中的四个序列eu379657.1、x70277.1、ae016958.1、eu092638.1具有100%同源性。所提供的引物和探针混合物利用所谓的原则。在pcr扩增期间,正向和反向引物与map dna杂交。当使用applied biosystems taqman tamra探针时,相同反应混合物中包括荧光探针,探针是用5`-染料(fam)和3`-猝灭剂(tamra)标记的dna探针。在pcr扩增期间,探针裂解,且报告染料和猝灭剂分离。可在一系列实时pcr平台上检测到所得荧光增加。
[0069]
样品可以是血液、体液或组织样品。样品可以是血液、血清、痰、奶、唾液、尿液、粪便样品。样品可以是来自畜群保障程序中使用的公牛的精液样品。样品可以是用于人类或动物食用的产品的样品。举例来说,样品可以是奶、乳酪或含有原料乳的乳制品的样品。
[0070]
该方法可以在一个反应器中进行,所述一个反应器例如一个试管、一个微量离心管或多孔板的一个孔。该方法的所有步骤均可以在一个反应器中进行。有利的是,该方法可以在一个反应器中进行,因为其允许该方法作为高通量筛选方法进行。该方法可以是高通量筛选方法。如果需要测试大量样品,例如如果需要测试牛群的map,那么这是有利的。
[0071]
该方法的步骤a)到e)可以在24小时内进行。这是有利的,因为其可在24小时内或48小时内确定样品中是否存在活的或有活性的分枝杆菌属物种。优选地,结果可以在小于48小时、小于24小时、小于12小时、小于10小时、小于8小时、小于6小时或更短时间内获得。
[0072]
本发明的方法将能够区分已针对分枝杆菌属物种进行疫苗接种的动物或个体和已感染分枝杆菌属物种的个体。这允许对动物,例如人类和牛针对分枝杆菌属物种进行疫苗接种,且仍可进行测试以检测分枝杆菌感染。
[0073]
先前使用感染动物或个体产生的抗分枝杆菌抗体作为感染标记来检测分枝杆菌属物种的方法不能用于已进行疫苗接种的动物或个体,因为对于疫苗的免疫反应产生可以通过这些测试检测到的抗体。
[0074]
本发明的方法可以区分感染动物/个体和疫苗接种动物/个体,因为本发明方法检测活分枝杆菌属物种细胞。
[0075]
本发明的方法还允许在极早期感染时,和在任何临床症状可见之前,检测例如血液样品中的分枝杆菌属物种。该方法可以能够在活分枝杆菌以极低数量,例如小于10个细胞/毫升样品存在于样品中时,鉴定所述活分枝杆菌的存在。
[0076]
本发明的方法还可用于监测处理功效,且用于筛选细菌数量是否在给予处理减少。
[0077]
可以通过使用宽宿主范围的分枝杆菌噬菌体或通过使用两种或更多种特异性地感染两种或更多种不同所需分枝杆菌属物种的分枝杆菌噬菌体,同时鉴定样品中的两种或
更多种不同所需分枝杆菌属物种。可以通过能够鉴定特定核苷酸,任选地dna序列的任何方法,例如使用利用对每一个所需分枝杆菌属物种具有特异性的引物的pcr反应,鉴定来自两种或更多种不同分枝杆菌属物种的标志序列。这允许同时鉴定样品中的两种或更多种不同所需分枝杆菌属物种。
[0078]
在另一方面中,本发明提供特异性感染所需分枝杆菌属物种的分枝杆菌噬菌体在用于检测由所需分枝杆菌属物种进行的感染的方法中的用途,其中分枝杆菌噬菌体裂解所需分枝杆菌属物种,以释放分枝杆菌核苷酸,任选地dna;且通过pcr或能够鉴定特定核苷酸,任选地dna序列的其它方法鉴定标志分枝杆菌核苷酸,任选地dna序列。
[0079]
在再一方面中,本发明提供一种适合于进行本发明方法的试剂盒。试剂盒可包括对所需分枝杆菌具有特异性的噬菌体和其根据本发明方法使用的说明书。
[0080]
试剂盒可包括与所需分枝杆菌属物种特异性结合的分枝杆菌噬菌体偶联的顺磁粒子。
[0081]
试剂盒可以进一步包括允许所需分枝杆菌属物种中的标志核苷酸,任选地dna序列特异性扩增的寡核苷酸(或引物)和探针。
[0082]
现在接着是仅作为实例的参看附图的本发明的实施方式,其中:
[0083]
图1.相较于当前使用的生物素-amp3和生物素-amptd生物素标记肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒,使用羧基-阿德姆珠粒300nm(carboxyl-adembeads 300nm)、myone甲苯磺酰基活化的戴诺珠粒、涂布有d29噬菌体的1
×
和10
×
bcmag甲苯磺酰基活化的珠粒(bcmag tosylactivated beads),将map atcc 19698与制备于7h9培养液中的稀释液系列磁性分离。
[0084]
图2.相较于当前使用的生物素-amp3和生物素-amptd生物素标记肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒,使用myone甲苯磺酰基活化的戴诺珠粒、涂布有d29噬菌体的1
×
和10
×
bcmag 1μm甲苯磺酰基活化的珠粒,将map atcc 19698与制备于uht全乳中的稀释液系列磁性分离。
[0085]
图3形象地比较以下:使用肽涂布的顺磁珠来从奶中选择性捕获map细胞的磁性分离;噬菌体扩增测定,以得到在24h内活map数量的;和is900 pcr。
[0086]
图4形象地绘示基于map的d29噬菌体介导的磁性分离(噬菌体磁性分离)结合map特异性qpcr的检测,且其由三个部分构成:
[0087]
·
通过噬菌体涂布的磁珠捕获所需map细胞
[0088]
·
由于噬菌体裂解作用,dna从噬菌体感染的活map细胞释放
[0089]
·
通过qpcr检测所得map dna
[0090]
图5:
‘
ms前’为对照样品,将不同类型的涂布珠粒的捕获能力进行比较:结果明确指示,10pfu/珠粒的pfu/珠粒比率是最佳的,因为所有四个map细胞浓度仍可检测到,且pcr条带在所有四个浓度下具有类似强度,而在其它涂布比率下,越来越少的map细胞浓度测试呈pcr阳性。
[0091]
图6:使用通过is900 pcr评定的减少量的d29涂布的顺磁珠,从通过phms处理的已加标的(spiked)培养液悬浮液(10到104个细胞/毫升)捕获map细胞。结果是针对在99℃沸腾25min,从以下样品中提取的dna:(a)磁性分离前(ms前)和紧接在使用phms之后:(b)使用10mg bcmag
tm
甲苯磺酰基活化的珠粒制备的10μl已涂布珠粒(最终浓度是1.7
×
107个珠粒/
毫升测试样品);(c)使用10mg bcmag
tm
甲苯磺酰基活化的珠粒制备的5μl已涂布珠粒(最终浓度是8.5
×
106个珠粒/毫升测试样品);和(d)使用10mg bcmag
tm
甲苯磺酰基活化的珠粒制备的1μl已涂布珠粒(最终浓度是1.7
×
106个珠粒/毫升测试样品)。m:trackit 100bp dna梯形带(thermofisher scientific),-ve:阴性对照。a到d在图6中从左到右。
‘
ms前’是通过pcr直接测试的对照map细胞浓度,比较三个不同涂布珠粒浓度的捕获能力。结果指示,1.7
×
107个珠粒/毫升的珠粒浓度对于map捕获是最佳的,而较低珠粒浓度将错过较低map浓度,即将不具有足够的检测灵敏度。
[0092]
图7:比较通过利用is900 pcr评定的使用肽和噬菌体涂布的顺磁珠进行磁性分离从已加标的培养液悬浮液(10到104个细胞/毫升)的map细胞捕获。结果针对在99℃沸腾25min从以下样品提取的dna:(a)磁性分离前(ms前);(b)肽介导的ms(pmms)后,其包括共价涂布到两种生物素化的肽amp3和amptd的myone甲苯磺酰基活化的珠粒(life sciences)的50:50混合物;(c)用pbs-0.5%牛血清白蛋白阻断过夜的d29噬菌体涂布的bcmag甲苯磺酰基活化的珠粒;和(d)未阻断的d29噬菌体涂布的bcmag甲苯磺酰基活化的珠粒。m:trackit 100bp dna梯形带(thermofisher scientific),-ve:阴性对照。a和b在图7顶行从左到右;且c和d在其底行从左到右。图7显示,噬菌体涂布的bcmag甲苯磺酰基活化的珠粒不应用pbs-bsa阻断,因为未阻断的珠粒证实其map捕获能力优于阻断的噬菌体涂布珠粒以及阻断的肽涂布珠粒。
[0093]
图8:比较在通过is900 pcr评定ms之后,从以四个浓度(104、103、102和10map/ml)加标的uht奶样品对map细胞的回收。结果是针对在99℃沸腾25min,从以下样品提取的dna:ms前和紧接在pms(使用10μl肽涂布的myone甲苯磺酰基活化的戴诺珠粒)和phms(使用10、15和20μl(分别1.7
×
107、2.2
×
107和3.4
×
107个珠粒/毫升样品)的最优涂布的d29噬菌体涂布的bcmag甲苯磺酰基活化的珠粒)之后。m:trackit 100bp dna梯形带(thermofisher scientific),-ve:阴性对照。相较于肽介导的磁性分离,从加标有减少数量的map细胞的奶样品捕获不同体积(10、15和20μl)的d29-bcmag顺磁珠的能力。结果指示,15μl珠粒实现最大捕获能力和检测灵敏度。
[0094]
图9
‘
ms前’是初始接种物;“甲苯磺酰基-b-amp3+甲苯磺酰基-b-amptd”是pms(对照);“d29 bcmag”是本发明的新型d29-ms。噬菌体涂布的珠粒对map的捕获与肽涂布的珠粒一样好,或稍微更好,且实现10map/50ml(当样品是奶时)的检测灵敏度。
[0095]
图10以下的透射电子显微照片:(a)以
‘
尾朝外(tail out)’定向涂布有d29噬菌体的bcmag甲苯磺酰基活化的顺磁珠;(b)被噬菌体涂布的珠粒捕获的多个map细胞;和(c)与单一噬菌体涂布珠粒连接的单一map细胞。注意:tem样品制备程序已影响珠粒的完整性,因此其并不表现为均匀球体。电子显微图,其显示尾部朝外的成功与bcmag甲苯磺酰基活化的珠粒结合的d29(顶行);和被d29涂布珠粒捕获的map细胞(底行)。
[0096]
图11在phms应用于以104个细胞/毫升加标有活map细胞的培养液悬浮液之后,is900 pcr的结果。在phms之后,将所有样品在37℃下孵育增加的孵育时间,之后使其经受施加以下的is900pcr:(a)不加热(顶部凝胶,未加热样品)和(b)在55℃下预先加热1min(底部凝胶,加热样品)。m:trackit 100bp dna梯形带(thermofisher scientific),+ve:阳性map dna对照,-ve:仅有水的阴性对照。这些结果证实热激步骤关于较早释放最大dna的益处,且因此需要较短的孵育时间。
[0097]
图12在phms应用于以104个细胞/毫升加标有γ辐射(失活)的map的培养液悬浮液之后的is900 pcr的结果。在phms之后,将所有样品在37℃下孵育增加的孵育时间,之后使其经受施加以下的is900 pcr:(a)不加热(顶部凝胶,未加热样品);和(b)在55℃下预先加热1min(底部凝胶,加热样品)。m:trackit 100bp dna梯形带(thermofisher scientific),+ve:阳性map dna对照,-ve:仅有水的阴性对照。没有dna从已通过γ-辐射处理完全失活的map细胞释放出,与是否施加热激步骤无关,从而证实新型噬菌体磁性-pcr测试对于仅活map的特异性。
[0098]
图13通过is900 taqman qpcr检测的,在phms和在37℃下孵育样品1-4h(具有(实线)和不具有(虚线)在55℃下热处理1min)之后,以104个细胞/毫升加标有map(由虚线指示)的培养液悬浮液中活map的数量。结果是以单独实验测试的三个map菌株的平均log
10
map计数/ml
±
标准差。定量噬菌体磁性qpcr结果确定就随着时间推移从噬菌体裂解的map细胞释放的dna数量,以及热激步骤对于从由于噬菌体裂解性酶的作用而减弱的map细胞更早释放最大dna的益处而言,与图11中所见相同的趋势。
[0099]
图14通过phms-qpcr检测的,以四个水平(104、103、102和10个细胞/50ml)加标有三个实验室生长的map菌株的7h9培养液和uht奶样品中的map数量。在is900 taqman qpcr之前,样品通过phms进行处理,随后在37℃下孵育2h或4h,且在55℃下进行轻微热处理1min,之后qpcr。结果以表示三个单独实验测试的三个map菌株的平均活map计数
±
标准差。当应用于map加标的培养液或map加标的奶时,证实新型噬菌体磁性qpcr测定具有类似检测灵敏度。
[0100]
图15储存在4℃下、不同悬浮缓冲液或培养液中的d29噬菌体涂布的bcmag甲苯磺酰基活化的珠粒的保质期的比较。按每月计,使用不同储存的磁珠测试相同稀释系列的map细胞,持续至多六个月。7h9/oadc/2mm cacl2培养液维持d29噬菌体涂布的珠粒的检测能力长于其它缓冲液中的任一个。
[0101]
图16相较于市售techne
tm map qpcr试剂盒,在从50ml已加标的奶中噬菌体磁性分离map细胞之后施加的is900 taqman qpcr(sidoti等人引物和探针)的优良检测能力。
[0102]
图17通过空斑测定评定的d29噬菌体涂布的bcmag甲苯磺酰基活化的顺磁珠在冷冻储存在4℃下持续12个月期间的稳定性。储存于7h9-oadc-2mm cacl2中、4℃下的已涂布珠粒上的活性分枝杆菌噬菌体的数量保持恒定持续8个月,但随后到12个月下降两个log
10
周期;其可能会影响其用于噬菌体磁性-qpcr测定。
[0103]
图18.每50ml来自392个北爱尔兰奶牛场的散装罐奶(btm)活map负荷的分布,其由phms-qpcr测定结果指示。在26.5%的散装罐奶中检测到活map,其中map污染水平在1-8432map/50ml奶范围内,然而《2%的农场的其散装罐奶的map污染水平》100map/50ml。
[0104]
图19.散装罐奶测试结果的相关系数矩阵(热图)。phms-qpcr结果是
‘
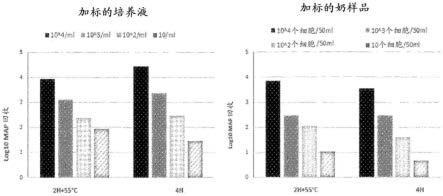
map数/50ml’,奶-elisa结果是奶-elisas/p比率。其它结果是奶记录参数。在散装罐奶的phms-qpcr结果与平行奶-elisa结果或实际上散装罐奶的任何其它奶记录测试结果之间不存在显著相关性(正或负)。
[0105]
图20.所追踪农场a-d的个别奶测试结果的相关系数矩阵(热图)。phms-qpcr结果是
‘
map数/50ml’,奶-elisa结果是奶-elisa s/p比率。其它结果是奶记录参数。在个别奶的phms-qpcr产生与平行奶-elisa结果或实际上来自农场a-d的奶的任何其它奶记录测试结
果之间不存在显著相关性(正或负)。
具体实施方式
[0106]
使用涂布有抗体或肽的珠粒,磁性分离(magnetic separation;ms)用于从奶中捕获病原性分枝杆菌属物种。活分枝杆菌细胞随后被涂布有分枝杆菌噬菌体的珠粒捕获。噬菌体测定的优点在于其能够快速检测活分枝杆菌细胞,不同于pcr,其检测所有所需细胞的dna,无论是活的还是死的。
[0107]
免疫磁性分离(immunomagnetic separation;ims)技术是一种通过使用修饰的磁性微球作为抗体的载体来捕获和富集所需细菌的技术。近来年,所述技术已广泛用于分离和纯化生物化学产物、细胞分离和纯化以及微生物检测领域。尤其在检测病原性微生物方面,ims已越来越广泛使用,所述技术已逐渐应用于相关实验室的日常测试工作。
[0108]
近年来,基于磁性微球的ims已广泛用于分离食源性病原体和更换或缩短预富集培养。然而,所述方法的分离效率受到磁性微珠的捕获效率和扩散速率限制。使用噬菌体磁性ms代替ims的主要优点依赖于使用噬菌体进行生物识别。与抗体产生相反,噬菌体是无动物的、通过细菌感染经济有效地产生,仅花费数小时。
[0109]
分枝杆菌噬菌体是一种能够特异性地感染分枝杆菌的dna病毒,其在自然界中已发现超过250个物种。噬菌体具有严格的宿主特异性,且仅可感染活细菌细胞且在其内复制。通过吸收、渗透和其它方法将噬菌体dna插入宿主细胞中,随后依赖于宿主细胞代谢酶进行后代增殖,最终由于噬菌体酶的作用而裂解细胞,释放子代。这是噬菌体生物扩增的理论基础。
[0110]
本发明方法使用涂布有噬菌体的珠粒来磁性分离,在本文中被称作噬菌体磁性ms。
[0111]
然而,初始噬菌体扩增测定(pms-噬菌体测定)是一种自身不太适合测试大量奶样品的多步骤、相当费力的测定。需要进行精简以提供其未来用于奶测试的任何可能性。使用涂布有适当分枝杆菌噬菌体的磁珠来捕获分枝杆菌细胞的噬菌体磁性分离提供解决方案。理论上,优点将在于,一旦被裂解性噬菌体捕获和感染,那么分枝杆菌细胞将从内部裂解且在几个小时之后释放其dna,所述dna随后可通过实时pcr定量。
[0112]
比较实施例1
[0113]
pms-噬菌体测定(参见图3):
[0114]
使用肽涂布的顺磁珠进行磁性分离以从奶中选择性捕获map细胞
[0115]
噬菌体扩增测定,以给出24h内活map数的指示
[0116]
is900 pcr应用于从空斑提取的dna,以确认map dna存在。
[0117]
此方法花费48-72小时。这对于商业使用来说太缓慢。
[0118]
实施例1
[0119]
材料和方法
[0120]
1.1.细菌菌株的培养。在本研究中使用十二个map菌株和九个其它分枝杆菌属某些种,如表1中详述。使map菌株在middlebrook 7h9培养液中在37℃下生长4到6周到稳定期,所述培养液含有10%(v/v)油酸-白蛋白-右旋糖-过氧化氢酶(oadc)补充物(培养液来自difco)和2μg/ml分枝杆菌素j(synbiotics europe sas,lyon,france)。将九个非靶标
(非所需)分枝杆菌某些种在37℃下在未添加分枝杆菌素j的相同7h9培养基中培养到稳定期。
[0121]
表1.使用d29分枝杆菌噬菌体进行测试以确认本发明的新型噬菌体测定对于map的特异性的鸟分枝杆菌类结核亚种(map)菌株和非靶标(或非所需)分枝杆菌属某些种的细节。
[0122][0123][0124]
2.2.在涂布在珠粒上前后滴定d29噬菌体。通过添加10μl的d29储备液到90μl培养液中,充分涡旋,将10倍稀释系列的d29分枝杆菌噬菌体储备液(含有大致10910
10
cfu/ml)制备于middlebrook 7h9/10%oadc培养液中。
[0125]
对于滴定d29储备液,稀释耻垢分枝杆菌mc
2 155,以提供具有1.0od
600
的感觉细胞(sensor cells)的悬浮液。将10μl的10-6
、10-7
、10-8
和10-9
d29噬菌体稀释液转移到四个空的9cm皮氏培养皿(petri dishes)中。向每一个皮氏培养皿中添加1ml耻垢分枝杆菌mc
2 155培养物、5ml middlebrook 7h9/10%oadc/1mm cacl2培养液(在37℃℃下预温热),且最后添加5ml熔融的middlebrook 7h9(1.5%)琼脂/10%oadc。一旦添加7h9琼脂,那么即时平缓地在每一方向上涡旋皮氏培养皿五次以混合内容物,随后使琼脂固化10min,之后在37℃下孵育板过夜。
[0126]
随后检查板的空斑迹象(清除区带)。对含有至多300个空斑的稀释液的空斑进行计数,且随后如下计算初始d29储备液悬浮液的pfu/ml:
[0127]
在可计数的稀释下的空斑数
×
稀释因子
×
接种因子
[0128]
对于滴定d29噬菌体,在涂布在四种类型的珠粒上之后,使用与在涂布在珠粒上前滴定d29分枝杆菌噬菌体相同的方法,如先前所描述。
[0129]
2.3.将d29分枝杆菌噬菌体共价偶联到四种类型的甲苯磺酰基活化的磁珠和羧基磁珠。本研究中使用两种类型的甲苯磺酰基活化的磁珠和羧化磁珠,如表3a中详述。d29分枝杆菌噬菌体通过其衣壳蛋白的胺部分与1μm myone甲苯磺酰基活化的戴诺珠粒、300nm羧基-阿德姆珠粒和1μm bcmag甲苯磺酰基活化的磁珠共价偶联。bcmag甲苯磺酰基活化的珠粒如供应商所建议使用(1
×
)和以10倍浓缩(10
×
)悬浮液形式使用,以增加用于ms的10μl等分试样中的珠粒数量。
[0130]
表3a.ademtech羧化的、myone甲苯磺酰基活化的和bcmag甲苯磺酰基活化的磁珠的直径、初始珠粒浓度和工作珠粒浓度的比较。
[0131][0132]
用于固定在myone珠粒上的溶液的组成是:0.1mol/l硼酸钠,ph 8.5用于涂布缓冲液;硫酸铵(3mol/l制备于涂布缓冲液中);0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2用于洗涤和储存缓冲液。
[0133]
对于将噬菌体固定在羧基-ademtech 300nm珠粒上,使用以下溶液:1
×
ademtech活化缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2用于洗涤和储存缓冲液。
[0134]
对于将噬菌体固定在1
×
和10
×
1μm bcmag甲苯磺酰基活化的珠粒上,使用以下溶液:0.1m碳酸钠缓冲液,ph 9.5用于偶联缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2用于洗涤和储存缓冲液。
[0135]
将分枝杆菌噬菌体涂布到myone甲苯磺酰基活化的戴诺珠粒上用1ml硼酸钠缓冲液洗涤35μl的myone甲苯磺酰基活化的戴诺珠粒(100mg/ml,1
×
10
12
个磁性粒子/毫升)两次。将150μl纯化的d29分枝杆菌噬菌体溶液(10
11
pfu/ml)添加到100μl(nh4)so4中,且适当混合。在混合下,在37℃下孵育磁性粒子17h。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。将噬菌体修饰的磁性粒子添加到1ml pbs阻断缓冲液中,以在搅动情况下在37℃℃下孵育2h。随后,使噬菌体修饰的甲苯磺酰基活化的珠粒在室温下在1ml洗涤缓冲液中进行五个洗涤步骤持续5min。对于磁性分离,每1ml测试样品使用10μl噬菌体涂布的myone甲苯磺酰基活化的戴诺珠粒。
[0136]
将分枝杆菌噬菌体涂布到羧基-阿德姆珠粒上首先,在ademtech活化缓冲液中洗
涤35μl的羧基-阿德姆珠粒300nm(30mg/ml,1.1
×
10
12
个珠粒/毫升)两次。将洗涤的珠粒添加到80μl edc(4mg/ml)和80μl磺基-nhs(9mg/ml)中,以在振荡下在室温下孵育5h,以活化纳米粒子上的羧酸基团。随后,用活化缓冲液洗涤珠粒两次,之后添加150μl d29噬菌体溶液和100μl的活化缓冲液。在混合(20rpm)下,在37℃下孵育混合物17h。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。将噬菌体修饰的磁性粒子添加到1ml pbs阻断缓冲液中,以在搅动情况下在37℃下孵育2h。随后,使噬菌体涂布的珠粒在pbs洗涤缓冲液中在室温下进行五个洗涤步骤持续5min,之后最终再悬浮在1ml中以供使用。
[0137]
将分枝杆菌噬菌体涂布到1
×
和10
×
bcmag 1μm甲苯磺酰基活化的磁珠上当准备好涂布珠粒时,将35μl再悬浮的珠粒(浓度为30mg/ml于100%异丙醇中)转移到微量离心管中,且放到磁力架上5min。丢弃异丙醇,且用1ml偶联缓冲液(0.1m碳酸钠缓冲液,ph 9.5)置换,之后剧烈涡旋珠粒1-2min。随后,将管放在磁力架上,且用偶联缓冲液洗涤5次。当准备好将噬菌体涂布到珠粒上时,通过将管放在磁力架上从洗涤的磁珠去除偶联缓冲液,且用150μl d29分枝杆菌噬菌体溶液加850μl偶联缓冲液置换。再悬浮磁珠,且通过涡旋极其充分地混合,之后将管放置在stuart旋转混合器(10-20rpm)上。在持续混合下,在37℃下孵育偶联反应物过夜。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。将1ml阻断缓冲液(具有0.5%(w/v)bsa的pbs ph 7.4)添加到噬菌体涂布的珠粒中,且在持续混合下在室温(21℃)下孵育2h。随后,用1ml洗涤缓冲液洗涤珠粒五次持续5min,其中在洗涤之间进行涡旋和磁性分离。最后,将噬菌体涂布的bcmag珠粒再悬浮在1ml储存缓冲液中以达到1mg珠粒/ml储备液稀释液。对于磁性分离,每1ml测试样品使用10μl噬菌体涂布的bcmag珠粒。
[0138]
2.4.与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从培养液对map捕获。
[0139]
此实验的程序是:将使用涂布有d29噬菌体的ademtech 300nm羧化珠粒、myone甲苯磺酰基活化的戴诺珠粒、1
×
bcmag甲苯磺酰基活化的珠粒和10
×
bcmag甲苯磺酰基活化的珠粒,从制备于7h9培养液中的稀释系列对map atcc 19698的磁性分离,与当前使用的生物素-amp3和生物素-amptd肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒进行比较。使用dynal beadretriever(life technologies)进行磁性分离。在持续混合下在室温下进行磁性捕获30min,随后在1ml含有0.05%(v/v)tween 20的磷酸盐缓冲盐水(pbs)(pbs-t20,sigma)中洗涤两次,且最终将珠粒再悬浮在1ml储存缓冲液中。
[0140]
2.5.与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从奶样品对map捕获。
[0141]
在此实验中,将使用涂布有d29噬菌体的myone甲苯磺酰基活化的戴诺珠粒、1
×
和10
×
bcmag 1μm甲苯磺酰基活化的珠粒从制备于uht全乳中的稀释系列对map atcc 19698的磁性分离,与当前使用的生物素-amp3和生物素-amptd生物素化肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒进行比较。如之前关于从培养液捕获描述程序。
[0142]
结果
[0143]
3.1.将d29分枝杆菌噬菌体共价偶联在磁珠上和偶联效率研究。
[0144]
通过主要衣壳纳米蛋白的胺化氨基酸性部分的反应,将d29噬菌体与三种类型的甲苯磺酰基活化的磁珠和羧基磁珠共价偶联。
[0145]
通过在涂布在四种不同磁珠上的前后滴定d29噬菌体,获得偶联效率的测定值,如
表3b中详述。对于噬菌体d29,myone甲苯磺酰基活化的戴诺珠粒、1
×
和10
×
bcmag 1μm甲苯磺酰基活化的磁珠全部均显示99.9%的几乎完美的偶联效率。
[0146]
表3b.涂布到ademtech羧化的、myone甲苯磺酰基活化的和bcmag甲苯磺酰基活化的磁珠上的活性d29噬菌体的数量。
[0147][0148]
3.2.与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从培养液对map捕获。
[0149]
使用pcr技术来扩增所需dna以用于最终基因感测检测。根据图1中显示的琼脂糖凝胶电泳,所选择的引物集排他性地扩增is900插入序列。如图1中所示,10
×
bcmag珠粒在d29上显示最强的组合效率。对于分枝杆菌噬菌体d29,bcmag珠粒的偶联效率比myone甲苯磺酰基活化的珠粒和羧基珠粒更好,如通过pcr产物条带的亮度所证明。
[0150]
3.3.与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从奶样品对map捕获。
[0151]
在此实验中,使用myone甲苯磺酰基活化的珠粒和两种不同浓度的bcmag珠粒来从奶中捕获map。在无预先ims的情况下,应用于已加标的奶的is900pcr的结果显示,由于通过奶组分进行的pcr抑制,没有靶标(或所需)dna是可检测的(图2)。d29涂布的10
×
bcmag珠粒显示在ms之后最佳map回收;类似于从培养液捕获map的结果。map被噬菌体涂布的myone甲苯磺酰基活化的珠粒和1
×
bcmag珠粒捕获的趋势也与使用这些类型的珠粒从培养液捕获map的结果一致。
[0152]
实施例2和3:优化的方法:
[0153]
在涂布在珠粒上的前后滴定d29噬菌体。
[0154]
d29分枝杆菌噬菌体储备液(含有大致10
9 10
10
cfu/ml)的10倍稀释系列,通过添加10μl d29储备液到90μl培养液中,充分涡旋,而于middlebrook 7h9/10%oadc培养液中制备。
[0155]
对于滴定d29储备液,稀释耻垢分枝杆菌mc
2 155,以提供具有1.0od
600
的感觉细胞的悬浮液。将10μl的10-6
、10-7
、10-8
和10-9
d29噬菌体稀释液转移到四个空的9cm皮氏培养皿中。向每一个皮氏培养皿中添加1ml耻垢分枝杆菌mc2155培养物、5ml middlebrook 7h9/10%oadc/1mm cacl2培养液(在37℃℃下预温热),且最后添加5ml熔融的middlebrook 7h9(1.5%)琼脂/10%oadc。一旦添加7h9琼脂,在每一方向上即时平缓地涡旋皮氏培养皿五次以混合内容物,随后使琼脂固化10min,之后在37℃下孵育板过夜。
[0156]
随后检查板的空斑迹象(清除区带)。对含有至多300个空斑的稀释液的空斑进行计数,且随后如下计算初始d29储备液悬浮液的pfu/ml:
[0157]
在可计数的稀释下的空斑数
×
稀释因子
×
接种因子
[0158]
对于在涂布在四种类型的珠粒上之后滴定d29噬菌体,使用与在涂布在珠粒上之前滴定d29分枝杆菌噬菌体的相同方法,如先前所描述。
[0159]
将d29分枝杆菌噬菌体与四种类型的甲苯磺酰基活化的磁珠和羧基磁珠共价偶联。
[0160]
本研究中使用两种类型的甲苯磺酰基活化的磁珠和羧化磁珠,如表3a中详述。将d29分枝杆菌噬菌体通过其衣壳蛋白的胺部分,与1μm myone甲苯磺酰基活化的戴诺珠粒、300nm羧基-阿德姆珠粒和1μm bcmag甲苯磺酰基活化的磁珠共价偶联。bcmag甲苯磺酰基活化的珠粒如供应商所建议使用(1
×
)和以10倍浓缩(10
×
)悬浮液形式使用,以增加用于ms的10μl等分试样中的珠粒数量。
[0161]
用于固定在myone珠粒上的溶液的组成是:0.1mol/l硼酸钠,ph 8.5用于涂布缓冲液;硫酸铵(3mol/l制备于涂布缓冲液中);0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2用于洗涤和储存缓冲液。
[0162]
对于将噬菌体固定在羧基-ademtech 300nm珠粒上,使用以下溶液:1
×
ademtech活化缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2用于洗涤和储存缓冲液。
[0163]
对于将噬菌体固定在1
×
和10
×
bcmag 1μm甲苯磺酰基活化的珠粒上,使用以下溶液:0.1m碳酸钠缓冲液,ph 9.5,用于偶联缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.5%w/v bsa,ph 7.4用于阻断缓冲液;0.01mol/l磷酸钠、0.15mol/l nacl、0.1%w/v bsa,ph 7.2,用于洗涤和储存缓冲液。
[0164]
将分枝杆菌噬菌体涂布到myone甲苯磺酰基活化的戴诺珠粒上用1ml硼酸钠缓冲液洗涤35μl myone甲苯磺酰基活化的戴诺珠粒(100mg/ml,1
×
10
12
个磁性粒子/毫升)两次。将150μl纯化的d29分枝杆菌噬菌体溶液添加到100μl(nh4)so4中且适当混合。在37℃℃下在振荡下孵育磁性粒子17h。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。随后,使噬菌体修饰的甲苯磺酰基活化的珠粒在室温下在1ml洗涤缓冲液中进行五个洗涤步骤持续5min。对于磁性分离,每1ml测试样品使用10μl噬菌体涂布的myone甲苯磺酰基活化的戴诺珠粒。
[0165]
将分枝杆菌噬菌体涂布到羧基-阿德姆珠粒上首先,在ademtech活化缓冲液中洗涤35μl羧基-阿德姆珠粒300nm(30mg/ml,1.1
×
10
12
个珠粒)两次。将洗涤的珠粒添加到80μl edc(4mg/ml)和80μl磺基-nhs(9mg/ml)中,以在室温下在振荡下孵育5h,以活化纳米粒子上的羧酸基团。随后,用活化缓冲液洗涤珠粒两次,之后添加150μl d29噬菌体溶液和100μl活化缓冲液。在混合(20rpm)下,在37℃下孵育混合物17h。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。随后,使噬菌体涂布的珠粒在pbs洗涤缓冲液中在室温下进行五个洗涤步骤持续5min,之后最终再悬浮在1ml中以供使用。
[0166]
将分枝杆菌噬菌体涂布到1
×
和10
×
bcmag 1μm甲苯磺酰基活化的磁珠上当准备好涂布珠粒时,将35μl再悬浮的珠粒(浓度为30mg/ml于100%异丙醇中)转移到微量离心管中,且放到磁力架上5min。丢弃异丙醇,且用1ml偶联缓冲液(0.1m碳酸钠缓冲液,ph 9.5)置
换,之后剧烈涡旋珠粒1-2min。随后,将管放在磁力架上,且用偶联缓冲液洗涤5次。当准备好将噬菌体涂布到珠粒上时,通过将管放在磁力架上从洗涤的磁珠去除偶联缓冲液,且用150μl d29分枝杆菌噬菌体溶液加850μl偶联缓冲液置换。再悬浮磁珠,且通过涡旋极其充分地混合,之后将管放置在stuart旋转混合器(10-20rpm)上。在持续混合下,在37℃下孵育偶联反应物过夜。在孵育之后,去除上清液且放置于另一管中以通过双琼脂分层常规方法对活性噬菌体进行计数。将1ml阻断缓冲液(具有0.5%(w/v)bsa的pbs ph 7.4)添加到噬菌体涂布的珠粒中,且在持续混合下在室温(21℃)下孵育2h。稍后省去阻断,因为其降低d29涂布的bcmag珠粒的捕获能力。随后,用1ml洗涤缓冲液洗涤珠粒五次持续5min,其中在洗涤之间进行涡旋和磁性分离。最后,将噬菌体涂布的bcmag珠粒再悬浮在1ml储存缓冲液中以达到1mg珠粒/ml储备液稀释液。对于磁性分离,每1ml测试样品使用10μl噬菌体涂布的bcmag珠粒。
[0167]
与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从培养液对map捕获。此实验的程序是:将使用涂布有d29噬菌体的ademtech 300nm羧化珠粒、myone甲苯磺酰基活化的戴诺珠粒、1
×
bcmag甲苯磺酰基活化的珠粒和10
×
bcmag甲苯磺酰基活化的珠粒,从制备于7h9培养液中的稀释系列对map atcc 19698的磁性分离,与当前使用的生物素-amp3和生物素-amptd肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒进行比较。使用dynal beadretriever(life technologies)进行磁性分离。在持续混合下在室温下进行磁性捕获30min,随后在1ml含有0.05%(v/v)tween 20的磷酸盐缓冲盐水(pbs)(pbs-t20,sigma)中洗涤两次,且最终将珠粒再悬浮在1ml储存缓冲液中。
[0168]
与肽涂布的珠粒相比,使用噬菌体涂布的珠粒从奶样品对map捕获。在此实验中,将使用涂布有d29噬菌体的myone甲苯磺酰基活化的戴诺珠粒、1
×
和10
×
bcmag 1μm甲苯磺酰基活化的珠粒从制备于uht全乳中的稀释系列对map atcc 19698的磁性分离,与当前使用的生物素-amp3和生物素-amptd生物素化肽涂布的bcmag 1μm甲苯磺酰基活化的珠粒进行比较。如之前关于从培养液捕获描述程序。
[0169]
实施例2:用于检测奶中的活鸟分枝杆菌类结核亚种(map)的基于噬菌体的一日测试的开发和优化
[0170]
本实施例的目标是将目前pms-噬菌体测定优化成以下:
[0171]
·
更快的一工作日测试
[0172]
·
更用户友好的型式
[0173]
·
具有高通量能力的测试
[0174]
·
但与pms-噬菌体测定具有相同的分析灵敏度,~10map/50ml奶。
[0175]
此一日测试基于d29噬菌体介导的磁性分离(噬菌体磁性分离)与map特异性qpcr组合检测map,且由三个部分构成:
[0176]
·
通过噬菌体涂布的磁珠捕获靶标(或所需)map细胞
[0177]
·
由于噬菌体裂解作用,dna从噬菌体感染的活map细胞释放
[0178]
·
通过qpcr检测所得map dna
[0179]
本细菌菌株和生长条件-研究中使用以下三个map菌株,包括一个参考菌株atcc19698、一个牛分离株b4和最初从零售的巴氏灭菌奶分离的菌株796pss(grant等人2002)。使用以下,使所有map菌株在37℃下在静态孵育箱中于螺帽玻璃小瓶(cole-parmer,
uk)中生长到稳定期持续2-3周其:5ml修饰的middlebrook 7h9培养液(pozzato等人2011),含有0.47%7h9粉末(difco)、0.1%酪胨和0.5%甘油(两者均来自sigma)、10%(v/v)油酸白蛋白右旋糖过氧化氢酶(oadc)补充物(difco)和2μg/ml分枝杆菌素j(synbiotics europe sas,lyon,france)。将待用于空斑测定的耻垢分枝杆菌mc
2 155在37℃下在未添加分枝杆菌素j的富含10%(v/v)oadc补充物(difco)的常规middlebrook 7h9培养基中培养到稳定期持续3天。
[0180]
map接种物的制备-用于对本研究中测试的培养液和奶样品加标的细菌悬浮液如先前foddai和grant(2015)所描述制备。简单来说,含有稳定期map培养液培养基的玻璃小瓶在冰上在ultrasonic ph 30(fisher scientific ltd,loughborough,uk)中通过在37khz下施加的超声波处理进行处理4min,以便使分枝杆菌凝块分散。随后,通过ziehl-neelsen(zn)染色验证去凝块的map悬浮液的纯度,以便确保仅红色抗酸细胞存在。每毫升培养液的map细胞数通过使用wpa co8000细胞密度仪(sislab,cornaredo,italy)测量在600nm下的光密度(od
600
)来估计。对于每一样品,将光密度调整到od
600 0.1(大致10
6-107个map细胞/毫升),随后将培养物连续稀释于含有0.05%(v/v)tween 20的磷酸盐缓冲盐水(pbs)(pbs-tw20,sigma)中。最后,使用四个加标水平(每毫升10
4-103、10
3-102、10
2-10和大致10个map)来制备本研究中测试的人工污染的培养液和奶样品,以评估通过噬菌体磁性分离和新型噬菌体磁性分离(phms)-qpcr测试获得的map回收率。
[0181]
d29分枝杆菌噬菌体的繁殖-使d29分枝杆菌噬菌体(最初在大约2008年由london school of hygiene and tropical medicine的ruth mcnerney博士赠予irene grant教授)在含有耻垢分枝杆菌mc
2 155(最初也是从ruth mcnerney博士接收到)的琼脂板中繁殖。向五或六个含有大约200到300个空斑的middlebrook 7h9琼脂板中充满补充有10%oadc和2mm cacl2的5ml 7h9培养液,随后在37℃下孵育过夜,随后在4℃下再孵育过夜。回收含有噬菌体粒子的培养液,且在2,500
×
g下离心10min,通过0.22μm millex gp millipore express pes膜过滤单元(millipore uk limited,croxley green,uk)过滤上清液。此储备培养物中存在的d29噬菌体粒子的数量通过滴定测定,其涉及将噬菌体储备液连续稀释于7h9培养液中,和与1ml耻垢分枝杆菌mc
2 155培养物和调温(55℃)的熔融7h9琼脂调温一起涂铺在皮氏培养皿中。将用于制备噬菌体涂布的顺磁珠的d29储备溶液标准化为10
11
pfu/ml的浓度,且随后储存在4℃下直到需要时。
[0182]
制备d29噬菌体涂布的珠粒的方案的优化-bcmag
tm
甲苯磺酰基活化的1μm顺磁珠(bioclone inc.,san diego,usa)通过与分枝杆菌噬菌体表面上的氨基基团共价连接而涂布有d29噬菌体。噬菌体涂布的顺磁珠使用制造商的说明书与laube等人(2014)关于用沙门氏菌属(salmonella)特异性噬菌体涂布顺磁珠所描述的珠粒涂布方案的组合来制备。简单来说,在到达实验室后,将bcmag甲苯磺酰基活化的珠粒(150mg)悬浮于1.5ml异丙醇(sigma)中,得到100mg/ml的储备液珠粒浓度,且如制造商所建议储存在4℃下。随后,一部分(10mg)再悬浮的顺磁珠(大致1.7
×
109个粒子)用1ml 0.1m碳酸钠/碳酸氢钠缓冲液ph 9.5洗涤三次,且共价涂布到先前再悬浮于1ml相同缓冲液中的d29噬菌体(10
10
pfu/ml)。在37℃下,在持续混合(30-40rpm)下,在stuart旋转混合器(cole-parmer,stone,uk)上进行顺磁珠与噬菌体粒子之间的涂布过夜(~12h)。在涂布之后,将珠粒捕获在磁力架上,且将上清液回收并通过噬菌体空斑测定测试以准许通过比较涂布前后的pfu计数来评定偶联效
率。还通过将涂布的珠粒拆分为两个部分来评定在用噬菌体与bsa涂布之后阻断顺磁珠的影响。将一部分涂布的珠粒再悬浮在pbs ph 7.4中。将另一部分与1ml含有0.5%bsa的pbs一起孵育过夜,磁性捕获,且最后再悬浮在含有0.2%bsa的1ml pbs中。噬菌体涂布的珠粒(10μl)的捕获能力通过磁性分离(ms)评定,所述磁性分离是使用dynal beadretriever(life technologies,paisley,uk)和测试以不同水平加标有map的培养液样品来进行。在ms之后,通过对从ms前后所测试样品提取(通过在99℃下沸腾25min和离心以澄清上清液)的dna进行常规is900 pcr(millar等人1996,参见以下细节)主观地评定所回收的map细胞的数量。还评定实现所需方法灵敏度所必需的噬菌体涂布的顺磁珠的量的优化。使用减少量的d29噬菌体涂布的顺磁珠(10μl、5μl、1μl),对于以四个不同水平加标有map的1ml培养液样品进行ms;顺磁珠的估计量分别是1.7
×
107、8.5
×
106和1.7
×
106个珠粒/毫升测试样品。在每一ms之后,通过常规is900 pcr主观地评定细菌的回收。为了得出优化结论,评定用减少量的d29噬菌体粒子制备的磁珠(10mg,大致1.7
×
109个珠粒)的捕获能力。制备具有不同噬菌体/磁珠(mb)比率(10、5、1、0.1map pfu/mb)的噬菌体涂布的珠粒且用于ms。对于每个类型的涂布的珠粒,通过比较在涂布前后的map pfu计数进行噬菌体空斑测定测试评定偶联效率,且通过常规is900 pcr主观地评定map细胞的回收。
[0183]
通过透射电子显微术(transmission electron microscopy;tem)可视化顺磁粒子上所固定的噬菌体粒子-为了确认d29噬菌体粒子已经以用于map捕获的正确定向(即,尾朝外)固定到顺磁珠上,以及证实在phms之后使用d29噬菌体涂布的珠粒成功捕获map细胞,进行tem。对于tem,在1ml分子级水(sigma)中洗涤10μl d29噬菌体涂布的珠粒三次,之后以1:100稀释于含有2%戊二醛的相同培养基中。在室温下,在密封暗盒中,将少量再悬浮的珠粒(10-20μl)涂布到碳涂布的em栅格(taab laboratories equipment limited,aldermaston,uk)上过夜。随后,栅格用先前通过0.2μm针筒过滤器过滤以去除沉淀的2%乙酸铀酰溶液(taab laboratories equipment limited)染色20min。使用whatman过滤纸吸收过量的染色剂,且最后使用jeol jem-1400+在100kv下操作的透射式电子显微镜(jeol uk,welwyn garden city,uk)可视化栅格。使用jeol ruby 8mp底部安放的ccd数码相机记录图像。应用类似方案来制备用于tem的phms后样品,以便可视化d29噬菌体涂布的珠粒成功捕获map细胞。出于健康和安全原因,采用含有10
4-105个map细胞的γ-辐射的map培养液悬浮液用于tem工作。在phms之后,将样品再悬浮在含有2%戊二醛的分子级水中,且如对于单独d29噬菌体涂布的珠粒一样处理。
[0184]
用d29噬菌体涂布的顺磁珠从已加标的奶回收map细胞-一旦已确立用d29噬菌体涂布珠粒的最佳条件,那么通过测试加标有减少量的map细胞(10到104个map/50ml)的50ml uht奶(购自当地超市)的四个重复来评定最佳d29噬菌体涂布的珠粒的回收率。在经受ms之前,使每一个人工污染的奶样品在2,500
×
g下离心15min,并且丢弃奶油和乳清级分,且将含有绝大部分map细菌负荷(foddai和grant 2015)的奶沉淀再悬浮在1ml pbs-tw20中。测试三个不同量的d29噬菌体涂布的珠粒(10μl、15μl和20μl/ml的再悬浮的奶沉淀)。使用涂布有两种生物素化肽amp3和amptd(foddai等人2010)的戴诺珠粒myone甲苯磺酰基活化的珠粒(life technologies)的pms平行用作对照,以便评定三个测试条件中的哪一个实现与现有pms测试类似的分析灵敏度。
[0185]
在qpcr之前phms后条件的优化-进行此实验以便鉴定最佳phms后条件以最大化从
已感染且随后由于d29噬菌体的作用而裂解的活map细胞释放的dna数量。通过phms,使用d29噬菌体涂布的bcmag顺磁珠来处理含有大致104个map细胞/毫升的培养液悬浮液。在phms之后,将珠粒样品再悬浮在50μl含有10%oadc和2mm cacl2的7h9 middlebrook培养液中,且在无振荡的情况下在37℃下孵育1、2、3和4h。在每一孵育时间,使样品在10,000
×
g下离心1min,且通过常规is900 pcr处理一小部分(10μl)样品上清液以检查从感染d29的map细胞释放的dna的存在。为了最大化适合于pcr目的的dna的数量和潜在地减少测试时间,评价在每一孵育时间后施加的引入在55℃下短暂轻微热激处理1min的影响。此模拟在初始噬菌体扩增测定期间,噬菌体感染的样品与熔融琼脂在55下一起涂铺时经历的短暂热激(foddai等人2009)。随后,基于从热激和未加热样品达到的pcr条带的强度,主观地评定从感染d29噬菌体的活map细胞释放的dna数量。随后,对含有大致104个先前经受10kgy剂量的γ-辐射以使其完全失活的map细胞的1ml培养液悬浮液进行相同实验,以便验证无活性map细胞在phms之后不会产生任何pcr产物。
[0186]
常规is900 pcr-如先前millar等人(1996)所描述且有一些修改,在本研究的第一部分期间施加常规is900 pcr来优化用于d29噬菌体涂布的珠粒的涂布方案。在最终50μl体积中进行每个pcr反应,其含有1
×
platinum
tm green hot start pcr主混合物、1u platinum
tm taq green hot startdna聚合酶、200μm每一种dntp(全部thermofisher scientific,paisley,uk)、3mm mgcl2、2μm正向引物p90(5
′
gaa ggg tgt tcg ggg ccg tcg gcc tta gg 3
′
)、2μm反向引物p91(5
′
ggc gtt gag gtc gat cgc cca cgt gac)和10μl通过在99℃下加热ms前后样品25min提取的基因组dna。在techne
tm prime热循环仪(cole-parmer)上,用以下条件进行pcr:在95℃下初始变性4min;37个循环:95℃持续30s,59.5℃持续30s和72℃持续30s,随后在72℃下最终延伸4min。通过琼脂糖凝胶电泳可视化pcr产物。is900 pcr条带的预期大小是394bp。
[0187]
与新型phms方法组合的三个实时定量qpcr方案的评价:作为与基于d29的phms新方法组合的潜在终点检测方法评价三个不同qpcr方案:is900 sybr green qpcr(bull等人2014)、is900 taqman qpcr(sidoti等人2011)和靶向f57基因的可商购获得的techne
tm primepro qpcr dna检测试剂盒,鸟分枝杆菌类结核亚种(techne ltd,product code tkit08017m)。如先前bull等人(2014)所描述并进行微小调整,进行is900 sybr green qpcr。简单来说,每一个反应以20μl的最终体积进行,且含有10μl 2
×
sybr green主混合物(sensifast
tm
hi-rox试剂盒,bioline reagents limited,london,uk)、1μm正向引物(av1:atgtggttgctgtgttggatgg)、1μm反向引物(av2:ccgccgcaatcaactccag)和2μl模板dna。pcr条件是:95℃持续10min,随后40个循环:95℃持续30s,58℃持续1min和72℃持续1min。在结束时应用标准熔融曲线分析来评价每一个qpcr阳性反应的特异性,所述每一个qpcr阳性反应由在95℃下10s,随后以0.2℃/s的温度增量从55℃升到95℃组成。如先前sidoti等人(2011)所报告并有一些修改进行is900 taqman qpcr。每一个反应以20μl的最终体积进行,且包括10μl 2
×
taqman qpcr主混合物(sensifast
tm
hi-rox试剂盒,bioline reagents limited)、1.5μm正向引物is900qf ccggtaaggccgaccatta、1.5μm反向引物is900qr acccgctgcgagagca、6皮摩尔is900 taqman探针fam-catggttattaacgacgacgcgcagc-tamra和4μl模板dna。pcr循环条件包括:50℃持续2min的初始升温区段;在95℃下持续10min的变性步骤;随后40个循环:95℃持续15s和60℃持续
1min。按照制造商说明书使用可商购获得的techne
tm primepro qpcr dna检测试剂盒(techne
tm
)基因。简单来说,每一个qpcr反应(20微升)包括10μl 2
×
qpcr主混合物、1μl map引物/探针混合物、1μl内部内源性对照引物/探针混合物、3μl无rna酶/dna酶的水和5μl模板dna。pcr循环条件包括:初始37℃持续10min;在95℃下持续2min的变性;随后50个循环:95℃持续10s和60℃持续1min。所有qpcr反应均是使用eco
tm
实时pcr系统(illumina,inc.,san diego,usa)和相关软件进行。每一轮qpcr中包括标准曲线,以准许定量所检测到的map。标准曲线由从含有10到104个map细胞/毫升的培养液悬浮液的连续稀释液提取的dna样品组成。
[0188]
从人工污染的奶样品回收map细胞-首先通过测试以四个水平(10
3-104、10
2-103、10-102、1-10)加标有map的50ml uht奶样品,评价新型phms-qpcr的分析灵敏度。用单独测试的三个map菌株atcc 19698、b4和796pss进行一组初步实验。为了较好地估测新测试的检测限值(lod
50
),安排测试加标和未加标的uht奶样品两者的设盲试验。所述试验中包括二十五个50ml uht奶样品,其包括20个以四个map污染水平(五个以10
3-104,五个以10
2-103,五个以10-102,五个以1-10)加标的样品和五个未加标的样品。操作员对于样品细节不知情,直到获得测试结果。此已加标的奶分析使用的测试条件是:使用d29噬菌体涂布的珠粒进行phms,phms后在37℃下孵育样品2小时,在55℃下短暂热激1min,在10,000xg下短暂离心1min以使细胞碎片沉降,以及在裂解循环结束时对从map细胞释放的dna施加is900 taqman qpcr。
[0189]
d29噬菌体涂布的珠粒的保质期-通过评价储存长达1年对于map细胞捕获的影响来测定储存在4℃下的d29涂布的bcmag
tm
顺磁珠的保质期。连同pbs ph 7.4,还评价本研究中制备的d29涂布的bcmag
tm
的第一储备液使用的再悬浮缓冲液、三种其它储存缓冲液(50mm tris hcl ph9,50%甘油和7h9-oadc-2mm calcl2培养液)。制备四种d29涂布的珠粒再悬浮于四种保藏缓冲液中的储备液,且储存在4℃下长达6个月,其中以每月间隔通过phms和常规is900pcr进行测试。通过测试以不同水平(10到104个细胞/毫升)加标有map的培养液悬浮液,评定随着时间推移的噬菌体涂布的珠粒的每一种储备液的map捕获能力。
[0190]
还监测随着时间推移涂布到顺磁珠上的噬菌体粒子的感染性的保持,以完成对d29涂布的珠粒的保质期评定。通过空斑测定每月一次测试在制备之后储存长达12个月的d29噬菌体涂布的珠粒储备液,以检查长期冷藏对于d29活性的影响。基于通过涂浦有耻垢分枝杆菌mc
2 155和熔融7h9琼脂的涂布珠粒的稀释液产生的空斑形成单位(pfu/ml),在冷冻储存期间以每月间隔,评估涂布到顺磁珠上的d29噬菌体的存活。
[0191]
新型phms-qpcr用于测试散装罐奶样品的应用在2019年9月到10月之间,提供由dale farm ltd(belfast,northern ireland)出于奶测试目的从100个北爱尔兰奶牛场收集的散装罐奶样品提供给qub用于通过新型phms-qpcr测定进行map测试。在到达qub实验室后,立刻通过phms-qpcr测定测试奶样品(一般~30-40ml)的活map。为了帮助释放map细胞以用于捕获以及最小化奶油级分的大小,将奶样品在水浴中在37℃下预温热10min,之后在2,500
×
g下离心15min。在离心之后,丢弃奶油和乳清级分,且将沉淀级分再悬浮在1ml pbs-tw20中且针对map进行测试。在phms之后,在37℃下孵育珠粒样品4h(而非实验室生长map所使用的2h),之后轻微热激处理和后续is900 qpcr。基于一些初步观测,发现此4h孵育时间更适于自然感染的奶样品中的map,尤其当测试在递送之前先前已经受长期冷藏的样
品时。将通过qpcr检测的每30-40ml奶体积的map数量校正为每50ml奶的map数量(表述奶中map计数的更常见方式),以准许比较所测试的不同体积的btm之间的结果。
[0192]
结果的统计分析-(a)在涂布珠粒前后和(b)在保质期实验期间长期储存在冷藏温度下前后观测到的平均空斑计数之间的差异的统计显著性,通过配对t检验,使用graphpad instat软件(graphpad inc.,san diego,usa)评定;当p值《0.05时,结果在统计学上显著。新型phms-qpcr测定的lod
50
和相关95%置信区间使用四个-水平加标方案的通用spearman-karber lod
50
计算来估计(aoac international 2006)。
[0193]
用于制备d29噬菌体涂布的珠粒的方案的优化:将d29噬菌体粒子共价固定到顺磁珠上通过将噬菌体粒子(大致10
10
pfu/ml)与10mg bcmag
tm
甲苯磺酰基活化的珠粒偶联且随后评价固定步骤前后的噬菌体浓度来评定。pfu计数反复地显示在涂布之后显著的3log
10
pfu/ml降低(p值=0.00066,配对t检验),因此证实通过采用laube等人(2014)方案成功将噬菌体粒子固定到顺磁珠上。通过比较偶联噬菌体涂布的顺磁珠前后的pfu计数获得的平均偶联效率是99.93
±
0.02%。
[0194]
当将使用噬菌体涂布的珠粒的phms应用于以四个水平加标有map的培养液时,观测到较高的map回收水平。当采用先前未用bsa阻断的d29噬菌体涂布的bcmag
tm
甲苯磺酰基活化的珠粒时,比较在phms前后所测试的样品的is900 pcr结果指示从所有加标水平成功回收map。如图7中所示,新噬菌体磁性分离的分析灵敏度视觉上类似于经受pms的样品的分析灵敏度。相比之下,当如珠粒制造商说明书中所述用bsa阻断噬菌体涂布的珠粒时,噬菌体涂布的珠粒的捕获能力大体上下降。还发现每一个phms所使用的顺磁珠的量是最大化捕获灵敏度的关键因素。使用10μl(10mg)d29噬菌体涂布的珠粒(等效于1.7
×
107个珠粒/毫升测试样品)的phms显示最佳的捕获灵敏度,且证实从所有加标水平成功回收。发现使用较低量的顺磁珠(5μl和1μl/ml样品)不利地影响phms的检测灵敏度(图6)。对于使用以较低噬菌体/mb比率制备的珠粒进行的phms,观测到类似趋势。涂布有10
10
pfu/ml细菌噬菌体(10pfu/mb)的顺磁珠显示最高的map检测能力,且使用较低噬菌体/mb比率(5、3、1和0.1pfu/mb)不利地影响测试的灵敏度。来自使用以降低pfu/mb比率制备的顺磁珠捕获的已加标的培养液的最低可检测的map数量分别是1-10map/ml(对于10pfu/mb比率)、10-100map/ml(对于5pfu/mb比率)和10
2-103map/ml(对于3、1和0.1pfu/mb比率)(图5)。
[0195]
通过最佳涂布的珠粒从已加标的奶的map细胞回收-一旦已确立用于将噬菌体涂布到顺磁珠上的最佳条件,那么进行实验以评定使用最优涂布的d29-噬菌体珠粒,从以四个水平加标有map的uht奶样品回收map。测试三个不同量的d29-噬菌体涂布的珠粒(10μl、15μl和20μl),以鉴定从奶最佳回收map细胞的每样品需要的数量。如图8中所示,对于所比较的三个不同量的d29-噬菌体涂布的珠粒,观测到类似检测灵敏度。在所有情况下,从所有加标水平成功地检测到map。然而,经受使用15μl噬菌体涂布的珠粒的phms的样品的pcr条带的外观指示以最高水平加标的样品中的稍微较高强度,随后以较低map加标水平的所有其它样品中的pcr条带的强度更渐进降低。pcr条带的外观表明当15μl噬菌体涂布的珠粒而非10μl用于phms时map细胞的回收率更大。使用较高数量的珠粒(20μl/ml的再悬浮的奶沉淀)不会引起map捕获能力的任何明显提高。
[0196]
概述:
[0197]
a:为了最大map细胞捕获,涂布到bcmag甲苯磺酰基活化的珠粒上d29噬菌体的最
佳数量-10pfu/珠粒-参见图5。
[0198]
‘
ms前’为对照样品,将其不同类型的涂布珠粒的捕获能力进行比较-结果明确指示,10pfu/珠粒的pfu/珠粒比率是最佳的,因为所有四个map细胞浓度仍可检测到,且pcr条带在所有四个浓度下具有类似强度,而在其它涂布比率下,越来越少的map细胞浓度测试呈pcr阳性。
[0199]
b:最佳map捕获所需的d29-噬菌体涂布的珠粒/毫升的数量-参见图6
[0200]
‘
ms前’是通过pcr直接测试的对照map细胞浓度,比较其的三个不同涂布珠粒浓度的捕获能力。结果指示,1.7
×
107个珠粒/毫升的珠粒浓度对于map捕获是最佳的,而较低珠粒浓度将错过较低map浓度,即将不具有足够的检测灵敏度。
[0201]
c:按照bcmag珠粒涂布说明书,是否应在用于磁性分离之前阻断噬菌体涂布的珠粒?-参见图7
[0202]
图7中的结果明确指示,噬菌体涂布的bcmag甲苯磺酰基活化的珠粒不应用pbs-bsa阻断,因为未阻断的珠粒表明map捕获能力优于已阻断的噬菌体涂布的珠粒以及也优于已阻断的肽涂布的甲苯磺酰基活化的珠粒。
[0203]
d:为了从奶中最大捕获map,每样品使用多少体积的噬菌体涂布的珠粒?-参见图8
[0204]
10μl肽涂布的珠粒已用于pms,但结果指示,15μl噬菌体涂布的珠粒在四个所测试的map细胞浓度中得到具有优良强度的pcr条带。
[0205]
e:相较于现有肽介导的磁性分离(pms)方法,使用优化的d29噬菌体涂布的珠粒从已加标的奶中捕获map-参见图9
[0206]
‘
ms前’是初始接种物;“甲苯磺酰基-b-amp3+甲苯磺酰基-b-amptd”是pms(对照);“d29 bcmag”是本发明的新型d29-ms。噬菌体涂布的珠粒对map的捕获与肽涂布的珠粒一样好,或稍微更好,且实现10map/50ml(当样品是奶时)的检测灵敏度。
[0207]
f:以正确定向成功与bcmag-甲苯磺酰基活化的珠粒连接的d29噬菌体和噬菌体涂布的珠粒对map细胞捕获的电子显微照片证据-参见图10
[0208]
噬菌体涂布的珠粒的tem
[0209]
图10显示tem结果,确定以正确定向将d29噬菌体粒子固定到顺磁珠上,其中噬菌体尾部从固体支撑物向外指向,且还通过phms成功捕获靶标map细胞。噬菌体尾部明显可见地从磁珠放射出,且map细胞明显与噬菌体尾部连接-参见图10。
[0210]
g:优化ms后条件以实现从噬菌体感染的map细胞的最大释放dna-参见图11
[0211]
优化phms后条件以最大化释放map dna
[0212]
我们的目标是为了鉴定phms后所需的步骤,以便最大化从随着时间推移与d29噬菌体涂布的珠粒一起孵育的活map细胞释放的dna的数量。在具有和不具有在55℃下短暂热激1min的情况下,在phms后每一小时孵育结束时,主观地评定pcr条带的强度。结果指示,如所预期的,检测到的dna数量随着时间推移而增加,其中在存在和不存在热激处理下,在37℃下孵育2和3h之后分别观测到最大dna数量(图11a和图11b)。在2和3h时间点之后,观测到pcr信号明显减少,其可指示噬菌体限制酶对于map dna的不良影响,潜在地降低适合于pcr扩增的dna分子的完整性。短暂热激明显地对于dna释放具有积极影响(图11b),可能是因为噬菌体减弱的map细胞壁更容易裂解,且在2h而非3h之后释放最大数量的dna。此表明,添加此短暂热激具有减少phms-qpcr测定的总体时间的潜能。从紧接在phms之后(t0)处理的样
品未曾观测到pcr条带,确定仅轻微加热步骤不足以裂解map细胞。在测试结束时检测到的dna仅来自于感染d29噬菌体的活map细胞,其由于裂解循环而破裂。
[0213]
在ms期间,噬菌体与map细胞结合且随后感染map细胞。裂解循环在活map细胞内进行,直到裂解发生,释放后代噬菌体以及map dna。图11中的条带的强度指示,当在37℃下孵育样品至多4h期间,ms后何时释放最大量的map dna。我们决定测试短暂热激的效果,模拟当样品与熔融琼脂在55℃下一起涂浦时,常规噬菌体测定中噬菌体感染的map细胞所经历的热激。包括热激步骤加速释放map dna,且因此将缩短总体测试时间1h。
[0214]
h:用辐射杀灭的map细胞进行的相同实验(如上述g)-结果证实即使在55℃热激之后不存在任何释放的dna-参见图12
[0215]
确认phms-pcr测定仅检测活map:为了评定新测试对于活map细胞的特异性,用加标(10
3-104map/ml)有辐射杀灭的map细胞悬浮液的培养液样品重复以上实验。在phms之后在37℃下孵育期间,且在具有和不具有在55℃下短暂热激1min的情况下,监测随着时间推移的dna释放。未观测到未热激或热激样品的pcr条带(图12)。因此证实,d29细菌噬菌体可以仅在活map细胞内完成其裂解循环,和在phms-qpcr测定结束时检测到的dna是初始样品中存在活map的可靠指示物。
[0216]
此实验完全与实验g相同,不同之处在于测试γ辐射杀灭的map培养物。绝对不存在任何map dna释放的证据,即使在55℃热激的情况下。此证实,我们的测试对于检测活map具有特异性。
[0217]
i:当优化的噬菌体捕获和裂解map细胞与map特异性的qpcr组合时,获得相同结果-最大释放map dna在ms后2h,此时包括在55℃下短暂热激1min,或者在ms后3-4h-参见图13
[0218]
将优化的噬菌体介导的map捕获和裂解与定量qpcr组合:评价三个不同qpcr方法以评定哪一种应与新型噬菌体磁性分离方法组合。应用is900 taqman qpcr提供关于来自所检测map细胞的dna数量的更清澈信息,且显示优于其它两种平行应用的qpcr方案的检测速率。最初将新型phms方法与is900 taqman qpcr组合使用,以测试从以高水平(104map/ml)加标有最初从奶分离的三个不同实验室生长的map菌株的培养液悬浮液回收map dna。结果指示在phms后,在37℃下孵育3h之后将近100%的map回收(图13)。如果样品在2h孵育期结束时在55℃下短暂热激1min以裂解已通过噬菌体裂解作用减弱的map细胞,那么提前1h(在2h孵育之后代替在37℃下3h)不断地从所有三个map菌株检测到更高数量的map。
[0219]
j:通过测试map加标的培养液和奶,证实新噬菌体磁性-qpcr测定具有足够的分析灵敏度和定量能力-参见图14
[0220]
进行第二轮实验以评定所述测试检测以四个水平(10到104map/50ml)加标的50ml 7h9培养液和uht奶样品中的map的分析灵敏度。平行测试两种版本测试以用于比较,所述测试涉及phms后在37℃下孵育2h(快速版)和4h(长久版),随后在两种情况下,在55℃下轻微加热1min和is900 taqman qpcr。用三个map菌株进行的实验的结果证实在两种情况下成功检测10个map细胞/50ml培养液或奶,且在两种测试版本之间检测灵敏度无显著差异(p值=0.940319,配对t检验)(图14)。对于平行于is900 taqman qpcr应用的另外两种qpcr方案观测到较低水平的检测。用可商购获得的techne qpcr试剂盒实现较高的检测限值(》100map/ml培养液或/50ml奶)(数据未显示),可能是由于相较于is900 map基因组中具有更低的f57
基因拷贝数。当is900 sybr green与phms组合使用时,未观测到dna扩增(数据未显示),可能是由于珠粒悬浮缓冲液中的oadc或cacl2抑制sybr生物化学反应。
[0221]
大部分优化工作是对于map加标的培养液进行。这种对于两种map加标的培养液和奶的平行测试证实,新测试同样适用于奶测试,和可实现10map/50毫升的靶标(或所需)检测灵敏度。
[0222]
k:储存在4℃下的d29噬菌体涂布的bcmag甲苯磺酰基活化的磁珠的保质期的测定-参见图15
[0223]
鉴于噬菌体涂布的珠粒最终变成商业测试的一部分,我们评定哪种储存缓冲液将在不损失检测能力的情况下最大化噬菌体涂布的珠粒的保质期-储存珠粒在7h9-oadc-2mm cacl2培养液中保持噬菌体活性至少6个月。在所测试的三个其它储存缓冲液中,噬菌体活性下降到不同程度。
[0224]
图17主要是最佳储存缓冲液(7h9-oadc-2mm cacl2)中的后续保质期研究。图17显示,噬菌体涂布的珠粒在4℃下稳定至少8个月,之后存在珠粒上存在的活d29噬菌体数量下降一些的证据。在所测试的四个不同储存缓冲液(pbs ph7.4,50mm tris-hcl ph 9,甘油50%和7h9-oadc-2mm cacl2培养液)中,仅储存于7h9-oadc-2mm cacl2培养液中的d29噬菌体涂布的珠粒保持其map捕获能力,且证实从所有四个所测试加标水平的map细胞回收,即使在4℃下储存6个月之后。再悬浮在三个其它储存缓冲液中的珠粒储备液显示,在储存几个月之后,捕获能力可见的下降(数据未显示)。制备新的d29噬菌体涂布的珠粒储备液,且储存于7h9-oadc-2mm cacl2中4℃下,且通过空斑测定每月测试,持续12个月。噬菌体数量在4℃下保持恒定持续8个月,但随后在储存的接着4个月内逐渐下降2log
10
(图17)。
[0225]
基于这些数据,含有cacl2的培养液是优选的储存缓冲液;且7h9-oadc-2mm cacl2培养液是优选的含有cacl2的培养液。
[0226]
l:选择最适当的qpcr方法以与噬菌体磁性分离组合-参见图16
[0227]
公开的map特异性taqman探针基的is900 qpcr方法(sidoti等人“validation and standardization of is900 and f57 real-time quantitative pcr assays for the specific detection and quantification of mycobacterium avium subsp.paratuberculosis.can j microbiol.2011年5月;57(5):347-54.在检测灵敏度和map计数潜力两个方面,证明是优于可从techne
tm
可商购获得的map qpcr试剂盒。is900 taqman方法识别作为标志dna序列的插入元件is900。techne试剂盒设计成识别作为标志dna序列的鸟分枝杆菌类结核亚种(map)的独特基因序列f57。
[0228]
m:新型phms-qpcr测试的检测灵敏度
[0229]
对人工污染的uht奶样品进行设盲测试,以测定测试对map的检测灵敏度和特异性。测试总共25个uht奶样品,包括以四个不同水平加标有map的20个样品(五个加标有10
3-104map/50ml;五个加标有10
2-103map/50ml;五个加标有10-102map/50ml;和五个加标有1-10map/50ml);和五个未加标的奶样品。在以10
3-104map/50ml和10
2-103map/50ml加标的所有五个样品中成功检测到map,但仅在3/5个加标有10-102map/50ml和1-10map/50ml的样品中成功检测到map。在五个未加标的uht奶样品中的任一个中未检测到活map细胞。评估的检测限值50%(lod
50%
)使用在线excel lod
50%
计算器计算为10.004(95%ci:1.20-82.83)个map细胞/50ml。
[0230]
n:btm样品的phms-qpcr测试
[0231]
btm样品的分析确认,phms-qpcr测定是一种对活map的灵敏测试。四十九(49%)/100个btm测试活map呈phms-qpcr阳性,其中检测到的活map数量在3到126map/50ml范围内。绝大部分(71%)的map阳性btm样品含有1-10map/50ml奶。可用于测试的btm体积有限意指,培养不能与基于噬菌体的测定平行进行以便确认phms-qpcr阳性奶样品中存在活map。
[0232]
讨论
[0233]
噬菌体可以不同方式使用来检测病原体(schmelcher和loessner 2014)。最常见的基于裂解性噬菌体的测试是噬菌体扩增测定或仅空斑测定。结核分枝杆菌的初始fastplaquetb测定和map的pms-噬菌体测定是噬菌体扩增测定的实例。两种测试均依赖于在完成噬菌体的裂解循环之前,与熔融琼脂和快速生长的耻垢分枝杆菌一起涂浦噬菌体感染的分枝杆菌细胞。当噬菌体感染的结核分枝杆菌或map细胞在琼脂内原位破裂时,它们释放后代噬菌体,其通过反复感染和破裂周围区域的耻垢分枝杆菌细胞,在引发剂结核分枝杆菌或map细胞(或凝块)周围产生空斑(清除区域)。不幸的是,由于事实上除结核分枝杆菌、map和耻垢分枝杆菌以外,d29噬菌体可以感染一系列分枝杆菌属某些种(rybniker等人2006),观测到空斑并非是样品中存在活结核分枝杆菌或map的决定性证据。必须从一些空斑收集dna,且进行靶标病原体特异性pcr以确认此。相比之下,对于本文报告的新型phms-qpcr测定,将裂解性d29噬菌体固定在待用于噬菌体介导的map细胞捕获的甲苯磺酰基活化的顺磁珠上,且一旦捕获到,那么也将起始噬菌体感染map细胞。
[0234]
据我们所知,仅其它公开的phms测定是使用涂布到甲苯磺酰基活化的m-280戴诺珠粒上的噬菌体p22来捕获鼠伤寒沙门氏菌细胞,之后在使用与作为光学报告剂的辣根过氧化酶缀合的特异性抗沙门氏菌抗体的免疫测定型式中检测的方法(laube等人2014)。这些作者并不选择利用噬菌体捕获的沙门氏菌属细胞将随后由于p22噬菌体作用裂解的事实。相比之下,对于我们的新型测定,我们确实选择等待细胞裂解自然出现,使得将实现针对活map的测试。仅活map细胞将支持内部导致后续裂解的d29噬菌体扩增。因此,对于我们的测试,从奶对map进行phms,随后在37℃下允许d29噬菌体在感染的map细胞内扩增到细胞通过噬菌体细胞内溶素的作用而从内破裂的时间点的孵育期,且释放宿主细胞dna且变得可用于进行qpcr确认和map定量。我们发现,在孵育结束时包括短暂热激(55℃持续1min),模拟在涂铺于pms-噬菌体测定中期间熔融琼脂的温度,帮助从噬菌体减弱的map细胞进行的dna更早、最大释放(图11到图13)。
[0235]
表4提供我们的先前pms-噬菌体测定与新型phms-qpcr测定之间的关键差异的概述。
[0236]
表4pms-噬菌体测定与phms-qpcr测定之间的差异的概述.
[0237][0238][0239]
在测试开发过程中,需要确认/优化多个事物,以便最大化后续map细胞捕获,包括通过tem确定顺磁珠表面上的正确噬菌体定向,在珠粒涂布期间使用的珠粒与噬菌体比率、每phms反应添加的噬菌体涂布的珠粒数量和对于已涂布的珠粒的最佳储存缓冲液。图5、图6、图7、图8和图10中呈现的结果应清楚地显示基于紧接在phms之后的常规is900 pcr测试,我们关于这些参数的决策。我们先前已使用此主观评价方式来成功优化了用于map(foddai等人2010b,o’brien等人2016)和牛分枝杆菌(stewart等人2012)的ms方法。我们的目的是为了实现在用d29噬菌体涂布的bcmag甲苯磺酰基活化的珠粒的情况下与我们先前用生物素标记肽涂布的甲苯磺酰基活化的戴诺珠粒类似或更好的map捕获能力和检测灵敏度,且我们已这样做了(图7和图8)。我们还证实,仅活map细胞可以支持噬菌体扩增,且从而在孵育期期间在有助于用于qpcr目的dna的phms之后通过噬菌体作用裂解(图11和图12)。此外,我们显示,在55下短暂热激1min并不会贡献足够裂解样品中的无活性map细胞的热量(图12b);此为关于phms-qpcr测定对仅活map的特异性方面极其重要的考量。
[0240]
选择实时qpcr作为在phms之后的终点检测方法,因为其提供快速和定量结果。我们评价了三种不同qpcr终点检测选择以与以下组合:phms-两种公开的is900 qpcr测定(一种基于sybr green(bull等人2014),另一种基于其它taqman探针(sidoti等人2011))和靶向f57而非is900的用于map的可商购获得的qpcr试剂盒。所有三种方法具有定量潜能,只要标准map dna曲线与样品一起运行即可。taqman qpcr和商业qpcr试剂盒在phms之后检测map,而sybr green qpcr测定并不产生任何阳性结果。商业map f57 qpcr试剂盒的检测灵敏度相较于taqman is900 qpcr的差异将是由于map细胞中f57靶标的拷贝数低于is900靶标。进一步研究揭露,用于在phms之后再悬浮磁珠的7h9-oadc-2mm cacl2培养液的oadc组分(其在dna模板阶段仍存在)引起对sybr green pcr扩增的抑制。这些结果证实,噬菌体涂
mediated magnetic separation(pms)-phage assay.j appl microbiol122,1357-1367.https://doi.org/10.1111/jam.13425
[0258]
foddai acg,grant ir(2020)methods for detection of viable foodbome pathogens:current state-of-art and future prospects appl microbiol biotechnol 104,4281-4288-accepted but not yet published gilardoni lr,paolicchi fa,mundo sl(2012)bovine paratuberculosis:a review of the advantages and disadvantages of different diagnostic tests.rev argent microbiol 44,201-15.
[0259]
geraghty,t.,graham,d.a.,mullowney,p.,more,s.j.(2014)a review of bovine johne
′
s disease control activities in 6 endemically infected countries.prev vet med 116,1-11.https://doi.org/10.1016/j.prevetmed.2014.06.003
[0260]
grant l,ball h,rowe m(2002)incidence of mycobacterium avium subsp.paratuberculosis in bulk raw and commercial pasteurized cow’s milk from approved dairy processing establishments in the united kingdom.appl env microbiol 68,2428-2435.https://doi.org/10.1128/aem.68.5.2428-2435.2002.
[0261]
grant ir,foddai acg,tarrant jc,kunkel b,hartmann fa,mc guirk s,hansen c,talaat am,collins mt(2017)viable mycobacterium avium ssp.paratuberculosis isolated from calf milk replacer.j dairy sci 100,9723-9735.https://doi.org/10.3168/jds.2017-13154
[0262]
laube t,cort
é
s p,llagostera m,alegret s,pividori mi(2014)phagomagnetic immunoassay for the rapid detection of salmonella.appl microbiol biotech 98(4),1795-1805.https://doi.org/10.1007/s00253-013-5434-4
[0263]
millar d,ford j,sanderson s,whitey s,tizard m,doran t,hermon-taylor j(1996)is900 pcr to detect mycobacterium paratuberculosis in retail supplies of whole pasteurized cows
′
milk in england and wales.appl environ microbiol 62,3446-3452.
[0264]
o’brien lm,mcaloon cg,stewart ld,strain saj,grant ir(2018)diagnostic potential of the peptide-mediated magnetic separation(pms)-phage assay and pms-culture to detect mycobacterium avium subsp.paratuberculosis in bovine milk samples.transbound emerg dis 65,719-726.https://doi.org/10.1111/tbed.12794
[0265]
o’brien l,strain sa,grant ir(2016)novel monoclonal antibody and peptide binders for mycobacterium avium subsp.paratuberculosis and their application for immunomagnetic separation.plos one 11(1),e0147870.https://doi.org/10.1371/journal.pone.0147870
[0266]
pozzato n,gwozdz j,gastaldelli m,capello k,dal ben c,stefani e(2011)evaluation of a rapid and inexpensive liquid culture system for the detection of mycobacterium avium subsp.paratuberculosis in bovine faeces.j microbiol meth 84,413-417.https://doi.org/10.1016/j.mimet.2011.01.019
5158.https://doi.org/10.1128/aem.00590-06.
[0277]
swift bmc,meade n,sandoval barron e,bennett m,perehenic t,hughes v,stevenson k,rees ced(2019)the development and use ofto detect viable mycobacteria from bovine tuberculosis and johne’s disease-infected animals.microb biotechnol 13,738-746.https://doi.org/10.1111/1751-7915.13518.
[0278]
van schaik g,rossiter cr,stehman sm,shin sj,shukken yh(2003)longitudinal study to investigate variation in results of repeated elisa and culture samples for mycobacterium avium subspecies
[0279]
paratuberculosis in commercial dairy herds.amer j vet res 64,479-484.https://doi.org/10.2460/ajvr.2003.64.479.
[0280]
实施例3:本发明的新型一日噬菌体磁性-qpcr测定相对于当前应用的用于诊断牛中的约氏病/map感染的
‘
黄金标准’测试的性能。
[0281]
此实施例中血液elisa和粪便qpcr使用的试剂盒是:
[0282][0283]
测试通过
‘
黄金标准’测试(粪便qpcr和/或血液-elisa)测试确认是感染map的来自28头奶牛的粪便和奶。
[0284][0285][0286]
n/a,样品不可用于测试
[0287]
本发明的新型噬菌体磁性(phms)-qpcr测定在28头map感染的牛的粪便中检测到活map比
‘
黄金标准’粪便qpcr测定多出8头(28.6%),说明新测试的更高检测灵敏度。两种粪便测试结果之间仅存在普通一致性:
[0288][0289]
所观察到的一致性的数量:18(观察的66.67%)
[0290]
偶然预期的一致性的数量:12.1(观察的44.72%)
[0291]
κ=0.397
[0292]
κ的se=0.131
[0293]
95%置信区间:0.140到0.654
[0294]
一致性的强度被视为
‘
普通’。
[0295]
通过本发明的新型噬菌体磁性-qpcr测定,从14头(50%)/28头map感染的牛收集的奶样品也测试呈活map阳性;说明新型测定对于检测自然污染的奶中的低数量的活map具有足够的灵敏度。
[0296]
测试来自通过当前两种对于约氏病应用的诊断测试进行的测试呈阴性的60头乳牛的粪便和奶。
[0297]
也使来自另一群组在应用
‘
黄金标准’测试时未显示map感染迹象的单一农场的60头奶牛的粪便和奶经受本发明的新型噬菌体磁性-qpcr测定。
[0298]
[0299][0300]
n/a,样品不可用于测试
[0301]
本发明的新型噬菌体磁性-qpcr测定的结果指示分别在50%和33.3%的60头
‘
黄金标准测试’阴性奶牛的粪便和奶中存在低水平的活map。来自相同奶牛的粪便和奶噬菌体磁性-qcpr结果之间存在中等一致性:
[0302][0303]
所观测到的一致性的数量:44(观测的73.33%)
[0304]
偶然预期的一致性的数量:30.0(观测的50.00%)
[0305]
κ=0.467
[0306]
κ的se=0.108
[0307]
95%置信区间:0.256到0.678
[0308]
一致性的强度被视为
‘
中等’。
[0309]
这些发现表明,当前应用于测试牛的约氏病的
‘
黄金标准’测试缺少检测灵敏度,这意味着,获得了实际上是map感染的奶牛的阴性测试结果。
[0310]
实施例4:噬菌体磁性qpcr:一种针对散装罐和个别奶牛牛奶中的活鸟分枝杆菌类
结核亚种的快速、灵敏且特异性的监测工具
[0311]
通过与测试map抗体存在的奶-elisa平行检测活鸟分枝杆菌类结核亚种(map)的新型基于噬菌体的测定(噬菌体磁性-qpcr),测试散装罐奶(btm)和个别奶牛牛奶。两种测试的结果之间不存在显著相关性。phms-qpcr被证明是一种灵敏得多的测试,其用于通过btm测试检测map感染的奶牛群和用于鉴定其中这些畜群的四个内的感染map和排出map的动物。我们已证实,新型phms-qpcr测定将可用于约氏病监测或奶质量保证程序。
[0312]
通过能够检测和定量活鸟分枝杆菌类结核亚种(map)的新型噬菌体磁性分离(phms)-qpcr测定,测试来自392个北爱尔兰奶牛场的散装罐奶样品和来自这些农场中的四个的动物(n=293)的个别奶,以便证实其作为奶监测工具的潜在效用。在26.5%的散装罐奶中检测到活map,其中map污染水平在1-8432map/50ml奶范围内;《2%的农场的散装罐奶的map污染水平》100map/50ml。追踪phms-qpcr测试来自其散装罐奶中具有最高map数量的四个农场的个别动物的奶指示,在每一个畜群中存在17-24%的在其奶中排出活map的动物。检测到的平均map数量在6.7到42.1map/50ml奶范围之间。通过phms-qpcr检测的散装或个别奶中的活map与平行奶-elisa结果之间,或实际上phms-qpcr结果与任何其它奶记录参数(体细胞计数、总细菌计数(bactoscan)、乳脂%或蛋白质%)之间未观测到显著相关性。在肽介导的磁性分离之后,在mh7+(pozzato)培养液中培养第二个50ml等分试样的61个来自四个农场的phms-qpcr阳性个别奶样品。在孵育之后通过is900 qpcr,五十二个(85.2%)培养液培养物显示map证据,从而确定phms-qpcr阳性结果总体上是奶样品中存在活map的真实指示。我们的发现明确证实,新型phms-qpcr测定可以是一种用于乳制品加工商的有用的奶监测工具或用于约氏病控制或奶质量保证程序的奶监测工具。
[0313]
奶是收集用于约氏病诊断目的三种样本类型中的一种,另两种是粪便和血液。奶代表更方便收集的样品类型,因为不需要兽医存在,且其可以从散装罐取样以用于畜群水平筛选目的或从奶牛场的个别动物取样。感染约氏病的病原体鸟分枝杆菌类结核亚种(map)的动物在其粪便和奶中排出细菌,即使在它们未显示任何约氏病临床体征时(barkema等人2010)。在感染动物的乳房内直接排出map可以在挤奶过程期间通过间接受到来自粪便的map(其含有的map数量总体上比奶中高得多)污染而增强(okura等人2013)。已感染的母畜的奶或初乳中存在map表示小牛传染约氏病的风险,此是为何不对小牛喂食感染map的奶是约氏病控制程序中的一个主要建议的原因(whittington等人2019)。map污染的奶还可表示一种人类暴露于map的媒介,这是因为奶牛的牛奶从小就被人类广泛食用。关于对奶进行巴氏灭菌是否能有效杀灭map(lund等人2002;robertson等人2017)和map是否是人类克罗恩氏病的原因或其促成因素(chiodini等人2012;waddell等人2015)的争论仍在继续。
[0314]
为何政府、动物健康组织、农民或奶加工商可能希望测试奶的map污染证据有若干原因。首先,为了在约氏病控制程序(mcaloon等人2019)或奶质量保证程序(weber等人2008)内畜群中监测随着时间推移散装罐奶中的map水平。其次,为了确保客户在食用生奶(giacometti等人2012)或商业巴氏灭菌奶(gerrard等人2018)方面的安全性。第三,为了能够证实map测试阴性畜群未感染(meyer等人2019),或为了证明来自奶牛群的奶不含map(等人2017)。在最新研究中,gamberale等人(2019)想要能够确定初乳的map状况以便建立安全初乳库。
[0315]
当前,仅广泛应用于测试奶的约氏诊断测试是奶-elisa,其检测map的抗体而非病原体自身(office international des epizooties 2019)。此测试被视为一种用于监测乳牛中的map感染的无创、切实可行的且有成本效益的方法(pesquiera等人2017;等人2017),但其具有某些限制。奶-elisa当应用于散装罐奶时仅准许鉴定具有极高的畜群map排出发生率的畜群(等人2017;sergeant等人2019),且当应用于测试来自个别动物的奶时,在map阴性和低发生率畜群中是不可靠的(lavers等人2014)。kostoulas等人(2013)报告,奶elisa区分健康牛和感染map的牛的能力极其不佳,但区分健康牛和map感染性牛的能力较高。应用于奶牛的牛奶的商业奶elisa的灵敏度在21-61%范围内,且奶elisa的特异性在83-100%范围内(nielsen和toft,2008)。对于个别动物测试,奶-elisa被视为比血液-elisa更不灵敏(khol等人2013)。不经常进行用于诊断目的的奶的培养,尽管事实是此被视为能够确定map存活力的唯一方法。这主要是因为结果变为可用所花费的时长和可能因为化学去污(其通常形成奶培养程序的一部分)对于map存活力的有害影响而不能检测到低水平的活map存在的独特可能性(dundee等人2001;bradner等人2013)。能够作为缓慢培养的替代方案来检测和定量奶中的活map的快速诊断测试将是对于约氏病监测的有吸引力的提议。以上,我们报告针对活map的新型基于噬菌体的测试(称为噬菌体磁性(phms)-qpcr)的开发和优化。此phms-qpcr测定是一种我们的先前用于检测奶中的活map的肽介导的磁性分离(pms)-噬菌体测定(foddai等人2011;foddai和grant 2015,2017)的简化和精简许多的版本。使用d29分枝杆菌噬菌体涂布的顺磁珠从奶样品中磁性分离map而非map特异性的生物素化肽。在我们的手中,pms-噬菌体测定已证实是一种用于奶中的活map的极灵敏且特异性的测试。不幸的是,由于其要求两个过夜孵育、多个定时步骤和添加试剂,且需要收集空斑以用于pcr确认阳性结果(foddai和grant 2017),将pms-噬菌体测定转移到其它实验室证实是由于多种原因而存在问题(butot等人2018)。新型phms-qpcr测定与pms-噬菌体测定的不同之处在于多个关键方面(在未公开的foddai和grant 2020中详述;且在以上实施例2中报告)。主要的不同是:不再需要熔融琼脂和耻垢分枝杆菌培养,新型测试在~7h而非48h内产生结果,且通过直接应用于样品的map特异性的且更快的taqman qpcr,而非通过应用于必须从空斑提取的dna的常规is900 pcr来确认map存在。我们认为,phms-qpcr测定可以代表对umap培养的长时等待替代性测试。
[0316]
本研究的目的是为了证实新型的基于噬菌体的phms-qpcr测定作为用于检测在畜群水平下散装罐奶中或感染map的奶牛群内的个别动物的奶中的活map污染的监测工具的潜在效用。与奶-elisa和其它奶记录测试同时进行phms-qpcr测试,使得可以测定测试结果之间的任何一致性或相关性。
[0317]
材料和方法
[0318]
phms-qpcr测定的描述
[0319]
新型phms-qpcr测定的开发和优化的完整细节在未公开的foddai和grant(2020)中报告且在以上实施例2中陈述。所述测定采用涂布到bcmag甲苯磺酰基活化的顺磁珠(bioclone inc.,san diego,usa)上的d29分枝杆菌噬菌体来捕获奶样品中的任何活map细胞且随后裂解所述活map细胞,以提供用于is900 taqman qpcr的map dna。简单来说,在以2500
×
g离心15min以获得奶沉淀之前,使奶样品在水浴中在37℃下预温热15min。将此充分
地再悬浮于1ml含有0.05%tween 20的磷酸盐缓冲盐水(pbs-t20,sigma-aldrich,poole,uk)中,之后将15μl d29噬菌体涂布的bcmag珠粒(如以上实施例2中和未公开的foddai和grant,2020中所描述)添加到每一样品中。使用内置的
‘
环境’程序在dynal beadretriever(life technologies,paisley,uk)中进行自动磁性分离,所述程序由以下组成:将样品加噬菌体涂布的珠粒混合30min,在1ml pbs-t20中两次洗涤珠粒-map细胞复合物1min,且随后在50μl含有10%oadc(均为difco)和2mm cacl2(sigma-aldrich)的middlebrook 7h9培养液中最终洗脱珠粒-map细胞复合物。每一轮beadretriever处理十五个奶样品。当phms完成时,将珠粒快速转移到1.5ml eppendorf管中,且在37℃下孵育4h;此时将管转移到在55℃下操作1min的stuart阻断加热器(cole-parmer,stone,uk)中,之后在10,000
×
g下离心2min。样品上清液(每反应8μl)用作用于is900 taqman qpcr的模板dna,所述is900 taqman qpcr立即进行或在将dna样品储存在-80℃下后的第二天进行。每样品进行重复的qpcr反应。在利用最初由sidoti等人(2011)报告的引物/探针序列和使用sensifast
tm
hi-rox主混合物(bioline reagents limited,london,uk)的eco-qpcr系统(illumina inc.,san diego,usa)上进行qpcr。不同于初始sidoti等人(2011)方案,qpcr反应设定包括增加的引物浓度和两倍量的模板dna;我们发现其提高检测灵敏度。pcr循环条件由以下组成:50℃持续2min的初始升温区段;在95℃下持续10min的变性步骤;随后40个循环:95℃持续15s和60℃持续1min。对所有样品均一致地应用38个循环的实时pcr循环阈值(ct)截止值,以改进对qpcr结果的解释。如果ct值≤38,那么结果被视为阳性。每一轮qpcr中包括标准曲线测定,其由以下构成:等效于104、103、102和10个map细胞/毫升的dna的重复样品,其准许对奶样品中所检测到的map细胞进行定量。使每一样品和对照dna的两个重复(而非三个重复)等分试样经受qpcr,这是由于eco-qpcr板(illumina inc.)的有限的48孔容量。
[0320]
散装罐奶测试
[0321]
在2019年10月到2020年1月之间,通过新型phms-qpcr测定测试来自供应dale farm limited的392个北爱尔兰奶牛场的单一散装罐奶(btm)样品。这些样品是来自dale farm实验室测试流的残余btm样品,且因此奶样品体积相当不一致;在15到40ml之间变化。这些392个畜群占供应dale farm进行奶加工的总共~1280个奶牛场的~30%。所有btm样品均在外部实验室(cattle information services(cis),telford,uk)已通过可商购获得的map奶-elisa测试,但由于因失误一批样品未发送,所以通过奶-elisa仅测试340个/392个散装罐奶样品。将phms-qpcr和奶-elisa结果与由gary watson,dale farm提供的其它可用的奶质量结果(体细胞计数、总细菌计数(bactoscan)、乳脂%、蛋白质%)一起核对。由于测试的奶体积不同,将phms-qpcr结果(估计的map计数/测试体积)校正为每50ml,以准许比较btm样品之间的map负荷。
[0322]
个别奶测试
[0323]
在2020年2月到3月期间,从四个奶牛群(农场a-d)的294头个别奶牛收集奶样品(100ml)用于map测试目的。这些畜群选自392个已测试其btm的农场,这是因为其具有最高map负荷。从挤奶室(而非通过手工挤奶)中的收集缸中取样个别奶样品,同时收集样品用于常规奶记录目的。在到达女王大学贝尔法斯特实验室后,将每一个100ml样品无菌拆分到两个无菌50ml离心管中。通过phms-qpcr测试测试一个50ml样品,且将另一个冷冻在-80℃下直到知道phms-qpcr结果为止。dale farm将来自相同动物、同时收集的奶记录样品发送到
cis telford用于map奶-elisa测试,和其内部实验室进行其它奶记录分析。将phms-qpcr和奶-elisa结果与由gary watson,dale farm提供的这些动物的其它可用的奶记录结果(泌乳数量、奶重量kg、乳脂%、蛋白质%、体细胞计数)一起核对。
[0324]
对测试呈phms-qpcr阳性的第二个50ml等分试样的任何奶样品进行pms,随后培养,如foddai和grant(2017)所描述。采用未添加蛋黄(下文称为pozzato培养液)和补充有panta抗生素(becton dickinson)的由pozzato等人(2011)描述的mh7+培养液。在37℃下孵育培养物几个月,且从孵育4周开始,定期视觉检查生长迹象。一旦观测到浑浊增加,那么小心地去除1ml等分试样的培养物,离心且再悬浮在100μl tris-edtaph 8.0中,将其在加热块中在99℃下加热30min以裂解map细胞以便释放dna。随后,使五微升上清液经受is900 taqman qpcr(参见上文描述的优化qpcr方案),以便确认培养物中map生物质的存在。
[0325]
结果统计分析
[0326]
通过使用graphpad prism 8.4.3版(graphpad software,san diego,usa)进行的pearson r相关性测试,评定phms-qpcr结果与所有其它可用的奶测试结果之间的相关性。构建相依表(2
×
2),且使用epitools流行病计算器(http://epitools.ausvet.com.au)测定phms-qpcr结果与奶-elisa结果之间的κ一致性。p值《0.05被认为是统计学上显著的。
[0327]
结果和讨论
[0328]
本文报告的奶测试的主要目的是为了评定新型phms-qpcr测定作为奶监测工具的效用,和为了将其性能与在许多国家通常应用于测试奶的map感染迹象的测定(奶-elisa)(geraghty等人2014;meyer等人2019)进行比较。phms-qpcr测定是一种先前由foddai和grant(2015)对于测试奶进行优化的pms-噬菌体测定的简单许多且易于应用的版本,且因此其可能适合于作为map培养的快速替代方案进行更大规模的奶测试。
[0329]
据我们所知,本文报告的btm测试代表对于北爱尔兰奶牛群制造的奶牛牛奶中的map的第一次合理规模的调查。在来自通过新型phms-qpcr测定测试的不同北爱尔兰奶牛场的104(26.5%)/392个btm中检测到活map,其中检测到的活map数量在1-8432map/50ml btm范围内。先前未曾对北爱尔兰奶牛群进行约氏病调查,然而很可能的是,北爱尔兰的感染畜群的比例在20%(英国数据,animal health and welfare northern ireland,2014)到35%(爱尔兰共和国数据,mcaloon等人,2016)范围内。因此,供应当地乳业合作商的北爱尔兰奶牛群中26.5%的map感染发生率的图形落在预期范围内。图18显示50ml btm样品中检测到的map污染水平的分布。大部分通过phms-qpcr测定测试活map呈阴性的btm样品(286/392,73.15%)和仅2(0.5%)和5(1.28%)个散装罐奶样品具有在最高1,001-10,000map/50ml和101-1,000map/50ml类别中的map污染水平。这些phms-qpcr来源的map计数与通过更早版本的噬菌体测定(通过噬菌体-pcr测定为2-320pfu/50ml,botsaris等人2013;通过pms-噬菌体测定为18-685pfu/50ml,foddai和grant 2017)和通过f57qpcr(《15-32.4个细胞/毫升,ricchi等人2016)测试的btm所报告的那些一致。其也与okura等人(2013)对于来自丹麦乳群的btm所预测的图(其中畜群内map感染发生率为7.5-60.0%)一致。在btm的情况下,有限体积的残余奶可用于测试意指,可能对于phms-qpcr阳性样品未进行培养以便确认实际上存在活map。然而,稍后在我们的研究中,培养phms-qpcr阳性的个别奶样品,且85.2%的液体培养物产生is900 qpcr阳性生物质;因此鉴于此,我们认为phms-qpcr阳性结果指示污染有活map的奶。
[0330]
与通过phms-qpcr测定的26.5%的btm阳性相对比,仅21(7.2%)/340个(未测试具有50个btm的一个批次,且一个奶样品酸臭且无法进行测试)btm样品通过map奶-elisa测试呈
‘
阳性’(九个的s/p比率》0.3)或
‘
疑似’(十二的s/p比率为0.2-0.3)。仅三个奶-elisa
‘
阳性’样品也测试呈phms-qpcr阳性(表a)。
[0331]
表a.340个散装罐奶样品的phms-qpcr结果和奶-elisa结果的2
×
2相依表。
[0332][0333]
κ=0.0046
‘
无一致性’,95%ci:-0.0463-0.0555,p(κ)=0.4281
[0334]
发现btm样品的phms-qpcr结果与奶-elisa结果之间不存在显著的正相关性或负相关性(r2=-0.02,p=0.520)。这可能并非出人意料的,这是因为两种测试检测不同事物;在phms-qpcr的情况下检测map抗原的排出,且在奶-elisa的情况下检测map抗体的存在。κ值(0.0046,95%ci:-0.0463-0.0555,p(κ)0.4281)指示btm的phms-qpcr结果与
‘
阳性’奶-elisa结果之间
‘
无一致性’(表a)。先前在一些国家中,奶-elisa已用以测试btm以用于map监测目的(nielsen和toft,2014;van weering等人,2007)。然而,总体上已确认,当应用于来自奶牛群内的个别动物的奶而非btm时(van weering等人2007),和当应用于测试来自大龄动物的奶时(kostoulas等人2013;wilson等人2010),奶-elisa测试可能是map感染状况的更可靠指示物。通过phms-qpcr测定检测的btm中的活map的存在与任一种其它奶记录结果(体细胞计数、总细菌计数(bactoscan)、乳脂%或蛋白质%)也不显著相关,由图19中的相关性矩阵说明。
[0335]
个别奶测试
[0336]
选择用于追踪测试来自个别动物的奶的四个奶牛群(农场a-d)是在研究的早期部分中指示其btm具有最高map负荷的七个北爱尔兰畜群之中。此个别奶测试的目的是双重的。首先,为了鉴定怀疑map感染的畜群内的哪些动物在其奶中和以何种数量排出细菌,且其次,为了确定当在个别奶牛水平下应用时,新型phms-qpcr测定结果与奶-elisa结果之间是否可能存在较好相关性。为了方便和速度起见,从挤奶室中的奶记录缸中收集测试的个别奶,因为个别奶通常将用于奶记录目的,而非在仔细手工清洁乳房之后收集。因此,我们不能排除在不同奶牛的奶之间携带map污染的可能性。
[0337]
表b.从在初始调查期间其散装罐奶具有最高map负荷的四个北爱尔兰奶牛场的奶牛收集的294个个别奶样品的phms-qpcr、奶-elisa和其它奶记录结果的概述。
[0338]
[0339][0340]
*仅对于农场d,对于先前冷冻且解冻的奶样品进行奶-elisa,这是因为dale farm与测试实验室之间的误会。
[0341]
上表b.概述了测试来自农场a-d的294个动物的个别奶的结果。phms-qpcr结果确认在所有四个农场存在在其奶中排出map的个别动物。在农场a和d,~17%的奶牛排出map到其奶中,且在农场b和c是~24%。奶-elisa结果指示在四个农场中的三个(除农场d外的所有)存在map阳性动物;农场b具有最高数量的测试奶-elisa阳性的奶牛(11/42,26.2%),且农场d不具有阳性结果和仅一个
‘
疑似’结果。然而,仅在农场d的情况下,奶-elisa测试必须对于先前冷冻的奶样品进行,这是由于dale farm与测试实验室之间的误会。因此,我们不能排除冷冻储存可能对于奶-elisa结果具有负面影响的可能性,如先前对于血清-elisa结果所报告(alinovi等人2009)。phms-qpcr阳性动物排出的活map的平均数量在农场a的6.7map/50ml奶到农场b的42.1map/50ml奶范围内。同样,这些map计数与当使用优化的pms-噬菌体测定测试时针对来自英国和北爱尔兰情形中的个别动物的奶所报告的数量一致(6-948pfu/50ml,foddai和grant 2017;8-94pfu/50ml,o’brien等人2018)。
[0342]
表c.来自农场a-d的个别动物的奶的phms-qpcr结果与奶-elisa结果之间的一致性。
[0343][0344]
统计分析(参见上表c)指示,对于个别奶,就btm而论,四个农场中的任一个的phms-qpcr结果与奶-elisa结果之间不存在显著的正相关性或负相关性(农场a、b、c和d的r2分别=0.22(p=0.080),-0.17(p=0.284),0.02(p=0.817)和0.13(p=0.300))。除了农场c之外,r2值高于btm的,且相关性p值接近农场a的统计显著性。phms-qpcr结果与奶-elisa结果之间的κ一致性也随着农场变化而变化,其中农场a结果显示
‘
普通一致性’,农场c结果显示
‘
略微一致性’,且农场b结果显示
‘
无一致性’(表c)。农场d结果的κ一致性可能未计算,这是由于elisa测试冷冻且解冻的奶可能影响奶-elisa结果的问题,如先前所提到。类似于btm结果,通过phms-qpcr检测的活map的存在与奶记录参数(泌乳数量、奶重量(kg)、乳脂%、蛋白质%或体细胞计数)中的任一个之间不存在显著相关性,如图20中的四个农场的相关性矩阵所示。
[0345]
在个别奶的情况下,对于第二个50ml等分试样的各phms-qpcr阳性奶样品(同时收集但冷冻储存在-20℃下直到需要为止)进行pms-培养,以便确认这些样品中活map的存在,且因此验证phms-qpcr阳性不是假阳性结果。在pozzato培养液中培养的61个phms-qpcr阳性的奶样品中,52个(85.2%)培养物在12周孵育期结束时产生is900 taqman qpcr测试呈阳性的团块,指示存在活map。仅应用液体培养物,且尚未分离纯map菌落。此较高百分比的is900 qpcr阳性培养物强烈表明,阳性phms-qpcr结果是奶样品中存在活map的真实指示,且并非是假阳性结果。
[0346]
就新型phms-qpcr测试可如何用作奶中活map的筛选测试来说,这可容易地添加到现有的测试范围中,所述测试应用于散装罐奶或来自个别动物的奶以用于奶加工商的奶记录目的。剩余的难处是beadretriever仪每次仅能够处理15个样品的局限性,意味着需要多轮来处理合理数量的奶样品(大概最大三轮,45个样品),以便在一个工作日内完成测定。确实存在较大容量的磁性分离仪(例如来自thermofisher scientific的kingfisher flex和来自qiagen的biosprint 96),其能够在单轮中处理多达96
×
1ml样品。然而,这些主要设计成用于dna提取且非细菌细胞分离目的。可能有定制软件方案来使这些仪器适合于map细胞分离和浓缩。当然,可以是手动地对于1.5ml eppendorf管、旋转混合器和合适的磁力架中的样品进行phms,这将有助于在一个工作日内处理如所希望的尽可能多的样品。然而,手动phms的限制将是其费力的性质、需要的塑料耗材的量增加和对捕获的珠粒-细胞复合物洗涤超过一次将可能是不可行的。还需要记住的是,在phms之后,在可以收集dna之前(在储存
在-80℃下过夜,之后在第二天进行is900 taqman qpcr之前),自然污染的奶样品需要4h的孵育期,因此在此情境下,手动phms-qpcr测定不再是一种一日测试。
[0347]
我们最近开发的针对奶中活map的phms-qpcr测定被证实具有比广泛使用的奶-elisa方法更高的map感染检测能力。本研究的结果明确证实,新型phms-qpcr测定可以是一种乳加工商可用的奶监测工具,因为其提供关于供应奶牛群和畜群内个别奶牛的map感染状况的信息,以及存在的活map数量的指示。出于奶监测目的,作为约氏病控制程序的一部分,或出于奶质量保证目的,举例来说,phms-qpcr测定结果将比奶-elisa结果更有意义,因为检测活map细胞(传染因子)而非简单地检测map的抗体。
[0348]
参考文献
[0349]
alinovi,c.,m.ward,t.lin,and c.wu.2009.sample handling substantially affects johne
′
s elisa.prev.vet.med.90:278-283.https://doi.org/10.1016/j.prevetmed.2009.04.004.
[0350]
animal health and welfare northern ireland(2014)a guide to johne’s disease for northern ireland farmers and vets.online:http://www.animalhealthni.com/johnes%20brochure%20a4.pdf last accessed 17 august 2020.
[0351]
barkema,h.w.,j.w.hesselink,s.l.b.mckenna,g.benedictus,and h.groenendaal.2010.global prevalence and economics of infection with mycobacterium avium subsp.paratuberculosis in ruminants.in:behr,m.a.,collins,d.,editors.paratuberculosis:organism,disease,control.wallingford,uk:cab international,pp.10-21.
[0352]
botsaris,g.,m.liapi,c.kakogiannis,c.e.r.dodd,and c.e.d.rees.2013.detection of mycobacterium avium subsp.paratuberculosis in bulk tank milk by combined phage-pcr assay:evidence that plaque number is a good predictor of map.int.j.food microbiol.164:76-80.https://doi.org/10.1016/j.ijfoodmicro.2013.03.023.
[0353]
bradner,l.,s.robbe-austerman,d.c.beitz,and j.r.stabel.2013.optimization of hexadecylpyridinium chloride decontamination for culture of mycobacterium avium subsp.paratuberculosis from milk.j.clin.microbiol.51(5):1575-1577.https://doi.org/10.1128/jcm.00333-13.
[0354]
butot,s.,m.ricchi,i.a.sevilla,l.michot,e.molina,m.tello,s.russo,n.arrigoni,j.m.garrido,and d.tomas.2019.estimation of the performance characteristics of analytical methods for mycobacterium avium subsp.paratuberculosis detection in dairy products.front.microbiol.10:509.https://doi.org/10.3389/fmicb.2019.00509.
[0355]
chiodini,r.j.,w.m.chamberlin,j.sarosiek,and r.w.mccallum.2012.crohn
′
s disease and the mycobacterioses:a quarter century later.causation or simple association?crit.rev.microbiol.38:52-93.https://doi.org/10.3109/1040841x.2011.638273.
[0356]
dundee,l.,i.r.grant,h.j.ball,and m.t.rowe.2001.comparative evaluation of four protocols for the isolation of mycobacterium avium ssp.paratuberculosis from milk.lett.appl.microbiol.33:173-177.https://doi.org/10.1046/j.1472-765x.2001.00979.x.
[0357]
foddai,a.,s.strain,r.h.whitlock,and i.r.grant.2011.application of a novel peptide-mediated phage assay for the detection of viable mycobacterium avium subsp.paratuberculosis to bovine bulk tank milk and feces samples.j.clin.microbiol.49:2017-2019.https://doi.org/10.1128/jcm.00429-11.
[0358]
foddai,a.c.g.,and i.r.grant.2015.an optimised milk testing protocol to ensure accurate enumeration of viable mycobacterium avium subsp.paratuberculosis by the pms-phage assay.int.dairy j.51:16-23.https://doi.org/10.1016/j.idairyj.2015.07.004.
[0359]
foddai,a.c.g.,and l.r.grant.2017.sensitive and specific detection of mycobacterium avium subsp.paratuberculosis in raw milk by the peptide-mediated magnetic separation(pms)-phage assay.j.appl.microbiol.122:1357-1367.https://doi.org/10.1111/jam.13425.
[0360]
foddai,a.c.g.,and l.r.grant.2020.a novel one-day phage-based test for rapid detection and enumeration of viable mycobacterium avium subsp.paratuberculosis in cows’milk.appl.microbiol.biotechnol,submitted but not yet published.
[0361]
gamberale,f.,g.pietrella,m.sala,p.scaramella,s.puccica,v.antognetti,n.arrigoni,m.ricchi,and a.cersini.2019.management of mycobacterium avium subsp.paratuberculosis in dairy farms:selection and evaluation of different dna extraction methods from bovine and buffaloes milk and colostrum for the establishment of a safe colostrum farm bank.microbiology open8:e875.https://doi.org/10.1002/mbo3.875.
[0362]
geraghty,t.,d.a.graham,p.mullowney,and s.j.more.2014.a review of bovine johne’s disease control activities in 6 endemically infected countries.prev.vet.med.116,1-11.https://doi.org/10.1016/j.prevetmed.2014.06.003.
[0363]
gerrard,z.e.,b.m.c.swift,g.botsaris,r.s.davidson,m.r.hutchings,j.n.huxley,and c.e.d.rees.2018.survival of mycobacterium avium subspecies paratuberculosis in retail pasteurised milk.food microbiol.74:57-63.https://doi.org/10.1016/j.fm.2018.03.004.
[0364]
giacometti,f.,a.serraino,g.finazzi,p.daminelli,m.n.losio,n.,arrigoni,s.piva,d.florio,r.riu,and r.g.zanoni.2012.sale of raw milk in northern italy:food safety implications and comparison of different analytical methodologies for detection of foodborne pathogens.foodborne pathog.dis.9:293-297.https://doi.org/10.1089/fpd.2011.1052.
[0365]
khol,j.l.,m.wassertheurer,e.sodoma,s.revilla-fern
á
ndez,j.damoser,e.m.d
ü
nser,u.kleb,and w.baumgartner.2013.long-term detection of mycobacterium avium subspecies paratuberculosis in individual and bulk tank milk from a dairy herd with a low prevalence of johne’s disease.j.dairy sci.96:3517-3524.https://doi.org/10.3168/jds.2012-6466.
[0366]
h.,m.ziller,f.gierke,and k.donat.2017.within-pool prevalence limits for the identification of paratuberculosis infected herds using antibody detection in pooled milk samples.berliner und m
ü
nchenerwochenschrift 130:34-41.https://doi.org/10.2376/0005-9366-16019.
[0367]
kostoulas,p.,w.j.browne,s.s.nielsen,and l.leontides.2013.bayesian mixture models for partially verified data:age-and stage-specific discriminatory power of an antibody elisa for paratuberculosis.prev.vet.med.111(3-4):200-205.https://doi.org/10.1016/j.prevetmed.2013.05.006.
[0368]
lavers,c.j.,h.w.barkema,i.r.dohoo,s.l.mckenna,and g.p.keefe.2014.evaluation of milk elisa for detection of mycobacterium avium subspecies paratuberculosis in dairy herds and association with within-herd prevalence.j.dairy sci.97:299-309.https://doi.org/10.3168/jds.2015-7101.
[0369]
lund,b.m.,g.w.gould,and a.m.rampling.2002.pasteurization of milk and the heat resistance of mycobacterium avium subsp.paratuberculosis:a critical review of the data.int.j.food microbiol.77:135-145.https://doi.org/10.1016/s0168-1605(02)00057-0.
[0370]
mcaloon,c.g.,m.l.doherty,p.whyte,l.o’grady,s.j.more,l.l.m.messam,m.good,p.mullowney,s.strain,and m.j.green.2016.bayesian estimation of prevalence of paratuberculosis in dairy herds enrolled in a voluntary johne’s disease control program in ireland.prev.vet.med.128:95-100.https://doi.org/10.1016/j.prevetmed.2016.04.014.
[0371]
mcaloon,c.g.,s.roche,c.ritter,h.w.barkema,p.whyte,s.j.more,l.o’grady,m.j.green,and m.l.doherty.2019.a review of paratuberculosis in dairy herds-part 2:on-farm control.vet.j.246:54-58.https://doi.org/10.1016/j.tvjl.2019.01.009.
[0372]
meyer,a.,c.g.mcaloon,j.a.tratalos,s.j.more,l.r.citer,d.a.graham,and e.s.g.sergeant.2019.modeling of alternative testing strategies to demonstrate freedom from mycobacterium avium ssp.paratuberculosis infection in test-negative dairy herds in the republic of ireland.j.dairy sci.102:1-16.https://doi.org/10.3168/jds.2018-14883.
[0373]
nielsen,s.s.,and n.toff.2008.ante mortem diagnosis of paratuberculosis:a review of accuracies of elisa,interferon-gamma assay and faecal culture techniques.vet.microbiol.129:217-255.https://doi.org/10.1016/j.vetmic.2007.12.011.
lrish dairy herds infected with mycobacterium avium subsp.paratuberculosis.j.dairy sci.102(3):2525-2538.https://doi.org/10.3168/jds.2018-15696.
[0383]
sidoti,f.,g.banche,s.astegiano,v.allizond,a.m.cuffini,and m.bergallo.2011.validation and standardization of is900 and f57real-time quantitative pcr assays for the specific detection and quantification of mycobacterium avium subsp.paratuberculosis.can.j.microbiol.57:347-354.https://doi.org/10.1139/w11-022.
[0384]
van weenng,h.,g.van schaik,a.der meulen,m.waal,p.franken,and k.van maanen.2007.diagnostic performance of the pourquier elisa for detection of antibodies against mycobacterium avium subspecies paratuberculosis in individual milk and bulk milk samples of dairy herds.vet.microbiol.125:49-58.https://doi.org/10.1016/j.vetmic.2007.05.010.
[0385]
waddell l.a.,a.rajic,k.d.c.and s.a.mcewen.2015.the zoonotic potential of mycobacterium avium ssp.paratuberculosis:a systematic review and meta-analyses of the evidence.epid.infect.143(15):3135-3157.https:lldoi.org/10.1017/s095026881500076x.
[0386]
weber,m.f.,a.g.nielen,j.velthuis,and h.j.w.van roermund.2008.milk quality assurance for paratuberculosis:simulation of within-herd infection dynamics and economics.vet.res.39:12.https://doi.org/10.1051/vetres:2007050.
[0387]
whittington,r.,k.donat,m.f.weber,d.kelton,s.s.nielsen,s.eisenberg,n.arrigoni,r.juste,j.l.s
á
ez,n.dhand,a,santi,a.michel,h.barkema,p.kralik,p.kostoulas,l.citer,f.griffin,r.barwell,m.a.s.moreira,i.slana,h.s.v.singh,h.s.yoo,g.ch
á
vez-gris,a.goodridge,m.ocepek,j.garrido,k.stevenson,m.collins,b.alonso,k.cirone,f.paolicchi,l.gavey,m.t.rahman,e.de marchin,w.van praet,c.bauman,g.fecteau,s.mckenna,m.salgado,j.fernandez-silva,r.dziedzinska,g.echeverr
í
a,j.v.thibault,v.fridriksdottir,a.derakhshandeh,m.haghkhah,l.ruocco,s.kawaji,e.momotani,c.heuer,s.norton,s.cadmus,a.agdestein,a.kampen,j.szteyn,j.e.schwan,g.caldow,s.strain,m.carter,s.wells,m.munyeme,r.wolf,r.gurung,c.verdugo,c.fourichon,t.yamamoto,s.thapaliya,e.di labio,m.ekgatat,a.gil,a.alesandre,j.piaggio,a.suanes,and j.h.de waard.2019.control of paratuberculosis:who,why and how.a review of 48countries.bmc vet.res.15:198.https://doi.org/10.1186/s12917-019-1943-4.
[0388]
wilson,d.j.,k.rood,p.biswas,and t.m.byrem.2010.herd-level prevalence of johne’s disease in utah and adjacent areas of the intermountain west as detected by a bulk-tank milk surveillance project.j.dairy sci.93(12):5792-5797.https://doi.org/10.3168/jds.2010-3481.
[0389]
本发明不限于本文描述的实施例,而是可在不脱离本发明范围的情况下进行修正或修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1