修饰蓝细菌、修饰蓝细菌的制造方法以及蛋白的制造方法与流程
1.本公开涉及将在菌体内产生的蛋白分泌至菌体外的蛋白的分泌生产率提高了的修饰蓝细菌、修饰蓝细菌的制造方法以及蛋白的制造方法。
背景技术:
2.在从化学工业到农渔畜牧业的广泛的产业领域中均要求不依赖于化石燃料且环境低负荷的物质生产方式。使用了微生物的物质生产由于能够在常温常压的环境下进行,并且随着近年来的基因操作技术的发展而变得能够生产广泛的化合物种类,因此作为满足上述要求的生产系统而受到关注。其中,由于蓝细菌及藻类等光合作用微生物将光作为能量源而能够将空气中的二氧化碳(co2)用作碳原料,因此作为碳中和的下一代的物质生产系统而特别受到期待。
3.例如,作为使用蓝细菌生产的物质,报告有乙醇(非专利文献1)、异丁醇(非专利文献2)、烷烃类(专利文献2)、脂肪酸(专利文献1)以及蛋白(非专利文献3)等。
4.另外,例如在非专利文献4中还公开了使蓝细菌表达蛋白的方法。
5.现有技术文献
6.专利文献
7.专利文献1:日本专利第6341676号公报
8.专利文献2:日本特开2015-109828号公报
9.非专利文献
10.非专利文献1:jason dexter and pengcheng fu,“metabolic engineering of cyanobacteria for ethanol production”,energy&environmental science,royal society of chemistry,2009,vol.2,pp.857-864
11.非专利文献2:shota atsumi et al.,“direct photosynthetic recycling of carbon dioxide to isobutyraldehyde”,nature biotechnology,nature publishing group,2009,vol.27,no.12,pp.1177-1180
12.非专利文献3:jie zhou et al.,“discovery of a super-strong promoter enable efficient production of heterologous proteins in cyanobacteria”,scientific reports,nature research,2014,vol.4,article no.4500
13.非专利文献4:andrew h.ng et al.,“fine-tuning of photoautotrophic protein production by combining promoters and neutral sites in the cyanobacterium synechocystis sp.strain pcc 6803”,applied and environmental microbiology,american society for microbiology,2015,vol.81,pp.6857-6863
技术实现要素:
14.发明所要解决的课题
15.但是,在上述现有技术中,使用蓝细菌难以高效地生产蛋白。
16.因此,本公开提供蛋白的分泌生产率提高了的修饰蓝细菌、修饰蓝细菌的制造方法、以及使用了修饰蓝细菌的蛋白的制造方法。
17.用于解决课题的手段
18.本公开的一个方式的修饰蓝细菌在蓝细菌中参与外膜与细胞壁的结合的蛋白的功能受到抑制或丧失。
19.发明效果
20.根据本公开的修饰蓝细菌及修饰蓝细菌的制造方法,能够提供蛋白的分泌生产率提高了的修饰蓝细菌。另外,根据本公开的蛋白的制造方法,能够高效地制造蛋白。
附图说明
21.图1是示意性地示出蓝细菌的细胞表层的图。
22.图2是实施例1的修饰蓝细菌的超薄切片的透射型电子显微镜观察图像。
23.图3是图2的虚线区域a的放大图像。
24.图4是实施例2的修饰蓝细菌的超薄切片的透射型电子显微镜图像。
25.图5是图4的虚线区域b的放大图像。
26.图6是比较例1的修饰蓝细菌的超薄切片的透射型电子显微镜图像。
27.图7是图6的虚线区域c的放大图像。
28.图8是表示实施例1、实施例2及比较例1的修饰蓝细菌在培养上清液中的蛋白量(n=3、误差条=sd)的图表。
具体实施方式
29.(成为本公开基础的见解)
30.蓝细菌(cyanobacteria,也称为蓝色细菌或蓝藻)是真细菌的一组,通过光合作用将水分解而产生氧,通过得到的能量将空气中的co2固定。需要说明的是,蓝细菌根据种类的不同,也可以固定空气中的氮(n2)。另外,作为蓝细菌的特性,已知生长快、光利用效率高,并且由于与其他藻类种类相比,基因操作更容易,因此在光合作用微生物中,关于蓝细菌的利用进行了活跃的研究开发。如上所述,作为使用了蓝细菌的物质生产的例子,报告了乙醇(非专利文献1)、异丁醇(非专利文献2)、烷烃类(专利文献2)以及脂肪酸(专利文献1)等燃料的生产。
31.另外,还进行了有关使用蓝细菌生产成为生物的营养源的物质的研究开发。例如,蛋白只能在生物中合成,因此认为作为为了简便且高效地生产蛋白而使用的生物种中的1种,利用光能和大气中的co2的光合作用微生物是有用的。
32.例如,在非专利文献3中记载了使用了蓝细菌集胞藻(synechocystis sp.)pcc 6803株的蛋白的生产方法。在该文献中,公开了用于使乙烯合成酶的基因的转录高效率地活化的启动子的碱基序列和用于增强翻译的核糖体结合序列。
33.另外,非专利文献4中公开了在将集胞藻pcc 6803株作为宿主表达重组蛋白的情况下,在该菌株所保持的质粒上的ns-pcc2区域插入编码蛋白的基因的方法。并报告了通过使用该方法,与在染色体dna(deoxyribonucleic acid,脱氧核糖核酸)上插入该基因的情况相比,重组蛋白的表达效率提高至约14倍。
34.然而,在上述现有技术中,为了回收在pcc 6803株的菌体内所产生的蛋白,需要将pcc 6803株的菌体破碎。因此,蛋白的回收很费功夫。另外,由于菌体内存在各种物质,因此有时需要除去这些物质以纯化目标蛋白。因此,蛋白的回收率降低。另外,每次生产蛋白时,都需要准备新的菌株,因此费功夫,生产成本也增加。如此,在上述的现有技术中,使用了蓝细菌的蛋白的生产效率仍处于低水平,期望开发出生产效率更高的技术。
35.因此,本发明人发现,通过使包覆蓝细菌的细胞壁的外膜部分地从细胞壁脱离,在蓝细菌的菌体内产生的蛋白变得容易分泌至菌体外。由此,能够在不破碎蓝细菌的菌体的情况下高效地回收分泌到菌体外的蛋白。另外,在回收蛋白后,还能够继续使用蓝细菌,因此生产效率提高。
36.因此,根据本公开,能够提供蛋白的分泌生产率提高了的修饰蓝细菌。另外,若对本公开的修饰蓝细菌进行培养,则还能够高效地制造蛋白。
37.(本公开的概要)
38.本公开的一个方式的概要如下。
39.本公开的一个方式的修饰蓝细菌在蓝细菌中参与外膜与细胞壁的结合的蛋白的功能受到抑制或丧失。
40.由此,在修饰蓝细菌中,细胞壁与外膜的结合(例如结合量及结合力)部分地降低,因此外膜变得容易从细胞壁部分地脱离。因此,在菌体内产生的蛋白变得容易漏出到外膜之外、即菌体外。因此,根据本公开的一个方式的修饰蓝细菌,能够提供蛋白的分泌生产率提高了的蓝细菌。另外,根据本公开的一个方式的修饰蓝细菌,由于不需要将菌体破碎来回收蛋白,因此在回收蛋白后,还能够重复使用修饰蓝细菌来产生蛋白。
41.例如,本公开的一个方式的修饰蓝细菌中,所述参与外膜与细胞壁的结合的蛋白可以是slh(surface layer homology,表层同源性)结构域保持型外膜蛋白和细胞壁-丙酮酸修饰酶中的至少1个。
42.由此,在修饰蓝细菌中,例如(i)与细胞壁结合的slh结构域保持型外膜蛋白及催化对细胞壁表面的结合糖链进行丙酮酸修饰的反应的酶(即细胞壁-丙酮酸修饰酶)中的至少1个的功能受到抑制或丧失,或者(ii)slh结构域保持型外膜蛋白和细胞壁-丙酮酸修饰酶中的至少1个的表达受到抑制。因此,外膜中的slh结构域保持型外膜蛋白的slh结构域与细胞壁表面的共价键型的糖链的结合(即结合量及结合力)降低。由此,在外膜与细胞壁的结合变弱的部分处,外膜变得容易从细胞壁脱离。因此,根据本公开的一个方式的修饰蓝细菌,外膜与细胞壁的结合降低,由此,外膜变得容易从细胞壁部分地脱离,因此在菌体内产生的蛋白变得容易漏出到菌体外。
43.例如,在本公开的一个方式的修饰蓝细菌中,所述slh结构域保持型外膜蛋白可以是由序列号1所示的氨基酸序列构成的slr1841、由序列号2所示的氨基酸序列构成的nies970_09470、由序列号3所示的氨基酸序列构成的anacy_3458、或者氨基酸序列的50%以上与这些中的任一个的slh结构域保持型外膜蛋白相同的蛋白。
44.由此,在修饰蓝细菌中,例如(i)上述序列号1~3所示的任一个的slh结构域保持型外膜蛋白或氨基酸序列的50%以上与这些中的任一个的slh结构域保持型外膜蛋白相同的蛋白的功能受到抑制或丧失,或者(ii)上述序列号1~3所示的任一个的slh结构域保持型外膜蛋白或氨基酸序列的50%以上与这些中的任一个的slh结构域保持型外膜蛋白相同
的蛋白的表达受到抑制。因此,在修饰蓝细菌中,(i)外膜中的slh结构域保持型外膜蛋白或与slh结构域保持型外膜蛋白具有同等功能的蛋白的功能受到抑制或丧失,或者(ii)外膜中的slh结构域保持型外膜蛋白或与slh结构域保持型外膜蛋白具有同等功能的蛋白的表达量降低。因此,根据本公开的一个方式的修饰蓝细菌,由于外膜用于与细胞壁结合的结合结构域(例如slh结构域)与细胞壁结合的结合量及结合力降低,因此外膜变得容易从细胞壁部分地脱离。
45.例如,在本公开的一个方式的修饰蓝细菌中,所述细胞壁-丙酮酸修饰酶可以是由序列号4所示的氨基酸序列构成的slr0688、由序列号5所示的氨基酸序列构成的synpcc7942_1529、由序列号6所示的氨基酸序列构成的anacy_1623、或者氨基酸序列的50%以上与这些中的任一个的细胞壁-丙酮酸修饰酶相同的蛋白。
46.由此,在修饰蓝细菌中,例如(i)上述序列号4~6所示的任一个的细胞壁-丙酮酸修饰酶或氨基酸序列的50%以上与这些中的任一个的细胞壁-丙酮酸修饰酶相同的蛋白的功能受到抑制或丧失,或者(ii)上述序列号4~6所示的任一个的细胞壁-丙酮酸修饰酶或氨基酸序列的50%以上与这些中的任一个的细胞壁-丙酮酸修饰酶相同的蛋白的表达受到抑制。因此,在修饰蓝细菌中,(i)细胞壁-丙酮酸修饰酶或与该酶具有同等功能的蛋白的功能受到抑制或丧失,或者(ii)细胞壁-丙酮酸修饰酶或与该酶具有同等功能的蛋白的表达量降低。由此,细胞壁表面的共价键型的糖链变得不易被丙酮酸修饰,因此细胞壁的糖链与外膜中的slh结构域保持型外膜蛋白的slh结构域结合的结合量及结合力降低。因此,在本公开的一个方式的修饰蓝细菌中,细胞壁表面的共价键型的糖链变得不易被丙酮酸修饰,因此细胞壁与外膜的结合力减弱,外膜变得容易从细胞壁部分地脱离。
47.例如,在本公开的一个方式的修饰蓝细菌中,表达所述参与外膜与细胞壁的结合的蛋白的基因可以缺失或失活。
48.由此,在修饰蓝细菌中,参与细胞壁与外膜的结合的蛋白的表达受到抑制,或者该蛋白的功能受到抑制或丧失,因此细胞壁与外膜的结合(所谓的结合量及结合力)部分地降低。其结果,在修饰蓝细菌中,外膜变得容易从细胞壁部分地脱离,因此在菌体内产生的蛋白变得容易漏出到外膜之外、即菌体外。因此,本公开的一个方式的修饰蓝细菌的蛋白的分泌生产率提高。另外,根据本公开的一个方式的修饰蓝细菌,由于不需要将菌体破碎来回收蛋白,因此在回收蛋白后,还能够重复使用修饰蓝细菌来产生蛋白。
49.例如,在本公开的一个方式的修饰蓝细菌中,表达所述参与外膜与细胞壁的结合的蛋白的基因可以是编码slh结构域保持型外膜蛋白的基因和编码细胞壁-丙酮酸修饰酶的基因中的至少1个。
50.由此,在修饰蓝细菌中,编码slh结构域保持型外膜蛋白的基因和编码细胞壁-丙酮酸修饰酶的基因中的至少1个基因缺失或失活。因此,在修饰蓝细菌中,例如(i)slh结构域保持型外膜蛋白和细胞壁-丙酮酸修饰酶中的至少1个的表达受到抑制,或者(ii)slh结构域保持型外膜蛋白和细胞壁-丙酮酸修饰酶中的至少1个的功能受到抑制或丧失。因此,外膜中的slh结构域保持型外膜蛋白的slh结构域与细胞壁表面的共价键型的糖链的结合(即结合量及结合力)降低。由此,在外膜与细胞壁的结合变弱的部分处,外膜变得容易从细胞壁脱离。因此,根据本公开的一个方式的修饰蓝细菌,外膜与细胞壁的结合降低,由此外膜变得容易从细胞壁部分地脱离,因此在菌体内产生的蛋白变得容易漏出到菌体外。
51.例如,在本公开的一个方式的修饰蓝细菌中,编码所述slh结构域保持型外膜蛋白的基因可以是由序列号7所示的碱基序列构成的slr1841、由序列号8所示的碱基序列构成的nies970_09470、由序列号9所示的碱基序列构成的anacy_3458、或者碱基序列的50%以上与这些中的任一个的基因相同的基因。
52.由此,在修饰蓝细菌中,编码上述序列号7~9所示的任一个的slh结构域保持型外膜蛋白的基因或与这些中的任一个的基因的碱基序列的50%以上相同的基因缺失或失活。因此,在修饰蓝细菌中,(i)上述中的任一个的slh结构域保持型外膜蛋白或与这些中的任一个蛋白具有同等功能的蛋白的表达受到抑制,或者(ii)上述中的任一个的slh结构域保持型外膜蛋白或与这些中的任一个蛋白具有同等功能的蛋白的功能受到抑制或丧失。因此,根据本公开的一个方式的修饰蓝细菌,由于外膜用于与细胞壁结合的结合结构域(例如slh结构域)的用于与细胞壁结合的结合量及结合力降低,因此外膜变得容易从细胞壁部分地脱离。
53.例如,在本公开的一个方式的修饰蓝细菌中,编码所述细胞壁-丙酮酸修饰酶的基因可以是由序列号10所示的碱基序列构成的slr0688、由序列号11所示的碱基序列构成的synpcc7942_1529、由序列号12所示的碱基序列构成的anacy_1623、或者碱基序列的50%以上与这些中的任一个的基因相同的基因。
54.由此,在修饰蓝细菌中,上述序列号10~12所示的任一个的编码细胞壁-丙酮酸修饰酶的基因或与这些中的任一个的编码酶的基因的碱基序列的50%以上相同的基因缺失或失活。因此,在修饰蓝细菌中,(i)上述任一个的细胞壁-丙酮酸修饰酶或与这些中的任一个的酶具有同等功能的蛋白的表达受到抑制,或者(ii)上述任一个的细胞壁-丙酮酸修饰酶或与这些中的任一个的酶具有同等功能的蛋白的功能受到抑制或丧失。由此,细胞壁表面的共价键型的糖链变得不易被丙酮酸修饰,因此细胞壁的糖链与外膜中的slh结构域保持型外膜蛋白的slh结构域结合的结合量及结合力降低。因此,在本公开的一个方式的修饰蓝细菌中,细胞壁4用于与外膜结合的糖链被丙酮酸修饰的量减少,因此细胞壁与外膜的结合力减弱,外膜变得容易从细胞壁部分地脱离。
55.另外,本公开的一个方式的修饰蓝细菌的制造方法包含使蓝细菌中参与外膜与细胞壁的结合的蛋白的功能受到抑制或丧失的步骤。
56.由此,所制造的修饰蓝细菌的细胞壁与外膜的结合(所谓的结合量及结合力)部分地降低,因此外膜变得容易从细胞壁部分地脱离。因此,在修饰蓝细菌中,菌体内产生的蛋白变得容易漏出到外膜之外(即菌体之外)。因此,根据本公开的一个方式的修饰蓝细菌的制造方法,能够提供蛋白的分泌生产率提高了的蓝细菌。另外,在所制造的修饰蓝细菌中,由于在菌体内产生的蛋白漏出到菌体外,因此不需要为了回收蛋白而破碎菌体。因此,根据本公开的一个方式的修饰蓝细菌的制造方法,能够提供即使回收蛋白也能够重复使用的利用效率高的修饰蓝细菌。
57.另外,本公开的一个方式的蛋白的制造方法包含对上述任一种修饰蓝细菌进行培养的步骤。
58.由此,由于能够回收漏出到修饰蓝细菌的菌体外的蛋白,因此不需要为了回收蛋白而从培养液中回收菌体而破碎菌体。另外,还可以在对修饰蓝细菌进行培养的同时回收蛋白。此外,由于在回收蛋白后还能够重复使用修饰蓝细菌,因此不需要在每次制造蛋白时
准备新的修饰蓝细菌。因此,根据本公开的一个方式的蛋白的制造方法,能够高效地制造蛋白。
59.以下,参照附图对实施方式具体地进行说明。
60.需要说明的是,以下说明的实施方式均表示总括性的或具体的例子。在以下的实施方式中示出的数值、材料、步骤、步骤的顺序等是一个例子,并不是为了限定本公开。另外,关于以下实施方式中的构成要素中的在表示最上位概念的独立权利要求中没有记载的构成要素,作为任意的构成要素进行说明。
61.另外,各图不一定是严格地进行图示的图。在各图中,对实质上相同的构成标注相同的附图标记,有时省略或简化重复的说明。
62.另外,下文中,数值范围并不是仅表示严格意义,还包括实质上同等的范围,例如对蛋白的量(例如数或浓度等)或其范围进行测量等。
63.另外,在本说明书中,菌体和细胞均表示1个蓝细菌的个体。
64.(实施方式)
65.[1.定义]
[0066]
本说明书中,碱基序列和氨基酸序列的同源性通过blast(basic local alignment search tool,基于局部比对算法的搜索工具)算法来计算。具体而言,通过用在ncbi(national center for biotechnology information,美国国立生物技术信息中心)(https://blast.ncbi.nlm.nih.gov/blast.cgi)的网页中可利用的blast程序进行成对(pair-wise)分析来计算。关于蓝细菌的基因及该基因所编码的蛋白的信息例如在上述ncbi数据库及cyanobase(http://genome.microbedb.jp/cyanobase/)中有公开。可以从这些数据库中获得目标蛋白的氨基酸序列和编码这些蛋白的基因的碱基序列。
[0067]
蓝细菌也被称为蓝藻或蓝色细菌,是通过叶绿素捕集光能,用得到的能量将水电解而产生氧,同时进行光合作用的原核生物的一组。蓝细菌富有多样性,例如在细胞形状方面,有集胞藻pcc 6803那样的单细胞性的种类和鱼腥藻(anabaena sp.)pcc 7120那样的多细胞相连而成的丝状性的种类。在生长环境方面,也有细长嗜热聚球藻(thermosynechococcus elongatus)那样的嗜热性的种类、细长聚球藻(synechococcus elongatus)那样的海洋性的种类、集胞藻属(synechocystis)那样的淡水性的种类。另外,还可举出许多如铜绿微囊藻(microcystis aeruginosa)那样具有气体囊泡并产生毒素的种类、以及不具有类囊体而在细胞膜中具有被称为聚光天线即藻胆体的蛋白的类囊体蓝藻(gloeobacter violaceus)那样具有独自的特征的种类。
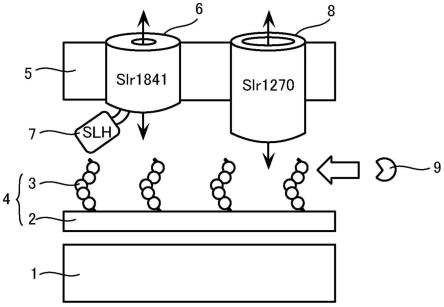
[0068]
图1是示意性地示出了蓝细菌的细胞表层的图。如图1所示,蓝细菌的细胞表层从内侧起依次由细胞膜(也称为内膜1)、肽聚糖2、以及形成细胞最外层的脂质膜即外膜5构成。在肽聚糖2上共价键合有由葡糖胺和甘露糖胺等构成的糖链3,另外在这些共价键型的糖链3上键合有丙酮酸(非专利文献5:jurgens and weckesser,1986,j.bacteriol.,168:568-573)。在本说明书中,包括肽聚糖2和共价键型的糖链3在内称为细胞壁4。另外,细胞膜(即内膜1)与外膜5之间的间隙存在被称为胞外质(periplasm)、参与蛋白的分解或立体结构的形成、脂质或核酸的分解、或者细胞外的营养素的摄入等的各种酶。
[0069]
slh结构域保持型外膜蛋白(例如图中的slr1841)由埋入到脂质膜(也称为外膜5)中的c末端侧区域和从脂质膜突出的n末端侧的slh结构域7构成,广泛地分布于属于作为蓝
细菌和革兰氏阴性细菌的一组的厚壁菌(negativicutes)纲的细菌中(非专利文献6:kojima et al.,2016,biosci.biotech.biochem.,10:1954-1959)。埋入到脂质膜(即外膜5)中的区域形成用于使亲水性物质能够透过外膜的通道,另一方面,slh结构域7具有与细胞壁4结合的功能(非专利文献7:kowata et al.,2017,j.bacteriol.,199:e00371-17)。为了使slh结构域7与细胞壁4结合,需要用丙酮酸修饰肽聚糖2中的共价键型的糖链3(kojima et al.,2016,j.biol.chem.,291:20198-20209)。作为编码slh结构域保持型外膜蛋白6的基因的例子,可举出集胞藻pcc 6803所保持的slr1841或slr1908、或鱼腥藻90所保持的oprb等。
[0070]
催化肽聚糖2中的共价键型的糖链3的丙酮酸修饰反应的酶(以下称为细胞壁-丙酮酸修饰酶9)是在革兰氏阳性菌炭疽杆菌(bacillus anthracis)中鉴定出的,被命名为csab(非专利文献8:mesnage et al.,2000,embo j.,19:4473-4484)。在公开了基因组碱基序列的蓝细菌中,多数种类保持有编码与csab的氨基酸序列的同源性为30%以上的同源蛋白的基因。作为例子,可举出集胞藻pcc 6803所保持的slr0688或聚球藻(synechococcus sp.)7502所保持的synpcc7502_03092等。
[0071]
在蓝细菌中,通过光合作用固定的co2经过多阶段的酶反应被转换为各种氨基酸。将它们作为原料,在蓝细菌的细胞质内合成蛋白。在这些蛋白中,既存在在细胞质内发挥功能的蛋白,也存在从细胞质被输送至胞外质而在胞外质内发挥功能的蛋白。但是,迄今为止在蓝细菌中尚没有报告过将蛋白主动分泌到细胞外的情况。
[0072]
由于蓝细菌具有较高的光合作用能力,因此不一定需要将有机物作为营养成分从外部摄入。因此,如图1的有机物通道蛋白8(例如slr1270)那样,蓝细菌在外膜5仅具有非常微小的使有机物透过的通道蛋白。例如,在集胞藻pcc 6803中,使有机物透过的有机物通道蛋白8仅存在外膜5的总蛋白量的约4%。另一方面,蓝细菌为了高效地将生长所需的无机离子类摄入到细胞内,如图1的slh结构域保持型外膜蛋白6(例如slr1841)那样,在外膜5中具有大量仅使无机离子类透过的离子通道蛋白。例如,在集胞藻pcc 6803中,使无机离子透过的离子通道蛋白占外膜5的总蛋白量的约80%。
[0073]
如此,认为由于在蓝细菌中,使外膜5中的蛋白等有机物透过的通道非常少,因此难以将在菌体内产生的蛋白主动地分泌至菌体外。
[0074]
[2.修饰蓝细菌]
[0075]
接着,参照图1对本实施方式的修饰蓝细菌进行说明。
[0076]
本实施方式的修饰蓝细菌的在蓝细菌中参与外膜5与细胞壁4的结合的蛋白(以下也称为结合相关蛋白)的功能受到抑制或丧失。由此,在修饰蓝细菌中,由于外膜5与细胞壁4的结合(例如结合量及结合力)部分地降低,因此外膜5容易从细胞壁4部分地脱离。因此,修饰蓝细菌的将菌体内产生的蛋白分泌至菌体外的蛋白的分泌生产率提高。另外,由于不需要将菌体破碎来回收蛋白,因此在回收蛋白后,还可以重复使用修饰蓝细菌来产生蛋白。需要说明的是,在本说明书中,将修饰蓝细菌在菌体内产出蛋白的情况称为产生,将所产生的蛋白分泌至菌体外的情况称为分泌生产。
[0077]
参与外膜5与细胞壁4的结合的蛋白例如可以是slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个。在本实施方式中,修饰蓝细菌的例如slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个蛋白的功能受到抑制或丧失。例如,在修
饰蓝细菌中,(i)slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个的功能可以受到抑制或丧失,(ii)与细胞壁4结合的slh结构域保持型外膜蛋白6的表达、以及催化细胞壁4的表面的结合糖链的丙酮酸修饰反应的酶(即细胞壁-丙酮酸修饰酶9)的表达中的至少1个可以受到抑制。由此,外膜5中的slh结构域保持型外膜蛋白6的slh结构域7与细胞壁4的表面的共价键型的糖链3的结合(即结合量及结合力)降低。因此,在这些结合变弱的部分,外膜5容易从细胞壁4脱离。通过外膜5从细胞壁4部分地脱离,修饰蓝细菌的细胞内,特别是存在于胞外质中的蛋白变得容易漏出到细胞外(外膜5之外)。
[0078]
如上所述,由于蓝细菌具有较高的光合作用能力,因此不一定需要将有机物作为营养成分从外部摄入。因此,对于蓝细菌的培养而言,只要有光、空气、水以及微量的无机物即可,蓝细菌通过外膜5的离子通道将无机物摄入到细胞内,在细胞内产生蛋白。特别是,在外膜5与细胞壁4之间的空隙的胞外质中存在有各种蛋白。在本实施方式的修饰蓝细菌中,参与外膜5与细胞壁4的结合的蛋白的功能受到抑制或丧失。其结果,外膜5容易从细胞壁4部分地剥离。然后,胞外质内的蛋白从外膜5的剥离部分露出到培养液中。由此,修饰蓝细菌的将在菌体内产生的蛋白分泌至菌体外的蛋白的分泌生产率提高。
[0079]
以下,对因slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个结合相关蛋白的功能受到抑制而修饰为外膜5部分地从细胞壁4脱离的蓝细菌更具体地进行说明。
[0080]
使成为本实施方式的修饰蓝细菌的亲本微生物的slh结构域保持型外膜蛋白6的表达和细胞壁-丙酮酸修饰酶9的表达中的至少1个抑制或丧失之前的蓝细菌(以下称为亲本蓝细菌)的种类没有特别限制,可以是任意种类的蓝细菌。例如,亲本蓝细菌可以是集胞藻(synechocystis)属、聚球藻(synechococcus)属、鱼腥藻(anabaena)属或嗜热聚球藻(thermosynechococcus)属,其中,可以是集胞藻(synechocystis sp.)pcc6803、聚球藻(synechococcus sp)pcc 7942或嗜热聚球藻(thermosynechococcus elongatus)bp-1。
[0081]
这些亲本蓝细菌中的slh结构域保持型外膜蛋白6和催化细胞壁-丙酮酸修饰反应的酶(即细胞壁-丙酮酸修饰酶9)的氨基酸序列、编码这些结合相关蛋白的基因的碱基序列、以及该基因在染色体dna或质粒上的位置可以通过上述ncbi数据库和cyanobase来确认。
[0082]
需要说明的是,本实施方式的修饰蓝细菌中功能受到抑制或丧失的slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9只要亲本蓝细菌保有,则可以是任意的亲本蓝细菌的蛋白或酶,不受编码它们的基因的存在部位(例如染色体dna上或质粒上)的限制。
[0083]
例如,slh结构域保持型外膜蛋白6在亲本蓝细菌为集胞藻(synechocystis)属的情况下,可以是slr1841、slr1908、或slr0042等,在亲本蓝细菌为聚球藻(synechococcus)属的情况下,可以是nies970_09470等,在亲本蓝细菌为鱼腥藻(anabaena)属的情况下,可以是anacy_5815或anacy_3458等,在亲本蓝细菌为微囊藻(microcystis)属的情况下,可以是a0a0f6u6f8_micae等,在亲本蓝细菌为蓝丝菌(cyanothece)属的情况下,可以是a0a3b8xx12_9cyan等,在亲本蓝细菌为瘦鞘丝藻(leptolyngbya)属的情况下,可以是a0a1q8ze23_9cyan等,在亲本蓝细菌为眉藻(calothrix)属的情况下,可举出a0a1z4r6u0_9cyan,在亲本蓝细菌为念珠藻(nostoc)属的情况下,可以是a0a1c0vg86_9noso等,在亲本蓝细菌为固氮蓝藻(crocosphaera)属的情况下,可以是b1wrn6_cros5等,在亲本蓝细菌为
宽球藻(pleurocapsa)属的情况下,可以是k9tae4_9cyan等。
[0084]
更具体而言,slh结构域保持型外膜蛋白6可以是例如集胞藻pcc6803的slr1841(序列号1)、聚球藻nies-970的nies970_09470(序列号2)、柱孢鱼腥蓝细菌(anabaena cylindrica)pcc 7122的anacy_3458(序列号3)等。另外,也可以是氨基酸序列的50%以上与这些slh结构域保持型外膜蛋白6相同的蛋白。
[0085]
由此,在修饰蓝细菌中,例如可以是(i)上述序列号1~3所示的任一个slh结构域保持型外膜蛋白6或氨基酸序列的50%以上与这些中的任一个slh结构域保持型外膜蛋白6相同的蛋白的功能受到抑制或丧失,也可以是(ii)上述序列号1~3所示的任一个slh结构域保持型外膜蛋白6或氨基酸序列的50%以上与这些中的任一个slh结构域保持型外膜蛋白6相同的蛋白的表达受到抑制。因此,在修饰蓝细菌中,(i)外膜5中的slh结构域保持型外膜蛋白6或与slh结构域保持型外膜蛋白6具有同等功能的蛋白的功能受到抑制或丧失,或者(ii)外膜5中的slh结构域保持型外膜蛋白6或与slh结构域保持型外膜蛋白6具有同等功能的蛋白的表达量降低。因此,在本实施方式的修饰蓝细菌中,由于外膜5用于与细胞壁4结合的结合结构域(例如slh结构域7)与细胞壁4结合的结合量及结合力降低,因此外膜5变得容易从细胞壁4部分地脱离。
[0086]
通常认为,如果蛋白的氨基酸序列的30%以上相同,则蛋白的立体结构的同源性高,因此与该蛋白具有同等功能的可能性高。因此,作为功能受到抑制或丧失的slh结构域保持型外膜蛋白6,例如可以是由与上述序列号1~3所示的slh结构域保持型外膜蛋白6中的任一个的氨基酸序列具有40%以上、优选50%以上、更优选60%以上、进一步优选70%以上、更进一步优选80%以上、另外优选90%以上的同源性的氨基酸序列构成、且具有与细胞壁4的共价键型的糖链3结合的功能的蛋白或多肽。
[0087]
另外,例如,细胞壁-丙酮酸修饰酶9在亲本蓝细菌为集胞藻(synechocystis)属的情况下,可以是slr0688等,在亲本蓝细菌为聚球藻(synechococcus)属的情况下,可以是syn7502_03092或synpcc7942_1529等,在亲本蓝细菌为鱼腥藻(anabaena)属的情况下,可以是ana_c20348或anacy_1623等,在亲本蓝细菌为微囊藻(microcystis)属的情况下,可以是csab(ncbi的登录id:tru80220)等,在亲本蓝细菌为蓝丝菌(cyanothece)属的情况下,可以是csab(ncbi的登录id:wp_107667006.1)等,在亲本蓝细菌为螺旋藻(spirulina)属的情况下,可以是csab(ncbi的登录id:wp_026079530.1)等,在亲本蓝细菌为眉藻(calothrix)属的情况下,可以是csab(ncbi的登录id:wp_096658142.1)等,在亲本蓝细菌为念珠藻(nostoc)属的情况下,可以是csab(ncbi的登录id:wp_099068528.1)等,在亲本蓝细菌为固氮蓝藻(crocosphaera)属的情况下,可以是csab(ncbi的登录id:wp_012361697.1)等,在亲本蓝细菌为宽球藻(pleurocapsa)属的情况下,可以是csab(ncbi的登录id:wp_036798735)等。
[0088]
更具体而言,细胞壁-丙酮酸修饰酶9例如可以是集胞藻pcc 6803的slr0688(序列号4)、聚球藻pcc 7942的synpcc7942_1529(序列号5)、或柱孢鱼腥蓝细菌(anabaena cylindrica)pcc 7122的anacy_1623(序列号6)等。另外,也可以是氨基酸序列的50%以上与这些细胞壁-丙酮酸修饰酶9相同的蛋白。
[0089]
由此,在修饰蓝细菌中,例如(i)上述序列号4~6所示的任一个细胞壁-丙酮酸修饰酶9或氨基酸序列的50%以上与这些中的任一个细胞壁-丙酮酸修饰酶9相同的蛋白的功
能受到抑制或丧失,或者(ii)上述序列号4~6所示的任一个细胞壁-丙酮酸修饰酶9或氨基酸序列的50%以上与这些中的任一个细胞壁-丙酮酸修饰酶9相同的蛋白的表达受到抑制。因此,在修饰蓝细菌中,(i)细胞壁-丙酮酸修饰酶9或与该酶具有同等功能的蛋白的功能受到抑制或丧失,或者(ii)细胞壁-丙酮酸修饰酶9或与该酶具有同等功能的蛋白的表达量降低。由此,细胞壁4的表面的共价键型的糖链3变得不易被丙酮酸修饰,因此细胞壁4的糖链3与外膜5中的slh结构域保持型外膜蛋白6的slh结构域7结合的结合量及结合力降低。因此,在本实施方式的修饰蓝细菌中,细胞壁4的表面的共价键型的糖链3变得不易被丙酮酸修饰,因此细胞壁4与外膜5的结合力减弱,外膜5变得容易从细胞壁4部分地脱离。
[0090]
另外,如上所述,认为若蛋白的氨基酸序列的30%以上相同,则与该蛋白具有同等功能的可能性高。因此,作为功能受到抑制或丧失的细胞壁-丙酮酸修饰酶9,例如可以是由与上述序列号4~6所示的细胞壁-丙酮酸修饰酶9中的任一个的氨基酸序列具有40%以上、优选50%以上、更优选60%以上、进一步优选70%以上、更进一步优选80%以上、另外优选90%以上的同源性的氨基酸序列构成、且具有催化用丙酮酸修饰细胞壁4的肽聚糖2的共价键型的糖链3的反应的功能的蛋白或多肽。
[0091]
另外,在本说明书中,使slh结构域保持型外膜蛋白6的功能受到抑制或丧失是指使该蛋白与细胞壁4的结合能力受到抑制或丧失、使该蛋白向外膜5的输送受到抑制或丧失、或者使该蛋白嵌入外膜5而发挥功能的能力受到抑制或丧失。
[0092]
需要说明的是,使细胞壁-丙酮酸修饰酶9的功能受到抑制或丧失是指使该蛋白的用丙酮酸修饰细胞壁4的共价键型的糖链3的功能受到抑制或丧失。
[0093]
作为使这些蛋白的功能受到抑制或丧失的手段,只要是通常用于蛋白的功能的抑制或丧失的手段,就没有特别限定。该手段例如可以是使编码slh结构域保持型外膜蛋白6的基因和编码细胞壁-丙酮酸修饰酶9的基因缺失或失活、抑制这些基因的转录、抑制这些基因的转录产物的翻译、或给予特异性地抑制这些蛋白的抑制剂等。
[0094]
在本实施方式中,也可以是修饰蓝细菌的使参与外膜5与细胞壁4的结合的蛋白表达的基因缺失或失活。由此,在修饰蓝细菌中,由于参与细胞壁4与外膜5的结合的蛋白的表达受到抑制,或者该蛋白的功能受到抑制或丧失,因此细胞壁4与外膜5的结合(所谓的结合量及结合力)部分地降低。其结果,在修饰蓝细菌中,外膜5变得容易从细胞壁4部分地脱离,因此在菌体内产生的蛋白变得容易漏出到外膜5之外、即菌体外。因此,本实施方式的修饰蓝细菌的将在菌体内产生的蛋白分泌至菌体外的蛋白的分泌生产率提高。另外,由于不需要将菌体破碎来回收蛋白,因此在回收蛋白后,还可以重复使用修饰蓝细菌来产生蛋白。
[0095]
使参与外膜5与细胞壁4的结合的蛋白表达的基因例如可以是编码slh结构域保持型外膜蛋白6的基因和编码细胞壁-丙酮酸修饰酶9的基因中的至少1个。在修饰蓝细菌中,编码slh结构域保持型外膜蛋白6的基因和编码细胞壁-丙酮酸修饰酶9的基因中的至少1个基因缺失或失活。因此,在修饰蓝细菌中,例如(i)slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个的表达受到抑制,或者(ii)slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个的功能受到抑制或丧失。因此,外膜5中的slh结构域保持型外膜蛋白6的slh结构域7与细胞壁4的表面的共价键型的糖链3的结合(即结合量及结合力)降低。由此,在外膜5与细胞壁4的结合变弱的部分,外膜5变得容易从细胞壁4脱离。因此,根据本实施方式的修饰蓝细菌,由于外膜5与细胞壁4的结合降低,外膜5变得容易从细胞壁4
部分地脱离,因此在菌体内产生的蛋白变得容易漏出到菌体外。
[0096]
在本实施方式中,为了使蓝细菌中的slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个的功能受到抑制或丧失,例如可以使编码slh结构域保持型外膜蛋白6的基因和编码细胞壁-丙酮酸修饰酶9的基因中的至少1个的转录受到抑制。
[0097]
例如,编码slh结构域保持型外膜蛋白6的基因在亲本蓝细菌为集胞藻(synechocystis)属的情况下,可以是slr1841、slr1908或slr0042等,在亲本蓝细菌为聚球藻(synechococcus)属的情况下,可以是nies970_09470等,在亲本蓝细菌为鱼腥藻(anabaena)属的情况下,可以是anacy_5815或anacy_3458等,在亲本蓝细菌为微囊藻(microcystis)属的情况下,可以是a0a0f6u6f8_micae等,在亲本蓝细菌为蓝丝菌(cyanothece)属的情况下,可以是a0a3b8xx12_9cyan等,在亲本蓝细菌为瘦鞘丝藻(leptolyngbya)属的情况下,可以是a0a1q8ze23_9cyan等,在亲本蓝细菌为眉藻(calothrix)属的情况下,可以是a0a1z4r6u0_9cyan等,在亲本蓝细菌为念珠藻(nostoc)属的情况下,可以是a0a1c0vg86_9noso等,在亲本蓝细菌为固氮蓝藻(crocosphaera)属的情况下,可以是b1wrn6_cros5等,在亲本蓝细菌为宽球藻(pleurocapsa)属的情况下,可以是k9tae4_9cyan等。这些基因的碱基序列可以从上述ncbi数据库或cyanobase获得。
[0098]
更具体而言,编码slh结构域保持型外膜蛋白6的基因可以是集胞藻pcc 6803的slr1841(序列号7)、聚球藻nies-970的nies970_09470(序列号8)、柱孢鱼腥蓝细菌(anabaena cylindrica)pcc 7122的anacy_3458(序列号9)、或者氨基酸序列的50%以上与这些基因相同的基因。
[0099]
由此,在修饰蓝细菌中,编码上述序列号7~9所示的任一个slh结构域保持型外膜蛋白6的基因或与这些中的任一个的基因的碱基序列的50%以上相同的基因缺失或失活。因此,在修饰蓝细菌中,(i)上述任一个slh结构域保持型外膜蛋白6或与这些中的任一个蛋白具有同等功能的蛋白的表达受到抑制,或者(ii)上述任一个slh结构域保持型外膜蛋白6或与这些中的任一个蛋白具有同等功能的蛋白的功能受到抑制或丧失。因此,在本实施方式的修饰蓝细菌中,由于外膜5用于与细胞壁4结合的结合结构域(例如slh结构域7)与细胞壁4结合的结合量及结合力降低,因此外膜5变得容易从细胞壁4部分地脱离。
[0100]
如上所述,如果蛋白的氨基酸序列的30%以上相同,则与该蛋白具有同等功能的可能性高。因此,认为如果编码蛋白的基因的碱基序列的30%以上相同,则表达与该蛋白具有同等功能的蛋白的可能性高。因此,作为编码功能受到抑制或丧失的slh结构域保持型外膜蛋白6的基因,例如可以是由与编码上述序列号7~9所示的slh结构域保持型外膜蛋白6的基因中的任一个的碱基序列具有40%以上、优选50%以上、更优选60%以上、进一步优选70%以上、更进一步优选80%以上、另外优选90%以上的同源性的碱基序列构成、且编码具有与细胞壁4的共价键型的糖链3结合的功能的蛋白或多肽的基因。
[0101]
另外,例如编码细胞壁-丙酮酸修饰酶9的基因在亲本蓝细菌为集胞藻(synechocystis)属的情况下,可以是slr0688等,在亲本蓝细菌为聚球藻(synechococcus)属的情况下,可以是syn7502_03092或synpcc7942_1529等,在亲本蓝细菌为鱼腥藻(anabaena)属的情况下,可以是ana_c20348或anacy_1623等,在亲本蓝细菌为微囊藻(microcystis)属的情况下,可以是csab(ncbi的登录id:tru80220)等,在亲本蓝细菌为cynahothese属的情况下,可以是csab(ncbi的登录id:wp_107667006.1)等,在亲本蓝细菌
为螺旋藻(spirulina)属的情况下,可以是csab(ncbi的登录id:wp_026079530.1)等,在亲本蓝细菌为眉藻(calothrix)属的情况下,可以是csab(ncbi的登录id:wp_096658142.1)等,在亲本蓝细菌为念珠藻(nostoc)属的情况下,可以是csab(ncbi的登录id:wp_099068528.1)等,在亲本蓝细菌为固氮蓝藻(crocosphaera)属的情况下,可以是csab(ncbi的登录id:wp_012361697.1)等,在亲本蓝细菌为宽球藻(pleurocapsa)属的情况下,可以是csab(ncbi的登录id:wp_036798735)等。这些基因的碱基序列可以从上述ncbi数据库或cyanobase获得。
[0102]
更具体而言,编码细胞壁-丙酮酸修饰酶9的基因可以是集胞藻pcc6803的slr0688(序列号10)、聚球藻pcc 7942的synpcc 7942_1529(序列号11)、或柱孢鱼腥蓝细菌(anabaena cylindrica)pcc 7122的anacy_1623(序列号12)。另外,也可以是碱基序列的50%以上与这些基因相同的基因。
[0103]
由此,在修饰蓝细菌中,编码上述序列号10~12所示的任一个的细胞壁-丙酮酸修饰酶9的基因或50%以上与编码这些中的任一个的酶的基因的碱基序列相同的基因缺失或失活。因此,在修饰蓝细菌中,(i)上述任一个的细胞壁-丙酮酸修饰酶9或与这些中的任一个的酶具有同等功能的蛋白的表达受到抑制,或者(ii)上述任一个的细胞壁-丙酮酸修饰酶9或与这些中的任一个的酶具有同等功能的蛋白的功能受到抑制或丧失。由此,细胞壁4的表面的共价键型的糖链3变得不易被丙酮酸修饰,因此细胞壁4的糖链3与外膜5中的slh结构域保持型外膜蛋白6的slh结构域7结合的结合量及结合力降低。因此,在本实施方式的修饰蓝细菌中,细胞壁4用于与外膜5结合的糖链3被丙酮酸修饰的量减少,因此细胞壁4与外膜5的结合力减弱,外膜5变得容易从细胞壁4部分地脱离。
[0104]
如上所述,认为如果编码蛋白的基因的碱基序列的30%以上相同,则表达与该蛋白具有同等功能的蛋白的可能性高。因此,作为编码功能受到抑制或丧失的细胞壁-丙酮酸修饰酶9的基因,例如可以是由与上述序列号10~12所示的编码细胞壁-丙酮酸修饰酶9的基因中的任一个的碱基序列具有40%以上、优选50%以上、更优选60%以上、进一步优选70%以上、更进一步优选80%以上、再进一步优选90%以上的同源性的碱基序列构成,且编码具有催化用丙酮酸修饰细胞壁4的肽聚糖2的共价键型的糖链3的反应的功能的蛋白或多肽的基因。
[0105]
[3.修饰蓝细菌的制造方法]
[0106]
接着,对本实施方式的修饰蓝细菌的制造方法进行说明。修饰蓝细菌的制造方法包含使在蓝细菌中参与外膜5与细胞壁4的结合的蛋白的功能受到抑制或丧失的步骤。
[0107]
在本实施方式中,参与外膜5与细胞壁4的结合的蛋白例如可以是slh结构域保持型外膜蛋白6和细胞壁-丙酮酸修饰酶9中的至少1个。
[0108]
需要说明的是,作为使蛋白的功能受到抑制或丧失的手段,没有特别限定,例如可以是使编码slh结构域保持型外膜蛋白6的基因和编码细胞壁-丙酮酸修饰酶9的基因缺失或失活、抑制这些基因的转录、抑制这些基因的转录产物的翻译、或给予特异性地抑制这些蛋白的抑制剂等。
[0109]
使上述基因缺失或失活的手段例如可以是针对该基因的碱基序列上的1个以上碱基的突变的导入、针对该碱基序列的向其他碱基序列的替换或其他碱基序列的插入、或者该基因的碱基序列的一部分或全部的删除等。
[0110]
抑制上述基因的转录的手段例如可以是针对该基因的启动子区域的突变导入、向其他碱基序列的替换或其他碱基序列的插入所导致的该启动子的失活、或crispr干扰法(非专利文献9:yao et al.,acs synth.biol.,2016,5:207-212)等。上述突变导入、或碱基序列的替换或插入的具体方法例如可以是紫外线照射、部位特异性突变导入、或同源重组法等。
[0111]
另外,抑制上述基因的转录产物的翻译的手段例如可以是rna(核糖核酸)干扰法等。
[0112]
通过使用以上的任一手段,可以使蓝细菌中的参与外膜5与细胞壁4的结合的蛋白的功能受到抑制或丧失来制造修饰蓝细菌。
[0113]
由此,通过本实施方式的制造方法制造的修饰蓝细菌的细胞壁4与外膜5的结合(即结合量及结合力)部分地减少,因此外膜5变得容易从细胞壁4部分地脱离。因此,在修饰蓝细菌中,菌体内产生的蛋白变得容易漏出到外膜5之外(即菌体之外)。因此,根据本实施方式的修饰蓝细菌的制造方法,能够提供蛋白的分泌生产率提高了的修饰蓝细菌。
[0114]
另外,在通过本实施方式的制造方法制造的修饰蓝细菌中,在菌体内产生的蛋白漏出到菌体外,因此不需要为了回收蛋白而破碎菌体。例如,只要在适当的条件下培养修饰蓝细菌,接着回收分泌到培养液中的蛋白即可,因此还能够一边培养修饰蓝细菌一边回收培养液中的蛋白。因此,如果使用通过本制造方法得到的修饰蓝细菌,则能够实施高效的微生物蛋白生产。因此,根据本实施方式的修饰蓝细菌的制造方法,能够提供在回收蛋白后还能够重复使用的利用效率高的修饰蓝细菌。
[0115]
需要说明的是,通过本实施方式的修饰蓝细菌的制造方法制造的修饰蓝细菌例如将肽酶或磷酸酶等主要是原本存在于胞外质中的蛋白组分泌到细胞外。在本实施方式中,例如,通过对编码如存在于胞外质中的蛋白组那样原本在蓝细菌的细胞内产生的蛋白的基因进行修饰,并替换为编码其他蛋白的基因,也能够使修饰蓝细菌生产所希望的蛋白。因此,根据本实施方式的修饰蓝细菌的制造方法,还能够提供能够简便且高效地产生所希望的蛋白的修饰蓝细菌。
[0116]
[4.蛋白的制造方法]
[0117]
接着,对本实施方式的蛋白的制造方法进行说明。本实施方式的蛋白的制造方法包含培养上述修饰蓝细菌的步骤。
[0118]
蓝细菌的培养通常可以基于使用了bg-11培养基(参照表2)的液体培养或其变通方法来实施。因此,修饰蓝细菌的培养也可以同样地实施。另外,作为用于制造蛋白的蓝细菌的培养期间,只要是能够在菌体充分增殖的条件下以高浓度蓄积蛋白的方式进行的期间即可,例如可以是1~3天,也可以是4~7天。另外,培养方法例如可以是通气搅拌培养或振荡培养。
[0119]
通过在上述条件下进行培养,修饰蓝细菌在菌体内产生蛋白,并将该蛋白分泌到培养液中。回收被分泌到培养液中的蛋白时,可以通过对培养液进行过滤或离心分离等,从培养液中除去细胞(所谓的菌体)等固体成分,回收培养上清液。根据本实施方式的蛋白的制造方法,由于蛋白被分泌到修饰蓝细菌的细胞外,因此不需要为了回收蛋白而破碎细胞。因此,能够重复使用蛋白回收后残留的修饰蓝细菌来进行蛋白的制造。
[0120]
需要说明的是,分泌到培养液中的蛋白的回收方法并不限于上述的例子,也可以
一边培养修饰蓝细菌一边回收培养液中的蛋白。例如,也可以通过使用使蛋白透过的透过膜来回收从透过膜透过的蛋白。在该情况下,也可以将从透过膜透过的蛋白作为营养源,培养乳酸菌等有用微生物。这样,能够一边培养修饰蓝细菌一边回收培养液中的蛋白,因此不需要从培养液中除去修饰蓝细菌的菌体的处理。因此,能够更简便且高效地制造蛋白。
[0121]
另外,由于不需要从培养液中回收菌体的处理和菌体的破碎处理,因此能够降低修饰蓝细菌受到的损伤和应激。因此,修饰蓝细菌的蛋白的分泌生产率不易降低,能够更长期地使用修饰蓝细菌。
[0122]
如以上那样,根据本实施方式的使用了修饰蓝细菌的蛋白的制造方法,能够简便且高效地得到用于制造食品成分原料或化合物的酶、医疗用领域中的诊断用酶或治疗用酶、或者农渔畜产领域中的饲料用酶等。
[0123]
实施例
[0124]
以下,用实施例对本公开的修饰蓝细菌、修饰蓝细菌的制造方法以及蛋白的制造方法具体地进行说明,但本公开并不仅仅限定于以下的实施例。
[0125]
在以下的实施例中,作为使蓝细菌的外膜从细胞壁部分地脱离的方法,进行编码slh结构域保持型外膜蛋白的slr1841基因的表达抑制(实施例1)、以及编码细胞壁-丙酮酸修饰酶的slr0688基因的表达抑制(实施例2),制造2种修饰蓝细菌。然后,进行这些修饰蓝细菌的蛋白的分泌生产率的测定和所分泌的蛋白的鉴定。其中,本实施例中使用的蓝细菌种为集胞藻pcc6803(以下简称为“蓝细菌”)。
[0126]
(实施例1)
[0127]
在实施例1中,制造了编码slh结构域保持型外膜蛋白的slr1841基因的表达受到抑制的修饰蓝细菌。
[0128]
(1)slr1841基因的表达受到抑制的蓝细菌修饰株的构建
[0129]
作为基因表达抑制法,使用了crispr(clustered regularly interspaced short palindromic repeat,规律间隔的短回文重复序列)干扰法。在本方法中,通过将编码dcas9蛋白的基因(以下称为dcas9基因)和slr1841_sgrna(single-guide ribonucleic acid,单导核糖核酸)基因导入到蓝细菌的染色体dna中,能够抑制slr1841基因的表达。
[0130]
由本方法进行的基因表达抑制的机制如下所述。
[0131]
首先,核酸酶活性缺陷的cas9蛋白(dcas9)和与s1r1841基因的碱基序列互补结合的sgrna(s1r1841_sgrna)形成复合物。
[0132]
接着,该复合物识别蓝细菌的染色体dna上的s1r1841基因,与s1r1841基因特异性地结合。由于该结合成为空间位阻,s1r1841基因的转录受到抑制。其结果,蓝细菌的s1r1841基因的表达受到抑制。
[0133]
以下,对将上述2个基因分别导入蓝细菌的染色体dna的方法具体地进行说明。
[0134]
(1-1)dcas9基因的导入
[0135]
以集胞藻(synechocystis)ly07株(以下也称为ly07株)(参照非专利文献9)的染色体dna为模板,使用表1中记载的引物psba1-fw(序列号13)和psba1-rv(序列号14)通过pcr(polymerase chain reaction,聚合酶链反应)法对用于控制dcas9基因和dcas9基因的表达的操纵基因、以及成为基因导入的标记的大观霉素抗性标记基因进行扩增。其中,ly07株中,上述3个基因以连接的状态插入到染色体dna上的psba1基因中,因此可以作为1个dna
片段通过pcr法进行扩增。在此,将得到的dna片段记为“psba1::dcas9盒”。使用in-fusion pcr克隆法(注册商标),将psba1::dcas9盒插入到puc19质粒中,得到puc19-dcas9质粒。
[0136]
表1
[0137]
引物名碱基序列序列号psba1-fw5
′‑
cagtgaattcgagctcggtatatagcgttgcagtccctgg-3
′
13psba1-rv5
′‑
gattacgccaagcttgcatgaccgcggtcacttcataacc-3
′
14slr2030-fw5
′‑
cagtgaattcgagctcggtaataaccgttgtcccttttgtttcatcg-3
′
15sgrna_slr1841-rv5
′‑
tgttagtgagccctgctgttagctcccagtatctctatcactgat-3
′
16sgrna_slr1841-fw5
′‑
acagcagggctcactaacagttttagagctagaaatagcaagttaaaataa-3
′
17slr2031-rv5
′‑
gattacgccaagcttgcatggggaacaagctgaatctgggcatc-3
′
18sgrna_slr0688-rv5
′‑
ttttagtctgtttgctgcatagctcccagtatctctatcactgat-3
′
19sgrna_slr0688-fw5
′‑
tgcagcaaacagactaaaagttttagagctagaaatagcaagttaaaataa-3
′
20
[0138]
将得到的puc19-dcas9质粒1μg与蓝细菌培养液(菌体浓度od730=0.5左右)混合,通过自然转化将puc19-dcas9质粒导入到蓝细菌的细胞内。通过使转化后的细胞在含有20μg/ml的大观霉素的bg-11琼脂培养基上生长来进行筛选。在所筛选的细胞中,染色体dna上的psba1基因与puc19-dcas9质粒上的psba1上游片段区域和psba1下游片段区域之间发生同源重组。由此,得到在psba1基因区域插入有dcas9盒的集胞藻dcas9株。其中,所使用的bg-11培养基的组成如表2所示。
[0139]
表2
[0140]
成分含量(mg/l)edta-na1柠檬酸铁铵6nano31500mgso475k2hpo439cacl228.6h3bo42.8mncl21.8znso40.2cuso40.08na2moo40.02co(no3)20.005tes-koh(ph 7.5)4580
[0141]
(1-2)s1r1841_sgrna基因的导入
[0142]
在crispr干扰法中,通过向sgrna基因上的被称为前间隔序列(protospacer)的区域导入与靶序列互补的约20个碱基的序列,sgrna与靶基因特异性结合。将本实施例中使用的前间隔序列示于表3。
[0143]
表3
[0144]
前间隔序列靶基因碱基序列序列号
slr18415
′‑
acagcagggctcactaaca-3
′
21slr06885
′‑
tgcagcaaacagactaaaa-3
′
22
[0145]
集胞藻ly07株中,sgrna基因(前间隔序列区域除外)与卡那霉素抗性标记基因以连接的形式插入到染色体dna上的slr2030-slr2031基因中。因此,通过对利用pcr法扩增该sgrna基因时使用的引物赋予与slr1841基因(序列号7)互补的前间隔序列(序列号21),能够容易地得到特异性识别slr1841的sgrna(slr1841_sgrna)。
[0146]
首先,以ly07株的染色体dna为模板,使用表1中记载的引物slr2030-fw(序列号15)和sgrna_slr1841-rv(序列号16)的组、以及sgrna_slr1841-fw(序列号17)和s1r2031-rv(序列号18)的组,通过pcr法对2个dna片段进行扩增。
[0147]
接着,以上述dna片段的混合溶液为模板,使用表1中记载的引物slr2030-fw(序列号15)和s1r2031-rv(序列号18)通过pcr法进行扩增,由此得到(i)slr2030基因片段、(ii)s1r1841_sgrna、(iii)卡那霉素抗性标记基因、(iv)slr2031基因片段依次连接而成的dna片段(slr2030-2031::slr1841_sgrna)。使用in-fusion pcr克隆法(注册商标),将slr2030-2031::slr1841_sgrna插入到puc19质粒中,得到puc19-slr1841_sgrna质粒。
[0148]
通过与上述(1-1)同样的方法将puc19-slr1841_sgrna质粒导入到集胞藻dcas9株中,在含有30μg/ml卡那霉素的bg-11琼脂培养基上对转化后的细胞进行筛选。由此,得到在染色体dna上的slr2030-s1r2031基因中插入有slr1841_sgrna的转化体集胞藻dcas9 slr1841_sgrna株(以下也称为s1r1841抑制株)。
[0149]
(1-3)s1r1841基因的抑制
[0150]
上述dcas9基因和slr1841_sgrna基因的启动子序列被设计为可在无水四环素(atc)的存在下被表达诱导。本实施例中,通过在培养基中添加终浓度为1μg/ml的atc,抑制了s1r1841基因的表达。
[0151]
(实施例2)
[0152]
实施例2中,通过下述的步骤,得到编码细胞壁-丙酮酸修饰酶的slr0688基因的表达受到抑制的修饰蓝细菌。
[0153]
(2)slr0688基因的表达受到抑制的蓝细菌修饰株的构建
[0154]
通过与上述(1-2)同样的步骤,将包含与slr0688基因(序列号4)互补的前间隔序列(序列号22)的sgrna基因导入到集胞藻dcas9株中,得到集胞藻dcas9 slr0688_sgrna株。其中,使用表1中记载的引物slr2030-fw(序列号15)和sgrna_slr0688-rv(序列号19)的组、以及sgrna_slr0688-fw(序列号20)和slr2031-rv(序列号18)的组;和使用in-fusion pcr克隆法(注册商标)将(i)slr2030基因片段、(ii)slr0688_sgrna、(iii)卡那霉素抗性标记基因、(iv)slr2031基因片段依次连接而成的dna片段(slr2030-2031::slr0688_sgrna)插入到puc19质粒中,得到puc19-slr0688_sgrna质粒,除此以外,在与上述(1-2)同样的条件下进行。
[0155]
此外,通过与上述(1-3)同样的步骤,抑制了slr0688基因的表达。
[0156]
(比较例1)
[0157]
比较例1中,通过与实施例1的(1-1)同样的步骤,得到集胞藻dcas9株。
[0158]
接着,对于实施例1、实施例2和比较例1中得到的菌株,分别进行细胞表层的状态的观察和蛋白的分泌生产率试验。以下,对详细情况进行说明。
[0159]
(3)菌株细胞表层的状态的观察
[0160]
分别制作实施例1中得到的修饰蓝细菌集胞藻dcas9 slr1841_sgrna株(所谓的slr1841抑制株)、实施例2中得到的修饰蓝细菌集胞藻dcas9slr0688_sgrna株(以下也称为slr0688抑制株)、以及比较例1中得到的修饰蓝细菌集胞藻dcas9株(以下称为对照株)的超薄切片,使用电子显微镜观察细胞表层的状态(换言之,外膜结构)。
[0161]
(3-1)菌株的培养
[0162]
以初始菌体浓度od730=0.05的方式,将实施例1的slr1841抑制株接种于含有1μg/ml atc的bg-11培养基,在光量为100μmol/m2/s、30℃的条件下振荡培养5天。另外,实施例2的slr0688抑制株和比较例1的对照株也在与实施例1同样的条件下进行培养。
[0163]
(3-2)菌株的超薄切片的制作
[0164]
将上述(3-1)中得到的培养液在室温下以2,500g离心分离10分钟,回收实施例1的slr1841抑制株的细胞。接着,将细胞用-175℃的液体丙烷急速冷冻后,使用含有2%戊二醛和1%单宁酸的乙醇溶液在-80℃下固定2天。利用乙醇对固定后的细胞进行脱水处理,使脱水后的细胞浸透到氧化丙烯中后,沉入树脂(quetol-651)溶液中。然后,在60℃下静置48小时,使树脂固化,用树脂将细胞包埋。使用超薄切片机(ultracut)将树脂中的细胞薄切成70nm的厚度,制成超薄切片。使用2%乙酸铀和1%柠檬酸铅溶液对该超薄切片进行染色,准备实施例1的slr1841抑制株的透射型电子显微镜的试样。另外,对于实施例2的slr0688抑制株和比较例1的对照株也分别进行同样的操作,准备透射型电子显微镜的试样。
[0165]
(3-3)利用电子显微镜的观察
[0166]
使用透射型电子显微镜(jeol jem-1400plus),在100kv的加速电压下,进行上述(3-2)中得到的超薄切片的观察。将观察结果示于图2~图7。
[0167]
首先,对实施例1的slr1841抑制株进行说明。图2是实施例1的slr1841抑制株的tem(transmission electron microscope,透射型电子显微镜)图像。图3是图2的虚线区域a的放大图像。图3的(a)是图2的虚线区域a的放大tem图像,图3的(b)是描绘了图3的(a)的放大tem图像的图。
[0168]
如图2所示,在实施例1的slr1841抑制株中,外膜从细胞壁部分地剥离(即外膜部分地剥落),且外膜部分地弯曲。
[0169]
为了更详细地确认细胞表层的状态,对虚线区域a进行放大观察,结果如图3的(a)和图3的(b)所示,确认到外膜部分地剥落的部分(图中的点划线区域a1和a2)。另外,在点划线区域a1的旁边确认到外膜大幅弯曲的部分。考虑该部分是外膜与细胞壁的结合减弱的部分,由于培养液从外膜浸透到胞外质内,因此外膜向外侧膨胀而弯曲。
[0170]
接着,对实施例2的slr0688抑制株进行说明。图4是实施例2的slr0688抑制株的tem图像。图5是图4的虚线区域b的放大图像。图5的(a)是图4的虚线区域b的放大tem图像,图5的(b)是描绘了图5的(a)的放大tem图像的图。
[0171]
如图4所示,在实施例2的slr0688抑制株中,外膜从细胞壁部分地剥离,且外膜部分地弯曲。另外,确认到slr0688抑制株中,外膜部分地从细胞壁脱离。
[0172]
为了更详细地确认细胞表层的状态,对虚线区域b进行放大观察,结果如图5的(a)和图5的(b)所示,确认到外膜大幅弯曲的部分(图中的点划线区域b1)和外膜部分地剥落的部分(图中的点划线区域b2和b3)。另外,在点划线区域b1、b2及b3各自的附近还确认到外膜
从细胞壁脱离的部分。
[0173]
接着,对比较例1的对照株进行说明。图6是比较例1的对照株的tem图像。图7是图6的虚线区域c的放大图像。图7的(a)是图6的虚线区域c的放大tem图像,图7的(b)是描绘了图7的(a)的放大tem图像的图。
[0174]
如图6所示,比较例1的对照株的细胞表层整齐,保持依次层叠有内膜、细胞壁、外膜和s层的状态。即,在对照株中,没有发现如实施例1和2那样外膜从细胞壁脱离的部分、外膜从细胞壁剥离(即剥落)的部分、以及外膜弯曲的部分。
[0175]
(4)蛋白的分泌生产率试验
[0176]
分别培养实施例1的slr1841抑制株、实施例2的slr0688抑制株和比较例1的对照株,测定分泌到细胞外的蛋白量(以下也称为分泌蛋白量)。根据培养液中的蛋白量,评价上述菌株各自的蛋白的分泌生产率。其中,蛋白的分泌生产率是指通过将在细胞内产生的蛋白分泌到细胞外来生产蛋白的能力。以下,对具体的方法进行说明。
[0177]
(4-1)菌株的培养
[0178]
用与上述(3-1)同样的方法培养实施例1的slr1841抑制株。培养独立地进行3次。另外,对于实施例2和比较例1的菌株,也在与实施例1的菌株同样的条件下进行培养。
[0179]
(4-2)分泌到细胞外的蛋白的定量
[0180]
将上述(4-1)中得到的培养液在室温下以2,500g离心分离10分钟,得到培养上清液。使用孔径为0.22μm的膜过滤器对得到的培养上清液进行过滤,完全除去实施例1的slr1841抑制株的细胞。通过bca(bicinchoninic acid,二喹啉甲酸)法对过滤后的培养上清液中所含的总蛋白量进行定量。对独立培养得到的3个培养液分别进行这一系列操作,求出实施例1的slr1841抑制株分泌到细胞外的蛋白量的平均值和标准偏差。另外,对于实施例2和比较例1的菌株,分别在同样的条件下进行3个培养液的蛋白的定量,求出3个培养液中的蛋白量的平均值和标准偏差。
[0181]
将结果示于图8。图8是表示实施例1、实施例2和比较例1的修饰蓝细菌的培养上清液中的蛋白量(n=3、误差条=sd)的图表。
[0182]
如图8所示,实施例1的slr1841抑制株和实施例2的slr0688抑制株与比较例1的对照株相比,分泌到培养上清液中的蛋白量(mg/l)均提高了约25倍。
[0183]
虽然省略数据的记载,但测定培养液的吸光度(730nm),计算了每1g菌体干燥重量的分泌蛋白量(mg蛋白/g菌体干燥重量),结果实施例1的slr1841抑制株和实施例2的slr0688抑制株的每1g菌体干燥重量的分泌蛋白量(mg蛋白/g菌体干燥重量)与比较例1的对照株相比均提高了约36倍。
[0184]
另外,如图8所示,与抑制了编码slh结构域保持型外膜蛋白的基因(slr1841)的表达的实施例1的slr1841抑制株相比,抑制了编码细胞壁-丙酮酸修饰酶的基因(slr0688)的表达的实施例2的slr0688抑制株在培养上清液中分泌的蛋白量更多。考虑这与细胞壁表面的共价键型的糖链的数量比外膜中的slh结构域保持型外膜蛋白(slr1841)的数量多有关。即,考虑实施例2的slr0688抑制株与实施例1的slr1841抑制株相比,外膜与细胞壁的结合量及结合力进一步降低,因此所分泌的蛋白量比实施例1的slr1841抑制株多。
[0185]
由以上结果确认到,由于抑制了与外膜和细胞壁的结合相关的蛋白的功能,蓝细菌的外膜与细胞壁的结合被部分地变弱,外膜从细胞壁部分地脱离。还确认到,由于外膜与
细胞壁的结合变弱,在蓝细菌的细胞内产生的蛋白变得容易漏出到细胞外。因此,根据本实施方式的修饰蓝细菌及其制造方法,显示出蛋白的分泌生产率大幅提高。
[0186]
(5)所分泌的蛋白的鉴定
[0187]
接着,通过lc-ms/ms鉴定上述(4-2)中得到的培养上清液中所含的分泌蛋白。以下对方法进行说明。
[0188]
(5-1)试样制备
[0189]
加入相对于培养上清液的液量为8倍量的冷丙酮,在20℃下静置2小时后,在20,000g下离心分离15分钟,得到蛋白的沉淀物。在该沉淀物中加入100mm tris ph8.5、0.5%十二烷酸钠(sdod),利用密闭式超声波破碎机溶解蛋白。调整至蛋白浓度为1μg/ml后,添加终浓度为10mm的二硫苏糖醇(dtt),在50℃下静置30分钟。接着,添加终浓度为30mm的碘乙酰胺(iaa),在室温(遮光)下静置30分钟。为了停止iaa的反应,添加终浓度为60mm的半胱氨酸,在室温下静置10分钟。添加胰蛋白酶400ng,在37℃下静置一晚,将蛋白进行肽片段化。加入5%tfa(trifluoroacetic acid,三氟乙酸)后,在室温下以15,000g离心分离10分钟,得到上清液。通过该操作除去sdod。使用c18旋转柱进行脱盐后,利用离心蒸发器使试样干固。然后,加入3%乙腈、0.1%甲酸(formic acid),使用密闭式超声波破碎机将试样溶解。以肽浓度达到200ng/μl的方式进行制备。
[0190]
(5-2)lc-ms/ms分析
[0191]
使用lc-ms/ms装置(ultimate 3000rslcnanolcsystem)在以下的条件下对上述(5-1)中得到的试样实施分析。
[0192]
试样注入量:200ng
[0193]
柱:capcell core mp 75μm
×
250mm
[0194]
溶剂:a溶剂为0.1%甲酸水溶液,b溶剂为0.1%甲酸+80%乙腈
[0195]
梯度程序(gradient program):试样注入4分钟后使b溶剂为8%、27分钟后使b溶剂为44%、28分钟后使b溶剂为80%、34分钟后测定结束
[0196]
(5-3)数据分析
[0197]
得到的数据在以下的条件下进行分析,进行蛋白和肽的鉴定以及定量值的计算。
[0198]
软件:scaffold dia
[0199]
数据库:uniprotkb/swiss prot database(集胞藻pcc 6803)
[0200]
破碎(fragmentation):hcd
[0201]
前体公差(precursor tolerance):8ppm
[0202]
片段公差(fragment tolerance):10ppm
[0203]
数据采集类型(data acquisition type):重叠dia
[0204]
肽长度(peptide length):8-70
[0205]
肽电荷(peptide charge):2-8
[0206]
最大漏切数量(max missed cleavages):1
[0207]
固定修饰(fixed modification):半胱氨酸碘乙酰胺化(carbamidomethylation)
[0208]
肽fdr(peptide fdr):1%以下
[0209]
从所鉴定的蛋白中相对定量值最大的蛋白起依次将10种蛋白示于表4。
[0210]
表4
[0211] 蛋白名uniprot登录id基因名1羧基末端蛋白酶p73458prc2ssr1853蛋白p72639ssr18533sll0314蛋白q55648sll03144sll0858蛋白p73742sll08585sll0319蛋白p74789sll03196一般分泌途径蛋白gp73704hofg7slr0581蛋白q55408slr05818未知的包含wd重复序列的蛋白sll1491p74598sll14919铁摄入蛋白a2q55835futa210质体蓝素p21697pete
[0212]
10种蛋白全部分别包含在实施例1的s1r1841抑制株和实施例2的slr0688抑制株的培养上清液中。在这些蛋白的全部中,保持有胞外质(指外膜与内膜的间隙)转移信号。根据该结果确认了,在实施例1和实施例2的修饰株中,外膜从细胞壁部分地脱离,由此胞外质内的蛋白变得容易漏出到外膜之外(即菌体外)。因此,显示出本实施方式的修饰蓝细菌的蛋白的分泌生产率大幅提高。
[0213]
(6)考察
[0214]
本实施例中,确认了本公开的修饰蓝细菌将存在于菌体内(在此为胞外质内)的蛋白分泌至菌体外。本公开的修饰蓝细菌例如能够进行基因修饰以产生其他蛋白来代替上文中鉴定的蛋白(即原本在菌体内产生的蛋白),因此能够高效地制造所期望的蛋白。另外,由于蓝细菌的光合作用能力高,因此通过给予光、水、空气和微量的无机物进行培养,能够在必要时简便地得到所需要的蛋白,因此不需要为了制造蛋白而使用复杂的装置。另外,蛋白例如在加工成营养补充剂等时,其功能容易丧失。因此,根据本公开的修饰蓝细菌,能够在维持蛋白的功能的状态下提供蛋白。通过以上的优点,可期待本公开的修饰蓝细菌在各种领域中的应用。
[0215]
另外,通过“(3-3)利用电子显微镜的观察”,在抑制了编码与外膜和细胞壁的结合相关的蛋白的基因的表达的修饰株中,确认到外膜与细胞壁的结合变弱,由此外膜部分地剥落,以及外膜部分地膨胀。考虑这是由于外膜与细胞壁的结合变弱,在外膜从细胞壁部分地脱离的部位,培养液在渗透压作用下变得容易从细胞外流入,在所流入的培养液作用下,外膜部分地膨胀。而且,考虑由于培养液的蛋白浓度与胞外质内的蛋白浓度之差大,因此从外膜流入到胞外质的培养液不会停止,无法耐受内压的外膜破裂而剥落(即剥离)。
[0216]
另外,表3中,通过lc-ms/ms分析鉴定的全部蛋白中,仅按相对定量值最大的顺序记载了10种。而且,在“(5-3)数据分析”中,记载了表3中记载的全部10种蛋白分别包含在实施例1的slr1841抑制株和实施例2的slr0688株的培养上清液中,但确认了通过lc-ms/ms分析鉴定的其他全部蛋白也同样分别包含在实施例1和实施例2的培养上清液中。而且,确认了所分泌的蛋白包含原本存在于胞外质内的蛋白和从细胞质向胞外质输送而在胞外质内发挥功能的蛋白。
[0217]
以上,基于实施方式对本公开的修饰蓝细菌、修饰蓝细菌的制造方法以及蛋白的制造方法进行了说明,但本公开并不限定于这些实施方式。只要不脱离本公开的主旨,对实
施方式实施本领域技术人员可想到的各种变形而得到的方式、将实施方式中的一部分构成要素组合而构建的其他方式也包含在本公开的范围内。
[0218]
在上述实施方式中,说明了通过使蓝细菌中的与外膜和细胞壁的结合相关的蛋白的功能受到抑制或丧失,使菌体内产生的蛋白漏出到菌体外的例子,但本公开并不限于此。例如,可以通过对蓝细菌施加外力来减弱外膜与细胞壁的结合,也可以使外膜脆弱化。另外,也可以通过在蓝细菌的培养液中添加酶或药剂来使外膜脆弱化。
[0219]
产业上的可利用性
[0220]
根据本公开的修饰蓝细菌、修饰蓝细菌的制造方法、以及使用了修饰蓝细菌的蛋白的制造方法,通过将水、光、空气、以及微量的无机物给予修饰蓝细菌来进行培养,能够高效地得到蛋白。例如,能够得到用于制造食品成分的原料或化合物的酶、医疗用领域中的诊断用酶或治疗用酶、或者农渔畜产领域中的饲料用酶等。
[0221]
符号说明
[0222]1ꢀꢀꢀꢀꢀꢀ
内膜
[0223]2ꢀꢀꢀꢀꢀꢀ
肽聚糖
[0224]3ꢀꢀꢀꢀꢀꢀ
糖链
[0225]4ꢀꢀꢀꢀꢀꢀ
细胞壁
[0226]5ꢀꢀꢀꢀꢀꢀ
外膜
[0227]6ꢀꢀꢀꢀꢀꢀ
slh结构域保持型外膜蛋白
[0228]7ꢀꢀꢀꢀꢀꢀ
slh结构域
[0229]8ꢀꢀꢀꢀꢀꢀ
有机物通道蛋白
[0230]9ꢀꢀꢀꢀꢀꢀ
细胞壁-丙酮酸修饰酶
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1