宿主细胞及其用于产生核糖醇和其他单糖的用途的制作方法
1.本发明提供了宿主细胞,特别是重组宿主细胞,其能够产生d-核酮糖并且不能将d-核酮糖转化为核糖醇以外的分子或在将d-核酮糖转化为核糖醇以外的分子方面的能力下降,其中宿主细胞包含编码多肽的异源核酸序列,其能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好。本发明还涉及此类宿主细胞用于产生核糖醇、l-核酮糖、l-阿拉伯糖或l-核糖的用途。虽然核糖醇和l-核酮糖在这些方面是有用的,但它们还可用作产生l-阿拉伯糖和l-核糖的中间体。
技术实现要素:
2.1)在第一个实施例中,本发明提供了一种宿主细胞,该宿主细胞能够产生d-核酮糖并且不能将d-核酮糖转化为核糖醇以外的分子或在将d-核酮糖转化为核糖醇以外的分子方面的能力下降,其中宿主细胞包含编码多肽的异源核酸序列,其能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好。
3.能够产生d-核酮糖并且不能将d-核酮糖转化为核糖醇以外的分子或将d-核酮糖转化为核糖醇以外的分子的能力降低的宿主细胞可以天然存在或可以被工程改造,例如特别是基因工程改造,以具有这些特性。关于如何实现这一点有许多公知方法。这些包括在非限制性实例中在载体中引入一个或多个异源基因,其中一个或多个异源基因被整合到宿主细胞染色体中,或被游离体维持。在其他实施例中,宿主细胞天然的基因可以被改变(包括但不限于基因的缺失)并且特别是使用例如同源重组进行特别改变,该同源重组使宿主细胞产生d-核酮糖和/或降低或消除宿主细胞将d-核酮糖转化为核糖醇以外的分子的能力。
4.如本文所用,“宿主细胞”是指原核或真核细胞,优选选自细菌、真菌,尤其是酵母。
5.如本文所用,表述“不能将d-核酮糖转化为核糖醇以外的分子或在将d-核酮糖转化为核糖醇以外的分子方面的能力降低”是指由d-核酮糖转化产生的非核糖醇分子与由d-核酮糖转化产生的核糖醇之间的摩尔比小于1。优选地,由d-核酮糖转化产生的核糖醇与由d-核酮糖转化产生的分子总量相比的摩尔百分比大于50%,尤其大于60%,更优选大于75%,尤其大于85%,例如尤其大于90%,最优选大于95%,尤其大于98%。在一个优选的实施例中,宿主细胞不能将d-核酮糖转化为核糖醇以外的分子,即由d-核酮糖转化产生的核糖醇与由d-核酮糖转化产生的分子总量相比的摩尔百分比为100%。
6.如本文所用,术语“转化”、“转化的”通常具有在单个化学步骤中,尤其是通过酶促转化由另一分子产生分子的含义。
7.如本文所用,“异源”应理解为表示基因或编码核酸序列已通过基因工程引入细胞。它可以以游离型或染色体形式存在。基因或编码核酸序列可以源自与引入它的宿主细胞不同的来源。但是,它也可以来自与引入它的宿主细胞相同的物种,但由于其非天然环境而被认为是异源的。例如,基因或编码核酸序列被称为异源的,因为它在一个启动子的控制下,该启动子不是它的天然启动子,或者它被引入一个不同于其天然位置的位置。宿主细胞可能含有在引入异源基因或编码核酸序列之前的基因或编码核酸序列的内源拷贝,或者它
可能不包含内源拷贝。
8.如本文所用的表述“能够将d-核酮糖转化为核糖醇,具有对nadph的辅因子偏好的多肽”是指能够将d-核酮糖转化为核糖醇的多肽优选使用辅因子nadph而不是另一种辅因子,辅因子nadph尤其优于辅因子nadh,优选优于宿主细胞中存在的另一种辅因子,尤其是在生物学相关浓度下的另一种辅因子。优选地,如本文所用的表述“能够将d-核酮糖转化为核糖醇,具有对nadph的辅因子偏好的多肽”是指能够将d-核酮糖转化为核糖醇的多肽,与任何其它辅因子相比,特别是与nadh相比,优选与任何出现在宿主细胞,特别是生物相关浓度中的其它辅因子相比,这种多肽优选使用nadph作为辅因子,其中优选的程度为nadph和与之比较的辅因子的综合的50%以上,特别是60%以上,更优选75%以上,特别优选85%以上,例如特别是90%以上,最优选95%以上,特别是98%以上。可以通过测量多肽对辅因子氧化的催化效率(k
cat
/km)来确定多肽使用特定辅因子将d-核酮糖转化为核糖醇的程度。例如,这可以如ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006中所述,使用d-核酮糖而不是木糖醇和nadh、nadph或代替nad
+
或nadp
+
的任何其他还原形式的辅因子来进行测量。氧化辅因子的产生可以通过本领域已知的方法来测量,例如,通过测量对应于nad(p)h氧化为nad(p)
+
的340nm处吸光度的降低来测量nad
+
和nadp
+
的产生。
9.本文中一般性和具体化地公开了能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽和编码这种多肽的核酸序列。此外,本领域普通技术人员能够产生各种其他不同的多肽,以及编码这些多肽的各自的核酸序列,多肽能够将d-核酮糖转化为核糖醇,且具有对nadph的辅因子偏好。例如,本领域技术人员可以将突变引入例如天然存在的脱氢酶/还原酶,脱氢酶/还原酶能够将d-核酮糖转化为核糖醇并且具有对nadh的辅因子偏好,通过序列诱变导致辅因子偏好从nadh转变为nadph。此类突变包括但不限于例如ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006中所述的那些对应的突变。
10.可以根据本领域已知的方法,例如ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006中所述的方法,通过确定反应的动力学参数,例如km,k
cat
和k
cat
/km来测量多肽将d-核酮糖转化为核糖醇的能力。其中用于将d-核酮糖转化为核糖醇的k
cat
也可以通过确定辅因子氧化的k
cat
来测量。优选地,能够将d-核酮糖转化为核糖醇并具有对nadph的辅因子偏好的多肽将d-核酮糖转化为核糖醇,以nadph作为辅因子,其中这种多肽的活性(特别是通过测量k
cat
确定)为seq id no 11所示氨基酸序列的多肽活性的至少20%,优选至少30%,特别为至少50%,更优选为至少75%,最优选为至少100%。
11.当本文中陈述宿主细胞包含编码多肽的核酸序列或编码多肽的基因时,这是指核酸序列或基因处于一种或多种适于表达多肽的调节序列的控制之下。对于编码能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽的核酸序列,调控序列尤其是驱动多肽高表达的启动子。
12.2)本发明的另一个实施例涉及实施例1)的宿主细胞,其中该宿主细胞能够由d-葡萄糖产生d-核酮糖。
13.3)本发明的另一个实施例涉及实施例1)或2)的宿主细胞,其中该宿主细胞能够通过戊糖磷酸途径由d-葡萄糖产生d-核酮糖。
14.4)本发明的另一个实施例涉及实施例1)-3)中任一项的宿主细胞,其中该宿主细胞不能将d-核酮糖转化为d-阿拉伯糖醇或将d-核酮糖转化为d-阿拉伯糖醇的能力降低。
15.为了清楚起见,表述“不能将d-核酮糖转化为d-阿拉伯糖醇或将d-核酮糖转化为d-阿拉伯糖醇的能力降低”是指由d-核酮糖转化产生的d-阿拉伯糖醇与由d-核酮糖转化产生的核糖醇之间的摩尔小于1。优选地,由d-核酮糖转化产生的核糖醇与由d-核酮糖转化产生的d-阿拉伯糖醇和核糖醇的总量相比的摩尔百分比大于50%,尤其大于60%,更优选大于75%,尤其大于85%,例如尤其大于90%,最优选大于95%,尤其大于98%。在一个优选的实施例中,宿主细胞不能将d-核酮糖转化为d-阿拉伯糖醇,即由d-核酮糖转化产生的核糖醇与由d-核酮糖转化产生的d-阿拉伯糖醇和核糖醇的总量相比的摩尔百分比是100%。
16.5)本发明的另一个实施例涉及实施例1)-4)中任一项的宿主细胞,其中该宿主细胞是真菌细胞。
17.6)本发明的另一个实施例涉及实施例5)的宿主细胞,其中所述真菌细胞是酵母细胞。
18.7)本发明的另一个实施例涉及实施例6)的宿主细胞,其中酵母细胞是毕赤酵母。
19.8)本发明的另一个实施例涉及实施例1)-7)中任一项的宿主细胞,其中该宿主细胞包含一种或多种编码能够将d-核酮糖转化为d-阿拉伯糖醇的多肽的内源基因,并且其中所述一个或多个内源基因被修饰,从而所述多肽的表达和/或活性被降低或消除。
20.如本文所用,表述“使得所述多肽的表达降低”是指与具有未修饰内源基因的宿主细胞相比,能够将d-核酮糖转化为d-阿拉伯糖醇的多肽的表达水平降低。优选地,与具有未修饰内源基因的宿主细胞中的表达水平相比,多肽的表达水平降低了20%或更多,尤其降低了40%或更多,更优选降低了50%或更多,尤其降低了70%或更多,例如尤其降低了90%或更多,甚至更优选降低了95%或更多,尤其降低了98%或更多。最优选地,消除表达,即不再表达能够将d-核酮糖转化为d-阿拉伯糖醇的多肽。
21.另一方面,多肽活性的降低意味着与由未修饰的内源基因编码的多肽相比,该多肽将d-核酮糖转化为d-阿拉伯糖醇的能力降低。可以通过根据本领域已知的方法,例如ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006中所述的方法,通过确定反应的动力学参数,例如km,k
cat
和k
cat
/km来测量多肽将d-核酮糖转化为d-阿拉伯糖醇的能力,其中用于将d-核酮糖转化为d-阿拉伯糖醇的k
cat
也可以通过确定辅因子氧化的k
cat
来测量。优选地,与由未修饰的内源基因编码的多肽相比,将d-核酮糖转化为d-阿拉伯糖醇的该多肽的活性(尤其是通过测量k
cat
确定)降低了20%或更多,尤其降低了40%或更多,更优选降低了50%或更多,尤其降低了70%或更多,例如尤其降低了90%或更多,甚至更优选降低了95%或更多,尤其降低了98%或更多。最优选地,活性被消除,即多肽不再能够将d-核酮糖转化为d-阿拉伯糖醇。
22.修饰基因以降低或消除该基因编码的多肽的表达或活性的方法是本领域众所周知的。多肽表达的降低可以通过以下方式实现,即例如改变编码多肽的基因的启动子,其中通过同源重组将启动子替换为活性较低的启动子。另一方面,可以通过例如删除编码多肽
的基因来消除多肽的表达,其中例如通过同源重组用选择标记替换基因来消除基因。可以例如通过同源重组用突变基因替换内源基因来降低或消除能够将d-核酮糖转化为d-阿拉伯糖醇的多肽的活性,其中突变基因编码多肽,多肽将d-核酮糖转化为d-阿拉伯糖醇的活性降低或消除。在另一个示例中,可以通过在存在多肽抑制剂的情况下培养表达多肽的宿主细胞,或通过共表达或共同产生多肽的抑制剂的方式降低或消除能够将d-核酮糖转化为d-阿拉伯糖醇的多肽的活性。
23.9)本发明的另一个实施例涉及实施例8)的宿主细胞,其中编码能够将d-核酮糖转化为d-阿拉伯糖醇的多肽的一个或多个内源基因通过删除该一个或多个基因而失活。
24.通过缺失使一个或多个内源基因失活是消除能够将d-核酮糖转化为d-阿拉伯糖醇的多肽表达的特定方式。通过缺失使基因失活的方法是本领域众所周知的,例如与缺少该基因的核苷酸序列进行同源重组的方法。下面在实施例中进一步描述了一种特定方法。
25.10)本发明的另一个实施例涉及实施例1)-9)中任一项的宿主细胞,其中能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽是核糖醇脱氢酶,或其催化活性的部分,为了将辅因子偏好从nadh改变为nadph而使其发生突变。
26.在一个优选的实施例中,核糖醇脱氢酶来自产气肠杆菌、大肠杆菌或球形红杆菌,例如尤其来自产气肠杆菌和/或大肠杆菌。
27.11)本发明的另一个实施例涉及实施例1)-9)中任一项的宿主细胞,其中能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含多肽或其催化活性部分,其中该多肽与seq id no 7所示氨基酸序列的多肽具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的序列一致性。
28.如本文所用的表述“或其催化活性部分”是指指定氨基酸序列的任何部分[在本实施例11的情况下),指定氨基酸序列是seq id no 7],条件是由氨基酸序列的这部分组成的多肽仍然能够将d-核酮糖转化为核糖醇,且具有nadph的辅因子偏好。
[0029]
本领域技术人员知道如何使用已知技术通过核苷酸交换、缺失和/或添加修饰编码给定多肽的核酸序列来产生多肽,该多肽包含与给定多肽或其部分具有某些序列一致性的多肽,或由与给定多肽或其部分具有某些序列一致性的多肽组成。由此类修饰的核酸序列编码的多肽可以通过已知方法产生,例如在宿主细胞中异源表达和纯化所表达的多肽来产生,并使用本领域已知的方法,例如尤其是上文描述的方法,测试多肽将d-核酮糖转化为核糖醇的能力和它们对nadph的辅因子偏好。此外,d-核酮糖转化为核糖醇以及对nadph的辅因子偏好所需的多肽的哪些部分/氨基酸是已知的(参见,例如,ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006;and ghosh,d.et al.,the refined three-dimensional structure of 3α,20β-hydroxysteroid dehydrogenase and possible roles of the residues conserved in short-chain dehydrogenases.structure 2,629
–
640,1994)且可通过已知技术来确定。
[0030]
12)本发明的另一个实施例涉及实施例11)的宿主细胞,其中所述能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含对应于seq id no:7的氨基酸s45和r46的两个氨基酸。
[0031]
13)本发明的另一个实施例涉及实施例11)的宿主细胞,其中能够将d-核酮糖转化
为核糖醇并具有对nadph的辅因子偏好的多肽包含具有seq id no:7所示氨基酸序列的多肽或其催化活性部分或由由seq id no:7所示氨基酸序列的多肽或其催化活性部分组成。
[0032]
14)本发明的另一个实施例涉及实施例1)-9)中任一项的宿主细胞,其中能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含多肽,该多肽与seq id no 9所示氨基酸序列的多肽或催化活性部分具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的序列一致性。
[0033]
15)本发明的另一个实施例涉及实施例14)的宿主细胞,其中所述能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含对应于seq id no:9的氨基酸s45和r46的两个氨基酸。
[0034]
16)本发明的另一个实施例涉及实施例14)的宿主细胞,其中能够将d-核酮糖转化为核糖醇并具有对nadph的辅因子偏好的多肽包含具有seq id no:9所示氨基酸序列的多肽或其催化活性部分,或由具有seq id no:9所示氨基酸序列的多肽或其催化活性部分组成。
[0035]
17)本发明的另一个实施例涉及实施例1)-9)中任一项的宿主细胞,其中能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含多肽,该多肽与seq id no 11所示氨基酸序列的多肽或其催化活性部分具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的序列一致性。
[0036]
18)本发明的另一个实施例涉及实施例17)的宿主细胞,其中所述能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽包含对应于seq id no:11的氨基酸s38和r39的两个氨基酸。
[0037]
19)本发明的另一个实施例涉及实施例17)的宿主细胞,其中能够将d-核酮糖转化为核糖醇并具有对nadph的辅因子偏好的多肽包含具有seq id no:11所示氨基酸序列的多肽或其催化活性部分,或由具有seq id no:11所示氨基酸序列的多肽或其催化活性部分组成。
[0038]
20)本发明的另一个实施例涉及实施例1)-9)中任一项的宿主细胞,其中所述宿主细胞包含异源核酸序列的多个拷贝,所述异源核酸序列编码能够将d-核酮糖转化为核糖醇且具有对nadph的辅因子偏好的多肽。
[0039]
21)本发明的另一个实施例涉及实施例20)的宿主细胞,其中异源核酸序列的每个拷贝编码实施例10)-19)中任一项的多肽。
[0040]
22)本发明的另一个实施例涉及实施例20)的宿主细胞,其中所述宿主细胞包含编码实施例11)-13)中任一项的,例如尤其是实施例12)的多肽的异源核酸序列的至少一个拷贝,例如仅一个拷贝,以及包含编码实施例14)-16)中任一项的,例如尤其是实施例15)的多肽的异源核酸序列的至少一个拷贝,例如仅一个拷贝。
[0041]
23)本发明的另一个实施例涉及产生核糖醇的方法,包括在其中核糖醇由宿主细胞产生的细胞培养条件下培养实施例1)-22)中任一项的宿主细胞,并且可选地分离所产生的核糖醇。
[0042]
如本文所用,术语“分离”是指提高相关化合物纯度的任何方法。纯化方法是本领域公知的并且包括例如离心、过滤、色谱法、结晶、液-液萃取等。
[0043]
例如,根据本发明,核糖醇可以通过在含有d-葡萄糖的培养基中培养毕赤酵母来
生产,其中核糖醇存在于上清液中,并且可以例如通过离心或超离心从上清液中分离酵母细胞,并通过色谱法从上清液中纯化核糖醇的方式来分离核糖醇。
[0044]
24)本发明的另一个实施例涉及实施例23)的方法,还包括将产生的核糖醇转化为l-核酮糖,并且可选地分离获得的l-核酮糖。
[0045]
如本文所提供的,根据本发明方法产生的核糖醇可以通过本领域普通技术人员已知的任何方法转化为l-核酮糖,而无需使用传统和常规方法和技术进行过度实验。
[0046]
例如,核糖醇可以转化为l-核酮糖,如下文献所述,moses and ferrier,the biochemical preparation of d-xylulose and l-ribulose.details of the action of acetobacter suboxydans on d-arabitol,ribitol and other polyhydroxy compounds.biochem j.1962apr;83:8-14or as described in ahmed et al.,biochemical preparation of l-ribose and l-arabinose from ribitol:a new approach.j biosci bioeng.1999;88(4):444-448。
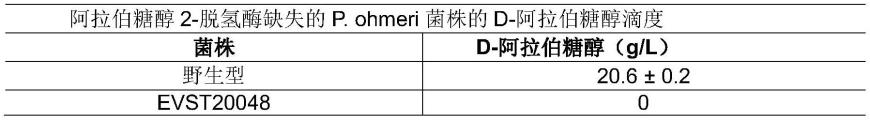
[0047]
或者,可以使用以下工艺将核糖醇转化为l-核酮糖:
[0048]
野生型氧化葡萄糖酸杆菌生物质通过发酵产生。通过离心或超滤将细胞与上清液分离,且细胞用于生物转化反应。
[0049]
含有核糖醇的上清液与氧化葡萄糖酸杆菌细胞混合并在发酵罐中搅拌,其中在例如通过离心或超离心法与细胞分离后通过实施例23)中的工艺获得该含有核糖醇的上清液。
[0050]
在此孵育过程中,氧化葡萄糖酸杆菌细胞将核糖醇转化为l-核酮糖。转化后,生物质和含有l-核酮糖的上清液可以通过离心或超滤分离。
[0051]
25)本发明的另一个实施例涉及实施例24)的方法,还包括将产生的l-核酮糖转化为l-阿拉伯糖。
[0052]
l-阿拉伯糖是自然界中存在的戊糖之一。对肠道蔗糖酶活性有特异性抑制作用,可用作甜味剂或膳食补充剂。此外,它还可用于治疗糖尿病和慢性便秘等疾病的医疗和制药应用。
[0053]
如本文所提供的,根据本发明方法由核糖醇产生的l-核酮糖可以通过本领域普通技术人员已知的任何方法转化为l-阿拉伯糖,而无需使用传统和常规方法和技术进行过度实验。
[0054]
例如,l-核酮糖可以转化为l-阿拉伯糖,如下所述,ahmed等人,biochemical preparation of l-ribose and l-arabinose from ribitol:a new approach.j biosci bioeng.1999;88(4):444-448 by using an l-arabinose isomerase。
[0055]
或者,可以使用以下工艺将l-核酮糖转化为l-阿拉伯糖:
[0056]
发酵表达l-阿拉伯糖异构酶的大肠杆菌细胞以产生生物质。
[0057]
通过离心或超滤将细胞与上清液分离并将细胞用于生物转化反应。
[0058]
将如上文实施例24)所述获得的含有l-核酮糖的上清液与表达l-阿拉伯糖异构酶的大肠杆菌细胞混合并在发酵罐中搅拌。
[0059]
表达l-阿拉伯糖异构酶的大肠杆菌细胞正在将l-核酮糖转化为l-阿拉伯糖。在转化之后,生物质和上清液可以通过离心或超滤分离,其中l-阿拉伯糖存在于上清液中。
[0060]
26)本发明的另一个实施例涉及实施例23)的方法,还包括在一个或多个步骤中由
from ribitol:a new approach.j biosci bioeng.1999;88(4):444-448 or as described above under embodiments 24)and 28)中所述,可以例如由核糖醇经由l-核酮糖在两步生化反应中制备l-核糖,其中每个反应在单独的工艺步骤中进行。
[0078]
或者,两个生化反应步骤可以通过例如使用宿主细胞在一个工艺步骤中组合,例如,通过基因改造,该宿主细胞能够将核糖醇转化为l-核酮糖和将l-核酮糖转化为l-核糖,例如,因为宿主细胞表达能够将核糖醇转化为l-核酮糖的多肽和能够将l-核酮糖转化为l-核糖的多肽。
[0079]
30)本发明的另一个实施例涉及实施例28)或29)的方法,还包括分离产生的l-核糖。
[0080]
如上文实施例23)所述,分离分子的方法在本领域中是公知的。特别地,由根据本发明方法产生的核糖醇产生的l-核糖可以通过本领域普通技术人员已知的任何方法分离,而无需使用传统和常规方法和技术进行过度实验。例如,l-核糖可以通过超滤将细胞与含有l-核糖的上清液分离,并对上清液进行离子交换层析,然后对l-核糖脱色和并使其结晶l,从而分离出l-核糖。
[0081]
31)本发明的另一个实施例涉及实施例1)-22)中任一项的宿主细胞用于产生核糖醇、l-核酮糖、l-阿拉伯糖或l-核糖的用途。
具体实施方式
[0082]
实施例
[0083]
实施例1.产气肠杆菌、大肠杆菌和球形红杆菌的核糖醇脱氢酶基因的克隆
[0084]
基于编码aby61_23105基因的序列cp011574.1(获自ncbi genbank https://www.ncbi.nlm.nih.gov/genbank/)的核苷酸4,925,718至4,926,467,根据提交的序列(seq id no 2),通过geneart gene合成(thermo fisher scientific,regensburg,germany)来化学合成来自e.aerogenes(seq id no1)的编码脱氢酶aby61_23105的dna片段。
[0085]
基于编码g2583_2620基因的序列cp001846.1(获自ncbi genbank https://www.ncbi.nlm.nih.gov/genbank/)的核苷酸2,632,596至2,633,345,根据提交的序列(seq id no 3),通过geneart gene合成(thermo fisher scientific,regensburg,germany)来化学合成来自大肠杆菌(seq id no 4)的编码核糖醇脱氢酶g2583_26205的dna片段。
[0086]
基于编码rsp03_rs18040基因的序列nz_bjxo01000022.1(获自ncbi genbank https://www.ncbi.nlm.nih.gov/genbank/)的核苷酸18,838至19,566,根据提交的序列(seq id no 6),通过geneart gene合成(thermo fisher scientific,regensburg,germany)来化学合成来自r.sphaeroides(seq id no 5)的编码氧化还原酶rsp03_rs18040的dna片段。
[0087]
对于上述所有dna片段,编码asci和sphi限制性位点的额外核苷酸分别包含在5’和3’末端,以便于进一步克隆。此外,腺苷三联体包含在起始atg之前,以说明在类似kozak的酵母序列中负3位的腺苷。
[0088]
合成的dna片段在大肠杆菌繁殖载体pmk-rq或pma-t中作为冻干dna递送。含有核酮糖还原酶启动子和终止子、cen-ars和leu2选择标记以及复制起点和用于在大肠杆菌中繁殖的氨苄青霉素抗性基因的p.ohmeri载体用于过表达来自产气杆菌、大肠杆菌和球状芽
孢杆菌的核糖醇脱氢酶基因。为了克隆到表达载体中,通过用asci和sphi限制酶(new england biolabs,ipswich,massachusetts)切割从pmk-rq或pma-t载体释放相应的dna片段。
[0089]
使用zymoclean凝胶dna回收试剂盒(zymo research corporation,irvine,california)对片段(分别为764bp、764bp和743bp)进行凝胶纯化,并使用t4 dna连接酶(new england biolabs,ipswich,massachusetts),在室温下与asci/sphi消化的和凝胶纯化的载体骨架连接1小时。在用连接混合物转化xl10 gold超感受态细胞(agilent technologies,santa clara,california)后,使用zypp质粒小提试剂盒(zymo research corporation,irvine,california)分离质粒dna并通过测序(microsynth,balgach,switzerland)进行验证。
[0090]
得到的质粒pev26597、pev26599和pev26600分别含有来自产气肠杆菌(ea_rdh)、大肠杆菌(ec_rdh)和球状芽孢杆菌(rs_rdh)的核糖醇脱氢酶。
[0091]
此外,根据以下出版物,即,ehrensberger等人,structure-guided engineering of xylitol dehydrogenase cosubstrate specificity.structure 14,567-575,march 2006,所有核糖醇脱氢酶都已发生突变,以将辅因子偏好从nad更改为nadp。ea_rdh和ec_rdh中的残基asp45以及rs_rdh中的asp38被丝氨酸取代。
[0092]
为了产生ea_mrdh_d45s突变体(seq id no 7和seq id no 8),使用引物对evpr13970/evpr13974(seq id no 13和seq id no 14)和evpr13973/evpr13388(seq id no 15和seq id no 16)对相应的野生型基因进行pcr扩增,然后用引物evpr13970/evpr13388(seq id no 13和seq id no 16)进行重叠延伸pcr。通过用限制性酶asci和sphi(new england biolabs,ipswich,massachusetts)进行限制性消化,将所得片段亚克隆到用于克隆表达野生型核糖醇脱氢酶的相同载体中,然后如上所述进行连接和验证。
[0093]
为了产生ec_mrdh_d45s突变体(seq id no 9和seq id no 10),使用引物对evpr13970/evpr13974(seq id no 13和seq id no 14)和evpr13973/evpr13388(seq id no 15和seq id no 16)对相应的野生型基因进行pcr扩增,然后用引物evpr13970/evpr13388(seq id no 13和seq id no 16)进行重叠延伸pcr。通过用酶asci和sphi(new england biolabs,ipswich,massachusetts)进行限制性消化,将所得片段亚克隆到用于克隆表达野生型核糖醇脱氢酶的相同载体中,然后如上所述进行连接和验证。
[0094]
为了产生rs_mrdh_d38s突变体(seq id no 11和seq id no 12),使用引物对evpr13970/evpr13976(seq id no 13和seq id no 17)和evpr13975/evpr13388(seq id no 18和seq id no 16)对相应的野生型基因进行pcr扩增,然后用引物evpr13970/evpr13388(seq id no 13和seq id no 16)进行重叠延伸pcr。通过用酶asci和sphi(new england biolabs,ipswich,massachusetts)进行限制性消化,将所得片段亚克隆到用于克隆表达野生型核糖醇脱氢酶的相同载体中,然后如上所述进行连接和验证。
[0095]
得到的质粒pev26672、pev26675和pev26676分别含有来自产气肠杆菌(ea_mrdh_d45s)、大肠杆菌(ec_mrdh_d45s)和球状芽孢杆菌(rs_rdh_d38s)的突变核糖醇脱氢酶。
[0096]
实施例2.p.ohmeri中阿拉伯糖醇2-脱氢酶基因的缺失
[0097]
为了将磷酸戊糖途径中的通量从d-阿拉伯糖醇重定向到核糖醇,使得将d-核酮糖转化为d-阿拉伯糖醇的阿拉伯糖醇2-脱氢酶缺失。为此,构建了含有阿拉伯糖醇2-脱氢酶
的5’和3’基因组同源区的质粒,其两侧是leu2选择标记。
[0098]
使用含有psti位点的引物ev5302(seq id no 19)和含有sali位点的ev53058(seq id no 20)从p.ohmeri的基因组dna中扩增阿拉伯糖醇2-脱氢酶基因的5’同源区。通过在30μl 0.2%sds中重新悬浮新划出的菌落并在95℃下加热4分钟来制备基因组dna模板。离心后取0.5μl上清液作为pcr模板。在由200μm dntp混合物和0.5μm每种引物和0.02u/μl iproof聚合酶(bio-rad,hercules,california)在1x缓冲液中组成的反应混合物中进行pcr扩增。pcr的完成步骤如下,首先在98℃下进行30秒的初始变性步骤,然后是98℃下10秒、58℃下30秒和72℃下50秒的30个循环,最后在72℃下进行7分钟的延伸步骤。pcr产物在1.5%琼脂糖凝胶上分离,使用zymoclean凝胶dna恢复试剂盒(zymo research corporation,irvine,california)提取和纯化。743bp pcr片段用psti和sali酶(new england biolabs,ipswich,massachusetts)进行限制性消化,并在室温下,使用t4 dna连接酶(new england biolabs,ipswich,massachusetts)连接到含有leu2选择标记的载体的骨架上,该leu2选择标记有两个loxp位点,其用psti和sali限制酶(new england biolabs,ipswich,massachusetts)进行线性化操作,并用zymoclean凝胶dna回收试剂盒(zymo research corporation,irvine,california)进行凝胶纯化。用连接混合物转化xl10 gold超感受态细胞(agilent technologies,santa clara,california)后,使用zyppy质粒小量提取试剂盒(zymo research corporation,irvine,california)分离质粒dna,并通过测序(microsynth,balgach,switzerland)进行验证。得到的质粒peve4916含有一个与阿拉伯糖醇2-脱氢酶5’区域同源的片段和一个两侧有两个loxp位点的leu2选择标记。
[0099]
使用含有ncoi位点的引物ev5304(seq id no 21)和含有spei位点的ev5301(seq id no 22)从p.ohmeri的基因组dna中扩增阿拉伯糖醇2-脱氢酶的3’同源区。
[0100]
得到的749bp pcr产物用ncoi和spei酶(new england biolabs,ipswich,massachusetts)进行限制性消化,并在室温下,并使用t4 dna连接酶(new england biolabs,ipswich,massachusetts)连接到peve4916的骨架,用ncoi和spei限制性酶(new england biolabs,ipswich,马萨诸塞州)对该骨架进行线性化以及用zymoclean凝胶dna回收试剂盒(zymo research corporation,irvine,california)进行凝胶纯化。在用连接混合物转化xl10 gold超感受态细胞(agilent technologies,santa clara,california)后,使用zyppy质粒小量提取试剂盒(zymo research corporation,irvine,california)分离质粒dna并通过测序(microsynth,balgach,switzerland)进行验证。得到的质粒peve4998含有阿拉伯糖醇2-脱氢酶的5’和3’同源区,其两侧有leu2选择标记,leu2选择标记两侧有loxp-位点。
[0101]
对于p.ohmeri阿拉伯糖醇2-脱氢酶基因的缺失,质粒peve4998用noti(new england biolabs,ipswich,massachusetts)在37℃下限制消化3小时,并使用nucleobond pc 20柱(macherey-nagel,dueren,germany)将产物清理干净。
[0102]
总共使用10μg dna来转化亮氨酸营养缺陷型p.ohmeri菌株。通过green et al.,1999的原生质球方法进行酵母转化,并进行了以下修改:使用zymolyase100t,而不是裂解酶来产生原生质球,并在37℃下与酶一起温育,直到监测到在酶解酶处理之前,细胞悬浮液的od
600
减少到原始od
600
的25%。简而言之,将p.ohmeri细胞在ypd培养基(1%酵母提取物、2%蛋白胨、2%葡萄糖)中于30℃培养过夜至最终od
600
为4。通过离心收获200个od
600
单位,
用水1和m山梨糖醇洗涤200个od
600
一次,将其重悬于3ml sce缓冲液(1m山梨糖醇,100mm柠檬酸三钠盐二水合物,10mm edta,ph 5.8)中。将dtt和zymolase(lubio science,luzern,switzerland)分别添加到10mm和0.5u/od的最终浓度,然后将混合物在37℃下轻轻摇动培养。通过测量细胞悬液的od
600
来监测细胞壁消化。当该值下降到原始od的25%时,通过温和离心终止消化。收获的原生质球用1m山梨糖醇和stc缓冲液(1m山梨糖醇、10mm tris-hcl ph 7.5、10mm cacl2)洗涤,最后重悬于含有50μg/ml小牛胸腺dna(calbiochem/vwr,dietikon,switzerland)。将100μl原生质球等分试样与待转化的dna混合,并在室温下孵育10分钟。然后将1ml peg溶液(20%peg 8000、10mm tris-hcl ph 7.5、10mm cacl2)添加到悬浮液中,孵育10分钟并沉淀下来。球状体在30℃下在0.9ml sos培养基(1m山梨糖醇、25%ypd、7mm cacl2)中再生1.5小时。向再生细胞中加入5ml 50℃温顶琼脂(0.67%酵母氮碱,不含氨基酸,0.2%kaiser合成完全脱除混合物,2%葡萄糖,1m山梨糖醇,2.5%noble-agar,ph 5.8),并将混合物均匀倒入预热过的含有山梨糖醇的选择性平板上(0.67%酵母氮碱,不含氨基酸,0.2%kaiser合成完全脱除混合物,2%葡萄糖,1m山梨糖醇,ph 5.8)。将板在30℃下孵育3天。在适当的选择板上重新选择转化体。
[0103]
通过菌落pcr确认阿拉伯糖醇2-脱氢酶的缺失。
[0104]
所得菌株evst20048含有阿拉伯糖醇2-脱氢酶的缺失,因此不能产生任何d-阿拉伯糖醇。
[0105]
野生型和阿拉伯糖醇2-脱氢酶缺失菌株的d-阿拉伯糖醇滴度如表1所示。
[0106]
表1
[0107][0108]
由于生成的阿拉伯糖醇2-脱氢酶缺失的p.ohmeri菌株是亮氨酸的原养型,因此需要去除eys20048中的leu2选择标记以进行进一步的修饰。根据上述原生质球过程,通过用游离型质粒上的cre重组酶转化菌株来去除leu2选择标记。通过亮氨酸漏失板上的不可行性来证实leu2选择标记的去除。
[0109]
所得菌株是evst20327,对亮氨酸是营养缺陷型的。
[0110]
实施例3.表达核糖醇脱氢酶的p.ohmeri菌株的构建
[0111]
p.ohmeri菌株evst20327(之前在实施例2中描述为亮氨酸营养缺陷型的阿拉伯糖醇2-脱氢酶缺失菌株)和仍含有阿拉伯糖醇2-脱氢酶基因和亮氨酸营养缺陷型的野生型菌株作为宿主,用于产生能够在用质粒pev26597、pev26599和pev26600转化后产生核糖醇。
[0112]
如实施例2所述进行酵母转化。
[0113]
用质粒pev26597、pev26599和pev26600转化evst20327分别产生菌株evst24258、evst24260和evst24261。用质粒pev26597、pev26599和pev26600转化野生型菌株分别产生菌株evst24845、evst24846和evst24847。作为对照,阿拉伯糖醇2-脱氢酶缺失菌株和野生型菌株均用空leu2质粒转化,分别产生evst22653和evst22686。
[0114]
一式三份测试每个产生的菌株,以进行核糖醇生产。为此,克隆首先在种子培养基(0.67%酵母氮碱,不含氨基酸,0.2%kaiser合成完全混合物,5%葡萄糖,ph 5.7)中于37
℃下生长过夜。从该过夜培养物中接种起始od
600
为0.1的生产培养基(0.67%酵母氮碱,不含氨基酸,0.2%kaiser合成完全混合物,25%葡萄糖,ph 5.7)中的主要培养物。
[0115]
该培养物在37℃下生长96小时,使用aminex hpx-87柱(bio-rad,hercules,california)和waters tq-detector(acquity uplc,连接到三重四极杆检测器,waters,milford,massachusetts),使用等度条件,水作为流动相,通过hplc/rid测定上清液的核糖醇浓度。
[0116]
所有测试菌株的核糖醇滴度如表2所示。
[0117]
表2
[0118][0119]
p.ohmeri菌株evst20327(之前在实施例2中描述为亮氨酸营养缺陷型的阿拉伯糖醇2-脱氢酶缺失菌株)和仍含有阿拉伯糖醇2-脱氢酶基因和亮氨酸营养缺陷型的野生型菌株作为宿主,用于产生酵母菌株,该酵母菌株能够在用质粒pev26672、pev26675和pev26676转化后产生核糖醇。
[0120]
如实施例2所述进行酵母转化。
[0121]
用质粒pev26672、pev26675和pev26676转化evst20327分别产生菌株evst24348、evst24351和evst24352。用质粒pev26672、pev26675和pev26676转化野生型菌株分别产生菌株evst24849、evst24850和evst24851。
[0122]
一式三份测试每个产生的菌株,用于核糖醇生产。如上所述进行核糖醇生产。
[0123]
表3中描述了所有测试菌株的核糖醇滴度。
[0124]
表3
[0125][0126]
实施例4.突变核糖醇脱氢酶基因整合到p.ohmeri中
[0127]
为了将来自产气杆菌和大肠杆菌的突变核糖醇脱氢酶基因整合到p.ohmeri的基因组中,用到了包含核酮糖还原酶启动子和终止子、cen-ars和leu2选择标记以及复制起点和在大肠杆菌中繁殖的氨苄青霉素抗性基因的整合载体。
[0128]
通过用asci和sphi限制性内切酶(new england biolabs,ipswich,
massachusetts)切割,然后使用zymoclean凝胶dna恢复试剂盒(zymo research corporation,irvine,california)进行凝胶纯化,从pev26672中释放相应的产气杆菌突变核糖醇脱氢酶,以及使用t4 dna连接酶(new england biolabs,ipswich,massachusetts)在室温下使相应的产气杆菌突变核糖醇脱氢酶与asci/sphi消化和凝胶纯化的整合载体骨架连接1小时。如示例1中所述进行验证。
[0129]
得到的质粒pev27141携带来自产气肠杆菌的突变核糖醇脱氢酶的整合盒,两侧是p.ohmeri的核酮糖还原酶启动子和终止子以及leu2选择标记。
[0130]
为了从大肠杆菌中克隆突变的核糖醇脱氢酶,首先将基因片段克隆到含有p.ohmeri磷酸甘油酸激酶启动子和转酮酶终止子的克隆载体中,然后亚克隆到含有cen-ars和leu2选择标记,以及用于在大肠杆菌中繁殖的复制起点和氨苄青霉素抗性基因的整合载体中。通过用asci和sphi限制酶(new england biolabs,ipswich,massachusetts)切割,从pev26675释放相应的dna片段,并使用t4 dna连接酶(new england biolabs,ipswich,massachusetts),使其与asci/sphi消化和凝胶纯化的克隆载体骨架连接1个小时。如实施例1所述进行验证。随后用spei和sacii限制性内切酶(new england biolabs,ipswich,massachusetts)切割得到的质粒pev28282,并在室温下,使用t4dna连接酶(new england biolabs,ipswich,massachusetts)使得到的质粒pev28282与spei/sacii消化和凝胶纯化的整合载体骨架连接1个小时。如实施例1所述进行连接产物的验证。
[0131]
得到的质粒pev28286携带来自大肠杆菌的突变核糖醇脱氢酶的整合盒,两侧是p.ohmeri的磷酸甘油酸激酶启动子和转酮酶终止子以及leu2选择标记。
[0132]
将实施例2中描述的亮氨酸营养缺陷型菌株evst20327用作宿主,用于产生酵母菌株,该酵母菌株能够通过用noti消化的pev27141质粒转化产生核糖醇,如实施例2中所述,产生菌株evst24957。
[0133]
如实施例3所述进行核糖醇生产,并显示在表4中。
[0134]
为了进一步提高生产菌株的核糖醇滴度,整合了一个突变核糖醇脱氢酶的多拷贝。
[0135]
由于所产生的p.ohmeri菌株evsst24957对亮氨酸是原养型的,因此需要去除leu2选择标记,并且如实施例2中所述去除leu2选择标记。
[0136]
如实施例2所述,所得亮氨酸营养缺陷型菌株evst25893另外用noti消化的pev28286质粒转化,产生菌株evst26201。
[0137]
如实施例3所述进行核糖醇生产,且核糖醇生产显示在表4中。
[0138]
此外,菌株evst20327用作对照。
[0139]
表4
[0140][0141]
这些结果表明,增加整合的突变核糖醇脱氢酶基因的拷贝数显著提高了核糖醇滴度。
[0142]
序列
[0143]
seq id no 1:产气肠杆菌脱氢酶的氨基酸序列
[0144]
mnhsvssmntslsgkvaavtgaasgiglecaktllgagakvvlidregeklnkivaelgenafalqvdlmqgeqvdkiidgilqlagrldifhanagayiggpvaegdpdvwdrvlhlntnaafrcvrsvlphmiaqksgdiiftssiagvvpviwepiytaskfavqafvhttrrqvsqhgvrvgavlpgpvvtallddwpkekmeealangslmqpievaesvlfmvtrsknvtvrdlvilpnsvdl
[0145]
seq id no 2:编码产气肠杆菌脱氢酶的核苷酸序列
[0146]
atgaaccactctgtttcttctatgaacacctctttgtctggtaaggttgctgctgttaccggtgctgcttctggtatcggtttggagtgtgctaagaccttgttgggtgctggtgctaaggttgttttgatcgacagagagggtgagaagttgaacaagatcgttgctgagttgggtgagaacgctttcgctttgcaggttgacttgatgcagggtgagcaggttgacaagatcatcgacggtatcttgcagttggctggtagattggacatcttccacgctaacgctggtgcttacatcggtggtccagttgctgagggtgacccagacgtttgggacagagttttgcacttgaacaccaacgctgctttcagatgtgttagatctgttttgccacacatgatcgctcagaagtctggtgacatcatcttcacctcttctatcgctggtgttgttccagttatctgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcacaccaccagaagacaggtttctcagcacggtgttagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggagaagatggaggaggctttggctaacggttctttgatgcagccaatcgaggttgctgagtctgttttgttcatggttaccagatctaagaacgttaccgttagagacttggttatcttgccaaactctgttgacttg
[0147]
seq id no 3:大肠杆菌核糖醇脱氢酶的氨基酸序列
[0148]
mnhsvpsmntslngkvaaitgaasgiglqcaktlleagakvvlidregeklqkivvelgenayalqidlfngeqvdsmlarivelaggldifhanagayiggpvaegdpdiwdrvlnlninaafrcvravlphmiaqksgdiiftssiagvvpviwepiytaskfavqafvhttrrqvsqygirvgavlpgpvvtallddwpkakmdealangslmqpievaesvlfmvtrsknvtvrdlvilpnsvdl
[0149]
seq id no 4:编码大肠杆菌核糖醇脱氢酶的核苷酸序列
[0150]
atgaaccactctgttccatctatgaacacctctttgaacggtaaggttgctgctatcaccggtgctgcttctggtatcggtttgcagtgtgctaagaccttgttggaggctggtgctaaggttgttttgatcgacagagagggtgagaagttgcagaagatcgttgttgagttgggtgagaacgcttacgctttgcagatcgacttgttcaacggtgagcaggttgactctatgttggctagaatcgttgagttggctggtggtttggacatcttccacgctaacgctggtgcttacatcggtggtccagttgctgagggtgacccagacatctgggacagagttttgaacttgaacatcaacgctgctttcagatgtgttagagctgttttgccacacatgatcgctcagaagtctggtgacatcatcttcacctcttctatcgctggtgttgttccagttatctgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcacaccaccagaagacaggtttctcagtacggtatcagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggctaagatggacgaggctttggctaacggttctttgatgcagccaatcgaggttgctgagtctgttttgttcatggttaccagatctaagaacgttaccgttagagacttggttatcttgccaaactctgttgacttg
[0151]
seq id no 5:球状红球菌核糖醇氧化还原酶的氨基酸序列
[0152]
maelmqgkvaaitgaasgiglecartlvaegatvvlidraedrlkalcaeigpralplvvdlldgpqvsgmlprilelagsldifhanagayiggqvaegdpdawdrmlnlninaafrsvhavlpymierksgdilftssvagvvpvvwepiytaskfavqafvhstrrqvaphgvrvgavlpgpvvtallddwpkakmeealangslmqpkevaeavlfmlsrpkgvvirdlvilphsvdi
[0153]
seq id no 6:编码球状红球菌氧化还原酶的核苷酸序列
[0154]
atggctgagttgatgcagggtaaggttgctgctatcaccggtgctgcttctggtatcggtttggagtgtgctagaaccttggttgctgagggtgctaccgttgttttgatcgacagagctgaggacagattgaaggctttgtgtgctgagatcggtccaagagctttgccattggttgttgacttgttggacggtccacaggtttctggtatgttgccaagaatcttggagttggctggttctttggacatcttccacgctaacgctggtgcttacatcggtggtcaggttgctgagggtgacccagacgcttgggacagaatgttgaacttgaacatcaacgctgctttcagatctgttcacgctgttttgccatacatgatcgagagaaagtctggtgacatcttgttcacctcttctgttgctggtgttgttccagttgtttgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcactctaccagaagacaggttgctccacacggtgttagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggctaagatggaggaggctttggctaacggttctttgatgcagccaaaggaggttgctgaggctgttttgttcatgttgtctagaccaaagggtgttgttatcagagacttggttatcttgccacactctgttgacatc
[0155]
seq id no 7:产气肠杆菌d45s突变脱氢酶的氨基酸序列
[0156]
mnhsvssmntslsgkvaavtgaasgiglecaktllgagakvvlisregeklnkivaelgenafalqvdlmqgeqvdkiidgilqlagrldifhanagayiggpvaegdpdvwdrvlhlntnaafrcvrsvlphmiaqksgdiiftssiagvvpviwepiytaskfavqafvhttrrqvsqhgvrvgavlpgpvvtallddwpkekmeealangslmqpievaesvlfmvtrsknvtvrdlvilpnsvdl
[0157]
seq id no 8:编码产气肠杆菌d45s突变脱氢酶的核苷酸序列
[0158]
atgaaccactctgtttcttctatgaacacctctttgtctggtaaggttgctgctgttaccggtgctgcttctggtatcggtttggagtgtgctaagaccttgttgggtgctggtgctaaggttgttttgatctctagagagggtgagaagttgaacaagatcgttgctgagttgggtgagaacgctttcgctttgcaggttgacttgatgcagggtgagcaggttgacaagatcatcgacggtatcttgcagttggctggtagattggacatcttccacgctaacgctggtgcttacatcggtggtccagttgctgagggtgacccagacgtttgggacagagttttgcacttgaacaccaacgctgctttcagatgtgttagatctgttttgccacacatgatcgctcagaagtctggtgacatcatcttcacctcttctatcgctggtgttgttccagttatctgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcacaccaccagaagacaggtttctcagcacggtgttagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggagaagatggaggaggctttggctaacggttctttgatgcagccaatcgaggttgctgagtctgttttgttcatggttaccagatctaagaacgttaccgttagagacttggttatcttgccaaactctgttgacttg
[0159]
seq id no 9:大肠杆菌d45s突变核糖醇脱氢酶的氨基酸序列
[0160]
mnhsvpsmntslngkvaaitgaasgiglqcaktlleagakvvlisregeklqkivvelgenayalqidlfngeqvdsmlarivelaggldifhanagayiggpvaegdpdiwdrvlnlninaafrcvravlphmiaqksgdiiftssiagvvpviwepiytaskfavqafvhttrrqvsqygirvgavlpgpvvtallddwpkakmdealangslmqpievaesvlfmvtrsknvtvrdlvilpnsvdl
[0161]
seq id no 10:编码大肠杆菌d45s突变的核糖醇脱氢酶的核苷酸序列
[0162]
atgaaccactctgttccatctatgaacacctctttgaacggtaaggttgctgctatcaccggtgctgcttctggtatcggtttgcagtgtgctaagaccttgttggaggctggtgctaaggttgttttgatctctagagagggtgagaagttgcagaagatcgttgttgagttgggtgagaacgcttacgctttgcagatcgacttgttcaacggtgagcaggttgactctatgttggctagaatcgttgagttggctggtggtttggacatcttccacgctaacgctggtgcttacatcggtggtccagttgctgagggtgacccagacatctgggacagagttttgaacttgaacatcaacgctgctttcagatgtgttagagctgttttgccacacatgatcgctcagaagtctggtgacatcatcttcacctcttctatcgctggtgttgttccagttatctgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcacaccaccagaagacag
gtttctcagtacggtatcagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggctaagatggacgaggctttggctaacggttctttgatgcagccaatcgaggttgctgagtctgttttgttcatggttaccagatctaagaacgttaccgttagagacttggttatcttgccaaactctgttgacttg
[0163]
seq id no 11:球状芽孢杆菌d38s突变氧化还原酶的氨基酸序列
[0164]
maelmqgkvaaitgaasgiglecartlvaegatvvlisraedrlkalcaeigpralplvvdlldgpqvsgmlprilelagsldifhanagayiggqvaegdpdawdrmlnlninaafrsvhavlpymierksgdilftssvagvvpvvwepiytaskfavqafvhstrrqvaphgvrvgavlpgpvvtallddwpkakmeealangslmqpkevaeavlfmlsrpkgvvirdlvilphsvdi
[0165]
seq id no 12:编码球状芽孢杆菌d38s突变氧化还原酶的核苷酸序列
[0166]
atggctgagttgatgcagggtaaggttgctgctatcaccggtgctgcttctggtatcggtttggagtgtgctagaaccttggttgctgagggtgctaccgttgttttgatctctagagctgaggacagattgaaggctttgtgtgctgagatcggtccaagagctttgccattggttgttgacttgttggacggtccacaggtttctggtatgttgccaagaatcttggagttggctggttctttggacatcttccacgctaacgctggtgcttacatcggtggtcaggttgctgagggtgacccagacgcttgggacagaatgttgaacttgaacatcaacgctgctttcagatctgttcacgctgttttgccatacatgatcgagagaaagtctggtgacatcttgttcacctcttctgttgctggtgttgttccagttgtttgggagccaatctacaccgcttctaagttcgctgttcaggctttcgttcactctaccagaagacaggttgctccacacggtgttagagttggtgctgttttgccaggtccagttgttaccgctttgttggacgactggccaaaggctaagatggaggaggctttggctaacggttctttgatgcagccaaaggaggttgctgaggctgttttgttcatgttgtctagaccaaagggtgttgttatcagagacttggttatcttgccacactctgttgacatc
[0167]
seq id no 13:具有asci限制性位点(带下划线)的evpr13970 pcr寡核苷酸
[0168]
cggacccttattaaactaaaaggcgcgccaaa
[0169]
seq id no 14:用于诱变的evpr13974 pcr寡核苷酸(小写)
[0170]
cttctcaccctctctagagatcaaaacaacctt
[0171]
seq id no 15:用于诱变的evpr13973 pcr寡核苷酸(小写)
[0172]
aaggttgttttgatctctagagagggtgagaag
[0173]
seq id no 16:具有sphi限制性位点(带下划线)的evpr13388 pcr寡核苷酸
[0174]
tcatatctttctagattctcttcgagagcatgc
[0175]
seq id no 17:用于诱变的evpr13976 pcr寡核苷酸(小写)
[0176]
tctgtcctcagctctagagatcaaaacaacggt
[0177]
seq id no 18:用于诱变的evpr13975 pcr寡核苷酸(小写)
[0178]
accgttgttttgatctctagagctgaggacaga
[0179]
seq id no 19:具有psti限制性位点(带下划线)的ev5302 pcr寡核苷酸
[0180]
aaagggctgcagggatccgtagaaatcttg
[0181]
seq id no 20:具有sali限制性位点(带下划线)的ev5305 pcr寡核苷酸
[0182]
aaaggggtcgacttgctcgtggtcggaaat
[0183]
seq id no 21:具有ncoi限制性位点(带下划线)的ev5304 pcr寡核苷酸
[0184]
aaagggccatggttctactgtgctaaggcc
[0185]
seq id no 22:具有spei限制性位点(带下划线)的ev5301 pcr寡核苷酸
[0186]
aaagggactagtagaatgacacggccgaca。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1