脂肪酶修饰的菌株的制作方法
脂肪酶修饰的菌株
1.本发明涉及一种产生类视黄醇的宿主细胞,特别是油质酵母,该宿主细胞经修饰为使得在使用甘油三酯油(如例如植物油)作为碳源进行发酵期间,基于由此类宿主细胞产生的总类视黄醇的视黄醇乙酸酯的百分比增加,其中降低或消除了某些参与非期望的视黄醇或视黄醇乙酸酯转换的内源性水解酶或转移酶的活性。特别地,此类经修饰的宿主细胞可能可用于生产维生素a的生物技术过程。
2.类视黄醇,包括维生素a,是必须经由营养品供应给人类的非常重要且不可缺少的营养因子之一。类视黄醇促进人类的健康,尤其是在视觉、免疫系统和生长方面。视黄醇乙酸酯是维生素a生产过程中的重要中间体或前体。
3.目前用于类视黄醇(包括维生素a及其前体)的化学生产方法具有一些不期望的特性,诸如高能耗、复杂的纯化步骤和/或不期望的副产物。因此,在过去的几十年中,已经研究了其他制造类视黄醇(包括维生素a及其前体)的方法,所述方法包括微生物转换步骤,这将导致更经济以及更环保的维生素a生产。
4.通常,产生类视黄醇的生物系统在工业上难以处理,且/或以低水平产生化合物,使得商业规模的分离是不实际的。最大的限制因素包括此类生物系统中中间体的不稳定性和/或副产物(例如视黄基脂肪酸酯)的相对高产量,特别是当使用在作为碳源的植物油上生长的油质宿主细胞时。
5.wo2019/058000描述了一种使用在玉米油上生长的产生类胡萝卜素的宿主细胞,从β-胡萝卜素到视黄醇和视黄醇乙酸酯(一种被认为比视黄醇更稳定的中间体)的新颖发酵方法,所述宿主细胞表达异源β-胡萝卜素氧化酶(beta-carotene oxidase,bco)、视黄醛还原酶(retinal reductase,rdh)和乙酰转移酶(acetyl-transferase,atf)。然而,由这种油质宿主细胞产生的相对高百分比的视黄醇因维生素a生产而“损失”,即被宿主细胞的内源行水解酶和/或转移酶催化而转换成非期望的副产物。
6.因此,改善视黄醇转换成视黄醇乙酸酯(维生素a生产中的一种稳定中间体)的发酵过程的产物特异性和/或生产率是一项持续存在的任务。特别地,期望开发一种优选使用在植物油上生长的油质宿主细胞、具有有限的副产物形成和最大的视黄醇乙酸酯积聚,而不损害所述宿主细胞的生长的发酵方法。
7.令人惊讶的是,我们现在发现对宿主细胞,特别是油质酵母的修饰,即对参与将植物油预消化成甘油和脂肪酸的某些酶的修饰,特别是阻断,可导致视黄醇乙酸酯形成增加,即与使用相应的未修饰宿主细胞的方法相比,基于总类视黄醇的视黄醇乙酸酯的百分比可增加至少约30%,例如增加至在约70-90%或更高范围内的百分比。
8.特别地,本发明涉及一种能够形成视黄醇乙酸酯的产生类视黄醇的宿主细胞,例如真菌宿主细胞,优选油质酵母细胞,例如耶氏酵母属(yarrowia),所述宿主细胞包含一种或多种遗传修饰,即降低或消除,优选地消除某些编码水解酶或转移酶的内源基因,特别地包括例如编码内源脂肪酶和/或酯酶的基因,包括但不限于对与seq id no:5具有至少约50%,例如60%、70%、80%、90%、95%、98%或100%同一性的内源基因的活性的修饰,其中seq id no:5对应于可从解脂耶氏酵母(yarrowia lipolytica)获得的lip8。
9.在一个方面中,本发明涉及一种使用本文所定义的此类经修饰的宿主细胞的发酵方法,所述宿主细胞在作为碳源的甘油三酯油(如例如植物油,例如玉米油)上生长,其中由视黄醇转换形成的视黄醇乙酸酯增加,从而导致基于所述经修饰的宿主细胞中存在/由所述经修饰的宿主细胞产生的总类视黄醇,视黄醇乙酸酯的百分比为约至少70%,例如约75%、80%、85%、90%、95%、98%或更多,包括100%。
10.根据本发明的要被修饰的合适内源性水解酶或转移酶可以选自具有脂肪酶和/或酯酶活性的酶。术语“脂肪酶”在本文中与术语“酯酶”或“具有脂肪酶和/或酯酶活性的酶”可互换使用。它是指通常在油质宿主细胞中表达的参与将甘油三酯油(如例如植物油)预消化成甘油和脂肪酸的酶。如本文所定义的在宿主细胞中要被修饰的合适的酶可以选自属于ec类3.1.1.-的内源酶,包括但不限于一种或多种具有与耶氏酵母属lip2、lip3、lip8、tgl1、lip16、lip17、lip18或lip4活性对应的酶。
11.如本文所用,具有与耶氏酵母属中的相应lip活性对应的活性的酶不仅包括来源于耶氏酵母属(例如解脂耶氏酵母,例如耶氏酵母属lip2、lip3、lip8、tgl-1、lip16、lip17、lip18、lip4或它们的组合)的基因,而且还包括具有等同酶活性但来源于另一来源生物体的酶,特别是来源于产生视黄醇乙酸酯的油质宿主细胞的酶,其中对此类等同内源基因的修饰将导致如本文所定义的视黄醛至视黄醇乙酸酯转换增加。
12.本发明涉及一种宿主细胞,所述宿主细胞在某些内源性水解酶/转移酶活性上被修饰,从而导致如本文所定义的维生素a发酵过程中的视黄醇乙酸酯增加。待修饰的合适宿主细胞选自产生类视黄醇的宿主细胞,特别是产生视黄醇乙酸酯的宿主细胞,其中视黄醇乙酸酯是经由由乙酰化酶(acetylating enzyme,atf)催化视黄醇的酶促转化而形成的,例如真菌宿主细胞,包括油质酵母细胞,例如红冬孢酵母属(rhodosporidium)、油脂酵母属(lipomyces)或耶氏酵母属,优选耶氏酵母属,更优选解脂耶氏酵母,其中经由如本文所定义的对所述内源酶活性(例如脂肪酶和/或酯酶活性)的修饰,视黄醇至视黄醇乙酸酯的转换被增强,导致基于细胞中总类视黄醇的视黄醇乙酸酯的百分比增加了至少约10%,并且其中所述修饰包括遗传修饰,例如降低/消除编码某些耶氏酵母属脂肪酶/酯酶的内源基因的活性或来自如本文所指定的其它油质宿主细胞的对应内源酶活性,包括但不限于对应基因的缺失。
13.如本文所定义,“经修饰的宿主细胞”与“野生型宿主细胞”相比较,“野生型宿主细胞”即在所定义的酶活性方面没有此类修饰的相应宿主细胞,即其中所述对应的内源酶(仍然)在体内表达并有活性。
14.在一个实施方式中,本发明提供了一种经修饰的宿主细胞,例如经修饰的产生视黄醇乙酸酯的油质宿主细胞,所述宿主细胞包含对与seq id no:5具有至少约50%,例如60%、70%、80%、90%、95%、98%或100%同一性的多肽的修饰,包括但不限于可获自解脂耶氏酵母的lip8,其中所述多肽的活性被降低或消除,优选被消除,包括基因表达的降低或消除,其中在作为碳源的甘油三酯油(例如植物玉米油)存在下的发酵中使用此类经修饰的宿主细胞导致视黄醇转换成的视黄醇乙酸酯的百分比增加,例如基于如本文所定义的相应宿主细胞中存在的总类视黄醇,有至少约70%的视黄醇乙酸酯。特别地,所述宿主细胞选自耶氏酵母属,例如解脂耶氏酵母,其中根据seq id no:5的lip8,包括由根据seq id no:6的多核苷酸编码的多肽的活性,被降低或消除,优选被消除,从而导致基于宿主细胞中的总类
视黄醇,有约30%或更多的视黄醇乙酸酯。根据seq id no:5的lip8来源于refseq yali0_b09361g。lip8或来自如本文所定义的另一种油质酵母的对应酶的降低或消除可以与其它内源酶的降低或消除进行组合,所述其它内源酶包括但不限于具有等同于耶氏酵母属lip2、lip3、tgl1、lip16、lip17、lip18或lip4活性的酶,包括与选自由seq id no:1、seq id no:3、seq id no:7、seq id no:9、seq id no:11、seq id no:13、seq id no:15以及它们的组合组成的组的序列具有至少约50%同一性的酶。
15.在一个实施方式中,本发明提供了一种经修饰的宿主细胞,例如经修饰的产生视黄醇乙酸酯的油质宿主细胞,所述宿主细胞包含对与seq id no:1具有至少约50%,例如60%、70%、80%、90%、95%、98%或100%同一性的多肽的修饰,包括但不限于可获自解脂耶氏酵母的lip2,其中所述多肽的活性被降低或消除,优选被消除,包括基因表达的降低或消除,其中在作为碳源的甘油三酯油(例如植物玉米油)存在下的发酵中使用此类经修饰的宿主细胞导致视黄醇转换成的视黄醇乙酸酯的百分比增加,例如基于如本文所定义的相应宿主细胞中存在的总类视黄醇,有至少约70%的视黄醇乙酸酯。特别地,所述宿主细胞选自耶氏酵母属,例如解脂耶氏酵母,其中根据seq id no:1的lip2,包括由根据seq id no:2的多核苷酸编码的多肽的活性,被降低或消除,优选被消除,从而导致基于宿主细胞中的总类视黄醇,有约30%或更多的视黄醇乙酸酯。根据seq id no:1的lip2来源于refseq yali0_a20350g。lip2或来自如本文所定义的另一种油质酵母的对应酶的降低或消除可以与其它内源酶的降低或消除进行组合,所述其它内源酶包括但不限于具有等同于耶氏酵母属lip8、lip3、tgl1、lip16、lip17、lip18或lip4活性的酶,包括与选自由seq id no:5、seq id no:3、seq id no:7、seq id no:9、seq id no:11、seq id no:13、seq id no:15以及它们的组合组成的组的序列具有至少约50%同一性的酶。
16.在又一实施方式中,本发明提供了一种经修饰的宿主细胞,例如经修饰的产生视黄醇乙酸酯的油质宿主细胞,所述宿主细胞包含对与seq id no:3具有至少约50%,例如60%、70%、80%、90%、95%、98%或100%同一性的多肽的修饰,包括但不限于可获自解脂耶氏酵母的lip3,其中所述多肽的活性被降低或消除,优选被消除,包括基因表达的降低或消除,其中在作为碳源的甘油三酯油(例如植物玉米油)存在下的发酵中使用此类经修饰的宿主细胞导致视黄醇转换成的视黄醇乙酸酯的百分比增加,例如基于如本文所定义的相应宿主细胞中存在的总类视黄醇,有至少约70%的视黄醇乙酸酯。特别地,所述宿主细胞选自耶氏酵母属,例如解脂耶氏酵母,其中根据seq id no:3的lip3,包括由根据seq id no:4的多核苷酸编码的多肽的活性,被降低或消除,优选被消除,从而导致基于宿主细胞中的总类视黄醇,有约30%或更多的视黄醇乙酸酯。根据seq id no:3的lip3来源于refseq yali0_b08030g。lip3或来自如本文所定义的另一种油质酵母的对应酶的降低或消除可以与其它内源酶的降低或消除进行组合,所述其它内源酶包括但不限于具有等同于耶氏酵母属lip8、lip2、tgl1、lip16、lip17、lip18或lip4活性的酶,包括与选自由seq id no:5、seq id no:1、seq id no:7、seq id no:9、seq id no:11、seq id no:13、seq id no:15以及它们的组合组成的组的序列具有至少约50%同一性的酶。
17.在又一实施方式中,本发明提供了一种经修饰的宿主细胞,例如经修饰的产生视黄醇乙酸酯的油质宿主细胞,所述宿主细胞包含对与seq id no:15具有至少约50%,例如60%、70%、80%、90%、95%、98%或100%同一性的多肽的修饰,包括但不限于可获自解脂
耶氏酵母的lip4,其中所述多肽的活性被降低或消除,优选被消除,包括基因表达的降低或消除,其中在作为碳源的甘油三酯油(例如植物玉米油)存在下的发酵中使用此类经修饰的宿主细胞导致视黄醇转换成的视黄醇乙酸酯的百分比增加,例如基于如本文所定义的相应宿主细胞中存在的总类视黄醇,有至少约70%的视黄醇乙酸酯。特别地,所述宿主细胞选自耶氏酵母属,例如解脂耶氏酵母,其中根据seq id no:15的lip4,包括由根据seq id no:16的多核苷酸编码的多肽的活性,被降低或消除,优选被消除,从而导致基于宿主细胞中的总类视黄醇,有约30%或更多的视黄醇乙酸酯。根据seq id no:15的lip4来源于refseq yali0_e08492g。lip4或来自如本文所定义的另一种油质酵母的对应酶的降低或消除可以与其它内源酶的降低或消除进行组合,所述其它内源酶包括但不限于具有等同于耶氏酵母属lip8、lip2、lip3、tgl1、lip16、lip17或lip18活性的酶,包括与选自由seq id no:5、seq id no:1、seq id no:3、seq id no:7、seq id no:9、seq id no:11、seq id no:13以及它们的组合组成的组的序列具有至少约50%同一性的酶。
18.根据另外的实施方式,本发明提供了一种经修饰的宿主细胞,例如经修饰的产生视黄醇乙酸酯的油质宿主细胞,所述宿主细胞包含对选自由与seq id no:7、seq id no:9、seq id no:11、seq id no:13以及它们的组合具有至少约50%、例如60%、70%、80%、90%、95%、98%或100%同一性的多肽组成的组的多肽的修饰;包括但不限于可从选自由tgl1、lip16、lip17、lip18以及它们的组合组成的组的解脂耶氏酵母获得的酶;其中所述多肽的活性被降低或消除,优选被消除,包括基因表达的降低或消除,其中在作为碳源的甘油三酯油(例如植物玉米油)存在下的发酵中使用此类经修饰的宿主细胞导致视黄醇转换成的视黄醇乙酸酯的百分比增加,例如基于如本文所定义的相应宿主细胞中存在的总类视黄醇,有至少约70%的视黄醇乙酸酯。特别地,所述宿主细胞选自耶氏酵母属,例如解脂耶氏酵母,其中选自根据seq id no:7、seq id no:9、seq id no:11、seq id no:13的tgl1、lip16、lip17、lip18或它们的组合的酶,包括由根据seq id no:8、seq id no:10、seq id no:12、seq id no:14的多核苷酸编码的多肽的活性被降低或消除,优选被消除,从而导致基于宿主细胞中的总类视黄醇,有约30%或更多的视黄醇乙酸酯。根据seq id no:7的tgl1来源于refseq yali0_e32035g。根据seq id no:9的lip16来源于refseq yali0_d18480g。根据seq id no:11的lip17来源于refseq yali0_f32131g。根据seq id no:13的lip18来源于refseq yali0_b20350g。选自由tgl1、lip16、lip17、lip18以及它们的组合组成的组的酶或来自如本文所定义的另一种油质酵母的对应酶的降低或消除可以与其它内源酶的降低或消除进行组合,所述其它内源酶包括但不限于具有等同于耶氏酵母属lip8、lip2和/或lip3和/或lip4活性的酶,包括与选自由seq id no:5、seq id no:1、seq id no:3、seq id no:15以及它们的组合组成的组的序列具有至少约50%同一性的酶。
19.优选地,根据本发明的经修饰的宿主细胞包含对具有与根据seq id no:5的lip8具有至少约50%同一性的酶的活性的酶,例如可从耶氏酵母属获得的酶,或来自另一种宿主细胞的具有等同于如本文所定义的耶氏酵母属lip8的活性的酶的修饰,从而导致例如在其中宿主细胞在作为碳源的甘油三酯油(例如玉米玉米油)的存在下生长的过程中,基于总类视黄醇的视黄醇乙酸酯的百分比在约70-90%或更高的范围内。结合对宿主细胞中内源酶活性的进一步修饰,视黄醇乙酸酯的百分比可以进一步增加,例如在其中宿主细胞在作为碳源的甘油三酯油(例如玉米玉米油)的存在下生长的过程中,基于总类视黄醇的视黄醇
乙酸酯的百分比增加至少约10%。特别优选的是与进一步修饰进行组合,所述进一步修饰为例如对与根据seq id no:1或seq id no:3或seq id no:15的lip2和/或lip3和/或lip4具有至少约50%同一性的酶,例如可从耶氏酵母属获得的酶或来自另一种宿主细胞的具有等同于耶氏酵母属lip2和/或lip3和/或lip4的活性的酶的修饰。通过引入对与选自由与根据seq id no:7、seq id no:9、seq id no:11、seq id no:13的tgl1、lip16、lip17、lip18以及它们的组合组成的组的酶具有至少约50%的同一性的一种或多种酶,例如可从耶氏酵母属获得的酶或者来自另一种宿主细胞的具有等同于选自由耶氏酵母tgl1、lip16、lip17和lip18组成的组的酶的活性的一种或多种修饰,基于总类视黄醇的视黄醇乙酸酯百分比的进一步增加是可能的。
20.如本文所用,酶的“活性”,特别是水解酶或转移酶活性,包括如本文所定义的脂肪酶或酯酶的活性,被定义为“比活性”,即其催化活性,即其催化由给定底物形成产物,例如形成视黄基脂肪酸酯的能力。如果酶(例如脂肪酶或酯酶)在体内(即在如本文所限定的宿主细胞内)或在合适的底物存在下的系统内执行其催化活性,则所述酶是有活性的。本领域技术人员知道如何测量酶活性,特别是如本文所定义的脂肪酶的活性,包括但不限于具有与耶氏酵母属lip2和/或lip3和/或lip8和/或tgl1和/或lip16和/或lip17和/或lip18和/或lip4活性对应的活性的酶。评估如本文所定义的脂肪酶/酯酶参与视黄基脂肪酸酯形成的能力的分析方法是本领域中已知的,并且包括通过hplc等进行测量。关于如本文所定义的lip2、lip3、lip4、lip8、tgl1、lip16、lip17和/或lip18的活性,技术人员可以测量由视黄醇转换形成的视黄基脂肪酸酯与由视黄醇转换形成的视黄醇乙酸酯进行比较,两者都是用经修饰的宿主细胞和野生型宿主细胞测量的。
21.如本文所用,酶,特别是如本文所定义的脂肪酶或酯酶具有“降低的或消除的”活性,是指所述酶的比活性降低,即催化由给定底物形成产物,例如在发酵期间将甘油三酯(例如植物油,优选玉米油)转换成甘油和脂肪酸的能力降低/消除,包括编码此类脂肪酶或酯酶的相应(内源)基因的活性降低或消除。降低100%在本文中被称为酶活性的消除,此是例如经由编码所述酶的内源基因中的缺失、插入、移码突变、错义突变或过早终止密码子,或者用已知方法阻断所述内源基因的表达和/或活性可实现的。
22.如本文所用,导致基因活性消除的基因“缺失”包括核酸序列中可导致具有减弱功能的等位基因的所有突变,包括但不限于缺失、插入、移码突变、错义突变和过早终止密码子,其中缺失意味着在宿主细胞中无法(再)检测到对应的基因/蛋白质活性,例如特别是内源脂肪酶活性。
23.在一个具体的实施方式中,本发明涉及如本文所定义的能够形成视黄醇乙酸酯的经修饰的宿主细胞,其中与使用相应的未修饰的宿主细胞形成视黄醇乙酸酯相比,在发酵期间视黄醇乙酸酯的形成增加。如本文所用,增加的视黄醇乙酸酯形成是指基于所述经修饰的宿主细胞中存在/由所述经修饰的宿主细胞产生的总类视黄醇,视黄醇乙酸酯的百分比为至少约30%,例如约75%、80%、85%、90%、95%、98%或更高,包括100%。
24.因此,本发明涉及一种产生类视黄醇的经修饰的宿主细胞,特别是产生视黄醇乙酸酯的真菌宿主细胞,其中与相应的未修饰的宿主细胞相比,基于由所述宿主细胞产生的类视黄醇总量,视黄醇乙酸酯的百分比至少在约70-90%的范围内,例如至少约70%,例如约75%、80%、85%、90%、95%、98%或更高,包括100%,并且其中所述修饰意味着降低或
消除内源脂肪酶或酯酶活性,包括但不限于与耶氏酵母属lip8对应的活性,并且任选地还有与耶氏酵母属lip2和/或lip3和/或lip4和/或tgl1和/或lip16和/或lip17和/或lip18对应的活性。
25.要根据本发明进行修饰的宿主细胞可以选自wo2019/058001或wo2019/057999中公开的解脂耶氏酵母,其中经由β-胡萝卜素氧化酶(beta-carotene oxidase,bco)、视黄醇脱氢酶(retinol dehydrogenase,rdh)和/或乙酰转移酶(acetyl-transferase,atf)的异源表达来优化从β-胡萝卜素形成视黄醇乙酸酯。特别地,如本文所定义的经修饰的宿主细胞可以表达来源于黑腹果蝇(drosophila melanogaster)的bco、来源于藤仓镰刀菌(fusarium fujikuroi)的rdh,和真菌atf,例如来源于拉茜斯酵母属(lachancea)或酵母属(saccharomyces)的atf。为了增强由宿主细胞产生的将β-胡萝卜素转换成视黄醛、转换成视黄醇、转化成视黄醇乙酸酯,所述酶可包含一个或多个突变,从而导致改进的将视黄醇乙酰化为视黄醇乙酸酯。
26.在产生类视黄醇的宿主细胞中引入修饰以产生更少或没有基因和/或蛋白质(例如如本文所定义的的脂肪酶或酯酶和相应基因)的拷贝,包括生成如本文所定义的具有在与耶氏酵母属lip8对应的酶方面降低/消除的活性,任选地还包括在与耶氏酵母属lip2和/或lip3和/或lip4和/或tgl1和/或lip16和/或lip17和/或lip18对应的酶方面降低/消除的活性的能够形成视黄醇乙酸酯的经修饰的合适宿主细胞,可包括使用弱启动子,或引入对(如本文所述的)相应酶(的部分),特别是其调节元件的一个或多个突变(例如插入、缺失/敲除或点/移码/错义突变、过早终止密码子),从而导致所述酶活性的降低/消除,例如经由体内诱变进行失活,例如通过催化残基的突变或通过产生干扰蛋白质折叠或在由宿主细胞分泌时激活脂肪酶/酯酶所必需的前序列(pre-sequence)或前导序列(pro-sequence)切割的突变或缺失。技术人员知道如何对如本文所定义的宿主细胞进行遗传操纵或修饰,从而导致降低/消除此类活性,例如水解酶/转移酶活性,包括如本文所定义的脂肪酶或酯酶活性。这些遗传操纵包括但不限于例如使用质粒、病毒或其他载体进行基因置换、基因扩增、基因破坏、转染、转化。这种遗传操纵的示例可以例如影响由如本文所定义的酶的n末端区域介导的与dna的相互作用,或与其他效应分子的相互作用。具体地,可以在蛋白质的功能(诸如用于催化活性的功能)部分中进行导致降低/消除的特定酶活性的修饰。此外,可以通过使所述酶与特异性抑制剂或与所述酶特异性相互作用的其他物质接触来实现酶比活性的降低/消除。为了鉴定此类抑制剂,可以在怀疑抑制所述酶的活性的化合物的存在下表达并测试相应酶(例如如本文所定义的某些脂肪酶)的活性。
27.可以以不同的方式来执行核酸或氨基酸中的突变产生,即诱变,诸如通过随机化或定点诱变,由诸如辐射等试剂引起物理损伤、化学处理,或插入遗传元件。技术人员知道如何引入突变。
28.根据本发明的能够产生视黄醇乙酸酯的经修饰的宿主细胞可包含进一步的修饰,包括降低或消除所述宿主细胞中存在的进一步的脂肪酶或酯酶活性,只要它们导致基于在如本文所定义的发酵中产生的总类视黄醇,视黄醇乙酸酯的百分比增加,而不损害此类经修饰的宿主细胞的生长即可。
29.因此,本发明还包括一种用于例如经由降低或消除特定酶活性,包括具有与耶氏酵母属lip8和/或lip2和/或lip3和/或lip4和/或tgl和/或lip16和/或lip17和/或lip18对
应的活性的脂肪酶/酯酶,来鉴定待修饰的内源水解酶的方法,所述方法包括在合适的宿主细胞,例如产生视黄醇乙酸酯的宿主细胞中逐一过表达相应内源基因,以观察此是否会放大负面效应,如降低视黄醇乙酸酯的百分比的步骤。随后,可以例如经由使其过表达会导致在所述宿主细胞的发酵期间视黄醇乙酸酯减少的酶的活性缺失,来降低/消除对应的基因,例如使对应的基因失活,并挑取具有增加的视黄醇乙酸酯形成的克隆。
30.一个具体的实施方式涉及一种用于鉴定如本文所定义并要根据本发明进行修饰的合适的内源水解酶/转移酶的方法,所述方法包括以下步骤:将植物油预消化成甘油和脂肪酸,
31.(2)基于与seq id no:1、seq id no:3、seq id no:5、seq id no:7、seq id no:9、seq id no:11、seq id no:13、seq id no:15至少约50%,例如60%、70%、80%、90%、95%、98%或100%的序列同源性,选择内源脂肪酶或酯酶,
32.(3)使所选择的基因过表达并比较基于总类视黄醇的视黄醇乙酸酯百分比,
33.(4)选择基因,其中所述基因的过表达对类视黄醇混合物中的视黄醇乙酸酯百分比有负面影响,以及
34.(5)例如经由缺失使所选择的在过表达时对视黄醇乙酸酯的形成具有负面影响的基因降低或消除,例如失活。根据本发明的一个具体方面,如本文所定义的经修饰的宿主细胞可在用于通过增加由宿主细胞产生的类视黄醇混合物中存在的视黄醇乙酸酯的百分比来减少维生素a发酵过程中的副产物形成的过程中使用。如本文所定义的经修饰的宿主细胞可包含进一步的修饰,包括引入(和表达)经宿主优化的异源多核苷酸。技术人员知道如何生成此类经修饰的多核苷酸。应当理解的是,本发明包括此类经宿主优化的核酸分子以及包含所谓的沉默突变的分子,只要它们仍然导致如本文所定义的携带经修饰的脂肪酶/酯酶活性的经修饰的宿主细胞即可。
35.术语“序列同一性”、“同一性%”或“序列同源性”在本文中可互换使用。出于本发明的目的,在此限定,为了确定两个氨基酸序列或两个核酸序列的序列同源性或序列同一性的百分比,对序列进行比对以实现最佳比较目的。为了优化两个序列之间的比对,可以在进行比较的两个序列中的任一序列中引入空位。此类比对可以在被比较的序列的全长上进行。或者,可以在较短的长度上进行比对,例如在约20个、约50个、约100个或更多个核苷酸/碱基或氨基酸上进行比对。序列同一性是两个序列之间在所报告的比对区域上相同匹配的百分比。可以使用用于两个序列的比对的needleman和wunsch算法来确定两个氨基酸序列之间或两个核苷酸序列之间的序列同一性百分比(needleman,s.b.和wunsch,c.d.(1970)j.mol.biol.48,443-453)。该氨基酸序列和核苷酸序列都可以通过算法来进行比对。已在计算机程序needle中实现了needleman-wunsch算法。出于本发明的目的,使用来自emboss程序包的needle程序(2.8.0版或更高版本,emboss:the european molecular biology open software suite(2000)rice,longden和bleasby,trends in genetics 16,(6),第276-277页,http://emboss.bioinformatics.nl/)。对于蛋白质序列,使用eblosum62来用于取代矩阵。对于核苷酸序列,使用ednafull。所使用的任选参数是为10的空位开放罚分和为0.5的空位延伸罚分。技术人员将理解,当使用不同的算法时,所有这些不同的参数将产生略微不同的结果,但是两个序列的总体同一性百分比不会显著改变。
36.如上所述通过程序needle进行比对后,查询序列与本发明序列之间的序列同一性
百分比计算如下:在两个序列中显示相同氨基酸或相同核苷酸的比对中对应位置的数目除以减去比对中的空位总数后的比对总长度。如本文所定义的同一性可以通过使用nobrief选项从needle获得,并在程序的输出中标记为“最长同一性”。如果所比较的两个氨基酸序列在他们的任何氨基酸上都没有差异,则它们是相同的或具有100%的同一性。关于源自植物的酶,技术人员知道植物来源的酶可包含叶绿体靶向信号,所述叶绿体靶向信号将经由特定的酶(例如叶绿体加工酶(chloroplast processing enzyme,cpe))切割。
37.在一个实施方式中,本发明的特征在于如本文所定义的经修饰的宿主细胞在用于产生视黄醇和视黄醇乙酸酯的发酵方法中的用途,包括经由合适的视黄醇脱氢酶(rdh)的作用酶促转换视黄醛的步骤,特别是基于由此类宿主细胞产生的类视黄醇总量,具有百分比为至少约65-90%的反式视黄醛,如例如在wo2019/057998中所例示。任选地,从发酵培养基中分离和/或进一步纯化视黄醇。此类方法可包括进一步的步骤,例如经由合适的bco,优选具有朝向反式视黄醛形成的选择性的bco,更优选导致基于由所述宿主细胞产生的类视黄醇总量有至少约65-90%的反式异构体的bco的作用将β-胡萝卜素酶促转换成视黄醛,例如在wo2019/057999中所例示。因此,优选的使用如本文所定义的经修饰的宿主细胞产生视黄醇和/或视黄醇乙酸酯的方法包括以下步骤:(1)经由合适的bco的作用将β-胡萝卜素酶促转换成视黄醛;(2)经由合适的rdh的作用将视黄醛酶促转换成视黄醇;以及任选地(3)从发酵培养基中分离和/或纯化视黄醇。
38.在一个实施方式中,本发明的特征在于如本文所定义的经修饰的宿主细胞在用于产生视黄醇乙酸酯的发酵过程中的用途,包括经由合适的乙酰转移酶(atf)的作用酶促转换视黄醇的步骤,如例如在wo2019/058001中所例示。任选地,从发酵培养基中分离和/或进一步纯化视黄醇乙酸酯。此类方法可包括进一步的步骤,例如经由合适的bco,优选具有朝向反式视黄醛形成的选择性的bco,更优选导致基于由所述宿主细胞产生的类视黄醇总量有至少约65-90%的反式异构体的bco的作用将β-胡萝卜素酶促转换成视黄醛,例如在wo2019/057999中所例示;和/或经由合适的视黄醇脱氢酶(rdh)的作用进行视黄醛的酶促转换,特别地基于由此类宿主细胞产生的类视黄醇总量,具有百分比为至少约65-90%的反式视黄醛,如例如在wo2019/057998中所例示。因此,优选的使用如本文所定义的经修饰的宿主细胞产生视黄醇乙酸酯的方法包括以下步骤:(1)经由合适的bco的作用将β-胡萝卜素酶促转换成视黄醛;(2)经由合适的rdh的作用将视黄醛酶促转换成视黄醇;(3)将视黄醇酶促转换成视黄醇乙酸酯;以及任选地(4)从发酵培养基中分离和/或纯化视黄醇乙酸酯。
39.经由本文所公开的方法获得的视黄醇和/或视黄醇乙酸酯可以在本领域中已知的条件下进一步加工/转换成维生素a。因此,本发明涉及一种使用如本文所定义的经修饰的宿主细胞进行维生素a的发酵生产的方法。
40.因此,在一个具体实施方式中,本发明涉及一种用于产生产物的方法,所述产物选自由以下组成的组:视黄醇、视黄醇乙酸酯、维生素a,和包含视黄醇、视黄醇乙酸酯和维生素a的混合物,其中所述混合物包含基于总类视黄醇至少约30%的视黄醇乙酸酯,所述方法包括以下步骤:
41.(a)提供能够形成视黄醇乙酸酯的产生类视黄醇的宿主细胞,
42.(b)将一种或多种修饰引入所述宿主细胞的基因组中,例如将修饰引入属于ec 3.1.1.-类的具有脂肪酶/酯酶活性的酶中,例如降低/消除所述酶活性,包括但不限于使相
应的基因缺失,特别是消除与耶氏酵母属lip8对应的脂肪酶活性,以及任选地进一步消除与耶氏酵母属lip2和/或lip3和/或lip4和/或tgl1和/或lip16和/或lip17和/或lip18对应的酶活性,其中所述经修饰的宿主细胞仍然能够在作为碳源的甘油三酯油(例如植物玉米油)上生长;
43.(c)任选地引入进一步的修饰,包括本领域技术人员已知的参与视黄醇、视黄醇乙酸酯和/或维生素a产生的(异源)酶的一个或多个拷贝的表达,
44.(d)在合适的条件下培养此类经修饰的宿主细胞,从而导致视黄醇、视黄醇乙酸酯和/或维生素a的形成,其中所述经修饰的宿主细胞在作为碳源的植物油上生长;以及
45.(e)任选地从培养(发酵)培养基中分离和/或进一步纯化视黄醇、视黄醇乙酸酯和/或维生素a。
46.经由此类方法获得的产物例如视黄醇、视黄醇乙酸酯和/或维生素a可以进一步在如在本领域中使用的用于食物、饲料或药物应用的配方中使用。
47.如本文所定义的经修饰的宿主细胞可以在需氧或厌氧条件下在补充有适当营养物并且如技术人员针对不同宿主细胞已知的包含作为碳源的甘油三酯油(例如植物玉米油)的存在的水性培养基中培养。宿主细胞的培养/生长可以以分批、补料分批、半连续或连续模式进行。如本领域技术人员所已知的,取决于宿主细胞,优选地类视黄醇(诸如维生素a)和前体(诸如视黄醛、视黄醇、视黄醇乙酸酯)的产生可变化。选自耶氏酵母属的产生β-胡萝卜素和类视黄醇的宿主细胞的培养和分离描述于例如wo2008/042338中。
48.要用于本发明的碳源是所有合适的甘油三酯油,包括但不限于含有游离脂肪酸(如油酸、棕榈酸、硬脂酸或亚油酸)和甘油的预水解油,例如植物油,包括但不限于玉米油、卡诺拉油、红花油、葵花油、玉米油、大豆油或花生油,优选玉米油。
49.如本文所用的“类视黄醇”或“类视黄醇混合物”包含维生素a、维生素a的前体和/或中间体,例如β-胡萝卜素切割产物(也称为脱辅基类胡萝卜素),包括但不限于视黄醛、视黄酸、视黄醇、视黄酸甲醇盐、视黄醇乙酸酯、视黄基脂肪酸酯、4-酮-类视黄醇、3-羟基-类视黄醇或它们的组合。类视黄醇的生物合成描述于例如wo2008/042338中。能够在例如发酵过程中产生类视黄醇的宿主细胞被称为“产生类视黄醇的宿主细胞”。维生素a途径的基因和生成产生类视黄醇的宿主细胞的方法是本领域已知的(参见例如wo2019/058000),包括但不限于β-胡萝卜素氧化酶、视黄醇脱氢酶和/或乙酰转移酶。能够将视黄醇乙酰化成视黄醇乙酸酯的合适乙酰转移酶(atf)公开于例如wo2019/058001中。导致高百分比的反式视黄醛的合适β-胡萝卜素氧化酶描述于例如wo2019/057999中。如本文所用的“产生视黄醇乙酸酯的宿主细胞”表达催化视黄醇转换成视黄醇乙酸酯的合适atf。
50.如本文所用的“视黄基脂肪酸酯”还包括长链视黄酯。这些长链视黄酯定义了由至少约8个,诸如9个、10个、12个、13个、15个或20个碳原子且至多约26个,诸如25个、22个、21个或更少的碳原子,以及优选至多约6个不饱和键,诸如0个、1个、2个、4个、5个、6个不饱和键组成的烃酯。长链视黄酯包括但不限于亚油酸、油酸或棕榈酸。
51.如本文所用的“维生素a”可以是在水溶液、固体和制剂中存在的任何化学形式的维生素a,包括视黄醇、视黄醇乙酸酯和视黄酯。它还包括视黄酸,例如未解离的游离酸形式的视黄酸,或解离为阴离子的视黄酸。
52.如本文所用的视黄醛是以iupac名称(2e,4e,6e,8e)-3,7-二甲基-9-(2,6,6-三甲
基环己烯-1-基)壬-2,4,6,8-四烯醛已知的。它包括顺式同种型和反式同种型两者,诸如11-顺式视黄醛、13-顺式视黄醛、反式视黄醛和全反式视黄醛。出于本发明的目的,形成反式视黄醛是优选的,所述反式视黄醛可通过使用立体选择性β-胡萝卜素氧化酶生成,例如在例如wo2019/057999中所述。
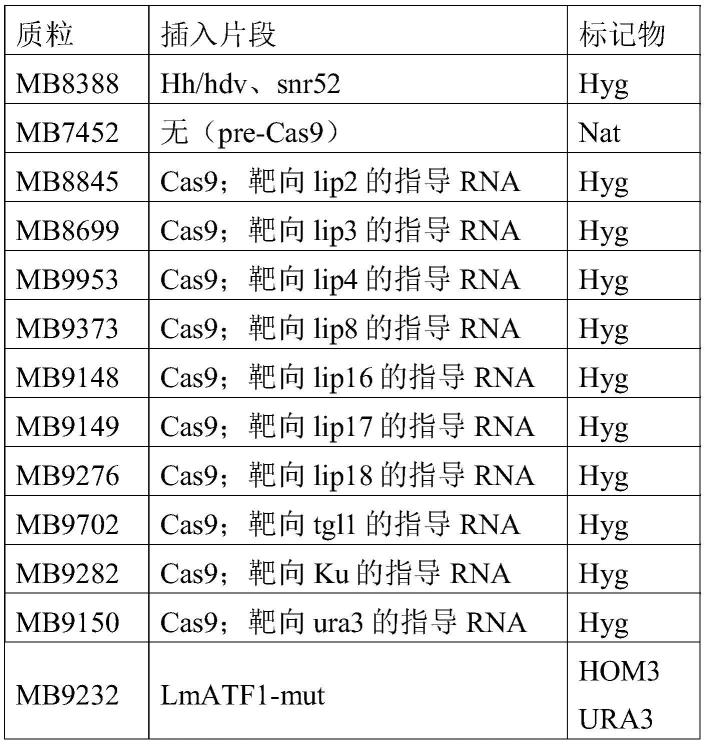
53.如本文所用的“类胡萝卜素”包括通过两个具有20个碳的香叶基香叶基焦磷酸酯分子的连接而自然形成的长的40个碳缀合的类异戊二烯多烯。这些类胡萝卜素包括但不限于八氢番茄红素、番茄红素和胡萝卜素,诸如β-胡萝卜素,所述类胡萝卜素可以在4-酮位置或3-羟基位置上被氧化以产生角黄素、玉米黄质或虾青素。类胡萝卜素的生物合成描述于例如wo2006/102342中。能够经由一个或多个导致类胡萝卜素,特别是β-胡萝卜素的酶促转换步骤产生类胡萝卜素的细胞,即其中参与类胡萝卜素产生的相应多肽在体内被表达并具有活性的细胞,在本文中被称为产生类胡萝卜素的宿主细胞。用于生成产生类胡萝卜素的细胞的基因和方法是本领域已知的,参见例如wo2006/102342。取决于要产生的类胡萝卜素,可以涉及不同的基因。
54.根据本发明的转换被定义为特定的酶促活性,即本文所述的酶的催化活性,包括但不限于脂肪酶或酯酶,特别是属于ec 3.1.1.-类的参与将视黄醇转换成视黄醇脂肪酸酯的内源酶、β-胡萝卜素氧化酶(bco)、视黄醇脱氢酶(rdh)、乙酰转移酶(atf)的酶促活性。
55.关于本发明,应当理解的是,生物(诸如微生物、真菌、藻类或植物)也包括具有相同生理性质的此类物种的同义词或基名(basonyms),如由国际原核生物命名法(international code of nomenclature of prokaryotes)或关于藻类、真菌和植物的国际命名法(international code of nomenclature)(melbourne法)所限定的。因此,例如,菌株lachancea mirantina是来源于日本的菌株接合酵母属ifo 11066的同义词。
56.以下实施例仅是说明性的,并不意图以任何方式限制本发明的范围。在本技术中引用的所有参考文献、专利申请、专利和公开的专利申请的内容据此以引用方式并入,特别是wo2019/058000、wo2019/058001、wo2008/042338、wo2019/057999、wo2006/102342或wo2019/057998。
实施例
57.实施例1:通用方法和菌株
58.本文所述的所有基本分子生物学和dna操纵程序通常是根据sambrook等人(编著),molecular cloning:a laboratory manual.cold spring harbor laboratory press:new york(1989)或ausubel等人(编著)current protocols in molecular biology.wiley:new york(1998)执行的。例示的所有遗传操纵都是在解脂耶氏酵母中执行的。
59.摇板测定.通常,向800μl的0.075%酵母提取物、0.25%的蛋白胨(0.25x yp)接种10μl新近生长的耶氏酵母属,并覆盖200μl的drakeol 5(penreco,karns city,pa,usa)矿物油,在该矿物油中含有2%油酸作为碳源。使转化体的克隆分离物在24孔板(multitron,30℃,800rpm)中在含有20%矿物油的ypd培养基中生长4天。将矿物油级分从摇板孔中移出,并使用光电二极管阵列检测器在正相柱上通过hplc进行分析。
60.dna转化.通过在ypd板培养基上过夜生长来转化菌株,从板上刮下50μl细胞,然后
通过在含有1μg转化dna(通常是用于整合转化的线性dna)、40%peg 3550mw、100mm乙酸锂、50mm二硫苏糖醇、5mm tris-cl ph 8.0、0.5mm edta的500μl中在40℃下孵育60分钟来转化,随后直接铺板到选择性培养基上,或者在显性抗生素标记物选择的情况下,使细胞在30℃下在ypd液体培养基上生长4小时,然后再铺板到选择性培养基上。
61.dna分子生物学.在puc57载体中以nhei和mlui末端合成基因。通常,将基因亚克隆到mb5082
‘
ura3’载体(seq id no:35)中,以用于解脂耶氏酵母转化中的标记物选择。为了通过基因和标记物hindiii/xbai(mb5082)的随机非同源末端连接来进行干净的基因插入,通过凝胶电泳和qiagen凝胶纯化柱来纯化限制性片段。为了从产生β-胡萝卜素的菌株生成产生视黄醇乙酸酯的菌株,用质粒mb9232转化该菌株,参见表2,用sfii切割并对hom3和ura3自养型进行双重选择。在genscript(piscataway,nj,usa)处合成质粒mb9287和mb9953,所述质粒含有cas9,以及在mb9287的情况下靶向lip2、lip3和lip8并且在mb9953的情况下靶向lip4的指导rna表达系统。
62.质粒列表.表1、表2、表3和序列表中列出了要使用的质粒、菌株、核苷酸和氨基酸序列。一般而言,本文提及的所有未修饰的序列与数据库中参考菌株clib122的登录序列相同(dujon b等人,nature.2004jul 1;430(6995):35-44)。
63.表1:用于构建菌株的质粒的列表,所述菌株用于过表达或缺失被指示为“插入片段”的相应基因,或用于构建用于使用所述插入片段作为grna驱动器与如所指示的标记物一起进行crispr/cas9方法。“lmatf1-mut”是指携带aa取代s480q_g409a_v407i_h69a_i484l的lachancea mirantina(lmatf1;wo2019058001中的seq id no:13)。有关更多详细信息,请参见文本。
[0064][0065]
表2:所使用的耶氏酵母属菌株的列表。在wo2016172282(表2和实施例5)中描述了ml7788和ml15710的构建。有关更多详细信息,请参见文本或表1。
[0066]
[0067][0068]
表3a:用于构建质粒/菌株的序列的列表。有关序列的详细信息,请参见序列表。
[0069]
[0070][0071]
表3b:如实施例3中所述的用于crispr cas9方法、pcr、测序的引物的列表。有关序列的更多详细信息,请参见序列表。
[0072]
[0073]
[0074]
[0075][0076]
发酵条件.发酵与前述条件相同,在总体积为0.5l至5l的台式反应器中使用矿物油覆盖和搅拌罐(参见wo2016/172282,实施例5和实施例6,但使用不同的油),然而它们是油酸进料的。通常,在补料分批搅拌罐反应器中观察到了相同的结果,具有提高的生产率,此证明了该系统用于生产类视黄醇的效用。优选地,用6%的葡萄糖分批进行发酵,并且在溶解氧下降到低于约20%后加入20%矿物油,并且在整个进料程序中继续进料以达到20%的溶解氧。在138小时处收获发酵器并进行比较。
[0077]
uplc反相视黄醇方法.对于快速筛选,这种方法不分离顺式异构体,仅分离主要官能团。使用带pda检测器(或类似物)和自动进样器的waters acquity uplc来进样。使用acquity uplc hss t31.8um p/n 186003539来解析类视黄醇。对于类视黄醇相关化合物,流动相由1000ml己烷、30ml异丙醇和0.1ml乙酸组成。柱温为20℃。进样体积是5μl。检测器是从210nm至600nm进行收集的光电二极管阵列检测器。根据表4检测分析物。
[0078]
表4a:使用反相视黄醇方法的分析物列表。所有加入的中间体的加总给出了类视黄醇的总量。β-胡萝卜素*可在325nm处检测到并将干扰视黄酯定量,因此必须小心观察胡萝卜素峰并且不要将它们包括在类视黄醇定量中。“n/a”表示“不适用”。有关更多详细信息,请参见文本。
[0079][0080]
表4b:具有溶剂a:水;溶剂b:乙腈;溶剂c:甲醇;溶剂d:叔丁基甲醚的uplc方法梯度。
[0081][0082]
方法校准.针对视黄醇乙酸酯校准方法,使用所指示的响应因子,针对视黄醇乙酸酯对视黄醇和视黄醛进行定量。使用容量瓶将视黄醇乙酸酯以约200μg/ml的浓度溶解在thf中作为储备溶液。使用容量瓶,在50/50甲醇/mtbe中制备储备溶液的x20、x50和x100稀释液。视黄醇乙酸酯的紫外吸光度会很快变成非线性,因此必须小心保持在线性范围内。因此,可能浓度越低越好。视黄醇棕榈酸酯也可用作视黄酯校准品。
[0083]
样品制备.根据条件,通过各种方法制备样品。对于全培养液或经洗涤的培养液样品,将培养液置于经称重的管中,并加入流动相。简单地在2ml试管中,加入25μl充分混合的培养液和975μl的thf。然后根据制造商的说明书在匀浆器(bertin corp,rockville,md,usa)中以最高设置3x处理样本,通常3次重复
×
15分钟
×
7500rpm。对于经洗涤的沉淀物,将样本在微量离心机中的1.7ml管中以10000rpm旋转1分钟,将培养液倾析出,加入1ml水混合,沉淀,然后倾析出,并定容至初始体积。将混合物再次沉淀,并用适量的流动相定容,并通过珠磨进行处理。为了分析矿物油级分,将
样品以4000rpm旋转10分钟,并通过正排量移液器(eppendorf,hauppauge,ny,usa)将油从顶部移出,稀释到流动相中,通过涡旋混合,并通过uplc分析测量类视黄醇浓度。
[0084]
实施例2:解脂耶氏酵母中的脂肪酶/酯酶过表达
[0085]
为了测试内源脂肪酶和/或酯酶对合适的耶氏酵母属宿主中类视黄醇产生的影响,进行了过表达实验,其中当时仅1种基因过表达(没有2种或更多种基因的组合)。
[0086]
如上所述过表达脂肪酶(实施例1)。合成天然耶氏酵母属脂肪酶基因,并通过genscript验证序列,然后将所述基因克隆到mb5082的nhei和mlui位点中。这些基因是tef1启动子驱动的,tef1启动子驱动允许通过尿嘧啶营养缺陷型菌株(ura3)的互补进行选择。
[0087]
将含有被xbai/hindiii切割的相应脂肪酶/酯酶基因的质粒转化到携带野生型lip8基因的产生类视黄醇的菌株ml18210-9中(参见实施例1,表2),并进行尿嘧啶原养型选择。使转化的克隆分离物在标准摇板测定中在0.25x酵母/蛋白胨(yp)以及玉米油作为碳源的2%和20%矿物油覆盖中生长4天,并通过先前描述的uplc分析方法进行测定。通过摇板测试经转化的耶氏酵母属菌株的至少两个单独克隆分离物,并通过uplc测定法测量每质量总类视黄醇中的视黄酯%和视黄醇%。结果在表5中叙述,显示了视黄基脂肪酸酯和视黄醇的产生。使用lip8的过表达实现了视黄基脂肪酸酯积聚和视黄醇转换方面的最佳表现,使用lip3过表达可见一些较小的影响。
[0088]
表5:如所指示的过表达单一内源脂肪酶或酯酶的耶氏酵母属菌株的性能。给出了基于类视黄醇总量,视黄酯的百分比(“酯%”)和视黄醇的百分比(“视黄醇%”)。空载体是没有插入orf的质粒,可以解释为阴性对照。有关更多详细信息,请参见文本。
[0089]
插入片段酯%视黄醇%空826lip32418lip8953tgl1843lip16761lip17865lip18945est1725lip11626lip12625lip20725lip1626lip15725lipr724ipf3594525
[0090]
实施例3:解脂耶氏酵母中脂肪酶基因的缺失
[0091]
使用现代crispr cas9方法使脂肪酶基因缺失。在诺尔丝菌素选择下,用表达cas9的mb7452(seq id no:34)预转化菌株,当随后的指导rna被转化时,这增加了缺失频率。使用10.1.3软件(biomatters ltd)选择cas9指导rna。选择接近开放阅读框
(open reading frame,orf)的起始处的位点以进行单个切割,或者选择在5'和3'处的位点以去除大部分基因。将指导序列插入载体mb8388(seq id no:33)的sapi克隆位点中,合成并通过genscript进行序列验证(序列见表3)。将菌株转化,并在200μg/ml的ypd潮霉素上选择,然后复制接种到ypd上。质粒通过在含有100μg/ml的诺尔丝菌素的ypd平板上外生长来传代,并复制接种到含200μg/ml的潮霉素的ypd上以鉴定已经失去指导rna片段,但仍然含有precas9质粒的mb7452的菌落。然后通过使用上游100bp和下游100bp的引物对该基因进行pcr来筛选这些克隆中的缺失,通过凝胶迁移率鉴定缺失,并对缺失进行测序。为了精确地去除cas9缺失的orf,在先前使用mb9282使ku70基因(yali0c08701g)缺失的菌株中使用模板dna(如在菌株clib122中100bp,50bp在orf的5'端并且50bp在orf的3'端)。指导rna表达区的序列参见表3中。使序列中编码指导序列的核苷酸退火并连接到sapi位点,并且导致寡核苷酸中存在的sapi位点被去除。指导序列的退火由指导序列中的特定突出端(上链上的5'至3':atg、gtt、cgt、ttt)指导。含有sapi位点的指导序列的前三个核苷酸被包含在插入序列中以使比对清晰,并且通过匹配突出端,经退火的突出端可以被装配到载体mb8388(seq id no:33)中。将24个碱基对的插入序列插入到由锤头状核酶系统(hh、hdv)驱动和加工的指导rna中,并且66个碱基对的插入物由耶氏酵母属snr52启动子驱动。单链寡核苷酸可以通过对上组和底下组进行退火并使用这些来连接到合适的sapi位点中,以装配指导序列。在mb8388中含有这些插入片段的质粒已经在dna提供商genscript(piscataway,nj,usa.)处常规合成。这些装配物中使用的寡核苷酸的示例包括在表3b中。
[0092]
实施例4:脂肪酶敲除对视黄醇乙酸酯形成的影响
[0093]
为了探索对视黄醇乙酸酯生产的影响,我们在产生视黄醇乙酸酯的菌株ml18210-1中构建了脂肪酶缺失,该菌株表达来自lachancea mirantina的高活性乙酰转移酶,即lmatf1(参见wo2019058001:seq id no:13),携带氨基酸取代s480q_g409a v407i_h69a_i484l。所述菌株的谱系由表2可知。使用crispr cas9方法进行脂肪酶基因的开放阅读框的去除。该方案通过使用mb9282初步引入ku70突变,随后将脂肪酶缺失质粒与模板dna(orf的5'和3'端的100个核苷酸碱基对,作为片段基因从genewiz.com,cambridge,ma,usa订购)共转化来执行,该模板dna指导orf的精确缺失,因为修复ku70突变体中的双链断裂需要同源重组。用这种技术执行仅一个脂肪酶基因的缺失,或几个脂肪酶基因的缺失,即连续缺失。测试所述经修饰的菌株的类视黄醇形成,特别是视黄醇乙酸酯的形成,如表6所示,重点在于纯度,即基于类视黄醇总量的视黄醇乙酸酯的百分比,以及丰度,即使用脂肪酶缺失菌株的视黄醇乙酸酯形成与使用菌株ml18210-1(针对所有内源脂肪酶基因的野生型菌株)的视黄醇乙酸酯形成之间的比较。使菌株在0.25倍酵母蛋白胨进料的摇板中在2%油酸中生长,并如实施例1中所述在摇板中用20%矿物油覆盖物在30℃发酵4天。表6中显示了单独lip8缺失的结果,导致基于总类视黄醇,视黄醇乙酸酯百分比为70%,或者与lip2和/或lip3和/或lip4组合,该百分比进一步增加。加入选自tgl1和/或lip16和/或lip17和/或lip18的进一步缺失可能导致至少相同的视黄基乙酰基百分比,即基于总类视黄醇至少约70-90%范围内的视黄醇乙酸酯,与仅缺失lip8的视黄醇乙酸酯形成相比进一步增加了至少约10%。
[0094]
表6:脂肪酶缺失对产生视黄醇乙酸酯的耶氏酵母属宿主中的视黄醇乙酸酯形成的纯度和丰度的影响。“%retac”意指视黄醇乙酸酯的纯度,“增加[%]”意指视黄醇乙酸酯的丰度,其中针对菌株ml18210-2的值为零,“缺失”是指缺失的基因。有关进一步详细信息,
请参见文本。
[0095]
ml菌株缺失%retac增加[%]18210-1n/an/an/a18210-2lip870%018210-3lip8 lip278%1218210-4lip8 lip2 lip392%3118210-5lip8 lip2 lip3 lip494%32
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1