用于抑制CPS1的哌嗪化合物的制作方法
用于抑制cps1的哌嗪化合物
1.相关申请的交叉引用
2.本技术要求2019年11月22日提交的美国临时专利申请号62/939,228的权益。该申请通过援引并入,如同在本文完整重写一样。
背景技术:
3.尿素循环的主要功能是从血液中除去有毒的氨。氨作为氨基酸分解代谢的正常副产物而产生。(adeva,m.m.,souto,g.,blanco,n.&donapetry,c.ammonium metabolism in humans[人体的铵代谢].metabolism[代谢]61,1495-1511(2012))。在癌症中,恶性细胞已经找到了利用这种途径来支持肿瘤生长的方法。(keshet,r.等人,rewiring urea cycle metabolism in cancer to support anabolism[重新连接癌症中的尿素循环代谢以支持合成代谢].nat rev cancer[自然综述:癌症]18,634-645(2018);lee,j.s.等人urea cycle dysregulation generates clinically relevant genomic and biochemical signatures[尿素循环失调产生临床相关的基因组和生化特征].cell[细胞]174,1559-1570.e22(2018);rabinovich,s.等人diversion of aspartate in ass1-deficient tumours fosters de novo pyrimidine synthesis[ass1缺陷肿瘤中天冬氨酸的转移促进嘧啶从头合成].nature[自然]527,379-383(2015);li,l.等人p53 regulation of ammonia metabolism through urea cycle controls polyamine biosynthesis[p53通过尿素循环调节氨代谢控制多胺生物合成].nature[自然]567,253-256(2019);m.等人role of cps1in cell growth,metabolism,and prognosis in lkb1-inactivated lung adenocarcinoma[cps1在lkb1失活肺腺癌中的细胞生长、代谢和预后中的作用].jnci j natl cancer inst[国立癌症研究所杂志]109,djw231(2017);kim,j.等人cps1 maintains pyrimidine pools and dna synthesis in kras/lkb1-mutant lung cancer cells[cps1维持kras/lkb1突变体肺癌细胞中的嘧啶库和dna合成].nature[自然]546,168-172(2017);pham-danis,c.等人urea cycle sustains cellular energetics upon egfr inhibition in egfr-mutant nsclc[尿素循环维持egfr突变体nsclc中egfr抑制后的细胞能量].mol.cancer res[分子癌症研究].17,1351-1364(2019))。
[0004]
这主要通过两种机制实现。一种机制是重新利用尿素循环代谢物以维持合成代谢途径,主要是支持嘧啶合成。第二种机制是上调尿素循环活性,以防止有毒的氨在生长的肿瘤中积累。
[0005]
催化氨参与尿素循环中的第一限速步骤,氨甲酰磷酸合成酶1(cps1)活性的上调通过这些机制在支持肿瘤生长中起重要作用。已经证明cps1过表达和活性通过支持多种癌症类型中的嘧啶合成来促进肿瘤生长。(keshet等人;lee等人;m.等人;kim,j.等人)在这种情况下,cps1产生的氨甲酰磷酸绕过尿素循环,而是被嘧啶生物合成途径中的cad基因消耗。这种重新连接的途径允许癌细胞绕过嘧啶生物合成途径中cps2功能的嘧啶抑制负反馈回路,否则将限制嘧啶在快速生长的恶性细胞中用于dna合成。在p53缺陷型癌症中,cps1过表达已被证明是从肿瘤中除去有毒的氨以允许持续生长所必需的。(li,l.等
人)
[0006]
cps1表达的上调发生在几种癌症类型中,并且与肺癌、结肠癌、胆管癌和一些胶质母细胞瘤亚型的预后不良有关。(kim,j.等人;palaniappan,a.等人,computational identification ofnovel stage-specific biomarkers in colorectal cancer progression[结直肠癌进展中新阶段特异性生物标志物的计算识别].plos one[公共科学图书馆:综合]11,e0156665(2016);may,d.等人investigating neoplastic progression of ulcerative colitis with label-free comparative proteomics[用无标记比较蛋白质组学研究溃疡性结肠炎的肿瘤进展].j.proteome res.[蛋白质组研究期刊]10,200-209(2011);lee,y.-y.等人overexpression of cps1 is an independent negative prognosticator in rectal cancers receiving concurrent chemoradiotherapy[cps1的过表达是接受同步放化疗的直肠癌的独立阴性预后因素].tumor biol[肿瘤生物学].35,11097-11105(2014);ma,s.-l.等人co-expression of the carbamoyl-phosphate synthase 1 gene and its long non-coding rna correlates with poor prognosis of patients with intrahepatic cholangiocarcinoma[氨甲酰磷酸合酶1基因及其长链非编码rna的共表达与肝内胆管癌患者的不良预后相关].molecular medicine reports[分子医学报告]12,7915-7926(2015);milinkovic,v.等人identification of novel genetic alterations in samples of malignant glioma patients[鉴定恶性神经胶质瘤患者样品中的新基因改变].plos one[公共科学图书馆:综合]8,e82108(2013))。这些观察结果强调了鉴定小分子抑制剂以探测cps1癌症生物学的必要性,希望可以开发靶向疗法来治疗依赖于cps1而生长的癌症。
[0007]
在人类基因组中,有两种已知的具有氨甲酰磷酸合成活性的基因,即cps1和cad。(de cima,s.等人structure of human carbamoyl phosphate synthetase:deciphering the on/off switch of human ureagenesis[人氨甲酰磷酸合成酶的结构:破译人尿素生成的开/关开关].sci rep[科学报告]5,16950(2015);shaw,s.m.&carrey,e.a.regulation of the mammalian carbamoyl-phosphate synthetase ii by effectors and phosphorylation[效应子和磷酸化对哺乳动物氨甲酰磷酸合成酶ii的调节].altered affinity for atp and magnesium ions measured using the ammonia-dependent part reaction[使用氨依赖性部分反应测量的atp和镁离子的亲和力改变].eur.j.biochem[欧洲生物化学杂志].207,957-965(1992))。
[0008]
cad是一种三功能酶,具有cps2、天冬氨酰转氨甲酰酶和二氢乳清酸酶的活性。在正常生理条件下,cps1活性仅与线粒体中通过尿素循环的氨解毒有关,而细胞质中的cad活性催化嘧啶从头合成中的前三个步骤。在考虑开发用于治疗癌症的cps1靶向抑制剂时,cps1优于cps2的对cad活性的选择性是避免与嘧啶合成的全身性抑制相关的毒性的首要优先选择。
[0009]
cps1蛋白由六个球状结构域组成:一个功能未知的小n端结构域、一个功能失活的谷氨酰胺氨基转移酶结构域、两个独特的atp酶结构域、一个整合结构域和一个n-乙酰谷氨酸(nag)结合结构域。(de cima,s.等人)cps1从氨、碳酸氢盐和两分子atp合成氨甲酰磷酸。这通过其两个独立且功能不同的atp酶结构域的协同努力来实现。在第一个atp酶结构域,碳酸氢盐首先被磷酸化,产生羧基磷酸盐。然后羧基磷酸盐的磷酸基团被氨取代,产生氨基
甲酸盐,其随后通过内部通道穿梭到第二个atp酶结构域。然后来自第二个atp分子的磷酸根转移到氨基甲酸盐,产生最终产物氨甲酰磷酸。
[0010]
cps1活性受到小分子辅因子n-乙酰谷氨酸(nag)的刺激,nag与nag结合结构域结合。在nag结合后,atp酶结构域中发生大的构象变化,从而实现高效催化。整合结构域将两个atp酶结构域分开,并可能有助于催化能力cps1构象的稳定性。
技术实现要素:
[0011]
本文描述了新化合物,它们可用于治疗癌症,特别是表现出改变的cps1状态的癌症,并且非常特别是表现出相对于来自需要癌症治疗的受试者的非癌细胞cps1表达增加的癌症。
[0012]
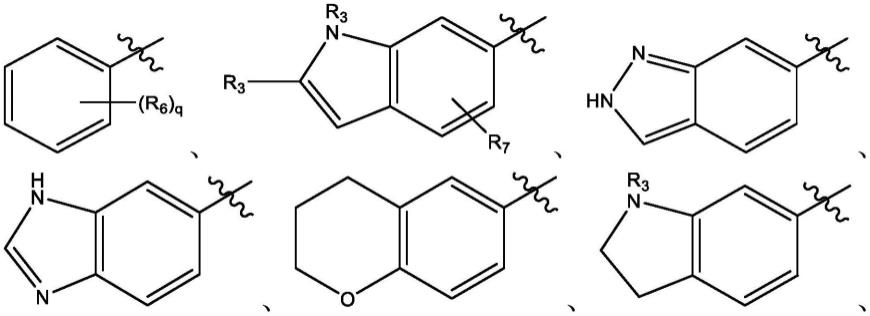
实施例可以包括例如一种由式i给出的化合物
[0013][0014]
或其药学上可接受的盐,其中
[0015]
r1选自由以下组成的组
[0016][0016]
其中
[0017]
p为0-2;
[0018]
r2各自相同或不同并且选自由-och3、-cl、-oh、-ch3和-f组成的组;
[0019]
r3各自相同或不同并且选自由-h或-ch3组成的组;
[0020]
n为0-2;
[0021]
r4各自相同或不同并且选自-h或-ch3;
[0022]
r5选自由以下组成的组:
[0023][0024][0025]
其中
[0026]
q为0-3;
[0027]
r6独立地相同或不同并且选自由以下组成的组:-f、-och3、-ochf2、-sch3、-ch3、-ocf3、-och2ph、-och(ch3)2、-nhc(o)ch3、-cl、-oh、-n(ch3)2、-oet、-ch2ch2oh、-s(o)2ch3、
[0028]
并且
[0029]
r7为-h、-f或-cl。
[0030]
在其他实施例中,r1为
[0031][0032]
在其他实施例中,r5选自由以下组成的组:
[0033][0034][0034]
其中
[0035]
q为0-3;r6独立地相同或不同并且选自由以下组成的组:-f、-och3、-ochf2、-sch3、-ch3、-ocf3、-och2ph、-och(ch3)2、-cl、-oh、-n(ch3)2、-oet、-ch2ch2oh、
[0036]
其中仅一个r6可以是-och3;并且r7为-h、-f或-cl。
[0037]
其他实施例提供了由式ii或式iii给出的化合物
[0038][0039]
或其药学上可接受的盐,其中r5选自由以下组成的组:
[0040][0041]
其中r
6a
选自由-h和-f组成的组;r
6b
选自由-h和-f组成的组;r
6c
选自由以下组成的组:-etoh、-och3、-cl、-n(ch3)2、-oh、-f、-ochf2、-ch3、-och(ch3)2、-ocf3、-och2ph、-oet、-sch3、
[0042]r6d
选自由-h和-f组成的组;r
6e
选自由-h和-f组成的组;其中r
6a
、r
6b
、r
6d
或r
6e
中的至少两个为-h。
[0043]
其他实施例提供了一种化合物或药学上可接受的盐,其中r5为
[0044][0045]
其他实施例提供了一种化合物或药学上可接受的盐,其中r1选自由以下组成的组
[0046][0047]
其中
[0048]r2a
为-h或-och3;
[0049]r2b
为-h或-oh;
[0050]r2c
为-h;
[0051]r2d
为-h或-och3;
[0052]r2e
为-h;
[0053]r2f
为-h、-f或-cl;
[0054]r2g
为-h;并且
[0055]r2h
为-h、-f、-cl或-ch3。
[0056]
其他实施例提供了一种化合物或药学上可接受的盐,其中r1为
[0057][0058]
并且其中r5选自由以下组成的组
[0059][0060]
其他实施例提供了一种化合物或药学上可接受的盐,其中r5选自由以下组成的组:组:
[0061]
其他实施例提供了一种化合物或药学上可接受的盐,其中r5为
[0062][0063]
其他实施例提供了一种化合物或药学上可接受的盐,其中r5为
[0064][0065]
其中
[0066]r6a
选自由-h和-f组成的组;
[0067]r6b
选自由-h和-f组成的组;
[0068]r6c
选自由以下组成的组:-etoh、-och3、-cl、-n(ch3)2、-oh、-f、-ochf2、-ch3、-och(ch3)2、-ocf3、-och2ph、-oet、-sch3、
[0069][0070]r6d
选自由-h和-f组成的组;
[0071]r6e
选自由-h和-f组成的组;
[0072]
其中r
6a
、r
6b
、r
6d
或r
6e
中的至少两个为-h。
[0073]
其他实施例可以提供一种药物组合物,该药物组合物包含有效量的如本文报道的化合物或药学上可接受的盐和至少一种药学上可接受的赋形剂。
[0074]
其他实施例提供了一种治疗需要治疗的受试者的癌症的方法,该方法包括向所述受试者施用有效量的本文报道的药物组合物、化合物或药学上可接受的盐。
[0075]
其他实施例提供了一种治疗需要治疗的受试者的癌症的方法,该方法包括向所述受试者施用有效量的如本文报道的化合物、药学上可接受的盐或药物组合物。
[0076]
其他实施例提供了一种治疗有需要的受试者的癌症的方法,该方法包括:检测来自所述受试者的含有所述癌症的细胞的生物样品中改变的cps1状态,并且如果所述癌症具有所述改变的cps1状态,则向所述受试者施用有效量的如本文报道的化合物、药学上可接受的盐或药物组合物。在其他实施例中,“改变的cps1状态”是cps1的表达增加。
[0077]
其他实施例提供了如本文报道的化合物或药学上可接受的盐在制备用于治疗癌症的药物中的用途。其他实施例提供了如本文报道的化合物或药学上可接受的盐的用途。
[0078]
如本文报道的各种实施例的化合物示于表1中。
[0079]
表1
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
具体实施方式
[0099]
本文引用的所有出版物和专利文献均通过援引并入本文,如同每个这样的出版物或文献被具体且单独地指出通过援引并入本文一样。在本披露的文本与通过援引并入的一个或多个文献的文本冲突的情况下,以本披露为准。对出版物和专利文献的引用并不旨在承认任何出版物和专利文献是相关的现有技术,也不构成对出版物和专利文献的内容或日期的任何承认。现在已经通过书面描述的方式描述了本文描述的实施例,本领域技术人员将认识到,本文描述的实施例可以在各种实施例中实践,并且本文提供的描述和实例是为
了说明而不是对权利要求的限制。
[0100]
如本文所用,“烷基”、“c1、c2、c3、c4、c5或c6烷基”或“c
1-c6烷基”旨在包括c1、c2、c3、c4、c5或c6直链(线性)饱和脂族烃基团和c3、c4、c5或c6支链饱和脂族烃基团。例如,c
1-c6烷基旨在包括c1、c2、c3、c4、c5和c6烷基基团。烷基的实例包括具有一至六个碳原子的部分,诸如但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基、仲戊基或正己基。
[0101]
在某些实施例中,直链或支链烷基具有六个或更少的碳原子(例如,对于直链为c
1-c6,对于支链为c
3-c6),并且在另一个实施例中,直链或支链烷基具有四个或更少的碳原子。
[0102]
如本文所用,术语“环烷基”是指具有3至7个碳原子(例如,c
3-c7)的饱和或不饱和非芳族烃环。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环戊烯基、环己烯基和环庚烯基。
[0103]
除非另有说明,否则术语“杂环烷基”是指具有一个或多个杂原子(例如o、n或s)的饱和或不饱和非芳族3-8元单环基团、7-10元稠合双环基团。杂环烷基基团的实例包括但不限于哌啶基、哌嗪基、吡咯烷基、二噁烷基、四氢呋喃基、异吲哚啉基、吲哚啉基、咪唑烷基、吡唑烷基、噁唑烷基、异噁唑烷基、三唑烷基、环氧乙烷基、氮杂环丁烷基、氧杂环丁烷基、噻吩烷基、1,2,3,6-四氢吡啶基、四氢吡喃基、四氢噻吩、二氢吡喃基、吡喃基、吗啉基、1,4-二氮杂环庚烷基、1,4-氧杂氮杂环庚烷基等。
[0104]
杂环烷基基团的其他实例包括但不限于吖啶基、吖辛因基、苯并咪唑基、苯并呋喃基、苯并噻吩基、苯并苯硫基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、4ah-咔唑基、咔啉基、色满基、色烯基、噌啉基、十氢喹啉基、2h,6h-1,5,2-二噻嗪基、二氢呋喃并[2,3-b]四氢呋喃、呋喃基、呋咱基、咪唑烷基、咪唑啉基、咪唑基、1h-吲唑基、吲哚烯基、吲哚啉基、吲哚嗪基、吲哚基、3h-吲哚基、靛红酰基、异苯并呋喃基、异色满烷基、异吲唑基、异吲哚啉基、异吲哚基、异喹啉基、异噻唑基、异噁唑基、亚甲基二氧基苯基、吗啉基、萘啶基、八氢异喹啉基、噁二唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、1,2,4-噁二唑5(4h)-酮、噁唑烷基、噁唑基、噁吲哚基、嘧啶基、菲啶基、菲咯啉基、吩嗪基、吩噻嗪基、吩噁噻吩基、吩噁嗪基、酞嗪基、哌嗪基、哌啶基、哌啶酮基、4-哌啶酮基、胡椒基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑烷基、吡唑啉基、吡唑基、哒嗪基、吡啶并噁唑、吡啶并咪唑、吡啶并噻唑、吡啶基、氮苯基、嘧啶基、吡咯烷基、吡咯啉基、2h-吡咯基、吡咯基、喹唑啉基、喹啉基、4h-喹嗪基、喹喔啉基、奎宁环基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、四唑基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、苯硫基、三嗪基、1,2,3-三唑基、1,2,4-三唑基、1,2,5-三唑基、1,3,4-三唑基和呫吨基。
[0105]
术语“任选取代的烷基”是指未取代的烷基或具有取代烃主链的一个或多个碳上的一个或多个氢原子的指定取代基的烷基。这样的取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸根、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸根、膦酸根、亚膦酸根、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚
氨基、巯基、烷硫基、芳硫基、硫代羧酸根、硫酸根、烷基亚磺酰基、磺酸根、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷芳基或芳族或杂芳族部分。
[0106]“芳基烷基”或“芳烷基”部分是被芳基取代的烷基(例如苯甲基(苄基))。“烷基芳基”部分是被烷基(例如甲基苯基)取代的芳基。
[0107]“烯基”包括在长度和可能的取代方面与上述烷基类似但含有至少一个双键的不饱和脂族基团。例如,术语“烯基”包括直链烯基基团(例如,乙烯基、丙烯基、丁烯基、戊烯基、己烯基)和支链烯基基团。在某些实施例中,直链或支链烯基基团在其主链中具有六个或更少的碳原子(例如,对于直链为c
2-c6,对于支链为c
3-c6)。术语“c
2-c
6”包括含有二至六个碳原子的烯基基团。术语“c
3-c
6”包括含有三至六个碳原子的烯基基团。
[0108]
术语“任选取代的烯基”是指未取代的烯基或具有取代一个或多个烃主链碳原子上的一个或多个氢原子的指定取代基的烯基。这样的取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸根、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸根、膦酸根、亚膦酸根、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸根、硫酸根、烷基亚磺酰基、磺酸根、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、杂环基、烷芳基或芳族或杂芳族部分。
[0109]“炔基”包括在长度和可能的取代方面与上述烷基类似但含有至少一个三键的不饱和脂族基团。例如,“炔基”包括直链炔基基团(例如乙炔基、丙炔基、丁炔基、戊炔基、己炔基)和支链炔基基团。在某些实施例中,直链或支链炔基基团在其主链中具有六个或更少的碳原子(例如,对于直链为c
2-c6,对于支链为c
3-c6)。术语“c
2-c
6”包括含有二至六个碳原子的炔基基团。术语“c
3-c
6”包括含有三至六个碳原子的炔基基团。
[0110]
术语“任选取代的炔基”是指未取代的炔基或具有取代一个或多个烃主链碳原子上的一个或多个氢原子的指定取代基的炔基。这样的取代基可以包括例如烷基、烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸根、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸根、膦酸根、亚膦酸根、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸根、硫酸根、烷基亚磺酰基、磺酸根、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷芳基或芳族或杂芳族部分。
[0111]
其他任选取代的部分(例如任选取代的环烷基、杂环烷基、芳基或杂芳基)包括未取代的部分和具有一个或多个指定取代基的部分。例如,取代的杂环烷基包括被一个或多个烷基基团取代的那些,诸如2,2,6,6-四甲基-哌啶基和2,2,6,6-四甲基-1,2,3,6-四氢吡啶基。
[0112]“芳基”包括具有芳香性的基团,包括具有至少一个芳环并且在环结构中不含有任何杂原子的“共轭”或多环体系。实例包括苯基、苄基、1,2,3,4-四氢萘基等。
[0113]“杂芳基”基团是如上所定义的芳基基团,不同的是在环结构中具有一至四个杂原子,还可以称为“芳基杂环”或“杂芳烃”。如本文所用,术语“杂芳基”旨在包括稳定的5-、6-或7-元单环或7-、8-、9-、10-、11-或12-元双环芳族杂环,其由碳原子和一个或多个杂原子
(例如1或1-2或1-3或1-4或1-5或1-6个杂原子,或例如1、2、3、4、5或6个杂原子)组成,这些杂原子独立地选自由氮、氧和硫组成的组。氮原子可以是取代的或未取代的(即,n或nr',其中r'是h或其他取代基,如所定义的)。氮和硫杂原子可以任选地被氧化(即,n
→
o和s(o)
p
,其中p=1或2)。需要注意的是,芳族杂环中s和o原子的总数不超过1个。
[0114]
杂芳基基团的实例包括吡咯、呋喃、噻吩、噻唑、异噻唑、咪唑、三唑、四唑、吡唑、噁唑、异噁唑、吡啶、吡嗪、哒嗪、嘧啶等。
[0115]
此外,术语“芳基”和“杂芳基”包括多环芳基和杂芳基基团,例如双环。此类芳基基团的非限制性实例包括例如萘、苯并噁唑、苯并二噁唑、苯并噻唑、苯并咪唑、苯并噻吩、亚甲基二氧基苯基、喹啉、异喹啉、萘啶、吲哚、苯并呋喃、嘌呤、苯并呋喃、脱氮嘌呤、吲哚嗪。
[0116]
在多环芳环的情况下,仅一个环需要是芳族的(例如,2,3-二氢吲哚),尽管所有的环都可以是芳族的(例如,喹啉)。
[0117]
环烷基、杂环烷基、芳基或杂芳基环可以在一个或多个环位置(例如成环碳或杂原子诸如n)被如上所述的取代基取代,例如烷基、烯基、炔基、卤素、羟基、烷氧基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸根、烷基羰基、烷基氨基羰基、芳烷基氨基羰基、烯基氨基羰基、烷基羰基、芳基羰基、芳烷基羰基、烯基羰基、烷氧基羰基、氨基羰基、烷硫基羰基、磷酸根、膦酸根、亚膦酸根、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸根、硫酸根、烷基亚磺酰基、磺酸根、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷芳基或芳族或杂芳族部分。芳基和杂芳基基团还可以与非芳族的脂环或杂环稠合形成多环体系(例如,四氢化萘、亚甲基二氧基苯基)。
[0118]
当与取代基的键显示为与连接环中的两个原子的键交叉时(如以下具有取代基r的实例所示),则此类取代基可以键合至环中的任何原子。
[0119][0120]
当任何变量(例如,r1)在化合物的任何成分或式中出现多于一次时,其在每次出现时的定义都独立于其在每隔一次出现时的定义。因此,例如,如果显示基团被0-2个r1部分取代,则该基团可以任选地被至多两个r1部分取代,并且r1在每次出现时独立地选自r1的定义。
[0121]
术语“羟基”包括具有-oh或-o-的基团。
[0122]
如本文所用,“卤代”或“卤素”是指氟代、氯代、溴代和碘代。术语“全卤化”通常是指其中所有氢原子都被卤素原子取代的部分。术语“卤代烷基”或“卤代烷氧基”是指被一个或多个卤素原子取代的烷基或烷氧基。
[0123]“烷氧基烷基”、“烷基氨基烷基”和“硫代烷氧基烷基”包括如上所述的烷基基团,其中氧、氮或硫原子取代一个或多个烃主链碳原子。
[0124]
术语“烷氧基”包括与氧原子共价连接的取代和未取代的烷基、烯基和炔基基团。烷氧基基团的实例包括但不限于甲氧基、乙氧基、异丙氧基、丙氧基、丁氧基和戊氧基基团。
取代的烷氧基基团的实例包括卤代烷氧基基团。烷氧基基团可以被诸如以下的基团取代:烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸根、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸根、膦酸根、亚膦酸根、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸根、硫酸根、烷基亚磺酰基、磺酸根、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷芳基或芳族或杂芳族部分。卤素取代的烷氧基基团的实例包括但不限于氟甲氧基、二氟甲氧基、三氟甲氧基、氯甲氧基、二氯甲氧基和三氯甲氧基。
[0125]“异构”是指分子式相同但原子键合顺序或原子空间排列不同的化合物。原子空间排列不同的异构体称为“立体异构体”。彼此不是镜像的立体异构体称为“非对映异构体”,彼此是不可重叠的镜像的立体异构体称为“对映异构体”或者有时称为光学异构体。含有等量的相反手性的单独对映体形式的混合物称为“外消旋混合物”。
[0126]
与四个不同取代基键合的碳原子称为“手性中心”。
[0127]“手性异构体”是指具有至少一个手性中心的化合物。具有多于一个手性中心的化合物可以作为单独的非对映异构体或者作为非对映异构体的混合物(称为“非对映异构体混合物”)存在。当存在一个手性中心时,立体异构体的特征可以是该手性中心的绝对构型(r或s)。绝对构型是指与手性中心连接的取代基的空间排列。与所考虑的手性中心连接的取代基按照cahn、ingold和prelog的排序规则排列。(calm等人,angew.chem.[应用化学]inter.编辑1966,5,385;勘误表511;cahn等人,angew.chem.[应用化学]1966,78,413;cahn和ingold,j.chem.soc.[化学学会会刊]1951(london),612;calm等人,experientia[经验]1956,12,81;cahn,j.chem.educ.[化学教育期刊]1964,41,116)。
[0128]
在本说明书中,手性中心在结构式内的每次出现,诸如本文所示的非限制性实例:
[0129][0130]
意在描绘所有可能的立体异构体。相比之下,用阴影和楔形绘制的手性中心,诸如本文所示的非限制性实例:
[0131][0132]
意在描绘如所示的立体异构体(在此sp3杂化碳手性中心中,r3和r4在纸平面中,r1在纸平面上方,并且r2在纸平面后面)。
[0133]“几何异构体”是指其存在阻碍围绕双键或环烷基接头(例如,1,3-环丁基)旋转的非对映异构体。这些构型的名称通过前缀顺式和反式或z和e来区分,这指示根据cahn-ingold-prelog规则,基团在分子中双键的相同或相反侧上。
[0134]
在本说明书中,结构式中的每次出现包括与所示双键相邻的波浪线:
[0135][0136]
意在描绘两种几何异构体。相反,此类没有波浪线绘制的结构意在描绘具有如所绘制的几何构型的化合物。
[0137]“互变异构体”是平衡存在并且容易从一种异构形式转化为另一种异构形式的两种或更多种结构异构体中的一种。这种转化导致伴随相邻共轭双键转换的氢原子的正式迁移。互变异构体在溶液中作为互变异构组的混合物存在。在可能发生互变异构化的溶液中,将达到互变异构体的化学平衡。互变异构体的确切比例取决于几个因素,包括温度、溶剂和ph。可以通过互变异构化相互转化的互变异构体的概念称为互变异构现象。
[0138]
在本说明书描述易于互变异构化的化合物但仅描述互变异构体中的一种的情况下,应当理解,所有互变异构体都包括作为所描述的化学含义的一部分。应当理解,本文披露的化合物可以描述为不同的互变异构体。还应理解,当化合物具有互变异构形式时,旨在包括所有互变异构形式,并且化合物的命名不排除任何互变异构形式。
[0139]
在可能的各种类型的互变异构现象中,通常观察到两种。在酮-烯醇互变异构中,电子和氢原子同时发生位移。环-链互变异构现象是由于糖链分子中的醛基团(
‑‑
cho)与同一分子中的一个羟基(
‑‑
oh)反应而产生的,从而使其呈如葡萄糖所示的环状(环形)形式。
[0140]
常见的互变异构对是:酮-烯醇、酰胺-腈、内酰胺-内酰亚胺、在杂环中(例如,在核碱基诸如鸟嘌呤、胸腺嘧啶和胞嘧啶中)的互变异构、亚胺-烯胺和烯胺-烯胺。
[0141]
此外,本文披露的结构和其他化合物包括其所有阻转异构体,应当理解,并非所有阻转异构体都可以具有相同水平的活性。“阻转异构体”是一种这样的立体异构体,其中两种异构体的原子在空间上排列不同。阻转异构体的存在归因于大基团围绕中心键的旋转受阻而导致旋转受限。这样的阻转异构体通常以混合物形式存在,然而由于色谱技术的最新进展,在选择的情况下可能分离两种阻转异构体的混合物。
[0142]
术语“晶体多晶型物”、“多晶型物”或“晶型”是指其中化合物(或其盐或溶剂化物)可以以不同的晶体堆积排列结晶的晶体结构,所有这些都具有相同的元素组成。不同的晶体形式通常具有不同的x射线衍射图、红外光谱、熔点、密度、硬度、晶体形状、光学和电学性质、稳定性和溶解度。重结晶溶剂、结晶速率、储存温度和其他因素可能导致一种晶型占优势。化合物的晶体多晶型物可以通过在不同条件下结晶来制备。应当理解,本文披露的化合物可以以结晶形式、结晶形式混合物或其酸酐或水合物存在。
[0143]
如果适用,本文披露的化合物包括化合物本身,以及它们的盐和溶剂化物。例如,盐可以在阴离子与芳基或杂芳基取代的苯化合物上的带正电荷的基团(例如,氨基)之间形成。合适的阴离子包括氯离子、溴离子、碘离子、硫酸根、硫酸氢根、氨基磺酸根、硝酸根、磷酸根、柠檬酸根、甲磺酸根、三氟乙酸根、谷氨酸根、葡糖醛酸根、戊二酸根、苹果酸根、马来酸根、琥珀酸根、富马酸根、酒石酸根、甲苯磺酸根、水杨酸根、乳酸根、萘磺酸根和乙酸根(例如三氟醋酸根)。术语“药学上可接受的阴离子”是指适于形成药学上可接受的盐的阴离子。同样地,盐也可以在阳离子与芳基或杂芳基取代的苯化合物上的带负电荷的基团(例如羧酸根)之间形成。合适的阳离子包括钠离子、钾离子、镁离子、钙离子和铵阳离子诸如四甲基铵离子。芳基或杂芳基取代的苯化合物还包括那些含有季氮原子的盐。
[0144]
另外,本文披露的化合物,例如化合物的盐,可以以水合或非水合(无水)形式或作为与其他溶剂分子的溶剂化物存在。水合物的非限制性实例包括一水合物、二水合物等。溶剂化物的非限制性实例包括乙醇溶剂化物、丙酮溶剂化物等。
[0145]
如本文所用,“药学上可接受的盐”是指本文披露的化合物的衍生物,其中母体化合物通过制备其酸或碱盐而改性。药学上可接受的盐的实例包括但不限于碱性残基诸如胺的无机酸盐或有机酸盐、酸性残基诸如羧酸的碱盐或有机盐等。药学上可接受的盐包括例如由无毒无机或有机酸形成的母体化合物的常规无毒盐或季铵盐。例如,此类常规无毒盐包括但不限于衍生自无机酸和有机酸的那些,这些无机酸和有机酸选自2-乙酰氧基苯甲酸、2-羟基乙磺酸、乙酸、抗坏血酸、苯磺酸、苯甲酸、重碳酸、碳酸、柠檬酸、依地酸、乙二磺酸、1,2-乙磺酸、富马酸、葡庚糖酸、葡糖酸、谷氨酸、乙醇酸、乙二醇对氨基苯胂酸、己基间苯二酚、海巴酸、氢溴酸、盐酸、氢碘酸、羟基马来酸、羟基萘甲酸、羟乙磺酸、乳酸、乳糖酸、月桂基磺酸、马来酸、苹果酸、扁桃酸、甲磺酸、萘磺酸、硝酸、草酸、双羟萘酸、泛酸、苯乙酸、磷酸、聚半乳糖醛酸、丙酸、水杨酸、硬脂酸、次乙酸、琥珀酸、氨基磺酸、磺胺酸、硫酸、单宁酸、酒石酸、甲苯磺酸以及常见的胺酸,例如甘氨酸、丙氨酸、苯丙氨酸、精氨酸等。
[0146]
药学上可接受的盐的其他实例包括己酸、环戊烷丙酸、丙酮酸、丙二酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基双环-[2.2.2]-辛-2-烯-1-羧酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、粘康酸等。本披露还涵盖当母体化合物中存在的酸性质子被金属离子例如碱金属离子、碱土金属离子或铝离子替代或与有机碱诸如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等配位时形成的盐。在盐形式中,应理解化合物与盐的阳离子或阴离子的比率可以是1:1,或除1:1以外的任何比率,例如3:1、2:1、1:2或1:3。
[0147]
应当理解,所有提及的药学上可接受的盐包括相同盐的如本文所定义的溶剂加成形式(溶剂化物)或结晶形式(多晶型物)。
[0148]“溶剂化物”是指包含化学计量或非化学计量量的溶剂的溶剂加成形式。一些化合物倾向于在结晶固态中捕获固定摩尔比的溶剂分子,从而形成溶剂化物。如果溶剂是水,则形成的溶剂化物是水合物;并且如果溶剂是醇,则形成的溶剂化物是醇化物。水合物是由一个或多个水分子与一个物质分子结合形成的,其中水保持其分子状态为h2o。
[0149]
所命名或描绘的化学物质旨在包括本发明化合物中存在的原子的所有天然存在的同位素。同位素包括原子序数相同但质量数不同的那些原子。作为一般实例而非限制,1h氢的同位素包括氚和氘,并且
12
c碳的同位素包括
13
c和
14
c。
[0150]
应当理解,本文披露的化合物的一些化合物及其异构体、盐、酯和溶剂化物可表现出比其他化合物更大的体内或体外活性。还应当理解,使用本文披露的化合物及其异构体、盐、酯和溶剂化物,一些癌症可以比其他癌症更有效地治疗,并且在某些受试者物种中可以比其他受试者物种更有效地治疗。
[0151]
如本文所用,“治疗”意指向受试者施用药物组合物以改善、减少或减轻疾病的症状。如本文所用,“治疗”描述了为了对抗疾病、病状或病症而对受试者进行管理和护理,并且包括施用本文披露的化合物或其药学上可接受的盐、多晶型物或溶剂化物,以减轻疾病、病状或病症的症状或并发症,或消除疾病、病状或病症。术语“治疗”还可以包括体外细胞或动物模型的治疗。
[0152]
治疗癌症可以使得肿瘤大小减小。肿瘤大小的减小也可以称为“肿瘤消退”。优选地,治疗后,肿瘤大小相对于其治疗前的大小减小5%或更多;更优选地,肿瘤大小减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;并且最优选地,减小大于75%或更多。肿瘤的大小可以通过任何可重复的测量手段来测量。肿瘤的大小可以测量为肿瘤的直径。
[0153]
治疗癌症可以使得肿瘤体积减小。优选地,治疗后,肿瘤体积相对于其治疗前的大小减小5%或更多;更优选地,肿瘤体积减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;并且最优选地,减小大于75%或更多。肿瘤体积可以通过任何可重复的测量手段来测量。
[0154]
治疗癌症可以使得肿瘤数量减少。优选地,治疗后,肿瘤数量相对于治疗前的数量减少5%或更多;更优选地,肿瘤数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;并且最优选地,减少大于75%。肿瘤的数量可以通过任何可重复的测量手段来测量。肿瘤的数量可以通过计数肉眼可见的肿瘤或在指定的放大倍数下测量。优选地,指定的放大倍数是2倍、3倍、4倍、5倍、10倍或50倍。
[0155]
治疗癌症可以使得远离原发性肿瘤部位的其他组织或器官中转移病灶的数量减少。优选地,治疗后,转移病灶的数量相对于治疗前的数量减少5%或更多;更优选地,转移病灶的数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;并且最优选地,减少大于75%。转移病灶的数量可以通过任何可重复的测量手段来测量。转移病灶的数量可以通过计数肉眼可见的转移病灶或在指定的放大倍数下测量。优选地,指定的放大倍数是2倍、3倍、4倍、5倍、10倍或50倍。
[0156]
如本文所用,“受试者”是指任何动物,诸如哺乳动物,包括啮齿动物(例如,小鼠或大鼠)、狗、灵长类动物、狐猴或人。
[0157]
与仅接受载体的群体相比,治疗癌症可以使得接受治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,超过60天;更优选地,超过90天;并且最优选地,超过120天。群体平均存活时间的增加可以通过任何可重复的手段来测量。群体平均存活时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均存活长度来测量。群体平均存活时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均存活长度来测量。
[0158]
与未接受治疗的受试者群体相比,治疗癌症可以使得接受治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,超过60天;更优选地,超过90天;并且最优选地,超过120天。群体平均存活时间的增加可以通过任何可重复的手段来测量。群体平均存活时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均存活长度来测量。群体平均存活时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均存活长度来测量。
[0159]
与接受使用不是本文披露的化合物或其药学上可接受的盐的药物的单一疗法的群体相比,治疗癌症可以使得接受治疗的受试者群体的平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,超过60天;更优选地,超过90天;并且最优选地,超过120
天。群体平均存活时间的增加可以通过任何可重复的手段来测量。群体平均存活时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均存活长度来测量。群体平均存活时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均存活长度来测量。
[0160]
与仅接受载体的群体相比,治疗癌症可以使得接受治疗的受试者群体的死亡率降低。与未接受治疗的群体相比,治疗癌症可以使得接受治疗的受试者群体的死亡率降低。与接受使用不是本文披露的化合物或其药学上可接受的盐、前药、代谢物、类似物或衍生物的药物的单一疗法的群体相比,治疗癌症可以使得接受治疗的受试者群体的死亡率降低。优选地,死亡率降低超过2%;更优选地,超过5%;更优选地,超过10%;并且最优选地,超过25%。接受治疗的受试者群体的死亡率的降低可以通过任何可重复的手段来测量。群体死亡率的降低可以例如通过计算群体在开始用活性化合物治疗后每单位时间的疾病相关死亡的平均数来测量。群体死亡率的降低还可以例如通过计算群体在用活性化合物完成第一轮治疗后每单位时间的疾病相关死亡的平均数来测量。
[0161]
治疗癌症可以使得肿瘤生长速率降低。优选地,治疗后,肿瘤生长速率相对于治疗前的数量降低至少5%;更优选地,肿瘤生长速率降低至少10%;更优选地,降低至少20%;更优选地,降低至少30%;更优选地,降低至少40%;更优选地,降低至少50%;甚至更优选地,降低至少50%;并且最优选地,降低至少75%。肿瘤生长速率可以通过任何可重复的测量手段来测量。肿瘤生长速率可以根据每单位时间肿瘤直径的变化来测量。
[0162]
治疗癌症可以使得肿瘤再生长减少,例如,在尝试手术切除它之后。优选地,治疗后,肿瘤再生长少于5%;更优选地,肿瘤再生长少于10%;更优选地,少于20%;更优选地,少于30%;更优选地,少于40%;更优选地,少于50%;甚至更优选地,少于50%;并且最优选地,少于75%。肿瘤再生长可以通过任何可重复的测量手段来测量。肿瘤再生长例如通过测量治疗后的先前肿瘤缩小后肿瘤直径的增加来测量。治疗停止后肿瘤未能复发表明肿瘤再生长减少。
[0163]
治疗或预防细胞增殖性疾病可以使得细胞增殖速率降低。优选地,治疗后,细胞增殖速率降低至少5%;更优选地,至少10%;更优选地,至少20%;更优选地,至少30%;更优选地,至少40%;更优选地,至少50%;甚至更优选地,至少50%;并且最优选地,至少75%。细胞增殖速率可以通过任何可重复的测量手段来测量。细胞增殖速率例如通过测量每单位时间组织样品中分裂细胞的数量来测量。
[0164]
治疗或预防细胞增殖性疾病可以使得增殖细胞的比例降低。优选地,治疗后,增殖细胞的比例降低至少5%;更优选地,至少10%;更优选地,至少20%;更优选地,至少30%;更优选地,至少40%;更优选地,至少50%;甚至更优选地,至少50%;并且最优选地,至少75%。增殖细胞的比例可以通过任何可重复的测量手段来测量。优选地,增殖细胞的比例例如通过定量组织样品中分裂细胞的数量相对于未分裂细胞的数量来测量。增殖细胞的比例可能与有丝分裂指数相当。
[0165]
治疗或预防细胞增殖性疾病可以使得细胞增殖区域或区的大小减小。优选地,治疗后,细胞增殖的区域或区的大小相对于其治疗前的大小减小至少5%;更优选地,减小至少10%;更优选地,减小至少20%;更优选地,减小至少30%;更优选地,减小至少40%;更优选地,减小至少50%;甚至更优选地,减小至少50%;并且最优选地,减小至少75%。细胞增
殖的区域或区的大小可以通过任何可重复的测量手段来测量。细胞增殖的区域或区的大小可以测量为细胞增殖区域或区的直径或宽度。
[0166]
治疗或预防细胞增殖性疾病可以使得具有异常外观或形态的细胞的数量或比例减少。优选地,在治疗后,具有异常形态的细胞的数量相对于其治疗前的大小减少至少5%;更优选地,减少至少10%;更优选地,减少至少20%;更优选地,减少至少30%;更优选地,减少至少40%;更优选地,减少至少50%;甚至更优选地,减少至少50%;并且最优选地,减少至少75%。异常细胞外观或形态可以通过任何可重复的测量手段来测量。异常细胞形态可以通过显微镜,例如,使用倒置组织培养显微镜来测量。异常细胞形态可能表现为核多态性。
[0167]
如本文所用,术语“减轻”意在描述病症的体征或症状的严重程度降低的过程。重要的是,体征或症状可能会减轻而不会消除。在优选的实施例中,本文披露的药物组合物的施用使得体征或症状的消除,然而,消除不是必需的。预期有效剂量会降低体征或症状的严重程度。例如,如果癌症的严重程度在多个位置中的至少一个内降低,则可能在多个位置发生的诸如癌症的病症的体征或症状减轻。
[0168]
如本文所用,术语“严重程度”旨在描述癌症从癌前状态或良性状态转变为恶性状态的可能性。替代性地或另外地,严重程度意在描述癌症分期,例如,根据tnm系统(由国际抗癌联盟(uicc)和美国癌症联合委员会(ajcc)接受)或通过其他本领域公认的方法。癌症分期是指癌症的程度或严重程度,取决于诸如原发性肿瘤的位置、肿瘤大小、肿瘤数量和淋巴结转移(癌症扩散到淋巴结中)的因素。替代性地或另外地,严重程度意在通过本领域公认的方法描述肿瘤等级(参见国家癌症研究所,www.cancer.gov)。肿瘤分级是一种用于根据癌细胞在显微镜下的异常程度以及肿瘤可能生长和扩散的速度来对癌细胞进行分类的系统。在确定肿瘤分级时会考虑许多因素,包括细胞的结构和生长模式。用于确定肿瘤分级的具体因素因每种癌症类型而异。严重程度还描述了组织学分级,也称为分化,它是指肿瘤细胞与相同组织类型的正常细胞的相似程度(参见国家癌症研究所,www.cancer.gov)。此外,严重程度描述了核分级,它是指肿瘤细胞中核的大小和形状以及正在分裂的肿瘤细胞的百分比(参见国家癌症研究所,www.cancer.gov)。
[0169]
在本文所述的实施例的另一方面,严重程度描述了肿瘤分泌生长因子、降解细胞外基质、变得血管化、失去对并列组织的粘附或转移的程度。此外,严重程度描述了原发性肿瘤转移到的位置的数量。最后,严重程度包括治疗不同类型和位置的肿瘤的难度。例如,不能手术的肿瘤、那些更容易进入多个身体系统的癌症(血液和免疫肿瘤)以及对传统治疗最耐受的那些被认为是最严重的。在这些情况下,延长受试者的预期寿命和/或减轻疼痛、降低癌细胞的比例或将细胞限制于一个系统,以及改善癌症分期/肿瘤分级/组织学分级/核分级被认为是减轻癌症的体征或症状。
[0170]
如本文所用,术语“症状”定义为疾病、病症、损伤或体内某物不正常的指征。症状被出现该症状的个体感觉到或注意到,但可能不容易被非医疗保健专业人员注意到。
[0171]“药物组合物”是包含本文披露的化合物的配制品,其形式适合施用于受试者。在一个实施例中,药物组合物为散装或单位剂型。单位剂型是多种形式中的任一种,包括例如胶囊、iv袋、片剂、气溶胶吸入器上的单个泵或小瓶。单位剂量的组合物中的活性成分(例如,所披露的化合物或其盐、水合物、溶剂化物或异构体的配制品)的量是有效量并且根据
所涉及的具体治疗而变化。本领域技术人员将理解,有时需要根据患者的年龄和状况对剂量进行常规变化。剂量还将取决于施用途径。考虑了多种途径,包括口服、肺部、直肠、肠胃外、经皮、皮下、静脉内、肌内、腹膜内、吸入、口腔、舌下、胸膜内、鞘内、鼻内等。用于局部或经皮施用的本文披露的化合物的剂型包括粉剂、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。在一个实施例中,活性化合物在无菌条件下与药学上可接受的载体以及与所需的任何防腐剂、缓冲剂或推进剂混合。
[0172]
如本文所用,短语“药学上可接受的”是指在合理医学判断范围内适用于与人类和动物的组织接触而没有过度毒性、刺激性、过敏反应或其他问题或并发症,同时具有相称的合理益处/风险比的那些化合物、阴离子、阳离子、材料、组合物、载体和/或剂型。
[0173]“药学上可接受的赋形剂”是指可用于制备药物组合物的赋形剂,该药物组合物通常是安全的、无毒的并且在生物学上或其他方面均无不良影响,并且包括可用于兽医用途以及人类药物用途的赋形剂。本说明书和权利要书中使用的“药学上可接受的赋形剂”包括一种和多于一种这样的赋形剂。
[0174]
本披露还提供药物组合物,其包含本文披露的任何化合物与至少一种药学上可接受的赋形剂或载体的组合。
[0175]
本文披露的药物组合物被配制成与其预期的施用途径相容。施用途径的实例包括肠胃外,例如静脉内、皮内、皮下、口服(例如吸入)、经皮(局部)和经粘膜施用。用于肠胃外、皮内或皮下施用的溶液或悬浮液可以包含以下成分:无菌稀释剂,诸如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,诸如氯化钠或葡萄糖。ph可以用酸或碱调节,诸如盐酸或氢氧化钠。肠胃外制剂可以封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0176]
本文披露的化合物或药物组合物可以以目前用于化疗治疗的许多众所周知的方法施用于受试者。例如,为了治疗癌症,本文披露的化合物可以直接注射到肿瘤中,注射到血流或体腔中或口服或通过皮肤用贴剂施用。所选择的剂量应足以构成有效的治疗,但不能高到引起不可接受的副作用。疾病状况(例如癌症、癌前期等)的状态和患者的健康应优选在治疗期间和治疗后的一段合理时间内密切监测。
[0177]
如本文所用,术语“治疗有效量”是指治疗、改善或预防所鉴定的疾病或病症或表现出可检测的治疗或抑制作用的药剂的量。该效果可以通过本领域已知的任何测定方法来检测。受试者的精确有效量将取决于受试者的体重、体型和健康状况;病症的性质和程度;以及选择用于施用的治疗剂或治疗剂组合。对于给定情况的治疗有效量可以通过在临床医生的技能和判断范围内的常规实验来确定。在优选的方面,待治疗的疾病或病症是癌症。在另一方面,待治疗的疾病或病症是细胞增殖性疾病。
[0178]
对于任何化合物,治疗有效量最初可以在例如肿瘤细胞的细胞培养测定中或在动物模型(通常为大鼠、小鼠、兔、狗或猪)中估计。动物模型也可用于确定适当的浓度范围和施用途径。然后可以使用这样的信息来确定在人中施用的有用剂量和途径。治疗/预防功效和毒性可以通过细胞培养或实验动物中的标准药学程序来确定,例如ed
50
(对50%的群体治疗有效的剂量)和ld
50
(对50%的群体致死的剂量)。毒性与治疗效果之间的剂量比是治疗指
数,并且其可以表示为比率ld
50
/ed
50
。表现出大治疗指数的药物组合物是优选的。剂量可以在该范围内变化,这取决于所采用的剂型、患者的敏感性和施用途径。
[0179]
调整剂量和施用以提供足够水平的活性剂或维持所需效果。可以考虑的因素包括疾病状态的严重程度、受试者的一般健康状况、受试者的年龄、体重和性别、饮食、施用时间和频率、药物组合、反应敏感性和对治疗的耐受性/反应。长效药物组合物可以每3至4天、每周或每两周一次施用,这取决于特定配制品的半衰期和清除率。
[0180]
包含本文披露的活性化合物的药物组合物可以以通常已知的方式制造,例如,通过常规的混合、溶解、制粒、制糖衣丸、研磨、乳化、包封、包埋或冻干工艺。药物组合物可以使用一种或多种药学上可接受的载体以常规方式配制,这些载体包括有助于将活性化合物加工成可药用制剂的赋形剂和/或助剂。当然,合适的配制品取决于所选择的施用途径。
[0181]
适用于注射使用的药物组合物包括无菌水溶液(水溶性)或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(新泽西州帕西帕尼的巴斯夫公司(basf,parsippany,n.j.))或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的,并且应该是易于注射的流体。它在制造和储存条件下必须是稳定的,并且必须防止微生物诸如细菌和真菌的污染作用。载体可以是包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)以及它们的合适混合物的溶剂或分散介质。例如,可以通过使用包衣诸如卵磷脂、通过在分散体的情况下保持所需的粒度和通过使用表面活性剂来保持适当的流动性。可以通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等来实现对微生物作用的预防。在许多情况下,优选在组合物中包括等渗剂,例如糖、多元醇诸如甘露醇和山梨醇,以及氯化钠。可注射组合物的延长吸收可以通过在组合物中包括延迟吸收的试剂例如单硬脂酸铝和明胶来实现。
[0182]
无菌可注射溶液可以通过将所需量的活性化合物根据需要与上文列举的成分中的一种或组合掺入适当的溶剂中,然后过滤灭菌来制备。通常,分散体通过将活性化合物掺入包含基本分散介质和来自上文列举的那些的所需其他成分的无菌媒介物中来制备。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法是真空干燥和冷冻干燥,其从其先前无菌过滤的溶液中产生活性成分加上任何其他所需成分的粉末。
[0183]
口服组合物通常包括惰性稀释剂或可食用的药学上可接受的载体。它们可以包封在明胶胶囊中或压缩成片剂。为了口服治疗施用的目的,活性化合物可以与赋形剂结合并以片剂、锭剂或胶囊剂的形式使用。口服组合物也可以使用流体载体来制备以用作漱口剂,其中流体载体中的化合物经口服施用并漱口并吐出或吞咽。药学上相容的粘结剂和/或佐剂材料可以作为组合物的一部分包括在内。片剂、丸剂、胶囊剂、锭剂等可含有以下任何成分或类似性质的化合物:粘结剂,诸如微晶纤维素、黄蓍胶或明胶;赋形剂,诸如淀粉或乳糖;崩解剂,诸如海藻酸、primogel或玉米淀粉;润滑剂,诸如硬脂酸镁或sterotes;助流剂,诸如胶体二氧化硅;甜味剂,诸如蔗糖或糖精;或调味剂,诸如薄荷、水杨酸甲酯或橙子调味剂。
[0184]
活性化合物可以与药学上可接受的载体一起制备,这些载体将保护化合物免于从体内快速消除,诸如控释配制品,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,诸如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备此
类配制品的方法对于本领域技术人员而言将是显而易见的。
[0185]
特别有利的是将口服或肠胃外组合物配制成剂量单位形式,以易于施用和剂量的均匀性。如本文所用的剂量单位形式是指适合作为用于待治疗的受试者的单位剂量的物理离散单位;每个单位含有经计算可产生所需治疗效果的预定量的活性化合物以及所需的药物载体。本文披露的化合物的剂量单位形式的规格由活性化合物的独特特性和待实现的特定治疗效果来决定并且直接取决于活性化合物的独特特性和待实现的特定治疗效果。
[0186]
在治疗应用中,根据本文所述的实施例使用的药物组合物的剂量根据药剂、受体患者的年龄、体重和临床状况以及施用治疗的临床医生或执业医师的经验和判断以及影响所选剂量的其他因素而变化。通常,剂量应足以使得肿瘤生长减缓,优选消退,并且还优选导致癌症完全消退。剂量可以在约0.01mg/kg/天至约5000mg/kg/天的范围内。在优选的方面,剂量可以在约1mg/kg/天至约1000mg/kg/天的范围内。在一个方面,剂量将在约0.1mg/天至约50g/天、约0.1mg/天至约25g/天、约0.1mg/天至约10g/天、约0.1mg至约3g/天或约0.1mg至约1g/天的范围内,以单剂量、分剂量或连续剂量(可根据患者的体重(kg)、体表面积(m2)和年龄(岁)进行调整)。药剂的有效量是提供由临床医生或其他合格观察者所指出的客观可识别的改善的量。例如,可以参考肿瘤直径来测量患者中肿瘤的消退。肿瘤直径的减小表明消退。治疗停止后肿瘤未能复发也表明消退。如本文所用,术语“剂量有效方式”是指在受试者或细胞中产生所需生物效应的活性化合物的量。
[0187]
药物组合物可以与施用说明书一起包括在容器、包装或分配器中。
[0188]
本文披露的化合物的配制和施用技术可以在remington:the science and practice of pharmacy[雷明顿:药学科学与实践],第19版,mack publishing co.,easton,pa.[宾夕法尼亚州伊斯顿的马克出版公司](1995)中找到。在一个实施例中,本文所述的化合物及其药学上可接受的盐可以与药学上可接受的载体或稀释剂组合用于药物制剂中。合适的药学上可接受的载体包括惰性固体填充剂或稀释剂和无菌水溶液或有机溶液。化合物将以足以提供本文所述范围内的所需剂量的量存在于此类药物组合物中。
[0189]
可以使用本文披露的一种或多种化合物治疗的示例性癌症包括但不限于肺癌、胶质母细胞瘤、结肠癌、前列腺癌、膀胱癌、食道癌和子宫内膜癌。
[0190]
待治疗的癌症可包括已确定直径小于或等于约2厘米的肿瘤。待治疗的癌症可包括已确定直径为约2至约5厘米的肿瘤。待治疗的癌症可包括已确定直径大于或等于约3厘米的肿瘤。待治疗的癌症可包括已确定直径大于5厘米的肿瘤。待治疗的癌症可通过显微镜外观分类为高分化、中分化、低分化或未分化。
[0191]
待治疗的癌症可以通过关于有丝分裂计数(例如,细胞分裂量)或核多态性(例如,细胞变化)的微观外观来分类。待治疗的癌症可以通过微观外观分类为与坏死区域(例如,死亡或退化细胞的区域)相关。待治疗的癌症可以分类为具有异常核型、具有异常数量的染色体或具有一个或多个外观异常的染色体。待治疗的癌症可以分类为非整倍体、三倍体、四倍体或具有改变的倍性。待治疗的癌症可以分类为具有染色体易位,或整个染色体的缺失或复制,或染色体的一部分的缺失、复制或扩增的区域。
[0192]
化合物或其药学上可接受的盐可以口服、经鼻、经皮、经肺、吸入、经颊、舌下、腹膜内、皮下、肌内、静脉内、直肠、胸膜内、鞘内和肠胃外施用。在一个实施例中,化合物口服施用。本领域技术人员将认识到某些施用途径的优点。
[0193]
利用化合物的施用方案可以根据多种因素选择,这些因素包括患者的类型、物种、年龄、体重、性别和医学病症;待治疗病症的严重程度;施用途径;患者的肾和肝功能;以及所采用的具体化合物或其盐。普通医师或兽医可以容易地确定和开出预防、对抗或阻止疾病进展所需的药物的有效量。
[0194]
实例
[0195]
表2呈现了本文披露的化合物的实施例的非限制性实例,以及它们的活性筛选结果,如实例100中更详细讨论的。如果化合物的所描绘的化学结构与其化学名称之间存在任何差异,则以描绘的化学结构为准。
[0196]
表2:活性筛选结果(参见以下实例100)
[0197]
[0198]
[0199]
[0200]
[0201][0202]
adpglo ic50值是至少两个值的几何平均值。
[0203]
一般程序
[0204]
在文中可以使用以下缩写:
[0205]
acn:乙腈
[0206]
aq.:水溶液
[0207]
boc2o:二碳酸二叔丁酯
[0208]
conc.:浓缩的
[0209]
dcm:二氯甲烷
[0210]
dce:1,2-二氯乙烷
[0211]
diad:偶氮二甲酸二异丙酯
[0212]
dipea:n,n-二异丙基乙胺,胡宁氏碱(hunig’s base)
[0213]
dmap:4-(二甲基氨基)吡啶
[0214]
dmf:二甲基甲酰胺
[0215]
dmso:二甲亚砜
[0216]
esi-ms:电喷雾电离-质谱法
[0217]
et2o:乙醚
[0218]
etoh:乙醇
[0219]
etoac:乙酸乙酯
[0220]
et3n:三乙胺
[0221]
koh:氢氧化钾
[0222]
lcms:液相色谱法-质谱法
[0223]
meoh:甲醇
[0224]
mw:微波
[0225]
nh4cl:氯化铵
[0226]
nmr:核磁共振
[0227]
on或o.n.:过夜
[0228]
制备型hplc:制备型高效液相色谱法
[0229]
制备型tlc:制备型薄层色谱法
[0230]
r.b.:圆底
[0231]
rt或r.t.:室温
[0232]
t3p:1-丙烷膦酸酐
[0233]
tea:三乙胺
[0234]
tfa:三氟乙酸
[0235]
thf:四氢呋喃
[0236]
tlc:薄层色谱法
[0237]
一般程序:
[0238]
使用b
ü
chi旋转式蒸发器或genevac离心式蒸发器进行溶剂去除。制备型lc/ms使用waters质量导向自动纯化系统和waters 19
×
100mm xbridge 5微米c18柱在碱性流动相条件下或者使用等效的waters csh c18柱在酸性条件下进行。nmr光谱使用bruker ascend 400mhz光谱仪记录。化学位移(δ)相对于残留溶剂信号(测量范围-6.4khz)以ppm为单位报告。1h nmr数据报告如下:化学位移(多重性、耦合常数和氢数)。多重性缩写如下:s(单峰)、d(双重峰)、t(三重峰)、q(四重峰)、m(多重峰)、br(宽峰)。
[0239]
当使用术语“惰性的”来描述反应器(例如反应容器、烧瓶、玻璃反应器等)时,它是指反应器中的空气已被基本无水分或干燥的惰性气体(如氮气、氩气等)代替。
[0240]
制备本发明化合物的一般方法和实验程序如下所述。在某些情况下,以举例的方式描述了特定的化合物。然而,应当理解,在每种情况下,根据以下描述的方案和实验程序制备一系列本发明的化合物。用于纯化目标化合物的制备型hplc条件
[0241]
色谱条件:
[0242]
制备型hplc仪器:配备2767馏分收集器的waters 2545泵
[0243]
柱:对于流动相(2)waters xbridge c18 100mm
×
19mm,5μm粒度
[0244]
对于流动相(1)waters csh c18 100mm
×
19mm,5μm粒度
[0245]
ms检测器:waters 3100质量检测器
[0246]
uv检测器:waters 2489双波长uv检测器
[0247]
流速:30ml/min
[0248]
示例性梯度时间:
[0249][0250]
代表性流动相:
[0251]
(1)
[0252]
流动相a:0.1%甲酸的水溶液
[0253]
流动相b:0.1%甲酸的acn溶液
[0254]
(2)
[0255]
流动相a:0.1%nh4oh的水溶液
[0256]
流动相b:0.1%nh4oh的can溶液
[0257]
用于纯化目标化合物的其他制备型hplc条件
[0258]
色谱条件:
[0259]
制备型hplc仪器:shimadzu
[0260]
柱:ascentis express c18或shim-pack xr-ods c18
[0261]
检测器:spd-m20a
[0262]
流速:1.2ml/min
[0263]
代表性流动相:
[0264]
(1)
[0265]
流动相a:0.05%甲酸的水溶液
[0266]
流动相b:0.05%甲酸的acn溶液
[0267]
用于纯化目标化合物的制备型sfc条件
[0268]
色谱条件:
[0269]
sfc仪器:thar sfc prep investigator(waters)
[0270]
柱:chiral technologies chiralpak ia 250mm
×
10mm,5μm粒度els检测器:waters 2424检测器
[0271]
uv检测器:waters 2998光电二极管阵列检测器,254nm
[0272]
流速:10ml/min
[0273]
等度运行:40%异丙醇作为助溶剂
[0274]
在下述实例中提供的uplc、hplc和ms数据记录如下:
[0275]
uplc waters acquity sd
[0276]
o方法名称:lc-ms1-2-ba
[0277]
设备:
[0278]
·
uplc waters acquity sqz
[0279]
·
柱:waters acquity uplc csh c18,50mm
×
2.1mm
×
1.8μm
[0280]
洗脱剂:
[0281]
·
(a)0.1%甲酸的acn溶液
[0282]
·
(b)0.1%甲酸的水溶液
[0283]
分析方法:
[0284]
·
自动进样器:waters2707
[0285]
·
进样体积:1μl
[0286]
·
泵:
[0287][0288]
·
柱温箱:
[0289]-柱温:环境温度
[0290]-分析时间:2.5min
[0291]
·
检测器:
[0292]-sqz
[0293]-elsd
[0294]-pda
[0295]
材料:
[0296]
典型的起始材料是可商购获得的和/或可以有机合成领域技术人员熟知的多种方式制备。在描述以下所描述的合成方法中,应理解,除非另外指示,否则可选择所有所提出的反应条件(包括溶剂、反应氛围、反应温度、实验持续时间及处理程序的选择)作为彼反应的标准条件。熟习有机合成的技术者应理解,分子的各个部分上所存在的官能基应与所提出的试剂及反应物相容。与反应条件不相容的取代基对于本领域技术人员将是显而易见的,并且因此指示了替代方法。实例的起始材料是可商购的,或通过标准方法由已知材料容易地制备。
[0297]
程序a((2r,6r)-4-(2-氟-4-(三氟甲氧基)苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮。
[0298][0299]
a.(3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-甲酸叔丁酯。
[0300][0301]
向圆底烧瓶中添加2-氟-4-甲氧基苯甲酸(1.19g,6.99mmol),然后添加dcm(46.7ml,4.67mmol)、胡宁氏碱(2.445ml,13.998mmol)和1-丙烷膦酸环酐[50%的etoac溶液(16.3mmol)]。在rt下搅拌5min后,添加(2r,6r)-2,6-二甲基哌嗪-1-甲酸叔丁酯(1.0g,4.66mmol),并将反应在rt下搅拌过夜。用水(20ml)淬灭反应,将有机层分离并用水(20ml)洗涤,经mgso4干燥,过滤并浓缩,得到粗黄色油状物。通过快速硅胶色谱法用己烷:etoac(0-100%梯度)洗脱来纯化粗物质,得到标题化合物(0.90g,2.64mmol,53%收率),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.32(dd,1h),6.92(dd,1h),6.85(dd,1h),3.81(s,3h),3.63-3.52(m,3h),3.48-3.32(m,3h),1.42(s,9h),1.19-1.08(m,6h)。esi-ms:367.1[m+h]
+
。
[0302]
b.((2r,6r)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮盐酸盐。
[0303][0304]
向含有(3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-甲酸叔丁酯(903mg,2.46mmol)的圆底烧瓶中添加meoh(4.5ml)和盐酸溶液[(4.0m的二噁烷溶液),3.1ml,12.32mmol],并将反应物在rt下搅拌2h。此后,将反应浓缩,得到标题化合物(745mg,2.46mmol,100%收率),为白色固体。1h-nmr(400mhz,dmso-d6)δ9.73(br s,2h),7.38(d,1h),6.94(dd,1h),6.87(dd,1h),4.11(br s,2h),3.81(s,3h),3.44-3.34(m,2h),3.19-3.13(m,2h),1.28(s,3h),1.26(s,3h)。esi-ms:267.5[m+h]
+
。
[0305]
c.实例1((2r,6r)-4-(2-氟-4-(三氟甲氧基)苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物1)
[0306][0307]
向反应容器中添加((2r,6r)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮,hcl(17mg,0.056mmol)、dcm(0.56ml,0.056mmol)、1-丙烷膦酸环酐[50%的etoac溶液(0.112mmol)]、2-氟-4-(三氟甲氧基)苯甲酸(0.019g,0.085mmol)和胡宁氏碱(0.029ml,0.168mmol)的溶液。将反应在rt下搅拌16h,然后将反应浓缩并通过反相hplc纯化,得到标题化合物(15.6mg,0.033mmol,59%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.53-7.49(dd,1h),7.31-7.27(m,1h),7.16-7.14(m,1h),7.05(dd,1h),6.78(dd,1h),6.65(dd,1h),4.48-2.22(m,2h),4.07(dd,1h),3.93(br d,1h),3.85(s,3h),3.79(dd,1h),3.29(br d,1h),1.36(br s,3h),1.25(br s,3h)。esi-ms:473.5[m+h]
+
。
[0308]
实例2
[0309][0310]
((2r,6r)-4-(2,3-二氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物2)
[0311]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2,3-二氟-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(11.6mg,0.026mmol,47%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.31-7.27(m,1h),7.21-7.17(m,1h),6.87-6.63(m,1h),6.78(dd,1h),6.65(dd,1h,),4.39-4.26(br m,2h),4.02(dd,1h),3.98-3.94(m,1h),3.96(s,3h),3.85(s,3h),3.78(dd,1h),3.32(br d),1.36(br s,3h),1.23(br s,3h)。esi-ms:437.6[m+h]
+
。
[0312]
实例3
[0313][0314]
((2r,6r)-4-(1h-吲哚-6-羰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物3)
[0315]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用1h-吲哚-6-甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(242mg,0.59mmol,89%),为白色固体。1h-nmr(400mhz,cdcl3)δ8.67(s,1h),7.58(d,1h),7.53(s,1h),7.23-7.22(m,1h),7.19-7.16(m,1h),7.13-7.09(m,1h),6.68(dd,1h),6.56(dd,1h),6.50(br s,1h),3.96-3.85(m,3h),3.83-3.74(m,2h),3.75(s,3h),3.55-3.43(m,1h),1.33(br s,3h),1.10(br s,3h)。esi-ms:410.2[m+h]
+
。
[0316]
实例4
[0317][0318]
((2r,6r)-4-(3-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物4)
[0319]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用3-氟-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(12mg,0.028mmol,51%),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.44(dd,1h),7.37-7.31(m,2h),7.25-7.20(1h,m),6.93(dd,1h),6.86(dd,1h),4.07-4.01(m,1h),3.89(s,3h),3.81(s,3h),3.77-3.70(m,1h),3.68-3.58(m,1h),3.44-3.35(m,1h),3.34-3.31(m,2h),1.30(br s,3h),1.03(br s,3h)。esi-ms:419.5[m+h]
+
。
[0320]
实例5
[0321][0322]
((2r,6r)-4-(4-乙氧基-2-氟苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物5)
[0323]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用4-乙氧基-2-氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(14.7mg,0.034mmol,61%),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.38-7.31(m,2h),6.95-6.89(m,2h),6.87-6.84(m,2h),4.09(q,2h),3.86(d,1h),3.80(s,3h),3.82-3.77(m,1h),3.63-6.58(m,1h),3.35-3.31(m,1h),3.24(d,1h),1.34(t,3h),1.23(br s,3h),1.08(br sm,3h)。esi-ms:433.6[m+h]
+
。
[0324]
实例6
[0325][0326]
((2r,6r)-2,6-二甲基-4-(1-甲基吲哚啉-6-羰基)哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物6)
[0327]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用1-甲基吲哚啉-6-甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(23.9mg,0.056mmol,85%),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.33(dd,1h),7.08(d,1h),6.92(dd,1h),6.85(dd,1h),6.67(dd,1h,),6.54(d,1h),3.97-3.90(m,2h),3.80(s,3h),3.79-3.74(m,1h),3.62-3.57(m,
1h),3.40-3.32(m,2h),3.29(t,2h),2.90(t,2h),2.73(s,3h),1.28(br s,3h),1.04(br s,3h)。esi-ms:426.7[m+h]
+
。
[0328]
实例7
[0329][0330]
((2r,6r)-2,6-二甲基-4-(2-甲基-1h-吲哚-6-羰基)哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物7)
[0331]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2-甲基-1h-吲哚-6-甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(13.2mg,0.031mmol,47%),为白色固体。esi-ms:424.4[m+h]
+
。
[0332]
实例8
[0333][0334]
n-(3-氟-4-((3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-羰基)苯基)乙酰胺(化合物8)
[0335]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用4-乙酰氨基-2-氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(17.0mg,0.038mmol,68%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.81(s,1h),7.62(d,1h),7.35(t,1h),7.29-7.26(m,1h),7.13(dd,1h),6.77(dd,1h),6.65(dd,1h),4.45-2.15(br s,2h),4.04(dd,1h),3.94(br dd,1h),3.84(s,3h),3.78(dd,1h),3.32(d,1h),2.20(s,3h),1.36(br s,3h),1.22(br s,3h)。esi-ms:446.4[m+h]
+
。
[0336]
实例9
[0337][0338]
((2r,6r)-4-(4-(二氟甲氧基)-2-氟苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物9)
[0339]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用4-(二氟甲氧基)-2-氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(13.1mg,0.028mmol,51%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.48(dd,1h),7.31-7.27(m,1h),7.04(dd,1h),6.95(dd,
1h),6.79-6.76(m,1h),6.65(dd,1h),6.49(d,1h),4.50-4.20(br m,2h),4.06(dd,1h),3.93(br dd,1h),3.84(s,3h),3.78(dd,1h),3.30(br d,1h),1.36(br s,3h),1.24(br s,3h)。esi-ms:455.6[m+h]
+
。
[0340]
实例10
[0341][0342]
((2r,6r)-4-(2,5-二氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物10)
[0343]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2,5-二氟-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(12.6mg,0.028mmol,51%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.31-7.27(m,1h),7.21(dd,1h),6.79-6.76(m,1h),6.73(dd,1h),6.65(dd,1h),4.46-4.21(m,2h),4.03-3.99(m,1h),3.98-3.92(m,1h),3.93(s,3h),3.85(s,3h),3.77(dd,1h),3.34(br d,1h),1.35(br s,3h),1.23(br s,3h)。esi-ms:437.5[m+h]
+
。
[0344]
实例11
[0345][0346]
((2r,6r)-4-(2-氯-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物11)
[0347]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2-氯-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(16.6mg,0.038mmol,68%),为白色固体。esi-ms:435.4[m+h]
+
。
[0348]
实例12
[0349][0350]
((2r,6r)-4-(2,4-二氟苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物12)
[0351]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2,4-二氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(12.9mg,0.032mmol,56%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.50-7.44(m,1h),7.31-7.27(m,1h),7.03-6.98(m,1h),6.90(ddd,1h),6.78(dd,1h),6.65(dd,1h),4.55-4.20(br s,2h),4.05(dd,1h),3.93(br dd,1h),3.84(s,3h),3.78(dd,1h),3.29(br d,1h),1.36(br s,3h),1.24(br s,3h)。esi-ms:407.4[m+h]
+
。
[0352]
实例13
[0353][0354]
((2r,6r)-4-(2h-吲唑-6-羰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物13)
[0355]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用6-吲唑甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(20.1mg,0.051mmol,78%),为白色固体。esi-ms:411.7[m+h]
+
。
[0356]
实例14
[0357][0358]
((3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲基苯基)甲酮(化合物14)
[0359]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2-氟-4-甲基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(12.4mg,0.031mmol,55%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.35-7.31(m,1h),7.30-7.26(m,1h),7.05(d,1h),6.95(d,1h),6.77(dd,1h),6.65(dd,1h),4.50-4.15(br s,2h),4.06(dd,1h),3.91(br d,1h),3.84(s,3h),3.79-3.75(m,1h),3.31(br d,1h),2.41(s,3h),1.35(br s,3h),1.23(br s,3h)。esi-ms:403.6[m+h]
+
。
[0360]
实例15
[0361][0362]
((2r,6r)-4-(2,6-二氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物15)
[0363]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2,6-二氟-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(13.3mg,0.030mmol,54%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.31-7.27(m,1h),6.78(dd,1h),6.65(dd,1h),6.56-6.50(m,2h),4.50-4.20(br s,2h),4.12(dd,1h),3.88-3.82(m,1h),3.85(s,3h),3.84(s,3h),3.76(dd,1h),3.33(dd,1h),1.33(br s,3h),1.28(br s,3h)。esi-ms:437.6[m+h]+。
[0364]
实例16
甲氧基苯基)甲酮(化合物19)
[0379]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用1h-吡咯并[2,3-b]吡啶-6-甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(13.7mg,0.033mmol,51%),为白色固体。1h-nmr(400mhz,cdcl3)δ9.36(br s,1h),8.05(d,1h),7.56(d,1h),7.47(dd,1h),7.33-7.29(m,1h),6.77(dd,1h),6.68-6.62(m,1h),6.58(dd,1h),4.22(br dd,1h),4.10-4.03(m,1h),3.92-3.85(m,1h),3.84(s,3h),3.81-3.74(m,3h),1.43(br s,3h),1.23(br s,3h)。esi-ms:411.7[m+h]
+
。
[0380]
实例20
[0381][0382]
((2r,6r)-4-(4-(二甲基氨基)-2-氟苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物20)
[0383]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用4-(二甲基氨基)-2-氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(10.2mg,0.023mmol,42%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.35(dd,1h),7.30-7.26(m,1h),6.77(dd,1h),6.65(dd,1h),6.51(dd,1h),6.33(dd,1h),4.45-4.15(br m,2h),3.98(br d,2h),3.84(s,3h),3.78(br dd),3.39(br d,1h),3.04-3.01(m,6h),1.36(br s,3h),1.21(br s,3h)。esi-ms:432.6[m+h]
+
。
[0384]
实例21
[0385][0386]
((2r,6r)-4-(2,3-二氢苯并呋喃-5-羰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物21)
[0387]
按照程序a中概述的方法合成标题化合物,在步骤(c)中用2,3-二氢苯并呋喃-5-甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(10.4mg,0.025mmol,45%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.39(d,1h),7.31-7.27(m,1h),7.27-7.25(m,1h),6.81(d,1h),6.77(dd,1h),6.65(dd,1h),4.65(t,2h),4.44-4.20(br m,1h),4.02-3.94(m,1h),3.93-3.78(m,3h),3.84(s,3h),3.61-3.52(m,1h),3.29-3.22(m,2h),1.39(br s,3h),1.20(br s,3h)。esi-ms:413.6[m+h]
+
。
[0388]
程序b((2r,6r)-4-(2-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲基苯基)甲酮(化合物22)
[0389][0390]
a.(2r,6r)-4-(2-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-甲酸叔丁酯。
[0391][0392]
向圆底烧瓶中添加2-氟-4-甲氧基苯甲酸(1.19g,6.99mmol),然后添加dcm(46.7ml,4.67mmol)、胡宁氏碱(2.45ml,13.99mmol)和1-丙烷膦酸环酐[50%的etoac溶液(9.7ml,16.3mmol)]。在rt下搅拌5min后,添加(2r,6r)-2,6-二甲基哌嗪-1-甲酸叔丁酯(1.0g,4.66mmol),并将反应在rt下搅拌过夜。此后,用水(20ml)淬灭反应,将有机层分离并用水(20ml)洗涤,经mgso4干燥,过滤并浓缩,得到粗黄色油状物。通过快速硅胶色谱法用己烷:etoac(0-100%梯度)洗脱来纯化粗物质,得到标题化合物(1.25g,3.40mmol,72.9%收率),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.35(dd,1h),6.93(dd,1h),6.87(dd,1h),4.15-4.12(m,1h),3.95-3.92(m,1h),3.82(s,3h),3.81-3.78(m,1h),3.72(dd,1h),3.54(dd,1h),3.18(dd,1h),1.42(s,9h),1.25(d,3h),1.08(d,3h)。esi-ms:367.1[m+h]
+
。
[0393]
b.((3r,5r)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮盐酸盐。
[0394][0395]
向含有(2r,6r)-4-(2-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-甲酸叔丁酯(1.35g,3.67mmol)的圆底烧瓶中添加meoh(6.7ml)、盐酸溶液[(4.0m的二噁烷溶液),4.6ml,18.37mmol],并将反应物在rt下搅拌2h。此后,将反应浓缩,得到标题化合物(1.21g,4.00mmol,109%收率),为白色固体。1h-nmr(400mhz,dmso)δ9.52(br s,1h),7.38(dd,1h),6.95(dd,1h),6.88(dd,1h),3.93(br s,1h),3.82(s,3h),3.65-3.58(m,1h),3.50-3.45(m,
4-甲氧基苯基)甲酮(化合物28)
[0422]
按照程序b中概述的方法合成标题化合物,在步骤(c)中用2-氟-4-甲氧基-6-甲基苯甲酸代替2-氟-4-甲基苯甲酸,得到标题化合物(1.3mg,0.003mmol,5%),为白色固体。esi-ms:433.7[m+h]
+
。
[0423]
实例29
[0424][0425]
((2r,6r)-4-(2-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(3-氟-4-甲氧基苯基)甲酮(化合物29)
[0426]
按照程序b中概述的方法合成标题化合物,在步骤(c)中用3-氟-4-甲氧基苯甲酸代替2-氟-4-甲基苯甲酸,得到标题化合物(5.3mg,0.012mmol,19%),为白色固体。esi-ms:419.6[m+h]
+
。
[0427]
实例30
[0428][0429]
((3r,5r)-4-(2-氟-4-异丙氧基苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物30)
[0430]
按照程序b中概述的方法合成标题化合物,用2-氟-4-异丙氧基苯甲酸代替2-氟-4-甲基苯甲酸,得到标题化合物(6.5mg,0.014mmol,22%),为白色固体。esi-ms:447.3[m+h]
+
。
[0431]
程序c:
[0432]
实例31
[0433][0434]
((3r,5r)-4-(2-氟-4-(三氟甲氧基)苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物31)
[0435]
向1打兰小瓶中添加((3r,5r)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮,hcl(10mg,0.033mmol)、dcm(0.330ml,0.033mmol)、1-丙烷膦酸环酐[50%的etoac溶液(0.066mmol)]的溶液,然后添加2-氟-4-(三氟甲氧基)苯甲酸(11mg,0.049mmol)和胡宁氏碱(17μl,0.099mmol)。将反应在rt下搅拌16h,然后将反应浓缩并通过反相hplc纯化,得到标题化合物(0.4mg,8.4
×
10-7
mol,3%),为白色固体。esi-ms:473.6[m+h]
+
。
[0436]
实例32
[0437][0438]
((3r,5r)-4-(2,4-二氟苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物32)
[0439]
按照程序c中概述的方法合成标题化合物,用2,4-二氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(2.1mg,0.005mmol,16%),为白色固体。esi-ms:407.6[m+h]
+
。
[0440]
实例33
[0441][0442]
((3r,5r)-4-(4-(二氟甲氧基)-2-氟苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物33)
[0443]
按照程序c中概述的方法合成标题化合物,用4-(二氟甲氧基)-2-氟苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(5.3mg,0.011mmol,35%),为白色固体。esi-ms:455.3[m+h]
+
。
[0444]
实例34
[0445][0446]
((3r,5r)-4-(2,3-二氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物34)
[0447]
按照程序c中概述的方法合成标题化合物,用2,3-二氟-4-甲氧基苯甲酸代替2-氟-4-(三氟甲氧基)苯甲酸,得到标题化合物(1.7mg,0.004mmol,12%),为白色固体。esi-ms:437.7[m+h]
+
。
[0448]
程序d:实例35,6-((3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-羰基)-2h-苯并[b][1,4]噁嗪-3(4h)-酮(化合物35)
[0449][0450]
向1打兰小瓶中添加((2r,6r)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮盐酸盐(20mg,0.066mmol)的dcm溶液(2.0ml),然后添加3-氧代-3,4-二氢-2h-苯并[b][1,4]噁嗪-6-甲酸(0.09mmol)、hatu(0.09mmol)和diea(0.225mmol)。将混合物在25℃下搅拌过夜,此后将粗混合物过滤,浓缩并通过制备型hplc直接纯化,得到标题化合物(19mg,
0.043mmol,65%),为白色固体。1h-nmr(400mhz,cdcl3)δ8.63(br s,1h),7.22-7.18(m,1h),7.03(d,1h),7.02-6.99(m,1h),6.92-6.90(m,1h),6.639(dd,1h),6.56(dd,1h),4.57(s,2h),4.34-4.12(br m,2h),3.94-3.81(m,2h),3.78-3.70(m,1h),3.75(s,3h),3.44(br d,1h),1.29(br s,3h),1.12(br s,3h)。esi-ms:442.4[m+h]
+
。
[0451]
实例36
[0452][0453]
(7-氯-1h-吲哚-3-基)((3r,5r)-4-(2-氟-4-甲氧基苯甲酰基)-3,5-二甲基哌嗪-1-基)甲酮(化合物36)
[0454]
按照程序d中概述的方法合成标题化合物,用7-氯-1h-吲哚-3-甲酸代替3-氧代-3,4-二氢-2h-苯并[b][1,4]噁嗪-6-甲酸,得到标题化合物(17.5mg,0.039mmol,59%),为白色固体。1h-nmr(400mhz,cdcl3)δ8.81(s,1h),7.68(d,1h),7.49(d,1h),7.23-7.17(m,2h),7.12-7.08(m,1h),6.69(dd,1h,),6.56(dd,1h),4.0-3.8(m,4h),3.78-3.6(m,2h),3.76(s,3h),1.33-1.10(m,6h)。esi-ms:444.5[m+h]
+
。
[0455]
实例37
[0456][0457]
((2r,6r)-2,6-二甲基-4-(1h-吡咯并[3,2-b]吡啶-6-羰基)哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物37)
[0458]
按照程序d中概述的方法合成标题化合物,用1h-吡咯并[3,2-b]吡啶-6-甲酸代替3-氧代-3,4-二氢-2h-苯并[b][1,4]噁嗪-6-甲酸,得到标题化合物(12.1mg,0.029mmol,45%),为白色固体。1h-nmr(400mhz,cdcl3)δ9.09(s,1h),8.61(d,1h),7.91(d,1h),7.58(dd,1h),7.30-7.27(m,1h),6.82-6.80(m,1h),6.78(dd,1h),6.65(dd,1h),4.45-4.25(br m,1h),4.12-4.05(m,1h),4.03-3.95(m,2h),3.94-3.87(m,1h),3.84(s,3h),3.59(br d,1h),1.44(br s,3h),1.21(br s,3h)。esi-ms:411.8[m+h]
+
。
[0459]
实例38
[0460][0461]
((2r,6r)-4-(1h-苯并[d]咪唑-5-羰基)-2,6-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物38)
[0462]
按照程序d中概述的方法合成标题化合物,用1h-苯并[d]咪唑-5-甲酸代替3-氧代-3,4-二氢-2h-苯并[b][1,4]噁嗪-6-甲酸,得到标题化合物(67.2mg,0.164mmol,55%),为白色固体。esi-ms:411.8[m+h]
+
。程序e:实例39((3r,5r)-3,5-二甲基-4-(4-(噁唑-5-基)苯甲酰基)哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物39)
[0463][0464]
向1打兰小瓶中添加((3r,5r)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(20mg,0.075mmol)、dmf(2.0ml)和4-(噁唑-5-基)苯甲酸(0.09mmol,1.20当量)。然后添加hatu(0.11mmol)、diea(0.225mmol),并将所得粗混合物在30℃下搅拌过夜。此后,将所得混合物过滤,浓缩并通过制备型hplc直接纯化,得到标题化合物(18.8mg,0.043mmol,65%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.97(s,1h),7.74(d,2h),7.48(d,2h),7.44(s,1h),7.40(dd,1h),6.79(dd,1h),6.66(dd,1h),4.45-4.36(br m,1h),4.34-4.25(br m,1h),4.01(dd,1h),3.92(br dd,1h),3.86(s,3h),3.78(dd,1h),3.33(dd,1h),1.38(d,3h),1.25(d,3h)。esi-ms:438.4[m+h]
+
。
[0465]
实例40
[0466][0467]
((3r,5r)-4-(4-(1h-咪唑-2-基)苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物40)
[0468]
按照程序e中概述的方法合成标题化合物,用4-(1h-咪唑-2-基)苯甲酸代替4-(噁唑-5-基)苯甲酸,得到标题化合物(9.5mg,0.021mmol,33%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.74(d,2h),7.32-7.28(m,1h),7.26(d,2h),7.06(s,2h),6.70(dd,1h),6.56(dd,1h),4.40-4.28(br m,1h),4.21-4.14(br m,1h),3.92(dd,1h),3.86-3.80(m,1h),3.76(s,3h),3.68(br d,1h),3.24(br d,1h),1.28(br d,3h),1.14(br d,3h)。esi-ms:437.8[m+h]
+
。
[0469]
实例41
[0470][0471]
((3r,5r)-4-(4-(1h-四唑-1-基)苯甲酰基)-3,5-二甲基哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物41)
[0472]
按照程序e中概述的方法合成标题化合物,用4-(1h-四唑-1-基)苯甲酸代替4-(噁唑-5-基)苯甲酸,得到标题化合物(6.0mg,0.013mmol,21%),为白色固体。esi-ms:439.4[m+h]
+
。
[0473]
实例42
[0474][0475]
((2r,6r)-4-(2-氟-4-甲氧基苯甲酰基)-2,6-二甲基哌嗪-1-基)(4-(2-羟乙基)苯基)甲酮(化合物42)
[0476]
按照程序e中概述的方法合成标题化合物,用4-(2-羟乙基)苯甲酸代替4-(噁唑-5-基)苯甲酸,得到标题化合物(6.6mg,0.016mmol,24%),为白色固体。esi-ms:415.7[m+h]
+
。
[0477]
实例43
[0478][0479]
((3r,5r)-3,5-二甲基-4-(2-甲基-1h-吲哚-6-羰基)哌嗪-1-基)(2-氟-4-甲氧基苯基)甲酮(化合物43)
[0480]
按照程序e中概述的方法合成标题化合物,用2-甲基-1h-吲哚-6-甲酸代替4-(噁唑-5-基)苯甲酸,得到标题化合物(1.1mg,0.003mmol,4%),为白色固体。esi-ms:424.4[m+h]
+
。
[0481]
程序f:实例44
[0482][0483]
哌嗪-1,4-二基双((2-氟-4-甲氧基苯基)甲酮)(化合物44)
[0484]
向1打兰小瓶中添加哌嗪(9.14mg,0.087mmol)、dcm(2.6ml)和胡宁氏碱(46.3μl,0.265mmol)。在rt下搅拌10min后,将2-氟-4-甲氧基苯甲酰氯(50mg,0.265mmol)添加到粗反应混合物中并将反应物在rt下搅拌16h。此后,将反应浓缩并通过反相hplc纯化,得到标题化合物(42mg,0.107mmol,41%),为白色固体。1h-nmr(400mhz,cdcl3)δ7.38(dd,2h),6.81-6.75(m,2h),6.68-6.58(m,2h),3.91-3.79(m,4h),3.86(s,6h),3.50-3.36(m,4h)。esi-ms:391.2[m+h]
+
。
[0485]
实例45
[0486][0487]
(2-甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物45)
[0488]
按照程序f中概述的方法合成标题化合物,用2-甲基哌嗪代替哌嗪,得到标题化合物(20.8mg,0.051mmol,48%),为白色固体。esi-ms:405.6[m+h]
+
。
[0489]
实例46
[0490][0491]
(r)-(2-甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物46)
[0492]
按照程序f中概述的方法合成标题化合物,用(r)-2-甲基哌嗪代替哌嗪,得到标题化合物(30.6mg,0.075mmol,43%),为白色固体。esi-ms:405.6[m+h]
+
。
[0493]
实例47
[0494][0495]
反式-2,5-二甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物47)
[0496]
按照程序f中概述的方法合成标题化合物,用反式-2,5-二甲基哌嗪代替哌嗪,得到标题化合物(11.0mg,0.026mmol,25%),为白色固体。esi-ms:419.7[m+h]
+
。
[0497]
实例48
[0498][0499]
(2,2-二甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物48)
[0500]
按照程序f中概述的方法合成标题化合物,用2,2-二甲基哌嗪代替哌嗪,得到标题化合物(10.5mg,0.024mmol,25%),为白色固体。esi-ms:419.7[m+h]
+
。
[0501]
实例49
[0502][0503]
((2s,6s)-2,6-二甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物49)
[0504]
按照程序f中概述的方法合成标题化合物,用(2s,6s)-2,6-二甲基哌嗪代替哌嗪,得到标题化合物(80.4mg,0.576mmol,69%),为白色固体。1h-nmr(400mhz,dmso-d6)δ7.36(dt,2h),6.95(dd,1h),6.92(dd,1h),6.89-6.84(m,2h),3.90-3.84(br d,1h),3.82-3.77(m,1h),3.81(s,3h),3.80(s,3h),3.64-3.57(m,1h),3.34-3.29(m,2h),3.27-3.22(d,1h),1.23(br s,3h),1.08(br s,3h)。esi-ms:419.7[m+h]
+
。
[0505]
实例50
[0506][0507]
((2r,6s)-2,6-二甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物50)
[0508]
按照程序f中概述的方法合成标题化合物,用(2r,6s)-2,6-二甲基哌嗪代替哌嗪,得到标题化合物(22.9mg,0.055mmol,3%),为白色固体。esi-ms:419.7[m+h]
+
。
[0509]
实例51
[0510][0511]
(s)-(2-甲基哌嗪-1,4-二基)双((2-氟-4-甲氧基苯基)甲酮)(化合物51)
[0512]
按照程序f中概述的方法合成标题化合物,用(s)-2-甲基哌嗪代替哌嗪,得到标题化合物(27.9mg,0.069mmol,39%),为白色固体。esi-ms:405.7[m+h]
+
。
[0513]
实例52
[0514]
程序g:((2r,6r)-4-(1h-吲哚-6-羰基)-2,6-二甲基哌嗪-1-基)(4,7-二甲氧基-1h-吲哚-2-基)甲酮(化合物52)。
[0515][0516]
a.(3r,5r)-4-(4,7-二甲氧基-1h-吲哚-2-羰基)-3,5-二甲基哌嗪-1-甲酸叔丁酯
[0517]
[0518]
向8-ml小瓶中添加4,7-二甲氧基-1h-吲哚-2-甲酸(80.0mg,0.362mmol)、(3r,5r)-3,5-二甲基哌嗪-1-甲酸叔丁酯(77.5mg,0.362mmol)、hatu(151.2mg,0.398mmol)、diea(1.08mmol)和dmf(3.0ml,0.041mmol),并将所得溶液在25℃下搅拌2h。此后,真空浓缩所得混合物,通过快速硅胶色谱法用dcm:meoh(20:1)洗脱来纯化粗物质,得到标题化合物(107mg,71%),为白色固体。esi-ms:418.1[m+h]+。
[0519]
b.(4,7-二甲氧基-1h-吲哚-2-基)((2r,6r)-2,6-二甲基哌嗪-1-基)甲酮。
[0520][0521]
向8-ml小瓶中添加hcl的1,4-二噁烷溶液(3.0ml,98.7mmol)、dcm(3.0ml,47.19mmol)和(3r,5r)-4-(4,7-二甲氧基-1h-吲哚-2-羰基)-3,5-二甲基哌嗪-1-甲酸叔丁酯(79.0mg,0.189mmol)。将所得溶液在25℃下搅拌1h,此后将粗物质真空浓缩并通过硅胶快速色谱法用氯仿/甲醇(20/1)洗脱来纯化,得到标题化合物(67mg),为白色固体。esi-ms:318.4[m+h]+。
[0522]
c.((2r,6r)-4-(1h-吲哚-6-羰基)-2,6-二甲基哌嗪-1-基)(4,7-二甲氧基-1h-吲哚-2-基)甲酮。
[0523][0524]
向40-ml小瓶中放入1-[(3r,5r)-3,5-二甲基哌嗪-1-基]-2-(1h-吲哚-2-基)乙酮(58.0mg,0.214mmol)、4,7-二甲氧基-1h-吲哚-2-甲酸(47.3mg,0.214mmol)、hatu(97.5mg,0.256mmol)、dmf(3.0ml,38.76mmol)和diea(0.641mmol)。将所得溶液在25℃下搅拌16h,此后将粗物质浓缩并通过制备型hplc纯化,得到标题化合物(37.4mg,0.078mmol,36.8%),为白色固体。1h-nmr(400mhz,dmso-d6,350k)δ11.06(br s,1h),10.92(br s,1h),7.61(d,1h,j=8.16hz),7.55(s,1h),7.45-7.43(m,1h),7.15-7.12(m,1h),6.78(d,1h,j=1.88hz),6.63(d,1h,j=8.28hz),6.5(br s,1h),6.42(d,1h,j=8.28hz),4.56-4.50(m,2h),3.90-3.83(br m,2h),3.88(s,3h),3.85(br s,3h),3.68(br d,2h,j=11.05hz),1.33(s,3h),1.32(s,3h)。esi-ms:461.5[m+h]
+
。
[0525]
活性测试
[0526]
方法
[0527]
cps1蛋白的纯化
[0528]
从sf21昆虫细胞表达和纯化cps1。将全长人cps1基因克隆到pfastbac hta中,并使用来自英杰公司(invitrogen)的bac-to-bac表达系统产生杆状病毒。使用p3病毒以1.5e6个细胞/ml的密度和2的moi感染sf21昆虫细胞。60h后通过离心收获细胞,将细胞沉淀重悬于裂解缓冲液(50mm甘氨酰甘氨酸ph 7.4、20mm kcl、1mm tcep、10%甘油和20mm咪唑和roche蛋白酶抑制剂片剂)中,然后在冰上用dounce匀浆器裂解40次。然后通过以30,
000rpm离心30min清除裂解物的不溶部分。将40ml上清液与2ml ni nta珠在4℃下在50ml锥形管中混合45min。
[0529]
用40ml洗涤缓冲液(50mm甘氨酰甘氨酸ph 7.4、500mm nacl、1mm tcep、10%甘油和50mm咪唑)通过将珠离心并再悬浮三次来洗涤珠。将结合的cps1蛋白在6ml洗脱缓冲液(50mm甘氨酰甘氨酸ph 7.4、500mm nacl、1mm tcep、10%甘油和250mm咪唑)中洗脱三次。将洗脱级分合并并使用截留分子量为10,000的amicon ultra离心过滤器浓缩。通过重复浓缩并再悬浮在过滤装置中的储存缓冲液(50mm甘氨酰甘氨酸ph 7.4、500mm nacl、1mm tcep和20%甘油)中除去咪唑。将cps1浓缩至约3mg/ml的最终浓度,然后等分,在液氮中快速冷冻并储存在-80℃。
[0530]
cps1活性的检测和化合物分析
[0531]
使用来自普洛麦格公司(promega)的adp-glo试剂盒测量cps1活性,并在测量cps1的atp酶活性的终点测定中对化合物进行分析。将50nm cps1在384孔板(康宁目录号3820)中以3μl体积单独或与来自dmso储备液的不同量的测试化合物在测定缓冲液(50mm hepes ph 7.0、12.5mm khco3、1.5mm(nh4)2so3、5mm mgcl2、50mm kcl、1mm tcep、0.01%tritonx 100、0.0025%bsa和0.2mm nag)中温育20min。dmso的最终浓度为0.04%。通过添加10μm atp引发反应,使最终体积达到6μl。在室温下放置60min后,用3μl adp-glo试剂终止反应,并在室温下温育30min。然后添加3μl激酶检测试剂,30min后在envision读板仪上测量发光信号。
[0532]
结果示于上表2中。
[0533]
测定2-transcreener adp fp测定
[0534]
使用来自贝尔布鲁克公司(bellbbrook)的transcreener adp fp试剂盒(目录号3010-1k)在终点测定中测量来自cps1的adp形成。将10nm cps1与不同量的抑制剂在测定缓冲液(50mm hepes ph 7.0、12.5mm khco3、1.5mm(nh4)2so3、5mm mgcl2、50mm kcl、1mm tcep、0.01%tritonx 100、0.0025%bsa和0.2mm)中温育20min。在384孔板中用不同量的atp引发反应,最终体积为6μl。60min后,用6ul的30mm edta淬灭反应。分别以2nm和6μg/ml的最终浓度添加adp alexa fluor 633和检测抗体。30min后在tecan m1000读板仪上测量荧光偏振(fp)。使用该测定法发现化合物108具有》66,666的fp(cps1)ic50(nm)值。
[0535]
本说明书中已经详细描述了新的、改进的和非显而易见的组合物,以使本领域普通技术人员能够理解。此外,对于本领域技术人员显而易见的是,对于组合物的特征而言,存在在本质上不背离本文披露的实施例的实质和范围的修改、变化、替换和等效物。因此,落在由所附权利要求限定的本发明的实质和范围内的所有这些修改、变化、替换和等效物都应包含在所附权利要求中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1