多取代烷基酸化合物及其应用
1.本发明涉及药物化学和药学治疗学技术领域,尤其涉及一种多取代烷基酸化合物及其应用。
背景技术:
2.apc(adenomatous polyposis coli,腺瘤性息肉蛋白)作为肿瘤相关蛋白,近年来研究发现其在肿瘤发生和转移中发挥了重要作用。野生型apc蛋白全长2843个氨基酸,由n端的arm结构域,中间的β-catenin结合区域和c端的dlg结合区域组成。生理状态下,apc位于细胞质,主要参与调节细胞粘附等多种功能。临床研究发现,85%先天性和80%后天性肿瘤转移病人中apc基因发生突变,表达为截短型apc蛋白。截短型apc蛋白只包含n端的arm结构域,其表面彻底暴露,进而在细胞内与生理状态下并不结合的一个蛋白asef发生结合。asef(apc-stimulated guanine nucleotide exchange factor,apc刺激的鸟苷酸交换因子)是由4个结构域(abr、sh3、dh和ph)组成,生理状态下处于自身抑制状态,被截短型的apc结合后,asef蛋白构象发生变化,自身抑制被释放,激活其鸟苷酸交换因子活性,进而招募并激活下游的gtp酶,将gtp水解为gdp,引发异常的细胞扁化,产生细胞膜皱褶化和假足,降低细胞间黏附力,形成息肉从而导致癌细胞转移等一系列病理现象的发生。
3.进一步体内研究表明,在apc突变的小鼠模型中(multiple interstine neoplasi,min),apc基因截短型突变通常会导致小鼠中的肿瘤快速转移,免疫组化显示截短型apc和asef在肿瘤细胞中高表达;apc发生截短型突变的肿瘤细胞中,asef被持续性地激活,大大增加了肿瘤细胞的迁移能力,从而促进了肿瘤组织的转移。因此,病理状态下的截短型apc/asef的蛋白-蛋白相互作用(下文简称为“apc/asef相互作用”)在肿瘤转移的发生发展中发挥着重要作用,以“apc/asef相互作用”作为靶标进行阻断将有望开辟抗肿瘤及抗肿瘤转移治疗的全新策略。
4.因此研究开发抑制apc/asef相互作用的抗肿瘤及抗肿瘤转移药物具有重要的现实意义和科学价值。
技术实现要素:
5.本发明的第一个目的在于,提供一种对apc/asef相互作用具有强效抑制活性并且可用于制备肿瘤及抗肿瘤转移药物的多取代烷基酸化合物。
6.本发明第二个目的在于,提供一种包含多取代烷基酸化合物的药物组合物。
7.本发明的第三个目的在于,提供多取代烷基酸化合物在制备抗肿瘤药物中的应用。
8.为了实现上述第一个目的,本发明提供了一种取代烷基酸化合物或其在药学上可接受的盐,所述多取代烷基酸化合物的结构如式(i)所示
[0009][0010]
式(i)
[0011]
其中,ar1、ar2分别选自芳基、取代芳基、五元芳杂环和六元芳杂环中的一种或两种;r1为羟基、巯基、氨基、卤素、β-吲哚基、β-咪唑基、苯基、4-羟基苯基和萘基中的一种;r2为1~12碳原子取代烷基、环丙基、环丁基、环戊基、环己基和环庚基中的一种;r3为羧甲基、4-叔丁基苯基和4-苯甲酰基苯基中的一种。
[0012]
作为一个优选方案,所述芳基为苯基、萘基;所述芳基的取代基选自f、cl、br、i、甲基、甲氧基、三氟甲基、氰基、硝基、氨基、羟基、乙氧基、苄氧基、磺酰胺基、苯基、苯甲酰基、1-吡唑基、甲硫基、苯氧基和β-吲哚基中的一种或多种;所述取代基的数目是1-2的整数。
[0013]
本发明的优选实施例中,多取代烷基酸化合物选自化合物458、456、448、445、444、442、438、439、440、380、379、381、382、383、384、385、386、376、377、378、375、354、355、356、357、358、359、348、272、262、369、370、371、372、368、507、479、471、472、463、426、212、503、504、505、506、480、453、274、481、y-001、y-002、y-003、y-004、y-005、y-006、y-007、y-008。具体结构式如下:
[0014][0015]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-苯甲酰基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0016][0017]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-羟基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0018][0019]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-(1-吡唑基)苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0020][0021]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-甲硫基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0022][0023]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-苯氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0024][0025]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2,3-二氢-1,4-苯并二烷-6-甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0026][0027]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-三氟甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0028][0029]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-溴苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0030][0031]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-碘苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0032][0033]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-甲酰胺基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0034][0035]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0036][0037]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-氰基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0038][0039]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-苯基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0040][0041]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-三氟甲基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0042][0043]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2,3-二氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0044][0045]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(3-氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0046][0047]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2,6-二氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0048][0049]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0050][0051]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-氯苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0052][0053]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-甲基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0054][0055]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-硝基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0056][0057]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(异烟酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0058][0059]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(4-磺酰胺基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0060][0061]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2-氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0062][0063]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2-甲基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0064][0065]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(3-甲基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0066][0067]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(2,4-二氟苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0068][0069]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0070][0071]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(吡啶-2-甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0072][0073]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(嘧啶-4-甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0074][0075]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-苯乙基-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0076][0077]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-甲氧基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0078][0079]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-乙氧基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0080][0081]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-苯乙氧基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0082][0083]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-((1h-吲哚-3-基)甲基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0084][0085]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-叔丁基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0086][0087]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-(4-苯甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0088]
[0089]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0090][0091]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-(4-氯苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0092][0093]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-(4-氨甲酰基苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0094][0095]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异丁基-11-(羟甲基)-14-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
(羟甲基)-16-(2-((s)-2-苯甲酰胺基丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0112][0113]
(2s,5s,8s,11s,14s)-1-氨基-2-(4-苯甲酰基苯乙基)-5-(4-羟基苯乙基)-8-异戊基-11-(羟甲基)-14-(2-((s)-2-(4-苯甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-1,4,7,10,13-五酮-3,6,9,12-四氮杂十七烷酸;
[0114][0115]
(4s,7s,10s,13r,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(巯甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0116][0117]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(氨甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0118][0119]
(4s,7s,10s,13r,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(氯甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0120][0121]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(β-吲哚基甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0122][0123]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(β-咪唑基甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0124][0125]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-苄基-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0126][0127]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(4-羟基苄基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸;
[0128][0129]
(4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(2-萘基甲基)-16-(2-((s)-2-(4-甲氧基苯甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸。
[0130]
本发明的化合物可能具有多个不对称中心、手性轴和手性平面并且可以以对映异构体、非对映异构体、差向异构体、外消旋体及其混合物的形式存在。
[0131]
为了实现上述第二个目的,本发明公开了一种药物组合物,其包含上述任一所示化合物和药学上可接受的辅料。
[0132]
在药学上可接受的辅料选自填充剂、润湿剂、黏合剂、崩解剂、润滑剂、溶剂、增溶剂、防腐剂、矫味剂、着色剂、ph调节剂和抗氧化剂中的一种或多种。
[0133]
药物组合物为片剂、胶囊、散剂、颗粒、糖浆剂、溶液、悬浮剂、注射剂或气雾剂。
[0134]
为了实现上述第三个目的,本发明公开了所述多取代烷基酸化合物或其在药学上可接受的盐在制备抗肿瘤及抗肿瘤转移药物中的应用。
[0135]
作为一个优选方案,所述肿瘤包括但不限于结肠癌、宫颈癌、乳腺癌、前列腺癌、甲状腺癌、肝癌、胃癌、肺癌、肾癌、膀胱癌、鼻咽癌、喉癌、腺样囊性癌、食道癌、白血病、黑色素瘤、视网膜母细胞瘤。
[0136]
本发明公开了所述多取代烷基酸化合物或其在药学上可接受的盐在制备apc/asef蛋白-蛋白相互作用抑制剂中的应用。
[0137]
就本发明所述具有通式i所示结构的多取代烷基酸化合物,具体合成策略分别如下:
[0138][0139]
式中,ar1、ar2、r1、r2、r3的含义与前文所述相同。
[0140]
1)将5-(叔丁基)-1-甲基-l-丙氨酰甘氨酰-l-谷氨酸溶于二氯甲烷中,加入三乙胺,冰浴0℃下搅拌0.5小时。将芳基取代的酰氯缓慢滴加到上述反应液中,滴完后反应10分钟。将反应液倒入水中,用二氯甲烷萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体a。
[0141]
2)将中间体a溶于甲醇中,加入2n氢氧化锂溶液,室温反应4小时。反应结束后,用稀盐酸调节ph到6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体b。
[0142]
3)将中间体b溶于dmf中,加入edci搅拌2小时,加入r1取代的胺,hobt、三乙胺,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离
得到中间体c。
[0143]
4)将中间体c溶于甲醇中,加入2n氢氧化锂溶液,室温反应4小时。反应结束后,用稀盐酸调节ph到6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体d。
[0144]
5)将中间体d溶于dmf中,加入edci搅拌2小时,加入r2取代的胺,hobt、三乙胺,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体e。
[0145]
6)将中间体e溶于甲醇中,加入2n氢氧化锂溶液,室温反应4小时。反应结束后,用稀盐酸调节ph到6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体f。
[0146]
7)将中间体f溶于dmf中,加入edci搅拌2小时,加入ar2取代的胺,hobt、三乙胺,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体g。
[0147]
8)将中间体g溶于甲醇中,加入2n氢氧化锂溶液,室温反应4小时。反应结束后,用稀盐酸调节ph到6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体h。
[0148]
9)将中间体h溶于dmf中,加入edci搅拌2小时,加入r3取代的胺,hobt、三乙胺,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体i。
[0149]
10)将中间体i溶于dmf,加入三氟乙酸,室温搅拌1小时。反应结束后,浓缩,残余物经柱层析分离,得到终产物i。
[0150]
根据上述制备方法的教导,本领域普通技术人员无需创造性劳动即可获得上述式ⅰ所包含的所有化合物。
[0151]
本发明提供了具有全新结构的多取代烷基酸化合物,对apc/asef相互作用抑制测试结果显示,本发明提供的化合物能够强效的抑制apc/asef相互作用,ic
50
均小于100nm。
[0152]
本发明的优点在于,本发明提供了具有全新结构的多取代烷基酸化合物,对肿瘤细胞增殖、迁移均有强效的抑制活性,其ic
50
均小于100μm。本发明化合物对正常细胞的增殖无毒性作用,对多种癌细胞具有抑制和杀伤作用,并能够抑制多种癌细胞的转移和侵袭,具有广谱抗肿瘤活性;该类化合物具有很好的水溶性,无论是从抗肿瘤活性,还是成药性来看,该类化合物均具有较好的开发和应用价值。因此,其不但有望开发成新型的单一用药方式的抗肿瘤及抗肿瘤转移药物,而且还可以开发成与现有药物组合给药的抗肿瘤及抗肿瘤转移药物。
附图说明
[0153]
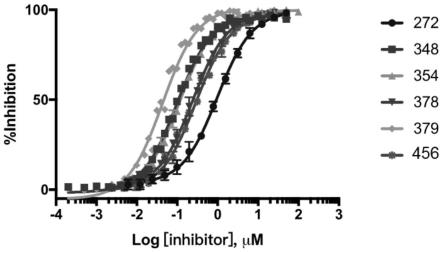
图1.化合物272、348、354、378、379、456抑制apc/asef相互作用曲线图。
[0154]
图2.化合物348在25μm能够抑制肝癌细胞(hepg2)增殖。
[0155]
图3.化合物348能够抑制结肠癌细胞系sw480的迁移。
[0156]
图4.化合物348能够抑制小鼠肿瘤增殖和转移。
具体实施方式
[0157]
以下,结合具体实施方式对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。
[0158]
实施例1.中间体的制备
[0159]
(1)中间体a的制备
[0160][0161]
将3.4g nh
2-age(tbu)-och3溶于50毫升二氯甲烷中,加入三乙胺1毫升,冰浴到0℃,搅拌0.5小时,逐渐滴入苯甲酰氯1.5g,反应10分钟。将反应液倒入水中,用二氯甲烷萃取三次,饱和食盐水洗涤一次,无水硫酸镁干燥,过滤,浓缩,残余物经柱层析分离得到化合物a4.2g,收率为93%。(1h nmr(600mhz,dmso-d6)δ9.03(d,j=6.5hz,1h)8.63(d,j=6.7hz,1h),8.32(t,j=5.8hz,1h),7.93
–
7.78(m,5h),4.46
–
4.42(m,1h),4.38
–
4.30(m,1h),4.20
–
4.14(m,2h),3.66(s,3h),1.97
–
1.87(m,2h),1.82
–
1.72(m,2h),1.47(d,3h),1.42(s,9h)
;
ms m/z:450.5[m+1]
+
)。
[0162]
(2)中间体b的制备
[0163][0164]
将4.0g中间体a溶于20毫升甲醇中,加入2n氢氧化锂20毫升,室温反应4小时。用稀盐酸调ph值至6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体b 3.4g。(1h nmr(600mhz,dmso-d6)δ9.12(d,j=6.5hz,1h),8.68(d,j=6.7hz,1h),8.33(t,j=5.8hz,1h),7.83
–
7.75(m,5h),4.43
–
4.38(m,1h),4.28
–
4.20(m,1h),4.10
–
4.04(m,2h),1.90
–
1.82(m,2h),1.80
–
1.70(m,2h),1.66(s,3h),1.40(s,9h)
;
ms m/z:435.8[m+1]
+
)。
[0165]
(3)中间体c的制备
[0166][0167]
将中间体b 3.0g溶于dmf中,加入edci 2g搅拌2小时,加入丝氨酸甲酯盐酸盐1.2g,hobt 0.1g、三乙胺3毫升,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体c3.18g,收率85%。(1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.88(d,j=6.7hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,1h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),3.67(s,3h),1.90
–
1.82(m,2h),1.80
–
1.70(m,2h),1.66(s,3h),1.40(s,9h)
;
ms m/z:537.6[m+1]
+
)。
[0168]
(4)中间体d的制备
[0169][0170]
将3.0g中间体c溶于20毫升甲醇中,加入2n氢氧化锂20毫升,室温反应4小时。用稀盐酸调ph值至6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体d 2.7g,收率92%。1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.88(d,j=6.7hz,1h),8.83(d,j=6.7hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,1h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),1.90
–
1.82(m,2h),1.80
–
1.70(m,2h),1.66(s,3h),1.40(s,9h)
;
ms m/z:523.3[m+1]
+
)。
[0171]
(5)中间体e的制备
[0172]
[0173]
将中间体d 2.5g溶于dmf中,加入edci 1g搅拌2小时,加入亮氨酸甲酯盐酸盐1.1g,hobt 0.1g、三乙胺3毫升,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体e2.8g,收率90%。(1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.91(d,j=6.7hz,1h),8.88(d,j=6.7hz,1h),8.83(d,j=6.7hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,2h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),3.67(s,3h),1.90
–
1.82(m,4h),1.80
–
1.70(m,2h),1.66(s,3h),1.49
–
1.42(m,1h),1.40(s,9h),0.9(d,6h)
;
ms m/z:650.8[m+1]
+
)。
[0174]
(6)中间体f的制备
[0175][0176]
将2.5g中间体e溶于20毫升甲醇中,加入2n氢氧化锂20毫升,室温反应4小时。用稀盐酸调ph值至6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体f 2.2g,收率90%。(1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.91(d,j=6.7hz,1h),8.88(d,j=6.7hz,1h),8.83(d,j=6.7hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,2h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),1.90
–
1.82(m,4h),1.80
–
1.70(m,2h),1.66(s,3h),1.49
–
1.42(m,1h),1.40(s,9h),0.9(d,6h)
;
ms m/z:635.9[m+1]
+
)。
[0177]
(7)中间体g的制备
[0178][0179]
将中间体f 2.0g溶于dmf中,加入edci 0.8g搅拌2小时,加入酪氨酸甲酯盐酸盐0.9g,hobt 0.05g、三乙胺1.5毫升,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体g 2.2g,收率85%。(1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.91(d,j=6.7hz,1h),8.88(d,j=6.7hz,1h),8.83(d,j=6.7hz,1h),8.52(d,j=5.8hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),6.96(dd,j
=7.9hz,2h),6.68(dd,j=7.9hz,2h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,3h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),3.67(s,3h),3.29
–
3.20(m,1h),3.05
–
2.98(m,1h),1.90
–
1.82(m,4h),1.80
–
1.70(m,2h),1.66(s,3h),1.49
–
1.42(m,1h),1.40(s,9h),0.9(d,6h)
;
ms m/z:813.4[m+1]
+
)。
[0180]
(8)中间体h的制备
[0181][0182]
将2.0g中间体g溶于20毫升甲醇中,加入2n氢氧化锂20毫升,室温反应4小时。用稀盐酸调ph值至6,用乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸镁干燥,过滤、浓缩,残余物经柱层析分离,得到中间体h 1.8g,收率93%。(1h nmr(600mhz,dmso-d6)δ9.04(d,j=6.5hz,1h),8.91(d,j=6.7hz,1h),8.88(d,j=6.7hz,1h),8.83(d,j=6.7hz,1h),8.52(d,j=5.8hz,1h),8.32(d,j=5.8hz,1h),7.83
–
7.75(m,5h),6.96(dd,j=7.9hz,2h),6.68(dd,j=7.9hz,2h),4.94(t,1h),4.63
–
4.58(m,1h),4.48
–
4.30(m,3h),4.26
–
4.20(m,1h),4.10
–
4.04(m,2h),4.01
–
3.95(m,1h),3.90
–
3.80(m,1h),3.29
–
3.20(m,1h),3.05
–
2.98(m,1h),1.90
–
1.82(m,4h),1.80
–
1.70(m,2h),1.66(s,3h),1.49
–
1.42(m,1h),1.40(s,9h),0.9(d,6h)
;
ms m/z:799.9[m+1]
+
)。
[0183]
(9)中间体i的制备
[0184][0185]
将中间体f 1.5g溶于dmf中,加入edci 0.5g搅拌2小时,加入(s)-4,5-二氨基-5-氧代戊酸叔丁酯盐酸盐0.5g,hobt 0.05g、三乙胺1.0毫升,50-80℃下搅拌10-20小时。反应结束后,加入到冰水中,固体析出后过滤,干燥,经柱层析分离得到中间体i 1.7g,收率90%。1h nmr(600mhz,dmso-d6)δ9.17(s,1h),8.63(d,j=6.7hz,1h),8.28(t,j=5.8hz,1h),8.06(d,j=7.6hz,1h),7.99(d,j=7.4hz,1h),7.93
–
7.88(m,3h),7.84(d,j=7.9hz,1h),7.81(d,j=8.0hz,1h),7.56-7.52(m,1h),7.46(dd,j=8.3,7.0hz,2h),7.09(m,2h),7.01(d,j=8.5hz,2h),6.64(d,j=8.5hz,2h),5.13(s,1h),4.46
–
4.42(m,1h),4.38
–
4.30
(m,3h),4.20
–
4.14(m,2h),3.73(d,j=5.8hz,2h),3.59(s,2h),2.93(dd,j=14.1,4.9hz,1h),2.67(dd,j=14.1,4.9hz,1h),2.30
–
2.15(m,4h),1.97
–
1.87(m,2h),1.82
–
1.72(m,2h),1.60
–
1.52(m,1h),1.42(s,18h),1.40
–
1.34(m,5h),0.83(d,j=6.6hz,3h),0.78(d,j=6.6hz,3h)
;
ms m/z:983.5[m+1]
+
。
[0186]
实施例2.化合物348的制备
[0187][0188]
将中间体i1.5g溶于dmf20毫升,加入三氟乙酸20毫升,室温搅拌1小时。反应结束后,浓缩,残余物经柱层析分离,得到终产物348 1g,收率80%。1h nmr(600mhz,dmso-d6)δ9.17(s,1h),8.63(d,j=6.7hz,1h),8.28(t,j=5.8hz,1h),8.06(d,j=7.6hz,1h),7.99(d,j=7.4hz,1h),7.93
–
7.88(m,3h),7.84(d,j=7.9hz,1h),7.81(d,j=8.0hz,1h),7.56-7.52(m,1h),7.46(dd,j=8.3,7.0hz,2h),7.09(m,2h),7.01(d,j=8.5hz,2h),6.64(d,j=8.5hz,2h),5.13(s,1h),4.46
–
4.42(m,1h),4.38
–
4.30(m,3h),4.20
–
4.14(m,2h),3.73(d,j=5.8hz,2h),3.59(s,2h),2.93(dd,j=14.1,4.9hz,1h),2.67(dd,j=14.1,4.9hz,1h),2.30
–
2.15(m,4h),1.97
–
1.87(m,2h),1.82
–
1.72(m,2h),1.60
–
1.52(m,1h),1.40
–
1.34(m,5h),0.83(d,j=6.6hz,3h),0.78(d,j=6.6hz,3h)
.13
c nmr(151mhz,dmso)δ174.00,173.98,173.00,172.92,171.99,171.18,170.95,170.22,168.93,166.50,155.79,133.80,131.42,130.07,128.19,127.67,127.62,114.92,61.54,54.86,54.40,51.88,51.79,51.58,49.46,42.22,40.32,36.32,30.13,30.02,27.50,27.28,24.08,22.99,21.43,17.56.ms m/z:869.30[m-1]-;hrms m/z[m+h]
+
:calcd for c40h55o14n8,871.3832;found,871.3831
[0189]
实施例3.化合物制备
[0190]
按照上述方法制备化合物458、456、448、445、444、442、438、439、440、380、379、381、382、383、384、385、386、376、377、378、375、354、355、356、357、358、359、272、262、369、370、371、372、368、507、479、471、472、463、426、212、503、504、505、506、480、453、274、481、y-001、y-002、y-003、y-004、y-005、y-006、y-007、y-008。
[0191]
实施例4.本发明化合物分子水平抑制apc/asef相互作用实验
[0192]
利用荧光偏振实验(fp)建立apc/asef相互作用抑制剂体外筛选体系,评价化合物分子水平抑制apc/asef相互作用的能力。300((4s,7s,10s,13s,16s)-4-氨基甲酰基-7-(4-羟基苯乙基)-10-异丁基-13-(羟甲基)-16-(2-((s)-2-(环丙基甲酰胺基)丙酰胺基)乙酰氨基)-6,9,12,15-四酮-5,8,11,14-四氮杂十九烷二酸)为阴性对照化合物。
[0193]
(1)表达纯化apc(303-739)和asef(170-271)。构建原核表达载体pet28a-apc和pet28a-asef并在菌株bl-21中大量表达apc和asef,然后应用亲和离子交换,凝胶过滤等层析方法得到重组质粒表达的纯化蛋白apc和asef;
[0194]
(2)母液配置:各称取化合物1mg并用dmso溶解至100mm初始浓度。配制荧光肽母液浓度为100μm。
[0195]
(3)反应条件:用反应缓冲液(50mm hepes 7.5,300mm nacl,1mm edta,1mm dtt)稀释apc(303-739)和荧光肽(tracer)至各自相应浓度。反应在室温,96孔板中进行。每个实验组做3个复孔。
[0196]
(4)梯度稀释:在a行各孔加入8μl化合物,b-h各行加入4μldmso。从a行各取4μl化合物加入b行稀释后再取出4μl加入c行,以此类推直到g行,g行稀释之后取出4μl化合物丢掉。
[0197]
(5)加入91μlapc蛋白稀释液,室温条件孵育1.5h。加入5μl荧光肽稀释液,室温条件下继续孵育1.5h。
[0198]
(6)信号值检测:用多功能酶标仪(synergy h4hybrid reader)来检测荧光偏振值。激发光为485nm,发射光为525nm,g因子为1,灵敏度设置为65。
[0199]
(7)数据处理:1)计算样本的平均荧光值,包含作为阳性对照的“蛋白+荧光肽”和作为阴性对照的“tracer”;2)然后按照以下公式进行计算inhibition(%)=100*(阳性对照-sample)/(阳性对照-阴性对照)。以小分子终浓度的log值为横坐标,抑制率(%)为纵坐标,用graphpad prism 7软件拟合出抑制曲线并求出ic
50
值,结果如下表1所示。以化合物272、348、354、378、379、456为代表绘制相应的亲和力曲线,结果如图1所示。
[0200]
表1化合物抑制apc/asef相互作用的ic
50
(单位:nm)
[0201]
[0202][0203]
实施例5.化合物的抗肿瘤活性测定
[0204]
1.mtt实验
[0205]
(1)使用处于生长对数期的人子宫颈癌细胞(hela),人肝癌细胞(hepg2),人胃癌细胞(mkn-45),人肺癌细胞(hcc-827),乳腺癌细胞(mcf7),人涎腺腺样囊性癌细胞(sacc-83),结肠癌细胞株(sw480)对细胞进行消化、重悬得到细胞悬液,将细胞稀释到50,000个/ml。在96孔板中每孔加入100μl,将铺好的96孔板放入培养箱中,在37℃、5%co2条件下培养16小时。
[0206]
(2)使用不含有fbs的培养基稀释化合物348样品。向96孔板中加入不同浓度的化合物。其中,化合物设置1μm,2μm,4μm,8μm,16μm共5个浓度梯度,每个浓度设6个复孔。同时设置不含有化合物样品的阴性对照组,也是6个复孔。在37℃、5%co2条件下培养6小时。
[0207]
(3)向每孔加入100μl含10%mtt的细胞培养基(其中mtt浓度为0.5mg/ml)。将96孔板放入培养箱中孵育4个小时。
[0208]
(4)移除96孔板中含有mtt的培养液,加入100μl的dmso,使甲醇溶解充分。使用酶标仪在od 490nm处测量96孔板的吸光值,并计算抑制率:
[0209]
抑制率=(1-od测试组/od阴性对照组)*100%
[0210]
根据抑制率计算ic
50
,结果如下表2所示。
[0211]
表2化合物对不同肿瘤细胞的ic
50
(单位:μm)
[0212]
[0213]
[0214][0215]
由上述结果可知,本发明的化合物均具有明显的抗肿瘤活性。
[0216]
实施例7.活死细胞双染实验
[0217]
calcein-am是一种能够轻易穿透活细胞膜对活细胞荧光标记的染色试剂,发绿色荧光(激发光490nm,发射光515nm)。calcein-am具有低细胞毒性,适合用于活细胞染色。calcein-am常与死细胞荧光探针碘化丙啶(pi)同时进行活死细胞的荧光双重染色。pi只能穿过死细胞膜到达细胞核,并嵌入细胞的dna双螺旋从而产生红色荧光(激发光535nm,发射光617nm)。由于calcein-am和pi都可被490nm激发,因此可用荧光显微镜同时观察活死细胞;而用545nm激发只可观察死细胞。我们使用yeasen公司的calcein-am/pi double stain kit试剂盒进行活细胞和死细胞水平的分析,具体步骤如下:
[0218]
1.在24孔板每孔种3
×
104个细胞,待细胞贴壁后,加相应浓度的化合物培养12-48h。
[0219]
2.用胰酶-edta将细胞重悬,每孔收集的细胞用200μl 1
×
assay buffe(r试剂盒中)重悬,加入calcein-am(终浓度2μm)和pi(终浓度4.5μm)染料,在37℃恒温孵育15min。
[0220]
3.在倒置荧光显微镜的10倍镜下观察,使用490
±
10nm激发滤片同时检测活细胞(黄绿色荧光)和死细胞(红色荧光)。使用545nm的发射滤片仅能观察到死细胞,随机选取5个视野拍照。
[0221]
我们使用活死细胞双染实验评估了25μm化合物348处理48h细胞的存活率。结果表明,药理学浓度的348并没有引起明显的细胞死亡,但导致了肿瘤细胞(hepg2)的数量(绿色)显著减少(图2)。作为对比,我们发现5μm doxorubicin(dox)处理12h的肿瘤细胞引起了明显的细胞死亡。这意味着化合物是通过抑制肿瘤细胞的增殖而不是产生细胞毒性来发挥抑癌作用的。
[0222]
实施例8.细胞迁移实验
[0223]
(1)transwell小室的制备
[0224]
使用corning公司的8μm孔径无胶24孔板transwell insert。预平衡:在24孔板中
中加入600μl含有血清的培养液,在37℃的培养箱里平衡一个小时增强细胞的粘附作用。如果需要加药处理,则此培养液中加入相应浓度的药物。
[0225]
(2)制备细胞悬液
[0226]
消化细胞,终止消化后离心弃去培养液,用pbs洗1-2遍,用无血清培养基重悬。
[0227]
(3)接种细胞
[0228]
用细胞活力分析系统(vi-cell xr)对细胞进行计数,取细胞悬液体积200μl加入transwell小室24孔板上室。在此培养液中加入相应5μm、10μm的化合物无348.
[0229]
(4)细胞固定与染色,计数
[0230]
100%甲醇固定10min,固定完之后用结晶紫染色染60min。用清水将染色液清洗干净之后放在37度培养箱烘干,去显微镜下拍照,20x镜下,每个实验组选5个视野,取平均值计数。
[0231]
实验结果如图3所示,随着化合物348浓度的增加,细胞迁移能力不断下降,10μm的时候迁移能力下降50%以上。348能够明显抑制剂结肠癌细胞sw480的迁移和侵袭。
[0232]
实施例9.化合物抑制裸鼠肿瘤转移实验
[0233]
a.建立sw480-gfp细胞株:建立稳定转染gfp的sw480细胞,利用流式细胞术进行gep荧光标记的细胞分选;b.脾包膜下注射法:将分选好的sw480-gfp细胞悬液0.2ml(5*106/只)注射至裸鼠脾包膜下,建立肝转移模型;c.盲肠原位接种法:将含有sw480-gfp细胞的瘤块1mm3原位种植于裸鼠盲肠壁,建立盲肠原位移植瘤;d.体外荧光成像系统及荧光共聚焦显微镜confocal评估转移情况,按照溶剂对照组和合适剂量的抑制剂348,处理构建成功的小鼠结肠癌转移模型(每组10只裸鼠)。通过活体荧光成像系统在动物活体外实时监测肿瘤转移的情况,我们将系统评估加入抑制剂后两种结肠癌肝转移模型抑制转移水平;e.包埋切片的肿瘤组织样本:当溶剂对照组的裸鼠肿瘤已不再转移或裸鼠开始出现死亡时,处死所有裸鼠。收集肿瘤,肝脏,比较化合物处理组与对照组肿瘤的大小,拍照、称重并将肿瘤和肝脏组织包埋切片。
[0234]
实验结果如图4所示,化合物348能够明显抑制小鼠肿瘤细胞的转移和侵袭,从而抑制肿瘤的形成。
[0235]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1