一种多肽化合物、多肽自组装网络材料及其制备方法与应用
本发明涉及生物医学材料技术领域,特别是涉及一种多肽化合物、由该多肽化合物自组装形成的网络状材料、及该多肽化合物和网络材料的制备方法与应用。
背景技术:
多肽自组装是多肽分子利用氢键、疏水性作用、π-π堆积作用等非共价键力,自组装形成形态与结构特异的多肽分子聚集体的过程,多肽分子聚集体可形成纳米级的三维网络结构,该结构类似于天然细胞外基质结构,可以为细胞提供储存与生长支撑,使其立体分布;该材料广泛应用于3d培养、细胞储存、组织工程等研究领域,是近年来生物医学材料领域的研究热点。
多肽自组装形成的网络结构,具有高含水量、生物相容、剪切稀化、破坏后快速自修复等特性,是开展储存和培养细胞、修复组织等的理想体系。然而,大部分多肽自组装网络材料应用时呈水凝胶状态,不便于进行细胞的接种(接种容易使细胞分布不均匀)与解离(解离时步骤繁琐且易对细胞造成损伤);同时,引发网络结构形成的条件或成分不利于细胞储存、培养或在人体中的应用,大部分网络结构的形成有赖于高浓度的盐离子、酸性ph环境、某种特异性蛋白、光照、或不适于细胞存活的温度等。
技术实现要素:
本发明的目的是针对现有技术中存在的问题,第一方面,提供一种在ph为中性的条件下可自组装形成网络结构的多肽化合物,包括依次连接的疏水结构、柔性结构和回转结构;
所述柔性结构至少包括一个较小侧基的氨基酸、一个带羟基的氨基酸、及不少于一个的疏水氨基酸;优选的,所述较小侧基的氨基酸为g、a、v中的一种,更优选g或a;所述带羟基的氨基酸为s、t、o中的一种,更优选s或t;所述柔性结构中的疏水氨基酸选自i、l、f中的一种或几种,更优选的,所述柔性结构中含有2个疏水氨基酸;
所述回转结构包括至少一个氨基酸序列为x3x4x3x3x1的单元,x1、x3和x4分别代表氨基酸;优选的,x1选自疏水氨基酸;进一步地,x3选自g和/或a;更进一步地,x4选自p和/或o;
所述疏水结构的氨基酸组成整体相对于回转结构较为疏水;优选自i、v、l、f、c、m、a等疏水氨基酸中的一种或几种的组合;更优选i、v、l、f中的一种或几种。
所述柔性结构中一端为较小侧基的氨基酸,另一端为疏水氨基酸;一端的较小侧基的氨基酸与所述疏水结构直接相连,另一端的疏水氨基酸与回转结构直接相连;进一步地,所述柔性结构选自gsii、gtii、gtvi、atvi中的一种;优选的,所述疏水结构选自fiiii或iiiii。
所述回转结构包括氨基酸序列为x3x4x3x3x1的多个单元,多个单元连续设置;更优选的,多个单元中所有的x1可相同可不同,x3可全部为g,或部分为g部分为a,或全部为a;x4可全部为p,或全部为o,或部分为p部分为o。
当所述单元为两个时,其氨基酸序列为x3x4x3x3x1-x3x4x3x3x2,x1、x2、x3和x4分别代表氨基酸;可选的,x1和x2都选自疏水氨基酸,可相同可不同;进一步地,x3选自g和/或a;更进一步地,x4选自p和/或o;可选的,两个回转结构中:x3可相同可不同,x4可相同可不同;具体的,所述回转结构的氨基酸序列为gpggvgpggv或goggvgpggv。
其氨基酸序列为以下中之一种:
iiiii-gsii-gpggvgpggv、
iiiii-gsii-goggvgpggv、
iiiii-gtii-goggvgpggv、
iiiii-gtvi-goggvgpggv、
fiiii-atvi-goggvgpgav。
第二方面,本发明提供一种制备上述多肽化合物的方法,通过固相多肽合成、微生物合成、发酵或其他生物化学方法制备得到。
第三方面,本发明提供一种多肽自组装网络材料,是由上述多肽化合物形成的纳米级且呈三维网络结构的材料;所述多肽自组装网络材料由多肽化合物溶解后(用于溶解所述多肽化合物的溶剂ⅰ选自ph值≥9的水性溶剂)在引发自组装的溶剂ⅱ中得到;优选的,所述引发自组装的溶剂ⅱ是能将多肽溶液的ph值调至中性的溶剂;
可选的,其为溶液状态,优选的,肽浓度≤0.09wt%;更优选的,肽浓度为0.0001wt%-0.09wt%;最优选的,肽浓度为0.01wt%-0.09wt%;或者
其为水凝胶状态;优选的,肽浓度为0.3wt%-1wt%。
第四方面,本发明提供一种制备上述多肽自组装网络材料的方法,在碱性(ph值大于9)条件下完全溶解所述多肽化合物,得到多肽溶液,以酸性溶液(稀盐酸、醋酸等)调节多肽溶液的ph值至小于9(优选7-8,更优选7-7.5),即得到所述多肽自组装网络材料。
可选的,溶解时使得所述多肽溶液中多肽化合物的肽浓度≤0.09wt%(优选0.0001wt%-0.09wt%,更优选0.01wt%-0.09wt%),得到的多肽自组装网络材料为溶液状态;溶解时使得所述多肽溶液中多肽化合物的肽浓度为0.3wt%-1wt%,得到的多肽自组装网络材料为水凝胶状态;溶解时使得所述多肽溶液中多肽化合物的肽浓度为0.09wt%-0.3wt%,得到的多肽自组装网络材料为液晶相。
第五方面,本发明提供一种上述多肽自组装网络材料在制备细胞及病毒的体外三维储存液、培养液、或药物、疫苗及化合物的储存液中的应用;优选的,所述细胞为免疫细胞、干细胞、肿瘤细胞、血细胞及神经细胞等,所述多肽自组装网络材料在液体状态下支撑细胞,使细胞在多肽自组装网络材料中形成立体分布。
第六方面,本发明提供一种上述多肽自组装网络材料在制备软骨、骨、皮肤、神经等组织的损伤与再生修复药物中的应用。
本发明提供了一种在0℃以上(特别是常温)中性(ph7-8)条件下即可自组装形成网络结构的多肽化合物及由该多肽化合物自组装形成的网络材料。该多肽化合物可在中性条件(也是生理条件)下,自组装为呈纳米级纤维状的多肽分子聚集体,进而形成纳米级的具有三维网络结构的网络材料。该网络材料在微观上呈网状支架,因此在溶液状态下即可实现对细胞与功能性大分子的负载;可应用于细胞(如免疫细胞、干细胞、肿瘤细胞、血细胞及神经细胞等)及病毒的体外三维储存、培养、及组织修复等,便于细胞的接种、解离及直接注射,在生物医学领域具有十分广阔的应用前景与临床应用价值。
附图说明
图1所示为本发明多肽自组装网络材料tem成像照片;
图2所示为本发明多肽自组装网络材料sem的扫描照片;
图3所示为细胞在本发明多肽自组装网络材料中的分布效果图;
图4所示为细胞从本发明多肽自组装网络材料解离后回收效率柱状图;
图5所示为细胞在本发明多肽自组装网络材料内扩增的结果图;
图6所示为本发明多肽自组装网络材料的细胞毒性试验柱状图;
图7所示为本发明多肽自组装网络材料的流变学分析散点图;
图8所示为本发明多肽自组装网络材料的组织修复的效果图。
具体实施方式
本发明首先提供一种可在常温生理(ph7-8)条件下自组装形成网络结构的多肽化合物。该多肽化合物由两个端部和两个端部之间夹着的柔性中部组成;其中,多肽化合物的一端为由疏水氨基酸组成的疏水结构,另一端为回转结构,中部为柔性结构。其中:
疏水结构的氨基酸组成整体相对于回转结构较为疏水,优选疏水氨基酸为i、v、l、f、c、m、a中的一种或几种的组合。疏水结构的氨基酸序列具体为fiiii、iiiii。
回转结构包括至少一个氨基酸序列为x3x4x3x3x1的单元,x1、x3和x4分别代表氨基酸,x1选自疏水氨基酸(例如i、v、l、f、c、m、a中的一种),x3选自g和/或a,x4选自p和/或o;回转结构可以包括多个这样的单元,当回转结构包括n个这样的单元时,n个单元连续排列,其氨基酸序列为x3x4x3x3x1-…-x3x4x3x3x1;多个单元中的所有x1可相同可不同,x3可全部为g,或部分为g部分为a,或全部为a;x4可全部为p,或全部为o,或一个为p一个为o。当回转结构为两个这样的单元时,其氨基端序列可表示为x3x4x3x3x1-x3x4x3x3x2,x1和x2都选自疏水氨基酸(例如i、v、l、f、c、m、a中的一种或两种),可相同可不同;前一个单元中的x3与后一个单元中的x3可相同可不同;前一个单元中的x4与后一个单元中的x4可相同可不同。回转结构的氨基酸序列具体为gpggvgpggv或goggvgpggv。
柔性结构至少包含一个较小侧基的氨基酸y1、一个带羟基的氨基酸y2、及一个的疏水氨基酸y3。其中,较小侧基的氨基酸y1选自g、a和/或v,带羟基的氨基酸y2为s、t和/或o,疏水氨基酸y3选自i、l、f中的一种或几种。柔性结构的氨基酸序列具体为gsii、gtii、gtvi、atvi。疏水结构与柔性结构中的一个较小侧基的氨基酸y1直接相连(与疏水结构相连的较小侧基的氨基酸y1位于柔性结构的一端),回转结构与柔性结构中的一个疏水氨基酸y3之间直接相连(与回转结构相连的疏水氨基酸y3位于柔性结构的另一端)。
该多肽化合物的制备方法可以通过常规的固相多肽合成、微生物合成、发酵或其他生物化学方法等任何合成方法制备。
基于该多肽化合物,本发明提供一种制备多肽自组装网络材料的方法,具体包括以下过程:
在碱性(ph值大于9)条件下完全溶解上述多肽化合物,得到多肽溶液,以稀盐酸、醋酸等酸性溶液调节多肽溶液的ph值至中性范围(7-8,优选7-7.5),即可自组装形成纳米级的具有三维网络结构的网络材料。该多肽自组装网络材料具有良好的生物相容性,形成了纳米级别的网络结构(见实验一的图1),并具有剪切破坏后的自修复特性(见实验六的图7)。该多肽自组装网络材料形成于中性ph值、温度为0℃以上(特别是室温)的条件,不依赖于盐离子、某一种蛋白或其衍生物、光照、或特定的温度区域,用于储存和/培养细胞时不会因高浓度的盐离子、低ph环境、某种特异性蛋白、光照、或特定的温度对细胞造成损伤,也因此适用于生物体。
通过调整多肽化合物在多肽溶液中的浓度,可使得到的多肽自组装网络材料以水凝胶(多肽浓度较高,≥0.3wt%)、液晶相(多肽浓度在0.09-0.3之间)或溶液状态(多肽浓度较低,≤0.09wt%)存在。该多肽自组装网络材料在溶液状态下时,即肽浓度≤0.09wt%,优选为0.0001wt%-0.09wt%,更优选0.01wt%-0.09wt%,或0.0001wt%-0.001wt%,或0.001wt%-0.01wt%,多肽化合物自组装形成纳米级的纤维状多肽分子聚集体,多肽分子聚集体再缠绕构建形成纳米级的三维网络结构,该结构呈网状支架,为细胞提供储存与生长支撑,溶液状态进行细胞的接种,就可使细胞在其中形成立体分布,同时也便于细胞的提取与解离,因此可作为细胞的3d培养液或细胞的储存液使用;适用于各种细胞,如癌细胞、干细胞、上皮细胞、神经元细胞等的储存、培养扩增及其他细胞生物学功能的分析。另一方面,由于该多肽化合物属于组织相容性材料,因此可直接用于人体的治疗,如可用于软骨、骨、皮肤、神经等组织的损伤与再生修复。该网络材料的制备操作简单方便,具有极大的市场价值。
以下结合具体实施例,更具体地说明本发明的内容,并对本发明作进一步阐述,但这些实施例绝非对本发明进行限制。
实施例一:多肽化合物
通过标准固相多肽合成方法合成得到本发明的多肽化合物,序列见表1。
表1本发明多肽化合物的序列
表1中多肽化合物均为白色粉末,纯度均≥98%,经高效液相色谱法和质谱的鉴定,确证为目标多肽。
表1中的疏水结构、柔性结构和回转结构中各氨基酸序列可以任意搭配和组合,如实施例no.1中的疏水结构可以与no.3中的柔性结构和no.4中的回转结构搭配形成多肽化合物。
实施例二:多肽自组装网络材料
将实施例一得到的多肽化合物加至pbs中,加入0.5%(v/v)的氨水至多肽化合物完全溶解,得到肽浓度为1wt%的母液,高压灭菌后于4℃储存,备用。利用该母液进行肽浓度调整,经10%(v/v)醋酸溶液调至中性条件,pbs透析、高压灭菌后即得到多肽自组装网络材料。
实验一:本发明多肽自组装网络材料的表面特征
1、透射电子显微镜(tem)
将实施例二得到的1wt%的母液用去离子水稀释至多肽化合物最终浓度为0.0001wt%,再经10%(v/v)醋酸溶液调至ph为7.4;将调节ph值之前和之后的0.0001wt%肽浓度的液体各10μl,ph值分别为9和7.4,置于用福尔瓦/碳包覆(formvar/carbon-coated)的300目铜网(北京达济科仪科技公司,中国,d11023)上,在60℃条件下,样品抽真空干燥并且在tem铜网表面滴加2%(重量/体积,g/100ml)磷钨酸(锐欣实验用品有限公司,中国,gz02536)60s,除去多余染液磷钨酸,干燥后进行tem成像。样品用h-7650tem(hitachi,日本,h-7650)在120千伏的条件下进行观察,以no.1和no.2的多肽化合物为例,结果见图1(a幅为组装前(ph=9,未加醋酸溶液)no.1的肽浓度为0.0001wt%的tem图像;b幅为组装后(ph=7.4加了醋酸溶液)no.1的肽浓度为0.0001wt%的tem图像;c幅为组装前(ph=9,未加醋酸溶液)no.2的肽浓度为0.0001wt%的tem图像;d幅为组装后(ph=7.4,加了醋酸溶液)no.2的肽浓度为0.0001wt%的tem图)。
2、扫描电子显微镜(sem)
将实施例二得到的1wt%的母液用去离子水稀释至多肽化合物最终浓度为0.001wt%,再经10%(v/v)醋酸溶液调至ph为7.4;将调节ph值之前和之后的0.001wt%肽浓度的液体各10μl,ph值分别为9和7.4,置于用铜箔(北京中镜科仪商贸有限公司,中国,jzcub)上,在常温条件下,样品静置干燥,进行sem成像前,样品进行喷金镀膜(cressington10,莱卡,德国)20s。样品用apreosem(apreo,捷克,美国)在1千伏的条件下进行成像并观察,以no.1和no.2的多肽化合物为例,结果见图2(a幅为组装前(ph=9,未加醋酸溶液)no.1的肽浓度为0.001wt%的sem图像;b幅为组装后(ph=7.4,加了醋酸溶液)no.1的肽浓度为0.001wt%的sem图像;c幅为组装前(ph=9,未加醋酸溶液)no.2的肽浓度为0.001wt%的sem图像;d幅为组装后(ph=7.4,加了醋酸溶液)no.2的肽浓度为0.001wt%的sem图像)。
图1和图2显示:碱性ph条件下,多肽化合物可自组装形成纤维,但纤维长度较短,且分布不均;而在中性ph条件下,多肽化合物溶液可自组装形成纳米级的纤维,纤维缠绕构建形成纳米级的三维网络结构,该网络结构内部分布有较为均匀的孔隙,图1中比例尺为100nm,可以清晰地看到该纳米级的三维网络结构呈网状支架,说明本发明得到的多肽自组装网络材料是纳米级别的。分析可知这种致密的三维网络结构,有利于高效保持水分,形成支撑性的网状支架。
其它编号的实施例有雷同的结果,在此不一一赘述。
实验二:多肽自组装网络材料结合细胞形成3d立体分布
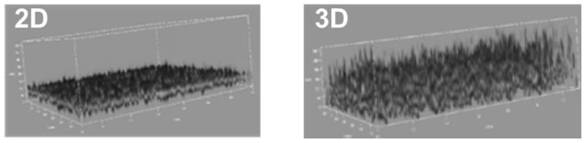
将1×106个/ml骨髓单个核细胞经calcein-am染色后,分别与肽浓度0.1%的多肽自组装网络材料和pbs缓冲液(ph7.4,购自北京索莱宝公司)混合,分别作为3d组和2d组。混匀后于thunder宽场高清成像系统观察细胞在多肽自组装网络材料中的3d分布效果,以no.1的多肽化合物为例,结果如图3所示。
图3表明,与2d组相比,3d组中骨髓单个核细胞在本发明多肽自组装网络材料中能形成3d立体分布,且细胞不易聚集;而2d组中的细胞紧贴在培养板底部,无法形成3d立体分布。
由于本发明多肽自组装网络材料在ph为中性条件下为液态,将细胞与多肽化合物溶液混合即可完成细胞的包裹过程,操作简单、方便,不会对细胞造成损伤。
其它编号的实施例有雷同的结果,在此不一一赘述。
实验三:细胞从多肽自组装网络材料中的解离
细胞的解离,即如何从支架中回收嵌入的细胞用于后续的实验研究,也是实验研究中的关键步骤。
取同等数量小鼠脾细胞,分别加入到不含多肽自组装网络材料的dmem培养基(dulbecco'smodifiedeaglemedium,购自美国gibco公司)中(作为2d组,二维),及含有本发明多肽自组装网络材料的dmem溶液(肽浓度为0.5wt%)中(作为3d组,三维),用细胞计数仪计数离心前的细胞数目,用dmem培养基将3d组稀释5倍体积,在25℃,2000r/min,离心10min,获得沉淀细胞。去除上清,用dmem培养基重悬,再用细胞计数仪计数,计算离心前后细胞回收率,以no.1的多肽化合物为例,结果如图4所示。
图4表明,2d组保存和3d组保存细胞离心回收率相近,说明细胞容易从本发明的多肽自组装网络材料中解离。向本发明多肽自组装网络材料中加入5倍体积以上的生理溶液(如pbs,1640培养基,dmem培养基,生理盐水等)离心后即可获得所需细胞,且对细胞不会造成损伤。而常规多肽自组装网络材料大多需要经酶解完成解组装后,才能进行细胞的解离,酶解本身会对细胞造成损伤。
其它编号的实施例有雷同的结果,在此不一一赘述。
实验四:细胞在多肽自组装网络材料内的扩增
hepa1-6为贴壁生长的肝癌细胞,将其加入dmem培养基(含加10%胎牛血清(fetalbovineserum,fbs),1%青霉素-链霉素和1%谷氨酰胺),在37℃,5%co2培养箱中培养4-5h,开始变形、贴壁,2d可铺满培养皿底部,需要进行换液,作为2d组。将hepa1-6细胞加入到含有本发明多肽化合物、10%胎牛血清的1640培养基(肽浓度为0.1wt%)中,调整细胞浓度为1×106个/ml培养,作为3d组。为了更清晰地观察细胞的分布,团状细胞形态、直径等,收集培养后不同时间点的2d组和3d组的细胞,并对细胞进行活死细胞染色剂染色、计数、通过激光共聚焦观察细胞的生长状态,以no.1的多肽化合物为例。
结果如图5所示(2d组在这三个时间点均无变化,因此只附上第8天的分布效果做示范;红色的点表示死细胞,绿色的点表示活细胞),肽浓度为0.1wt%的本发明多肽自组装网络材料培养的hepa1-6细胞不再贴着培养皿的表面生长,而是呈球状生长,3-4d可形成较小细胞团,7-8天可形成较大的细胞团,继续培养细胞团继续增大,表明本发明多肽自组装网络材料内培养的细胞具有良好的扩增能力,细胞聚集成团,细胞团直径逐渐变大,且活细胞比例明显高于2d组。可见3d组可模拟天然细胞生长的微环境,让细胞接近自然状态扩增,为研究细胞间相互作用、细胞迁移、和以细胞为基础的药物检测等应用提供了基础。而2d组培养的hepa1-6细胞贴着培养皿的表面以二维状态扩增,活细胞比例显著低于3d组。
实验五:多肽自组装网络材料的细胞毒性实验
根据国家标准gb/t16886.5进行试验,以不同肽浓度的多肽化合物(0.01wt%-1wt%)作为测试组,0.5%的苯酚水溶液(质量体积比,g/100ml)作为阳性对照组,dmem培养基作为阴性对照组。dmem培养基铺在96孔板中,把1×104个bhk-21细胞系均匀地接种在每孔中,随后将cck-8细胞增殖检测试剂加入到每孔中,在37℃,5%co2培养箱中培养24小时,使用紫外分光光度计检测450nm处的光密度(od450),并通过od450值(以阴性对照为参考)计算其相对增值率(relativegrowthrate,rgr)。根据我国医疗器械生物学评价标准按以下评分标准评定材料毒性程度:0级:rgr≥100%,1级:rgr为75-99%,2级:rgr为50-74%,3级:rgr为25-49%,4级:rgr为1-24%,5级:rgr为0;rgr为0-1级为合格;2级应结合细胞形态分析,综合评价;3-5级为不合格。以no.1的多肽化合物为例,相对增值率rgr的结果如图6所示。
图6结果显示在肽浓度为0.1-1wt%的范围内,细胞的rgr均高于80%,为0-1级,说明本发明多肽自组装网络材料在此浓度区间时无明显细胞毒性;由于本发明多肽自组装网络材料的使用浓度在此浓度范围内,说明本发明多肽自组装网络材料在使用时无细胞毒性。
其它编号的实施例有雷同的结果,在此不一一赘述。
实验六:多肽自组装网络材料的流变学分析
该实验使用流变仪进行分析。流变仪校准后,将充分混匀的终浓度为0.5wt%的多肽化合物溶液(启动自组装需要时间,没有充分自组装之前是溶液状态)缓慢地加入到流变仪的37℃帕尔贴面板上,缓慢降下夹具,使夹具与面板之间的间距达到500μm,使用1%的应力,上机检测约1h,随后将应力调整至500%,剪切10s后,将应力调回至1%,继续扫描0.5h,得到流变学数据,以no.1和no.2的多肽化合物为例,结果如图7所示。
图7表明,本发明的多肽化合物溶液在5min内迅速组装,储存模量g’迅速超过20pa且强度持续增加,其中no.2和no.1的多肽化合物分别在700s和1500s时储存模量g’达到100pa,呈水凝胶状。在持续成胶3600s后向其施加500倍的应力使其剪切稀化,no.2和no.1的多肽化合物的储存模量g’分别迅速下降至0.01pa左右和0.1pa,且储存模量g’在此应力下瞬间小于损耗模量g”,完成解组装。随后将应力恢复到剪切前的状态,本发明多肽化合物迅速恢复成水凝胶状,其储存模量g’重新回到100pa以上,说明本发明多肽化合物自组装形成的网络材料具有反复组装的特性,即:具有良好的剪切破坏后的自修复特性。
实验七:多肽自组装网络材料的组织修复实验
用6-8周的wistar大鼠建立大鼠皮肤创伤模型:在大鼠背部剪去直径约1cm的皮肤,形成全皮层创伤,用无菌纱布固定止血,对照组仅用无菌生理盐水清洁创面,实验组使用无菌生理盐水清创后,使用本发明多肽自组装网络材料(肽浓度为0.05wt%)皮下注射于创伤周围,进行为期12天的表面观察。以no.1多肽化合物为例,结果如图8所示。
图8可以看出,在注射后的第4、8、12天的三个时间点,创伤局部多点注射本发明多肽自组装网络材料的小鼠,创面恢复速度快,创面可以达到无血瘕愈合,组织弹性好不易出血。
其它编号的实施例有雷同的结果,在此不一一赘述。
该实验表明,本发明的多肽自组装网络材料可作为软骨、骨、皮肤、神经等组织的损伤与再生修复的治疗药物,使用时,在损伤或需要再生修复的组织周围采用注射的方式给予本发明多肽自组装网络材料。
综上所述,本发明多肽化合物在ph为中性条件下能够形成纳米纤维网络状结构,且兼具一定机械强度,能够结合细胞形成立体分布;其形成的三维网络结构(即多肽自组装网络材料)易于解组装,能够在不改变环境因素的条件下,实现细胞的解离;并且该多肽自组装网络材料支持细胞的3d扩增。
此外,本发明多肽化合物中不同的氨基酸替代会严重影响多肽的自组装能力及形成网络体系的储能模量,将本发明多肽化合物中的氨基酸进行随意替换,可能会影响自组装能力和形成网络体系的储能模量(见图7的流变学实验,no.1和no.2的多肽化合物氨基酸序列不同,流变学储能模量不同,自组装能力也不同)。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的内容。
- 还没有人留言评论。精彩留言会获得点赞!