一种高谷氨酸驴胶原活性肽的应用
1.本发明涉及一种高谷氨酸驴胶原活性肽的应用,属于功能产品开发技术领域。
背景技术:
2.人体的生长代谢与各种必需元素的存在息息相关,元素摄入的不足、过量或不平衡都会不同程度地引起机体生理功能的异常或发生疾病。近年来,包括硫酸亚铁、碳酸钙、和氯化锌在内的无机金属盐成为常见的元素补充剂。然而,这些无机金属补充剂往往会在碱性肠环境中形成不溶物,严重影响人体的吸收利用率。研究人员一直在探求副作用小、生物利用率高的钙、铁、锌等营养强化剂。继以乳酸亚铁、葡萄糖酸锌为例的第二代有机金属补铁剂之后,出现的第三代氨基酸金属元素补充剂,如甘氨酸亚铁。它们稳定性好、可以增加矿物质在肠中的溶解度,被认为可潜在的促进金属离子的吸收,提高其生物利用度。但是,这些氨基酸螯合物成本高昂,并且会引起脂肪氧化具有副作用,功效不够明显。与氨基酸相比,肽的生物效价和营养价值比单一氨基酸更高。肽可以通过细胞旁路通道转运到肠上皮细胞中,不需要消耗能量,更易被机体吸收。肽可作为金属离子的运载体,与金属离子形成螯合物,充当保护金属离子的作用,同时促进金属离子的吸收。金属肽螯合物可避免直接吸收无机离子对胃肠道造成的损伤,同时保持金属离子的生理活性,增强钙、铁、锌离子的生物利用度。
3.肽的金属结合活性会受到蛋白酶的种类、肽的分子量、氨基酸组成和特定氨基酸含量的影响。谷氨酸作为二元羧基酸性氨基酸,富有螯合基团,具有较强的金属螯合活性,且可以保护肝脏,改善智力发育,两者的反应比甘氨酸与金属离子的螯合反应更加复杂。葛重宇等采用全自动氨基酸分析仪分别测定了18家企业阿胶中17种氨基酸的含量,结果显示,不同企业阿胶中各种氨基酸的含量有一定的差异,但均以甘氨酸含量最高、脯氨酸次之;其中相对于甘氨酸,谷氨酸的含量为37%~42%(葛重宇,庞慧,李楠,郑洁,何昌隆,杨欢,沈玉萍.18家企业阿胶中氨基酸的含量分析与比较研究[j].中国药房,2017,28(01):122
‑
126.)。
[0004]
目前本领域现有技术中,对驴胶原肽生产加工仅仅是通过酶解和根据分子量大小进行超滤截留分离不同的肽段,即将胶原水解成小分子肽,以利于消化吸收,但所得肽含量低且功能性没有明显提高。专利cn 107904274 a提供了一种阿胶活性肽的制备方法,认为1000~2000da的肽发挥主要活性作用。但单纯的肽不具备补血功效,从中药配位学说的角度看,忽视了传统阿胶以混合膳食(如阿胶糕)的形式服用,其在消化过程中肽与金属离子的协同作用。
技术实现要素:
[0005]
针对目前存在的问题,本专利采用复合酶解和柱层析的方法,分离得到高谷氨酸驴胶原活性肽,氨基酸组成中,相对甘氨酸,谷氨酸的含量可达50~75%,肽含量达95~99%,具有强二价金属螯合能力,且在改善贫血、钙缺失、补充微量元素、提高机体免疫等方
面发挥优良功效。
[0006]
本发明的目的在于提供一种高谷氨酸驴胶原活性肽、高谷氨酸驴胶原活性肽的制备方法及由此制备得到的驴胶原多肽金属螯合物,及其在改善贫血、元素补充和提高机体免疫方面的应用。为提高驴产业的经济价值、产品营养利用率、资源合理利用和开发新型膳食补充剂方面提供理论支持。
[0007]
本发明提供了一种驴胶原蛋白肽,在所述驴胶原蛋白肽中,谷氨酸的含量为50~75%,相对分子质量为180~2000da的肽占总驴胶原蛋白肽含量的70%以上,肽含量为95~99%。
[0008]
本发明提供了制备权利要求1所述驴胶原蛋白肽的方法,包括以下步骤:
[0009]
(1)酶解消化:选用驴源性胶原蛋白,采用复合酶解技术进行体外消化,灭酶,离心后取上清液即为胶原多肽酶解液;
[0010]
(2)分离制备:将胶原多肽酶解液经过柱层析、洗脱液洗脱,分离出不同吸附强度的组分,收集吸附力强的肽组分,纳滤浓缩脱盐、冷冻干燥得到高谷氨酸驴胶原蛋白肽。
[0011]
在一种实施方式中,步骤(1)所述的驴源性胶原蛋白为阿胶、驴皮、驴骨、驴蹄中的一种或多种。
[0012]
在一种实施方式中,步骤(1)所述的复合酶解技术,为选用胃蛋白酶、胰蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶中的两种或多种进行酶解。
[0013]
在一种实施方式中,当所述酶为木瓜蛋白酶和碱性蛋白酶时,采用分步酶解:酶解底物的浓度为5~10%,先向酶解体系中加入终浓度为1000~5000u/ml的木瓜蛋白酶,保持ph为7.0~9.0、温度40~60℃,酶解2~4h,再向酶解体系中加入终浓度为500~3000u/ml的碱性蛋白酶,保持ph为9.0~12.0、温度40~60℃,酶解2~4h。
[0014]
在一种实施方式中,当所述酶为胃蛋白酶和胰蛋白酶时,采用分步酶解:酶解底物的浓度为5~10%,向酶解体系中加入终浓度为1000~3000u/ml的胃蛋白酶,保持ph为2.5~3.5、温度30~40℃,酶解2~4h,再向酶解体系中加入终浓度为300~600u/ml的胰蛋白酶,保持ph为6.0~8.0、温度30~40℃,酶解2~4h。
[0015]
在一种实施方式中,当所述酶为中性蛋白酶和碱性蛋白酶时,采用分步酶解:酶解底物的浓度为5~10%,向酶解体系中加入终浓度为1000~3000u/ml的中性蛋白酶,保持ph为6.0~8.0、温度40~50℃,酶解2~4h,再向酶解体系中加入终浓度为2000~4000u/ml的碱性蛋白酶,保持ph为8.0~10.0、温度40~50℃,酶解2~4h。
[0016]
在一种实施方式中,步骤(1)所述的灭酶温度为90~100℃,灭酶时间3~15min;所述的离心转速为6000~10000r/min,离心时间为1~30min。
[0017]
在一种实施方式中,步骤(2)所述的柱层析,利用固定化金属亲和层析,介质基础包括琼脂糖、壳聚糖、葡聚糖。
[0018]
在一种实施方式中,使用40%~80%的二甲基亚砜为洗涤剂,环氧氯丙烷为活化剂,活化温度为30~60℃,活化时间2~4h;亚氨基二乙酸为接枝配基,接枝温度50~70℃,时间8~16h。
[0019]
在一种实施方式中,步骤(2)中所述分离出不同吸附强度的组分,收集吸附力强的肽组分具体为:先用缓冲液a洗脱至基线平稳,然后用缓冲液b(0.02mol/l磷酸氢二钠、0.05mol/l nacl)洗脱强亲和能力的部分,即为吸附力强的肽组分。
[0020]
在一种实施方式中,所述缓冲液a包含0.05
‑
0.1mol/l乙酸钠,0.05
‑
0.1mol/l nacl。
[0021]
在一种实施方式中,所述缓冲液b包含0.02
‑
0.1mol/l磷酸氢二钠、0.05
‑
0.1mol/l nacl。
[0022]
本发明提供了利用所述驴胶原肽制备得到的驴胶原肽金属螯合物,将驴胶原肽与金属离子螯合得到驴胶原肽金属螯合物。
[0023]
本发明提供了制备所述驴胶原肽金属螯合物的方法,调节胶原肽液的ph为5.0~7.0,胶原肽与金属离子的质量比为1:1~4:1,温度为30~60℃,螯合反应30~90min,过滤取上清液后冷冻干燥,即得驴胶原肽金属螯合物。
[0024]
在一种实施方式中,所述金属离子为铁、钙、锌中的一种或多种。
[0025]
本发明提供了所述驴胶原肽、或权利要求5所述驴胶原肽金属螯合物、或含有驴胶原肽金属螯合物的产品在改善机体免疫、缺铁性贫血中的应用。
[0026]
在一种实施方式中,产品可用于包括药物、药物组合物或药物辅料。
[0027]
在一种实施方式中,所述药物或药物组合物还包含微囊、微球、纳米粒以及脂质体,所述药用辅料包含赋形剂以及附加剂。
[0028]
在一种实施方式中,所述产品包括但不限于食品、保健品饮品、肠内营养制剂、膳食补充剂、兽药或者饲料添加剂。
[0029]
本发明的有益效果:本发明所提供的高谷氨酸驴胶原活性肽,通过氨基酸组成分析,相对甘氨酸,谷氨酸的含量达45%~75%,分子质量集中分布在180~2000da,具有强二价金属离子螯合能力,与金属离子螯合制备得到的驴胶原肽金属螯合物可以有效改善缺铁性贫血症状、对机体的免疫功能有显著提升,可用于开发新型膳食补充剂,为提高驴产业的经济价值、产品营养利用率、资源合理利用和开发新型膳食补充剂方面提供理论支持,可应用于药品、食品及保健品开发方面。
附图说明
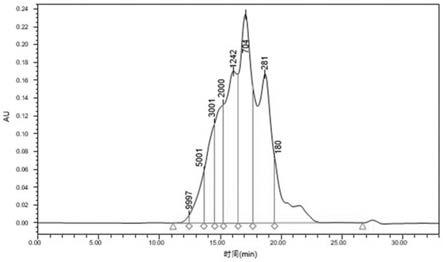
[0030]
图1为高谷氨酸阿胶活性肽的分子量分布图;
[0031]
图2为高谷氨酸阿胶肽及肽铁螯合物红外光谱图;
[0032]
图3为不同浓度亚铁离子与高谷氨酸阿胶肽作用后的荧光光谱图。
具体实施方式
[0033]
洗脱时所用的缓冲液a:0.05mol/l乙酸钠,0.05mol/l nacl;
[0034]
缓冲液b:0.02mol/l磷酸氢二钠、0.05mol/l nacl。
[0035]
实施例1
[0036]
1、高谷氨酸驴胶原肽i的制备与应用
[0037]
(1)将阿胶粉与超纯水混合均匀至底物浓度为5%,将溶液在37℃消化2min,盐酸调节ph至3.0,加入胃蛋白酶液(加酶量2000u/ml),于台式恒温振荡器中37℃,200rpm恒温振荡2h,中间检测ph,保持ph为3.0。用naoh调节ph至7.0,加入胰蛋白酶液(加酶量为500u/ml),于台式恒温振荡器中37℃、200rpm恒温振荡2h。结束后95℃灭酶15min,冷却至室温,离心机6000r/min离心30min,取上清液得阿胶多肽酶解液。
[0038]
(2)用超纯水多次冲洗琼脂糖微球,依次加入20%、40%、60%的二甲基亚砜对其清洗,将洗净后的介质转移至锥形瓶,加入60%的二甲基亚砜溶液和30%的环氧氯丙烷作为反应环境体系,加入naoh使其浓度为0.8mol/l。锥形瓶封口后置于40℃,160rpm的恒温空气浴摇床上,活化3.5h。活化后,将琼脂糖微球与亚氨基二乙酸质量比为1:0.6,在60℃下以150rpm的转速搅拌16h偶联。偶联完毕后填料装柱,超纯水流洗4个柱体积后用0.1mol/l的feso4溶液流洗6个柱体积,使填料充分吸附fe
2+
,用超纯水清洗至流出液中无fe
2+
检出,用缓冲液a(0.05mol/l乙酸钠,0.05mol/l nacl)平衡,控制流速1ml/min。阿胶多肽酶解液(10mg/ml)加到已平衡的亲和层析柱上,监测220nm处的吸光度。上样后用缓冲液a洗脱至基线平稳,然后用缓冲液b(0.02mol/l磷酸氢二钠、0.05mol/l nacl)洗脱强亲和能力的部分,得到a、b两个肽组分。采用三氯乙酸沉淀蛋白,吸收差法测定b组分(即高谷氨酸驴胶原肽i)的肽含量为97.6%,用高效液相色谱仪检测酸水解后的氨基酸组成分析,相对甘氨酸,其谷氨酸含量为52.71%。
[0039]
(3)调节a、b组分多肽液的ph为5.5,分别与fe
2+
、ca
2+
、zn
2+
溶液反应,肽与fe
2+
、ca
2+
、zn
2+
的质量比均为4:1,超声处理15min,37℃恒温振荡螯合30min后过滤取上清液,采用icp
‑
ms分别测得a组分铁螯合活性为6.3ug/mg,钙螯合活性为2.1ug/mg,锌螯合活性为3.4ug/mg;b组分(即高谷氨酸驴胶原肽i)铁螯合活性为23.6μg/mg,钙螯合活性为12.7ug/mg,锌螯合活性为14.5ug/mg。
[0040]
2、高谷氨酸驴胶原肽i分子量分布
[0041]
用高效液相色谱仪来测定其分子量分布。结果如图1和表1所示。
[0042]
表1高谷氨酸驴胶原肽i的相对分子量分布
[0043][0044]
由表1可知,高谷氨酸驴胶原肽i的相对分子量分布主要集中在180~2000da。经过亲和层析柱富集后,保留更多低分子量的肽,这种小分子肽能够与金属离子发生强螯合作用,更具有生物营养价值,并促进金属离子的吸收。
[0045]
3、高谷氨酸驴阿胶肽和高谷氨酸阿胶肽铁螯合物的初步鉴定
[0046]
(1)傅里叶变换红外光谱分析
[0047]
分别称取高谷氨酸阿胶肽和阿胶肽铁螯合物样品与干燥的kbr粉末以1:100于玛瑙研钵中,研磨混合均匀,压片,进行傅里叶红外光谱扫描,扫描范围为4000cm
‑1~400cm
‑1。
[0048]
结果如图2所示,高谷氨酸阿胶肽在3428.81cm
‑1处的高频吸收为酰胺基n
‑
h的伸缩振动峰;1654cm
‑1处为羰基c=o的伸缩振动峰,由于氨基的影响,c=o向低波数移动;1390cm
‑1处为羧基c
‑
o的伸缩振动吸收峰,1249cm
‑1和1085cm
‑1的弱吸收峰为c
‑
n的伸缩振动和c
‑
h的弯曲振动。与铁反应生成阿胶肽螯合铁后,一些主要吸收峰发生了明显位移,相对强度也有所变化。3428cm
‑1处吸收峰移动至3409cm
‑1处,表明加铁后酰胺基参与了螯合反应,增加了空间阻碍,破坏了原有的共轭体系,吸收峰向短波长移动。c=o伸缩振动由1654cm
‑1处移至1639cm
‑1较低波数处,表明羧基氧参与了螯合反应;1249cm
‑1和1085cm
‑1处的吸收峰消失,且1124cm
‑1处出现了新的较大吸收峰,说明与铁离子作用后,c
‑
n的伸缩振动和
n
‑
h的弯曲振动吸收发生了变化。由红外吸收结果说明,铁离子主要与阿胶肽的羧基氧和氨基氮原子发生了螯合反应,生成新的物质。
[0049]
(2)荧光光谱分析
[0050]
设定不同浓度梯度的fe
2+
溶液加至高谷氨酸阿胶肽(ep)溶液中,将两者混合均匀至肽的最终浓度为0.1mg/ml。设定荧光分光光度计激发波长335nm,发射波长365~500nm。
[0051]
结果如图3所示,向肽中添加fe
2+
溶液后,335nm激发处的荧光强度显著降低,随着fe
2+
浓度的升高,荧光强度仍不断下降,且最大荧光强度下的发射波长有红移趋势,表明阿胶肽中的发色团和铁离子之间发生相互作用,导致激发态能量变化,荧光强度发生改变。fe
2+
与肽螯合反应导致螯合物荧光猝灭,荧光强度减弱是多肽结构改变发生的典型标志。
[0052]
实施例2
[0053]
1、高谷氨酸驴胶原肽ii的制备与应用
[0054]
(1)将驴骨粉加超纯水混匀至底物浓度6%,调节ph值为7.0,加中性蛋白酶(加酶量为3000u/ml)于台式恒温振荡器中40℃,200rpm恒温振荡2h,中间检测ph,保持ph为7.0。用naoh调节ph至9.0,加入碱性蛋白酶(加酶量为2000u/ml),于台式恒温振荡器中45℃、200rpm恒温振荡2h。结束后90℃灭酶10min,冷却至室温,转速为8000r/min,离心20min,取上清液得驴骨胶原肽酶解液。
[0055]
(2)用超纯水多次冲洗琼脂糖微球,依次加入40%、60%的二甲基亚砜对其进行清洗,将洗净后的介质转移至锥形瓶,60%的二甲基亚砜溶液和30%的环氧氯丙烷作为反应环境体系,加入naoh使其浓度为0.8mol/l。锥形瓶封口后置于50℃,160rpm的恒温空气浴摇床上,活化3h。活化后,将琼脂糖微球与亚氨基二乙酸质量比为1:0.6,在50℃下以150rpm的转速搅拌12h偶联。偶联完毕后填料装柱,超纯水流洗4个柱体积后用0.1mol/l的feso4溶液流洗6个柱体积,使填料充分吸附fe
2+
,用超纯水清洗至流出液中无fe
2+
检出,用缓冲液a(0.05mol/l乙酸钠,0.05mol/l nacl)平衡,流速1ml/min。将驴骨胶原肽酶解液(10mg/ml)加到已平衡的亲和层析柱上,监测220nm处的吸光度。上样后用缓冲液a洗脱至基线平稳,然后用缓冲液b(0.02mol/l磷酸氢二钠、0.05mol/l nacl)洗脱强亲和能力的部分,得到a、b两个肽组分。采用三氯乙酸沉淀蛋白,吸收差法测定b组分(即高谷氨酸驴胶原肽ii)的肽含量为98.1%,用高效液相色谱仪检测酸水解后的氨基酸组成分析,相对甘氨酸,其谷氨酸含量为62.38%。
[0056]
(3)调节a、b组分多肽液的ph为6.0,分别与fe
2+
、ca
2+
、zn
2+
溶液反应,肽与fe
2+
、ca
2+
、zn
2+
的质量比均为3:1,超声处理15min,30℃恒温振荡螯合60min后过滤取上清液,采用icp
‑
ms分别测得a组分铁螯合活性为5.5ug/mg,钙螯合活性为1.9ug/mg,锌螯合活性为1.2ug/mg;b组分(即高谷氨酸驴胶原肽ii)铁螯合活性为27.4μg/mg,钙螯合活性为18.9ug/mg,锌螯合活性为17.5ug/mg。
[0057]
2、高谷氨酸驴胶原肽ii分子量分布
[0058]
用高效液相色谱仪来测定其分子量分布。结果如表2所示。
[0059]
表2高谷氨酸驴胶原肽ii的相对分子量分布
[0060][0061]
由表2可知,高谷氨酸驴胶原肽ii的相对分子量分布主要集中在180~2000da。经过亲和层析柱富集后,保留更多低分子量的肽,这种小分子肽能够与金属离子发生强螯合作用,更具有生物营养价值,并促进金属离子的吸收。
[0062]
实施例3
[0063]
1、高谷氨酸驴胶原肽iii的制备与应用
[0064]
(1)将干燥驴皮胶原粉与超纯水混合至底物浓度为8%,95℃烊化30min,降温至45℃,调节ph至7.5,再加入木瓜蛋白酶液(加酶量4000u/ml),于台式恒温振荡器中45℃,200rpm恒温振荡3h,中间检测ph,保持ph为7.5。用naoh调节ph至9.0,加入碱性蛋白酶液(加酶量为2000u/ml),于台式恒温振荡器中50℃、200rpm恒温振荡3h。结束后100℃灭酶5min,冷却至室温,转速为10000r/min,离心15min,取上清液得驴皮多肽酶解液。
[0065]
(2)用超纯水多次冲洗琼脂糖微球,加入60%的二甲基亚砜对其进行多次清洗,将洗净后的介质转移至锥形瓶,60%的二甲基亚砜溶液和30%的环氧氯丙烷作为反应环境体系,加入naoh使其浓度为0.8mol/l。锥形瓶封口后置于55℃,160rpm的恒温空气浴摇床上,活化2.5h。活化后,将琼脂糖微球与亚氨基二乙酸质量比为1:0.6,在65℃下以150rpm的转速搅拌8h偶联。偶联完毕后填料装柱,超纯水流洗4个柱体积后用0.1mol/l的feso4溶液流洗6个柱体积,使填料充分吸附fe
2+
,用超纯水清洗至流出液中无fe
2+
检出,用缓冲液a(0.05mol/l乙酸钠,0.05mol/l nacl)平衡,控制流速1ml/min。将驴皮胶原肽酶解液(10mg/ml)加到已平衡的亲和层析柱上,监测220nm处的吸光度。上样后用缓冲液a洗脱至基线平稳,然后用缓冲液b(0.02mol/l磷酸氢二钠、0.05mol/l nacl)洗脱强亲和能力的部分,得到a、b两个肽组分。采用三氯乙酸沉淀蛋白,吸收差法测定b组分(即高谷氨酸驴胶原肽ii)的肽含量为98.7%,用高效液相色谱仪检测酸水解后的氨基酸组成分析,相对甘氨酸,其谷氨酸含量为74.15%。
[0066]
(3)调节a、b组分多肽液的ph为6.5,分别与fe
2+
、ca
2+
、zn
2+
溶液反应,肽与fe
2+
、ca
2+
、zn
2+
的质量比均为2:1,超声处理15min,40℃恒温振荡螯合60min后过滤取上清液,采用icp
‑
ms分别测得a组分铁螯合活性为4.7ug/mg,钙螯合活性为0.9ug/mg,锌螯合活性为2.1ug/mg;b组分(高谷氨酸驴胶原肽iii)铁螯合活性为32.8μg/mg,钙螯合活性为24.6ug/mg,锌螯合活性为23.2ug/mg。
[0067]
2、高谷氨酸驴胶原肽iii分子量分布
[0068]
用高效液相色谱仪来测定其分子量分布。结果如表3所示。
[0069]
表3高谷氨酸驴胶原肽iii的相对分子量分布
[0070][0071]
由表2可知,高谷氨酸驴胶原肽ii的相对分子量分布主要集中在180~2000da。经过亲和层析柱富集后,保留更多低分子量的肽,这种小分子肽能够与金属离子发生强螯合
作用,更具有生物营养价值,并促进金属离子的吸收。
[0072]
3、高谷氨酸驴胶原肽相对氨基酸含量分析比较
[0073]
表4高谷氨酸驴胶原肽i、ii、iii的相对氨基酸含量分析
[0074][0075]
氨基酸组成对肽的功能有重要影响。驴胶原蛋白中氨基酸含量依次为甘氨酸(gly)、脯氨酸(pro)、丙氨酸(ala)、谷氨酸(glu),经过酶解、分离制备后,谷氨酸(glu)含量明显提高,而脯氨酸(pro)、丙氨酸(ala)含量明显下降。谷氨酸作为二元羧基酸性氨基酸,富有螯合基团,具有较强的金属螯合活性,通过酶解消化和亲和柱层析可富集暴露更多的谷氨酸,同时增强肽的金属螯合能力,提高多肽的功能活性。
[0076]
实验例一:本发明高谷氨酸驴胶原肽铁螯合物对小鼠缺铁性贫血症状的改善
[0077]
将实施例1、2、3中制备得到的高谷氨酸驴胶原肽,分别与亚铁离子进行螯合反应,得到高谷氨酸驴胶原肽铁螯合物i、ii、iii,与传统补铁剂硫酸亚铁比较,试验方法及结果如下:
[0078]
实验方法:初断乳小鼠进驻后,按体重随机分为1组正常对照组和6组贫血造模组,
正常组饲喂正常饲料(铁含量45mg/kg),造模组饲喂低铁饲料(铁含量10mg/kg),造模4周后,测定血红蛋白hb含量,以hb<100g/l为造模成功。造模成功的ida模型小鼠按血红蛋白值随机分为6组,每组10只,分别为正常组、模型组、硫酸亚铁组、阿胶组和高谷氨酸驴胶原肽铁螯合物(i组、ii组、iii组),其中各实验组加铁量一致。造模成功后第2天,各组分别同一时间灌胃给药,每天灌胃1次,灌胃体积为0.2ml/40g.bw,对照组小鼠灌胃同等体积的生理盐水。连续给药4周后,确定血象指标回升后,禁食12h,采集血液分析其血象值及生化指标。
[0079]
实验结果:本发明高谷氨酸驴胶原肽铁螯合物对缺铁性贫血小鼠血象值的影响见表5。
[0080]
表5高谷氨酸驴胶原肽铁螯合物对缺铁性贫血小鼠血象指标的影响
[0081][0082]
由表5可知,缺铁性贫血模型组与正常组小鼠相比,红细胞含量、血红蛋白含量、红细胞压积、平均红细胞体积存在显著性差异(p<0.05)。不同形式补铁剂连续灌胃给药4周后,高谷氨酸驴胶原肽铁螯合物i、ii、iii组与贫血模型组相比可明显提高贫血小鼠血液中红细胞含量、血红蛋白含量、红细胞压积、平均红细胞体积。与硫酸亚铁组相比,给药可明显提高小鼠血液中的红细胞含量和血红蛋白值,且ii组和iii组与正常组相比无差异。这可说明高谷氨酸驴胶原肽铁螯合物对缺铁性贫血具有改善作用。
[0083]
实验例二:本发明高谷氨酸驴胶原肽铁螯合物对贫血小鼠机体免疫的影响
[0084]
为探究本发明制备的高谷氨酸驴胶原肽铁螯合物对贫血小鼠机体免疫的影响,将其与硫酸亚铁进行比较,分别检测各组小鼠的t淋巴细胞表达水平。
[0085]
实验结果:本发明高谷氨酸驴胶原肽铁螯合物对贫血小鼠机体免疫的影响见表6。
[0086]
表6高谷氨酸驴胶原肽铁螯合物对贫血小鼠t淋巴细胞水平的影响
[0087][0088]
t淋巴类细胞为免疫系统重要部分,cd
4+
t细胞为诱导性细胞,cd
8+
t细胞为细胞毒性细胞。如表中所示,给药不同铁补充后,各给药组的cd
4+
t细胞比例升高,cd
8+
t细胞比例下降,同等剂量水平下,高谷氨酸驴胶原肽铁螯合物组与硫酸亚铁组有显著性差异,且iii组t细胞的比例与正常组接近。说明给予高谷氨酸驴胶原肽铁螯合物利于其免疫功能的恢复,以改善贫血症状,补充铁剂能升高cd
4+
t细胞的比例,并降低cd
8+
t细胞比例,增强机体免疫功能。
[0089]
通过动物实验探究高谷氨酸驴胶原肽铁螯合物对贫血小鼠的血液学状态改善和机体免疫的影响,表明本发明由高谷氨酸驴胶原活性肽制备得到的高谷氨酸驴胶原肽铁螯合物能使贫血小鼠血液学指标恢复到正常水平,比传统的铁补充剂硫酸亚铁表现出更好的效果;在改善贫血状态的同时利于恢复集体的免疫功能,对机体免疫产生积极的影响,具有提高机体免疫的功效,可应用于食品、药品及保健品的生产中。
[0090]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1