脱氢表雄酮衍生物、具有抗黄病毒活性的药物及其应用
1.本发明涉及药物化学技术领域,尤其涉及一种脱氢表雄酮衍生物、具有抗黄病毒活性的药物及其应用。
背景技术:
2.黄病毒科(flaviviridae)黄病毒属(flavivirus)为有包膜的单股正链rna病毒,该类病毒通过吸血的节肢动物(蚊、蜱、白蛉等)传播而引起感染。黄病毒属病毒包括约70种病毒,其中大多数为人兽共患传染病的病原体,如日本乙型脑炎病毒(japanese encephalitis virus,jev)、西尼罗病毒(west nile virus,wnv)、黄热病毒(yellow fever virus,yfv)、1
‑
4型登革病毒(dengue virus,denv)和寨卡病毒(zika virus,zikv)等。
3.黄病毒属病毒感染可引起发烧、头痛、关节痛、结膜炎和皮疹瘙痒等症状,严重时还会引起感染者死亡。近年来,随着全球气候的变化,黄病毒属病毒的分布在全球范围内逐步扩大,同时,由于病毒基因某些位点的突变使其适应新的传播媒介,黄病毒属病毒的感染呈现出进一步蔓延的趋势。而且目前缺乏针对黄病毒属病毒的疫苗,研发抗黄病毒属病毒感染药物的需求日益迫切。
4.在分析已知药物化学结构的基础上,设计合成药物的衍生物是现代新药研究的出发点。改造天然化合物投入少、周期短、效益高,有利于构建大量的可供活性筛选的化合物库,为抗病毒药物的研发奠定了基础。脱氢表雄酮(dhea)是睾酮生物合成中的一个中间产物,一种类固醇和性激素前体。脱氢表雄酮可以影响脂肪的形成,调节nadph,调节白介素和干扰素的产生,结合内皮细胞膜受体,此外还对多种病毒具有拮抗作用。
5.申请号为cn99813658.1的发明专利公开了一种17
‑
酮甾类化合物及其衍生物、代谢产物和前体在治疗丙型肝炎病毒和其他披膜病毒中的应用。申请号为cn201711426066.7的发明专利公开了一种去氢表雄酮
‑6‑
葡萄糖苷衍生物及其作为抗丙型肝炎病毒药物的应用。
6.但是,上述化合物或者衍生物的抗黄病毒活性功效有限,同时,还可能存在细胞毒性大、水溶性欠佳,致使其抗病毒活性功能进一步受限的技术缺陷。鉴于此,有必要设计一种改进的脱氢表雄酮衍生物、具有抗黄病毒活性的药物及其应用,以解决上述问题。
技术实现要素:
7.本发明的目的在于提供一种脱氢表雄酮衍生物、具有抗黄病毒活性的药物及其应用。
8.为实现上述发明目的,本发明提供了一种脱氢表雄酮衍生物,所述脱氢表雄酮衍生物具备抗黄病毒科病毒活性的功能,其结构式为:
[0009][0010]
其中,r1为苯基;r2为氢原子。
[0011]
作为本发明的进一步改进,所述脱氢表雄酮衍生物的结构式为:
[0012][0013]
为实现上述发明目的,本发明还提供了一种具有抗黄病毒活性的药物,以上述脱氢表雄酮衍生物作为活性成分,具备抗黄病毒科病毒活性的功能。
[0014]
作为本发明的进一步改进,所述具有抗黄病毒活性的药物还包括药学上可接受的载体、稀释剂或赋形剂。
[0015]
作为本发明的进一步改进,所述具有抗黄病毒活性的药物的剂型为经胃肠道给药剂型;所述经胃肠道给药剂型包括但不限于为散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂中的一种。
[0016]
作为本发明的进一步改进,所述具有抗黄病毒活性的药物的剂型为非经胃肠道给药剂型;所述非经胃肠道给药剂型包括但不限于为注射给药剂型、呼吸道给药剂型、滴鼻剂、皮肤给药剂型、黏膜给药剂型、腔道给药剂型中的一种。
[0017]
作为本发明的进一步改进,所述黄病毒科病毒包括黄病毒属病毒。
[0018]
作为本发明的进一步改进,所述黄病毒属病毒包括但不限于为乙型脑炎病毒、寨卡病毒、登革热病毒中的一种。
[0019]
为实现上述发明目的,本发明还提供了上述脱氢表雄酮衍生物,或者上述具有抗黄病毒活性的药物在制备黄病毒抑制剂或黄病毒病治疗药物中的应用。
[0020]
为实现上述发明目的,本发明还提供了一种抑制黄病毒科病毒活性的方法。包含有效剂量的上述脱氢表雄酮衍生物,或者将包含有效剂量的上述具有抗黄病毒活性的药物的化学药物与感染黄病毒科病毒的宿主进行接触,用以抑制黄病毒科病毒在宿主细胞中的翻译阶段,显著改善黄病毒感染导致的正常细胞病变。
[0021]
本发明的有益效果是:
[0022]
1、本发明提供的脱氢表雄酮衍生物,具备优异的抗黄病毒活性的功效。体外实验
测试表明,其在对细胞无毒性作用的浓度下,能够显著改善黄病毒感染导致的正常细胞病变。此外,该脱氢表雄酮衍生物对乙型脑炎病毒的抑制ic
50
值为3.056μm,对寨卡病毒的抑制ic
50
值为5.436μm,对登革病毒的抑制ic
50
值为2.603μm。体内实验结果表明,通过建立感染日本乙型脑炎病毒的小鼠动物模型,对用药治疗后小鼠的存活率和临床症状进行分析,同时以健康小鼠、感染日本乙型脑炎病毒后未给药治疗的小鼠作为参比,通过数据统计分析,在存活率方面,脱氢表雄酮衍生物对日本乙型脑炎病毒等黄病毒科病毒感染有一定的治疗效果,为临床用药提供了新的选择;将该脱氢表雄酮衍生物引入抑制黄病毒的应用中,具有重大的现实意义,有望被用于制备新型抗黄病毒药物。
[0023]
2、本发明提供的脱氢表雄酮衍生物,在抑制黄病毒方面具有优良的功效,其可单独或与其它抗黄病毒药物组合后,用于制备黄病毒抑制剂或黄病毒病治疗药物,具备巨大的应用前景。
[0024]
3、本发明提供的脱氢表雄酮衍生物,以脱氢表雄酮为母体,在脱氢表雄酮母体的17位点进行改造,从构效关系角度引入不同的基团,相比于未改造的脱氢表雄酮或者在其他位点改造的脱氢表雄酮衍生物,本发明借助于其改造后的理化特性和新引入的惰性负电性的功能基团(由碳氮双键连接带负电性的苯基构建而成),使得改造后的脱氢表雄酮衍生物具备结构新颖,水溶性好和细胞毒性小的优点,由此显著提升其抗黄病毒活性的功效,因此,相比于未改造的脱氢表雄酮或者在其他保守位点改造的脱氢表雄酮衍生物,其具备更为优异的抗黄病毒活性的功效;其发挥抗黄病毒活性的作用机理在于:黄病毒进入宿主细胞后,衍生物在病毒翻译前或者翻译阶段发挥抗病毒作用,但在病毒复制阶段无抑制作用,表明衍生物在黄病毒进入宿主细胞后发挥抗病毒作用。
附图说明
[0025]
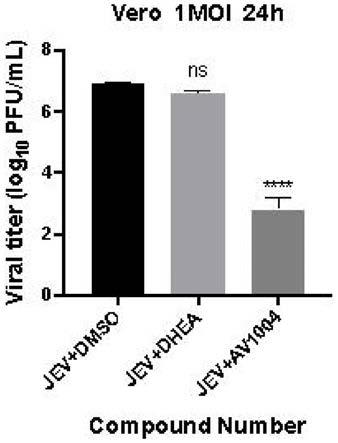
图1为本发明提供的脱氢表雄酮及衍生物体外抑制日本乙型脑炎病毒的对比结果。
[0026]
图2为本发明提供的脱氢表雄酮衍生物对细胞毒性作用的cc
50
的测定。
[0027]
图3为本发明提供的脱氢表雄酮衍生物体外抑制日本乙型脑炎病毒的效果(图3中a为不同药物浓度抑制实验;图3中b为根据剂量依赖性实验计算出的药物对日本乙型脑炎病毒ic
50
数值)。
[0028]
图4为本发明提供的脱氢表雄酮衍生物体外抑制寨卡病毒的效果(图4中a为不同药物浓度抑制实验;图4中b为根据剂量依赖性实验计算出的药物对寨卡病毒ic
50
数值)。
[0029]
图5为本发明提供的脱氢表雄酮衍生物体外抑制登革病毒的效果(图5中a为不同药物浓度抑制实验;图5中b为根据剂量依赖性实验计算出的药物对登革病毒ic
50
数值)。
[0030]
图6为本发明提供的脱氢表雄酮衍生物降低jev引起的死亡率。
[0031]
图7为本发明提供的脱氢表雄酮衍生物的病毒吸附实验。
[0032]
图8为本发明提供的脱氢表雄酮衍生物的病毒入侵实验。
[0033]
图9为本发明提供的脱氢表雄酮衍生物的复制子实验。
[0034]
图10为本发明提供的脱氢表雄酮衍生物的chx实验。
具体实施方式
[0035]
为了使本发明的目的、技术方案和优点更加清楚,下面结合附图和具体实施例对本发明进行详细描述。
[0036]
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
[0037]
另外,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0038]
实验材料:vero细胞(非洲绿猴肾细胞);bhk
‑
21细胞(乳仓鼠肾细胞);hela细胞(人子宫颈癌细胞);脱氢表雄酮衍生物;日本乙型脑炎病毒(genbank:u47032.1);寨卡病毒(genbank:kj776791);登革病毒(denv type 2,genbank:af038403.1)。
[0039]
实施例1
[0040]
本发明实施例1提供了一种脱氢表雄酮衍生物,记为av1004,其制备路线为:在脱氢表雄酮母体的17位点进行改造,从构效关系角度引入新的基团,其改造的位点以及结构式变化如下式所示:
[0041][0042]
对比例1
[0043]
对比例1提供了一种未经改造的脱氢表雄酮(dhea)。
[0044]
对比例2
[0045]
对比例2为添加二甲基亚砜(dmso)的空白对比例。
[0046]
进行抗黄病毒活性功能测试:
[0047]
一、对实施例1提供的脱氢表雄酮衍生物(av1004)、对比例1提供的脱氢表雄酮(dhea)以及对比例2提供的二甲基亚砜(dmso)空白对照组进行体外抑制日本乙型脑炎病毒的验证,实验方法如下:
[0048]
s1,取生长状态良好的vero细胞进行消化传代,用细胞生长液调整细胞密度为2
×
105/ml,接种于24孔板,每孔500μl,置于37℃、5%co2培养箱培养14h。
[0049]
s2,培养14h后,吸弃上清,将较低浓度的10μm实施例1的脱氢表雄酮衍生物av1004、对比例1的脱氢表雄酮以及对比例2的dmso分成三组,分别加入到对应的细胞孔中,并在37℃细胞培养箱中处理1小时。
[0050]
s3,每孔加入日本乙型脑炎病毒(jev病毒)(moi=1),置于37℃、5%co2培养箱感染1小时。
[0051]
s4,吸弃上清,用无血清dmem洗涤3次,再将含有不同化合物的维持培养基加入到细胞孔中,继续培养24小时。
[0052]
s5,培养24小时后,收取细胞上清,并冻存在
‑
80℃冰箱中。
[0053]
s6,通过噬斑实验检测上述培养24小时后细胞上清子代病毒滴度。
[0054]
验证结果如图1所示,实施例1的脱氢表雄酮衍生物av1004处理vero细胞24h后,细胞上清中的子代病毒滴度与对比例1的脱氢表雄酮处理组相比明显下降,说明在化合物较低浓度下,实施例1的脱氢表雄酮衍生物av1004比对比例1的脱氢表雄酮有更强的抗黄病毒功能。从图1中还可以看出,对比例1的脱氢表雄酮衍生物av1004的子代病毒滴度低于对比例2的dmso空白对照组,表明未改造处理的脱氢表雄酮抗黄病毒的功能较弱。
[0055]
二、实施例1提供的脱氢表雄酮衍生物(av1004)对细胞活性的检测,实验方法如下:
[0056]
s1,取生长状态良好的vero细胞进行消化传代,用细胞生长液调整细胞密度为3
×
104/ml,接种于96孔板,每孔100μl,置于37℃、5%co2培养箱培养14h;
[0057]
s2,14h后,取出96孔板,弃去孔中培养基,用无菌pbs清洗三次;
[0058]
s3,将脱氢表雄酮衍生物(av1004)用细胞维持液稀释成200μm、100μm、50μm、10μm、5μm、2μm、1μm和0.1μm,然后依次加入到vero细胞中。
[0059]
s4,48h后,用celltiter
‑
one solution assay试剂盒进行细胞活力检测。将96孔板在室温下静置30min,把100μl的celltiter
‑
glo试剂添加到每个孔中,并在振荡器上搅拌2分钟,然后将细胞在室温下避光孵育10分钟。最后用多泳道荧光读值器记录发光信号。
[0060]
检测结果:
[0061]
测定细胞存活率能反应化合物对细胞的毒性作用,根据公式计算出细胞存活率(%)=经过化合物处理的细胞发光值平均值/细胞对照组发光值平均值。
[0062]
检测结果如图2所示,实施例1提供的脱氢表雄酮衍生物av1004对vero细胞的毒性作用较小,其cc
50
大于100μm。
[0063]
三、噬斑减少实验检测脱氢表雄酮衍生物(av1004)抑制病毒感染效果
[0064]
1、确认脱氢表雄酮衍生物av1004对jev病毒的抑制作用,具体步骤如下:
[0065]
p11,用胰酶消化vero细胞,并进行细胞计数,24孔板每孔加入细胞1.0
×
105个。
[0066]
p12,培养14h后,吸弃上清,将稀释好的实施例1的av1004和对比例2的dmso(20μm、10μm、5μm、2μm以及1μm)分别加入到对应的细胞孔中,并在37℃细胞培养箱中处理1小时。
[0067]
p13,每孔加入jev病毒(moi=1),置于37℃、5%co2培养箱感染1小时。
[0068]
p14,吸弃上清,用pbs洗涤3次,再将含有药物的维持培养基加入到细胞孔中,继续培养24小时。
[0069]
p15,培养24小时后,收取细胞上清,并冻存在
‑
80℃冰箱中。
[0070]
p16,通过噬斑实验检测上述培养24小时后细胞上清子代病毒滴度。
[0071]
结果如图3中的a所示,将浓度梯度的化合物处理vero细胞24h后,相比于对比例2,实施例1中的细胞上清中的子代病毒滴度明显下降。
[0072]
2、确认脱氢表雄酮衍生物av1004对zikv病毒的抑制作用,具体步骤如下:
[0073]
p21,用胰酶消化vero细胞,并进行细胞计数,24孔板每孔加入细胞1.0
×
105个。
[0074]
p22,培养14h后,吸弃上清,将稀释好的实施例1的av1004和对比例2的dmso(20μm、10μm、5μm、2μm以及1μm)加入到对应的细胞孔中,并在37℃细胞培养箱中处理1小时。
[0075]
p23,每孔加入zikv病毒(moi=1),置于37℃、5%co2培养箱感染1小时。
[0076]
p24,吸弃上清,用pbs洗涤3次,再将含有药物的维持培养基加入到细胞孔中,继续培养24小时。
[0077]
p25,培养24小时后,收取细胞上清,并冻存在
‑
80℃冰箱中。
[0078]
p26,通过噬斑实验检测上述培养24小时后细胞上清子代病毒滴度;结果如图4中的a所示,将浓度梯度的化合物处理vero细胞24h后,相比于对比例2,实施例1中的细胞上清中的子代病毒滴度明显下降。
[0079]
3、确认脱氢表雄酮衍生物av1004对denv病毒的抑制作用,具体步骤如下:
[0080]
p31,用胰酶消化vero细胞,并进行细胞计数,24孔板每孔加入细胞1.0
×
105个。
[0081]
p32,培养14h后,吸弃上清,将稀释好的实施例1的av1004和对比例2的dmso(20μm、10μm、5μm、2μm以及1μm)加入到对应的细胞孔中,并在37℃细胞培养箱中处理1小时。
[0082]
p33,每孔加入denv病毒(moi=1),置于37℃、5%co2培养箱感染1小时。
[0083]
p34,吸弃上清,用pbs洗涤3次,再将含有药物的维持培养基加入到细胞孔中,继续培养24小时。
[0084]
p35,培养24小时后,收取细胞上清,并冻存在
‑
80℃冰箱中。
[0085]
p36,通过噬斑实验检测上述培养24小时后细胞上清子代病毒滴度;结果如图5中的a所示,将浓度梯度的化合物处理vero细胞24h后,相比于对比例2,实施例1中的细胞上清中的子代病毒滴度明显下降。
[0086]
上述三组处理组结果显示,实施例1提供的脱氢表雄酮衍生物av1004能有效抑制黄病毒感染。
[0087]
半最大效应浓度(ic
50
)测试的实验结果:
[0088]
半最大效应浓度(ic
50
)能反应脱氢表雄酮衍生物av1004对病毒的抑制效果,即能达到50%最大生物效应(抑制病毒)对应的有效浓度。可以根据药物剂量依赖性实验数据计算得出ic
50
数值。
[0089]
从图3中的b,图4中的b和图5中的b的ic
50
曲线图可以看出,实施例1提供的脱氢表雄酮衍生物av1004对日本乙型脑炎病毒的抑制ic
50
值为3.056μm,对寨卡病毒的抑制ic
50
值为5.436μm,对登革病毒的抑制ic
50
值为2.603μm。
[0090]
注意:本发明中,所述噬斑实验的具体做法为:
[0091]
r1,将bhk
‑
21细胞分至24孔板中,密度为2.0
×
105个/ml。
[0092]
r2,14h后,准备噬斑实验。用无血清dmem洗涤两遍,将样品做10倍梯度稀释,然后每孔加入200μl样品感染,每个浓度级做两孔重复,置于37℃、5%co2培养箱感染1小时。
[0093]
r3,感染完成后,吸弃上清,用无血清dmem洗一次,每孔加入1ml含1.0%甲基纤维素和2%fbs的培养基,37℃培养,勿移动。
[0094]
r4,培养3天后,取出细胞板,吸弃细胞覆盖物,加入甲醛溶液,固定细胞12h。
[0095]
r5,吸弃甲醛溶液,加入含0.1%的结晶紫染色液,处理细胞4h。
[0096]
r6,回收结晶紫染色液,用自来水冲洗细胞板,并在烘箱中烘干。随后拍照并计噬斑个数。
[0097]
四、脱氢表雄酮衍生物av1004对感染日本乙型脑炎病毒的小鼠的治疗效果评价,具体实验步骤:
[0098]
a1,六周龄c57bl/6雌鼠分为四组:dmso组(对比例2,10只)、脱氢表雄酮衍生物组(实施例1,10只)、jev+dmso组(p3株感染组,10只)、jev+脱氢表雄酮衍生物组(p3株感染治疗组,10只)。
[0099]
a2,小鼠腹腔注射105pfu乙脑病毒,对照组小鼠腹腔注射同体积的dmem培养基。在感染病毒后1h,小鼠灌胃35mg/kg的衍生物,随后一日一次灌胃六周龄小鼠。动物实验持续23天,每天称量存活小鼠体重,并记录其行为表现和死亡情况。
[0100]
实验结果:
[0101]
检测脱氢表雄酮衍生物av1004对jev感染小鼠存活率的影响:攻毒实验持续至感染后23天,存活小鼠基本无明显的神经症状。由图6可以看出,在感染6~13天,jev+dmso组死亡数量急剧上升,直到第14天才未出现死亡小鼠,最终死亡率达到90%。而jev+脱氢表雄酮衍生物组小鼠死亡数量明显少于jev组,最终死亡率为60%,说明脱氢表雄酮衍生物可有效降低jev感染引起的小鼠死亡。对比例2的dmso组与实施例1的脱氢表雄酮衍生物组未见任何死亡,说明衍生物对小鼠的健康无影响。
[0102]
五、本发明提供的脱氢表雄酮衍生物(av1004)抗黄病毒的具体机理的验证和过程分析如下:
[0103]
p51、进行病毒吸附实验,步骤如下:
[0104]
1)细胞板中单层vero细胞长到80%时,dmem清洗细胞,换液加入含有20μm衍生物的培养基或等体积dmso的培养基,在37℃、5%co2培养箱孵育1小时。
[0105]
2)每孔加入jev病毒(moi=5),置于4℃冰箱孵育1小时。用dmem清洗细胞三次,收取细胞样品进行后续检测。
[0106]
如图7所示的病毒吸附实验数据表明,该脱氢表雄酮衍生物在病毒吸附阶段无抑制作用。
[0107]
p52、进行病毒入侵实验,步骤如下:
[0108]
1)细胞板中单层vero细胞长到80%时,dmem清洗细胞,换液加入含有20μm衍生物的培养基或等体积dmso的培养基,在37℃、5%co2培养箱孵育1小时。
[0109]
2)每孔加入jev病毒(moi=5),置于4℃冰箱孵育1小时。用dmem清洗细胞三次。
[0110]
3)换上新的培养基,将细胞板放到在37℃、5%co2培养箱孵育1小时,再收取细胞样品进行后续检测。
[0111]
如图8所示的病毒入侵实验数据表明,该脱氢表雄酮衍生物在病毒入侵阶段无抑制作用。
[0112]
p53、进行复制子实验,步骤如下:
[0113]
1)为确认衍生物在jev的复制阶段是否有效,我们采用复制子来定量评估其抑制作用。使用t7 mmessage mmachine试剂盒(invitrogen)根据线性化的jev复制子合成体外转录本。
[0114]
2)hela细胞长至80%时,细胞转染,并将20μm衍生物添加到培养基中培养24h。收获细胞,并使用rluc测定系统(promega)测量荧光素酶活性。
[0115]
如图9所示的复制子实验数据表明,该脱氢表雄酮衍生物在病毒复制阶段无抑制
作用。
[0116]
p54、进行chx实验,步骤如下:
[0117]
1)用胰酶消化vero细胞,并进行细胞计数,24孔板每孔加入细胞1.0
×
105个。
[0118]
2)培养14h后,吸弃上清,每孔加入jev病毒(moi=1),置于37℃、5%co2培养箱感染1小时。
[0119]
3)吸弃上清,用pbs洗涤3次,再将含有药物以及chx的维持培养基加入到细胞孔中,继续培养9小时。
[0120]
4)培养9小时后,收取细胞样品进,通过rt
‑
pcr检测不同处理组中病毒mrna的表达水平。
[0121]
如图10所示的chx实验数据表明,该脱氢表雄酮衍生物在病毒进入细胞后,病毒翻译前或者翻译阶段发挥抗病毒作用。
[0122]
综合上述实验验证结果表明,该脱氢表雄酮衍生物在病毒进入宿主细胞后发挥抗病毒作用。
[0123]
实施例2
[0124]
本发明实施例2提供了一种包含上述脱氢表雄酮衍生物(av1004)的具有抗黄病毒活性的药物,其以脱氢表雄酮衍生物(av1004)为有效活性成分,具备优异的抗黄病毒功能。该药物的剂型可以根据实际应用需要进行调整,在此不做限定。
[0125]
需要注意的是,本领域技术人员应当理解,本发明提供的具备抗黄病毒活性的脱氢表雄酮衍生物并不局限于实施例1中提供的衍生物av1004,还可以是其他构型的衍生物,均具备较好的抗黄病毒活性的功效,在此不进行穷举。
[0126]
综上所述,本发明提供了一种脱氢表雄酮衍生物、具有抗黄病毒活性的药物及其应用。该脱氢表雄酮衍生物在抑制黄病毒方面具有优良的功效,在对细胞无毒性作用的浓度下,能够显著改善黄病毒感染导致的正常细胞病变。该脱氢表雄酮衍生物或者包含其的具有抗黄病毒活性的药物可单独或与其它抗黄病毒药物组合后,用于制备黄病毒抑制剂或黄病毒病治疗药物,具备巨大的应用前景。
[0127]
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1