一种水虻抗菌肽Hidefensin1及应用
一种水虻抗菌肽hidefensin1及应用
技术领域
1.本发明涉及基因生物工程技术领域,具体涉及一种水虻抗菌肽hidefensin1及应用。
背景技术:
2.昆虫抗菌肽是当昆虫在受到意外损伤或病原菌感染时,由自身免疫所产生的一类抗菌活性物质,主要由脂肪体合成后释放到血淋巴中产生(梁英2014,rocha et al 2016)。抗菌肽具有很多潜在优势,如分子量较小(30
‑
60个氨基酸)、广谱抗菌作用、热稳定性好,且不产生耐药性等(wang g et al 2016)。因此可用于开发新型高效低毒肽类新药(lakshmaiah et al 2015),用作抗生素类药物的替代药物或与抗生素联用以达到抑菌效果。
3.近年来,因为多种因素导致的抗生素等药品滥用,由此产生的耐药性细菌问题成为全世界公共卫生领域的一大难题,越来越多的国家和地区开始严格控制抗生素等药物的使用(尹昆仑等2015),而研究新型安全稳定的抗菌物质也成为一大研究热点。
4.昆虫防御素最早由matuyama和natori及lambert等分别从麻蝇和丽蝇phormiaterranorae中分离获得(lambert j et al 1989)。随着研究的深入,国内外的专家和学者已在昆虫纲中发现了30多种防御素,这些昆虫纲包括双翅目、鞘翅目、膜翅目、毛翅目、半翅目和蜻蜓目等体内分离得到抗菌肽。这些抗菌肽具有多种良好的特性,如水溶性好、热稳定好、具有广谱抗菌活性、可抑制多种细菌、真菌、疟原虫、病毒及肿瘤细胞,但对正常的体细胞无(低)毒副作用等。
5.亮斑扁角水虻(hermetiaillucens l.,双翅目)暴露于多种病原菌生长的环境,如畜禽粪便、餐厨垃圾等废弃有机物,因此可能存在多种新型抗菌肽基因。目前化学合成与基因工程技术依然是生产抗菌肽的主要方法。经过分析亮斑扁角水虻基因组,可筛出新型的抗菌肽基因并进行抗菌肽制备。
6.因此,从亮斑扁角水虻中发掘新的抗菌肽进行深入研究,对医药、食品防腐剂、饲料添加剂和动植物病害生物防治等诸多领域具有重要的意义。为亮斑扁角水虻抗菌肽功能和作用机制研究提供了分子基础,并为抗菌肽在生物防治和医药中的应用提供理论依据。
技术实现要素:
7.本发明的一个目的在于提供了一种来源于亮斑扁角水虻的抗菌肽,所述的抗菌肽的序列为seq id no.3所示。
8.本发明的另一个目的在于提供了上述抗菌肽的抑菌作用。
9.为了达到上述目的,本发明采取以下技术措施:
10.申请人通过对亮斑扁角水虻武汉品系的基因组进行分析,获得了一种全新的抗菌肽hidefensin1,该抗菌肽的序列为seq id no.3所示;可利用本领域的常规方案,例如合成,原核或真核表达,来制备该抗菌肽;该抗菌肽的前肽为seq id no.2所示,包括信号肽。
11.编码seq id no.3所示蛋白或seq id no.2所示蛋白的基因也属于本发明的保护范围。
12.抗菌肽hidefensin1在制备细菌抑菌剂中的应用,所述的细菌包括金黄色葡萄球菌或大肠杆菌。
13.与现有技术相比,本发明具有以下优点:
14.1、通过对武汉亮斑扁角水虻基因组进行分析,得到全新的hidefensin1抗菌肽。
15.2、hidefensin1具有广谱抗菌活性,在医药、病害防治、饲料添加剂等方面有良好的应用前景。
16.3、新抗菌肽hidefensin1的制备方法,该方法简便,快速且成本低廉。
附图说明
17.图1为抗菌肽基因hidefensin1的pcr扩增电泳示意图;
18.泳道m:dl2000 dna marker;1:抗菌肽基因hidefensin1所扩增条带。
19.图2为pet32a
‑
hidefensin1的构建示意图;
20.图中def1为抗菌肽基因hidefensin1。
21.图3为重组大肠杆菌bl21(de3)
‑
pet32a
‑
hidefensin1的诱导表达及蛋白纯化示意图;
22.图3中a为15%sds
‑
page分析表达的重组蛋白:泳道1
‑
2分别是空载体诱导前、后表达样品;泳道3
‑
4分别是重组蛋白诱导前、后表达样品;m1是蛋白marker
‑
broad range protein ladder;
23.图3中b为15%sds
‑
page分析蛋白纯化结果:泳道1
‑
3分别是100mm、200mm、500mm咪唑溶液纯化洗脱相;泳道4是0.05mg/ml标准牛血清蛋白(bsa);m2是蛋白marker
‑
unstained protein molecular weight marker。
24.图4为trx
‑
hidefensin1融合蛋白的抑菌实验示意图;
25.图4中a为trx
‑
hidefensin1抑制大肠杆菌的结果,1:纯化的trx
‑
hidefensin1融合蛋白,2:纯化的标签蛋白trx(阴性对照),3:50μg/ml的抗生素ampicillin(阳性对照);
26.图4中b为trx
‑
hidefensin1抑制金黄色葡萄球菌的结果,1:纯化的trx
‑
hidefensin1融合蛋白,2:纯化的标签蛋白trx(阴性对照),3:50μg/ml的抗生素ampicillin(阳性对照)。
具体实施方式
27.下面结合具体实施例,进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规实验条件,《分子克隆实验手册》(第三版)【j.萨姆布鲁克等编著,2003,北京:科学出版社】中所述的条件进行,或按照制造厂商所建议的条件。
28.在本发明实施例中,是以大肠杆菌原核表达的方式来制备抗菌肽hidefensin1,本领域技术人员亦可采取其他本领域的常规方式,例如人工合成,其余的原核表达或真核表达方式来制备包含seq id no.3所示氨基酸的抗菌肽;
29.实施例1:
30.抗菌肽hidefensin1的表达:
31.一、抗菌肽基因hidefensin1的扩增
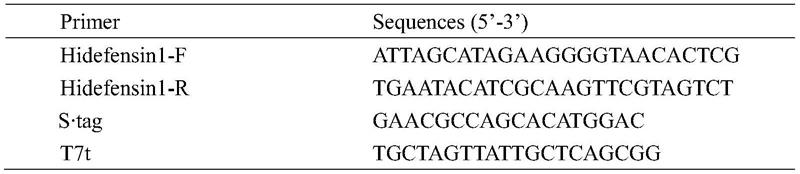
32.本实施例中所需引物
[0033][0034]
以公司合成hidefensin1基因序列(seq id no.1所示,为配合大肠杆菌的表达,seq id no.1所示序列为根据大肠杆菌的表达模式进行了密码子优化后的序列)为模板,以pcr引物进行pcr,扩增的体系和条件如下所示:
[0035]
pcr扩增的体系为:
[0036][0037][0038]
pcr反应参数为:95℃预变性5min;95℃变性30s,56℃退火30s,72℃延伸40s,30个循环;72℃延伸7
‑
10min。将反应后的产物取3
‑
5μl用1%琼脂糖凝胶电泳验证,电泳条件135v,40min。结果得到大小为250bp左右的条带(图1),该目的产物包含seq id no.1所示序列,翻译后的蛋白为seq id no.2所示。
[0039]
(3)pcr产物的回收与纯化
[0040]
pcr大量扩增后用1%的琼脂糖电泳回收凝胶,在紫外灯下进行切胶、用胶回收试剂盒(北京solarbio公司)进行dna凝胶回收,具体步骤详见凝胶回收试剂盒说明书。同时用1%的琼脂糖凝胶电泳检测回收情况。
[0041]
二、重组质粒pet32a
‑
hidefensin1的构建
[0042]
(1)目的片段和质粒pet32a双酶切
[0043]
运用内切酶xhoi和bamhi分别对目的基因hidefensin1及表达载体pet32a进行双酶切反应,其反应体系及条件如下:
[0044]
pcr产物双酶切体系(30μl):
[0045][0046]
质粒pet32a双酶切体系(20μl):
[0047][0048]
按上述各试剂的比例配制各50μl反应体系,混匀后,短暂离心,将反应体系置于37℃,反应30min,使之酶切完全,再于80℃加热5min失活内切酶,以免影响后续连接反应。双酶切产物要经过1%琼脂糖凝胶验证,再采用胶回收法纯化酶切产物。用nanodrop2000测其浓度及od
260/280
。
‑
20℃保存备用。
[0049]
(2)目的片段的连接与转化
[0050]
使用t4 dna连接酶对双酶切后的目的基因hidefensin1和质粒pet32a进行连接,在0.2ml ep管中进行反应,配制10μl反应体系,混匀后,短暂离心,将反应体系置于22℃,连接1.5h,再65℃,10min终止反应,热失活t4 dna连接酶。
[0051]
连接反应的体系为:
[0052][0053]
(3)大肠杆菌e.coli dh5α感受态制备及转化
[0054]
a.从
‑
20℃保存的dh5α甘油管中沾取少量菌液,在lb固体培养基上划线,37℃培养12h后,挑取单菌落于含5ml lb液体培养基进行37℃,180r/min,摇床过夜培养;
[0055]
b.将培养的菌种接种5ml于含50ml lb培养基的三角瓶中,37℃,200r/min培养至od600于0.3
‑
0.4之间,约需1.5h
‑
2.5h;
[0056]
c.将培养液置于冰上10min,使其冷却;
[0057]
d.按无菌要求进行操作,用灭菌的50ml离心管分装培养液,配平。然后4℃,5000r/min离心3min;
[0058]
e.倒掉上清,收集菌体,将50ml离心管倒置片刻,以利于管中的培养液流出而被吸
干,倒干净培养液对感受态细胞制作成功与否关系密切(培养液中的成分会减弱cacl2对膜的通透性,但防止因放置过久使菌体流出);
[0059]
f.将每50ml的初始培养液的菌体用10ml冰浴的0.1mol/l cacl2(一直冰浴放置)重悬菌体沉淀(用枪头将底部菌体吸吹打匀),然后冰上放10min,放置不宜过长和过短,确保放置10min;
[0060]
g.然后4℃,5000r/min离心3min收集菌体,离完心的离心管须置冰上;
[0061]
h.每50ml的初始培养液第二次用10ml冰浴的0.1mol/l cacl2重悬菌体,然后冰上放置30min,放置不宜过长和过短,确保放置30min;
[0062]
i.最后4℃,5000r/min离心3min收集菌体。
[0063]
j.第三次加2ml冰浴的cacl2溶液(按50ml培养液加2ml cacl2溶液,则100ml培养液加4ml cacl2溶液,用枪头将底部菌体吸吹打匀,用1.5ml无菌eb管分装,每管100μl(其中含有10%的甘油)即得大肠杆菌感受态细胞,于
‑
80℃下保存,如当天直接用于转化的可不加甘油;
[0064]
k.取制备的100μl dh5α感受态细胞,于冰上融解,向其中加入10μl连接产物,对照加10μl灭菌水,轻轻混匀,冰浴30min;
[0065]
l.42℃热击90s后,迅速冰浴3min;
[0066]
m.加入500μl
‑
800μl lb液体培养基,于37℃,120r/min摇床培养,复苏1h;
[0067]
n.5000r/min离心5min,收集菌体。吸出约500μl lb液体培养基后,重悬剩余菌体,涂布含lb平板(含1
‰
amp),于37℃过夜培养。对照取100μl涂布lb平板(含1
‰
amp),另吸取100μl涂布lb平板,于37℃过夜培养。
[0068]
(4)重组质粒的抽提和鉴定
[0069]
将转化的dh5α涂布于含有抗生素amp的lb平板中,12
‑
16h后,挑取10个阳性菌落于含有5ml液体lb培养基(含1
‰
amp)的pa瓶中,于37℃,180r/min过夜培养。收集菌体,用质粒提取试剂盒提取其质粒,用1%的琼脂糖胶电泳检测,并使用nanodrop2000测其浓度及od
260/280
。然后pcr检测鉴定,pcr体系实施例2一样只是采用质粒自带引物s
·
tag和t7t引物,并对产物送去擎科生物公司测序检测目的基因是否存在于质粒上。重组质粒的构建可见图2所示。
[0070]
三、基因工程菌株的构建和诱导表达
[0071]
(1)大肠杆菌bl21(de3)感受态制备及转化
[0072]
大肠杆菌bl21(de3)的感受态制备(或购买)与dh5α相同。同样采用cacl2转化法进行常规转化。
[0073]
(2)大肠杆菌bl21(de3)阳性克隆的筛选
[0074]
从长出较多菌落的平板中任意各挑取5个单菌落于5ml lb液体培养基(5μl amp)pa瓶中,180r/min,37℃培养过夜。以重组质粒为模板进行目的基因pcr,pcr体系同步骤一,但引物替换为质粒自带引物s
·
tag和t7t。对pcr产物进行0.8%琼脂糖凝胶电泳验证,135v,40min。验证含目的基因的重组质粒是否成功转入宿主菌,鉴定后能扩增出目的片段的则为阳性克隆子。
[0075]
(3)目的蛋白的诱导表达与sds
‑
page鉴定
[0076]
经抗性筛选和pcr鉴定后,将(2)中阳性克隆子对应的菌液用0.4mm iptg诱导剂进
行诱导表达,以转化空载体的bl21(de3)
‑
pet32a作为对照,具体操作步骤如下(注意操作中接种、加样、取样、悬浮处理以及收集菌体等均在无菌条件下操作):
[0077]
a.挑取该转化菌株的单菌落至5ml lb液体培养基(含1
‰
amp)中,37℃过夜培养,180r/min;
[0078]
b.将0.5ml过夜培养物接种至50ml lb液体培养基中,装于250ml锥形瓶中,37℃过夜培养,180r/min;
[0079]
c.用0.4mmol/l iptg诱导,分别于“诱导前”、“诱导后”取1ml菌液,12000
×
g离心2min,分离菌体和发酵上清。于
‑
20℃保存;
[0080]
d.用100μl灭菌水重悬菌体,室温下放置5min。12000
×
g离心3min,用5
×
sds loading buffer重悬菌体,沸水浴5
‑
10min;
[0081]
e.将所有样品煮沸后3000
×
g离心3min。变性后样品进行sds
‑
page电泳检测。
[0082]
f.电泳结束后,卸下凝胶,在考马斯亮蓝染色液(1g考马斯亮蓝r
‑
250,乙醇:乙酸:水=5:1:4)中染色1个小时,然后用脱色液(乙醇:乙酸:水=4:1:5)脱色,每隔30min换液一次,直至背景脱干净为止。通过观察凝胶可知:目的基因在大肠杆菌bl21(de3)中诱导表达,大小为28kda左右(图3)。
[0083]
(4)目的蛋白的分离纯化与浓缩
[0084]
为了获得大量的目的蛋白,需要将阳性克隆子进行大量的表达,然后离心收集菌体,进行高压破碎,释放胞内目的蛋白,之后取菌体破碎后上清进行蛋白纯化,由于载体pet32a含有6
×
his标签,所以蛋白纯化采用镍柱纯化。纯化后组分经过冷冻干燥进行浓缩,且采用sds
‑
page检测纯化结果。通过观察凝胶可知:目的蛋白在200mm咪唑溶液洗脱下组分纯,大小为28kda左右(图3),所述的目的蛋白包括seq idno.3所示的氨基酸,本发明称为trx
‑
hidefensin1;标签蛋白trx为硫氧还原蛋白。
[0085]
实施例2:
[0086]
trx
‑
hidefensin1体外抗菌活性的测定
[0087]
待测菌株:金黄色葡萄球菌(staphylococcus aureus)、大肠杆菌(escherichia coli)和肠炎沙门氏菌(salmonella entericasubspenterica)。
[0088]
采用打孔平板对峙培养法检测其抗菌活性。将生长至对数期的待测菌株,按接种量为1%接种至lb培养基,混合倒平板。然后用牛津杯(尺寸:内径
‑
外径
‑
高:6mm
‑
8mm
‑
10mm)在培养基上对称均匀地打孔。精确吸取所表达的trx
‑
hidefensin1蛋白200μl(15μg/ml),加入培养基的牛津杯中,每个指示菌做三个重复。病原细菌于37℃培养12h,观察抑制效果。
[0089]
抑菌效果如下表和图4所示:
[0090]
抑菌圈直径
[0091][0092]
注:因为牛津杯外径为8.00mm,所以抑菌圈直径最小检测限为8.00mm。
[0093]
从图4中可以看出,表达样品trx
‑
hidefensin1对革兰氏阳性菌金黄色葡萄球菌、
革兰氏阴性菌大肠杆菌均有抑制效果。对肠炎沙门氏菌无抑菌效果,即不展示图片。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1