一种含氟叔碳中心的构建方法
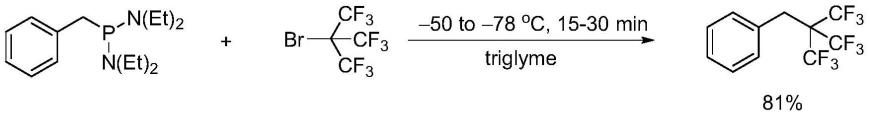
1.本发明涉及有机合成领域,具体涉及一种含氟叔碳中心的构建方法。
背景技术:
2.含氟化合物由于其独特的物理化学性质在医药、农药和材料领域都有着非常重要的应用。近年来,尽管有大量的合成方法学被报道,但大多数仍集中于简单氟烷基砌块的构建。对于含氟叔碳中心的构建方法非常有限。该类化合物含氟较多,具有非常特殊的性质和广阔的应用前景。比如,由于氟谱的化学位移受氟原子周围电子云密度的影响非常大,因此可以利用氟谱化学位移高效的识别化学环境的细微变化。目前,已经有大量的含氟分析物被用于复杂混合物中的特异性分析和识别。另一方面,自然界和生物体中具有极少的含氟物质,因此对于含氟化合物的检测可以几乎不受其他因素的干扰。总体而言,基于
19
f-nmr的检测技术由于其较高的特异性识别能力和精确度在生物医药、检测标记等领域有着巨大的应用前景。但是目前限制该技术更广泛应用的是其相对较低的灵敏度,常规的nmr分析需要毫克级别的样品量,然而更多情况下实际的样品量远远达不到这个标准。而向化合物中引入多个化学位移等价的氟原子可以有效的提高氟谱检测的灵敏度,例如,全氟叔丁基[-c(cf3)3]是极好的选择。
[0003]
向分子中引入全氟叔丁基的方法非常有限,传统的方法依赖于剧毒气体全氟异丁烯的使用,或是利用九氟叔丁烷在碱的存在下和亲电试剂反应,原料均为气体,且具有极大的毒性,极大了限制了其发展。
[0004]
1998年,kolomeitsev和等人发展了一种arbuzov类型的取代反应。用氨基磷酸盐和多种含氟卤代物反应,制备了多种含氟化合物,其中包括了一例全氟叔丁基取代的化合物。
[0005][0006]
2013年,报道了一种光引发的对烯烃的氢化氟烷基化反应。以氟烷基碘代物为氟烷基自由基前体,三(三甲基硅基)硅烷为氢源实现了对于烯烃的氢化氟烷基化反应。文中展示了多种氟烷基碘代物,其中仅包括一例全氟叔丁基碘参与的反应实例,且反应效率仅为中等。
[0007][0008]
除此以外,几乎没有实用的方法学可用于向底物中引入全氟叔丁基。同时,在已有
的方法中也存在着明显的局限性:(1)依赖于剧毒的气体全氟异丁烯(全氟叔丁基卤代物的主要制备方法也以全氟异丁烯为原料);(2)所用试剂操作不便,难以处理,大多为气体或易升华的固体(全氟叔丁基碘易升华,具有强刺激性);(3)底物范围较窄,反应效率较低。
[0009]
因此,本领域急需提供一种安全、高效、通用性广的含氟叔碳中心的构建方法。
技术实现要素:
[0010]
本发明的目的在于提供一种安全、高效、通用性广的含氟叔碳中心的构建方法。具体地,提供一种式i化合物在构建含氟叔碳中心中的用途。
[0011]
本发明第一方面,提供了一种式i化合物用于亲电试剂的氟烷基化以构建含氟叔碳中心的用途,
[0012][0013]
其中,r
f1
、r
f2
各自独立地选自下组:c1-c8的全氟烷基、-(cf2)nra,
[0014]
n为0、1、2、3、4、5、6、7或8;
[0015]
各ra独立地选自下组:h、d、卤素、-no2、-cn、氧代、-oh、-nh2、-cooh、-cho、被1个或2个c1-c6的烷基取代的氨基、取代或未取代的c1-c8的烷基、取代或未取代的c1-c8烯基、取代或未取代的c1-c8炔基、取代或未取代的c3-c8环烷基、取代或未取代的具有1-3个选自o、n和s的杂原子的3-10元杂环烷基、取代或未取代的c6-c10的芳基、取代或未取代的具有1-3个选自o、n和s的杂原子的c5-c10的杂芳基、取代或未取代的c1-c6亚烷基-rb、-o-rb、-s-rb、-oco-rb、-coo-rb、-co-rb或-s(=o)
2-rb;
[0016]
其中,各rb独立的选自下组:取代或未取代的c1-c8的烷基、取代或未取代的c3-c8环烷基、取代或未取代的具有1-3个选自o、n和s的杂原子的3-10元杂环烷基、取代或未取代的c6-c10的芳基、取代或未取代的具有1-3个选自o、n和s的杂原子的5-10元杂芳基;
[0017]
其中,所述取代指基团上的一个或多个h原子被选自下组的基团取代:d、卤素、-no2、-cn、氧代(=o)、-oh、-nh2、-cooh、-cho、被1个或2个c1-c6的烷基取代的氨基、卤素取代或未取代的c1-c8的烷基、c3-c8环烷基、取代或未取代的具有1-3个选自o、n和s的杂原子的3-8元杂环烷基、c6-c10的芳基、具有1-3个选自o、n和s的杂原子的5-10元的杂芳基、卤素取代或未取代的c1-c6亚烷基-rc、-o-rc、-s-rc、-oco-rc、-coo-rc、-co-rc或-s(=o)
2-rc;
[0018]
其中,各rc独立的选自下组:卤素取代或未取代的c1-c8的烷基、卤素取代或未取代的c3-c8环烷基、具有1-3个选自o、n和s的杂原子的3-8元杂环烷基、c6-c10的芳基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基;和
[0019]
r1、r2为离去基团,较佳地,r1、r2各自独立地选自下组:f、cl、br、i、otf、ots、ons、oso
2-c1-c6烷基、oso2ph、oac、cn、no2,且r1、r2不同时为氟。
[0020]
在另一优选例中,所述取代指基团上的一个或多个h原子被选自下组的基团取代:卤素取代或未取代的c1-c8的烷基、卤素取代或未取代的c1-c8的烷硫基、c6-c10的芳基、c6-c10的芳氧基、c6-c10的芳基-甲酰氧基、c6-c10的芳硫基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基、具有1-3个选自o、n和s的杂原子的5-10元杂芳氧基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基-甲酰氧基、具有1-3个选自o、n和s的杂原子的5-10元杂芳硫
基、卤素取代或未取代的c1-c8烷基磺酰基、c6-c10芳基磺酰基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基磺酰基或甲酰基。
[0021]
在另一优选例中,所述取代指基团上的一个或多个h原子被选自下组的基团取代:卤素、no2、cn、氧代、-oh、-nh2、-cooh、-cho、被1个或2个c1-c6的烷基取代的氨基、c1-c8的烷基、卤代的c1-c8的烷基、c1-c8的烯基、c1-c8的炔基、c1-c8的烷氧基、c6-c10的芳基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基、c1-c8的烷基磺酰基、c6-c10芳基磺酰基、具有1-3个选自o、n和s的杂原子的5-10元杂芳基磺酰基、c1-c8烷基-co-、c1-c8的烷基-coo-、c1-c8烷氧基-co-、c6-c10芳基-co-、c6-c10芳基-coo-、c6-c10芳氧基-co-、具有1-3个选自o、n和s的杂原子的5-10元杂芳基-co-、具有1-3个选自o、n和s的杂原子的5-10元杂芳基-coo-、具有1-3个选自o、n和s的杂原子的5-10元杂芳氧基-co-。
[0022]
在另一优选例中,各ra独立地选自下组:卤素、-no2、-cn、氧代、-cooh、-cho、取代或未取代的c6-c10的芳基、取代或未取代的具有1-3个选自o、n和s的杂原子的c5-c10的杂芳基、取代或未取代的亚甲基-rb、-oco-rb、-coo-rb、-co-rb或-s(=o)
2-rb;
[0023]
其中,各rb独立的选自下组:取代或未取代的c1-c8的烷基、取代或未取代的c3-c8环烷基、取代或未取代的具有1-3个选自o、n和s的杂原子的3-10元杂环烷基、取代或未取代的c6-c10的芳基、取代或未取代的具有1-3个选自o、n和s的杂原子的5-10元杂芳基;
[0024]
其中,所述取代指基团上的一个或多个h原子被选自下组的基团取代:d、卤素、-no2、-cn、氧代(=o)、-cooh、-cho。
[0025]
在另一优选例中,式i化合物作为含氟叔碳负离子的前体,用于亲电试剂的氟烷基化反应,从而在所述亲电试剂(底物)上构建含氟叔碳中心。
[0026]
在另一优选例中,所述r1为f、cl、br、i、otf、ots、ons、oso2me、oso2ph、oac、cn或no2。
[0027]
在另一优选例中,所述r2为f、cl、br、i、otf、ots、ons、oso2me、oso2ph、oac、cn或no2。
[0028]
在另一优选例中,所述的r
f1
和r
f2
独立地选自下组:-cf3、-cf2h、-cf2cf3和cf2cf2cl;且
[0029]
r1和r2独立地选自下组:f、cl、br、i、otf和ots。
[0030]
在另一优选例中,所述的式i化合物为1,1-二溴-2,2-双三氟甲基乙烯。
[0031]
本发明第二方面,提供了一种在化合物中构建含氟叔碳中心的方法,所述的方法包括步骤:
[0032]
在惰性溶剂中,在氟源存在下,用如本发明第一方面所述的式i化合物与底物反应,从而得到具有含氟叔碳中心的产物。
[0033]
在另一优选例中,所述当待构建含氟叔碳基团的化合物具有离去基团时,将所述化合物直接作为底物进行反应;
[0034]
当所述化合物不具备离去基团时,将所述化合物制备成包含离去基团的形式后进行反应;
[0035]
其中,所述离去基团选自下组:f、cl、br、i、otf、ots、ons、oso2me、oso2ph、oac、cn、no2,较佳地为f、cl、br、i、otf、ots。
[0036]
在另一优选例中,所述的方法包括步骤:
[0037]
(i-1)在非质子性溶剂中,在氟源存在下,用式i化合物与底物r
3-lg反应,得到具有含氟叔碳中心的化合物;
[0038][0039]
或者,所述的方法包括步骤:
[0040]
(i-2)在非质子性溶剂中,在氟源存在下,用式i化合物与底物r
3-x-lg反应,得到具有含氟叔碳中心的化合物;
[0041][0042]
式中,各r
f1
、r
f2
、r1和r2如本发明第一方面所定义;
[0043]
各r3独立地选自下组:取代或未取代的c1-c30的烷基、取代或未取代的c2-c30的烯基、取代或未取代的c2-c30的炔基、取代或未取代的c6-c20的芳基、取代或未取代的5-至20-元的杂芳基、取代或未取代的c7-c25的烷基-c6-c20芳基、取代或未取代的c1-c5烷基5-至20-元的杂芳基、取代或未取代的c3-c20的环烷基、取代或未取代的c1-c5烷基-c3-c20的环烷基、取代或未取代的3-至20-元的杂环基,或取代或未取代的c1-c5烷基-3-至20-元的杂环基;其中,所述的杂芳基或杂环基中具有1-5个选自下组的杂原子:n、o或s;所述的环烷基或杂环基可以为单环、多环、螺环或桥环结构;
[0044]
对于r3,所述的取代指基团上的一个或多个氢原子(如1-4个)被选自下组的取代基取代:卤素、氰基、氧代(=o)、硫代、卤代或未取代的c1-c6烷基、卤代或未取代的c2-c6烯基、卤代或未取代的c2-c6炔基、卤代或未取代的c1-c6烷氧基、卤代或未取代的c6-c10的芳基、卤代或未取代的c6-c10的芳基-氧基、卤代或未取代的c3-c8环烷基、卤代或未取代的3-8杂环烷基、c1-c10烷基-coo-、c1-c10烷基-oco-、c1-c10烷基-co-、c1-c10烷基-nhc(o)-、c6-c10芳基-nhc(o)-、-cooh、-no2、-oh、-nh2、被1个或2个c1-c6的烷基取代的氨基、c1-c6烷基-s-、或连接在基团上相邻两个原子上的取代基与相连的所述原子一起形成c3-c10环烷基或具有1-3个选自o、n和s的杂原子的5-10元杂芳基;
[0045]
x选自下组:o、n、s、se、i;
[0046]
各lg独立地为离去基团,且lg独立地选自下组:f、cl、br、i、otf、ots、ons、oso2me、oso2ph、oac、cn、no2。
[0047]
在另一优选例中,所述的lg选自下组:f、cl、br、i、otf、ots,较佳的lg为f、cl、br、i。
[0048]
在另一优选例中,步骤(i-1)包括步骤:
[0049]
(i-1)在氟源的存在下,将式i化合物与反应溶剂、底物混合,从而反应生成具有含氟叔碳中心的化合物。
[0050]
在另一优选例中,步骤(i-1)的反应具有一个或多个如下特征:
[0051]
(1)所述的反应温度为0-120℃,较佳地25-35℃;
[0052]
(2)10min-12h,较佳地,2h-10h。
[0053]
在另一优选例中,步骤(i-2)包括步骤:
[0054]
(i-2)在氟源的存在下,将式i化合物与反应溶剂混合,反应后加入底物,从而反应生成具有含氟叔碳中心的化合物。
[0055]
在另一优选例中,式(i-2)中,加入底物后的反应具有一个或多个如下特征:
[0056]
(1)所述的反应温度为0-120℃,较佳地25-35℃;
[0057]
(2)10min-12h,较佳地,2h-10h。
[0058]
在另一优选例中,所述的氟源选自下组:kf、kf+冠醚、csf、csf+冠醚、agf、cuf、cuf2、khf2、四甲基氟化铵(tmaf)、四丁基氟化铵(tbaf)、四正丁基铵-二氟代三苯基硅酸盐(tbat)、三(二甲氨基甲基)锍二氟三甲基氨酸硅酸盐(tasf),或其组合。
[0059]
在另一优选例中,所述的氟源选自下组:kf、kf+冠醚或csf。
[0060]
在另一优选例中,所述的溶剂选自下组:二甲基亚砜,n,n-二甲基甲酰胺,n,n-二甲基乙酰胺,n,n-二甲基苯胺,n-甲基吡咯烷酮,乙腈、1,4-二氧六环、四氢呋喃、乙酸乙酯、甲苯、乙醚,或其组合;较佳地,所述的溶剂选自n,n-二甲基甲酰胺,n-甲基吡咯烷酮和乙腈,更佳地,所述溶剂是无水溶剂。
[0061]
在另一优选例中,所述式i化合物的用量为底物的1.0-5.0当量,较佳地为1.2-3.0当量。
[0062]
在另一优选例中,所述氟源的用量为底物的3.0-15.0当量,较佳地为3.8-10.0当量,更佳地为5.0-9.3当量。
[0063]
本发明第三方面,还提供了一种含有全氟叔丁基的式a化合物,
[0064][0065]
其中,r
x
选自下组:h、d、卤素、-no2、-cn、氧代、-oh、-nh2、-cho、被1个或2个c1-c6的烷基取代的氨基、取代或未取代的c1-c30的烷基、取代或未取代的c2-c30烯基、取代或未取代的c2-c30炔基、取代或未取代的c3-c20环烷基、取代或未取代的具有1-6个选自o、n和s的杂原子的3-20元杂环烷基、取代或未取代的c6-c20的芳基、取代或未取代的具有1-6个选自o、n和s的杂原子的c5-c20的杂芳基、取代或未取代的c1-c8亚烷基-ry、-o-ry、-s-ry、-oco-ry、-coo-ry、-co-ry或-s(=o)
2-ry;所述的环烷基或杂环烷基可以为单环、多环、螺环或桥环结构;
[0066]
其中,ry选自下组:取代或未取代的c3-c8环烷基、取代或未取代的具有1-3个选自o、n和s的杂原子的3-10元杂环烷基、取代或未取代的c6-c10的芳基、取代或未取代的具有1-3个选自o、n和s的杂原子的5-10元杂芳基;
[0067]
所述的取代指基团上的一个或多个氢原子(如1-4个)被选自下组的取代基取代:d、卤素、硝基、氰基、氧代(=o)、硫代、-oh、-nh2、-cooh、-cho、被1个或2个c1-c6的烷基取代的氨基、卤代或未取代的c1-c8烷基、卤代或未取代的c2-c6烯基、卤代或未取代的c2-c6炔基、卤代或未取代的c1-c6烷氧基、卤代或未取代的c6-c10的芳基、卤代或未取代的c6-c10的芳基-氧基、卤代或未取代的c3-c8环烷基、卤代或未取代的3-8杂环烷基、c1-c10烷基-coo-、c1-c10烷基-oco-、c1-c10烷基-co-、c1-c10烷基-nhc(o)-、c6-c10芳基-nhc(o)-、-cooh、-no2、-oh、-nh2、被1个或2个c1-c6的烷基取代的氨基、c1-c6烷基-s-、或连接在基团上
相邻两个原子上的取代基与相连的所述原子一起形成c3-c10环烷基或具有1-3个选自o、n和s的杂原子的5-10元杂芳基;
[0068]
其中,r
x
不为:-ph、-oh、二甲氨基、-co2me、-co2et、正丙基、乙烯基、-ch2oh、-cooh、-ome、-sme、-i、-ch2ome、-ch2och2ch2och3、-ch3、且
[0069]
当r
x
为-ch2ry时,ry不为:-cn、-co2et、-co2me、-cho、-c(o)nh2、-ch2oh、-cooh、-oc(o)me、-sh、-i、-br、-ch2nh2、-ots和-c6f5。
[0070]
在另一优选例中,所述式a化合物不为
[0071][0072]
在另一优选例中,所述式a化合物选自实施例2-65所制备的化合物。
[0073]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0074]
本发明人经过广泛而深入的研究,通过大量筛选和测试,提供了一类适用于构建含氟叔碳中心的化合物,通过本发明的化合物与氟源组成的反应体系,可以用于在底物分子中构建含氟叔碳中心。本发明的方法条件温和,操作安全,具有很好的工业应用前景。在此基础上完成了本发明。
[0075]
术语
[0076]
除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。
[0077]
如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
[0078]
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
[0079]
如本文所用,术语“室温”或“常温”是指温度为4-40℃,较佳地,25
±
5℃。
[0080]
当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。举例而言,-ch2o-等同于-och
2-。
[0081]
在整个说明书中,使用的术语“任选取代的”或“可以被取代的”等表示该基团可以与或不与一个或多个非-氢取代基进一步取代或稠合(以形成多环体系)。对于合适的化学上合适的特定官能团的取代基对于本领域技术人员来说是显而易见的。
[0082]
除非另有表述,术语“烷基”本身或作为另一取代基的一部分是指具有指定碳原子数的直链或支链烃基(即,c1-30表示1-30个碳),包括1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个碳原子的烷基。烷基的例子包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基等。“取代烷基”是指烷基中的一个或多个位置被取代,尤其是1-4个取代基,可在任何位置上取代。术语“亚烷基”指有指定碳原子数的直链或支链的二价烃基,包括1、2、3、4、5、6、7、8个碳原子的亚烷基。
[0083]
除非另有表述,术语“烯基”指具有一个或多个双键的不饱和烷基。类似地,术语“炔基”指具有一个或多个三键的不饱和烷基。例如包括2、3、4、5、6、7、8、9、10、11、12、13、14或15个碳原子的烯基/炔基。典型的例子包括乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-和3-丙炔基、3-丁炔基和更高级的同系物和异构体。
[0084]
除非另有表述,术语“环烷基”是指具有指定环原子数(例如,c3-20环烷基)并且完全饱和的或在环顶之间具有不超过一个双键的烃环,包括具有3、4、5、6、7、8、9、10、11或12个环碳原子的环烷基。“环烷基”也指双环和多环烃环,例如双环[2.2.1]庚烷、双环[2.2.2]辛烷等。
[0085]
除非另有表述,术语“杂环烷基”是指具有指定环原子数(例如,3-20元杂环烷基)且含有一至五个(如2、3和4个)选自n、o和s的杂原子的环烷基,其中氮和硫原子任选被氧化,且氮原子任选被季铵化。杂环烷基可以是单环、双环或多环体系,包括具有3、4、5、6、7、8、9、10、11、12个环原子的杂环烷基。杂环烷基的非限制性例子包括吡咯烷、咪唑烷、吡唑烷、丁内酰胺、戊内酰胺、咪唑烷酮、乙内酰脲、二氧戊环、苯邻二甲酰亚胺、哌啶、1,4-二噁烷、吗啉、硫代吗啉、硫代吗啉-s-氧化物、硫代吗啉-s,s-氧化物、哌嗪、吡喃、吡啶酮、3-吡咯啉、噻喃、吡喃酮、四氢呋喃、四氢噻吩、奎宁环等。杂环烷基可以经环碳或杂原子(如o、n或s原子)连接于分子的其余部分。对于诸如环烷基烷基和杂环烷基烷基的术语,是指环烷基或杂环烷基通过烷基或亚烷基连接体连接到分子的其余部分。例如,环丁基甲基-是连接到分子其余部分的亚甲基连接基上的环丁基环。
[0086]
除非另有表述,术语"烷氧基"或“烷基氧基”、"烷胺基""或“烷基胺基”以其常规意义使用,指代分别经氧原子或氮连接于分子的其余部分的那些烷基。此外,所述烷胺基可以是单取代或双取代的。例如,甲胺基、乙胺基、丙胺基、异丙胺基、丁胺基、异丁胺基、叔丁胺基、二甲胺基、二乙胺基、二丙胺基、二异丙胺基、二丁胺基、二异丁胺基、二叔丁胺基等。双取代时烷基部分可以相同或不同,也可和与各烷基相连的氮原子组合形成3-7元环。因此,-nrarb所示基团表示包括哌啶基、吡咯烷基、吗啉基、氮杂环丁烷基(azetidinyl)等。
[0087]
除非另有表述,术语“卤代”或“卤素”本身或作为另一取代基的一部分是指氟、氯、溴、或碘原子。此外,诸如“卤代烷基”等术语表示包括单卤代烷基或多卤代烷基。例如,术语“c1-4卤代烷基”表示包括三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基等。
[0088]
除非另有表述,术语“芳基”表示多不饱和的(通常芳香性)的烃基,其可以是单环或稠合在一起或共价连接的多环(最多三环),芳基的非限制性例子包括苯基、萘基、蒽基、联苯基。术语“芳烷基”是指包括其中芳基连接到与分子的其余部分连接的烷基的那些基团(例如苄基,苯乙基,吡啶基甲基等)。
[0089]
除非另有表述,术语"杂芳基"是指具有指定环原子数(例如,5-20元杂芳基)且含
有1至5个(如2、3或4)选自n、o和s的杂原子的芳基(或环),其中氮和硫原子任选被氧化,氮原子任选被季铵化,包括具有5、6、10个环原子的杂环基。杂芳基可通过杂原子(如o、n或s原子)连接于分子的其余部分。杂芳基的非限制性例子包括吡啶基、哒嗪基、吡嗪基、嘧啶基、三嗪基、喹啉基、喹喔啉基、喹唑啉基、噌啉基、酞嗪基、苯并三嗪基(benzotriazinyl)、嘌呤基、苯并咪唑基、苯并吡唑基、苯并三唑基、苯并异噁唑基、异苯并呋喃基(isobenzofuryl)、异吲哚基、中氮茚基、苯并三嗪基、噻吩并吡啶基、噻吩并嘧啶基、吡唑并嘧啶基、咪唑并吡啶、苯并噻唑基、苯并呋喃基、苯并噻吩基、吲哚基、喹啉基、异喹啉基、异噻唑基、吡唑基、吲唑基、蝶啶基、咪唑基、三唑基、四唑基、噁唑基、异噁唑基、噻二唑基、吡咯基、噻唑基、呋喃基、噻吩基等等。
[0090]
在一些实施例中,上述术语(如“烷基”,“芳基”和“杂芳基”)将包括指定基团的取代和未取代形式。为简洁起见,除非指明被取代,术语烷基、芳基和杂芳基等是指未取代的形式。
[0091]
在本文中,除特别说明之处,术语“取代”指基团上的一个或多个氢原子被选自下组的取代基取代:卤素、-cn、-oh、-nh2、-cooh、未取代或卤代的c1-c6烷基、未取代或卤代的c2-c6烯基、未取代或卤代的c2-c6炔基、未取代或卤代的c2-c6酰基、未取代或卤代的c1-c6烷氧基、c3-c6环烷基、包含1-3个选自o、n和s的杂原子的3-6元杂环基、c6-c10芳基、苄基、包含1-3个选自o、n和s的杂原子的3-6元杂芳基。
[0092]
如文本所用,术语“c
1-c8烷基磺酰基”是指c
1-c8烷基-s(=o)
2-。
[0093]
如文本所用,术语“甲酰基”指-co-或-(c=o)-。
[0094]
如文本所用,术语“甲酰氧基”指-h-(c=o)o-,如“c6-c10的芳基-甲酰氧基”指c6-c10的芳基-(c=o)o-。
[0095]
式i化合物
[0096][0097]
其中,r
f1
、r
f2
、r1和r2如上所述。
[0098]
当r
f1
、r
f2
中的一个或两个为-(cf2)nra,且n≥1时,-(cf2)
n-具有足够的吸电子能力,对ra没有特别要求,优选地,ra为吸电子基团,如卤素、-no
2、-cooh、-cho、以及-coo-rb、-co-rb或-s(=o)
2-rb等,其中rb如上定义,优选地n≥2。当n为0时,ra可为一个或多个(如1、2或3个)吸电子基取代的c1-c3亚烷基(如亚甲基)。
[0099]
r1、r2可以为本领域常用的离去基团。离去基团包括但并不限于:f、cl、br、i、otf、ots、ons、oso
2-c1-c6烷基、oso2ph、oac、cn、no2。
[0100]
本发明还包括同位素标记的化合物,等同于原始化合物在此公开。不过实际上对一个或更多的原子被与其原子量或质量序数不同的原子取代通常会出现。可以列为本发明的化合物同位素的例子包括氢,碳,氮,氧,磷,硫,氟和氯同位素,分别如2h、3h、
13
c、
11
c、
14
c、
15
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f、
19
f和
36
cl。本发明中的化合物,或对映体,非对映体,异构体,或其盐,其中含有上述化合物的同位素或其他同位素原子都在本发明的范围之内。同位素标记的化合物可以用一般的方法,通过用易得的同位素标记试剂替换为非同位素的试剂,用批露在示例中的方案或本领域常规方法可以制备。
[0101]
用途
[0102]
本发明人意外地发现,在氟源存在下,式i化合物可作为含氟叔碳负离子的前体,用于亲电试剂的氟烷基化,从而构建叔碳中心。
[0103]
本发明中,术语“构建含氟叔碳中心”指在底物化合物上形成含氟叔碳基团,本发明中,“含氟叔碳中心”或“含氟叔碳基团”通常具有式-c(-cf3)(r
f1
)(r
f2
),其中r
f1
、r
f2
如上定义,较佳地,所述含氟叔碳基团为-c(cf3)3。
[0104]
本发明中,术语“亲电试剂(electrophile)”指在化学反应中具有亲电性的化学试剂,是一种电子对受体,即路易斯酸。在反应过程中,它倾向于与电负性物种结合。
[0105]
此外,本发明的式i化合物高反应活性,可在常温下与亲电试剂快速反应,可作为一种衍生化试剂用于待测物质的检测。例如将[-c(cf3)3]引入化合物中,从而提高
19
f-nmr的检测精度,可显著降低nmr分析所需样品量。
[0106]
构建含氟叔碳中心的方法
[0107]
本发明提供了一种在化合物中构建含氟叔碳中心的方法,所述的方法包括步骤:
[0108]
在惰性溶剂中,在氟源存在下,用如本发明第一方面所述的式i化合物与底物反应,从而得到具有含氟叔碳中心的产物。
[0109]
更具体地,所述的方法可包括步骤:
[0110]
(i-1)在非质子性溶剂中,在氟源存在下,用式i化合物与底物r
3-lg反应,得到具有含氟叔碳中心的化合物;
[0111][0112]
或者,所述的方法包括步骤:
[0113]
(i-2)在非质子性溶剂中,在氟源存在下,用式i化合物与底物r
3-x-lg反应,得到具有含氟叔碳中心的化合物;
[0114][0115]
式中,各r
f1
、r
f2
、r1和r2、x、r3、lg如上所定义。
[0116]
不希望限制本发明,一种可能的反应机理为:
[0117][0118]
在氟源存在下,式i化合物形成叔碳负离子(i-a),进攻亲电试剂(如包含离去基团的化合物)带正电性的原子(如与离去基团相连的原子),亲电试剂失去离去基团,从而形成式含有叔碳中心的式i-b化合物。
[0119]
本领域技术人员理解,但原料化合物不含带正电性的原子或所述原子正电性不足时,可通过本领域常规方法引入常用的离去基团等吸电子基团,然后作为反应底物与本发
明的式i化合物进行反应,从而构建叔碳中心。
[0120]
本发明中,将化合物制备成包含离去基团(通常为吸电子基团)的形式是为反应提供活性位点,其中离去基团的种类和将其引入化合物的方法是本领域已知的,如制备成卤代化合物形式等。
[0121]
由于本发明的式i化合物具有较强的反应活性,对离去基团的种类没有特别要求,可使用本领域常用的离去基团,以使得底物上与所述离去基团相连的原子具有亲电性。可用于本发明的离去基团的实例包括但并不限于:f、cl、br、i、otf、ots、ons、oso2me、oso2ph、oac、cn、no2,较佳地为f、cl、br、i、otf、ots。
[0122]
此外,由于本发明的式i化合物与底物可以在较低温度(如室温)下进行,通常底物包含的各种官能团可在本发明的反应条件下稳定存在,因此,可适用本发明方法的底物广泛,在存在离去基团提供相应反应位点的基础上,对其它部分结构没有特别要求,本发明方法的底物可以为本领域常见的各种小分子化合物。
[0123]
本发明中,术语“小分子”是指具有小于约10kda、小于约2kda或小于约1kda的分子量的化合物,如50da、200da或500da。
[0124]
在本发明的方法中可以使用任何合适的溶剂。优选非质子溶剂,代表性的溶剂包括但不限于二甲基亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n,n-二甲基苯胺、n-甲基吡咯烷酮、乙腈、1,4-二氧六环、四氢呋喃、乙酸乙酯、甲苯、乙醚、戊烷、己烷、庚烷、石油醚、环戊烷、环己烷、苯、甲苯、二甲苯、三氟甲苯,卤代苯如氯苯、氟苯、二氯苯和二氟苯,二氯甲烷、氯仿、丙酮、二乙醚,或其组合。
[0125]
本发明的方法中的反应可以在任何合适的温度下进行。例如,反应温度可以是约-78℃至约100℃,或者为约-50℃至约100℃,或者为约-25℃至约50℃,或约-10℃至约40℃,或约0℃至约25℃。在一些实施方案中,反应温度可以是20
±
5℃。在一些实施方案中,反应时间为10min-24h,较佳地1-12h。
[0126]
含有全氟叔丁基的化合物
[0127]
本发明还提供了一类具有含氟叔丁基的化合物,如式a所示:
[0128][0129]
其中,r
x
如上定义。
[0130]
上述含有全氟叔丁基的化合物可作为
19
f-nmr检测的标准品,或用于
19
f-mri(核磁共振成像)中。
[0131]
本发明的主要优点包括:
[0132]
1.本发明提供了一种高效、通用性广的构建含氟叔碳中心的新方法,通过本发明的方法可在多种化合物中方便的引入含氟叔碳基团,且本发明的方法底物官能团兼容性好,对底物的其他官能团影响小,可进一步扩大底物范围,提高收率,降低成本。
[0133]
2.本方法反应条件温和,操作安全,反应速度快,产率高,可在室温下进行反应,且无需使用易挥发的剧毒物质,非常适合工业化生产,制得的产物在生物医药、农药和材料科学等方面具有极大的应用潜力。
[0134]
下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而
不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0135]
实施例1
[0136][0137]
在氩气保护下,向干燥的400ml封管i中加入三苯基膦(39.7g,200mmol,2.0equiv)和苯甲腈(200ml),搅拌溶解。用甲醇/液氮冷却-20℃,分批加入cbr4(26.2g,100mmol,1.0equiv),维持0℃以下反应0.5小时。与此同时,在氩气保护下,向干燥的200ml封管ii中加入120ml浓硫酸。封管i反应结束后,降温至-78℃,抽为负压,拧紧旋塞。将i,ii封管通过导管相连。向封管ii中缓慢滴入六氟丙酮水合物(26.4g,120mmol,1.2equiv),拧开封管i旋塞,通入六氟丙酮气体,大约半小时加完(期间最好保证封管i温度为-70℃以下)。加完后拧紧封管i,撤去冷浴,缓慢恢复至室温后,继续反应2小时。反应结束后,加硅藻土过滤,用少量苯甲腈(20ml)洗,滤液减压蒸馏,得无色液体14.07g(45℃,50mmhg),产率44%。
[0138]
实施例2-31的典型操作
[0139][0140]
在手套箱中,向干燥的10ml聚乙烯(pe)管中加入亲电试剂(0.3mmol,1.0equiv),无水csf(227.9mg,1.5mmol,5.0equiv)和超干dmf,然后加入1,1-二溴-2,2-双三氟甲基乙烯(144.8mg,0.45mmol,1.5equiv),盖上盖子,室温下反应。反应结束后,加水,用乙醚萃取,合并有机相,水洗,干燥,过滤后浓缩,快速柱层析得目标产物。
[0141]
实施例2
[0142]
实施例2制备得到的具体化合物为
[0143]
底物为溴代物,反应时间2h,得白色固体108.0mg,产率93%。1h nmr(400mhz,cdcl3)δ7.64-7.62(m,2h),7.58(d,j=8.3hz,2h),7.47(t,j=7.5hz,2h),7.41-7.37(m,3h),3.49(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ141.2,140.4,132.1,129.7,129.0,127.7,127.2,127.0,122.1(q,j=288.5hz),60.0(m,j=25.4hz),32.3;ms-ei(m/z,%):386[m]
+,
167(100.00);hrms-ei(m/z):calcd for c
17h11
f9[m]
+,
386.0712;found,386.0704;ir(film):1267,1245,1225,1177,1120,1059,998,982,771,762,742,721,713cm-1
.
[0144]
实施例3
[0145]
实施例3制备得到的具体化合物为
[0146]
底物为溴代物,反应时间2h,得无色液体82.6mg,产率75%。1h nmr(400mhz,cdcl3)δ7.34(d,j=8.5hz,2h),7.24(d,j=8.2hz,2h),3.40(s,2h),1.33(s,9h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(101mhz,cdcl3)δ151.3,131.4,127.6,125.3,122.1(q,j=288.2hz),59.9(m,j=25.4hz),34.7,32.2,31.4;ms-ei(m/z,%):366[m]
+,
351(100.00);hrms-ei(m/z):calcd for c
15h15
f9[m]
+,
366.1025;found,366.1033.
[0147]
实施例4
[0148]
实施例4制备得到的具体化合物为
[0149]
底物为溴代物,反应时间2h,得白色固体93.9mg,产率91%。1h nmr(400mhz,cdcl3)δ7.30(d,j=8.6hz,2h),7.24(d,j=8.4hz,2h),3.39(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(126mhz,cdcl3)δ134.6,133.0,129.2,128.7,121.9(q,j=288.4hz),59.8(m,j=25.6hz),32.0;ms-ei(m/z,%):344[m]
+,
125(100.00);hrms-ei(m/z):calcd for c
11
h6clf9[m]
+,
344.0009;found,344.0005;ir(film):1268,1246,1235,1000,983,740cm-1
.
[0150]
实施例5
[0151]
实施例5制备得到的具体化合物为
[0152]
底物为溴代物,反应时间2h,得无色油状液体111.8mg,产率96%。1h nmr(400mhz,cdcl3)δ7.46(d,j=8.5hz,2h),7.18(d,j=8.3hz,2h),3.38(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(101mhz,cdcl3)δ132.3,130.6,128.8,121.7,120.9(q,j=288.6hz),58.8(m,j=25.7hz),31.1;ms-ei(m/z,%):388[m]
+,
169(100.00);hrms-ei(m/z):calcd for c
11
h6brf9[m]
+,
387.9504;found,387.9485;ir(film):1258,1230,1175,1058,998,981,735,713cm-1
.
[0153]
实施例6
[0154]
实施例6制备得到的具体化合物为
[0155]
底物为溴代物,反应时间2h,得无色油状液体92.8mg,产率92%。1h nmr(400mhz,cdcl3)δ7.63(d,j=8.5hz,2h),7.43(d,j=8.1hz,2h),3.46(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ136.1,132.5,132.1,121.8(q,j=288.8hz),118.3,112.7,59.9(m,j=25.7hz),32.4;ms-ei(m/z,%):335[m]
+,
116(100.00);hrms-ei(m/z):calcd for c
12
h6f9n[m]
+,
335.0351;found,335.0356;ir(film):2230,1340,1307,1268,1247,1233,1176,999,983,739,721,713cm-1
.
[0156]
实施例7
[0157]
实施例7制备得到的具体化合物为
[0158]
底物为溴代物,反应时间2h,得无色油状液体101.3mg,产率95%。1h nmr(400mhz,cdcl3)δ8.20(d,j=8.8hz,2h),7.50(d,j=8.5hz,2h),3.52(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ148.1,138.1,132.7,123.5,121.8(q,j=288.5hz),59.9(m,j=26.0hz),32.2;ms-ei(m/z,%):355[m]
+,
109(100.00);hrms-ei(m/z):calcd for c
11
h6f9no2[m]
+,
355.0249;found,355.0249;ir(film):1268,1246,1235,1000,983,740cm-1
.
[0159]
实施例8
[0160]
实施例8制备得到的具体化合物为
[0161]
底物为溴代物,反应时间2h,得无色油状液体95.2mg,产率89%。1h nmr(400mhz,cdcl3)δ8.22-8.21(m,2h),7.66(d,j=7.8hz,1h),7.56-7.52(m,1h),3.53(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ148.3,137.7,132.8,129.5,126.6,123.6,121.8(q,j=288.5hz),59.9(m,j=25.8hz),32.2;ms-ei(m/z,%):355[m]
+,
109(100.00);hrms-ei(m/z):calcd for c
11
h6f9no2[m]
+,
355.0249;found,355.0242;ir(film):1534,1351,1268,1245,1235,1002,984,743,713,692cm-1
.
[0162]
实施例9
[0163]
实施例9制备得到的具体化合物为
[0164]
底物为溴代物,反应时间2h,得无色油状液体98.1mg,产率93%。1h nmr(400mhz,cdcl3)δ7.91(d,j=8.2hz,2h),7.41(d,j=8.1hz,2h),3.46(s,2h),2.60(s,3h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ197.6,137.0,136.0,132.0,128.3,121.9(q,j=289.2hz),59.9(m,j=25.7hz),32.4,26.7;ms-ei(m/z,%):352[m]
+,
337(100.00);hrms-ei(m/z):calcd for c
13
h9f9[m]
+,
352.0504;found,352.0504;ir(film):1268,1246,1235,1000,983,740,713cm-1
.
[0165]
实施例10
[0166]
实施例10制备得到的具体化合物为
[0167]
底物为溴代物,反应时间2h,得无色油状液体105.2mg,产率90%。1h nmr(400mhz,cdcl3)δ7.91(d,j=8.4hz,2h),7.52(d,j=8.2hz,2h),3.50(s,2h),3.07(s,3h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ140.8,137.1,132.7,127.5,121.8(q,j=289.9hz),59.9(m,j=25.9hz),44.5,32.2;ms-ei(m/z,%):388[m]
+,
109(100.00);hrms-ei(m/z):calcd for c
12
h9f9o2s[m]
+,
388.0174;found,388.0177.
[0168]
实施例11
[0169]
实施例11制备得到的具体化合物为
[0170]
底物为溴代物,反应时间2h,得无色油状液体112.2mg,产率91%。1h nmr(400mhz,cdcl3)δ7.77(dd,j=7.8,1.3hz,1h),7.65(td,j=7.7,1.3hz,1h),7.54-7.52(m,3h),7.48-7.44(m,3h),3.49(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ144.7,138.2,133.9,133.0,132.1,131.4,130.2,128.7,127.9,122.0(q,j=288.3hz),118.6,111.4,59.9(m,j=25.6hz),32.3;ms-ei(m/z,%):411[m]
+,
192(100.00);hrms-ei(m/z):calcd for c
18h10
f9n[m]
+,
411.0664;found,411.0667.
[0171]
实施例12
[0172]
实施例12制备得到的具体化合物为
[0173]
底物为溴代物,反应时间2h,得无色油状液体112.1mg,产率89%。1h nmr(400mhz,cdcl3)δ7.48(d,j=8.8hz,1h),6.99(d,j=2.9hz,1h),6.75(dd,j=8.8,3.0hz,1h),3.78(s,3h),3.69(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.3(s,9f);
13
c nmr(101mhz,cdcl3)δ158.7,134.1,131.8,121.9(q,j=288.8hz),118.2,117.6,115.7,59.8(m,j=26.1hz),55.6,31.6;ms-ei(m/z,%):418[m]
+,
199(100.00);hrms-ei(m/z):calcd for c
12
h8brf9o[m]
+,
417.9609;found,417.9620;ir(film):1338,1269,1243,1025,998,984,712cm-1
.
[0174]
实施例13
[0175]
实施例13制备得到的具体化合物为
[0176]
底物为溴代物,反应时间2h,得无色油状液体121.5mg,产率98%。1h nmr(400mhz,cdcl3)δ7.57(s,1h),6.88(s,1h),4.13(s,2h),3.95(s,3h),3.94(s,3h);
19
f nmr(376mhz,cdcl3)δ-65.8(s,9f);
13
c nmr(101mhz,cdcl3)δ152.1,148.9,143.8,121.8(q,j=288.4hz),119.3,115.6,109.0,59.8(m,j=25.9hz),56.48,56.45,27.0;ms-ei(m/z,%):415[m]
+,
398(100.00);hrms-ei(m/z):calcd for c
13h10
f9no4[m]
+,
415.0461;found,415.0463.
[0177]
实施例14
[0178]
实施例14制备得到的具体化合物为
[0179]
底物为溴代物,反应时间2h,得无色油状液体139.1mg,产率92%。1h nmr(400mhz,cdcl3)δ8.06(d,j=8.3hz,1h),7.68(s,1h),7.25-7.23(m,1h),3.81(s,2h);
19
f nmr(376mhz,cdcl3)δ-63.8(s,3f),-64.9(s,9f);
13
c nmr(101mhz,cdcl3)δ141.5,135.7,131.1(q,j=33.2hz),127.9,126.4(q,j=3.6hz),123.7(q,j=272.3hz),121.8(q,j=290.1hz),108.0,59.9(m,j=26.1hz),36.5;ms-ei(m/z,%):504[m]
+,
285(100.00);hrms-ei(m/z):calcd for c
12
h5f
12
i[m]
+,
503.9239;found,503.9242.
[0180]
实施例15
[0181]
实施例15制备得到的具体化合物为
[0182]
底物为溴代物,反应时间2h,得无色油状液体105.9mg,产率93%。1h nmr(400mhz,cdcl3)δ7.35(d,j=8.0hz,2h),7.22-7.18(m,1h),3.94(s,2h);
19
f nmr(376mhz,cdcl3)δ-64.6(s,9f);
13
c nmr(101mhz,cdcl3)δ137.8,130.1,129.2,129.1,122.0(q,j=289.6hz),59.2(m,j=25.9hz),27.6;ms-ei(m/z,%):378[m]
+,
159(100.00);hrms-ei(m/z):calcd for c
11
h5cl2f9[m]
+,
377.9601;found,377.9609;ir(film):1562,1439,1340,1255,1230,1211,1172,1038,994,978,780,768,759,744,711,639cm-1
.
[0183]
实施例16
[0184]
实施例16制备得到的具体化合物为
[0185]
底物为溴代物,反应时间2h,得淡黄色油状物100.9mg,产率90%。1h nmr(400mhz,cdcl3)δ7.31(d,j=1.7hz,1h),7.16(dd,j=8.6,2.2hz,1h),6.86(d,j=8.6hz,1h),3.90(s,3h),3.35(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(101mhz,cdcl3)δ155.1,133.3,131.1,123.5,122.3,121.9(q,j=288.3hz),111.7,59.8(m,j=25.4hz),56.2,31.6;ms-ei(m/z,%):374[m]
+,
155(100.00);hrms-ei(m/z):calcd for c
12
h8clf9o[m]
+,
374.0114;found,374.0122.
[0186]
实施例17
[0187]
实施例17制备得到的具体化合物为
[0188]
底物为溴代物,反应时间2h,得淡黄色油状物112.4mg,产率94%。1h nmr(400mhz,cdcl3)δ7.59(dd,j=8.0,1.5hz,1h),7.53(d,j=1.6hz,1h),7.35(d,j=8.0hz,1h),3.91(s,3h),3.88(s,3h),3.56(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.9(s,9f);
13
c nmr(101mhz,cdcl3)δ166.8,158.5,132.3,131.7,125.0,122.0(q,j=288.6hz),121.6,111.4,59.7(m,j=25.8hz),55.7,52.4,25.0;ms-ei(m/z,%):398[m]
+,
69(100.00);hrms-ei(m/z):calcd for c
14h11
f9o3[m]
+,
398.0559;found,398.0562.
[0189]
实施例18
[0190]
实施例18制备得到的具体化合物为
[0191]
底物为溴代物,反应时间2h,得白色固体107.9mg,产率97%。1h nmr(400mhz,cdcl3)δ6.46(s,2h),6.43(t,j=2.2hz,1h),3.78(s,6h),3.36(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ160.6,132.7,122.0(q,j=288.7hz),
110.1,100.2,60.0(m,j=25.6hz),55.4,32.8;ms-ei(m/z,%):370[m]
+,
151(100.00);hrms-ei(m/z):calcd for c
13h11
f9o2[m]
+,
370.0610;found,370.0607.
[0192]
实施例19
[0193]
实施例19制备得到的具体化合物为
[0194]
底物为溴代物,反应时间2h,得白色固体91.8mg,产率85%。1h nmr(400mhz,cdcl3)δ8.94(dd,j=4.1,1.8hz,1h),8.14(dd,j=8.3,1.7hz,1h),7.80(d,j=7.9hz,2h),7.51(t,j=7.7hz,1h),7.41(dd,j=8.3,4.1hz,1h),4.40(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.3(s,9f);
13
c nmr(101mhz,cdcl3)δ149.7,147.5,136.3,131.9,130.5,128.6,128.4,125.8,122.2(q,j=288.4hz),121.3,60.2(m,j=25.6hz),25.0;ms-ei(m/z,%):361[m]
+,
272(100.00);hrms-ei(m/z):calcd for c
14
h8f9n[m]
+,
361.0508;found,361.0510;ir(film):1438,1339,1270,1246,1234,1002,986,801,713cm-1
.
[0195]
实施例20
[0196]
实施例20制备得到的具体化合物为
[0197]
底物为溴代物,反应时间2h,得白色固体100.9mg,产率93%,等比例放大至4.0mmol,得白色固体1.3161g,产率91%。1h nmr(400mhz,cdcl3)δ7.86-7.81(m,4h),7.53-7.51(m,2h),7.41(d,j=8.7hz,1h),3.61(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.3(s,9f);
13
c nmr(101mhz,cdcl3)δ133.1,133.0,131.3,129.0,128.2,128.1,127.9,127.7,126.7,126.5,122.1(q,j=288.2hz),60.0(m,j=25.5hz),32.8;ms-ei(m/z,%):360[m]
+,
141(100.00);hrms-ei(m/z):calcd for c
15
h9f9[m]
+,
360.0555;found,360.0550.
[0198]
实施例21
[0199]
实施例21制备得到的具体化合物为
[0200]
底物为溴代物,反应时间2h,得白色固体125.7mg,产率94%。1h nmr(400mhz,cdcl3)δ7.83(dd,j=7.7,1.2hz,1h),7.53(td,j=7.6,1.4hz,1h),7.44
–
7.33(m,4h),7.27
–
7.25(m,2h),3.55(s,3h),3.47(s,2h);
19
f nmr(376mhz,cdcl3)δ
–
65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ169.3,141.8,141.6,131.5,131.4,131.1,130.6,130.1,129.6,128.3,127.6,122.0(q,j=288.7hz),59.9(m,j=25.5hz),51.9,32.4;ms-ei(m/z,%):444[m]
+,
225(100.00);hrms-ei(m/z):calcd for c
19h13
f9o2[m]
+,
444.0766;found,444.0775;ir(film):1723,1263,1241,1231,1187,1126,1054,998,982,762,723,713,641cm-1
.
[0201]
实施例22
[0202]
实施例22制备得到的具体化合物为
[0203]
底物为溴代物,反应时间2h,得白色固体140.2mg,产率96%。1h nmr(500mhz,cdcl3)δ7.78(dd,j=7.7,1.4hz,1h),7.49(td,j=7.5,1.2hz,1h),7.42
–
7.39(m,1h),7.35(d,j=8.0hz,2h),7.32
–
7.29(m,3h),3.48(s,2h),1.24(s,9h);
19
f nmr(376mhz,cdcl3)δ
–
65.4(s,9f);
13
c nmr(126mhz,cdcl3)δ168.3,142.0,141.1,133.2,131.4,130.8,130.6,129.8,129.6,128.7,127.5,122.0(q,j=288.5hz),81.6,59.9(m,j=25.1hz),32.3,27.6;ms-ei(m/z,%):486[m]
+,
211(100.00);hrms-ei(m/z):calcd for c
22h19
f9o2[m]
+,
486.1236;found,486.1230;ir(film):1709,1368,1264,1243,1232,1173,1129,1058,998,982,848,755,724,713,639cm-1
.
[0204]
实施例23
[0205]
实施例23制备得到的具体化合物为
[0206]
底物为溴代物,反应时间2h,得白色固体106.6mg,产率89%。1h nmr(500mhz,cdcl3)δ7.78(d,j=8.6hz,1h),7.67(d,j=1.6hz,1h),7.53(s,1h),7.35(dd,j=8.6,1.7hz,1h),3.63(s,2h);
19
f nmr(376mhz,cdcl3)δ-66.0(s,9f);
13
c nmr(126mhz,cdcl3)δ140.4,137.8,131.2,130.4,125.2,124.2,124.0,121.9(q,j=288.5hz),121.3,59.5(m,j=25.7hz),24.2;ms-ei(m/z,%):400[m]
+,
181(100.00);hrms-ei(m/z):calcd for c
13
h6clf9s[m]
+,
399.9730;found,399.9729;ir(film):1270,1229,1172,1037,997,974,838,795,727,709,660,639cm-1
.
[0207]
实施例24
[0208]
实施例24制备得到的具体化合物为
[0209]
底物为溴代物,反应时间2h,得淡黄色油状物104.6mg,产率88%。1h nmr(500mhz,cdcl3)δ7.27(d,j=4.8hz,1h),6.95(d,j=5.8hz,1h),3.46(s,2h);
19
f nmr(376mhz,cdcl3)δ-66.2(s,9f);
13
c nmr(126mhz,cdcl3)δ130.1,129.0(m),125.9,121.9(q,j=288.3hz),115.9,58.9(m,j=25.9hz),26.3(m);ms-ei(m/z,%):394[m]
+,
175(100.00);hrms-ei(m/z):calcd for c9h4brf9s[m]
+,
393.9068;found,393.9062.
[0210]
实施例25
[0211]
实施例25制备得到的具体化合物为
[0212]
底物为溴代物,反应时间2h,得淡黄色油状物97.6mg,产率86%。1h nmr(500mhz,
cdcl3)δ7.22(s,2h),3.34(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(126mhz,cdcl3)δ151.0,145.4,125.7,121.5(q,j=288.8hz),59.7(m,j=26.4hz),31.1;ms-ei(m/z,%):379[m]
+,
160(100.00);hrms-ei(m/z):calcd for c
10
h4cl2f9n[m]
+,
378.9572;found,378.9574;ir(film):1588,1543,1271,1178,1003,985,713cm-1
.
[0213]
实施例26
[0214]
实施例26制备得到的具体化合物为
[0215]
底物为溴代物,反应时间2h,得淡黄色油状物107.5mg,产率92%。1h nmr(400mhz,cdcl3)δ7.52(t,j=7.7hz,1h),7.44(d,j=7.5hz,1h),7.28(d,j=7.5hz,1h),3.57(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.5(s,9f);
13
c nmr(101mhz,cdcl3)δ152.8,141.4,138.7,127.8,124.8,121.8(q,j=289.0hz),59.7(m,j=26.2hz),34.5;ms-ei(m/z,%):389[m]
+,
310(100.00);hrms-ei(m/z):calcd for c
10
h5brf9n[m]
+,
388.9456;found,388.9460;ir(film):1580,1562,1437,1324,1266,1244,1189,1065,1002,982,746,726,713,677cm-1
.
[0216]
实施例27
[0217]
实施例27制备得到的具体化合物为
[0218]
底物为溴代物,反应时间10h,氟谱产率92%。
19
f nmr(376mhz,dmf):δ
–
66.6(s,9f),with phocf3δ-57.8(s)as internal standard.ms-ei(m/z,%):356[m]
+,
69(100.00).
[0219]
实施例28
[0220]
实施例28制备得到的具体化合物为
[0221]
底物为氯代物,反应时间10h,氟谱产率99%。
19
fnmr(376mhz,dmf):δ
–
66.4(s,9f),with phocf3δ-57.8(s)as internal standard.ms-ei(m/z,%):336[m]
+,
117(100.00).
[0222]
实施例29
[0223]
实施例29制备得到的具体化合物为
[0224]
底物为五氟苯腈,反应时间8h,得无色油状物108.3mg,产率92%。
19
f nmr(376mhz,cdcl3)δ
–
61.0(t,j=25.3hz,9f),
–
123.9(m,2f),
–
129.1(m,2f);
13
c nmr(101mhz,cdcl3)δ148.4(dm,j=263.5hz),146.6(dm,j=264.8hz),120.9(q,j=294.0hz),111.1(t,j=12.5hz),106.0(t,j=3.6hz),98.4(tt,j=17.2,2.9hz),64.6(m,j=29.7hz);ms-ei(m/z,%):393[m]
+,
69(100.00);hrms-ei(m/z):calcd for c
11f13
n[m]
+,
392.9818;found,392.9807.
[0225]
实施例30
[0226]
实施例30制备得到的具体化合物为
[0227]
底物为五氟吡啶,反应时间8h,氟谱产率74%。
19
f nmr(376mhz,dmf):δ
–
60.9(t,j=24.5hz,9f),
–
89.6(m,2f),
–
130.7(m,2f),with phocf3δ-57.8(s)as internal standard.ms-ei(m/z,%):369[m]
+,
69(100.00).
[0228]
实施例31
[0229]
实施例31制备得到的具体化合物为
[0230]
底物为五氟硝基苯,反应时间8h,氟谱产率64%。
19
f nmr(376mhz,dmf):δ
–
61.2(t,j=25.4hz,9f),
–
129.5(m,2f),
–
147.4(m,1f),
–
159.7(m,2f),with phocf3δ-57.8(s)as internal standard.ms-ei(m/z,%):386[m]
+,
217(100.00).
[0231]
实施例32-43的典型操作
[0232][0233]
在手套箱中,向干燥的10ml聚乙烯(pe)管中加入亲电试剂(0.3mmol,1.0equiv),无水csf(423.8mg,2.79mmol,9.3equiv)和超干dmf,然后加入1,1-二溴-2,2-双三氟甲基乙烯(289.7mg,0.9mmol,3.0equiv),盖上盖子,室温下反应。反应结束后,加水,用乙醚萃取,合并有机相,水洗,干燥,过滤后浓缩,快速柱层析得目标产物。
[0234]
实施例32
[0235]
实施例32制备得到的具体化合物为
[0236]
底物为氯代物,反应时间10h,得白色固体97.4mg,产率83%。1h nmr(400mhz,cdcl3)δ7.74(d,j=8.4hz,2h),7.37(d,j=2.2hz,1h),7.32(d,j=8.1hz,2h),6.54(d,j=2.3hz,1h),3.94(s,3h),3.44(s,2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ151.0,133.6,132.0,131.6,129.8,125.4,122.0(q,j=288.8hz),103.1,59.9(m,j=25.5hz),39.2,32.4;ms-ei(m/z,%):390[m]
+,
171(100.00);hrms-ei(m/z):calcd for c
15h11
f9n2[m]
+,
390.0773;found,390.0771.
[0237]
实施例33
[0238]
实施例33制备得到的具体化合物为
[0239]
底物为氯代物,反应时间10h,得白色固体100.2mg,产率89%。1h nmr(400mhz,cdcl3)δ8.61(s,1h),8.10(s,1h),7.66(d,j=8.7hz,2h),7.45(d,j=8.4hz,2h),3.47(s,
2h);
19
f nmr(376mhz,cdcl3)δ-65.4(s,9f);
13
c nmr(101mhz,cdcl3)δ152.7,141.0,136.9,133.1,130.9,121.9(q,j=288.5hz),119.8,59.8(m,j=25.7hz),32.0;ms-ei(m/z,%):377[m]
+,
158(100.00);hrms-ei(m/z):calcd for c
13
h8f9n3[m]
+,
377.0569;found,377.0568.
[0240]
实施例34
[0241]
实施例34制备得到的具体化合物为
[0242]
底物为碘代物,反应时间5h,氟谱产率94%。
19
f nmr(376mhz,dmf):δ
–
66.7(s,9f),with phocf3δ-57.8(s)as internal standard.ms-ei(m/z,%):388[m]
+,
43(100.00).
[0243]
实施例35
[0244]
实施例35制备得到的具体化合物为
[0245]
底物为碘代物,反应时间8h,得淡黄色液体69.3mg,产率73%。1h nmr(400mhz,cdcl3)δ3.34(t,j=6.5hz,2h),2.07
–
2.03(m,2h),1.75
–
1.61(m,4h);
19
f nmr(376mhz,cdcl3)δ-67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ122.2(q,j=287.5hz),58.9(m,j=26.2hz),50.9,29.5,27.2,20.9(m);ms-ei(m/z,%):289[m-n2]
+,
145(100.00);hrms-ei(m/z):calcd for c8h8f9n3[m]
+,
317.0569;found,317.0572.
[0246]
实施例36
[0247]
实施例36制备得到的具体化合物为
[0248]
底物为碘代物,反应时间8h,得无色油状物106.8mg,产率97%。1h nmr(400mhz,cdcl3)δ7.31(t,j=7.3hz,2h),7.23
–
7.18(m,3h),2.66
–
2.62(m,2h),2.04
–
2.00(m,2h),1.73
–
1.64(m,4h),1.43
–
1.35(m,2h);
19
f nmr(376mhz,cdcl3)δ-67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ142.2,128.53,128.51,126.0,122.3(q,j=287.6hz),58.9(m,j=26.2hz),35.8,30.9,29.7,27.6,23.3;ms-ei(m/z,%):366[m]
+,
91(100.00);hrms-ei(m/z):calcd for c
15h15
f9[m]
+,
366.1025;found,366.1021.
[0249]
实施例37
[0250]
实施例37制备得到的具体化合物为
[0251]
底物为碘代物,反应时间8h,得无色油状物103.5mg,产率90%。1h nmr(500mhz,cdcl3)δ7.10(d,j=8.4hz,2h),6.85(d,j=8.5hz,2h),3.80(s,3h),2.61(t,j=7.0hz,2h),2.07
–
2.04(m,2h),1.73
–
1.63(m,4h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(126mhz,cdcl3)δ158.0,133.8,129.3,122.2(q,j=288.0hz),114.0,58.9(m,j=25.9hz),55.4,34.5,32.3,27.5,23.0;ms-ei(m/z,%):382[m]
+,
121(100.00);hrms-ei(m/z):calcd for c
15h15
f9o[m]
+,
382.0974;found,382.0967;ir(film):2925,1613,1513,1468,1235,1175,1146,1090,1037,967,950,820,727,707,658cm-1
.
[0252]
实施例38
[0253]
实施例38制备得到的具体化合物为
[0254]
底物为碘代物,反应时间8h,得白色固体111.7mg,产率88%。1h nmr(400mhz,cdcl3)δ7.64(d,j=9.5hz,1h),7.38(d,j=8.6hz,1h),6.85(dd,j=8.6,2.4hz,1h),6.79(d,j=2.3hz,1h),6.26(d,j=9.5hz,1h),4.06(t,j=5.6hz,2h),2.31
–
2.27(m,2h),2.19
–
2.13(m,2h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ161.7,161.2,156.0,143.4,129.0,122.2(q,j=287.8hz),113.6,113.0,101.4,67.6,58.8(m,j=26.5hz),24.5,23.5(one carbon was not observed);ms-ei(m/z,%):422[m]
+,
134(100.00);hrms-ei(m/z):calcd for c
16h11
f9o3[m]
+,
422.0559;found,422.0562;ir(film):2978,1729,1630,1616,1306,1284,1238,1227,1101,1074,1052,995,968,832,729cm-1
.
[0255]
实施例39
[0256]
实施例39制备得到的具体化合物为
[0257]
底物为碘代物,反应时间8h,得白色固体99.2mg,产率81%。1h nmr(500mhz,cdcl3)δ7.86(dd,j=5.4,3.1hz,2h),7.73(dd,j=5.5,3.0hz,2h),3.73(t,j=6.8hz,2h),2.13
–
2.10(m,2h),2.06
–
1.99(m,2h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(126mhz,cdcl3)δ168.3,134.3,132.0,123.6,122.0(q,j=287.7hz),58.7(m,j=26.2hz),37.7,25.0,23.0;ms-ei(m/z,%):407[m]
+,
160(100.00);hrms-ei(m/z):calcd for c
15h10
f9no2[m]
+,
407.0562;found,407.0564;ir(film):1707,1402,1370,1370,1256,1232,1090,1067,1033,957,892,727,715,710cm-1
.
[0258]
实施例40
[0259]
实施例40制备得到的具体化合物为
[0260]
底物为碘代物,反应时间8h,得白色固体103.9mg,产率72%。1h nmr(500mhz,cdcl3)δ6.78(s,1h),6.71(s,1h),6.42(d,j=8.9hz,1h),6.13(d,j=9.0hz,1h),3.88(s,3h),3.85(s,3h),3.61(s,2h),3.43(s,2h),1.78(s,4h);
19
f nmr(376mhz,cdcl3)δ
–
67.4(s,9f);
13
c nmr(126mhz,cdcl3)δ168.3,150.2,148.2,127.6,126.1,125.0,121.9(q,j=288.2hz),118.8,111.2,109.6,58.5(m,j=26.6hz),56.1,56.1,46.8,43.1,24.0,22.8;ms-ei(m/z,%):479(m
+,
100.00);hrms-ei(m/z):calcd for c
19h18
f9no3[m]
+,
479.1137;found,479.1149;ir(film):2919,1661,1514,1466,1403,1268,1235,1144,1091,1037,950,728,709cm-1
.
[0261]
实施例41
[0262]
实施例41制备得到的具体化合物为
[0263]
底物为碘代物,反应时间8h,得白色固体118.2mg,产率93%。1h nmr(400mhz,cdcl3)δ6.82(d,j=7.8hz,1h),6.73
–
6.70(m,2h),6.01
–
5.91(m,1h),5.11
–
5.06(m,2h),4.04(t,j=5.9hz,2h),3.84(s,3h),3.34(d,j=6.7hz,2h),2.35
–
2.31(m,2h),2.14
–
2.07(m,2h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ150.1,146.4,137.7,134.3,122.3(q,j=288.8hz),120.7,115.9,115.2,112.8,69.4,58.8(m,j=26.3hz),56.0,40.0,24.6,23.8;ms-ei(m/z,%):424(m
+,
100.00);hrms-ei(m/z):calcd for c
17h17
f9o2[m]
+,
424.1079;found,424.1074;ir(film):1511,1459,1352,1337,1264,1227,1189,1166,1140,1101,1039,966,914,801,728,708cm-1
.
[0264]
实施例42
[0265]
实施例42制备得到的具体化合物为
[0266]
底物为碘代物,反应时间8h,得白色固体137.6mg,产率94%。1h nmr(400mhz,cdcl3)δ8.56(d,j=7.3hz,1h),8.10(d,j=8.1hz,1h),7.90(d,j=7.9hz,1h),7.53
–
7.37(m,3h),7.16(t,j=7.5hz,1h),7.00(d,j=8.3hz,1h),4.24(t,j=5.2hz,2h),2.60
–
2.56(m,2h),2.37
–
2.34(m,2h);
19
f nmr(376mhz,cdcl3)δ
–
67.0(s,9f);
13
c nmr(101mhz,cdcl3)δ162.7,156.2,152.2,136.0,131.9,130.0,126.2,125.0,123.0,122.4,122.3(q,j=288.1hz),121.7,121.3,112.0,68.3,58.8(m,j=26.7hz),25.4,24.0;ms-ei(m/z,%):487[m]
+,
240(100.00);hrms-ei(m/z):calcd for c
20h14
f9nos[m]
+,
487.0647;found,487.0645.
[0267]
实施例43
[0268]
实施例43制备得到的具体化合物为
[0269]
底物为碘代物,反应时间8h,得白色固体122.1mg,产率95%。1h nmr(400mhz,cdcl3)δ8.00(d,j=8.7hz,2h),6.90(d,j=8.8hz,2h),4.35(q,j=7.1hz,2h),4.05(t,j=5.6hz,2h),2.31
–
2.27(m,2h),2.17
–
2.11(m,2h),1.38(t,j=7.1hz,3h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ166.4,162.3,131.7,123.6,122.2(q,j=287.6hz),114.1,67.1,60.9,58.8(m,j=26.3hz),24.6,23.6,14.5;ms-ei(m/z,%):426[m]
+,
121(100.00);hrms-ei(m/z):calcd for c
16h15
f9o3[m]
+,
426.0872;found,426.0869.
[0270]
实施例44
[0271]
实施例44制备得到的具体化合物为
[0272]
底物为碘代物,在手套箱中,向干燥的10ml聚乙烯(pe)管中加入无水csf(423.8mg,2.79mmol,9.3equiv)和超干乙腈(3.0ml),然后加入1,1-二溴-2,2-双三氟甲基乙烯(289.7mg,0.9mmol,3.0equiv),盖上盖子,室温反应1小时。加入底物(0.3mmol,1.0equiv)和四丁基碘化铵(221.6mg,0.6mmol,2.0equiv),室温下反应6小时。反应结束后,加水,用乙醚萃取(20ml
×
3),合并有机相,水洗,干燥,过滤后浓缩,快速柱层析可得目标产物,白色固体108.8mg,产率67%。1h nmr(400mhz,cdcl3)δ3.98(d,j=1.0hz,6h),2.46
–
2.42(m,2h),2.02
–
1.98(m,5h),1.59(br.s,2h),1.38
–
1.28(m,14h);
19
f nmr(376mhz,cdcl3)δ
–
67.2(s,9f);
13
c nmr(101mhz,cdcl3)δ184.9,184.3,144.5,144.4,143.2,138.8,122.3(q,j=286.5hz),61.3,58.9(m,j=26.1hz),30.2,29.9,29.5,29.4,29.1,28.9,27.6,26.5,23.3,12.1;ms-ei(m/z,%):540[m]
+,
197(100.00);hrms-ei(m/z):calcd for c
23h29
f9o4[m]
+,
540.1917;found,540.1931;ir(film):2930,2856,1650,1611,1459,1269,1239,1206,1093,947,728,707cm-1
.
[0273]
实施例45
[0274]
实施例45制备得到的具体化合物为
[0275]
底物为苯次磺酰氯,在手套箱中,向干燥的10ml聚乙烯(pe)管中加入无水csf(227.9mg,1.5mmol,5.0equiv)和超干dmf(3.0ml),然后加入1,1-二溴-2,2-双三氟甲基乙烯(114.8mg,0.45mmol,1.5equiv),盖上盖子,室温反应1小时。加入底物(0.3mmol,1.0equiv),室温下反应10分钟。反应结束后,加水,用乙醚萃取(20ml
×
3),合并有机相,水洗,干燥,过滤后浓缩,快速柱层析可得目标产物,无色液体70.7mg,产率72%。放大至6.0mmol:在手套箱中,向干燥的100ml聚乙烯(pe)管中加入无水csf(4.56g,30.0mmol,5.0equiv)和超干dmf(40ml),然后加入1,1-二溴-2,2-双三氟甲基乙烯(2.90g,9.0mmol,1.5equiv),盖上盖子,室温反应1小时。加入底物(6.0mmol,1.0equiv),室温下反应10分钟。反应结束后,加水,用乙醚萃取(80ml
×
3),合并有机相,水洗,干燥,过滤后浓缩,快速柱层析可得目标产物,无色液体1.3875g,产率70%。1h nmr(400mhz,cdcl3)δ7.76(d,j=7.7hz,2h),7.51(t,j=7.5hz,1h),7.40(t,j=7.6hz,2h);
19
f nmr(376mhz,cdcl3)δ-64.8(s,9f);
13
c nmr(101mhz,cdcl3)δ139.1,131.9,129.4,124.2,121.4(q,j=288.4hz),65.5(m,j=27.8hz);ms-ei(m/z,%):328[m]
+,
109(100.00);hrms-ei(m/z):calcd for c
10
h5f9s[m]
+,
327.9963;found,327.9969.
[0276]
实施例46
[0277]
实施例46制备得到的具体化合物为
[0278]
底物为苯基氯化硒,在手套箱中,向干燥的10ml聚乙烯(pe)管中加入无水csf(227.9mg,1.5mmol,5.0equiv)和超干dmf(3.0ml),然后加入1,1-二溴-2,2-双三氟甲基乙
烯(114.8mg,0.45mmol,1.5equiv),盖上盖子,室温反应1小时。加入底物(0.3mmol,1.0equiv),室温下反应4分钟。反应结束后,加水,用乙醚萃取(20ml
×
3),合并有机相,水洗,干燥,过滤后浓缩,快速柱层析可得目标产物,无色油状物79.9mg,产率70%。1h nmr(400mhz,cdcl3)δ7.85(d,j=7.6hz,2h),7.51(t,j=7.5hz,1h),7.39(t,j=7.7hz,2h);
19
f nmr(376mhz,cdcl3)δ63.5(s,9f);
13
c nmr(101mhz,cdcl3)δ139.6,131.6,129.5,122.2,122.1(q,j=285.6hz),58.7(m,j=28.1hz);ms-ei(m/z,%):376[m]
+,
157(100.00);hrms-ei(m/z):calcd for c
10
h5f
974
se[m]
+,
369.9467;found,369.9472.
[0279]
实施例47-65
[0280][0281]
在手套箱中,向干燥的10ml聚乙烯(pe)管中加入底物(0.3mmol,1.0equiv),无水csf(173.2mg,1.14mmol,3.8equiv)和超干乙腈(3.0ml),然后加入1,1-二溴-2,2-双三氟甲基乙烯(115.9mg,0.36mmol,1.2equiv),盖上盖子,置于手套箱内室温反应6小时。反应结束后,加水,用乙醚萃取(20ml
×
3),合并有机相,水洗,干燥,过滤后浓缩,快速柱层析可得目标产物。
[0282]
[0283][0284]
综上所述,本发明的方法可以在各类底物上构建含氟叔碳中心,反应条件温和(可室温反应)、反应速度快,产率高、操作安全无需使用易挥发剧毒物质,可在碳原子已及杂原子上引入含氟叔碳基团,且对底物上官能基团的相容性极好,在其反应条件下,不会破坏底物上的酯基、醚键、酰胺键、烯键等官能团,从而获得更高的产率并降低成本。
[0285]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1