一类抑制RNA解旋酶DHX33的化合物及其应用的制作方法
一类抑制rna解旋酶dhx33的化合物及其应用
技术领域
1.本发明属于药物化学领域,涉及dhx33的小分子抑制剂、包含其的药物组合物、其制备方法、及其用于预防和/或治疗dhx33相关疾病的医药用途。
背景技术:
2.本发明涉及抑制dhx33 rna解旋酶活性的化合物。dhx33属于含有dead/h盒的rna解旋酶蛋白家族。其中的dead/h代表氨基酸的缩写asp
‑
glu
‑
ala
‑
asp/his,这一序列连同其他多个保守性的氨基酸序列,出现在rna解旋酶家族成员的蛋白序列中,高度参与核酸底物结合以及atp水解。虽然这些家族成员共有这些相同的序列,但是每个rna解旋酶都有各自特定的专一性和独特的生物功能。dhx33蛋白的分子量是72kda,具有解旋核酸的功能,它利用atp水解所释放的生物能来驱动改变rna和蛋白质复合物的构象,进而参与多种rna的代谢活动,具体地,从rna转录、剪切、编辑、翻译到降解等一系列生物过程。dhx33的功能并不仅仅局限于对rna分子的修饰,研究表明,除了解旋rna双链之外,dhx33蛋白也参与到dna的代谢。具体,dhx33蛋白可以解开dna的双链结构,并在基因表达过程中起重要作用。
3.研究表明,dhx33通过结合在多种癌症相关的基因启动子,影响了dna的甲基化状态,进而在基因组水平调控多种癌症基因的表达和肿瘤发展相关的信号通路,对细胞生长、增殖、迁移、凋亡、糖代谢等多种细胞活动有至关重要的作用。此外,发现dhx33可以感受外来双链rna分子的侵入并在细胞的先天免疫中发挥重要作用。dhx33作为十分重要的细胞生长调控基因,在多种癌症中高度表达,比如肺癌、淋巴瘤、神经胶质母细胞瘤、乳腺癌、结肠癌、肝癌等。多种癌症的发生发展依赖于dhx33蛋白的高度表达。dhx33的遗传敲除可以显著抑制ras癌基因驱动的肺癌发生发展;体内和体外实验证实,抑制dhx33蛋白后,多种癌症如乳腺癌、结肠癌、脑胶质瘤、淋巴瘤等癌症的发生发展都受到明显抑制。
4.研究表明,dhx33的蛋白功能依赖于其解旋酶活力。dhx33的解旋酶活力缺失突变体不具有dhx33蛋白的功能,无法替代野生型dhx33基因的功能。本发明提供了多种具有抑制dhx33酶活力的化合物结构及合成方法,具有针对多种癌症治疗的潜在价值。
技术实现要素:
5.本发明通过大量的研究,发现了一系列具有抑制dhx33的rna解旋酶活性的小分子化合物,具有预防和/或治疗dhx33相关疾病(例如脑胶质母细胞瘤等癌症)的潜在价值。
6.第一方面,本发明提供了一种具有式i结构的化合物或其药学上可接受的形式:
[0007][0008]
其中,
[0009]
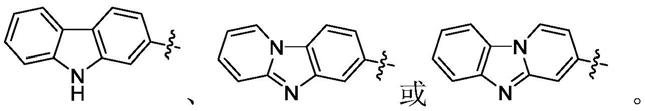
环a选自咔唑环和苯并[4,5]咪唑并[1,2
‑
a]吡啶环;
[0010]
每个r1独立地选自卤素、氨基、硝基、羟基、c1‑4烷基、c1‑4卤代烷基、c1‑4烷氧基、c1‑4卤代烷氧基、
‑
nh(c1‑4烷基)、
‑
n(c1‑4烷基)2或c1‑4羟基烷基;
[0011]
每个r2独立地选自卤素、c1‑4烷基或c1‑4卤代烷基;
[0012]
每个r3独立地选自卤素、氰基、氨基、硝基、羟基、c1‑4烷基、c1‑4卤代烷基、c1‑4烷氧基或c1‑4卤代烷氧基;
[0013]
m选自0、1、2、3或4;
[0014]
n和p独立地选自0、1、2或3;
[0015]
所述药学上可接受的形式选自药学上可接受的盐、酯、立体异构体、互变异构体、溶剂化物、氮氧化物、同位素标记物、代谢物和前药。
[0016]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的环a选自
[0017]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的每个r1独立地选自卤素、氨基、硝基、羟基、c1‑4烷基、c1‑4卤代烷基、c1‑4烷氧基或c1‑4卤代烷氧基。
[0018]
在一些优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r1独立地选自氟、氯、溴、氨基、硝基、羟基、甲基、乙基、异丙基、三氟甲基、甲氧基、乙氧基、异丙氧基或三氟甲氧基。
[0019]
在一些更优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r1独立地选自甲基或甲氧基。
[0020]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的每个r2独立地选自卤素或c1‑4烷基。
[0021]
在一些优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r2独立地选自氟、氯、溴、甲基、乙基或异丙基。
[0022]
在一些更优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r2独立地选自甲基。
[0023]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的每个r3独立地选自卤素、氰基、氨基、硝基、羟基、c1‑4烷基或c1‑4烷氧基。
[0024]
在一些优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r3独立地选自氟、氯、溴、氰基、氨基、硝基、羟基、甲基、乙基、异丙基、甲氧基、乙氧基或异丙氧基。
[0025]
在一些更优选的实施方案中,上述式i化合物或其药学上可接受的形式中的每个r3独立地选自氰基或甲基。
[0026]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的m选自0、1、2或3。
[0027]
在一些优选的实施方案中,上述式i化合物或其药学上可接受的形式中的m选自0、1或2。
[0028]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的n选自0、1或2。
[0029]
在一些实施方案中,上述式i化合物或其药学上可接受的形式中的p选自0、1或2。
[0030]
在一些实施方案中,本发明提供了一种具有式i结构的化合物或其药学上可接受的形式:
[0031][0032]
其中,
[0033]
环a选自
[0034]
每个r1独立地选自氟、氯、溴、氨基、硝基、羟基、甲基、乙基、异丙基、三氟甲基、甲氧基、乙氧基、异丙氧基或三氟甲氧基;
[0035]
每个r2独立地选自氟、氯、溴、甲基、乙基或异丙基;
[0036]
每个r3独立地选自氟、氯、溴、氰基、氨基、硝基、羟基、甲基、乙基、异丙基、甲氧基、乙氧基或异丙氧基;
[0037]
m选自0、1、2或3;
[0038]
n和p独立地选自0、1或2;
[0039]
所述药学上可接受的形式选自药学上可接受的盐、酯、立体异构体、互变异构体、溶剂化物、氮氧化物、同位素标记物、代谢物和前药。
[0040]
在一些实施方案中,上述式i化合物或其药学上可接受的形式为式i
‑
1至式i
‑
3化合物或其药学上可接受的形式:
[0041][0042]
其中r1、r2、r3、n和p如式i中所定义;q选自0、1或2。
[0043]
本领域技术人员应当理解,本发明涵盖针对各个实施方案进行任意组合所得的化合物。由一个实施方案中的技术特征或优选技术特征与另外的实施方案中的技术特征或优选技术特征组合得到的实施方案也包括在本发明的范围内。
[0044]
第二方面,本发明还提供了如下化合物或其药学上可接受的盐、酯、立体异构体、
互变异构体、溶剂化物、氮氧化物、同位素标记物、代谢物或前药:
[0045][0046][0047]
第三方面,本发明提供了一种药物组合物,其包含至少一种上述式i、式i
‑
1至式i
‑
3化合物或其药学上可接受的形式,以及一种或多种药学上可接受的载体。
[0048]
第四方面,本发明提供了上述式i、式i
‑
1至式i
‑
3化合物或其药学上可接受的形式、或者上述药物组合物,其用作dhx33抑制剂,用于预防和/或治疗至少部分由dhx33介导的疾病或病症(例如脑胶质母细胞瘤等癌症)。
[0049]
第五方面,本发明提供了上述具有式i、式i
‑
1至式i
‑
3化合物或其药学上可接受的形式或者上述药物组合物在制备用于预防和/或治疗至少部分由dhx33介导的疾病或病症(例如脑胶质母细胞瘤等癌症)的药物中的用途。
[0050]
第六方面,本发明提供了一种用于预防和/或治疗至少部分由dhx33介导的疾病或病症(例如脑胶质母细胞瘤等癌症)的方法,其包括以下步骤:将预防和/或治疗有效量的上述式i、式i
‑
1至式i
‑
3化合物或其药学上可接受的形式或者上述药物组合物施用于对其有需求的个体。
[0051]
本发明不限于文中所述的特定实施方案;还应该理解,文中所使用的术语仅用于描述而非限制特定实施方案。
[0052]
术语定义
[0053]
除非另有说明,下列术语在本发明中的含义如下。
[0054]
术语“包含”、“包括”、“具有”或“含有”或其任何其它变体旨在涵盖非排他性或开放式的包含内容。例如,包含一系列元素的组合物、方法或装置不一定仅限于已明确列出的元素,而是可能还包含其它未明确列出的元素或上述组合物、方法或装置所固有的元素。
[0055]
当数值范围的下限和上限被公开时,落入该范围中的任何数值或任何亚范围都表示被具体公开。特别地,本文中所公开的参数的每一个数值范围(例如,以“约a至b”,或同等的“大约a至b”,或同等的“约a
‑
b”的形式)均应理解为涵盖其中的每一个数值和亚范围。例
如,“c1‑
4”应理解为涵盖其中的任意亚范围以及每一个点值,如c2‑4、c3‑4、c1‑2、c1‑3、c1‑4等,以及c1、c2、c3、c4等。
[0056]
术语“药物组合物”是指可以用作药物的组合物,其包含药物活性成分(或治疗剂)以及可选的一种或多种药学上可接受载体。术语“药学上可接受的载体”是指与治疗剂一同给药的辅料,并且其在合理的医学判断的范围内适于接触人类和/或其它动物的组织而没有过度的毒性、刺激性、过敏反应或与合理的益处/风险比相应的其它问题或并发症。在本发明中可使用的药学上可接受的载体包括但不限于:a)稀释剂;b)润滑剂;c)粘合剂;d)崩解剂;e)吸收剂、着色剂、调味剂和/或甜味剂;f)乳化剂或分散剂;和/或g)增强化合物的吸收的物质等。
[0057]
上述药物组合物可以系统地作用和/或局部地作用。为此目的,它们可以通过适合的途径给药,例如通过胃肠外、局部、静脉内、口服、皮下、动脉内、真皮内、经皮、直肠、颅内、腹膜内、鼻内、肌内途径或作为吸入剂给药。
[0058]
上述给药途径可以通过适合的剂型来实现。在本发明中可使用的剂型包括但不限于:片剂、胶囊剂、锭剂、硬糖剂、散剂、喷雾剂、乳膏剂、软膏剂、栓剂、凝胶剂、糊剂、洗剂、软膏剂、水性混悬剂、可注射溶液剂、酏剂、糖浆剂等。
[0059]
当口服给药时,可将上述药物组合物制成任意口服可接受的制剂形式,包括但不限于片剂、胶囊剂、水溶液剂、水混悬剂等。
[0060]
上述药物组合物还可以无菌注射剂的形式给药,包括无菌注射水或油混悬剂,或者无菌注射水或油溶液剂。其中,可使用的载体包括但不限于:水、林格氏溶液和等渗氯化钠溶液。另外,灭菌的非挥发油也可用作溶剂或悬浮介质,如单甘油酯或二甘油酯。
[0061]
上述药物组合物可以包含0.01mg至1000mg的至少一种上述式i、式i
‑
1至式i
‑
3化合物或其药学上可接受的形式。
[0062]
术语“至少部分由dhx33介导的疾病或病症”是指发病机理中至少包含一部分与dhx33有关的因素的疾病,例如脑胶质母细胞瘤等癌症。
[0063]
术语“有效量”是指能够诱发细胞、组织、器官或生物体(例如个体)产生生物或医学反应,并且足以实现所需预防和/或治疗效果的剂量。
[0064]
可调整给药方案以提供最佳所需响应。例如,可单次给药,可随时间分剂量给药,或可根据实际情况按比例减少或增加剂量后给药。可以理解的是,对于任何特定个体,具体的给药方案应根据需要以及给药组合物或监督组合物的给药人员的专业判断而调整。
[0065]
术语“对其有需求”是指医生或其它护理人员对个体需要或者将要从预防和/或治疗过程中获益的判断,该判断的得出基于医生或其它护理人员在其专长领域中的各种因素。
[0066]
术语“个体”(或称受试者)是指人类或非人动物。本发明的个体包括患有疾病和/或病症的个体(患者)和正常的个体。本发明的非人动物包括所有脊椎动物,例如非哺乳动物,例如鸟类、两栖类、爬行类等,和哺乳动物,例如非人灵长类、家畜和/或驯化动物(例如绵羊、犬、猫、奶牛、猪等)。
[0067]
术语“治疗”是指减轻或消除所针对的疾病或病症。如果受试者接受了治疗量的本发明的化合物或其药学上可接受的形式或者本发明的药物组合物,该受试者的至少一种指标和症状表现出可观察到的和/或可检测出的缓解和/或改善,则表明该受试者已被成功地
“
治疗”。可以理解的是,治疗不仅包括完全地治疗,还包括未达到完全地治疗,但实现了一些生物学或医学相关的结果。具体而言,“治疗”表示本发明的化合物或其药学上可接受的形式或者本发明的药物组合物可以实现下列效果中的至少一种,例如:(1)在可能有疾病倾向,但尚未经历或显示疾病病理学或症状学的动物中防止疾病发生;(2)在正在经历或显示疾病病理学或症状学的动物中抑制疾病(即阻止病理学和/或症状学的进一步发展);(3)在正在经历或显示疾病病理学或症状学的动物中改善疾病(即逆转病理学和/或症状学)。
[0068]
术语“药学上可接受的盐”是指对生物体基本上无毒性的,本发明的化合物的盐。药学上可接受的盐通常包括但不限于本发明的化合物与药学上可接受的无机/有机酸或无机/有机碱反应而形成的盐,此类盐又被称为酸加成盐或碱加成盐。适合的盐的综述参见,例如,jusiak,soczewinski,et al.,remington’s pharmaceutical sciences[m],mack publishing company,2005和stahl,wermuth,handbook of pharmaceutical salts:properties,selection,and use[m],wiley
‑
vch,2002。用于制备本发明的化合物的药学上可接受的盐的方法是本领域技术人员已知的。
[0069]
术语“药学上可接受的酯”是指对生物体基本上无毒性的,在生物体体内水解成本发明的化合物或其盐的酯。药学上可接受的酯通常包括但不限于本发明的化合物与药学上可接受的羧酸或磺酸形成的酯,此类酯又被称为羧酸酯或磺酸酯。
[0070]
术语“异构体”是指因具有相同的原子数和原子类型而具有相同的分子量,但原子的空间排列或构型不同的化合物。
[0071]
术语“立体异构体”(或称“旋光异构体”)是指由于具有至少一个手性因素(包括手性中心、手性轴、手性面等)而导致具有垂直的不对称平面,从而能够使平面偏振光旋转的稳定异构体。由于本发明的化合物存在可能导致立体异构的不对称中心以及其它化学结构,因此本发明也包括这些立体异构体及其混合物。除非另外指出,本发明的化合物的所有立体异构体形式都在本发明的范围之内。
[0072]
术语“互变异构体”(或称“互变异构形式”)是指具有不同能量的,可通过低能垒互相转化的结构异构体。若互变异构是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(或称质子转移互变异构体)包括但不限于通过质子迁移来进行的互相转化,如酮
‑
烯醇异构化、亚胺
‑
烯胺异构化、酰胺
‑
亚胺醇异构化等。除非另外指出,本发明的化合物的所有互变异构体形式都在本发明的范围之内。
[0073]
术语“溶剂化物”是指由本发明的化合物(或其药学上可接受的盐)与至少一种溶剂分子通过非共价分子间作用力结合而形成的物质。例如,溶剂化物包括但不限于水合物(包括半水合物、一水合物、二水合物、三水合物等)、乙醇合物、丙酮合物等。
[0074]
术语“氮氧化物”是指叔胺类或含氮(芳)杂环类化合物结构中的氮原子经氧化而形成的化合物。例如,式i化合物母核中的氮原子可以形成相应的氮氧化物。
[0075]
术语“同位素标记物”是指将本发明的化合物中的特定原子替换为其同位素原子而形成的衍生化合物。除非另外指出,本发明的化合物包括h、c、n、o、f、p、s、cl的各种同位素,例如但不限于2h(d)、3h(t)、
13
c、
14
c、
15
n、
17
o、
18
o、
18
f、
31
p、
32
p、
35
s、
36
s和
37
cl。
[0076]
术语“代谢物”是指本发明的化合物经代谢后形成的衍生化合物。关于代谢的进一步信息可参见goodman and gilman's:the pharmacological basis of therapeutics(9
th ed.)[m],mcgraw
‑
hill international editions,1996。本发明涵盖本发明的化合物的所
有可能的代谢物形式,即在施用本发明的化合物的个体体内形成的物质。化合物的代谢物可以通过所属领域的公知技术来鉴定,其活性可以通过试验来表征。
[0077]
术语“前药”是指在施用于个体后能够直接或间接地提供本发明的化合物的衍生化合物。特别优选的衍生化合物或前药是在施用于个体时可以提高本发明的化合物的生物利用度的化合物(例如,更易吸收入血),或者促进母体化合物向作用位点(例如,淋巴系统)递送的化合物。除非另外指出,本发明的化合物的所有前药形式都在本发明的范围之内,且各种前药形式是本领域已知的,例如参见t.higuchi,v.stella,pro
‑
drugs as novel drug delivery systems[j],american chemical society,vol.14,1975。此外,本发明还涵盖含有保护基的本发明的化合物。在制备本发明的化合物的任何过程中,保护在任何有关分子上的敏感基团或反应基团可能是必需的和/或期望的,由此形成本发明的化合物的化学保护的形式。这可以通过常规的保护基实现,例如在t.w.greene,p.g.m.wuts,protective groups in organic synthesis[m],john wiley&sons,2006中描述的保护基。使用本领域已知的方法,在适当的后续阶段可以移除这些保护基。
[0078]
术语“独立地”是指结构中存在的取值范围相同或相近的至少两个基团(或环系)可以在特定情形下具有相同或不同的含义。例如,取代基x和取代基y独立地为氢、卤素、羟基、氰基、烷基或芳基,则当取代基x为氢时,取代基y既可以为氢,也可以为卤素、羟基、氰基、烷基或芳基;同理,当取代基y为氢时,取代基x既可以为氢,也可以为卤素、羟基、氰基、烷基或芳基。
[0079]
在本文中单独或与其它基团组合使用时,术语“卤素”是指氟(f)、氯(cl)、溴(br)和碘(i)。
[0080]
在本文中单独或与其它基团组合使用时,术语“烷基”是指直链或支链的脂肪族烃基。例如,本发明中所使用的术语“c1‑4烷基”是指具有1至4个碳原子的烷基。例如,烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、或叔丁基等。
[0081]
在本文中单独或与其它基团组合使用时,术语“卤代烷基”是指被一或多个(诸如1至3个)相同或不同的卤素原子取代的烷基。例如,本发明中所使用的术语“c1‑4卤代烷基”是指具有1至4个碳原子的卤代烷基。例如,卤代烷基包括但不限于
‑
ch2f、
‑
chf2、
‑
cf3、
‑
ch2cf3、
‑
cf2cf3、
‑
ch2ch2cf3、
‑
ch2cl等。
[0082]
在本文中单独或与其它基团组合使用时,术语“羟基烷基”是指被一或多个(诸如1至3个)羟基取代的烷基。例如,本发明中所使用的术语“c1‑4羟基烷基”是指具有1至4个碳原子的羟基烷基。例如,羟基烷基包括但不限于子的羟基烷基。例如,羟基烷基包括但不限于等。
[0083]
在本文中单独或与其它基团组合使用时,术语“烷氧基”是指通过氧原子与分子的其余部分连接的烷基。例如,烷氧基包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基等。
[0084]
在本文中单独或与其它基团组合使用时,术语“卤代烷氧基”是指一价的直链或支链的卤代烷基
‑
o
‑
基团,其被至少一个选自氟、氯、溴和碘的原子取代,可以含有不饱和度,并且通过一个与氧原子相连的单键连接至其它基团,例如c1‑4卤代烷氧基。例如,卤代烷氧基包括但不限于氟甲氧基(
‑
och2f)、二氟甲氧基(
‑
ochf2)、三氟甲氧基(
‑
ocf3)、1
‑
氟乙氧基
(
‑
ochfch3)、2
‑
氟乙氧基(
‑
och2ch2f)、1,2
‑
二氟乙氧基(
‑
ochfch2f)、2,2
‑
二氟乙氧基(
‑
och2chf2)、1,2,2
‑
三氟乙氧基(
‑
ochfchf2)、2,2,2
‑
三氟乙氧基(
‑
och2cf3)等。
[0085]
在本文中单独或与其它基团组合使用时,术语“羟基”是指
‑
oh。
[0086]
在本文中单独或与其它基团组合使用时,术语“氰基”是指
‑
cn。
[0087]
在本文中单独或与其它基团组合使用时,术语“氨基”是指
‑
nh2。
具体实施方式
[0088]
为了使本发明的目的和技术方案更加清楚,以下结合实施例对本发明的实施方案进行详细描述。但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。
[0089]
实施例中所使用的试剂或仪器均为可以通过市购获得的常规产品。未注明具体条件者,均按照常规条件或制造商建议的条件进行。本发明中所使用的术语“室温”是指20℃
±
5℃。在用于修饰某一数值或数值范围时,本发明中所使用的术语“约”是指包括该数值或数值范围以及该数值或数值范围的本领域技术人员可接受的误差范围,例如该误差范围为
±
10%、
±
5%、
±
4%、
±
3%、
±
2%、
±
1%、
±
0.5%等。
[0090]
以下实施例中记载的化合物的结构通过核磁共振(nmr)和/或质谱(ms)来确定。
[0091]
核磁共振(nmr)的测定仪器使用bruker 400mhz核磁共振仪,测定溶剂为氘代甲醇(cd3od)、氘代氯仿(cdcl3)、六氘代二甲基亚砜(dmso
‑
d6),内标物质为四甲基硅烷(tms)。
[0092]
以下实施例中的核磁共振(nmr)数据中的缩写代表的含义如下:
[0093]
s:单峰、d:二重峰、t:三重峰、q:四重峰、dd:双二重峰、qd:四二重峰、ddd:双双二重峰、ddt:双双三重峰、dddd:双双双二重峰、m:多重峰、br:宽峰、j:偶合常数、hz:赫兹、δ:化学位移。
[0094]
全部化学位移(δ)值以百万分之一(ppm)的单位给出。
[0095]
质谱(ms)的测定仪器使用agilent 6120b质谱仪,离子源为电喷雾离子源(esi)。
[0096]
hplc的测定使用安捷伦1200dad高压液相色谱仪(sunfirc c18,150x 4.6mm,5μm,色谱柱)和waters 2695
‑
2996高压液相色谱仪(gimini c18,150x 4.6mm,5μm色谱柱)。
[0097]
薄层层析硅胶板使用青岛海洋gf254硅胶板,薄层色谱法(tlc)使用的硅胶板采用的规格是0.15mm
‑
0.2mm,薄层层析分离纯化产品采用的规格是0.4mm
‑
0.5mm硅胶板。
[0098]
柱层析一般使用青岛海洋200
‑
300目硅胶为载体。
[0099]
实施例中的反应进程的监测采用薄层色谱法(tlc),反应所使用的展开剂的体系有a:二氯甲烷和甲醇体系;b:石油醚和乙酸乙酯体系,溶剂的体积比根据化合物的极性不同而进行调节。
[0100]
纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂的体系包括a:二氯甲烷和甲醇体系;b:石油醚和乙酸乙酯体系,溶剂的体积比根据化合物的极性不同而进行调节,也可以加入少量的三乙胺和酸性或碱性试剂等进行调节。
[0101]
化合物的合成
[0102]
实施例1:化合物ab24350(2
‑
(3
‑
(7
‑
甲氧基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)的合成
[0103]
(1)化合物3(2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑)
的制备
[0104][0105]
将化合物1(2
‑
溴
‑7‑
甲氧基咔唑)(300mg,1.08mmol,1eq)溶解于1,4
‑
二氧六环(2ml)中,加入化合物2(联硼酸频那醇酯)(331mg,1.30mmol,1.2eq)、乙酸钾(213mg,2.17mmol,2.0eq)和1,1'
‑
双(二苯基膦)二茂铁(24mg,0.032mmol,0.03eq)。在有氮气保护的条件下,将混合物加热到90℃反应16个小时。待反应完成后,将混合物用快速柱色谱(石油醚/乙酸乙酯=50/1至25/1至10/1)纯化,获得黄色固体化合物3(2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑)(314mg,产率:89%)。ms(esi)m/z:324[m+h
+
]。tlc:石油醚/乙酸乙酯(5/1);r
f
(化合物1)=0.4;r
f
(化合物2)=0.3;1h nmr(400mhz,cdcl3)δ7.98
‑
7.93(m,3h),7.85(s,1h),7.65(d,j=7.2hz,1h),6.91(s,1h),6.84(d,j=8.4hz,1h),3.89(s,3h),1.38(s,12h)。
[0106]
(2)化合物5(2
‑
(3
‑
溴
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)的合成
[0107][0108]
将粗提化合物4(2
‑
(2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(300mg,1.38mmol,1.0eq)溶解于四氢呋喃(10ml)中,在
‑
78℃的条件下加入n
‑
溴代丁二酰亚胺(269mg,1.51mmol,1.09eq)。将混合物于
‑
78℃的条件下搅拌0.5小时。将混合物用水稀释后,用乙酸乙酯萃取。有机层干燥,过滤并浓缩。残余物用快速柱色谱(石油醚/乙酸乙酯=10/1)纯化,获得黄色固体化合物5(2
‑
(3
‑
溴
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(216mg,产率:53%)。ms(esi)m/z:295[m+h
+
]。tlc:石油醚/乙酸乙酯(10/1);r
f
(化合物4)=0.6;r
f
(化合物5)=0.5。
[0109]
(3)化合物ab24350(2
‑
(3
‑
(7
‑
甲氧基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)的制备
[0110][0111]
将化合物3((2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑))(164mg,0.508mmol,1.5eq)溶解于1,4
‑
二氧六环和水的混合物(1.5ml/0.3ml)中,加入化合物5(2
‑
(3
‑
溴
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(100mg,0.339mmol,
1.0eq)、碳酸铯(221mg,0.678mmol,2.0eq)、乙酸钯(4mg,0.0169mmol,0.05eq)和1,1'
‑
双(二苯基膦)二茂铁(19mg,0.0339mmol,0.3eq)。将混合物放在封闭的试管内于
‑
78℃的条件下搅拌反应3个小时。待反应完成后,将混合物浓缩,用快速柱色谱纯化(石油醚/乙酸乙酯=20/1至10/1),获得灰白色固体化合物ab24350(2
‑
(3
‑
(7
‑
甲氧基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)(27mg,产率:19.3%)。ms(esi)m/z:412[m+h
+
]。1h nmr(400mhz,dmso
‑
d6)δ11.05(s,1h),7.95
‑
7.90(m,2h),7.38(s,1h),7.28(s,1h),7.15(d,j=7.6hz,1h),6.93(s,1h),6.73(d,j=8hz,1h),6.28(s,1h),3.81(s,3h),2.51(s,3h),2.21(s,3h),2.09(s,3h)。
[0112]
实施例2:化合物ab24374(2
‑
(3
‑
(7
‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)的合成
[0113]
(1)化合物7(4
‑
溴
‑5‑
甲基
‑2‑
硝基苯重氮四氟硼酸盐)的合成
[0114][0115]
将化合物6(4
‑
溴
‑5‑
甲基
‑2‑
硝基苯胺)(1g,4.33mmol,1eq)溶解于二氯甲烷(100ml)中,于0℃条件下加入三氟化硼乙醚配合物(737mg,5.19mmol,1.2eq),而后加入亚硝酸叔丁酯(669mg,6.49mmol,1.5eq)。将反应物于室温搅拌40分钟。待反应完成后,将混合物过滤,固体物用真空干燥获得白色固体化合物7(4
‑
溴
‑5‑
甲基
‑2‑
硝基苯重氮四氟硼酸盐)(1.03g,产率:72.1%)。ms(esi)m/z:330.0[m
‑
h
+
]。tlc:石油醚/乙酸乙酯(10/1);r
f
(化合物6)=0.2;r
f
(化合物7)=0.7。
[0116]
(2)化合物9(4
‑
溴
‑
4'
‑
甲氧基
‑5‑
甲基
‑2‑
硝基
‑
1,1'
‑
联苯)的制备
[0117][0118]
将化合物7(4
‑
溴
‑5‑
甲基
‑2‑
硝基苯重氮四氟硼酸盐)(1.03g,3.16mmol,1.1eq)和化合物8((4
‑
甲氧基苯基)硼酸)(436mg,2.87mmol,1.0eq)溶解于1,4
‑
二氧六环(100ml)中,加入乙酸钯(19mg,0.08mmol,0.03eq)。在有氮气保护条件下,将混合物于室温搅拌反应两个小时。待反应完成后,将混合物用快速柱色谱(石油醚/乙酸乙酯=10/1)纯化获得黄色固体化合物9(4
‑
溴
‑
4'
‑
甲氧基
‑5‑
甲基
‑2‑
硝基
‑
1,1'
‑
联苯)(611mg,产率:60.2%)。ms(esi)m/z:322.1[m+h
+
]。tlc:石油醚/乙酸乙酯(10/1);r
f
(化合物7)=0.7;r
f
(化合物9)=0.6。
[0119]
(3)化合物10(2
‑
溴
‑7‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑)的制备
[0120][0121]
将化合物9(4
‑
溴
‑
4'
‑
甲氧基
‑5‑
甲基
‑2‑
硝基
‑
1,1'
‑
联苯)(300mg,0.93mmol,1eq)加入磷酸三乙酯(3ml)中,将反应物加热到200℃,搅拌30分钟。待反应完成后,将混合物冷却到室温,过滤,获得的固体物用真空干燥后获得白色固体化合物10(2
‑
溴
‑7‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑)(120mg,产率:60.2%)。ms(esi)m/z:290.1[m+h
+
]。tlc:石油醚/乙酸乙酯(10/1);r
f
(化合物9)=0.6;r
f
(化合物10)=0.4。
[0122]
(4)化合物11(7
‑
甲氧基
‑3‑
甲基
‑2‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑)的制备
[0123][0124]
将化合物10(2
‑
溴
‑7‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑)(120mg,0.40mmol,1eq)和(bpin)2(123mg,0.49mmol,1.2eq)溶解于1,4
‑
二氧六环(10ml)中,加入乙酸钾(79mg,0.81mmol,2eq)、[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(34mg,0.04mmol,0.1eq)。在有氮气保护的条件下,将混合物加热到90℃搅拌两个小时。待反应完成后,将混合物用快速柱色谱(二氯甲烷/甲醇=100/1)纯化后获得白色固体化合物11(7
‑
甲氧基
‑3‑
甲基
‑2‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑)(130mg,产率:94.2%)。ms(esi)m/z:338.1[m+h
+
]。tlc:石油醚/乙酸乙酯(5/1);r
f
(化合物10)=0.3;r
f
(化合物11)=0.2。
[0125]
(5)化合物ab24374(2
‑
(3
‑
(7
‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)的制备方法
[0126][0127]
化合物11((7
‑
甲氧基
‑3‑
甲基
‑2‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)
‑
9h
‑
咔唑))(100mg,0.30mmol,1.5eq)和化合物5(2
‑
(3
‑
溴
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(60mg,0.20mmol,1.0eq)溶解于1,4
‑
二氧六环和水的混合物(3ml/0.6ml)中,而后加入碳酸铯(130mg,0.40mmol,2eq)、乙酸钯(24mg,0.10mmol,0.5eq)和1,1'
‑
双二苯基膦二茂铁(110mg,0.20mmol,0.1eq)。在有氮气保护的条件下,将反应物加热到100℃,搅拌反应两个小时。待反应完成后,将混合物用水(20ml)稀释,而后用二氯甲烷萃取三次(20ml
×
3)。将有机层干燥,过滤,浓缩。将残余物用制备型薄层色谱(石油醚/乙酸乙酯=5:
1)纯化后,获得白色固体化合物ab24374(2
‑
(3
‑
(7
‑
甲氧基
‑3‑
甲基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)(6mg,产率:6.9%)。ms(esi)m/z:426.15[m+h
+
]。1h nmr(400mhz,dmso
‑
d6)δ10.90(s,1h),7.88(d,j=4hz,1h),7.82(s,1h),7.27(s,1h),7.15(s,1h),6.91(s,1h),6.71(s,1h),6.06(s,1h),3.81(s,3h),2.30(s,3h),2.11(s,3h),1.93(s,3h),1.21(s,3h)。
[0128]
实施例3:化合物ab24375(2
‑
(3
‑
(6
‑
甲氧基
‑
9h
‑
咔唑
‑2‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
甲腈)的合成
[0129]
以与实施例2相同的方式获得化合物ab24375(产率:8.5%),1h nmr(400mhz,cdcl3)δ8.01(d,j=4hz,1h),7.92(s,1h),7.53(s,1h),7.33(s,1h),7.31(s,1h),7.04(s,1h),6.91(s,1h),6.24(s,1h),3.93(s,3h),2.54(s,3h),2.29(s,3h),2.18(s,3h)。
[0130]
实施例4:化合物ab24385(2
‑
(3
‑
(2
‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶
‑7‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)的合成
[0131]
(1)化合物14(7
‑
溴
‑2‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶)的合成
[0132][0133]
将化合物12(4
‑
溴
‑2‑
碘苯甲胺)(5g,16.78mmol,1eq)和化合物13(2
‑
溴
‑5‑
甲氧基吡啶)(4.7g,25.17mmol,1.5eq)溶解于二甲苯(50ml)中,加入碘化亚铜(639mg,3.35mmol,0.2eq)、碳酸铯(16.4g,50.34mmol,2eq)和1,10
‑
菲罗啉(1.2g,6.71mmol,0.4eq)。将混合物加热到120℃搅拌16小时。待反应完成后,将混合物用快速柱色谱(二氯甲烷/甲醇=300/1至250/1)纯化后获得黑色油状化合物14(7
‑
溴
‑2‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶)(390mg,产率:8.3%)。ms(esi)m/z:277.1[m+h
+
]。tlc:二氯甲烷/甲醇(20/1);r
f
(化合物12)=0.8;r
f
(化合物14)=0.3。
[0134]
(2)化合物16(2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)苯并[4,5]咪唑并[1,2
‑
a]吡啶)的合成
[0135][0136]
将化合物14(7
‑
溴
‑2‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶)(330mg,1.19mmol,1eq)和化合物15(联硼酸频那醇酯)(906mg,3.57mmol,3eq)溶解于1,4二氧六环(10ml),加入碳酸钾(350mg,3.57mmol,3eq)、[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(44mg,0.059mmol,0.05eq)和1,1'
‑
双(二苯基膦)二茂铁(66mg,0.119mmol,0.1eq)。将反应物加热到100℃搅拌16小时。待反应完成后,将混合物用快速柱色谱(二氯甲烷/甲醇=100/1)纯化获得黑色油状化合物16(2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)苯并[4,5]咪唑并[1,2
‑
a]吡啶)(210mg粗提物)。ms(esi)m/z:415.10[m+h
+
]。tlc:二氯甲烷/甲醇
(30/1);r
f
(化合物14)=0.4;r
f
(化合物16)=0.4。
[0137]
(3)化合物ab24385(2
‑
(3
‑
(2
‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶
‑7‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)的制备
[0138][0139]
向化合物16(2
‑
甲氧基
‑7‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)苯并[4,5]咪唑并[1,2
‑
a]吡啶)(210mg,0.648mmol,1eq)和化合物5(2
‑
(3
‑
溴
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(247mg,0.842mmol,1.3eq)在1,4
‑
二氧六环/水(5ml/0.5ml)的混合物中加入碳酸铯(422mg,1.29mmol,2eq)、乙酸钯(8mg,0.032mmol,0.05eq)和1,2
‑
二(二苯基膦基)乙烷(36mg,0.064mmol,0.1eq)。将混合物加热到100℃搅拌16小时。待反应完成后,将混合物用水(20ml)稀释,并用二氯甲烷萃取三次(20ml
×
3)。将有机层干燥过滤浓缩,残余物用制备型高压液相色谱纯化获得黄色固体ab24385(2
‑
(3
‑
(2
‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶
‑7‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)(9mg,产率:3.3%)。ms(esi)m/z:413.1[m+h
+
]。1h nmr(400mhz,cd3od
‑
d4):δ8.48(s,1h),8.17(d,j=6.8hz,1h),7.73(s,1h),7.58(d,j=8.4hz,1h),7.46(d,j=8.4hz,1h),7.41(d,j=8.0hz,1h),7.09(s,1h),6.25(s,1h),3.95(s,3h),2.56(s,3h),2.25(s,3h),2.16(s,3h)。
[0140]
实施例5:化合物ab24379(2
‑
(3
‑
(3
‑
甲氧基苯并[4,5]咪唑并[1,2
‑
a]吡啶
‑7‑
基)
‑
2,5
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)
‑5‑
甲基噻吩
‑3‑
腈)的合成
[0141]
以与实施例4相同的方式获得化合物ab24379(产率:2.0%),1h nmr(400mhz,cd3od
‑
d4):δ8.70(s,1h),8.48(s,1h),7.64(s,1h),7.35(s,1h),7.09(s,1h),6.93(s,1h),6.74(s,1h),6.24(s,1h),3.97(s,3h),2.56(s,3h),2.25(s,3h),2.16(s,3h)。
[0142]
药理活性测试
[0143]
重组rna解旋酶dhx33的制备
[0144]
蛋白质的分离纯化参见wang x,ge w,and zhang y.recombinant dhx33 protein possesses dual dna/rna helicase activity.biochemistry.2019;58(4):250
‑
8。将几种不同的rna解旋酶基因(小鼠dhx33基因)克隆到pet32m
‑
3c载体的bamh i/not i酶切位点之间。然后将质粒转化到大肠杆菌菌株bl
‑
21plyss(de3)中,加入0.5mm异丙基1
‑
硫代
‑
β
‑
d
‑
吡喃半乳糖苷(iptg),在16℃诱导重组蛋白表达16小时。将细胞沉淀并重悬于细胞裂解缓冲液[50mm tris
‑
hcl(ph7.2),150mm nacl,1%triton x
‑
100和添加有蛋白酶抑制剂的50mm咪唑]中。然后将细胞超声处理并以13000rpm的转速离心25分钟。将上清液与tris缓冲液平衡的镍
‑
次氮基三乙酸珠温育,然后充分洗涤。然后用tris缓冲液中的300mm咪唑洗脱提纯的蛋白质,然后在4℃下对不含咪唑的tris缓冲液透析过夜。
[0145]
dhx33解旋酶活力分析
[0146]
将解旋酶活性反应成分添加到96孔不透明白色板中。方法概述如下:将中性抗生物素蛋白(neutravidin)以10μg/ml(100μl/孔)的终浓度在4℃下包被在96孔板上过夜。随
后将中性抗生物素蛋白包被的板用100μl的0.1%(w/v)bsa(溶于常规pbs中)在22℃封闭2小时。洗涤后,加入由两条寡dna单链(一条单链的序列为生物素标记的5'
‑
gctgaccctgctcccaatcgtaatctatag
‑
3';另一条单链的序列为dig标记的5'
‑
cgattgggagcagggtcagc
‑
3')所退火产生的dna双链体[2.5ng,退火反应在含1m nacl的浓度为1m的pbs(ph7.0)中进行],并在22℃温育4小时。加入90μl反应混合物后开始解旋酶反应[纯化的全长dhx33蛋白0.25μg,溶解于25mm 4
‑
mops(ph 7.0),5mm atp,2mm dtt,3mm mncl2和100μg/ml bsa]。在37℃下反应60分钟。洗涤后,每个孔用封闭溶液[10%(w/v)bsa在0.1m马来酸和0.15m nacl(ph7.5)中]培育30分钟,然后与20μl抗体溶液一起温育(抗
‑
dig
‑
ap,roche,在封闭缓冲液中)30分钟。用100μl检测缓冲液[0.1m tris
‑
hcl和0.1m nacl(ph9.5)]洗涤后,然后将1μl化学发光底物(cspd
‑
0.25mm)加入各孔,并将板在17℃温育5分钟。然后将板拍干并在37℃下温育30分钟。通过发光多孔板读数器(enspire,perkinelmer)对每个孔中剩余的dig
‑
ap标记物对照计数10分钟。
[0147]
细胞半抑制浓度(ec
50
)测定
[0148]
将dhx33过表达的癌症细胞株u251
‑
mg细胞以1
×
104/100ul/孔铺到96孔板上。等待细胞贴壁完全,将化合物以5nm、10nm、25nm、50nm、100nm、250nm、500nm、1000nm、2000nm、5000nm、10μm、20μm的浓度添加到细胞培养基中,用多通道排枪混合均匀。等待化合物和细胞温育时间达到48小时后,用cck
‑
8试剂(上海翌圣生物公司)按照标准流程添加到96孔板的培养基中,温育2个小时后,用酶标仪读板(od=450nm),将实验重复三次,并绘制化合物在不同浓度下的抑制曲线,计算化合物的半抑制浓度(ic
50
)。
[0149]
细胞培养及来源
[0150]
u251
‑
mg细胞购自中科院细胞库。用含有10%胎牛血清(fbs)、2mm l
‑
谷氨酰胺以及链霉素和青霉素的mem培养基培养,生长条件设定为37℃、5%co2带有湿度的细胞培养箱中。细胞每隔3天传代一次,传代10次之后丢弃不用。
[0151]
试验结果及分析
[0152]
本发明的化合物对dhx33蛋白的解旋酶活力的半抑制浓度如表1所示。从表1可以看出,本发明的化合物对dhx33蛋白的解旋酶活力具有显著的抑制作用。
[0153]
表1:化合物对dhx33蛋白的解旋酶活力抑制性分析
[0154][0155]
表2:化合物对u251
‑
mg的半抑制浓度分析
[0156][0157]
由表2可以看出,本发明的化合物对dhx33过表达的癌症细胞株u251
‑
mg细胞具有明显的抑制作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1