一种差向异构酶的突变体,其编码基因、氨基酸序列及其应用的制作方法
1.本发明涉及一种酶突变体,特别涉及一种差向异构酶的突变体、其编码基因、氨基酸及在生产d
‑
阿洛酮糖中的应用。
背景技术:
2.d
‑
阿洛酮糖是d
‑
果糖的碳
‑
3异构体,是一种罕见的单糖,存在于天然产物中。近年来,d
‑
阿洛酮糖因其健康益处而受到广泛关注,包括作为低热量甜味剂、肝脏脂肪生成酶和肠道酶糖苷酶的抑制剂减少身体脂肪积累。自然界中,d
‑
阿洛酮糖的含量极少,且极难获得。来源于野生菌株未经改造的差向异构酶在热稳定性方面较差,工业应用存在一定的局限性,导致酶的使用时间偏短,应用成本偏高,限制了d
‑
阿洛酮糖的大规模工业化生产。因此,热稳定性好的差向异构酶的资源仍然偏少,不利于d
‑
阿洛酮糖的工业化应用推广。
3.目前已经有多项关于差向异构酶的突变体提高催化果糖生成阿洛酮糖效率或效果的专利申请。专利cn201911384895.2、cn201911378513.5、cn201911204720.9等通过点突变得到耐高温的酶,但最适温度过高,不利于工业生产,最适温度下半衰期短,酶回收利用的价值不大;专利cn201810059404.6、cn201610816801.4、cn201911099450.x等通过点突变和随机突变等方式使酶的半衰期有所延长,其热稳定性有所提高,但反应平衡并没有明显右移,其转化率依然在30%左右。cn201910655539.3得到的突变体酶活有了显著提升,但是其最适温度没有提高,此温度下底物和产物的溶解度有限,限制了工业上高浓度底物的生产,不利于工业放大。
4.因此,如何同时提高差向异构酶的热稳定性以及提高其生产d
‑
阿洛酮糖的效率,使其能够在较高底物浓度下进行催化反应,为酶法工业化生产d
‑
阿洛酮糖提供有效途径是当前亟需解决的技术问题。
技术实现要素:
5.针对现有技术中的不足之处,本发明通过基因工程方法获得了差向异构酶突变体;在提高了差向异构酶突变体的热稳定性同时,使酶的最适温度提高了10
‑
20℃,并且该突变体在水中就能发挥很好的催化效果,不需要其他缓冲溶液存在,该方法为酶法工业化生产d
‑
阿洛酮糖提供有效途径。
6.本发明第一方面提供了一种差向异构酶突变体,所述突变体的氨基酸序列如seq id no.4或seq id no.5所示。
7.本发明第二方面提供了一种差向异构酶突变体,所述突变体的核苷酸序列如seq id no.2或seq id no.3所示;或者所述突变体的基因序列为编码前文所述的差向异构酶的氨基酸序列的核苷酸序列。
8.本发明第三方面提供了一种差向异构酶突变体的构建方法,包括如下步骤;按照随机突变试剂盒获得随机突变体,筛选其中具有优良性能的突变体。该方法中所述试剂盒为市面上可购买到的任意quickmutationtm基因随机突变试剂盒。
9.本发明第四方面提供了一种差向异构酶突变体在生产d
‑
阿洛酮糖中的应用。
10.进一步地,所述应用包括将细胞用于d
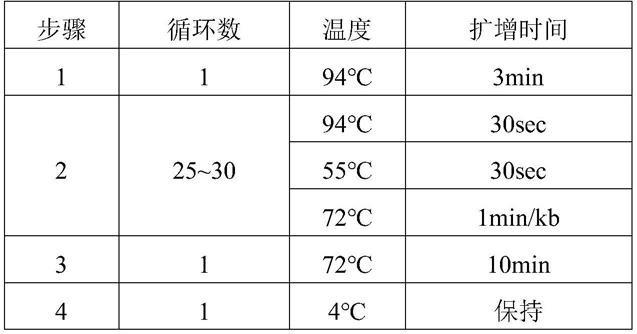
‑
阿洛酮糖生产的催化体系中进行反应。
11.进一步地,所述d
‑
阿洛酮糖生产的催化体系包括100~1000g/l果糖,0~576g/l硼酸,前文所述的氨基酸序列如seq id no.4或seq id no.5所示的突变体的全细胞浓度15~45g/l;优选的全细胞浓度为25~35g/l。
12.进一步地,所述d
‑
阿洛酮糖生产的催化体系温度控制在65~90℃范围内,反应ph可在6.5~8.5范围内波动,硼酸浓度可在72~288g/l范围内波动,d
‑
果糖可在200~800g/l范围内波动;
13.对于上文所述的技术方案中,优选的体系温度控制在75~85℃范围内。
14.对于上文所述的技术方案中,优选的反应ph可在7.0~8.0范围内。
15.对于上文所述的技术方案中,优选的反应硼酸浓度可在72~216g/l范围内。
16.与现有技术相比,本发明具有如下有益效果:
17.本发明通过基因工程方法获得的差向异构酶突变体e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211和e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237;其性质较野生株有显著提高,体现在以下几方面:(1)突变体的最适温度比原始菌提高了10
‑
20℃;(2)最适温度下的生产强度是原始菌的1.54倍和1.17倍;(3)酶的热稳定性有显著提高;(4)该突变体无需添加金属离子,可用纯水作为反应溶液,就能发挥很好的催化效果,从而降低了反应成本,同时有利于简化后续纯化工艺,缩减生产周期,对规模化生产有重要意义;(5)突变体在高浓度果糖700g/l为底物的情况下,添加硼酸盐,阿洛酮糖转化率可进一步提高至73.2%。(6)使用全细胞作为催化剂可以去除细胞的破碎、酶的纯化步骤,而且对于性质较好的酶,使用全细胞催化,省去固定化的步骤,更具有产业化可行性。
附图说明
18.图1重组大肠杆菌中差向异构酶的sds
‑
page分析。其中lane m:分子量标记;1:阴性对照2:重组菌;3:纯化后差向异构酶;
19.图2突变株的最适温度;
20.图3热稳定性数据;
21.图4不同硼酸添加摩尔比例对阿洛酮糖转化率的影响。
具体实施方式
22.下面对本发明的具体实施方式进行详细地描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
23.本发明中,除非另有其他明确说明,否则百分比、百分含量均以质量计。如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从商业途径购买。
24.本申请的实施例中所涉及的酶学性质、热稳定性和半衰期检测方法如下:
25.1.酶学性质测定
26.酶活定义:1u酶活定义为在60℃下,每分钟催化生产1mol的d
‑
阿洛酮糖所需要的酶量定义为一个酶活单位(u),反应体系包含100g/l果糖,30g/l全细胞,在50mm tris
‑
hcl(ph 7.5)中进行反应。hplc检测d
‑
阿洛酮糖产量以确定酶活力。
27.突变后的酶学性质可能发生改变,探究最佳酶活条件,分别将未突变wt(原始菌)和突变体在相同条件下的酶学性质进行分析比较。
28.2.热稳定性和半衰期检测
29.温度稳定性的测定:用pbs将酶液的浓度稀释至30g/l,在35℃和45℃下孵育,测定孵育不同时间的残余酶活。
30.t
1/2
值是指酶在特定温度下处理一段时间后残余酶活为50%时对应的时间。具体测定方法如下:以未进行热处理的酶的活力作为100%,分别测定并计算出酶在35℃和45℃下处理不同时间后的残余酶活。以处理时间为横坐标,以ln(%残余酶活)为纵坐标,绘制时间—ln(%残余酶活)的曲线,据图计算t
1/2
=ln2/k
d
,k
d
为该图斜率。
31.实施例1突变体的构建
32.来源于细菌flavonifractorplautii的差向异构酶基因dtease(gene id:56822880),密码子优化后的序列如seq id no:1所示。
33.突变体的获得
34.所述突变体是在seq id no:1所翻译的差向异构酶氨基酸序列的基础上发生的突变,获得突变体的方法,包括如下步骤:
35.1.按照quickmutation
tm
基因随机突变试剂盒设计引物和随机突变,引物序列为:
36.random
‑
f:gatatacatatgaacccgatcggtatgc;seq id no.6;
37.random
‑
r:ggtgctcgagcgcggtcagttc;seq id no.7;
38.2.随机突变pcr反应
39.随机突变pcr反应参考下表设置随机突变pcr反应体系:
40.表1
41.试剂最终浓度体积双蒸水或milliq水
‑
12.2μlrandommut buffer(10
×
)1
×
2μlmutation enhancer(10
×
)1
×
2uldntp(2.5mm)0.25mm2μl模板dna0.2pg
‑
5ng/μl1μl引物混合物(各10μm)各0.2μm0.4μlrandommut dna polymerase
‑
0.4μl总体积
‑
20μl
42.按照如下参数设置pcr仪:
43.表2
[0044][0045]
3.转化感受态细胞
[0046]
取10μl的pcr产物,1%的琼脂糖检测,观察到目的条带后加1μl的dmt酶于剩余的pcr产物中,混匀孵育1h。加入2
‑
5μl消化产物与于50μldmt感受态细胞中,混匀后冰浴30min,之后42℃水浴热击45s,立即放于冰上2
‑
5min。之后加入250μl的lb培养基,200rpm,37℃培养1h,取100
‑
200μl菌液于卡那抗性的平板上过夜培养。得到多个突变体,其中性质突出的突变体命名为e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211和e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237,蛋白的氨基酸序列分别为seq id no:4和seq id no:5。
[0047]
4.野生株和突变体的表达
[0048]
使用lb培养基培养重组大肠杆菌为e.coli bl21
‑
pet29(a)
‑
dtease、e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211和e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237,于37℃,200rpm的条件下过夜,以5%接种量接种到发酵培养基中,进行扩大培养,待细胞od
600
=0.4~1.0,添加0.3mm iptg,低温诱导过夜,离心收获全细胞作为催化剂。
[0049]
所述的种子培养基和发酵培养基:酵母浸粉5g/l,胰蛋白胨10g/l,nacl10g/l,121℃灭菌15min,冷却后加入终浓度为100mg/l的卡那霉素。
[0050]
实施例2
[0051]
在1l体系中,称取700g的d
‑
果糖和144g硼酸,加水调ph=7.5,加入e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237的全细胞至30g/l浓度,体系在80
±
1℃下进行反应1h。每隔10min取样进行产量分析。
[0052]
50min底物果糖的转化率达到72%,产物阿洛酮糖浓度达到504g/l,生产强度为607.2g/l
·
h,是野生株的1.54倍。
[0053]
在1l体系中,称取700g的d
‑
果糖和144g硼酸,加水调ph=7.5,加入e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211的全细胞至30g/l浓度,体系在70
±
1℃下进行反应1h。每隔10min取样进行产量分析。
[0054]
1h后底物果糖的转化率达到66.1%,产物阿洛酮糖浓度达到462.7g/l,生产强度为462.7g/l
·
h,是野生株的1.17倍。
[0055]
实施例3热稳定性
[0056]
各细胞的最适温度如图2所示。突变株e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211的最适温度由60℃提高到75℃,e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237提高到85℃。
[0057]
将e.coli bl21
‑
pet29(a)
‑
dtease、e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211和e.colibl21
‑
pet29(a)
‑
dtease
‑
203
‑
237的全细胞分别置于60℃和90℃下孵育一定时长,每
隔1~2h在各自的最适温度下以100g/l的d
‑
果糖溶液进行反应,以未孵育的细胞反应转化效果为对照,检测活性变化。
[0058]
反应结果如图3中的左右图所示。突变体具有优良的热稳定性,其中e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211在90℃保温育1h后还保有93%的活性,孵育12h后,残余酶活尚有37%。
[0059]
半衰期:
[0060]
表2野生菌株和突变株在60℃和90℃下的半衰期
[0061][0062][0063]
实施例4d
‑
阿洛酮糖在水体系中的高效合成
[0064]
将100g/l的d
‑
果糖分别溶于50mm ph7.5的磷酸缓冲液和ph=7.5的水中,加入e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237或e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211的全细胞至最终浓度30g/l,体系在各自的最适温度下进行反应。定时取样进行产量分析。
[0065]
在使用纯净水做反应溶液时,细胞e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237相对于缓冲体系中的产生d
‑
阿洛酮糖的转化率为116.9%,e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211相对于缓冲体系中的产生d
‑
阿洛酮糖的转化率为108.2%。
[0066]
实施例5硼酸盐添加提高阿洛酮糖转化率
[0067]
在反应体系中添加硼酸盐能大幅度提高阿洛酮糖的转化率。差向异构酶催化果糖生成阿洛酮糖的反应为双向反应。当反应体系中,两种糖浓度达到一定比例后,反应处于平衡状态。硼酸盐与阿洛酮糖络合后,减少反应体系中游离的阿洛酮糖,使反应右移,提高阿洛酮糖的转化率。在100g/l的反应体系中加入硼酸,使硼酸与果糖的摩尔比分别为0:1,0.3:1,0.5:1,1:1和2:1,加入e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237的全细胞至30g/l浓度,于ph=7.5,80
±
1℃下进行反应。
[0068]
反应效果如图所示,当硼酸的添加量与果糖浓度的比例为0.5mol:1mol时,阿洛酮糖的转化率达到最高,达到73.2%。
[0069]
对比例1
[0070]
d
‑
阿洛酮糖在水体系中的高效合成
[0071]
将100g/l的d
‑
果糖分别溶于50mm ph7.5的磷酸缓冲液和ph=7.5的水中,加入e.coli bl21
‑
pet29(a)
‑
dtease的全细胞至最终浓度30g/l,体系在各自的最适温度下进行反应。定时取样进行产量分析。
[0072]
在使用纯净水做反应溶液时,细胞e.coli bl21
‑
pet29(a)
‑
dtease相对于缓冲体系中的产生d
‑
阿洛酮糖的转化率为99.6%。
[0073]
对比例2
[0074]
野生株反应效果
[0075]
在1l体系中,称取700g的d
‑
果糖和144g硼酸,加水调ph=7.5,加入e.coli bl21
‑
pet29(a)
‑
dtease的全细胞,体系在60
±
1℃下进行反应1h。定时取样进行产量分析。
[0076]
阿洛酮糖的转化率达到56.5%(1h),对应浓度为395.5g/l,生产强度为395.5g/l/h。
[0077]
对比例3
[0078]
其他突变体的反应效果
[0079]
随机突变获得的其他突变体在e.coli bl21中表达得到e.coli bl21
‑
pet29(a)
‑
dtease
‑
222
‑
285、e.colibl21
‑
pet29(a)
‑
dtease
‑
235
‑
290、e.colibl21
‑
pet29(a)
‑
dtease
‑
247
‑
310、e.colibl21
‑
pet29(a)
‑
dtease
‑
252
‑
325,按照如前述的培养方式培养获取细胞。
[0080]
在1l体系中,称取700g的d
‑
果糖和144g硼酸,加水调ph=7.5,加入e.coli bl21
‑
pet29(a)
‑
dtease
‑
222
‑
285、e.coli bl21
‑
pet29(a)
‑
dtease
‑
235
‑
290、e.coli bl21
‑
pet29(a)
‑
dtease
‑
247
‑
310、e.coli bl21
‑
pet29(a)
‑
dtease
‑
252
‑
325的全细胞,体系在60
±
1℃下进行反应1h。定时取样进行产量分析。
[0081]
阿洛酮糖的转化率仅有12.3~13.7%,对应浓度为86.1~92g/l,生成强度为78.2~86.1g/l/h。
[0082]
总之,通过本申请的对比例和实施例数据对比分析可知:所获得的突变体e.coli bl21
‑
pet29(a)
‑
dtease
‑
153
‑
211和e.coli bl21
‑
pet29(a)
‑
dtease
‑
203
‑
237在应用于d
‑
阿洛酮糖合成过程中可显著提高其生产强度,而突变体e.coli bl21
‑
pet29(a)
‑
dtease
‑
222
‑
285、e.coli bl21
‑
pet29(a)
‑
dtease
‑
235
‑
290、e.coli bl21
‑
pet29(a)
‑
dtease
‑
247
‑
310、e.coli bl21
‑
pet29(a)
‑
dtease
‑
252
‑
325。在突变后并没有达到同样正向效果,表明随机突变有可能获得性能更为优良的突变体,但不是必然。
[0083]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,本领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1