一种特异性杀伤肿瘤细胞的免疫细胞制剂及其制备方法和应用与流程
本发明属于生物医药技术领域,具体而言,涉及一种特异性杀伤肿瘤细胞的免疫细胞制剂及其制备方法和应用。
背景技术:
近年来,我国恶性肿瘤的发病率逐年增高,并且大多数患者预后较差,严重危害人类的健康和生活质量(liangw,guanw,chenr,etal.cancerpatientsinsars-cov-2infection:anationwideanalysisinchina[j].thelancetoncology,2020,21(3):335-337.)。目前,手术治疗、放疗、化疗作为针对肿瘤的三大常规治疗方法,远远不能改变肿瘤治疗的现状。随着分子生物学技术的发展、免疫学理论的不断丰富,肿瘤的免疫疗法逐渐兴起,过继性细胞免疫疗法(adoptivecellimmunotherapy,aci)已经成为继手术治疗、放疗、化疗后肿瘤的另一种有效治疗手段。过继性细胞免疫疗法是指从肿瘤患者体内分离免疫活性细胞,在体外进行扩增和功能鉴定,然后向患者回输,从而达到直接杀伤肿瘤或激发机体的免疫应答杀伤肿瘤细胞的目的。
过继性免疫治疗的关键在于筛选具有肿瘤特异性杀伤作用的效应细胞,对靶细胞即肿瘤细胞产生致命的杀伤,以实现过继性免疫治疗高效低毒的特点。抗原特异性的细胞毒性t淋巴细胞(cytotoxictlymphocyte,ctl)由于其具有杀瘤谱广、杀瘤活性高、增殖能力强等特点,已成为过继性免疫治疗中常用的效应细胞,如何提高ctl细胞数量及活性、增强其抗肿瘤特异性是提高过继性免疫治疗效果的关键。树突状细胞(dendriticcells,dc)是迄今为止发现的效力最强的抗原递呈细胞,具有高效摄取、加工、递呈肿瘤相关抗原,并激活初始免疫反应的独特功能,在免疫反应的诱导和调控中发挥重要作用,dc能够显著刺激初始t细胞增殖,是机体适应性t细胞免疫应答的启动者。
目前,dc-ctl制备技术存在的缺陷包括:(1)自体肿瘤组织来源的全肿瘤抗原成分众多,可能引发自身免疫反应,存在安全风险;(2)使用人工合成的单一肿瘤抗原多肽负载dc制备得到的dc-ctl治疗效果有限,只能有效杀伤表达该单一肿瘤抗原的肿瘤细胞;(3)制备流程复杂,需用传统的免疫磁珠分离技术分选出cd8+t细胞,磁性微珠难以完全洗脱而成为了非细胞杂质,对目的细胞的后续培养存在一定的影响,扩增时间长等;(4)现有的细胞因子组合培养扩增的ctl数量不足,细胞活性不高,难以满足临床需求。
本发明针对上述缺陷,通过dc细胞呈递癌睾丸抗原的多组抗原肽段,制备了针对特异性肿瘤细胞系杀伤的dc-ctl混合细胞制剂,以达到自体免疫细胞特异性杀伤肿瘤的目的,所述制备方法流程简单,无需使用传统的免疫磁珠分离技术从外周血单个核细胞中分选出cd8+t细胞,且制备得到的dc-ctl混合细胞制剂纯度高、安全性高、活性高、数量多、能够达到临床级的ctl细胞量,对肿瘤细胞的杀伤特异性强,具有良好的临床应用价值。
技术实现要素:
本发明的目的在于提供一种特异性杀伤肿瘤细胞的免疫细胞制剂及其制备方法和应用,所述制备流程简单,无需使用传统的免疫磁珠分离技术从外周血单个核细胞中分选出cd8+t细胞,制备得到的dc-ctl混合细胞纯度高、数量多、能够达到临床级的ctl细胞量,对肿瘤细胞的杀伤特异性强。
本发明的上述目的通过以下技术方案得以实现:
本发明的第一方面提供了一种特异性杀伤肿瘤细胞的免疫细胞制剂的制备方法。
进一步,所述方法包括如下步骤:
(1)制备针对prame抗原的dc呈递肽库;
(2)采集血液并分离单个核细胞;
(3)含特定呈递抗原肽的mo-dc的培养;
(4)t细胞的培养;
(5)mo-dc细胞和t细胞混合培养,获得针对prame抗原特异的dc-ctl免疫细胞制剂。
进一步,所述步骤(1)中的dc呈递肽库包括在hla-a*02:01配型免疫细胞靶向prame抗原时所呈递可能肽段中可溶性、亲和力和呈递能力均较高的4条肽段;
优选地,所述4条肽段的序列如seqidno.1~4所示。
进一步,prame抗原为黑色素瘤特异性抗原(preferentiallyexpressedantigenofmelanoma,prame),在88%初发和95%转移黑色素瘤中都有表达,正常皮肤组织和良性黑色素瘤细胞中则不表达。prame在细胞内生成后被降解成小分子多肽,并与主要组织相容性复合体(mhc)分子结合形成复合物,进一步被呈递到细胞表面。除了黑色素瘤外,prame还在多种肿瘤组织中显著表达,包括肺癌、乳腺癌、鳞状细胞癌、肾细胞癌、霍杰金氏淋巴瘤、头颈部肿瘤、肉瘤及成神经管细胞瘤等,此外,prame在急性淋巴细胞白血病、急性粒细胞白血病等血液恶性肿瘤中均显著表达。
进一步,所述步骤(2)中的血液源自hla-a*02:01患者的自身外周血液。
进一步,所述步骤(2)中的单个核细胞的分离方法包括(但不限于):葡聚糖-泛影葡胺密度梯度离心法(ficoll-hypaquedensitygradientcentrifugation),用此方法分离外周血单个核细胞(pbmc)的纯度可达95%,淋巴细胞约占90%,其中t淋巴细胞占80%,b淋巴细胞占4~10%。ficoll-hypaque混合溶液,又称淋巴细胞分层液,在分离人外周血单个核细胞(pbmc)时,要求其比重为1.077±0.01。
进一步,所述步骤(3)中的特定呈递抗原肽的序列如seqidno.1~4所示。
进一步,本发明所述的所有呈递抗原肽(如seqidno.1~4所示)均通过uniprot-blast(https://www.uniprot.org/blast/)确认为对应抗原肽单一来源,无高同源性的其他抗原来源肽段。理论上不会造成非特异性杀伤。临床已完成对3例患者回输,无副反应发生。这些多肽库可以有效提升dc-ctl细胞的靶向杀伤作用,使得患有表达prame肿瘤的hla-a*02:01配型患者获益。
进一步,所述步骤(3)中培养的方法包括如下步骤:
(1)将权利要求1步骤(2)中所述的细胞加入到淋巴细胞无血清培养基中进行培养,得到基础培养体系;
(2)向步骤(1)所述的基础培养体系中添加il-4,gm-csf因子诱导分化得到一次培养体系;
(3)向步骤(2)所述的一次培养体系中添加特定呈递抗原肽孵育,并加入tnf-α、ifn-γ刺激诱导得到含特定呈递抗原肽的mo-dc;
优选地,步骤(1)中所述培养的时间为2小时,培养后需去除悬浮细胞;
优选地,步骤(2)中所述培养的条件为含500u/mlil-4,800u/mlgm-csf,5%hs的淋巴细胞无血清培养基,培养的时间优选为6天,每2天半量换液;
优选地,步骤(3)中所述的特定呈递抗原肽的序列如seqidno.1~4所示;
优选地,步骤(3)中所述的特定呈递抗原肽的浓度为10-50μg/ml;
优选地,步骤(3)中所述添加的时间为培养的第5天;
优选地,步骤(3)中所述的tnf-α、ifn-γ的浓度分别为10ng/ml(1000u)、100iu/ml。
进一步,所述步骤(4)中培养的方法包括如下步骤:
(1)在第6天,使用新鲜的外周血分离单个核细胞或直接使用免疫细胞制剂制备方法的步骤(2)中制备得到的单个核细胞冻存复苏后加入到无血清培养基中,贴壁培养2小时后,取出悬浮细胞,得到t细胞基础培养体系;
(2)向步骤(1)所述的t细胞基础培养体系中添加ifn-γ、il-7、il-15;
优选地,步骤(2)中所述ifn-γ、il-7、il-15的浓度分别为1000u/ml、5ng/ml、5ng/ml(1000u)。
进一步,所述步骤(5)中培养的方法包括如下步骤:
(1)用含5%hs、cd3、il-2、il-7、il-15、il-21、il-1α、免疫细胞制剂制备方法的步骤(1)中特定呈递抗原肽的培养基培养mo-dc和t细胞混合细胞;
(2)第9天,添加含5%hs和300u/mlil-2的新鲜培养基;
(3)第11天开始,每2天添加含300u/mlil-2的新鲜培养基,到第15~16天,获得足量针对prame抗原特异的dc-ctl免疫细胞制剂;
优选地,所述cd3、il-2、il-7、il-15、il-21、il-1α、免疫细胞制剂制备方法的步骤(1)中特定呈递抗原肽的浓度分别为50ng/ml、20u/ml、10ng/ml、10ng/ml、30ng/ml、5ng/ml、10μg/ml;
优选地,步骤(1)所述培养基中的细胞密度为1×106-2×106个/ml;
优选地,步骤(2)所述培养基中的细胞密度为2×106-5×106个/ml;
优选地,步骤(3)所述培养基中的细胞密度为2×106-10×107个/ml。
本发明的第二方面提供了一种特异性杀伤肿瘤细胞的免疫细胞制剂。
进一步,所述免疫细胞制剂采用本发明第一方面所述的方法制备而成。
在本发明的实施例中,所述用于预防肿瘤发生、阻止肿瘤发展的免疫细胞制剂通过树突状细胞递呈的抗原信息而具有识别肿瘤细胞的能力,进而特异性的杀伤肿瘤细胞。
进一步,所述免疫细胞制剂的给药方式包括(但不限于):皮内注射、静脉注射、肌内注射、在所述肿瘤内部给药、在所述肿瘤部位周围给药。
本发明的第三方面提供了一种药物组合物。
进一步,所述药物组合物包含本发明第二方面所述的免疫细胞制剂。
进一步,本发明所述的免疫细胞制剂采用本发明第一方面所述的方法制备而成。
进一步,所述药物组合物还可包括药学上可接受的载体、稀释剂和/或赋形剂(包括它们的组合)。
进一步,所述药物组合物还可包括另外的药学活性剂。
进一步,所述药学活性剂包括另外的免疫细胞制剂、药物(如抗癌症药物:用于放疗的药物和化疗的药物)。
本发明的第四方面提供了如下任一方面的应用。
进一步,所述应用包括:
(1)本发明第一方面所述的方法在预防肿瘤发生、阻止肿瘤发展中的应用;
(2)本发明第二方面所述的免疫细胞制剂在预防肿瘤发生、阻止肿瘤发展中的应用;
(3)本发明第一方面所述的方法在制备预防肿瘤发生、阻止肿瘤发展的药物中的应用;
(4)本发明第二方面所述的免疫细胞制剂在制备预防肿瘤发生、阻止肿瘤发展的药物中的应用。
进一步,本发明所述的肿瘤包括非实体瘤、实体瘤。
进一步,所述非实体瘤包括(但不限于):急性淋巴细胞白血病、慢性淋巴细胞白血病、急性粒细胞白血病、慢性粒细胞白血病、早幼粒细胞白血病、多发性骨髓瘤、非霍奇金氏淋巴瘤、急性髓性白血病、慢性髓性白血病、b细胞淋巴瘤、t细胞淋巴瘤。
进一步,所述实体瘤包括(但不限于):黑色素瘤、霍杰金氏淋巴瘤、成神经管细胞瘤、头颈部肿瘤、肺鳞状细胞癌、头颈部鳞状细胞癌、肉瘤、肾癌、胃癌、肺癌(包括小细胞和非小细胞肺癌和肺腺癌)、肝癌、食道癌、喉癌、甲状腺癌、皮肤癌、胰腺癌(包括外分泌胰腺癌)、膀胱癌(包括加速性和转移性膀胱癌)、胆囊癌、前列腺癌、睾丸癌、生殖道癌、淋巴癌、直肠癌、乳腺癌、子宫颈癌、结肠癌(包括大肠癌)、卵巢癌。
本发明的优点和有益效果:
(1)本发明所述的免疫细胞制剂制备流程简单。无需传统磁珠分选cd8+t细胞,本发明通过添加特定呈递抗原肽,使dc刺激对应hla配型t细胞形成ctl,以增强最终获得的细胞的特异杀伤功能。
(2)本发明所述的免疫细胞制剂扩增时间短且能够达到临床级ctl细胞量。dc和t细胞混合后,t细胞开始激活扩增(扩增7天),扩增时间与传统cik(扩增14天)相比减少一倍,但体系t细胞仍具有高增殖潜能。按1×108个起始细胞量混合培养,到混合扩增第7天,混合细胞总数可达1×1010个,与临床级dc-cik细胞量无差异。
(3)安全性高。本发明所述的所有呈递抗原肽(如seqidno.1~4所示)均通过uniprot-blast(https://www.uniprot.org/blast/)确认为对应抗原肽单一来源,无高同源性的其他抗原来源肽段。理论上不会造成非特异性杀伤。临床已完成对3例患者回输,无副反应发生。这些多肽库可以有效提升dc-ctl细胞的靶向杀伤作用,使得患有表达prame肿瘤的患者获益。
(4)杀伤特异性。本发明所述的免疫细胞制剂具有更高的特异性杀伤的效率,且其对肿瘤细胞的杀伤活性显著提高,具有很好的临床应用价值。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
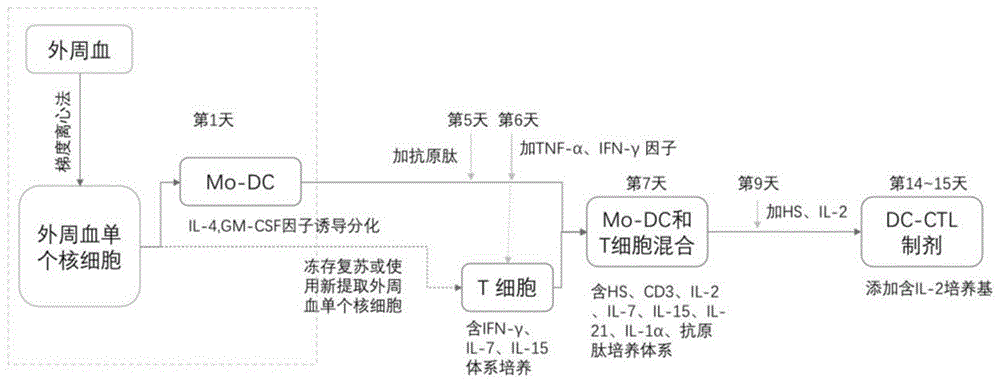
图1显示的是dc-ctl的制备流程图;
图2显示的是针对prame抗原的dc-ctl免疫细胞制剂对靶细胞thp1(hla-a*02:01)和nb4(hla-a*11:01)的杀伤效果比较图;
图3显示的是dc-cik、无针对性抗原的dc-ctl、针对prame抗原的dc-ctl免疫细胞制剂对靶细胞thp1(hla-a*02:01)的杀伤效果比较图;
图4显示的是dc-cik、无针对性抗原的dc-ctl、针对prame抗原的dc-ctl免疫细胞制剂对靶细胞nb4(hla-a*11:01)的杀伤效果比较图。
具体实施方式
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
本发明所述的所有呈递抗原肽(如seqidno.1~4所示)均通过uniprot-blast(https://www.uniprot.org/blast/)确认为对应抗原肽单一来源,无高同源性的其他抗原来源肽段。理论上不会造成非特异性杀伤。临床已完成对3例患者回输,无副反应发生。这些多肽库可以有效提升dc-ctl细胞的靶向杀伤作用,使得患有表达prame肿瘤的患者获益。
实施例1对照组dc-cik细胞的制备
本实施例中对照组dc-cik细胞的制备方法包括如下步骤:
(1)通过ficoll分离单采或外周血来源的患者血样,获得单个核细胞(pbmc)。将pbmc按1×107-2×107个/ml培养在581淋巴细胞无血清培养基(corningkbm58188-581-cm)中2小时,分离贴壁细胞和悬浮细胞。
(2)mo-dc培养:将步骤(1)中的贴壁细胞培养于含500u/mlil-4,800u/mlgm-csf,5%hs的581淋巴细胞无血清培养基中6天,每2天半量换液;在第6天添加10ng/ml(1000u)tnf-α+ifn-γ(100iu/ml),诱导分化,形成mo-dc。
(3)cik细胞培养:将步骤(1)中的悬浮细胞培养于581淋巴细胞无血清培养基中培养7天,在第一天添加1000u/mlifn-γ,在第二天添加100ng/mlcd3,5ng/ml(1000u)il-1α,500u/mlil-2,之后每隔2天半量换含有500u/mlil-2,5%hs的培养基。
(4)在第7天,将cik和mo-dc混合,用含500u/mlil-2,5%hs的培养基按照2×106-10×106个/ml的细胞密度继续培养,到第14天,每两天补加新鲜培养基,获得常规制备的dc-cik混合细胞制剂。
实施例2无针对性抗原的dc-ctl免疫细胞制剂的制备
本实施例中无针对性抗原的免疫细胞dc-ctl的制备方法包括如下步骤:
使用本专利实施例3中所述的方法制备无针对性抗原的免疫细胞dc-ctl,其中,在mo-dc培养的步骤中不加入对应合成靶细胞相关的抗原肽,其余步骤均相同。
实施例3针对prame抗原的dc-ctl免疫细胞制剂制备
选取hla-a*02:01配型免疫细胞靶向癌睾丸抗原(prame)呈递肽段4条(如seqidno.1~4所示),在体外合成后,按等比例混合,无菌过滤后,制备成针对prame抗原的dc呈递肽库。本实施例中针对prame抗原的dc-ctl免疫细胞制剂的制备流程图见图1,具体实验步骤如下:
(1)按照实施例1中步骤(1)分类pbmc获得hla-a*02:01配型来源患者的外周血来源单个核细胞的贴壁细胞和悬浮细胞。
(2)含特定呈递抗原肽的mo-dc培养:将步骤(1)中贴壁细胞培养于含500u/mlil-4,800u/mlgm-csf,5%hs的581淋巴细胞无血清培养基中培养,得到基础培养体系;培养时间为2小时,培养后需去除悬浮细胞,然后向所述的基础培养体系中添加il-4,gm-csf因子诱导分化得到一次培养体系,培养的时间优选为6天,每2天半量换液,在培养的第5天,向所述的一次培养体系中添加10-50μg/ml的特异抗原肽段进行孵育,并添加10ng/ml(1000u)tnf-α+ifn-γ(100iu/ml),刺激诱导分化,形成含特定呈递抗原肽的mo-dc。
(3)t细胞培养:在第6天,使用新鲜的外周血分离单个核细胞或直接使用本发明实施例1中制备得到的单个核细胞冻存复苏后加入到无血清培养基中,贴壁培养2小时后,取出悬浮细胞,得到t细胞基础培养体系,向所述的t细胞基础培养体系中添加1000u/mlifn-γ、5ng/mlil-7、5ng/ml(1000u)il-15,培养t细胞。
(4)第7天,用含5%hs、50ng/mlcd3、20u/mlil-2、10ng/mlil-7、10ng/mlil-15、30ng/mlil-21、5ng/mlil-1α、10μg/ml特定呈递抗原肽(如seqidno.1~4所示)的培养基培养mo-dc和t细胞混合细胞,所述培养基中的细胞密度为1×106-2×106个/ml;第9天,添加含5%hs和300u/mlil-2的新鲜培养基,所述培养基中的细胞密度为2×106-5×106个/ml;第11天开始,每2天添加含300u/mlil-2的新鲜培养基,所述培养基中的细胞密度为2×106-10×107个/ml,到第15~16天,获得足量hla-a*02:01来源针对prame抗原特异的dc-ctl免疫细胞制剂。
实施例4杀伤特异性的比较
1、实验方法
采用hla-a*02:01的肿瘤细胞系thp1以及hla-a*11:01的肿瘤细胞系nb4验证比较实施例1、实施例2、实施例3中制备得到的杀伤免疫细胞dc-cik、无针对性抗原的dc-ctl、针对prame抗原的dc-ctl对靶细胞的作用效果。本实施例所述实验主要通过使用cytotox
(1)使用含10%胎牛血清(fbs)的rpmi1640培养基扩增培养人急性单核细胞白血病细胞株thp1和急性早幼粒细胞株nb4,分别获得1×107个以上细胞的细胞量,并确保靶细胞已连续传代2次以上,且细胞正处于对数生长期。
(2)将靶细胞重悬到淋巴细胞无血清培养基后,调整细胞密度到2×105个/ml。取一个新的圆底96孔板,向靶细胞对应孔,每孔加入50μl(10000个细胞),按实验组和对照组均三组重复。
(3)取实施例1、实施例2、实施例3中的免疫效应细胞dc-cik、无针对性抗原的dc-ctl、针对prame抗原的dc-ctl,离心重悬到淋巴细胞无血清培养基中,将细胞密度调整至4×106个/ml,按20:1,10:1,5:1的效应细胞:靶细胞比例等倍稀释(每个比例需要总体积500μl),加入对应效应细胞孔杀伤孔,每孔50μl。向空靶细胞孔加50μl淋巴细胞无血清培养基。向空效应细胞孔加50μl淋巴细胞无血清培养基,以确保每孔体积为100μl。用排枪混匀每孔中的细胞。
(4)将96孔板在培养箱中孵育细胞过夜。在孵育结束前45分钟,取出96孔板,向靶细胞阳性对照孔内加入10μl裂解液(10x),裂解细胞。继续孵育45分钟。
(5)孵育结束后,将96孔板在250xg下离心4分钟。从每一个孔中取出50μl转移到一个新的96孔平底(酶分析)板中。向每孔中加入50μl配好的底物混合物,用锡箔纸或不透明的盒子盖住平板以避光。在室温孵育30分钟。
(6)30分钟后,向每孔中加入50μl的终止液(stopsolution)。用注射器针头把大气泡戳破,加入stopsolution后一小时之内在490nm或492nm测量吸光值。
(7)按照如下公式计算细胞毒性:
2、实验结果
图2显示了针对prame抗原的dc-ctl免疫细胞制剂对靶细胞thp1(hla-a*02:01)和nb4(hla-a*11:01)的杀伤效果的比较,其中,人急性单核细胞白血病细胞株thp1和急性早幼粒细胞株nb4均高表达prame,但hla配型不同,结果表明本发明制备的hla-a*02:01来源的dc-ctl,对hla-a*02:01呈递的prame识别杀伤能力强,对hla-a*11:01呈递的prame识别杀伤能力有限,具有特异的免疫细胞杀伤活性,所述dc-ctl制剂在提升效应细胞(dc-ctl)与靶细胞的效靶比时,能够高效识别细胞hla-a*02:01限制性表位呈递的多肽,更加显著地增强了细胞的特异杀伤能力。
结果显示,制备的针对prame抗原特异性杀伤的免疫细胞dc-ctl在对应靶细胞杀伤上比传统dc-cik有更强的杀伤效果,尤其在效靶比为20:1时针对hla-a*02:01的肿瘤细胞系thp1,其杀伤效果随效靶比增加有显著加强,而在nb4(hla-a*11:01)中验证发现,dc-ctl和dc-cik的杀伤效果相近(见图3和图4),表明dc-ctl有特异性靶向杀伤能力。
另一方面,实验结果显示,dc-ctl特异性杀伤来源于加入的抗原肽,而不是dc-ctl的培养方案(见图3和图4)。对比与无抗原肽添加的dc-ctl制备,后者在以thp1(hla-a*02:01)为靶细胞的杀伤中作用明显有限。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
序列表
<110>深圳豪石生物科技有限公司
<120>一种特异性杀伤的免疫细胞制剂及其制备方法和应用
<141>2021-03-02
<160>4
<170>siposequencelisting1.0
<210>1
<211>9
<212>prt
<213>人工序列(artificialsequence)
<400>1
serleuleuglnhisleuileglyleu
15
<210>2
<211>9
<212>prt
<213>人工序列(artificialsequence)
<400>2
glnleuleualaleuleuproserleu
15
<210>3
<211>10
<212>prt
<213>人工序列(artificialsequence)
<400>3
serleutyrserpheprogluprogluala
1510
<210>4
<211>10
<212>prt
<213>人工序列(artificialsequence)
<400>4
alaleutyrvalaspserleuphepheleu
1510
- 还没有人留言评论。精彩留言会获得点赞!