抽穗期调控基因Ehd5及其应用
抽穗期调控基因ehd5及其应用
技术领域
1.本发明属于植物学和分子生物学领域,更具体地,本发明涉及一种新型的抽穗期调控基因ehd5及其应用。
背景技术:
2.粮食短缺正随着越来越多的人口增加而称为世界范围内的重要问题。,人们预测到2050年全球人口将达到90亿,这要求世界粮食作物的产量要大幅度提升。禾本科植物,特别是水稻(oryza sativa),长期作为主要的粮食作物之一,是世界一半以上人口的主食,全球无数的科学家致力于改良其各种性状,提高其生产效率。
3.抽穗期作为禾谷类植物如水稻的重要农艺性状,不仅决定了植物品种的分布区域、耕作制度及季节适应性,还显著影响植物的产量、品质及抗逆性。水稻抽穗期是指水稻从播种到开始抽穗的时间,其长短受到光照、温度、肥水状况等外部信号和激素、抽穗期基因等内源因素的影响。已有的分子机制研究表明水稻由营养生长转向生殖生长的成花过程是由多个主效基因和微效基因共同调控的,调控网络十分复杂,因此解析水稻抽穗期遗传特性及分子调控网络对指导育种、品种改良及扩大水稻种植范围进而解决全球粮食问题具有重要意义。本领域中,已经确定了一些抽穗期相关基因,这些基因组成复杂的分子调控网络,共同调节水稻由营养生殖向生殖生长的转变,进而影响栽培水稻的抽穗期和种植地域适应性。
4.水稻作为一个典型的短日照(sd)植物,其存在两条主要的开花调控途径,分别是osgi-hd1-hd3a途径和ghd7-ehd1-rft1途径。osgi是拟南芥gi的同源基因,其表达受生物钟影响,具有昼夜节律性。sd条件下,osgi通过hd1、ehd1、osmads51等基因来调控水稻成花转化;ld情况下,osgi对开花影响作用不显著。osgi可调控hd1的表达,hd1通过ld条件下抑制和sd条件下促进成花素hd3a/rft1基因的表达,进而影响osmads15的表达来调控水稻抽穗期。ghd7-ehd1-rft1组成的花期调控途径是水稻中所特有的,ghd7作为ld条件下是抽穗期抑制因子,其可以通过与hd1蛋白直接结合而下调hd3a的表达或抑制ehd1的表达推迟抽穗;同时,ghd7基因的表达也受多个基因的调节。ehd1是水稻特有的花期调控基因,是抽穗期调控网络中重要的光信号整合点,受到多个基因的调控。在ld条件下,水稻osgi-hd1-hd3a途径受到抑制,开花推迟,但终究还会开花就是通过ehd1基因促进成花素rft1基因表达实现的。目前,已知的调节ehd1表达的基因有许多,其中促进开花的有sdg724、hd18、ehd2、ehd4、ehd3、osmads51、osvil2等基因,抑制开花的有oscol9(constans-like9)、ghd7、ghd8、oslfl1、osmads56、dth7、osco3等基因。在这两条调控途径中,hd1和ghd7蛋白可以形成蛋白复合体来抑制ehd1的表达进而影响水稻开花,osgi除了影响hd1表达外还会通过osmads51来调节ehd1的表达,这说明这两条调控途径间存在相互联系。
技术实现要素:
5.本发明的目的在于提供一种新型的抽穗期调控基因ehd5及其应用。
6.在本发明的第一方面,提供一种改良禾本科植物性状或制备性状改良的禾本科植物的方法,包括:上调植物中ehd5的表达或活性;所述改良性状包括:促进抽穗、提高产量、提高抗病性和/或改变籽粒粒型(如增加粒宽、降低粒长)。
7.在一个优选例中,所述上调植物中ehd5的表达或活性包括将ehd5的编码基因或含有该编码基因的表达构建物或载体转入植物中;对ehd5进行功能获得性突变;以表达增强型启动子或组织特异性启动子促进ehd5表达;或,以增强子促进ehd5表达。
8.在另一优选例中,所述的对ehd5进行功能获得性突变包括:对ehd5的编码基因进行靶向性改造,改变导致ehd5发生翻译提前终止的碱基的类型;较佳地,突变型基因相对于野生型基因在基因编码的第3084-3087位碱基产生缺失(即在第8号染色体物理位置24,475,456碱基处),由“gtatt”变为“g”(相对于野生型ehd5基因cds序列的1677-1680位碱基缺失),导致蛋白编码移码,翻译提前终止。
9.在本发明的另一方面,提供一种ehd5或其上调剂的用途,用于改良禾本科植物性状或制备性状改良的禾本科植物;所述改良性状包括:促进抽穗、提高产量、提高抗病性和/或改变籽粒粒型(包括改变籽粒粒长和粒宽,即改变籽粒长宽比,如增加粒宽、降低粒长,降低长宽比)。
10.在另一优选例中,所述ehd5上调剂包括:外源的ehd5编码基因或含有该编码基因的表达构建物或载体;较佳地,所述表达构建体包括增强型启动子、组织特异性启动子或增强子;或,对ehd5进行功能获得性点突变的试剂(如通过伽马射线辐射诱变获得的材料)。
11.在另一优选例中,所述的对ehd5进行功能获得性点突变的试剂为在发生ehd5突变的植物中将突变体回复为ehd5野生型的试剂;较佳地,构建互补质粒,该互补质粒中引入野生型基因的编码序列,将该互补质粒转化植物;较佳地,将8号染色体物理位置24,475,456碱基处的缺失突变进行恢复,恢复为gtatt;也即将相应于seq id no:1的第1677-1680位的碱基缺失进行恢复;较佳地,恢复为第1676-1680位为gtatt
12.在另一优选例中,所述的上调、促进、提高或增强表示显著性的上调、促进、提高或增强,如上调、促进、提高或增强20%、40%、60%、80%、90%或更高。
13.在另一优选例中,所述的促进抽穗(抽穗提早/提前)表示显著性地促进,例如使得抽穗时间提前1~30天,更具体例如提前2、4、6、8、10、12、14、15、16、18、20、22、25、28天。
14.在另一优选例中,所述的提高产量表示显著性地提高产量,例如产量提高1~30%;更具体例如提高2%、4%、6%、8%、10%、12%、14%、15%、16%、18%、20%、22%、25%、28%。
15.在另一优选例中,所述的提高抗病性表示显著性地提高抗病性,例如患病植株比例显著降低1~99%;更具体例如降低5%、10%、30%、50%、70%、90%、95%、98%。
16.在另一优选例中,所述的增加粒宽表示显著性地增加,例如增加1~30%;更具体例如增加2%、4%、6%、8%、10%、12%、14%、15%、16%、18%、20%、22%、25%、28%。
17.在另一优选例中,所述的禾本科植物是禾谷类作物或所述ehd5来自禾谷类作物;较佳地,所述的禾谷类作物包括:水稻(oryza sativa),玉米(zea mays),小米(setaria italica),大麦(hordeum vulgare),小麦(triticum aestivum),黍(panicum miliaceum),高粱(sorghum bicolor),黑麦(secale cereale),燕麦(avena satival),二穗短柄草(brachypodium distachyum)。
18.在另一优选例中,所述的ehd5包括cdna序列、基因组序列(gdna),或在它们基础上人工优化或改造的序列。
19.在另一优选例中,所述的ehd5包括它的同源物。
20.在另一优选例中,所述的ehd5的多肽的氨基酸序列选自下组:(i)具有seq id no:2所示氨基酸序列的多肽;(ii)将如seq id no:2所示的氨基酸序列经过一个或几个(如1-20个,1-10个,1-5个,1-3个)氨基酸残基的取代、缺失或添加而形成的,具有所述调控性状功能的、由(i)衍生的多肽;(iii)氨基酸序列与seq id no:2所示氨基酸序列的同源性≥80%(较佳地≥85%,≥90%,≥95%或≥98%),具有所述调控性状功能的多肽;(iv)seq id no:2所示氨基酸序列的多肽的活性片段;或,(v)在seq id no:2所示氨基酸序列的多肽的n或c末端添加标签序列或酶切位点序列,或在其n末端添加信号肽序列后形成的多肽。
21.在另一优选例中,所述的ehd5受光周期诱导,昼夜节律性表达,从而调控植物的抽穗时间、产量、抗病性和/或籽粒粒型;或所述的ehd5与其上游包括gi和phyb的基因和下游包括ghd7、ehd1的基因形成信号通路,从而调控植物的抽穗时间、产量、抗病性和/或籽粒粒型。
22.在本发明的另一方面,提供一种禾本科植物ehd5的用途,用于作为鉴定禾本科植物性状的分子标记,或用作定向筛选植物的分子标记物;其中,所述性状包括:抽穗、产量、抗病性和/或籽粒粒型。
23.在本发明的另一方面,提供一种定向选择或鉴定植物的方法,所述方法包括:鉴定测试植物中的ehd5蛋白或其基因的表达或序列特征;若是该测试植物的ehd5蛋白或其基因高表达,则其为抽穗正常或提早、产量正常或提高、抗病性正常或提高的植株;若是该测试植物的ehd5蛋白或其基因低表达或不表达,则其为抽穗延迟、产量低、抗病性低的植株。
24.在另一优选例中,所述高表达或高活性,是指与同类或同种植物的表达或活性的平均值相比,表达或活性具有统计学意义的提高。
25.在另一优选例中,所述低表达或低活性,是指与同类或同种植物的表达或活性的平均值相比,表达或活性具有统计学意义的降低。
26.在本发明的另一方面,提供一种筛选调节禾本科植物性状的物质(潜在物质)的方法,包括:(1)将候选物质加入到表达ehd5蛋白的体系中;(2)检测所述体系,观测其中ehd5蛋白的表达或活性,若其表达或活性提高,则表明该候选物质为可用于促进抽穗、提高产量和/或提高抗病性的物质。
27.在另一优选例中,(1)中,所述的体系中还表达roc4蛋白;(2)中,还包括检测所述体系中ehd5蛋白与roc4蛋白的相互作用,若能够促进两者的相互作用,则表明该候选物质为可用于促进抽穗、提高产量和/或提高抗病性的物质。
28.在另一优选例中,所述的筛选方法中,还包括设置对照组,从而明确分辨测试组中ehd5或roc4表达或活性与对照组的差异。
29.在另一优选例中,所述的候选物质包括(但不限于):针对ehd5或roc4蛋白或其编码基因或它们的上游或下游蛋白或基因设计的调控分子(如上调剂、小分子化合物基因编辑构建物等)。
30.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
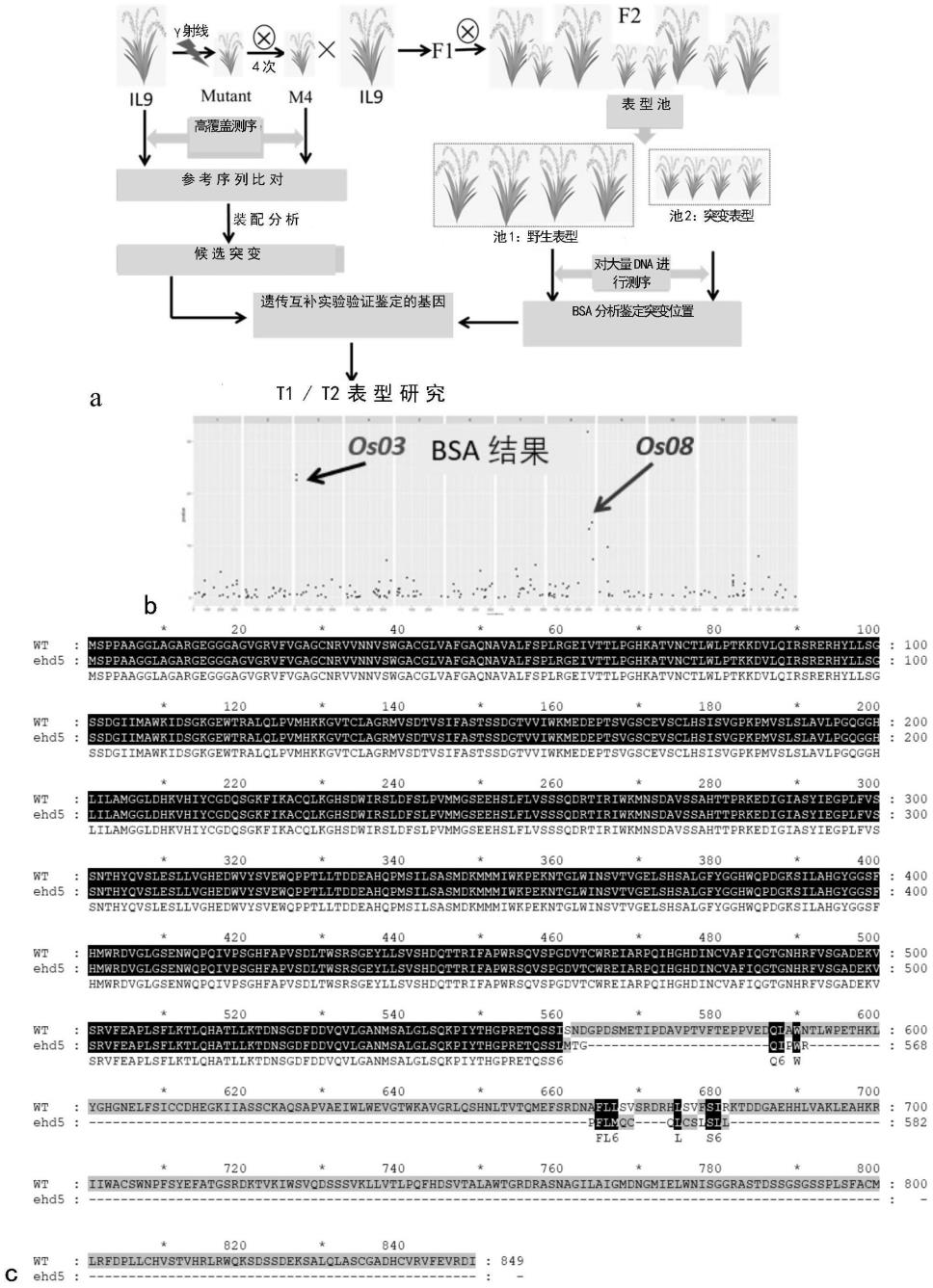
31.图1、候选位点的确定及bsa分析结果;
32.a、候选基因的分析流程示意图;
33.b、利用bsa方法分析f2分离群体,确定了候选基因;
34.c、8号染色体ehd5基因在野生型和突变体中的序列编码氨基酸比较。
35.图2、突变体以及野生型的表型考察与统计;
36.a、突变体ehd5以及野生型的抽穗期、株高、穗长、分蘖数、单株产量表型的考察(纵坐标单位根据柱体上方标注的单位);
37.b、突变体ehd5以及野生型的代表性植株照片示意图(摄于野生型抽穗起始后第30天);
38.c、突变体ehd5以及野生型的粒形比较。
39.图3、ehd5基因互补植物及其表型观测;
40.a、野生型植株、突变体植株、引入空载质粒的突变体植株、引入互补载体p1301-08质粒的突变体植株的抽穗性状比较(摄于野生型抽穗起始后第20天);
41.b、野生型植株、突变体植株、引入互补载体p1301-08质粒的突变体籽粒的扫描电镜结果比较;
42.c、野生型植株、突变体植株、引入互补载体p1301-08质粒的突变体植株的叶片染病情况比较。
43.图4、ehd5基因过表达植物及其表型观测;
44.a、野生型植株(wt)、突变体植株(mu)、引入空载质粒的突变体植株(mu-co)、ehd5过表达的野生型植株(wt-ox)、ehd5过表达的突变型植株(mu-ox)的抽穗性状比较(摄于野生型抽穗起始后第12天);
45.b、短日照培养条件下(sd(11/13h),即11h日照/13h黑暗)的抽穗期比较;
46.c、长日照培养条件下(ld(14/10h),即14h日照/10h黑暗)的抽穗期比较。
47.图5、ehd5基因的亚细胞定位。
48.图6、短日照(sd(10h/14h),即10h日照/14h黑暗)条件下,野生型东北il9的ehd5基因各不同取样时间(第1次取样时间为播种后23天,之后每5天取一次叶片,直至取样11次)基因表达情况。
49.图7、ehd5基因在植物各个组织中的差异表达情况。
50.图8、ehd5基因的昼夜节律表达;
51.a、短日照(sd(10h/14h),即10h日照/14h黑暗)条件下培养野生型东北il9(wt)以及突变体(突变体ehd5,mu)的表达量分析;
52.b、长日照(ld(14h/10h),即14h日照/10h黑暗)条件下培养野生型东北il9(wt)以及突变体(突变体ehd5,mu)的表达量分析。
53.图9、ehd5基因与其它抽穗基因的相关性分析。
54.图10、rna-seq和定量实验分析ehd5基因及其上下游基因在昼夜节律表达的表达量趋势。
55.图11、酵母双杂交实验分析ehd5蛋白的相互作用蛋白。
56.图12、烟草双分子荧光互补(bifc)实验分析ehd5蛋白的相互作用蛋白。
具体实施方式
57.本发明首次研究及揭示了一种新型基因ehd5,其编码一条具有重要生物功能的ehd5多肽,该多肽可以调控植物抽穗性状、产量性状、抗病性性状和/或籽粒形状等性状,是一种具有潜力的植物遗传改良基因。并且,本发明还首次揭示了ehd5具有剂量效应,其表达量相对高意味着抽穗时间相对提前、产量性状相对更理想。ehd5还具有昼夜节律性表达的特点。本发明披露了调控植物抽穗期等性状的新机制,对于植物性状的遗传改良具有重要的理论意义。
58.ehd5
59.如本发明所用,除非特别说明,所述的ehd5指具有seq id no:2序列的多肽或其编码基因,还包括具有与ehd5多肽相同功能的序列变异形式。所述的编码基因可以是gdna或cdna,也可以包含启动子。例如,所述的cdna具有seq id no:1所示的核苷酸序列。所述编码基因的序列也包括与本发明所提供的序列相简并的序列。
60.所述ehd5多肽的变异形式包括(但并不限于):若干个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个,还更佳如1-8个、1-5个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。任何与所述的ehd5多肽同源性高(比如与seq id no:2所示的多肽序列的同源性为70%或更高;优选地同源性为80%或更高;更优选地同源性为90%或更高,如同源性95%,98%或99%)的、且具有ehd5多肽相同功能的蛋白也包括在本发明内。来源于水稻以外其它物种的与seq id no:2所示序列的多肽序列的同源性较高、或在同样或相近的调控通路中发挥同样或相近作用的多肽也包括在本发明中。
61.本发明中,所述的“ehd5”也包括其同源物。应理解,虽然本发明中优选研究了获自特定物种水稻的ehd5,但是获自其它物种的与所述ehd5高度同源(如具有60%以上,如70%,80%,85%、90%、95%、甚至98%序列相同性)的其它多肽或基因也在本发明考虑的范围之内。
62.本发明还包括一种突变形式的ehd5多肽截短体,编码其的基因序列在相应于seq id no:1的第1677-1680位碱基产生缺失,即由“gtatt”变为“g”,导致蛋白编码移码,翻译提前终止,从而该ehd5多肽发生显著性截短。所述截短体不具有野生型ehd5多肽的功能,存在该突变的植物,其抽穗性状、产量性状、抗病性状和/或籽粒粒型性状发生显著性变化。
63.如本发明所用,所述的“籽粒”是指植物的果实或种子,在水稻、玉米、小麦、大麦等作物中也称为穗粒。
64.编码所述ehd5多肽的多核苷酸(基因)可以是来自植物的天然基因,也可以是它们的简并的序列。
65.包含所述编码序列的载体,以及用所述的载体或多肽编码序列经基因工程产生的宿主细胞也包括在本发明中。本领域的技术人员熟知的方法能用于构建含合适的表达载体。
66.宿主细胞通常是植物细胞。转化植物一般可使用农杆菌转化或基因枪转化等方法,例如叶盘法、水稻幼胚转化法等;优选的是农杆菌法。对于转化的植物细胞、组织或器官可以用常规方法再生成植株,从而获得相对于野生型而言性状发生改变的植物。
67.改良植物的方法/应用
68.如本文所用,所述的“植物”包括表达ehd5的植物。根据本领域的知识,存在ehd5的植物,其内在存在如本发明所主张的作用机制,可以实现如本发明所主张的技术效果。在一些优选方式中,所述的植物为作物,较佳地为禾谷类作物,所述禾谷类作物为具有籽粒(穗粒)的作物。所述的“禾谷类作物”可以是禾本科植物。较佳地,所述的禾本科植物包括:水稻,大麦、小麦、燕麦、黑麦、玉米、高粱、二穗短柄草等。
69.在本发明人的研究工作中,通过对粳稻材料东北il9进行γ射线诱变处理,得到了突变体植株。突变体植株表现为晚抽穗、粒型改变、生长势弱等性状,生育后期(成熟期)出现抗病性差异,且杂交自交统计分析初步确定为单基因控制性状。接下来,本发明人将突变体进行自交4代,拿到纯合突变体并与东北il9亲本进行杂交再自交,得到f2代;利用f2遗传群体进行分离群体混合测序的分析方法(bsa),结合亲本材料的高覆盖测序,初步拿到了几个候选基因。拿到候选基因后,本发明人进行候选基因的互补试验,然后进行表型观察统计,确定了相关基因ehd5。
70.ehd5位于8号染色体上,其在突变体中存在移码突变,进而导致转录翻译提前终止。在ehd5互补和过表达植株中,抽穗期、粒型、株高等农艺性状得到了恢复;同时,在过表达材料中,ehd5表达量高于野生型和突变体,其抽穗时间也有了一定程度的提前,说明此基因存在着剂量效应。
71.为了探究ehd5基因对水稻抽穗期的调控机制,本发明人分别在长日照和短日照条件下进行取材,然后进行rna-seq和定量实验,发现该基因表达受光周期诱导,存在昼夜节律;同时,通过对野生型和突变体表达量对比分析,可以预期该基因位于osgi和osphyb等基因的下游,ghd7、ehd1等基因的上游。另外,本发明人还对该基因的分子生物学功能进行了探究,通过亚细胞定位、酵母筛库、bifc及水稻原生质体内co-ip等实验,这些结果提示ehd5和roc4蛋白在植物体内和体外均存在互作。
72.基于本发明人的新发现,本发明提供了一种改良禾本科植物性状或制备性状改良的禾本科植物的方法,包括:上调植物中ehd5的表达或活性;所述改良性状包括:促进抽穗、提高产量、提高抗病性和/或调节籽粒粒型。
73.基于本发明人的新发现,本发明提供了一种ehd5或其上调剂的用途,用于改良禾本科植物性状或制备性状改良的禾本科植物;所述改良性状包括:促进抽穗、提高产量、提高抗病性和/或改变籽粒粒型。
74.因此,本发明提供了一种使植物、特别是低表达(包括不表达)ehd5的植物表现为抽穗期正常或提早、产量提高、抗病性提高和/或改变籽粒粒型的方法,包括:上调ehd5的表达或活性。
75.应理解,在得知了所述ehd5以及包含ehd5的信号通路(较佳地,也包括其上游基因和下游基因)的功能后,可以采用本领域人员熟知的多种方法来调节所述的ehd5的表达或活性或调节期上游基因或下游基因。比如可以采用本领域人员熟知的多种方法来过表达ehd5。所述的ehd5的上游基因包括gi和phyb的基因等,所述的ehd5的下游基因包括ghd7、ehd1;他们可与ehd5共同形成新的信号通路。
76.本发明中,所述的ehd5蛋白或其编码基因、其上游或下游蛋白或其编码基因的上调剂包括了促进剂、激动剂、激活剂。所述的“上调”、“促进”包括了蛋白活性的“上调”、“促进”或蛋白表达的“上调”、“促进”,且它们为具有统计学意义的“上调”、“促进”。任何可提高
ehd5或含有其的信号通路蛋白(包括其上游和下游蛋白)的活性、提高ehd5或包含其的号通路蛋白的稳定性、上调ehd5或包含其的信号通路基因的表达、增加ehd5或包含其的信号通路蛋白有效作用时间的物质、增加各个蛋白的磷酸化/激活水平,这些物质均可用于本发明,作为对于上调ehd5或信号通路有用的物质。它们可以是化合物、化学小分子、生物分子。所述的生物分子可以是核酸水平(包括dna、rna)的,也可以是蛋白水平的。
77.本发明还提供了一种上调植物中ehd5表达的方法,所述的方法包括:将ehd5的编码基因或含有所述编码基因的表达构建物或载体转入植物中。此外,也可对ehd5或其编码基因进行功能获得性突变;以表达增强型启动子或组织特异性启动子促进ehd5的编码基因的表达;或,以增强子促进ehd5的编码基因的表达。应理解,其它的上调植物中ehd5表达的方法也应被包含在本发明中。
78.植物定向筛选或靶向性筛选
79.在得知了ehd5功能以后,可以以其为分子标记物,来进行植物的定向筛选。也可基于该新发现来筛选通过调节这一机制,从而定向调控植物抽穗性状、产量性状、抗病性性状和/或籽粒粒型的物质或潜在物质。
80.因此,本发明提供了一种定向选择或鉴定植物的方法,所述方法包括:鉴定测试植物中的ehd5的表达或序列特征;若是该测试植物的ehd5蛋白或其基因高表达,则其为抽穗正常或提早、产量正常或提高、抗病性正常或提高、和/或籽粒粒型改变的植株;若是该测试植物的ehd5蛋白或其基因低表达或不表达,则其为抽穗延迟、产量低、抗病性低、和/或籽粒粒宽窄的植株。
81.本发明提供了一种筛选调节禾本科植物性状的物质(潜在物质)的方法,包括:(1)将候选物质加入到表达ehd5的体系中;(2)检测所述体系,观测其中ehd5的表达或活性,若其表达或活性提高,则表明该候选物质为可用于促进抽穗、提高产量、提高抗病性和/或调节籽粒粒型的物质。
82.在进一步的优选方式中,所述的体系中还表达roc4蛋白;还包括检测所述体系中ehd5蛋白与roc4蛋白的相互作用,若能够促进两者的相互作用,则表明该候选物质为可用于促进抽穗、提高产量、提高抗病性和/或调节籽粒粒型的物质。
83.以蛋白或基因或其上特定的区域作为靶点,来筛选作用于该靶点的物质的方法是本领域人员所熟知的,这些方法均可用于本发明。所述的候选物质可以选自:肽、聚合肽、拟肽、非肽化合物、碳水化合物、脂、抗体或抗体片段、配体、有机小分子、无机小分子和核酸序列等。根据待筛选的物质的种类,本领域人员清楚如何选择适用的筛选方法。
84.可以采用多种常规的技术来鉴定系统中基因的转录或表达情况。这些技术包括但不限于:寡核苷酸杂交技术(如探针),多聚酶链反应(pcr),聚丙烯酰胺凝胶电泳等。检测蛋白与蛋白之间相互作用以及相互作用的强弱可采用多种本领域技术人员熟知的技术,比如免疫共沉淀技术、gst沉降技术、噬菌体展示技术或酵母双杂交系统。蛋白的核定位也是本领域熟知的技术。
85.此外,也可采用烟草双分子荧光互补(bifc)实验来分析蛋白的互作。其原理主要为:在荧光蛋白(yfp、gfp、luciferase等)的两个β片层之间的环结构上有许多特异性位点可以插入外源蛋白而不影响荧光蛋白的荧光活性。bifc技术正是利用荧光蛋白家族的这一特性,将荧光蛋白分割成两个不具有荧光活性的分子片段,再分别与目标蛋白融合表达。如
果两个目标蛋白因物理相互作用而靠近,就使得荧光蛋白的两个分子片段在空间上相互靠近,重新形成有活性的荧光基团而发出荧光。
86.经过大规模的筛选,可以获得一类特异性作用于ehd5或由其参与的信号通路,对植物抽穗性状、产量性状、抗病性性状和/或籽粒粒型性状有调控作用的潜在物质。
87.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
88.材料和方法
89.1、ctab法提取植物基因组总dna
90.(1)将需要提取dna的植物叶片(3~5cm)放入2ml ep管中,置于液氮中1min;
91.(2)预先在液氮中预冷研磨棒,用预冷的研磨棒研磨ep管中的叶片;
92.(3)12000rpm离心1min(离心机型号:thermofisher sy-40r),将研磨后的叶片粉末离心到试管底部;
93.(4)加入750ul ctab溶液,65℃烘箱30~60min;
94.(5)然后加入750ul三氯甲烷(氯仿),颠倒混匀,12000rpm离心30min;
95.(6)吸取500~750ul上清到新的ep管,加入等体积的异丙醇,混匀,4℃放置30min或-20℃放置10min;
96.(7)12000rpm离心30min,倒掉上清;
97.(8)加入1ml 75%乙醇,离心15min;
98.(9)去上清,室温晾干;
99.(10)加入200ul ddh2o溶解。
100.2、rna提取、反转录及qpcr步骤
101.新鲜植物组织或者-80℃冻存的组织用trizol reagent提取,提取完成后取1.5μl测浓度,2μl电泳检测,看条带是否完整。总rna样品用toyobo公司revertra ace qpcr rt master mix with gdna remover试剂盒进行反转作为实时定量pcr的模版。实时定量pcr实验所使用仪器是applied biosystems q5 real time pcr仪,所使用试剂是toyobo公司的thunderbirdqpcr mix试剂盒,内参是ubiquitin基因(ubq)。
102.3、水稻原生质体亚细胞定位
103.水稻原生质体的制备
104.(1)水稻种子去壳消毒,播于1/2ms培养基上30℃培养10~12天;
105.(2)将水稻幼苗剪去根和叶子,保留茎和叶鞘,用刀片切成0.5~1mm的小段,尽量大小保持一致,样品要新鲜,勿将茎部组织来回切割以减少原生质体中的杂质;
106.(3)将切下的小段立刻转移至盛有20~30ml 0.6m d-mannitol的锥形瓶(锡箔纸包裹好)中黑暗10min;
107.(4)在切小段的过程中,配制酶解液,酶解液要现配;
108.(5)将锥形瓶中的0.6m d-mannitol小心去除,加入上步所配酶解液,真空抽滤5min;
109.(6)将锥形瓶放在摇床上,低速旋转4h(提前将房间温度调至25℃);
110.(7)在酶解的4h内,配制w5、mmg和peg溶液;
111.(8)向消化后的锥形瓶中加入20ml的w5溶液(与酶解液同体积),手中剧烈震荡10s;
112.(9)用40μm尼龙网过滤原生质体入50ml离心管中,用w5溶液将锥形瓶冲洗干净,平衡离心,100g,升7降4(acc 7;dec 4)离心3min,用枪头吸掉上清;
113.(10)加入10ml w5溶液,100g,升7降4(acc 7;dec 4)离心3min,用枪头吸掉上清;
114.(11)用1ml的mmg轻柔重悬,将离心管中的原生质体转移至2ml ep管待用,同时血球计数板镜检计数,并将原生质体稀释至所需浓度;
115.(12)准备2ml ep管,将10μg质粒dna加到管底(一般100μl的原生质体加10μg dna,对于bifc或共表达系统可加15μg),加入100μl的原生质体,暂时不要混匀;
116.(13)顺着管壁,缓慢加入110μl新配的peg溶液,加完立即轻柔混匀;
117.(14)室温黑暗放置10~20min;
118.(15)缓慢加入440μl w5溶液,混匀终止反应,然后100g,升7降4(acc7;dec 4)离心3min,用枪头吸掉上清;
119.(16)重复(15)一次;
120.(17)700μl w5溶液重悬原生质体;
121.(18)平放在试管盒中,放入26℃培养箱,培养10~16小时。
122.4、亚细胞定位
123.(1)在ehd5亚细胞定位实验中,以东北il9的cdna为模板,扩增ehd5基因全长orf,连入p1300-gfp载体;
124.(2)以东北il9的cdna为模板,扩增roc4基因全长orf,连入p1300-mcherry载体;
125.(3)对35s::gfp-ehd5和35s::mcherry-roc4载体进行测序和质粒中抽(方法见);
126.(4)质粒瞬时转化入水稻原生质体;
127.(5)使用激光共聚焦扫描显微镜zeiss lsm880观察融合蛋白在细胞内的定位。
128.5、蛋白免疫共沉淀实验
129.蛋白提取
130.(1)300g,5min离心收集原生质体;
131.(2)加入蛋白提取液,冰上放置30min,每10min摇一次;
132.(3)4℃离心,13000rmp,15min;
133.(4)将上清转移至已预冷的低吸附离心管中,吸取100μl加入loading buffer,99℃煮5~10min用作对照。
134.6、co-ip实验
135.(1)取25μl ha beads到低吸附离心管中,加入500μl洗涤缓冲液重悬;
136.(2)放在磁力架上吸附,去除上清,重复两次;
137.(3)将提取的蛋白(5.2步上清溶液)加入含有beads的离心管中,4℃孵育3~4h;
138.(4)磁力架收集beads,并清洗3次;
139.(5)加入loading buffer,99℃煮5~10min,放冰上待用;
140.(6)蛋白电泳,杂交显影。
141.7、序列信息
142.野生型ehd5基因全长cds序列(seq id no:1):
143.atgtcgccgccggcagcaggagggctcgccggagcccgcggcgagggcggcggagcaggggtggggagggtcttcgtgggcgctgggtgcaaccgcgtggtgaacaacgtctcctggggagcttgcggcctcgtcgccttcggcgcgcagaacgccgtcgcgctcttttcccctttgagaggtgagattgtgacgacgcttccggggcacaaggccacggtgaactgcaccctttggttgcccacgaagaaggatgtgctccaaatccgctccagggagagacactatctattatcaggaagttctgatggtattatcatggcatggaagattgattctggaaaaggagagtggactcgtgcgttgcaactgcctgtgatgcacaaaaaaggggtcacctgtcttgctggaaggatggtgtcagatactgtttcaatatttgcctccacctcctcagatggaactgtggtcatttggaaaatggaagatgaaccaactagtgttggcagctgtgaagtgtcttgtttgcattctatatccgttggtccaaagccaatggtttcactttcattagcagtattgcctgggcagggaggccatctcattttggcaatgggaggtttggatcacaaggtccacatttattgtggggatcagtcaggcaagttcattaaagcttgtcagcttaaaggtcattctgattggattagaagtttagacttctctttacctgtgatgatgggcagtgaggagcacagccttttccttgttagctcatctcaggatagaaccattcggatctggaaaatgaattcggatgctgtttcttctgctcacacaacacccagaaaggaagatattgggattgcctcctatattgaaggtcctttgtttgtgtccagtaatacacattaccaggtatcattggagtcccttctcgttggtcatgaggactgggtgtattctgtagaatggcagcctcctacgctactaactgatgatgaagctcatcagccaatgagcatattatctgcatccatggacaagatgatgatgatatggaagccagagaaaaataccggtctttggataaattcagtgactgttggtgagttaagtcactcagcactgggattctatggtggccattggcagcctgatggcaaatccatccttgcacatggatatggtggatcgtttcatatgtggagggatgttggactgggttctgaaaactggcagcctcagatagtcccatctggtcattttgcacctgtatctgacttaacatggtcaagatctggtgaatatctgttatcagtcagccatgatcagacaacacgcatatttgctccttggagaagccaagttagcccaggggatgtgacttgttggcgtgaaattgctcgccctcaaattcatgggcacgatattaactgtgtggcattcattcagggtaccgggaaccaccggttcgttagtggcgccgatgaaaaggtctctagagtctttgaagctcctttgtcatttttgaagacccttcaacatgcaactttgttgaaaactgataactctggagattttgacgatgtgcaagtacttggagcaaatatgtctgctcttggactttcacagaaacctatatatacacatggaccaagggaaacccaaagcagtatttctaatgacgggccagattccatggagaccattcctgatgcagtgccaactgtgttcactgagcctcctgtagaggatcaactagcctggaatactctatggcctgaaactcacaaactttatggccatggaaatgaactcttctccatctgctgtgatcatgaagggaagatcattgcatcatcttgcaaggctcaatcagcaccagttgctgagatctggctgtgggaggttggaacatggaaagctgttggccgcctgcaatctcacaacctgacagttacacagatggagttttctcgtgacaatgcttttcttttgagtgtatcaagggatcgtcatttgtctgtcttctcaatcaggaagacagatgatggagcagagcatcatcttgttgcaaagcttgaagcacacaaaagaattatatgggcatgctcatggaaccccttcagctacgaatttgcaactggatcaagggacaagaccgtcaagatatggagcgttcaagattcatcttctgtcaagctgctcgtgacgttgcctcagttccacgacagtgtgacagcattggcctggacaggccgtgaccgtgctagtaatgctggcattctcgctattggcatggacaacggaatgatcgagctctggaacatttcaggggggagagcctccactgacagcagcggctcaggttcatctccgctcagctttgcatgcatgctccgttttgatcctctgctgtgtcatgtatcaactgtgcaccgtttacggtggcagaaatctgactcatccgatgagaaatcagcgctacagttagcttcttgtggagctgatcattgtgtaagggtgtttgaggtccgtgacatttga
144.ehd5蛋白全长序列(seq id no:2):
145.msppaagglagargegggagvgrvfvgagcnrvvnnvswgacglvafgaqnavalfsplrgeivttlpghkatvnctlwlptkkdvlqirsrerhyllsgssdgiimawkidsgkgewtralqlpvmhkkgvtclagrmvsdtvsifastssdgtvviwkmedeptsvgscevsclhsisvgpkpmvslslavlpgqgghlilamggldhkvhiycgdqsgkf
ikacqlkghsdwirsldfslpvmmgseehslflvsssqdrtiriwkmnsdavssahttprkedigiasyiegplfvssnthyqvslesllvghedwvysvewqpptlltddeahqpmsilsasmdkmmmiwkpekntglwinsvtvgelshsalgfygghwqpdgksilahgyggsfhmwrdvglgsenwqpqivpsghfapvsdltwsrsgeyllsvshdqttrifapwrsqvspgdvtcwreiarpqihghdincvafiqgtgnhrfvsgadekvsrvfeaplsflktlqhatllktdnsgdfddvqvlganmsalglsqkpiythgpretqssisndgpdsmetipdavptvfteppvedqlawntlwpethklyghgnelfsiccdhegkiiassckaqsapvaeiwlwevgtwkavgrlqshnltvtqmefsrdnafllsvsrdrhlsvfsirktddgaehhlvakleahkriiwacswnpfsyefatgsrdktvkiwsvqdsssvkllvtlpqfhdsvtalawtgrdrasnagilaigmdngmielwnisggrastdssgsgssplsfacmlrfdpllchvstvhrlrwqksdssdeksalqlascgadhcvrvfevrdi
146.实施例1、抽穗期基因的鉴定
147.针对粳稻材料东北il9,本发明人进行γ射线诱变处理,得到了一系列突变体植株。进一步地,从这些突变体中,本发明人筛选获得具有典型性状的突变体植株,其表现为晚抽穗、粒型改变、生长势弱等性状,生育后期(成熟期)出现抗病性差异。
148.本发明人将野生型东北il9和晚抽穗突变体进行杂交,得到f1代,f1代自交后得到f2代;通过对野生型和突变体的表性考察及杂交后代分离比统计分析发现,此表型是由单基因控制的(图1a)。
149.随机选取96株f2植株,根据抽穗期长短将96株水稻分为两组(晚抽穗组和早抽穗组),提取叶片dna进行混合池测序,然后进行bsa分析,得到两个候选的基因位点,分别位于3号染色体和8号染色体。
150.另一方面,本发明人对野生型和纯合突变体进行高覆盖测序,以nipponbare为参考序列进行组装比对,最终也确定了候选位点(图1b)。
151.因此,本发明人利用bsa方法分析f2分离群体,确定了ehd5基因,且杂交自交统计分析初步确定为单基因控制性状。
152.测序发现,8号染色体的ehd5基因在突变体中存在移码突变,导致翻译提前终止(图1c)。具体地,野生型ehd5基因在第3084-3087位的碱基为“gtatt”,而突变体中由“gtatt”变为“g”(即相对于野生型ehd5基因cds序列的1677-1680位碱基缺失),从而导致移码突变。
153.实施例2、野生型东北il9和纯合突变体表型统计
154.本发明人将上述获得的突变体植株命名为突变体ehd5。
155.本发明人对于野生型东北il9和自交四代的纯合突变体ehd5,各种植72株(3个株系,每个株系24株),进行抽穗期、株高、穗长、分蘖、每穗粒数、千粒重等表型的考察,并进行结果统计。
156.统计结果表明,在突变体ehd5中,植株的抽穗期推迟15天左右,分蘖数、株高及单株产量均有明显下降(图2a、图2b)。
157.同时,本发明人发现,突变体ehd5的粒型也发生了改变,籽粒变得细长,也即粒宽显著变小、粒长略增加(图2c)。
158.实施例3、ehd5基因互补植物及其表型观测
159.为了进一步确定ehd5基因的功能,本发明人构建了互补载体p1301-08(cp08),将上述确定的位于8号染色体上的ehd5基因全长克隆于pcambia1300,并将其转化晚抽穗的突
变体(突变体ehd5)。
160.每个互补株系在t0代至少得到了10株阳性植株,收种后本发明人对每个株系进行自交得t1代,对t1代进行农艺性状统计。
161.结果显示,互补载体p1301-08的引入可以使抽穗期不再推迟,也即获得性状互补(图3a)。
162.同时,扫描电镜结果显示,cp08互补植株粒型完全恢复(图3b)。
163.获取叶片观测其抗病性,结果显示抗病性也得到了互补(图3c)。
164.实施例4、ehd5基因过表达植物及其表型观测
165.pncgr构建方法:pncgr是在p1301的基础上,利用hindiii和psti酶切位点,加入了ha tag,所用的启动子是ubiquitin promoter。
166.本发明人将ehd5基因全长克隆于pncgr构建了过表达载体,并将其转化野生型东北il9成熟胚,获得过表达植株(wt-ox)。同时,也将之转化突变体(突变体ehd5)成熟胚,获得过表达植株(mu-ox)。
167.培养所述过表达植株wt-ox、mu-ox以及mu-co,以野生型以及突变体植株为对照。
168.结果如图4a~c,在ehd5互补(mu-co)和过表达植株(wt-ox)中,抽穗期、粒型、株高等农艺性状得到了恢复;同时,在过表达植株(wt-ox)中,ehd5表达量高于野生型和突变体,其抽穗时间显著地提前于野生型(图4b),说明ehd5基因存在着剂量效应。
169.实施例5、ehd5基因的亚细胞定位
170.本发明人还对该基因的分子生物学功能进行了探究,包括分离野生型东北il9水稻的原生质体,进行亚细胞定位。
171.本发明人构建了gfp-ehd5融合蛋白,同时构建mcherry-roc4融合蛋白作为核定位信号,利用pcambia1300(p1300)质粒在水稻原生质体进行了瞬时表达,共聚焦显微镜观察发现gfp-ehd5主要在胞质和核膜上表达。
172.结果如图5,可见ehd5基因表达蛋白主要定位于胞质和核膜。
173.实施例6、ehd5基因各个生长期表达情况和组织表达差异
174.本发明人分析了短日照(sd(10/14h),即10h日照/14h黑暗)条件下,野生型东北il9的ehd5基因各不同生长期表达情况各异。结果如图6所示。
175.在野生型东北il9的营养生长阶段,本发明人分析了ehd5基因在植物各个组织中的差异表达情况。
176.结果如图7所示,(倒数第一叶(dl1,developing leaf 1),倒数第二叶(dl2,developed leaf 2),倒数第三叶(dl3,developed leaf 3),倒数第四叶(dl4,developed leaf 4),茎秆(stem),叶鞘(sheath)、嫩苗底部附近(asa,around shoot apex)以及根(shoot))
177.实施例7、ehd5基因的昼夜节律表达
178.为了探究ehd5基因对水稻抽穗期的调控机制,本发明人分别在短日照(sd(10h/14h),即10h日照/14h黑暗)和长日照(ld(14h/10h),即14h日照/10h黑暗)条件下培养野生型东北il9(wt)以及突变体(突变体ehd5,mu),然后进行表达量分析。
179.结果显示,ehd5基因表达受光周期诱导,存在昼夜节律,尤其在野生型中这种表达变化更为显著,如图8a~b。
180.实施例8、ehd5基因上下游基因分析
181.基于对野生型和突变体转录组测序分析,对水稻抽穗基因进行了相关性研究,如图9;结合酵母筛库方法对多种基因的深入研究,提示ehd5基因位于osgi和osphyb等基因的下游,ghd7、ehd1等基因的上游。
182.本发明人进行了rna-seq和定量实验,分析ehd5基因及其上下游基因在昼夜节律表达中是否具有相同的表达量趋势。结果如图10,可见不管在短日照还是在长日照条件下,野生型及突变体中,ehd5基因的下游基因具有相同的表达量趋势。
183.实施例9、ehd5蛋白的相互作用蛋白
184.本发明人进行了酵母双杂交实验,分析ehd5蛋白的相互作用蛋白。结果如图11,ehd5和roc4蛋白在体外存在互作。
185.本发明人也获得了野生型东北il9水稻的原生质体,进行原生质体内co-ip实验。结果也显示,ehd5和roc4蛋白在植物体内存在互作。
186.本发明人也进行了烟草双分子荧光互补(bifc)实验,在烟草植株活体细胞中检测蛋白质-蛋白质相互作用,该实验方法根据常规方法。结果如图12,显示ehd5和roc4蛋白在植物体内存在互作。
187.上述结果可确定,ehd5和roc4蛋白在植物体内和体外均存在互作。
188.实施例10、基于ehd5表达或活性的筛选
189.细胞:表达ehd5的水稻细胞(也可以是原生质体、幼苗或者愈伤组织等)。
190.测试组:培养所述表达ehd5的水稻细胞,给予候选物质;
191.对照组:培养所述表达ehd5的水稻细胞,不给予候选物质。
192.分别检测测试组和对照组中ehd5的表达或活性情况,并进行比较。如果测试组中ehd5的表达或活性在统计学上高于(如高20%或更高)对照组,就表明该候选物是促进抽穗、提高产量、提高抗病性和/或增加籽粒粒宽的物质的潜在物质。
193.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1