一种可见光不对称催化构建的含氮杂芳烃手性环状醇、其制备方法及应用
1.本发明属于含氮杂芳烃手性环状醇衍生物合成技术领域,具体涉及一种可见光不对称催化构建的含氮杂芳烃手性环状醇、其制备方法及应用。
背景技术:
2.羰基与烯烃的还原偶联反应是直接合成醇类化合物的一种方便实用的方法,这两种底物的官能团都很丰富,而且自由基反应活性高(j.streuff,synthesis,2013,45,281-307)。环状醇或杂环醇类化合物在天然产品、医药和农用化学品中普遍存在,在过去的50多年,这类环状醇的合成主要通过分子内极性翻转策略实现。利用还原性金属和金属化合物,如:na(j.ardisson,j.p.f
éré
zou,m.julia,a.pancrazi,tetrahedron lett.1987,28,2001)、zn(c.-h.yeh,r.p.korivi,c.-h.cheng,adv.synth.catal.2013,355,1338.)、bu3snh(j.c.tripp,c.h.schiesser,d.p.curran,j.am.chem.soc.2005,127,5518)、smi2(e.j.corey,g.z.zheng,tetrahedron lett.1997,38,2045.)和cp2ticl(r.e.est
é
vez,j.l.oller-l
ó
pez,r.robles,c.r.melgarejo,a.j.m.cuerva,j.e.oltra,org.lett.2006,8,5433)作为试剂或催化剂以及电化学(t.shono,h.ohmizu,s.kawakami,h.sugiyama,tetrahedron lett.1980,21,5029)和光化学(j.cossy,d.belotti,n.k.cuong,c.chassagnard,tetrahedron 1993,49,7691)手段,已建立了大量有效的制备基本的羰自由基阴离子的方法。使用bu3snh作为自由基引发剂取得了巨大成功,并将这种自由基加成形成c(sp3)-c(sp3)键的过程命名为beckwith-enholm环化反应(d.s.hays,g.c.fu,j.org.chem.1998,63,6375)。最近,knowles和rueping利用可见光驱动的光氧化还原催化(k.t.tarantino,p.liu,r.r.knowles,j.am.chem.soc.2013,135,10022;e.fava,m.nakajima,a.l.p.nguyen,m.rueping,j.org.chem.2016,81,6959),相继完成了芳香酮与酯活化烯烃、芳香醛与电中性烯烃的beckwith-enholm环化。通过利用这一经典而强大的环化策略,可实现新型且有价值的环状醇的模块化甚至多样化的合成,并将有效地促进药物的发现。但是,由于自由基加成反应活性高、立体选择性控制难,尚未实现环状醇的催化不对称合成。
3.含亚胺的氮杂芳烃,如吡啶类、喹啉类和苯并咪唑类,结构多样,在许多天然产物、药物、配体和功能材料中常被用作关键的结构基元。因此,开发适宜的合成方法来获取已知的和未知的氮杂芳烃衍生物在许多科学和工业领域广受关注。近年来,由于自由基的高反应活性,可使用简单和未修饰的原料,直接利用这些氮杂芳烃固有的吸电子特性触发自由基转化被证明是一种重要的合成策略(a)o.boubertakh,j.-p.goddard,eur.j.org.chem.2017,2072;b)g.evano,c.theunissen,angew.chem.2019,131,7638;angew.chem.int.ed.2019,58,7558;c)r.s.j.protor,r.j.phipps,angew.chem.2019,131,13802;angew.chem.int.ed.2019,58,13666;d)y.zhao,w.xia,org.biomol.chem.2019,17,4951;e)c.cavedon,p.h.seeberger,b.pieber,eur.j.org.chem.2019,1379;f)a.c.sun,
r.c.maatee,e.j.mcclain,c.r.j.stephenson,synthesis 2019,51,1063;g)y.yin,x.zhao,z.jiang,chemcatchem,2020,12,4471.)。其中,光氧化还原催化氮杂芳烃实现分子间自由基加成已有大量实例,表明该策略是一种构建结构多样氮杂芳烃富有前景的方法(a)k.miyazawa,y.yasu,t.koike,m.akita,chem.commun.2013,49,7249;b)m.nakajima,q.lefebvre,m.rueping,chem.commun.2014,50,3619;c)k.n.lee,z.lei,m.-y.ngai,j.am.chem.soc.2017,139,5003;d)l.capaldo,m.fagnoni,d.ravelli,chem.eur.j.2017,23,6527;e)f.lima,u.k.sharma,l.grunenberg,d.saha,s.johannsen,j.sedelmeier,e.v.van der eycken,s.v.ley,angew.chem.2017,129,15332;angew.chem.int.ed.2017,56,15136;f)a.trowbridge,d.reich,m.j.gaunt,nature 2018,561,522;g)y.yin,y.dai,h.jia,j.li,l.bu,b.qiao,x.zhao,z.jiang,j.am.chem.soc.2018,140,6083;h)k.cao,s.m.tan,r.lee,s.yang,h.jia,x.zhao,b.qiao,z.jiang,j.am.chem.soc.2019,141,5437;i)y.yin,y.li,t.p.q.zhan,g.wang,x.zhao,b.qiao,k.-w.huang,z.jiang,j.am.chem.soc.2020,142,19451.)。同时,多个课题组证明了外在手性氢键催化(a)y.yin,y.dai,h.jia,j.li,l.bu,b.qiao,x.zhao,z.jiang,j.am.chem.soc.2018,140,6083;b)brimiooulle,r.;lenhart,d.;maturi,m.m.;bach,t.angew.chem.2015,127,3944;angew.chem.int.ed.2015,54,3872;c)jiang,c.;chen,w.;zheng,w.-h.;lu,h.org.biomol.chem.2019,17,8673;d)yin,y.;zhao,x.;qiao,b.;jiang,z.org.chem.front.2020,7,1283;e)h.b.hepburn,p.melchiorre,chem.commun.2016,52,3520;f)s.j.proctor,h.j.davis,r.j.phipps,science 2018,360,419;g)x.liu,y.liu,g.chai,b.qiao,x.zhao,z.jiang,org.lett.,2018,20,6298;h)b.qiao,c.li,x.zhao,y.yin,z.jiang,chem.commun.2019,55,7534;i)m.-c.fu,r.shang,b.zhao,b.wang,y.fu,science 2019,363,1429;j)d.zheng and a.studer,angew.chem.2019,131,15950;angew.chem.int.ed.2019,58,15803;k)a.bauer,f.s.brimme,t.bach,nature 2005,436,1139;l)l.j.rono,h.g.yayla,d.y.wang,m.f.armstrong,r.r.knowles,j.am.chem.soc.2013,135,17735;)可以为这种高反应性的过程提供良好的立体控制。因此,通过光氧化还原和手性氢键协同催化,探索羰自由基加成到含氮杂芳烃烯烃,可实现前所未有的高对映选择性beckwith-enholm环化反应,高对映选择性地合成多种重要的氮杂芳烃官能团化的环状醇类化合物,这些环醇化合物具有相邻的1,2-或非相邻的1,3-对映中心。相比离子型合成方法(a)b.m.trost,d.a.thaisrivongs,j.am.chem.soc.2008,130,14092;b)b.m.trost,d.a.thaisrivongs,j.hartwig,j.am.chem.soc.2011,133,12439.),基于自由基的策略可以有效地避免使用强碱,且在循环过程中同时生成两个立体中心,以良好的官能团容忍性获得更有用、更复杂的含氮杂芳烃碳环和杂环醇类化合物。
技术实现要素:
4.本发明目的在于克服现有技术缺陷,提供一种可见光不对称催化构建的含氮杂芳烃手性环状醇、其制备方法及应用,并对获得的产物进行活性研究。该方法反应底物简单,反应条件温和,无重金属参与,收率高且对映选择性高;所得产物均可抑制h2o2诱导的细胞内活性氧(ros)含量增加,降低细胞氧化应激。
5.基于上述目的,本发明采取如下技术方案:
6.一种可见光不对称催化构建的含氮杂芳烃手性环状醇,结构通式如下:
7.r1为萘基、2-噻吩基、c1-c6的直链烷基或h;ar1为2-吡啶、3-吡啶、4-吡啶、异喹啉、苯并噻唑、苯并恶唑、苯并咪唑、以及甲基、甲氧基、f、cl或br单取代的-吡啶、3-吡啶、4-吡啶,r为f、cl、br、me、甲氧基或h。
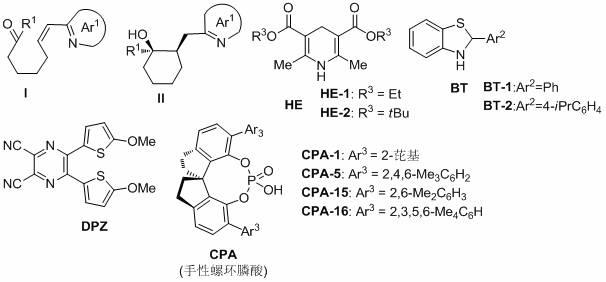
8.上述含氮杂芳烃手性环状醇具体为下述结构的化合物:
[0009][0010]
chin,old
ˇ
rich pytela,guo wei,hongjun liu,filip bures*,zhiyong jiang*.rsc adv.,2014,4,30062)制备获得。手性螺环膦酸cpa为自制,参考文献:(f.x.xu,d.huang,c.han,w.shen,x.f.lin,y.g.wang.j.org.chem.,2010,75,8677;ilijasteffen m
ü
ller,benjamin list*.j.am.chem.soc.2010,132,17370),汉斯酯(he)或苯并噻唑啉(bt)购买自百灵威或参考文献(mohammad g.dekamin*,siamand ilkhanizadeh,zahra latifidoost,hamed daemi,zahra karimi,mehdi barikani.rsc adv.,2014,4,56658-56664;hidenori chikashita*,makoto miyazaki,kazuyoshi itoh.synthesis,1984;4:308-310)。
[0021]
实施例1
[0022]
(1r,2r)-1-苯基-2-(吡啶-2-基甲基)环己醇8的具体制备步骤如下:
[0023][0024]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-1-苯基-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-1 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物8,产率为71%,光学纯为95%ee,16:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=4.3hz,1h),7.62(d,j=7.4hz,2h),7.53(t,j=7.7hz,1h),7.35(t,j=7.6hz,2h),7.20(t,j=7.3hz,1h),7.13
–
7.06(m,1h),6.99(d,j=7.7hz,1h),6.12(s,1h),2.63(qd,j=14.9,5.3hz,2h),2.45
–
2.35(m,1h),1.84
–
1.72(m,4h),1.64
–
1.54(m,1h),1.48
–
1.35(m,3h);
13
c nmr(300mhz,cdcl3)δ160.2,149.7,147.9,136.7,128.0,126.0,125.1,124.5,120.9,75.7,44.9,41.4,38.9,26.6,26.5,22.0;高分辨数据为:hrms(esi)m/z 290.1513(m+na
+
),calc.for c
18h21
nona 290.1515.
[0025]
实施例2
[0026]
合成(1r,2r)-1-(4-氟苯基)-2-(吡啶-2-基甲基)环己醇9的反应式如下所示。
[0027][0028]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(4-氟苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶
剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物9,产率为74%,光学纯为96%ee,9:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.48(d,j=4.3hz,1h),7.63
–
7.50(m,3h),7.13
–
7.07(m,1h),7.07
–
6.91(m,3h),2.63(qd,j=14.9,5.2hz,2h),2.42
–
2.30(m,1h),1.86
–
1.70(m,4h),1.62
–
1.52(m,1h),1.46
–
1.36(m,3h);
13
c nmr(300mhz,cdcl3)δ161.3(d,j=243.6hz),159.7,147.8,145.5(d,j=3.0hz),136.8,126.7(d,j=7.7hz),124.6,121.0,114.6(d,j=20.9hz),75.4,45.0,41.6,38.8,26.7,26.4,22.0;高分辨数据为:hrms(esi)m/z 308.1419(m+na
+
),calc.for c
18h20
fnona 308.1421.
[0029]
实施例3
[0030]
合成(1r,2r)-1-(3-氟苯基)-2-(吡啶-2-基甲基)环己醇10的反应式如下所示。
[0031][0032]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(3-氟苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物10,产率为88%,光学纯为97%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.50(d,j=4.3hz,1h),7.57(t,j=7.6hz,1h),7.41
–
7.27(m,3h),7.16
–
7.10(m,1h),7.04(d,j=7.8hz,1h),6.89(t,j=7.7hz,1h),6.47(s,1h),2.75
–
2.60(m,2h),2.44
–
2.34(m,1h),1.85
–
1.73(m,4h),1.62
–
1.55(m,1h),1.48
–
1.37(m,3h);
13
c nmr(300mhz,cdcl3)δ163.0(d,j=244.1hz),159.6,153.0,153.0(d,j=6.0hz),147.5,137.1,129.4(d,j=8.1hz),124.7,121.1,120.7(d,j=2.5hz),112.7(d,j=21.2hz).112.5(d,j=22.1hz),75.5(d,j=1.6hz),44.8,41.2,38.7,26.6,26.4,21.9.高分辨数据为:hrms(esi)m/z 286.1602(m+h
+
),calc.for c
18h21
fno 286.1602.
[0033]
实施例4
[0034]
合成(1r,2r)-1-(2-氟苯基)-2-(吡啶-2-基甲基)环己醇11的反应式如下所示。
[0035][0036]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(2-氟苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-15 0.02mmol,he-1 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通
过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物11,产率为83%,光学纯为96%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=5.6hz,1h),7.95(td,j=8.4,2.1hz,1h),7.54(td,j=7.7,1.8hz,1h),7.21
–
7.13(m,2h),7.12
–
7.07(m,1h),7.06
–
6.95(m,2h),2.86
–
2.74(m,1h),2.74
–
2.64(m,2h),2.22
–
2.09(m,1h),1.93
–
1.79(m,1h),1.78
–
1.69(m,2h),1.59
–
1.51(m,1h),1.49
–
1.31(m,3h);
13
c nmr(300mhz,cdcl3)δ159.2(d,j=244.2hz),159.8,147.4,137.1,136.1(d,j=12.3hz),129.0(d,j=4.9hz),128.1(d,j=8.5hz),124.6,124.0(d,j=3.2hz),121.0,115.8(d,j=25.0hz),75.2(d,j=6.0hz),42.4(d,j=5.5hz),39.2,38.2(d,j=3.6hz),26.4,26.3,21.7;高分辨数据为:hrms(esi)m/z 286.1600(m+h
+
),calc.for c
18h21
fno 286.1602.
[0037]
实施例5
[0038]
合成(1r,2r)-1-(4-氯苯基)-2-(吡啶-2-基甲基)环己醇12的反应式如下所示。
[0039][0040]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(4-氯苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物12,产率为90%,光学纯为97%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.44(d,j=4.3hz,1h),7.57
–
7.42(m,3h),7.25(d,j=8.4hz,2h),7.11
–
7.02(m,1h),6.97(d,j=7.9hz,1h),2.59(qd,j=15.0,5.2hz,2h),2.36
–
2.25(m,1h),1.78
–
1.66(m,4h),1.56
–
1.49(m,1h),1.41
–
1.30(m,3h);
13
c nmr(300mhz,cdcl3)δ159.8,148.4,147.8,136.8,131.7,128.1,126.7,124.6,121.0,75.5,44.8,41.3,26.6,26.4,21.9;高分辨数据为:hrms(esi)m/z 324.1126(m+na
+
),calc.for c
18h20
clnona 324.1126.
[0041]
实施例6
[0042]
合成(1r,2r)-1-(3-氯苯基)-2-(吡啶-2-基甲基)环己醇13的反应式如下所示。
[0043][0044]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(3-氯苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶
剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物13,产率为90%,光学纯为97%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.46(d,j=4.1hz,1h),7.62
–
7.43(m,3h),7.25
–
7.20(m,1h),7.17
–
7.12(m,1h),7.08(dd,j=7.5,5.0hz,1h),6.99(d,j=7.8hz,1h),2.63(qd,j=15.1,5.1hz,2h),2.40
–
2.29(m,1h),1.81
–
1.66(m,4h),1.58
–
1.50(m,1h),1.44
–
1.32(m,3h);
13
c nmr(300mhz,cdcl3)δ159.7,152.3,147.9,136.8,134.1,129.3,126.2,125.7,124.6,123.4,121.0,75.6,44.7,41.4,38.9,26.6,26.4,21.9;高分辨数据为:hrms(esi)m/z 324.1123(m+na
+
),calc.for c
18h20
clnona 324.1126.
[0045]
实施例7
[0046]
合成(1r,2r)-1-(4-溴苯基)-2-(吡啶-2-基甲基)环己醇14的反应式如下所示。
[0047][0048]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(4-溴苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物14,产率为89%,光学纯为97%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.47(d,j=4.9hz,1h),7.59
–
7.40(m,5h),7.10(dd,j=7.1,5.3hz,1h),7.00(d,j=7.8hz,1h),2.63(qd,j=15.0,5.2hz,2h),2.41
–
2.29(m,1h),1.85
–
1.67(m,4h),1.62
–
1.52(m,1h),1.45
–
1.34(m,3h);
13
c nmr(300mhz,cdcl3)δ159.7,148.9,147.7,136.7,131.0,127.2,124.7,121.0,119.8,75.48,44.8,41.3,38.8,26.6,26.4,21.9;高分辨数据为:hrms(esi)m/z 368.0619(m+na
+
),calc.for c
18h20
brnona 368.0620.
[0049]
实施例8
[0050]
合成(1r,2r)-1-(4-甲基苯基)-2-(吡啶-2-基甲基)环己醇15的反应式如下所示。
[0051][0052]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(4-甲基苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物15,产率为85%,光学纯为92%ee,10:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=5.0hz,
1h),7.56
–
7.44(m,3h),7.16(d,j=7.9hz,2h),7.12
–
7.04(m,1h),6.99(d,j=7.8hz,1h),2.64(qd,j=14.7,5.4hz,2h),2.43
–
2.35(m,1h),2.33(s,3h),1.84
–
1.70(m,4h),1.62
–
1.53(m,1h),1.45
–
1.35(m,3h);
13
c nmr(300mhz,cdcl3)δ160.3,148.0,146.7,136.6,135.4,128.7,125.0,124.5,120.8,75.6,45.0,41.5,38.9,26.6,26.5,22.1,20.9;高分辨数据为:hrms(esi)m/z 304.1670(m+na
+
),calc.for c
19h23
nona 304.1672.
[0053]
实施例9
[0054]
合成(1r,2r)-1-(3-甲基苯基)-2-(吡啶-2-基甲基)环己醇16的反应式如下所示。
[0055][0056]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(3-甲基苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物16,产率为73%,光学纯为92%ee,13:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.55(d,j=4.3hz,1h),7.57(td,j=7.7,1.9hz,1h),7.52
–
7.40(m,2h),7.30(d,j=8.2hz,1h),7.17
–
7.01(m,3h),2.70(qd,j=14.8,5.3hz,2h),2.50
–
2.40(m,4h),1.89
–
1.75(m,4h),1.68
–
1.57(m,1h),1.50
–
1.38(m,3h);
13
nmr(300mhz,cdcl3)δ160.3,149.6,148.0,137.4,136.6,127.9,126.8,125.9,124.5,122.2,120.8,75.7,44.9,41.5,38.9,26.7,26.5,22.0,21.7;高分辨数据为:hrms(esi)m/z 304.1670(m+na
+
),calc.for c
19h23
nona 304.1672.
[0057]
实施例10
[0058]
合成(1r,2r)-1-(4-甲氧基苯基)-2-(吡啶-2-基甲基)环己醇17的反应式如下所示。
[0059][0060]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(4-甲氧基苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于25℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物17,产率为58%,光学纯为85%ee,7:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=4.0hz,1h),7.59
–
7.47(m,3h),7.13
–
7.04(m,1h),6.99(d,j=7.8hz,1h),6.88(d,j=8.9hz,2h),3.79
(s,3h),2.65(qd,j=14.7,5.4hz,2h),2.35(dq,j=10.3,5.6hz,1h),1.82
–
1.69(m,4h),1.62
–
1.52(m,1h),1.43
–
1.33(m,3h);
13
c nmr(300mhz,cdcl3)δ160.3,157.8,147.9,141.9,136.7,126.2,124.5,120.9,113.3,75.4,55.2,45.1,41.6,38.8,26.7,26.5,22.1;高分辨数据为:hrms(esi)m/z 320.1619(m+na
+
),calc.for c
19h23
no2na 320.1621.
[0061]
实施例11
[0062]
合成(1r,2r)-1-(3-甲氧基苯基)-2-(吡啶-2-基甲基)环己醇18的反应式如下所示。
[0063][0064]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(3-甲氧基苯基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌80小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物18,产率为60%,光学纯为86%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=4.3hz,1h),7.62(d,j=7.4hz,2h),7.53(t,j=7.7hz,1h),7.35(t,j=7.6hz,2h),7.20(t,j=7.3hz,1h),7.13
–
7.06(m,1h),6.99(d,j=7.7hz,1h),6.12(s,1h),2.63(qd,j=14.9,5.3hz,2h),2.45
–
2.35(m,1h),1.84
–
1.72(m,4h),1.64
–
1.54(m,1h),1.48
–
1.35(m,3h);
13
c nmr(300mhz,cdcl3)δ160.2,149.7,147.9,136.7,128.0,126.0,125.1,124.5,120.9,75.7,44.9,41.4,38.9,26.6,26.5,22.0;高分辨数据为:hrms(esi)m/z298.1798(m+h
+
),calc.for c
19h24
no
2 298.1802.
[0065]
实施例12
[0066]
合成(1r,2r)-1-(2-萘基)-2-(吡啶-2-基甲基)环己醇19的反应式如下所示。
[0067][0068]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(2-萘基)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物19,产率为95%,光学纯为98%ee,13:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.51(d,j=4.5hz,1h),8.17(s,1h),7.91
–
7.77(m,3h),7.67(d,j=8.7hz,1h),7.53
–
7.37(m,3h),7.07(dd,j=7.5,
5.1hz,1h),6.97(d,j=7.8hz,1h),6.31(s,1h),2.77
–
2.51(m,3h),1.95
–
1.78(m,4h),1.66
–
1.59(m,1h),1.51
–
1.41(m,3h);
13
c nmr(300mhz,cdcl3)δ160.1,147.9,147.2,136.7,133.4,132.2,128.2,127.6,127.4,125.7,125.3,124.5,124.0,123.8,120.9,75.9,44.8,41.3,39.0,26.7,26.6,22.1;高分辨数据为:hrms(esi)m/z 340.1671(m+na
+
),calc.for c
22h23
nona 340.1672.
[0069]
实施例13
[0070]
合成(1r,2r)-1-(2-噻吩)-2-(吡啶-2-基甲基)环己醇20的反应式如下所示。
[0071][0072]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-(2-噻吩)-7-(吡啶-2-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物20,产率为62%,光学纯为90%ee,81%ee,2:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.49(d,j=4.3hz,1h),7.62(d,j=7.4hz,2h),7.53(t,j=7.7hz,1h),7.35(t,j=7.6hz,2h),7.20(t,j=7.3hz,1h),7.13
–
7.06(m,1h),6.99(d,j=7.7hz,1h),6.12(s,1h),2.63(qd,j=14.9,5.3hz,2h),2.45
–
2.35(m,1h),1.84
–
1.72(m,4h),1.64
–
1.54(m,1h),1.48
–
1.35(m,3h);
13
c nmr(300mhz,cdcl3)δ160.2,149.7,147.9,136.7,128.0,126.0,125.1,124.5,120.9,75.7,44.9,41.4,38.9,26.6,26.5,22.0;高分辨数据为:hrms(esi)m/z 274.1256(m+h
+
),calc.for c
16h20
nos 274.1260.
[0073]
实施例14
[0074]
合成(1r,2r)-1-甲基-2-(吡啶-2-基甲基)环己醇21的反应式如下所示。
[0075][0076]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-8-(吡啶-2-基)辛基-7-烯-2-酮0.10mmol,手性螺环膦酸cpa-15 0.02mmol,he-1 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于25℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物21,产率为78%,光学纯为92%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.50(d,j=4.5hz,1h),7.62(td,j=7.7,1.7hz,1h),7.24
–
7.06(m,2h),3.32(dd,j=14.0,4.9hz,1h),3.14(s,2h),2.42(dd,j
=14.0,7.9hz,1h),1.93
–
1.77(m,2h),1.69
–
1.53(m,3h),1.49
–
1.33(m,2h),1.22(s,3h),1.19
–
1.15(m,1h);
13
c nmr(300mhz,cdcl3)δ161.7,148.5,136.6,123.8,121.0,72.4,48.6,42.5,39.1,30.0,25.8,24.0,20.8;高分辨数据为:hrms(esi)m/z 206.1537(m+h
+
),calc.for c
13h20
no 206.1539.
[0077]
实施例15
[0078]
合成(1r,2r)-1-己基-2-(吡啶-2-基甲基)环己醇22的反应式如下所示。
[0079][0080]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-1-(吡啶-2-基)十三烷基-1-烯-7-酮0.10mmol,手性螺环膦酸cpa-5 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物22,产率为58%,光学纯为88%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.51(d,j=4.7hz,1h),7.64(td,j=7.7,1.6hz,1h),7.22
–
7.11(m,2h),3.48(s,1h),3.31(dd,j=13.9,4.7hz,1h),2.45(dd,j=13.9,8.4hz,1h),2.02
–
1.89(m,2h),1.68
–
1.46(m,5h),1.36
–
1.19(m,12h),0.89(t,j=6.3hz,3h);
13
c nmr(300mhz,cdcl3)δ161.6,148.0,137.2,124.1,121.2,73.7,49.2,38.2,37.5,32.3,32.0,30.2,29.4,25.4,23.4,22.7,22.4,14.1;高分辨数据为:hrms(esi)m/z 276.2321(m+h
+
),calc.for c
18h30
no 276.2322.
[0081]
实施例16
[0082]
合成(1r,2r)-2-(吡啶-2-基甲基)环己醇23的反应式如下所示。
[0083][0084]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(吡啶-2-基)己烷-6-烯醛0.10mmol,手性螺环膦酸cpa-16 0.02mmol,he-1 0.15mmol,然后加入4毫升纯化干燥后的乙醚,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于25℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌70小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物23,产率为52%,光学纯为81%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.48(d,j=4.5hz,1h),7.61(td,j=7.7,1.7hz,1h),7.20
–
7.06(m,2h),4.11(s,1h),3.22(td,j=9.9,4.1hz,1h),3.04(dd,j=14.2,5.3hz,1h),2.83(dd,j=14.2,4.7hz,1h),2.07
–
1.93(m,1h),1.78
–
1.58(m,4h),
1.32
–
1.21(m,2h),1.20
–
1.10(m,2h);
13
c nmr(300mhz,cdcl3)δ160.7,148.2,136.9,123.9,121.2,74.8,45.4,42.7,35.2,32.1,25.8,24.9;高分辨数据为:hrms(esi)m/z214.1199(m+na
+
),calc.for c
12h17
nona 214.1202.
[0085]
实施例17
[0086]
合成(1r,2r)-2-((4-氯吡啶-2-基)甲基)-1-苯基环己醇24的反应式如下所示。
[0087][0088]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(4-氯吡啶-2-基)-1-苯基环己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-20℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物24,产率为70%,光学纯为91%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.37(d,j=5.4hz,1h),7.56(d,j=7.6hz,2h),7.33(t,j=7.8hz,2h),7.20(t,j=7.3hz,1h),7.09(dd,j=5.4,1.8hz,1h),6.97(d,j=1.5hz,1h),2.66
–
2.54(m,2h),2.44
–
2.37(m,1h),1.83
–
1.73(m,4h),1.62
–
1.56(m,1h),1.46
–
1.39(m,3h);
13
c nmr(300mhz,cdcl3)δ162.0,148.9,148.5,145.0,128.1,126.3,125.0,124.8,121.5,75.6,45.2,41.4,38.6,27.0,26.2,21.9;高分辨数据为:hrms(esi)m/z 302.1303(m+h
+
),calc.for c
18h21
clno302.1306.
[0089]
实施例18
[0090]
合成(1r,2r)-2-((5-氯吡啶-2-基)甲基)-1-苯基环己醇25的反应式如下所示。
[0091][0092]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(5-氯吡啶-2-基)-1-苯基环己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物25,产率为68%,光学纯为91%ee,6:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.43(d,j=2.4hz,1h),8.39(d,j=2.4hz,0.16h),7.59
–
7.54(m,2h),7.46(dd,j=8.3,2.5hz,1h),7.34(t,j=7.7hz,2h),7.21(t,j=7.3hz,1h),6.89(d,j=8.3hz,1h),6.79(d,j=8.3hz,0.17h),4.52(s,1h),2.58(d,j=5.8hz,2h),2.38(dd,j=8.3,4.9hz,1h),1.76(d,j=8.7hz,4h),1.59
(d,j=7.5hz,1h),1.41(d,j=7.0hz,3h);
13
c nmr(300mhz,cdcl3)δ158.8,148.9,147.1,136.1,128.1,126.2,125.1,124.9,75.8,45.1,41.4,38.2,26.8,26.2,21.9;高分辨数据为:hrms(esi)m/z 324.1126(m+na
+
),calc.for c
18h20
clnona 324.1126.
[0093]
实施例19
[0094]
合成(1r,2r)-2-((5-甲氧基吡啶-2-基)甲基)-1-苯基环己醇26的反应式如下所示。
[0095][0096]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(5-甲氧基吡啶-2-基)-1-苯基环己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-2 0.15mmol,然后加入4毫升纯化干燥后的1,2-二氯乙烷,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物26,产率为60%,光学纯为90%ee,10:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.19(d,j=2.9hz,1h),7.60(d,j=7.5hz,2h),7.34(t,j=7.8hz,2h),7.20(t,j=7.3hz,1h),7.06(dd,j=8.5,3.0hz,1h),6.90(d,j=8.5hz,1h),5.84(s,1h),3.82(s,3h),2.65
–
2.49(m,2h),2.41
–
2.30(m,1h),1.84
–
1.70(m,4h),1.62
–
1.53(m,1h),1.45
–
1.35(m,3h);
13
c nmr(300mhz,cdcl3)δ153.8,152.1,149.7,134.9,128.0,126.0,125.1,124.7,121.9,75.8,55.6,45.0,41.5,37.7,26.7,26.5,22.0;高分辨数据为:hrms(esi)m/z 290.1513(m+na
+
),calc.for c
19h23
no2na 290.1515.
[0097]
实施例20
[0098]
合成(1r,2r)-1-苯基-2-(吡啶-4-基甲基)环己醇27的反应式如下所示。
[0099][0100]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-1-苯基-7-(吡啶-4-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,he-1 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于5℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物27,产率为78%,光学纯为92%ee和82%ee,1:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.34(d,j=4.7hz,2h),7.52(d,j=7.6hz,2h),7.36(t,j=7.6hz,2h),7.24(t,j=7.2hz,1h),6.84(d,j=5.1hz,2h),2.64(s,1h),2.42
–
2.33(m,1h),2.24
–
2.13(m,1h),2.00
–
1.91(m,1h),1.83(dd,j=13.2,4.1hz,
1h),1.77
–
1.70(m,2h),1.64
–
1.58(m,1h),1.52
–
1.40(m,2h),1.27
–
1.19(m,1h);
13
c nmr(300mhz,cdcl3)δ150.9,149.2,147.9,128.3,126.6,124.6,124.5,75.9,47.4,41.4,36.0,26.7,25.8,21.8;高分辨数据为:hrms(esi)m/z 268.1700(m+h
+
),calc.for c
18h22
no 268.1696.
[0101]
实施例21
[0102]
合成(1r,2r)-1-苯基-2-(吡啶-3-基甲基)环己醇28的反应式如下所示。
[0103][0104]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-1-苯基-7-(吡啶-3-基)庚-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,bt-2 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-10℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌70小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物28,产率为88%,光学纯为83%ee,》19:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ8.32(d,j=4.0hz,1h),8.17(s,1h),7.51(d,j=7.6hz,2h),7.37(t,j=7.7hz,2h),7.26
–
7.16(m,2h),7.08(dd,j=7.6,4.8hz,1h),2.39(dd,j=13.5,2.3hz,1h),2.22
–
2.10(m,2h),1.98
–
1.81(m,2h),1.81
–
1.68(m,3h),1.67
–
1.55(m,2h),1.51
–
1.38(m,2h);
13
c nmr(300mhz,cdcl3)δ150.2,147.9,146.9,136.9,136.4,128.3,126.5,124.6,123.0,76.0,47.8,41.5,33.6,26.6,25.8,21.9;高分辨数据为:hrms(esi)m/z 268.1694(m+h
+
),calc.for c
18h22
no 268.1696.
[0105]
实施例22
[0106]
合成(1r,2r)-2-(苯并[d]噻唑-2-基甲基)-1-苯基环己醇30的反应式如下所示。
[0107][0108]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(苯并[d]噻唑-2-基)-1-苯基环己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,bt-1 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-40℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物30,产率为72%,光学纯为97%ee,3:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ7.92(d,j=8.1hz,1h),7.73(d,j=7.9hz,1h),7.59
–
7.54(m,2h),7.43
–
7.37(m,1h),7.32(q,j=7.1hz,3h),7.22
–
7.16(m,1h),3.85(s,1h),2.89
–
2.79(m,2h),2.47
–
2.36(m,1h),1.83
–
1.71(m,4h),1.64
–
1.56(m,3h),1.44
–
1.32(m,1h);
13
c nmr(300mhz,cdcl3)δ171.2,153.0,148.1,134.9,
128.3,126.5,125.9,124.8,124.7,122.4,121.3,75.7,45.8,41.4,35.0,26.8,26.0,21.9;高分辨数据为:hrms(esi)m/z 346.1236(m+na
+
),calc.for c
20h21
nosna 346.1236.
[0109]
实施例23
[0110]
合成(1r,2r)-2-(苯并[d]恶唑-2-基甲基)-1-苯基环己醇31的反应式如下所示。
[0111][0112]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(苯并[d]恶唑-2-基)-1-苯基环己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,bt-1 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于-40℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物31,产率为81%,光学纯为95%ee,4:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ7.65
–
7.58(m,1h),7.57
–
7.52(m,2h),7.42
–
7.37(m,1h),7.35
–
7.29(m,2h),7.26
–
7.22(m,2h),7.18(t,j=7.3hz,1h),2.76
–
2.66(m,2h),2.53
–
2.46(m,1h),1.91
–
1.71(m,4h),1.70
–
1.60(m,3h),1.48
–
1.39(m,1h);
13
c nmr(300mhz,cdcl3)δ166.8,150.5,147.5,141.0,128.4,128.3,127.4,126.6,125.6,124.7,124.3,124.0,124.0,119.4,119.3,110.2,75.6,74.6,44.0,43.6,41.5,29.9,28.8,27.2,25.8,25.0,21.8,21.5,20.0;高分辨数据为:hrms(esi)m/z 330.1464(m+na
+
),calc.for c
20h21
no2na 330.1465.
[0113]
实施例24
[0114]
合成(1r,2r)-2-((1-甲基-1h-苯并[d]咪唑-2-基)甲基)-1-苯基环己醇32的反应式如下所示。
[0115][0116]
将105.0μl(0.0015mmol,0.015equiv)的dpz溶液(1.0mg的dpz溶于200ul甲苯中制得)加到25ml schlenk管中,真空除去溶剂。随后加入(z)-7-(1-甲基-1h-苯并[d]咪唑-2-基)-1-苯基己烷-6-烯-1-酮0.10mmol,手性螺环膦酸cpa-1 0.02mmol,bt-1 0.15mmol,然后加入4毫升纯化干燥后的甲苯,依次经过抽真空、-80℃冷冻3-5min、恢复至室温、氩气保护(一般整个流程进行三次),将反应瓶置于25℃恒温箱中,在2个3w蓝色led灯(led灯距反应瓶为3cm;led灯波长为450-455nm)照射条件下搅拌60小时。待反应结束后,用旋转蒸发仪蒸去溶剂,直接通过柱层析分离(体积比,正己烷/乙酸乙酯=30~5:1)即得到产物32,产率为75%,光学纯为88%ee,3:1dr。核磁数据为:1h nmr(300mhz,cdcl3)δ7.63
–
7.52(m,3h),7.35(t,j=7.5hz,2h),7.29
–
7.10(m,4h),3.33(s,3h),2.77(dd,j=14.9,10.1hz,1h),2.49
–
2.39(m,1h),2.36
–
2.20(m,2h),1.99
–
1.48(m,8h);
13
c nmr(300mhz,cdcl3)δ154.1,
147.1,141.8,135.4,127.7,126.6,125.6,121.2,121.0,118.1,108.5,74.2,44.0,33.6,29.0,27.0,25.1,21.2,20.5;hrms(esi)m/z 343.1778(m+na
+
),calc.for c
21h24
n2ona 343.1781.
[0117]
生物活性评价
[0118]
1.h2o2诱导的大鼠肾上腺嗜铬细胞瘤细胞(pc12)氧化应激损伤模型的建立
[0119]
取对数期生长的pc12细胞,胰酶消化后,以1000r/min离心5min,去除上清液后,加入完全培养液吹打至单个细胞状态,调整细胞密度为5
×
106个/ml。
[0120]
2.细胞氧化应激损伤模型的建立
[0121]
96孔板内,每孔加入4000个pc12细胞,在37℃、5%co2的培养条件下贴壁培养24h后,吸除上清,分别加入用dmem培养液配成的1mmol/l、800μmol/l、600μmol/l、400μmol/l、200μmol/l、100μmol/l的h2o
2 100μl,分别作用4h、8h、16h后,吸除上清,每孔加入90μl dmem培养液、10μl cck8作用2h后在450nm处测定吸光度。空白组中为不加细胞的dmem培养基100μl。每组设6个复孔。综合考虑选用200μmol/l的h2o2[0122]
作用16h作为最佳建模条件。
[0123]
3.细胞活力的测定观测
[0124]
取pc12细胞种于96孔板内,每孔100μl,在37℃、5%co2的培养条件下贴壁培养24h后,吸除上清,空白组和h2o2组加入100μldmem培养液,给药组分别加入用dmem培养液配成的1μmol/l浓度化合物100μl,预培养8h后,吸除上清,除空白组外其他组再加入用dmem培养液配成的200μmol/l的h2o
2 100μl,作用18h后,吸除上清,每孔加入90μl dmem培养液、10μl cck8,作用2h后,在450nm处测定吸光度。每组设6个复孔。细胞活力率=[1-(对照组-给药组)/(对照组-空白组)]
×
100%。结果如表1所示。
[0125]
表1不同手性含氮杂芳烃手性环状醇化合物对pc12细胞氧化应激的影响
[0126][0127][0128]
注:h2o2组浓度为200μmol/l,给药组分别加入1μmol/l浓度化合物(实施例),预培养后,加入200μmol/l的h2o2,空白组为100%。
[0129]
细胞活力测定结果如表1所示,与空白组相比,h2o2组的细胞活力明显下降;同时与h2o2组相比,给药组的细胞活力明显升高。实验结果表明实施例中的化合物可明显升高h2o2组细胞的细胞活力。
[0130]
最后所应说明的是:上述实施例仅用于说明而非限制本发明的技术方案,任何对本发明进行的等同替换及不脱离本发明精神和范围的修改或局部替换,其均应涵盖在本发明权利要求保护的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1