鸽腺病毒B型荧光定量检测引物、探针及试剂盒
鸽腺病毒b型荧光定量检测引物、探针及试剂盒
技术领域
1.本发明属于动物病毒学领域,具体涉及一种鸽腺病毒b型荧光定量检测引物、探针及试剂盒。
背景技术:
2.人类养鸽历史悠久,鸽经驯化成观赏鸽、赛鸽和肉鸽,拥有较强的免疫系统,加上鸽舍多采用开放式或半开放式,空气流通好,空气新鲜,相比较其他畜禽,鸽生病较少。然而,随着养鸽业规模化、集约化的迅速发展,饲养总量、饲养密度的增加,鸽的饲养方式发生了改变,由于饲养管理水平低,疫病防治意识差,加上鸽的贸易流通频繁(包括信鸽的比赛),鸽病也越来越多,越来越严重,越来越复杂。近年来鸽病毒性传染病严重威胁着养鸽业,据国内外研究,已经报道的鸽病毒性传染病有鸽新城疫、鸽痘、鸽腺病毒感染、h9亚型低致病性禽流感、鸽ⅰ型疱疹病毒感染、鸽轮状病毒感染和鸽圆环病毒感染等。腺病毒由于种类多,血清型复杂,宿主广泛,或作为主要的致病性病原或作为与其他致病性病原共感染的条件致病性病原,对养鸽业造成严重的威胁。禽腺病毒(fowl aviadenovirus,fadv)的血清2型、4型、5型、6型、8型、10型和12型均有在鸽群中检测到,有的血清型会引起鸽出现包涵体肝炎。鸽腺病毒a型(pigeon aviadenovirus a,piadv
‑
a)和鸽腺病毒b型(pigeon aviadenovirus b,piadv
‑
b)是不同于fadv的腺病毒,虽然同属于禽腺病毒属(aviadenovirus),却是不同的病毒种。鸽腺病毒a型主要与幼鸽疾病综合征相关,幼鸽发病后出现呕吐,腹泻,食欲下降,甚至死亡。鸽腺病毒b型可以感染所有日龄的鸽子,其特征是引起鸽子猝死和广泛性肝炎坏死症。也有研究表明在出现呕吐、腹泻的鸽群的粪便中也能检测到鸽腺病毒b型。鸽腺病毒a型基因组大小为45480bp,鸽腺病毒b型的基因组大小为41981bp,两者的核苷酸同源性为54.9%,国际病毒分类委员会(the international committee on taxonomy of viruses,ictv)已经将这两种病毒分类为不同的病毒种。虽然鸽腺病毒b型之前在国外有报道,但国内一直未见报道,近期我们从国内发病的鸽群中也检测到了该病毒的存在。
3.实时荧光定量pcr方法(real
‑
time pcr)是一种在dna扩增反应中,以荧光化学物质检测每次聚合酶链式反应(pcr)循环后产物总量的方法。实时荧光定量pcr在pcr扩增过程中,通过荧光信号,对pcr进程进行实时监测。由于在pcr扩增的指数期,模板的ct值和该模板的起始拷贝数存在线性关系。荧光探针法是用序列特异的荧光标记探针来检测产物,探针法的出现使得定量pcr技术的特异性比常规pcr技术大大提高。taqman探针法是指real
‑
time pcr扩增时在加入一对引物时,还同时另外加入一个特异性的荧光探针,该探针只与模板特异性地结合,其结合位点在两条引物之间。探针的5
′
端标记有荧光报告基团(reporter,r),如fam、vic、cy5、joe等,3
′
端标记有荧光淬灭基团,如eclipse、tamra、bhq
‑
1、bhq
‑
2等。当探针完整的时候,5
′
端报告基团经仪器光源激发的荧光正好被近距离的3
′
端荧光基团淬灭,仪器检测不到5
′
端报告基团所激发的荧光信号。随着real
‑
time pcr的进行,taq酶在链延伸过程中遇到与模板结合的探针,其5
′‑3′
外切酶活性(此活性是双链特异
性的,游离的单链探针不受影响)就会切割探针,释放5
′
端报告基团游离于反应体系中,远离3
′
端荧光淬灭基团的屏蔽,5
′
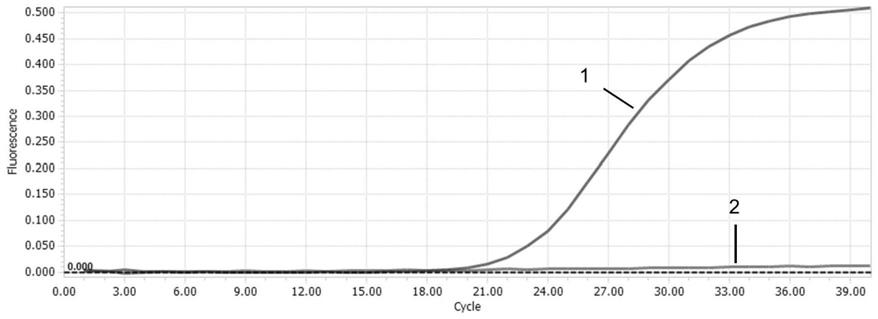
端报告基团受激发所发射的荧光信号就可以被监测到。也就是说每扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积与real
‑
time pcr产物形成完全同步,报告信号的强度就代表了模板dna的拷贝数。由于taqman实时荧光定量探针在常规sybr greenⅰ实时荧光定量pcr方法的基础上,加入一条更特异性的探针,使检测目的基因只有和taqman探针特异性的结合,才能检测到阳性扩增信号,使检测结果更特异性,被广泛应用于动物传染病学检测领域。此外,不同荧光报告基团(reporter,r)标记,可同时对单一样本(尤其针对样品难以获取或病原载量较低样本)开展多种病原学检测,具有高通量、成本低廉、结果迅速等优点,在新发传染病等领域被广泛使用。
技术实现要素:
4.本发明的目的在于提供一种用于鸽腺病毒b型实时荧光定量pcr检测的引物和探针及其应用与试剂盒。本发明建立的鸽腺病毒b型taqman探针实时荧光定量pcr方法灵敏度高、稳定性好、特异性强、重复性好,最低可检测34拷贝/μl,该方法不仅可用于流行病学检测,还可以用于鸽腺病毒b型感染程度的精确定量,可有效用于鸽腺病毒b型致病机制差异研究,本发明可填补国内外相关研究领域空白。
5.本发明的目的通过如下技术方案实现:
6.一种用于鸽腺病毒b型实时荧光定量pcr检测的引物和探针,所述引物序列如下:
7.引物piadv
‑
b
‑
tf(seq id no.1):5
’‑
cgtggatgacacgcttctta
‑3’
;
8.引物piadv
‑
b
‑
tr(seq id no.2):5
’‑
ttccattctcatccgcagttat
‑3’
;所述探针序列如下:
9.探针piadv
‑
b
‑
probe(seq id no.3):5
’‑
actgggagttcacctcaataccga
‑3’
;
10.其中,探针piadv
‑
b
‑
probe(seq id no.3)其5
’‑
端标记荧光报告基团fam,3
’‑
端标记荧光淬灭基团eclipse。
11.所述引物和探针用于鸽腺病毒b型的实时荧光定量pcr检测方法为:
12.(1)核酸的制备
13.用北京全式金生物技术有限公司核酸提取试剂盒(easypure viral dna/rna kit)按照说明书方法进行操作提取鸽腺病毒b型dna。
14.(2)阳性标准品的构建:
15.利用oligo 7引物设计软件设计引物,上游引物piadv
‑
b
‑
f:5'
‑
aacagtcggcattaaccccag
‑
3'、下游引物piadv
‑
b
‑
r:5'
‑
ccgataccactttccgtagcc
‑
3',预期扩增片段大小为315bp,引物由生工生物工程(上海)股份有限公司合成。
16.使用pcr扩增试剂(2
×
pcr master试剂)推荐的100μl体系进行扩增,其中2
×
pcr master mix反应液25μl、上/下游引物(piadv
‑
b
‑
f/piadv
‑
b
‑
r)(引物浓度为20μmol
·
l
‑1)各1μl、模板dna2μl,补充灭菌去离子水至总反应体积50μl。混匀后进行pcr扩增,扩增条件为94℃预变性5min后进入循环,94℃变性30s、54℃退火35s、72℃延伸30s,35个循环结束后,72℃终延伸10min。
17.pcr反应结束后,用1.0%的琼脂糖凝胶电泳对pcr产物进行鉴定,利用琼脂糖凝胶回收试剂盒对特异性目的片段进行切胶回收。按照peasy
‑
t1 simple cloning kit克隆连
接试剂盒说明书将目的基因片段克隆到peasy
‑
t1载体上,随机挑取10个单菌落于氨苄青霉素(含量为100μg/ml)抗性的lb液体培养基培养14h后,利用快速质粒小提试剂盒提取相应的质粒。采用pcr扩增时的引物(piadv
‑
b
‑
f/piadv
‑
b
‑
r)和条件对提取的质粒进行pcr鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序。经blast分析后,符合实验预期的阳性重组质粒作为本研究的标准品(p
‑
piadv
‑
b)。利用分光光度计测定其浓度后,计算相应的拷贝数为3.4
×
109拷贝/μl。经线性化酶切后,进行连续10倍倍比稀释,将获得的浓度分别为3.4
×
108拷贝/μl至3.4
×
100拷贝/μl,均冻存于
‑
20℃备用。
18.(3)taqman实时荧光定量pcr反应条件优化:
19.按照probe qpcr mix试剂盒说明书配制20μl的实时荧光定量pcr反应体系,在不同引物终浓度、对不同反应条件进行优化,确定建立的实时荧光定量pcr方法的最佳反应条件。
20.反应体系的优化时,主要对引物浓度、探针浓度以及引物与探针的用量进行优化。
21.引物浓度优化:将上游引物piadv
‑
b
‑
tf以及下游引物piadv
‑
b
‑
tr的浓度均倍比稀释为2.5μmol/l、5.0μmol/l、10μmol/l、20μmol/l再分别进行检测,通过试验结果的分析比较,确定上游引物piadv
‑
b
‑
tf以及下游引物piadv
‑
b
‑
tr的最佳浓度为10μmol/l。
22.探针浓度优化:将探针piadv
‑
b
‑
probe的浓度倍比稀释为2.5μmol/l、5.0μmol/l、10μmol/l、20μmol/l再分别进行检测,通过试验结果的分析比较,确定探针piadv
‑
b
‑
probe的最佳浓度为10μmol/l。
23.退火和延伸温度进行优化时,所选的退火和延伸温度为54℃、56℃、58℃、60℃、62℃以及64℃,通过试验结果的分析比较,确定最优的退火和延伸温度均为58℃。
24.通过上述方法筛选出的最佳反应体系为:probe qpcr mix(2
×
)混合液10μl、上/下游引物(piadv
‑
b
‑
tf和piadv
‑
b
‑
tr)(10μmol/l)各0.4μl、探针(piadv
‑
b
‑
probe)(10μmol/l)0.8μl、dna模板1μl、水(nuclease
‑
free water)补足至20μl。优化后的最佳反应条件为:95℃预变性120s;95℃10s、58℃30s,共40个循环。循环结束后,做出对应的熔解曲线。
25.(4)标准曲线的建立:
26.分别以标准品(p
‑
piadv
‑
b)含量为3.4
×
108拷贝/μl
‑
3.4
×
103拷贝/μl的标准品作为模板,用优化后的反应条件进行扩增,获得扩增动力学曲线。以标准品起始拷贝数的常用对数为横坐标,以循环数阈值(cycle threshold,ct值)为纵坐标,推导出标准线性回归方程,获得实时荧光定量pcr标准曲线的线性方程的斜率为
‑
3.307,y轴截距为39.57,相关系数为1.000,扩增效率为101%,表明建立的实时荧光定量pcr方法的标准曲线具有良好的线性关系。
27.分别以标准品(p
‑
piadv
‑
b)含量为3.4
×
105拷贝/μl至3.4
×
100拷贝/μl的标准品作为模板,用优化后的反应条件进行扩增,获得本发明的最低检测限为34拷贝/μl。
28.本发明还提供一种所述的引物和探针在制备用于鸽腺病毒b型特异性检测试剂盒中的应用。
29.本发明还提供一种鸽腺病毒b型实时荧光定量pcr检测试剂盒,所述试剂盒包括所述的引物(引物piadv
‑
b
‑
tf和引物piadv
‑
b
‑
tr)和探针(piadv
‑
b
‑
probe)。
30.所述的试剂盒,其结果判定如下:
31.当fam通道出现阳性扩增信号,结果判定为鸽腺病毒b型阳性;
32.当fam通道未出现阳性扩增信号,结果判定为鸽腺病毒b型阴性。
33.较之现有技术而言,本发明的优点在于:
34.1.检测快速、高效:该检测方法无需进行常规琼脂糖凝胶电泳检测,反应结束后即可通过实时荧光定量pcr机器自带的程序进行结果判定。
35.2.定量准确:通过制备标准品、绘制标准曲线,根据检测待检样品中的ct值,直接对鸽腺病毒b型感染给出判定,并可对其感染程度进行准确定量。
36.3.灵敏度高:最低可检测34拷贝/μl。
37.4.特异性强:与鸽群中常见的病原鸽圆环病毒(picov)、鸽副黏病毒(pindv)、鸽轮状病毒(pirotv)、h9亚型禽流感病毒(h9 aiv)均无反应信号,仅对鸽腺病毒b型检测出现荧光信号。
38.5.重复性好:建立的实时荧光定量pcr检测方法进行piadv
‑
b检测的组内变异系数为0.18%
‑
2.11%,组间变异系数0.44%
‑
2.29%,表明建立的实时荧光定量pcr检测方法重复性好。
附图说明
39.图1实时荧光定量pcr检测piadv
‑
b扩增曲线;其中,1为piadv
‑
b扩增曲线,2为阴性对照。
40.图2实时荧光定量pcr检测piadv
‑
b的标准曲线。
41.图3实时荧光定量pcr检测piadv
‑
b敏感性试验结果图;其中,1:模板浓度3.4
×
105拷贝/μl;2:模板浓度3.4
×
104拷贝/μl;3:模板浓度3.4
×
103拷贝/μl;4:模板浓度3.4
×
102拷贝/μl;5:模板浓度3.4
×
101拷贝/μl;6为3.4
×
100拷贝/μl。
42.图4为实时荧光定量pcr检测piadv
‑
b特异性试验的结果图;其中:1为piadv
‑
b;c为picov、pindv、pirotv、h9 aiv对照样品。
具体实施方式
43.下面结合说明书附图和实施例对本发明内容进行详细说明:
44.实施例1
45.1.相关试验病原
46.试验用病原鸽腺病毒b型(piadv
‑
b)、鸽圆环病毒(picov)、鸽副黏病毒(pindv)、鸽轮状病毒(pirotv)、h9亚型禽流感病毒(h9 aiv)均由福建省农业科学院畜牧兽医研究所鉴定和保存。
47.2.核酸的制备
48.用北京全式金生物技术有限公司核酸提取试剂盒(easypure viral dna/rna kit)按照说明书方法进行操作提取鸽腺病毒b型dna。并按照试剂盒的方法同时提取试验对照的核酸dna(picov,无需进行反转录)或核酸rna(pindv、pirotv、h9 aiv,需要反转录成cdna),均放置
‑
20℃保存备用。
49.3.taqman实时荧光定量pcr检测方法的引物设计
50.根据鸽腺病毒b型核苷酸序列分析比对结果,利用引物设计软件primerexpress设计特异性的引物和探针,序列为:
51.引物piadv
‑
b
‑
tf(seq id no.1):5
’‑
cgtggatgacacgcttctta
‑3’
52.引物piadv
‑
b
‑
tr(seq id no.2):5
’‑
ttccattctcatccgcagttat
‑3’
53.探针piadv
‑
b
‑
probe(seq id no.3):5
’‑
actgggagttcacctcaataccga
‑3’
54.其中探针piadv
‑
b
‑
probe(seqn0.3)其5
’‑
端标记荧光报告基团fam,3
’‑
端标记荧光淬灭基团eclipse;
55.引物和探针均在生工生物工程(上海)股份有限公司合成。
56.4.piadv
‑
b阳性标准品的构建
57.利用oligo 7引物设计软件设计引物,上游引物piadv
‑
b
‑
f:5'
‑
aacagtcggcattaaccccag
‑
3'、下游引物piadv
‑
b
‑
r:5'
‑
ccgataccactttccgtagcc
‑
3',预期扩增片段大小为315bp。
58.使用pcr扩增试剂(2
×
pcr master试剂)推荐的100μl体系进行扩增,其中2
×
pcr master mix反应液25μl、上/下游引物(piadv
‑
b
‑
f/piadv
‑
b
‑
r)(引物浓度为20μmol
·
l
‑1)各1μl、模板dna2μl,补充灭菌去离子水至总反应体积50μl。混匀后进行pcr扩增,扩增条件为94℃预变性5min后进入循环,94℃变性30s、54℃退火35s、72℃延伸30s,35个循环结束后,72℃终延伸10min。
59.pcr反应结束后,用1.0%的琼脂糖凝胶电泳对pcr产物进行鉴定,利用琼脂糖凝胶回收试剂盒对特异性目的片段进行切胶回收。按照peasy
‑
t1 simple cloning kit克隆连接试剂盒说明书将目的基因片段克隆到peasy
‑
t1载体上,随机挑取10个单菌落于氨苄青霉素(含量为100μg/ml)抗性的lb液体培养基培养14h后,利用快速质粒小提试剂盒提取相应的质粒。采用pcr扩增时的引物(piadv
‑
b
‑
f/piadv
‑
b
‑
r)和条件对提取的质粒进行pcr鉴定,将筛选出的阳性重组质粒送生工生物工程(上海)股份有限公司进行测序。经blast分析后,符合实验预期的阳性重组质粒作为本研究的标准品(p
‑
piadv
‑
b)。利用分光光度计测定其浓度后,计算相应的拷贝数为3.4
×
109拷贝/μl。经线性化酶切后,进行连续10倍倍比稀释,将获得的浓度分别为3.4
×
108拷贝/μl至3.4
×
100拷贝/μl,均冻存于
‑
20℃备用。
60.5.taqman实时荧光定量pcr特异性检测方法的建立
61.5.1 taqman实时荧光定量pcr检测piadv
‑
b反应条件优化
62.按照probe qpcr mix试剂盒说明书配制20μl的实时荧光定量pcr反应体系,筛选出的最佳反应体系为:probe qpcr mix(2
×
)混合液10μl、上/下游引物(piadv
‑
b
‑
tf和piadv
‑
b
‑
tr)(10μmol/l)各0.4μl、探针(piadv
‑
b
‑
probe)(10μmol/l)0.8μl、dna模板1μl、水(nuclease
‑
free water)补足至20μl。优化后的最佳反应条件为:95℃预变性120s;95℃10s、58℃30s,共40个循环(扩增曲线见图1)。
63.分别以标准品(p
‑
piadv
‑
b)含量为3.4
×
108拷贝/μl
‑
3.4
×
103拷贝/μl的标准品作为模板,用优化后的反应条件进行扩增,获得扩增动力学曲线。以标准品起始拷贝数的常用对数为横坐标,以循环数阈值(cycle threshold,ct值)为纵坐标,推导出标准线性回归方程(标准曲线,见图2),获得实时荧光定量pcr标准曲线的线性方程的斜率为
‑
3.307,y轴截距为39.57,相关系数为1.000,扩增效率为101%,表明建立的实时荧光定量pcr方法的标准曲线具有良好的线性关系。
64.5.2 taqman实时荧光定量pcr检测piadv
‑
b的敏感性试验
65.分别以标准品(p
‑
piadv
‑
b)含量为3.4
×
105拷贝/μl至3.4
×
100拷贝/μl的标准品
作为模板,用优化后的反应条件进行扩增,获得本发明的最低检测限为34拷贝/μl(图3)。
66.5.3 taqman实时荧光定量pcr检测piadv
‑
b的特异性试验
67.用优化后的实时荧光定量pcr条件,分别对piadv
‑
b、picov、pindv、pirotv、h9 aiv进行检测。结果可见,仅对piadv
‑
b出现阳性扩增,对picov、pindv、pirotv、h9 aiv均未见阳性扩增信号(图4),表明建立的实时荧光定量pcr方法特异性强。
68.5.4 taqman实时荧光定量pcr检测piadv
‑
b重复性试验
69.用建立的实时荧光定量pcr方法分别对质粒含量为3.4
×
106、3.4
×
104、3.4
×
102的标准品进行检测,每种质粒含量重复3次,计算组内(intra
‑
group)变异系数。分别将上述不同质粒含量的标准品分装后置于
‑
20℃保存,每隔7d取出,用建立的实时荧光定量pcr方法进行检测,共检测3次,计算组间(inter
‑
group)变异系数。建立的实时荧光定量pcr检测方法的组内变异系数为0.18%
‑
2.11%,组间变异系数0.44%
‑
2.29%,表明建立的实时荧光定量pcr检测方法重复性好。
70.6.临床应用
71.使用建立的鸽腺病毒b型特异性检测方法,对35份临床送检鸽源病料进行鸽腺病毒b型感染的实时荧光定量pcr检测,结果显示:fam通道出现荧光信号阳性样品3份(浓度分别为1.1
×
106拷贝/μl、6.3
×
103拷贝/μl和2.9
×
105拷贝/μl),表明为鸽腺病毒b型阳性,阳性率为8.57%。。
72.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1