中华绒螯蟹肿瘤坏死因子及其应用
本发明涉及中华绒螯蟹肿瘤坏死因子,及其编码基因与应用。
背景技术:
肿瘤坏死因子(tumornecrosisfactor,tnfs)是一类强大的炎症细胞因子,参与炎症反应、细胞凋亡、细胞增殖和免疫应答等。tnfs还通过调控细胞死亡和存活而在宿主防御机制中发挥效应分子的作用。tnf超家族激活细胞死亡和存活途径,作为抵抗入侵病毒的强大屏障。在哺乳动物中,已有二十多个tnf配体超家族成员基因的结构和功能得到明确定义。大多数tnf配体超家族成员是ⅱ型跨膜蛋白,具有保守的同型三聚体c端tnf同源结构域(tnfhomologydomain,thd)。thd折叠成反平行的β-三明治结构,并组装成三聚体,每个配体有三个受体结合位点,在相邻亚基之间形成凹槽。thd通过富含半胱氨酸的结构域(cysteine-richdomain,crd)与其同源受体结合,而该家族的其他成员则由蛋白水解切割位点组成,以产生可溶形式。crd的关键特征是存在三种二硫键,这是thd在引发细胞应答的多种信号途径中的适应性基础。多价配体在信号转导中诱导受体簇,从而实现基本的系统排列。
在硬骨鱼如牙鲆、虹鳟鱼、金头鲷科、鲤鱼和斑点叉尾鮰中,已鉴定到tnf-α基因。除此之外,在斑马鱼和虹鳟鱼中还发现了一些tnf配体超家族成员。哺乳动物和硬骨鱼之间的tnfs在保守残基和功能上有许多相似之处。一个成熟蛋白质的释放是通过两个保守的半胱氨酸参与的,这些半胱氨酸参与了跨膜结构域中二硫键的形成。由于tnf参与多种蛋白质的表达和功能,因此对tnf配体超家族进行了积极的研究。最近,在一些水生动物如海胆、海鞘和鲍鱼中也发现了tnf配体超家族成员。在栉比扇贝和太平洋牡蛎中还发现了一种新的转录因子——脂多糖(lps)诱导的tnf-α因子,该因子在tnf信号通路中起着重要的作用。
中华绒螯蟹eriocheirsinensis(俗称河蟹、大闸蟹)是一种重要的淡水养殖蟹类,可创造巨大的经济价值。然而,随着集约化养殖的快速发展,由细菌、病毒和寄生虫等病原引起的各种病害日益严重,给河蟹养殖业造成了重大的经济损失。中华绒螯蟹缺乏真正的适应性免疫,只能依赖其先天免疫系统来识别病原,抵御病原侵染。因此,研究其免疫防御机制,尤其是免疫相关基因作用机制对于疾病防御具有重要意义。早期实验发现,tnf蛋白在抗病甲壳动物中表达量上调,可能在甲壳动物的抗细菌性疾病的免疫反应中发挥重要作用。因此,为治疗中华绒螯蟹细菌性疾病,研究和开发河蟹tnf蛋白有重要意义。
技术实现要素:
针对上述现有技术,本发明经研究发现了一种中华绒螯蟹肿瘤坏死因子,提供了其编码基因,以及其在增强中华绒螯蟹免疫防御功能、抑制金黄色葡萄球菌或/和副溶血弧菌中的应用。
本发明是通过以下技术方案实现的:
中华绒螯蟹肿瘤坏死因子,其氨基酸序列如seqidno.1所示。
上述中华绒螯蟹肿瘤坏死因子的编码基因(cdna),其核苷酸序列如seqidno.2所示。
所述中华绒螯蟹肿瘤坏死因子在中华绒螯蟹免疫防御功能中的用途。
所述中华绒螯蟹肿瘤坏死因子在抑制金黄色葡萄球菌或/和副溶血弧菌中的应用。
所述中华绒螯蟹肿瘤坏死因子在制备抑制金黄色葡萄球菌或/和副溶血弧菌的药物中的应用。
所述中华绒螯蟹肿瘤坏死因子在治疗由金黄色葡萄球菌或/和副溶血弧菌引起的疾病中的应用。
所述中华绒螯蟹肿瘤坏死因子在制备治疗由金黄色葡萄球菌或/和副溶血弧菌引起的疾病的药物中的应用。
一种重组载体,其包含有中华绒螯蟹肿瘤坏死因子的编码基因。
一种表达中华绒螯蟹肿瘤坏死因子的重组工程菌,其基因组中包含有中华绒螯蟹肿瘤坏死因子的编码基因。
上述重组载体、重组工程菌在制备中华绒螯蟹肿瘤坏死因子中的应用。
一种抑制金黄色葡萄球菌或/和副溶血弧菌的制剂,其含有有效剂量的中华绒螯蟹肿瘤坏死因子。
一种用于治疗由金黄色葡萄球菌或/和副溶血弧菌引起的疾病的制剂,其含有有效剂量的中华绒螯蟹肿瘤坏死因子。
seqidno.1:
mekkatytvispphpsrrlwlawvaagvsvvalvvacvtaavvneqstrvnhleerlmemeshledilrltianheydnldydgedgdyvyydnqdddeitvrrvlrrkrqansidnelpdssavpiydqaygvnlktqrapkglrlydslldtneedddqageetvpettdspikphhrvsnlwvpkrrrdrlpsssgppplsartlvrkidsangqenelaenlfpnvsppslrrsrlterrsrtkslhgsrrglkrrqkqrvrsnptpssvvfrsslvkatsrhdgftspnsvvpqanglleapkvvpqdgsrkihafsrpppssvygkkrrkirnkqtrkwrrrptitlahftastanstrlslpttgehldwtaapwmeklglntkysvdegtvtvreaglyyiyaqilhesgragggfqilvddipilecqapalrpapschtggvsylprnaevrvrdldnylrtvhvgrntffgmvklmdapntaeelvla。
seqidno.2(单下划线所示序列是荧光定量pcr引物,estnf-qf:5’-aagccacatacacagtcatctctcc-3’和estnf-qr:5’-atctccatcagccgttcctcc-3’;双下划线所示序列是race引物estnf-f:5’-cgggtccaggcgtggtctgaaaagg-3’和estnf-r:5’-tggaggcggtgaagtgagccagggtgat-3’):
本发明经研究发现了中华绒螯蟹肿瘤坏死因子,通过细菌生长和细菌清除实验研究了estnf蛋白的抗细菌作用,研究结果表明estnf蛋白能够抑制金黄色葡萄球菌和副溶血弧菌的生长,并促进河蟹体内细菌的清除速率。本发明公开了estnf基因在中华绒螯蟹免疫防御功能中的用途,为预防病原菌引起的疾病提供了理论基础,也为河蟹健康养殖提供了理论指导。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
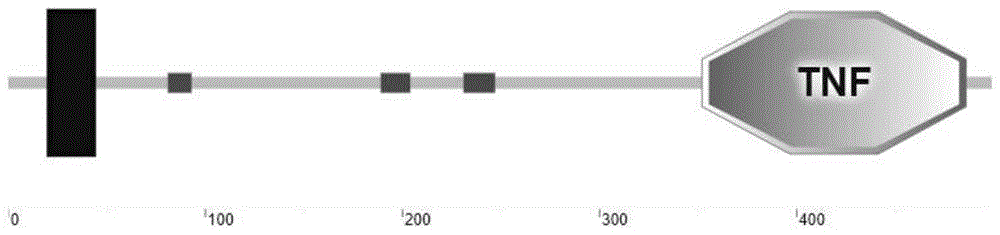
图1:蛋白结构域预测图。
图2;estnf基因在河蟹不同组织(血细胞、心脏、肝胰腺、鳃、肌肉、肠道、神经、眼柄)中的表达分布情况。
图3:estnf基因受金黄色葡萄球菌和副溶血弧菌刺激后的表达模式变化示意图,其中,a:金黄色葡萄球菌;b:副溶血弧菌。
图4:sds-page胶结果示意图,其中,m:蛋白分子量标准;1:包含pet30a-estnf重组质粒的escherichiacolitransetta(de3)菌株诱导前;2:包含pet30a-estnf重组质粒的e.colitransetta(de3)菌株0.5mmiptg诱导后;3:纯化的restnf蛋白。
图5:体外细菌生长抑制实验结果示意图,其中,a:副溶血弧菌;b:金黄色葡萄球菌。
图6:体内细菌清除实验结果示意图,其中,a:副溶血弧菌;b:金黄色葡萄球菌。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
实施例一
1.中华绒螯蟹总rna的提取
提取健康中华绒螯蟹(每只体重约40g,购买于江苏省扬州市宝应县中华绒螯蟹养殖塘口,采集人黄颖,采集日期2018.06.18)血细胞、心脏、肝胰腺、鳃、肌肉、肠道、神经和眼柄组织。另外,将50μl金黄色葡萄球菌和副溶血弧菌(约3×107个细菌)分别注入河蟹第二步足,提取不同时间段(2、6、12、和24h)的肝胰腺组织用来分析病原菌刺激后estnf表达量的变化。
(1)100mg组织中加入1mltrizol试剂,冰浴中充分匀浆;随后转入1.5ml离心管中,15-30℃静置5min;
(2)加入200μl氯仿,剧烈振荡30s并于15-30℃静置5min;
(3)于4℃,12,000rpm,离心10min;离心后样品分层,上层水相中含rna,下层有机相中含蛋白和dna;
(4)取上清,加入0.5ml异丙醇,轻轻混匀,于15-30℃静置10min后,在管底会出现胶状沉淀,即为rna;
(5)于4℃,12,000rpm,离心10min后弃去上清;
(6)向沉淀中加入1ml75%乙醇,轻轻混匀;
(7)于4℃,12,000rpm,离心5min后弃上清;
(8)将rna样品凉干,加入适量depc水溶解(可于55-60℃促溶10min);将rna样品分装,-80℃冻存。
2.cdna的合成
2.1smarterracecdnaamplificationkit反转录cdna
(1)混合下列试剂至无rna酶pcr管中,轻微离心后室温放置一旁,待步骤(6)使用:
(2)将下列试剂分别加入两个无rna酶pcr管中:
forpreparationof5’-race-readycdna:
rna1.0-2.75μl;
5’-cdsprimera1.0μl;
forpreparationof3’-race-readycdna:
rna1.0-3.75μl;
3’-cdsprimera1.0μl;
(3)步骤(2)离心管中加入无菌水,5’-race-readycdna和3’-race-readycdna分别补齐至3.75μl和4.75μl,轻微离心混合;
(4)离心管放至pcr仪中孵育,72℃3min,42℃2min,样品冷却至4℃,离心14,000g10s;
(5)5’-race-readycdna离心管中加入1μlsmarterⅱaoligo;
(6)向步骤(1)离心管中依次加入下列试剂:
(7)取步骤(6)中混合物,加入步骤(4)(3’-race-readycdna)或步骤(5)(5’-race-readycdna)的离心管中,总体积10μl;
(8)轻微离心混合,将样品收集到管底;
(9)离心管放至pcr仪中孵育,42℃90min,70℃10min,样品冷却至4℃,离心14,000g10s;
(10)取100μltricine-edtabuffer稀释合成的cdna模板,样品放至-20℃冰箱保存。
2.2primescripttmrtreagentkit(perfectrealtime)反转录cdna
(1)以中华绒螯蟹总rna作为模板,按下列组份配制rt反应液(在冰上进行):
(2)反转录条件:37℃15min,85℃5s,4℃冷却;
(3)将上述溶液-20℃冰箱保存。
3.estnf基因扩增与纯化
3.1通过分析中华绒螯蟹肝胰腺组织的转录组数据,发现tnf基因的中间片段,设计基因特异性前引物estnf-f:5’-cgggtccaggcgtggtctgaaaagg-3’和通用性后引物upm配对,以中华绒螯蟹肝胰腺3’-race-readycdna为模板扩增目的基因的3’端序列;并设计基因特异性后引物estnf-r:5’-tggaggcggtgaagtgagccagggtgat-3’,和通用性引物upm配对,以中华绒螯蟹肝胰腺5’-race-readycdna为模板扩增目的基因的5’端序列。
(1)pcr体系:如表1所示;
表1
(2)pcr扩增程序:94℃30s、72℃2min,5个循环;94℃30s、70℃30s、72℃2min,5个循环;94℃30s、68℃30s、72℃2min,25个循环;72℃10min;4℃10min。
3.2将pcr产物进行1%琼脂糖凝胶电泳后,切下目的条带;利用快捷型琼脂糖凝胶dna回收试剂盒(离心柱型)进行胶回收,具体步骤如下:
(1)将胶放入1.5ml离心管中,加入400μl的溶胶结合液db;
(2)放入到56℃金属浴中至胶融化;
(3)将所得溶液混匀后移到吸附柱ac中,室温放置2min,12,000rpm,离心1min,弃废液;
(4)加入700μl漂洗液wb,12,000rpm,离心1min,弃废液;
(5)加入500μl漂洗液wb,12,000rpm,离心1min,弃废液;
(6)将吸附柱放回原来的收集管中,12,000rpm,离心2min,去除漂洗液;
(7)将吸附柱放入一个新的1.5ml离心管中,在吸附膜中央加入30μl洗脱缓冲液eb,室温放置2min,12,000rpm,离心1min。离心管中收集液即为胶回收产物。
3.3将纯化后的pcr产物与peasy-t3克隆载体连接,连接体系为5μl:胶回收产物4μl,peasy-t3cloningvector1μl。体系混匀后25℃金属浴连接反应20min。
3.4将5μl连接产物加入到50μl-80℃冻存的trans1-t1大肠杆菌感受态细胞中,用移液枪轻轻吹吸混匀,冰浴30min;42℃热激45s后,立即置于冰上2min;加入溶菌肉汤(luria-bertani,lb)液体培养基500μl,37℃,200rpm振荡培养1h;将培养好的菌液6,000rpm离心3min,留100μllb培养基将细胞重悬,在含50μl氨苄青霉素的lb固体平板上涂布均匀,于37℃培养箱里正放1h后,倒置培养过夜。
3.5用灭菌的牙签从转化后的平板上挑取白色菌落,在装有10μl无菌水的pcr管中搅匀,作为pcr扩增的模板使用。用载体通用引物m13forwardprimer、m13reverseprimer进行pcr扩增。
(1)pcr反应体系25μl各组分用量如下:
(2)pcr反应程序为:94℃5min;94℃30s、53℃45s、72℃2min,35个循环;72℃10min;4℃10min。
(3)pcr反应结束后将pcr反应液进行1%琼脂糖凝胶电泳检测,选出阳性克隆,并找到与之对应的菌液。将含有阳性克隆的菌液接种到含100μg/ml氨苄青霉素的5mllb液体培养基中,37℃,200rpm过夜振荡培养,送南京思普金生物科技有限公司进行样品测序。得到estnf的5’末端序列和含有polya的3’末端序列。对所得序列进行拼接,获得estnf基因全长序列。
本发明采用race方法扩增得到estnf的全长序列,经全序列测定,该cdna全长为2462bp(如seqidno.2所示)(cdna全长为2462bp,包括一个1500bp的开放阅读框,编码499个氨基酸,5’端有216bp的非编码翻译区,3’端有746bp的非编码翻译区),编码一个由499个氨基酸组成的estnf蛋白(如seqidno.1所示),其分子量为56.1kda,蛋白结构域预测图如图1所示。
4.用sybrgreen荧光实时定量pcr研究estnf在中华绒螯蟹各个组织中的分布情况,以及在肝胰腺组织中,受金黄色葡萄球菌、副溶血弧菌刺激后不同时间段表达模式的变化。荧光实时定量pcr参照北京全式金生物公司的transstarttopgreenqpcrsupermix试剂盒。反应体系为10μl:上游引物0.2μl,下游引物0.2μl,1:10稀释的cdna模板1μl,2×transstarttopgreenqpcrsupermix5μl,ddh2o3.6μl。qrt-pcr反应程序如下:94℃30s,1个循环;94℃5s,60℃30s,40个循环;从60℃到95℃获得溶解曲线。所用引物序列如下,以同样的条件扩增甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,gapdh)基因作为内标。实验重复进行3次,数据采用2-δδct法进行处理。
estnf-qf:5’-aagccacatacacagtcatctctcc-3’;
estnf-qr:5’-atctccatcagccgttcctcc-3’;
扩增长度:169bp;
esgapdh-qf:5’-ctgcccaaaacatcatcccatc-3’;
esgapdh-qr:5’-ctctcatccccagtgaaatcgc-3’;
本发明采用荧光定量pcr技术检测了estnf基因在河蟹不同组织(血细胞、心脏、肝胰腺、鳃、肌肉、肠道、神经、眼柄)中的表达分布情况,结果如图2所示,结果表明其在检测的组织中都有所表达。因此estnf基因可以应用于河蟹多种组织,具有较广的普遍性。
本发明采用了荧光定量pcr技术检测了estnf基因受金黄色葡萄球菌和副溶血弧菌刺激后的表达模式变化。结果如图3所示,结果表明细菌刺激后,estnf的表达量明显上调,说明estnf参与了抵抗外来入侵细菌的免疫应答反应。
5.estnf重组蛋白的表达和纯化
5.1estnf基因扩增
(1)pcr扩增(中华绒螯蟹肝胰腺组织提取的rna,反转为cdna为模板)得到estnf全长序列的目的条带,扩增引物序列如下:
estnf-ex-f:5’-tactcagaattcatggagaaaaaagccacatac-3’;
estnf-ex-r:5’-tactcagcggccgcggccagcaccagctcctcg-3’;
pcr扩增体系如下:
(2)pcr扩增的反应条件为:98℃变性10s,55℃退火5s,72℃延伸10s,30个循环后,72℃延伸5min。将pcr产物进行1%的琼脂糖凝胶电泳,利用胶回收得到estnf表达片段。
5.2质粒制备
用无菌牙签挑取pet30a载体的菌液,接种到含有卡那霉素的lb液体培养基中,放入37℃摇床,200rpm摇菌过夜。利用质粒小量制备试剂盒提取质粒,具体操作如下:
(1)加入200μlbuffercbs于吸附柱中,12,000rpm离心1min,弃废液,将吸附柱放回;
(2)取2-3ml过夜培养的菌液,9,000rpm离心1min,弃上清;
(3)加入250μlsolutioni,充分悬浮菌体;
(4)加入250μlsolutionii,颠倒混匀4-6次,充分裂解菌体,直至溶液变清亮;
(5)加入350μlsolutioniii,颠倒混匀4-6次,室温放置5min后12,000rpm离心10min;
(6)将上清转移到dna吸附柱中,室温12,000rpm离心1min,取出dna吸附柱,弃废液;
(7)将吸附柱放入原收集管中,加入500μlw1solution,12,000rpm离心1min,弃废液;
(8)将吸附柱放入原收集管,加入500μlwashsolution,12,000rpm离心1min,弃废液;
(9)重复(8)一遍;
(10)12,000rpm,离心2min,彻底去掉washsolution;然后开盖室温放置5min,以彻底晾干吸附柱中残留的漂洗液;
(11)把上述吸附柱移到一个干净的离心管中,在dna吸附膜中央加入80μlelutionbuffer,37℃放置2min。12,000rpm离心1min,离心管中的液体即为包含pet30a质粒的溶液;
(12)取3μl质粒溶液进行电泳检测,将质量好的质粒溶液放于-20℃保存。
5.3estnf与pet30a载体连接
(1)将纯化后的dna片段与pet30a载体分别用ecori和noti双酶切,酶切体系(20μl)为:
酶切反应条件:37℃水浴3h;
(2)琼脂糖凝胶电泳分离后,按照dna回收试剂盒(北京百泰克)的操作进行dna回收和纯化,方法同上。
(3)将回收的酶切后载体与片段进行连接,体系(10μl)为:
16℃连接过夜。
5.4重组载体转化至表达菌株
(1)连接产物转化至克隆感受态细胞
a.将10μl连接产物转入到50μle.colitranst1感受态细胞中,轻轻地混合均匀,冰浴30min;
b.42℃水浴中热激45s,立即冰浴2min;
c.加入500μl液体lb培养基,放入37℃摇床,200rpm振荡培养1h;
d.取100μl培养好的菌液,涂布于加有卡那霉素的lb平板上,37℃培养箱里正放lh后,倒置培养过夜。
(2)菌落pcr鉴定阳性克隆
从每个平板挑取5个阳性单克隆,接种于含50μg/ml卡那霉素的3mllb培养液中,过夜摇菌后提取重组质粒。使用pcr方法验证质粒是否构建成功。
(3)测序分析
将筛菌得到的阳性克隆摇菌过夜并送思普金公司进行测序,测序结果用dnaman软件进行序列比对,确认为目的序列后提取质粒,方法同上。
(4)阳性质粒转化至表达感受态细胞
取5μl重组质粒,转化入表达菌株e.colitransetta(de3)中,涂布lb平板(含卡那霉素),37℃培养过夜。挑单克隆菌落,选取pcr阳性菌落,即为构建好的表达菌株。
5.5蛋白试表达
将表达菌株接种于3mllb培养基(含50μg/ml卡那霉素)中,37℃,200rpm过夜培养。吸取50μl菌液,按1:100比例转接到新的5mllb培养基(含50μg/ml卡那霉素)中,37℃,转培养3h左右,至菌液浓度的od600达到0.6-0.8时,取出500μl菌液作为对照,放在4℃保存。剩余部分加入异丙基-β-d-硫代半苷(isopropyl-β-d-thiogalactoside,iptg)至终浓度0.5mm,继续37℃振荡培养诱导表达4h,取500μl菌液留作检测之用。
诱导前和诱导后的菌液6,000rpm离心3min,倒掉上清,将收集的菌体重悬于100μl蒸馏水中,然后对其进行上样前处理:加入30μl蛋白loadingbuffer,混匀后金属浴100℃10min,蛋白经变性处理后,进行12%sds-page电泳检测。随后,使用考马斯亮蓝染液将凝胶染色20min,再用脱色液脱色至条带清晰。选择表达量较高的菌株加入1/10体积灭菌甘油,-80℃保种。
5.6蛋白大规模表达
按试表达的方法将表达体系扩大至300mllb培养基,加入iptg(终浓度为0.5mm)37℃诱导4h。6,000rpm10min收集菌体。用20ml1×pbs(含0.2%tritonx-100)重悬菌体,使用超声波破碎仪在冰浴中超声破碎(超声5s、间歇5s,全程60min)。破碎后的菌液4℃,12,000rpm离心10min,分别收集上清和沉淀。
5.7重组蛋白的亲和纯化
(1)取1ml填料装柱;
(2)加入2ml的无菌水洗涤ni柱;
(3)再加入5ml的chargebuffer(50mmniso4)缓冲液漂洗ni柱;
(4)再加入3ml的bindingbuffer缓冲液(0.5mnacl,5mmimidazole,20mmtris-hcl,ph7.9)漂洗ni柱;
(5)把蛋白上清液加入ni柱中;
(6)加入10ml的bindingbuffer缓冲液漂洗ni柱;
(7)加入6ml的washbuffer缓冲液(0.5mnacl,60mmimidazole,20mmtris-hcl,ph7.9)漂洗ni柱;
(8)加入5ml的elutebuffer缓冲液(0.5mnacl,1mimidazole,20mmtris-hcl,ph7.9)洗脱ni柱上结合的tnf蛋白;
(9)用5ml的stripbuffer缓冲液(0.5mnacl,0.1mmedta,20mmtris-hcl,ph7.9)漂洗ni柱;
(10)用10ml无菌水冲洗柱子,然后用20%酒精充满柱填料,4℃下保存填料。收集的各个组分sds-page胶验证后,合并其中较纯的洗脱液,置于tris-hcl(25mm,ph7.5)缓冲中4℃透析。
本发明构建了estnf基因的大肠杆菌表达载体,并进行了重组表达和蛋白质纯化(如图4所示)。
6.体外细菌生长抑制实验
37℃,200rpm过夜培养金黄色葡萄球菌和副溶血弧菌,分别取1μl过夜菌液(约107个细菌数)转移至新鲜lb液体培养基(5ml),再向内加入restnf蛋白至终浓度为100μg/ml。放置试管于摇床内,设置温度为37℃,转速为200rpm,振荡培养,每间隔2h对od600的吸光值进行测定,bsa(终浓度100μg/ml)作为阴性对照。结果如图5所示,通过微生物生长抑制实验来检测restnf是否具有抗菌活性。结果显示,restnf(100μg/ml)能够显著抑制副溶血弧菌和金黄色葡萄球菌的生长。具体而言,在实验进行的0-4h,细菌生长缓慢,各组间没有显著差异;在4-12h(对数生长期),与bsa对照组相比,restnf能够明显减缓细菌的增殖,这说明restnf具有一定的抗菌活性。
7.体内细菌清除实验
将中华绒螯蟹分为3组,每组15只。取过夜培养的金黄色葡萄球菌和副溶血弧菌于6,000rmp离心5min,用灭菌pbs洗涤菌体3次并重悬至浓度3.0×107细胞/ml。第一组,将500μl纯化的重组蛋白(600μg/ml)与500μl金黄色葡萄球菌或副溶血弧菌混合;第二组,将500μl的bsa(600μg/ml)与500μl的金黄色葡萄球菌或副溶血弧菌混合;第三组即为500μl的灭菌pbs与500μl的金黄色葡萄球菌或副溶血弧菌混合;混合均匀后置于28℃恒温摇床轻摇30min。每组各取50μl分别注射入河蟹体内,在注射后的2、10和20min三个时间点,于每组随机选取3只河蟹抽取500μl血淋巴(注射器内提前抽入等体积的acd-b抗凝剂)。用灭菌pbs将混合物进行梯度稀释,稀释梯度为10倍、100倍和1000倍,分别取50μl100倍和1000倍两个梯度的稀释液在lb固体培养基平板上均匀涂布,于37℃培养过夜后,对菌落计数。该实验重复3次。结果如图6所示。我们检测了restnf在中华绒螯蟹体内对入侵细菌的可能作用。结果发现,在副溶血弧菌和金黄色葡萄球菌(预先与restnf或bsa孵育)注射中华绒螯蟹后的10和20min,restnf共孵育细菌组的细菌数量明显少于两个对照组,说明restnf能够促进机体对入侵细菌的清除。
本发明通过细菌生长和细菌清除实验研究了estnf蛋白的抗细菌作用。研究结果表明,estnf蛋白能够抑制金黄色葡萄球菌和副溶血弧菌的生长,并促进河蟹体内细菌的清除速率。
本发明提供了克隆的estnf基因在中华绒螯蟹免疫防御功能中的用途,为预防病原菌引起的疾病提供理论基础,也为河蟹健康养殖提供理论指导。
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。本说明书引述的所有出版物、专利和专利申请通过引用并入本文,如同这些出版物、专利和专利申请各自特别地和个别地表明通过引用并入本文。
序列表
<110>河海大学
<120>中华绒螯蟹肿瘤坏死因子及其应用
<141>2021-03-19
<160>2
<170>siposequencelisting1.0
<210>1
<211>499
<212>prt
<213>eriocheirsinensis
<400>1
metglulyslysalathrtyrthrvalileserproprohisproser
151015
argargleutrpleualatrpvalalaalaglyvalservalvalala
202530
leuvalvalalacysvalthralaalavalvalasngluglnserthr
354045
argvalasnhisleuglugluargleumetglumetgluserhisleu
505560
gluaspileleuargleuthrilealaasnhisglutyraspasnleu
65707580
asptyraspglygluaspglyasptyrvaltyrtyraspasnglnasp
859095
aspaspgluilethrvalargargvalleuargarglysargglnala
100105110
asnserileaspasngluleuproaspserseralavalproiletyr
115120125
aspglnalatyrglyvalasnleulysthrglnargalaprolysgly
130135140
leuargleutyraspserleuleuaspthrasnglugluaspaspasp
145150155160
glnalaglyglugluthrvalprogluthrthraspserproilelys
165170175
prohishisargvalserasnleutrpvalprolysargargargasp
180185190
argleuproserserserglyproproproleuseralaargthrleu
195200205
valarglysileaspseralaasnglyglngluasngluleualaglu
210215220
asnleupheproasnvalserproproserleuargargserargleu
225230235240
thrgluargargserargthrlysserleuhisglyserargarggly
245250255
leulysargargglnlysglnargvalargserasnprothrproser
260265270
servalvalpheargserserleuvallysalathrserarghisasp
275280285
glyphethrserproasnservalvalproglnalaasnglyleuleu
290295300
glualaprolysvalvalproglnaspglyserarglysilehisala
305310315320
pheserargproproproserservaltyrglylyslysargarglys
325330335
ileargasnlysglnthrarglystrpargargargprothrilethr
340345350
leualahisphethralaserthralaasnserthrargleuserleu
355360365
prothrthrglygluhisleuasptrpthralaalaprotrpmetglu
370375380
lysleuglyleuasnthrlystyrservalaspgluglythrvalthr
385390395400
valargglualaglyleutyrtyriletyralaglnileleuhisglu
405410415
serglyargalaglyglyglypheglnileleuvalaspaspilepro
420425430
ileleuglucysglnalaproalaleuargproalaprosercyshis
435440445
thrglyglyvalsertyrleuproargasnalagluvalargvalarg
450455460
aspleuaspasntyrleuargthrvalhisvalglyargasnthrphe
465470475480
pheglymetvallysleumetaspalaproasnthralaglugluleu
485490495
valleuala
<210>2
<211>2462
<212>dna
<213>eriocheirsinensis
<400>2
agcgggcagtgcgggtaaggctactgagcgagatagagagagcgaggagagcgagagaga60
gggtgagagagagagagagatagagggagcaagggacaccggttcaacataccacgtgca120
ctgagaccaatacaagacaacacaaagccacacagccacgtattgcatctcctcggctcg180
ctacgccatacacaaacgcttaaaagtcaccccagcatggagaaaaaagccacatacaca240
gtcatctctcctccacacccgtccaggcgcctatggttggcgtgggtggcggcgggcgtg300
agtgtggtggcgctggtggtggcgtgtgtgacagcggcggtggtgaacgagcagtcgacc360
cgcgtcaatcacttggaggaacggctgatggagatggagagtcaccttgaggatattctc420
cggttaacgatcgctaaccatgagtacgataacttggactacgatggcgaggacggggac480
tatgtgtactacgataaccaggacgatgacgagatcactgtccgccgcgtcttgaggaga540
aagaggcaggcgaacagtatcgacaacgaattacccgactcgtccgcggtgcccatctac600
gaccaggcgtacggggtcaacctcaagacccagagagcaccaaagggcctgaggttgtac660
gactccctgctggacaccaatgaggaggatgacgaccaggcaggagaggagactgtacct720
gagaccaccgacagccccatcaagccacaccacagagttagcaacctgtgggtccctaag780
aggagacgggacaggttgccctcctcctcaggccctccgcccctttccgccagaactctc840
gtgcgcaagatcgactctgccaacggccaagaaaacgagctcgctgaaaatctcttcccc900
aacgtgtcgcccccctcgctacgtcgctcccgcctcaccgaaagacgatcccggaccaag960
agcctgcacgggtccaggcgtggtctgaaaaggcgacagaagcagcgggtgcggtctaac1020
ccaacgccaagctctgtggtatttcgatcttcgcttgtaaaggccacctcccgccacgac1080
gggttcacgagccccaacagcgtggtgccccaagccaacggtctgctggaggccccgaag1140
gtggtgccgcaggacgggagcaggaagatacatgctttctccaggcctccccccagcagc1200
gtctacggcaagaagaggaggaagatcaggaacaagcagactaggaagtggaggaggcgc1260
cccaccatcaccctggctcacttcaccgcctccaccgcgaactccacccgactaagcctc1320
ccaaccactggcgagcacctggactggaccgccgccccctggatggagaagctcggcctg1380
aacaccaagtacagcgtggacgagggaacggtgacggtgcgggaggcgggtctctactac1440
atctacgcccagatcctacacgagtcaggacgggcaggcggcggtttccagatcctcgtg1500
gacgatatcccgatcctagagtgccaggcgcccgctctgagacccgcaccgtcctgccac1560
acggggggagtctcctacctgcccaggaacgcggaggtacgagtgcgcgacctcgacaac1620
tacctgcggacggtgcatgtgggccgcaacaccttcttcggcatggtgaagctgatggac1680
gccccgaacacggccgaggagctggtgctggcctaggcggcgacggagaggcggaggcgg1740
cgggggaaggagcgggaagaggtgacgatgggaggaaatgagagtaaaggagaagatggg1800
agatgaaagaagaggcggcaacaggagatagagttagaagatgcggtaagaagagtttaa1860
agaagaggtgaagaaggataaggagttggaagaagagtcgtgagggagaaagaaggaacg1920
ggaggaagaaagcgtgaagggaagtatacgaggaaaccaccaaagcgtgaaagaagaaaa1980
aggaaaaaaagatgtagatgaaaaaggagaagggatttaaaggtgatggcgaaggagaat2040
gggaggaatgtgtatgggaaaaaaaaagattgaaagaaggtgaagacgacaatgacgagg2100
acgacgaagacgaagaagaagaagaagaccgagacgaaaacgaagaccaagacgaacacg2160
acgacaatacaaaaaagaagaaaaaaaaagatgaagaaaaggtagtgaaaaaaaaagaaa2220
agtggatgagagagaaaggtaaaaaagagaagagtaaaaatgacataaaagcaggaacta2280
ggagagaaaagggaatagtaaagcaggaagagatcacagaaacaaaagagttagacaaag2340
aaaaacaaaacaatgaacgagaaagaattgcacaggaagagaagcagacaagagagagaa2400
gaaaacaggaagaaaatcaaaagaggaagaaagcgttggggaaaaaaaaaaaaaaaaaaa2460
aa2462
- 还没有人留言评论。精彩留言会获得点赞!