促进造血干细胞中FOXO1基因表达上调的方法与流程
促进造血干细胞中foxo1基因表达上调的方法
技术领域
1.本发明涉及生物领域。具体地,本发明涉及促进造血干细胞中foxo1基因表达上调的方法。
背景技术:
2.造血干细胞(hematopoietic stem cells,缩写为hscs),是一类具有高度自我更新能力和多谱系分化潜能的成体干细胞。根据文献报道,单颗造血干细胞就具有重建整个血液系统的能力,可以应用于临床治疗白血病等各种血液疾病,具有重要的应用价值。
3.foxo1转录因子为fox家族中foxo亚家族的重要成员,是调节细胞氧化应激反应及细胞增殖、细胞凋亡、细胞自噬、代谢和免疫反应等多种生理作用的转录因子,主要通过转录和传导各种生长因子及细胞因子信号发挥其生物学功能,此外,foxo1还参与人体生长发育、代谢、自噬、应激、dna损伤或修复、肿瘤发生、血管生成等生命过程。
4.目前,造血干细胞中foxo1基因表达调控方式仍有待研究。
技术实现要素:
5.本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提出了jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物在上调造血干细胞中foxo1基因表达中的用途、促进造血干细胞中foxo1基因表达上调的方法、用于使造血干细胞中foxo1基因表达上调的药物组合物、jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物在制备药物中的用途。将jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物作用于造血干细胞,可以有效地上调foxo1基因表达,为foxo1基因调控提供了可靠的研究手段,为通过foxo1调控造血干细胞功能的研究和临床应用奠定了基础,具有重要的科研和临床转化价值。
6.在本发明的一个方面,本发明提出了jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物在上调造血干细胞中foxo1基因表达中的用途。发明人发现,jnk信号通路抑制剂单独作用或者jnk信号通路抑制剂、mtor信号通路抑制剂和嘧啶吲哚衍生物三者共同作用于造血干细胞,可以使得造血干细胞中的foxo1基因表达上调,由此,影响造血干细胞的增殖、代谢等生理作用,为foxo1基因的研究奠定了基础,具有重要的科研和临床转化价值。
7.在本发明的另一方面,本发明提出了一种促进造血干细胞中foxo1基因表达上调的方法。根据本发明的实施例,所述方法包括:将含有jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物的组合物与造血干细胞共培养。jnk信号通路抑制剂单独作用或者jnk信号通路抑制剂、mtor信号通路抑制剂和嘧啶吲哚衍生物三者共同作用于造血干细胞,可以使得造血干细胞中的foxo1基因表达上调。
8.根据本发明的实施例,所述共培养所采用的培养基中,所述jnk信号通路抑制剂的浓度为0.1~20μm,所述mtor信号通路抑制剂的浓度为1~200nm,所述嘧啶吲哚衍生物的浓
度为1~1000nm。在一些优选实施例中,所述共培养所采用的培养基中,所述jnk信号通路抑制剂的浓度为1~5μm,所述mtor信号通路抑制剂的浓度为80~120nm,所述嘧啶吲哚衍生物的浓度为30~40nm。在此培养条件下,可以使得造血干细胞中的foxo1基因表达上调量较高。
9.根据本发明的实施例,所述jnk信号通路抑制剂选自jnk
‑
in
‑
8,所述mtor信号通路抑制剂选自rapamycin,所述嘧啶吲哚衍生物选自um171。由此,可以使得造血干细胞中的foxo1基因表达上调。
10.根据本发明的实施例,所述共培养所采用的培养基选自含有flt3配体、血小板生成素、干细胞生长因子以及低密度脂蛋白至少之一的stemspan系列培养基。由此,有助于造血干细胞生长代谢。
11.根据本发明的实施例,所述flt3配体的浓度为1~200ng/ml,所述血小板生成素的浓度为1~200ng/ml,所述干细胞因子的浓度为1~200ng/ml,所述低密度脂蛋白的浓度为1~200μg/ml。在一些优选实施例中,所述flt3配体的浓度为80~120ng/ml,所述血小板生成素的浓度为40~60ng/ml,所述干细胞因子的浓度为80~120ng/ml,所述低密度脂蛋白的浓度为40~60μg/ml。由此,有助于造血干细胞生长代谢。
12.在本发明的又一方面,本发明提出了一种用于使造血干细胞中foxo1基因表达上调的药物组合物。根据本发明的实施例,所述药物组合物包括:jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物。由此,上述药物组合物作用于造血干细胞,可以使其foxo1基因表达上调。
13.根据本发明的实施例,所述药物组合物进一步包括:药学上可接受的辅料。
14.根据本发明的实施例,所述jnk信号通路抑制剂选自jnk
‑
in
‑
8,所述mtor信号通路抑制剂选自rapamycin,所述嘧啶吲哚衍生物选自um171。
15.在本发明的又一方面,本发明提出了jnk信号通路抑制剂以及任选的mtor信号通路抑制剂和嘧啶吲哚衍生物在制备药物中的用途。根据本发明的实施例,所述药物用于使foxo1基因表达上调。由此,将上述药物作用于造血干细胞,可以使得造血干细胞中foxo1基因表达上调。
16.根据本发明的实施例,所述jnk信号通路抑制剂选自jnk
‑
in
‑
8,所述mtor信号通路抑制剂选自rapamycin,所述嘧啶吲哚衍生物选自um171。
17.根据本发明的实施例,所述药物用于提高造血干细胞的集落形成能力。
18.根据本发明的实施例,所述组合物用于提高造血干细胞中cd34
+
cd38
‑
、cd34
+
cd90
+
、cd34
+
cd45ra
‑
、cd34
+
cd45ra
‑
cd38
‑
cd90
+
细胞群比例及数量。
19.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
20.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
21.图1显示了根据本发明实施例的foxo1基因过表达的细胞群与对照组分析示意图;
22.图2显示了根据本发明实施例的foxo1基因表达量与对照组分析示意图;
23.图3显示了根据本发明实施例的rna
‑
seq基因差异分析结果示意图;
24.图4显示了根据本发明实施例的atac
‑
seq中差异基因分析结果示意图;
25.图5显示了根据本发明实施例的foxo1基因表达上调的细胞群与对照组分析示意图;
26.图6显示了根据本发明实施例的流式细胞分析示意图,其中jru为添加了jnk
‑
in
‑
8、rapamycin和um171三个小分子的实验组。
具体实施方式
27.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
28.实施例1
29.1.1脐带血分离cd34
+
细胞
30.1)脐带血的采集
31.在手术室无菌环境中采集胎儿脐带中血液,保存于加有抗凝剂的血袋,暂时存放于4℃微环境中,于24小时内送达实验室使用。
32.2)分离脐带血中的单核细胞
33.a)在无菌实验台中,将脐带血转移到提前准备好的无菌培养瓶里,按照血液:磷酸盐缓冲溶液=1.2的体积加入对应体积的pbs,混匀;
34.b)将稀释的脐带血贴壁缓慢加入盛有15ml人淋巴分离液的50ml离心管中,注意缓慢加入,保持两液面界面清晰,不能打破血液和淋巴分离液之间的液面平衡;
35.c)在室温下,1500转/分钟离心20分钟;
36.d)离心结束后,液面分为三层,最上层是血浆/组织匀浆层,最下面是红细胞,中间层是分离液,在血浆层与分离液层之间是一层薄而致密的白膜,即单核细胞层(包括了淋巴细胞和单核细胞)。小心吸取白膜层细胞到另一个50ml离心管中;
37.e)用pbs等比稀释到50ml体积,颠倒混匀。
38.f)在室温下,以1600转/分钟离心10分钟;
39.g)弃上清,用pbs重悬备用。
40.3)磁珠分选法分离cd34
+
细胞
41.a)按照一定比例,将人cd34磁珠与脐带血中分离的单核细胞混合,吹匀,放到4℃冰箱中静置30分钟,同时将磁珠分选所需要的设备放到超净台中,用紫外光照射除菌;
42.b)加入10ml pbs混匀,1600转/分钟离心5分钟;
43.c)弃上清,用含有0.5%bsa的pbs重悬,准备过吸附柱;
44.d)用含有0.5%bsa的pbs润洗吸附柱,然后加入单核细胞悬液,等待其完全通过吸附柱;
45.e)用1ml含有0.5%bsa的pbs清洗吸附柱,重复3遍;
46.f)将吸附柱转移到15ml离心管中,再往吸附柱滤膜上加入1ml含有0.5%bsa的pbs,将吸附在滤膜上的携带有cd34磁珠的细胞冲洗到离心管中;
47.g)离心,弃上清,加入培养基重悬cd34
+
细胞。
48.4)流式分析所得单核细胞中cd34
+
所占比例。
49.a)将所得携带有cd34磁珠的细胞取出一小部分到1.5ml离心管中;
50.b)加入相应的表面蛋白抗体,静置于4℃冰箱中;
51.c)30分钟后取出,加入1ml pbs;
52.d)1600转/分钟,离心3分钟;
53.e)弃上清,用200ul预冷的pbs重悬,即可用流式细胞分析仪检测分析所得细胞的表型。
54.1.2构建转染载体
55.1)用pcr技术扩增目的基因片段;
56.2)胶回收目的基因片段;
57.3)用适合的限制性内切酶切割质粒载体和目的基因片段,产生粘性末端;
58.4)胶回收质粒载体和目的基因片段,除去酶及盐离子;
59.5)用连接酶将质粒载体和目的片段连接;
60.6)阳转连接产物进入大肠杆菌;
61.7)将上述步骤中的大肠杆菌涂在含有抗性筛选物的琼脂糖平板上;
62.8)用针挑取大肠杆菌克隆,并用pcr技术鉴定阳性克隆;
63.9)扩增经过鉴定的阳性克隆,并提取扩增后菌群质粒,进行酶切检测;
64.10)将所得质粒进行测序检测,确认阳性结果;
65.11)待测序结果出来后,确认为阳性即可重新转化,并扩大培养获得大量质粒;
66.12)将所得大量质粒,除菌后放置于
‑
20℃保存待用。
67.1.3慢病毒包装及转染实验
68.本实验主要分为三个步骤,依次是慢病毒包装、测试病毒滴度、感染靶细胞。实验过程中所用的慢病毒载体购买于adgene公司,是以水泡性口炎病毒g蛋白(vsv
‑
g)为囊膜蛋白,以附注除和进行病毒外壳组装的表达蛋白质粒prsv/rev和带有囊膜、基质的多蛋白表达基因gag,蛋白酶、反转录酶和整合酶多蛋白表达基因pol,以及rev应答原件rre的质粒pmdlg/prre转染人胚胎肾上皮细胞系293t进行包装。
69.1.3.1慢病毒包装
70.1)接种293t细胞到10cm培养皿中(8
×
106细胞/皿),24小时后观察细胞生长状态,细胞边界清晰,不聚团,形成单细胞层。胞内颗粒少,形态饱满。当细胞占据80%左右培养皿面积后,进行病毒包装操作;
71.2)取出1.5ml离心管,依次加入质粒pll(15μg)、pmdlg/prre(5μg),prsv rev(5μg)pvsvg(5μg),再加入50μl的2.5m cacl2,混匀,再加入450μl超纯水,混匀;
72.3)取5ml流式细胞管,加入500μl的2
×
hbs。将1.5ml离心管里的混合溶液以1滴/秒的速度加入到流式管中,加完立即涡旋震荡。混匀后,溶液呈乳白色。
73.4)将混合液逐滴加入到293t细胞培养皿中;
74.5)经过12小时培养,更换新鲜培养基;
75.6)转染后44~48小时后,用注射器收集带有病毒的培养上清液,用0.22μm的滤器过滤清楚残余的细胞;
76.7)将收集的病毒液离心浓缩,保存于
‑
80℃冰箱,或者立即使用。
77.1.3.2测试病毒感染滴度
78.1)将小鼠成纤维细胞接种于24孔板中,接种密度为2万细胞/孔;
79.2)培养24小时,用收集好的病毒感染小鼠成纤维细胞,设置感染梯度为1μl、10μl、50μl、100μl,补充培养基(含10%胎牛血清的高糖dmem)至250μl,并按1000
×
比例添加polybrene(8μg/ml);
80.3)感染12小时后更换培养基;
81.4)感染72小时后,通过流式细胞分析技术,计算感染效率;
82.1.3.3感染靶细胞
83.原代cd34
+
血细胞在感染之前,需要在体外活化处理48小时,其具体的操作步骤如下:
84.1)取适量步骤1.1最终所得cd34
+
细胞接种到12孔低贴附培养板中,10万/孔;
85.2)活化48小时后,取适量含有病毒颗粒的培养基感染细胞;
86.3)持续感染16~24小时,更换为新鲜培养基;
87.持续培养4天,取100μl细胞悬液进行流式分析,检测细胞表型变化。
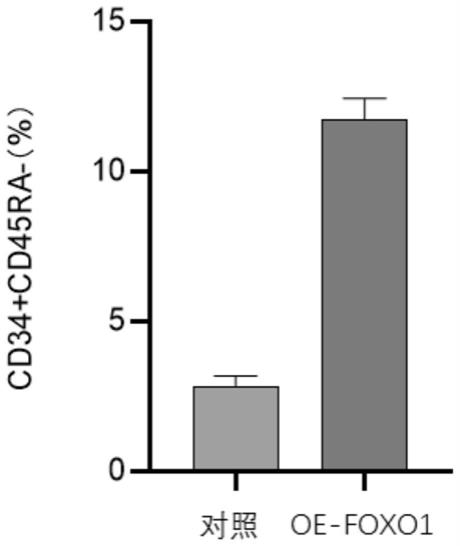
88.发明人对对照组的细胞进行foxo1基因过表达,记作oe
‑
foxo1组。如图1所示,oe
‑
foxo1组cd34
+
cd45ra
‑
细胞群比例显著高于对照组。由此,表明通过上调foxo1可以促进hsc扩增。
89.1.4cd34
+
细胞培养方法
90.1)用含有scf(100ng/ml)、flt
‑
3l(100ng/ml)、tpo(50ng/ml)、ldl(10μg/ml)的stemspan培养基重悬cd34+细胞,分别添加jnk
‑
in
‑
8+rapamycin+um171(简称jru)(jnk
‑
in
‑
8浓度为2μm,rapamycin浓度为100nm,um171浓度为35nm)、jnk
‑
in
‑
8(浓度为2μm)、sr1(浓度为1μm)、um171(浓度为35nm)、dmso,加入6孔低贴附板中,控制细胞密度1
×
106/ml以下;
91.2)将细胞放到37℃,5%co2的细胞培养箱中培养;
92.3)每2天,进行半量更换培养基,保证细胞密度1
×
106/ml以下。
93.细胞培养24小时,测定细胞中的foxo1基因表达量。结果如图2所示,可以看出,小分子化合物可以显著上调foxo1基因的表达。
94.细胞培养24小时,提取jnk
‑
in
‑
8组的细胞rna(qiagen rnaeasy plus mini kit cat:74136),rna反转录为cdna,以cdna为模板开展qpcr实验,对所得数据进行rna
‑
seq分析。结果如图3所示,jnk
‑
in
‑
8(j8)实验组细胞的基因表达水平与原代细胞接近,与dmso对照组有显著差异,主要差异自体现在钙离子及其活性、细胞周期、葡萄糖及转导、代谢活性、启动子调节等方面。
95.细胞培养24小时,提取细胞进行atac
‑
seq测序分析。结果如图4所示,染色质开放区域片段序列主要集中在foxo1基因,所占比例达到37.53%,其中还包括hlf、runx1、gata2等对维持造血干细胞再生能力直接相关的基因。这个数据表明,foxo1可能是促进造血干细胞扩增和维持自我更新能力的关键基因。
96.细胞培养7天,对细胞进行流式细胞分析。结果如图5所示。j8实验组细胞中的cd34+cd45ra
‑
细胞群比例显著优于dmso对照组。
97.培养14天,对细胞进行流式细胞分析,结果如图6所示,可以看出,小分子可以提高
造血干细胞中cd34
+
cd38
‑
、cd34
+
cd90
+
、cd34
+
cd45ra
‑
、cd34
+
cd45ra
‑
cd38
‑
cd90
+
细胞群比例及数量,表明其具有扩增造血干细胞的效果。
98.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
99.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1