用于富集正三十醇结合物的复合体及其制备方法与应用与流程
1.本发明属于生物化学领域,涉及一种用于富集正三十醇结合物的复合物及其制备方法,特别涉及一种基于磁力分离的用于富集正三十醇互作蛋白的复合物及其制备方法与应用。
背景技术:
2.正三十醇(也叫三十烷醇,1
‑
三十烷醇)的作用主要体现在促进植物发根、促进植物吸收矿质元素、促进叶片光合、促进花芽萌发等。在农业生产中,喷施正三十醇可以增加作物小穗数和每穗粒数等。
3.目前还没有关于正三十醇互作蛋白的报道,主要原因是没有有效的办法找到与正三十醇互作的蛋白。
4.正三十醇可能与其互作蛋白共同发挥功能,但是其中详细机理目前还没有报道。
5.如果能够找到植物组织内与正三十醇相互作用的蛋白等成分,将有利于进一步研究这些成分的组成和性质,进而人工干预正三十醇的合成与分解途径或潜在的正三十醇启动或参与的信号通路,改善农作物的生产性能。
技术实现要素:
6.为了解决现有技术中存在的问题,本发明第一方面提供了一种用于富集正三十醇结合物的复合物,所述复合物包括正三十醇部分和配体部分,所述配体部分能够被驱动以便将所述复合物或含有所述复合物的复合体从混合物体系中分离。
7.在一些实施方式中,所述正三十醇结合物为正三十醇互作蛋白。
8.在一些实施方式中,所述正三十醇部分和所述配体部分通过共价键连接。
9.在一些实施方式中,所述正三十醇部分和所述配体部分直接连接。
10.在一些实施方式中,所述配体部分能够与配体结合物特异性结合以便通过所述配体结合物将所述复合物或含有所述复合物的复合体从混合物体系中分离。
11.在一些实施方式中,所述配体部分的材料为能够与正三十醇相结合的修饰的生物素分子,所述配体结合物为固定化的链霉亲和素。
12.在一些实施方式中,所述配体部分的材料为连接有末端羧基连接臂的生物素。
13.在一些实施方式中,所述配体部分的材料为生物胞素。
14.在一些实施方式中,所述配体结合物为链霉亲和素琼脂糖凝胶。
15.在一些实施方式中,所述正三十醇部分和所述配体部分间接连接。
16.在一些实施方式中,所述配体部分是磁性材料,所述配体部分能够通过磁场驱动以便将所述复合物或含有所述复合物的复合体从混合物体系中分离。
17.在一些实施方式中,所述配体部分是磁珠,所述磁珠的表面修饰有末端基团能够与醇羟基反应结合的活性臂。
18.在一些实施方式中,所述磁珠为顺磁磁珠。
19.在一些实施方式中,所述磁珠的粒径为30
‑
100微米(比如,40微米、微米、50微米、60微米、70微米、80微米、90微米)。
20.在一些实施方式中,所述磁珠为羧基磁珠。
21.在一些实施方式中,所述活性臂的末端为羧基。
22.在一些实施方式中,所述活性臂为c
10
‑
15
的烃链羧酸。
23.本发明第二方面提供了本发明第一方面所述复合物的制备方法,所述制备方法为:将所述正三十醇和所述配体部分原料进行化学反应,形成包括所述正三十醇部分和所述配体部分的所述复合物。
24.在一些实施方式中,所述化学反应为酯化反应。
25.在一些实施方式中,所述酯化反应为正三十醇与连接有末端羧基连接臂的生物素之间发生酯化反应。
26.在一些实施方式中,所述酯化反应为正三十醇与生物胞素之间发生酯化反应。
27.在一些实施方式中,所述酯化反应为正三十醇与羧基磁珠之间发生酯化反应。
28.在一些实施方式中,所述酯化反应为:将正三十醇溶液与羧基磁珠溶液混合,进行酯化反应,得到所述复合物粗品。
29.在一些实施方式中,所述正三十醇溶液为正三十醇溶液的乙醇溶液。
30.在一些实施方式中,所述正三十醇溶液与乙醇的用量质量比为2
‑
6:1(比如,3:1、4:1、5:1)。
31.在一些实施方式中,所述正三十醇溶液中含有表面活性剂。
32.在一些实施方式中,所述表面活性剂为tween
‑
20。
33.在一些实施方式中,所述正三十醇溶液中,所述表面活性剂与所述乙醇的用量体积比为0.5
‑
2:1。
34.在一些实施方式中,所述羧基磁珠溶液的溶剂为mes溶液。
35.在一些实施方式中,所述mes溶液为浓度10
‑
30g/l的2
‑
(n
‑
吗啡啉)乙磺酸水溶液。
36.在一些实施方式中,所述羧基磁珠溶液的浓度为30
‑
70毫克/毫升(比如,35毫克/毫升、40毫克/毫升、45毫克/毫升、50毫克/毫升、55毫克/毫升、60毫克/毫升、65毫克/毫升)。
37.在一些实施方式中,将所述羧基磁珠清洗后使用。
38.在一些实施方式中,用mes溶液将所述羧基磁珠清洗后使用。
39.在一些实施方式中,所述羧基磁珠溶液的溶剂为mes
‑
mix溶液。
40.在一些实施方式中,所述mes
‑
mix溶液为含有10
‑
30毫克/毫升2
‑
(n
‑
吗啡啉)乙磺酸和3
‑
7毫克/毫升1
‑
(3
‑
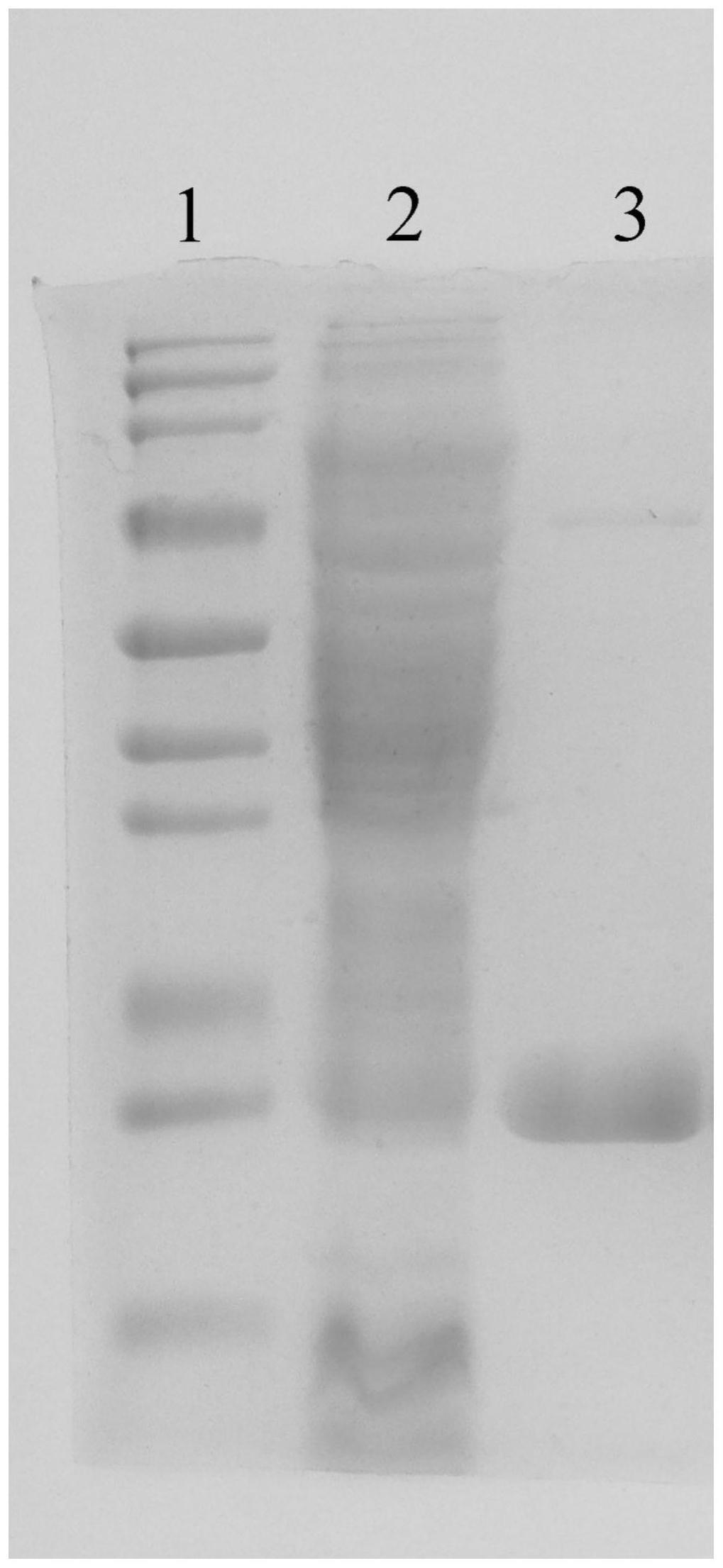
二甲氨基丙基)
‑3‑
乙基碳二亚胺的水溶液。
41.在一些实施方式中,所述羧基磁珠溶液的浓度为15
‑
35毫克/毫升(比如,18毫克/毫升、20毫克/毫升、22毫克/毫升、24毫克/毫升、26毫克/毫升、28毫克/毫升、30毫克/毫升、32毫克/毫升)。
42.在一些实施方式中,所述酯化反应中,所述正三十醇与所述羧基磁珠的用量质量比为:1:20
‑
40(比如,1:22、1:24、1:26、1:28、1:30、1:32、1:34、1:36、1:38)。
43.在一些实施方式中,所述酯化反应的温度20
‑
30℃(比如,22℃、24℃、26℃、28℃)。
44.在一些实施方式中,所述酯化反应的时间为60
‑
180min(比如,80min、100min、
120min、140min、160min)。
45.在一些实施方式中,在所述酯化反应过程中,间隔3
‑
10min混匀一次。
46.在一些实施方式中,在所述酯化反应过程中,间隔10
‑
30分钟,向反应体系中添加一次mix溶液,每次添加量与反应体系的体积比为:1:10
‑
25。
47.在一些实施方式中,所述mix溶液为含有10
‑
30毫克/毫升2
‑
(n
‑
吗啡啉)乙磺酸和30
‑
90毫克/毫升1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺的水溶液。
48.在一些实施方式中,用磁力吸附含有所述复合物粗品的反应体系,弃去所述反应体系中的液体成分,得到纯化的复合物。
49.在一些实施方式中,用洗液清洗所述纯化的复合物,得到精制的复合物。
50.在一些实施方式中,所述洗液为pbst溶液。
51.在一些实施方式中,所述清洗的方法为:将所述洗液与所述纯化的复合物混合,用磁力吸附含有所述复合物粗品的反应体系,弃去所述反应体系中的液体成分,得到精制的复合物。
52.在一些实施方式中,将所述精制的复合物溶于te
‑
tw溶液中,得到所述复合物溶液,备用。
53.在一些实施方式中,所述复合物溶液中,所述复合物的浓度为4.0
‑
8.0毫克/毫升(比如,4.5毫克/毫升、5.0毫克/毫升、5.5毫克/毫升、6.0毫克/毫升、6.5毫克/毫升、7.0毫克/毫升、7.5毫克/毫升)。
54.在一些实施方式中,所述te
‑
tw溶液为含0.5
‑
1.5v/v%三羟甲基氨基甲烷、0.2
‑
0.5g/l乙二胺四乙酸二钠和0.005
‑
0.015v/v%tween
‑
20的水溶液。
55.在一些实施方式中,所述复合物溶液的保存温度为1
‑
6℃(比如,2℃、3℃、4℃、5℃)。
56.本发明第三方面提供了一种正三十醇结合物的富集方法,所述富集方法为:使用本发明第一方面所述复合物,富集植物组织中的正三十醇结合物。
57.在一些实施方式中,所述植物为杨树。
58.在一些实施方式中,所述组织为根部。
59.在一些实施方式中,所述富集方法包括如下步骤:
60.s1、将植物总蛋白溶液与所述复合物溶液混合,进行孵育,得到第一混合物;
61.s2、驱动所述第一混合物中的所述配体部分,将所述复合物或含有所述复合物的复合体从所述第一混合物中分离,得到分离产物;
62.s3、洗脱所述分离产物,得到所述正三十醇结合物。
63.在一些实施方式中,所述植物总蛋白溶液中,溶剂为蛋白结合液,所述植物总蛋白的浓度为5
‑
15μg/ml(比如,6μg/ml、7μg/ml、8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml)。
64.在一些实施方式中,所述蛋白结合液的成分为含0.1
‑
0.3m tris,0.4
‑
0.6mnacl,15
‑
25mm mgcl2,0.8
‑
1.2v/v%tween
‑
20的水溶液,ph 7.5。
65.在一些实施方式中,所述植物总蛋白溶液中,所述植物总蛋白为所述植物组织中的总蛋白干粉。
66.在一些实施方式中,所述复合物溶液中,所述复合物的浓度为4.0
‑
8.0毫克/毫升
(比如,4.5毫克/毫升、5.0毫克/毫升、5.5毫克/毫升、6.0毫克/毫升、6.5毫克/毫升、7.0毫克/毫升、7.5毫克/毫升)。
67.在一些实施方式中,所述复合物溶液中,溶剂为te
‑
tw溶液。
68.在一些实施方式中,所述te
‑
tw溶液为含0.5
‑
1.5v/v%三羟甲基氨基甲烷、0.2
‑
0.5g/l乙二胺四乙酸二钠和0.005
‑
0.015v/v%tween
‑
20的水溶液。
69.在一些实施方式中,所述植物总蛋白与所述复合物的用量质量比为:1:30
‑
100(比如,1:40、1:50、1:60、1:70、1:80、1:90)。
70.在一些实施方式中,在步骤s2中,所述孵育的时间为2
‑
10min(比如,3min、4min、5min、6min、7min、8min、9min)。
71.在一些实施方式中,在步骤s2中,所述孵育的条件为冰上。
72.在一些实施方式中,在步骤s2中,用磁力吸住所述配体部分,将所述复合物或含有所述复合物的复合体从所述第一混合物中分离,得到所述分离产物。
73.在一些实施方式中,在步骤s3中,用磁力吸住所述配体部分,用蛋白洗脱液洗脱所述分离产物,洗脱液中含有所述正三十醇结合物。
74.在一些实施方式中,在步骤s3中,所述洗脱的时间为2
‑
10min(比如,3min、4min、5min、6min、7min、8min、9min)。
75.在一些实施方式中,在步骤s3中,所述洗脱的条件为冰上。
76.在一些实施方式中,所述洗脱液的成分为含10
‑
30mm tris,5
‑
15mm nacl,0.08
‑
0.12v/v%tween
‑
20的水溶液,ph 7.5。
77.本发明第四方面提供了一种正三十醇结合物,所述正三十醇结合物是通过使用本发明第三方面所述的富集方法得到的。
78.本发明第五方面提供了本发明第一方面所述的复合物、本发明第二方面所述的制备方法、本发明第三方面所述的富集方法或发明第四方面所述正三十醇结合物在制备用于促进植物发根、促进植物吸收矿质元素、促进叶片光合、促进花芽萌发、增加作物小穗数和增加作物每穗粒数中任一项的制剂中的用途。
79.本发明相对于现有技术的有益之处在于:更方便的找出某一物质的互作蛋白,比现有的酵母单杂交,等温滴定量热发,核磁共振等技术更简洁实用,费用也更少。通过免疫的方法,找到一种研究三十烷醇互作蛋白的方法,为研究其他物质的互作蛋白提供新的思路。
附图说明
80.图1为蛋白的电泳图,其中,泳道1代表蛋白marker,分子量从上到下分别为:250kda、150kda、100kda、70kda、50kda、40kda、30kda、25kda、20kda、15kda,泳道2代表植物总蛋白,泳道3代表正三十醇互作蛋白。
具体实施方式
81.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
82.本发明提供了一种用于富集正三十醇的复合体及其富集方法,其主要技术构思如
下:
83.通过将正三十醇结合到磁珠上,形成磁珠
‑
正三十醇复合体,将该复合体与植物总蛋白一起孵育,使蛋白与复合体中的正三十醇部分结合,形成磁珠
‑
正三十醇
‑
蛋白复合体。通过磁力架磁性吸附磁珠从而固定磁珠
‑
正三十醇
‑
蛋白复合体。之后将该复合体与蛋白洗脱液一起孵育,通过改变结合环境的方式将蛋白洗脱下来,得到与正三十醇互作的蛋白。
84.磁珠与正三十醇的结合原理是:磁珠具有的羧基与正三十醇具有的羟基发生酯化反应,通过酯键将正三十醇紧密结合到磁珠上。
85.定义
86.(1)正三十醇结合物:
87.能够与正三十醇通过非共价键模式特异性结合的生物分子或生物分子复合体,包括但不限于:蛋白质,糖蛋白,蛋白质复合体,糖蛋白复合体,蛋白质
‑
糖蛋白复合体,以及前述成分与rna组成的复合体。
88.当正三十醇结合物为能够与正三十醇通过非共价键模式特异性结合的蛋白时,正三十醇结合物可称作正三十醇互作蛋白。
89.(2)正三十醇部分:
90.也可称作正三十醇残基,指在复合物中来自正三十醇的部分。
91.(3)配体部分:
92.配体部分指在复合物中来自配体的部分,当配体为小分子时,配体部分也可称作配体残基。
93.前述正三十醇部分与前述配体部分稳定结合,在一些情况下,二者通过共价键结合,形成复合物,用于富集前述正三十醇结合物。
94.(4)含有复合物的复合体:
95.在一些情况下,指复合物与正三十醇结合物相结合形成的复合体。
96.(5)被驱动以便将复合物或含有复合物的复合体从混合物体系中分离:
97.包括但不限于,1)通过非接触的方式(比如,磁场)驱动配体部分(比如,磁珠,有时其表面还具有用于与正三十醇相结合的连接臂残基)并带动复合体或含有复合物的复合体从混合物体系(可能含有复合体,潜在的正三十醇结合物和其他成分的混合物)中分离;2)使用固相物(比如,能够固定链霉亲和素的载体)通过亲和的方式(比如,亲和生物素部分)驱动配体部分将复合物或含有复合物的复合体从混合物体系(可能含有复合体,潜在的正三十醇结合物和其他成分的混合物)中分离,比如,固相载体与复合物或含有复合物的复合体中的配体部分相结合,进而去掉混合物体系中的其他成分。
98.实施例1:复合体的制备
99.一、材料
100.羧基磁珠:购自海狸公司(beaverbeads)公司,粒径30
‑
100微米,顺磁性,磁珠表面修饰有十二碳羧酸基团。
101.二、溶液配制方法:
102.(1).mes溶液配制方法:
103.称取19.5g 2
‑
(n
‑
吗啡啉)乙磺酸置于1l烧瓶中,用超纯水定容至1l,形成mes溶液。
nacl,20mm mgcl2,1v/v%tween
‑
20 detergent)中,加入100微升磁珠
‑
正三十醇复合体悬液。冰上,结合5分钟。形成磁珠
‑
正三十醇
‑
蛋白复合体。
131.3、磁力处理
132.通过磁力架磁性吸附磁珠从而固定磁珠
‑
正三十醇
‑
蛋白复合体。
133.去除液体成分。
134.4、洗脱
135.加入500微升蛋白洗脱液(20mm tris(ph 7.5),10mm nacl,0.1v/v%tween
‑
20 detergent)。
136.置于冰上,5分钟。通过改变溶液,破坏正三十醇与蛋白的结合的方式洗脱蛋白。
137.通过磁力架磁性吸附磁珠。
138.吸取液体,得到与正三十醇互作的蛋白。
139.5、电泳
140.使用常规sds
‑
page电泳,考马斯亮蓝染色,泳道1中加入蛋白marker,分子量分别为(从上到下依次为250、150、100、70(红色)、50、40、30、25(红色)、20、15kda),泳道2中加入前面步骤1所得到的植物总蛋白样品,泳道3为正三十醇互作蛋白样品。电泳图谱参见图1。
141.由图1可见,泳道3电泳结果显示两个蛋白,蛋白1,分子量约70kda,蛋白2,分子量约20kda。
142.由此可知,正三十醇在植物体内能够与蛋白1和蛋白2相结合,蛋白1和蛋白2可能是与正三十醇和其他可能的成分形成复合体而发挥正三十醇的植物激素作用。上调植物体中蛋白1和蛋白2的表达(比如,通过转基因转入更强的启动子的蛋白1和蛋白2基因)可能能够增加植物提对正三十醇的敏感性,促进植物生长。
143.当采用不同种属的植物,不同组织、不同发育时期的植物总蛋白操作时,可能还会发现更多三十醇互作蛋白。
144.当使用全细胞匀浆代替植物总蛋白实验后,磁珠
‑
正三十醇复合体还可能分离出蛋白之外的其他参与成分,比如,小rna。
145.因此,本发明的磁珠
‑
正三十醇复合体具有较多潜在用途。
146.实施例三、生物胞素
‑
正三十醇复合物的应用
147.生物胞素中赖氨酸的羧基与正三十醇的羟基发生酯化反应,形成生物胞素
‑
正三十醇复合物。
148.该复合物与植物总蛋白孵育后将与正三十醇互作蛋白结合,形成生物胞素
‑
正三十醇
‑
正三十醇互作蛋白复合物。
149.用链霉亲和素琼脂糖凝胶与生物胞素的生物素部分结合而捕获生物胞素
‑
正三十醇
‑
正三十醇互作蛋白复合物,进一步洗脱,释放正三十醇互作蛋白。
150.由技术常识可知,本发明可以通过其它的不脱离其精神实质或必要特征的实施方案来实现。因此,上述公开的实施方案,就各方面而言,都只是举例说明,并不是仅有的。所有在本发明范围内或在等同于本发明的范围内的改变均被本发明包含。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1