喹唑啉衍生物的盐的晶体的制作方法
本申请是以下申请的分案申请:申请日2017年08月24日;申请号:201780044063.9;发明名称:“喹唑啉衍生物的盐的晶体”。
相关申请的交叉引用
本申请要求于2016年08月25日向中华人民共和国国家知识产权局提交的第201610730222.8号中国发明专利申请的权益,在此将其全部内容以援引的方式整体并入本文中。
本申请涉及喹唑啉衍生物的马来酸盐的晶体、其制备方法及其在预防和治疗肿瘤中的用途。
背景技术:
目前全球范围内,尤其是发展中国家,肺癌是发病率和死亡率最高的恶性肿瘤。肺癌分为小细胞肺癌和非小细胞肺癌(nsclc),其中nsclc占到肺癌患者总数的80%。传统放疗化疗手段缺乏特异性,在取得疗效、延长生存期的同时,也带来了较多副作用,导致患者生活质量显著降低。近年分子靶向治疗在肺癌的治疗中取得重大突破,针对nsclc的有效的药物靶点主要为表皮生长因子受体(egfr)。
egfr是一种酪氨酸激酶受体,为her/erbb家族成员之一,该家族包括egfr、her2、her3和her4,由三部分组成:胞外的配体结合区、由单链构成的跨膜区以及胞内的酪氨酸激酶区。egfr广泛分布于哺乳动物的上皮细胞、成纤维细胞、胶质细胞、角质细胞等细胞的表面。egfr信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用。egfr等蛋白酪氨酸激酶功能缺失或其相关信号通路中关键因子的异常活性或细胞定位异常,均会引起肿瘤、糖尿病、免疫缺陷及心血管疾病的发生。
目前已上市的相关药物有吉非替尼(gefitinib,iressa)、厄洛替尼(erlotinib,tarceva)以及egfr/her2双重抑制剂拉帕替尼等。可逆型egfr抑制剂吉非替尼、厄洛替尼对egfr突变的非小细胞肺癌患者有着良好的治疗作用,可以显著延长患者的无进展生存期(pfs)和总生存期(os)。然而,近些年的临床应用表明,大部分egfr突变患者的pfs不超过12~14个月,随即对上述egfr靶向药产生耐药性。
研究表明,约一半左右的egfr靶向药产生耐药性的原因为egfr的20位外显子发生的二次突变(t790m)相关。为解决上述egfr靶向药的耐药性问题,近些年开发了诸多不可逆egfr抑制剂,如afatinib(bibw-2992)、canertinib(ci-1033)、neratinib(hki-272)、co-1686、hm781-36b等。cn104513229a公开了式(i)化合物,其化学名称为n6-(1-丙烯酰基氮杂环己烷-4-基)-n4-(3-氯-4-氟苯基)-7-甲氧基喹唑啉-4,6-二胺。
式(i)化合物是选择性表皮生长因子受体抑制剂,可通过竞争性结合胞内段酪氨酸激酶的磷酸化位点,阻断其与atp的相互作用,抑制酪氨酸磷酸化及下游一系列的信号传导,继而抑制肿瘤细胞的生长,可用于治疗非小细胞肺癌和乳腺癌等多种恶性肿瘤。参见中国专利申请cn104513229a,在此将其全文引入作为参考。
发明概述
本申请提供式(i)化合物的马来酸盐的结晶,包含式(i)化合物的马来酸盐的结晶的结晶组合物,包含式(i)化合物的马来酸盐的结晶或其结晶组合物的药物组合物,以及它们在预防或治疗肿瘤的药物中的用途。
发明详述
在以下的说明中,包括某些具体的细节以对各个公开的实施方案提供全面的理解。然而,相关领域的技术人员会认识到,不采用一个或多个这些具体的细节,而采用其它方法、部件、材料等的情况下可实现实施方案。
除非本申请中另外要求,在整个说明书和其后的权利要求书中,词语“包括(comprise)”及其英文变体例如“包括(comprises)”和“包括(comprising)”应解释为开放式的、含括式的意义,即“包括但不限于”。
在整个本说明书中提到的“一实施方案”或“实施方案”或“在另一实施方案中”或“在某些实施方案中”意指在至少一实施方案中包括与该实施方案所述的相关的具体参考要素、结构或特征。因此,在整个说明书中不同位置出现的短语“在一实施方案中”或“在实施方案中”或“在另一实施方案中”或“在某些实施方案中”不必全部指同一实施方案。此外,具体要素、结构或特征可以任何适当的方式在一个或多个实施方案中结合。
应当理解,在本申请说明书和附加的权利要求书中用到的单数形式的冠词“一”(对应于英文“a”、“an”和“the”)包括复数的对象,除非文中另外明确地规定。因此,例如提到的包括“催化剂”的反应包括一种催化剂,或两种或多种催化剂。还应当理解,术语“或”通常以其包括“和/或”的含义而使用,除非文中另外明确地规定。
一方面,本申请提供式(i)化合物的马来酸盐的结晶
另一方面,本申请提供结晶组合物,其包含占所述结晶组合物的重量的50wt%以上,优选80wt%以上,更优选90wt%以上,最优选95wt%以上的式(i)化合物的马来酸盐的结晶。
另一方面,本申请提供药物组合物,其包含治疗有效量的式(i)化合物的马来酸盐的结晶或其结晶组合物。
另一方面,本申请提供了式(i)化合物的马来酸盐的结晶或其结晶组合物或它们的药物组合物在制备用于预防或治疗肿瘤的药物中的用途。
另一方面,本申请提供了用于预防或治疗肿瘤的方法,包括向有需要的个体给予式(i)化合物的马来酸盐的结晶或其结晶组合物或它们的药物组合物。
另一方面,本申请提供了用于预防或治疗肿瘤的式(i)化合物的马来酸盐的结晶或其结晶组合物或它们的药物组合物。
另一方面,本申请提供了式(i)化合物的马来酸盐的结晶或其结晶组合物或它们的药物组合物在预防或治疗肿瘤中的用途。
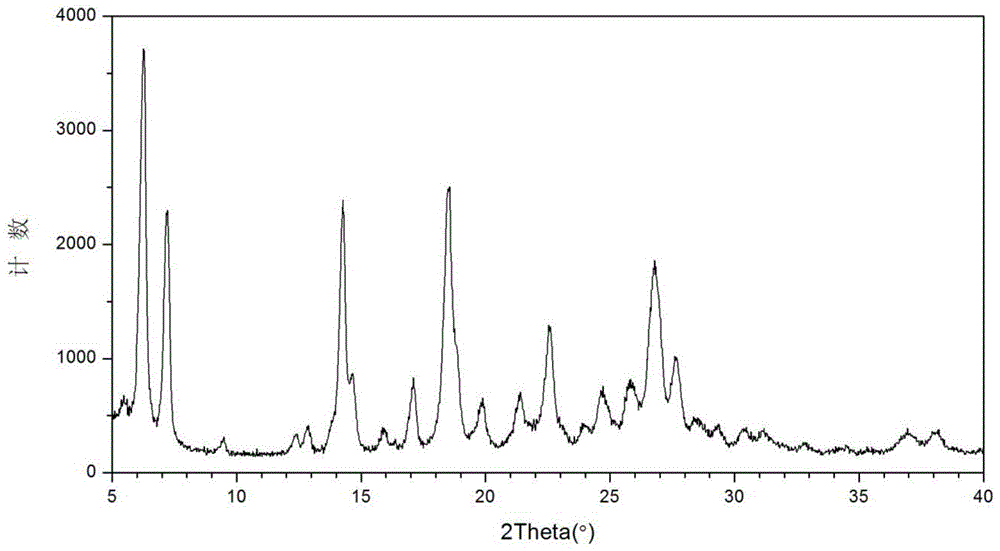
在本申请的一些实施方案中,本申请的式(i)化合物的马来酸盐的结晶为式(i)化合物的马来酸盐的a型结晶,其在x-射线粉末衍射图谱中在2θ=6.24°、7.19°、14.26°、18.50°和26.80°±0.2°处有衍射峰,优选地在2θ=6.24°、7.19°、14.26°、18.50°、22.59°、26.80°和27.64°±0.2°处有衍射峰,更优选地在2θ=6.24°、7.19°、14.26°、14.65°、17.09°、18.50°、21.38°、22.59°、24.70°、25.83°、26.80°和27.64°±0.2°处有衍射峰。
在本申请的一些实施方案中,本申请的式(i)化合物的马来酸盐的a型结晶具有如图1所示的x-射线粉末衍射图谱。
在本申请的一些实施方案中,本申请的式(i)化合物的马来酸盐的a型结晶的熔点为196~198℃。
在本申请的一些实施方案中,在本申请的式(i)化合物的马来酸盐的a型结晶中,式(i)化合物与马来酸的摩尔比为1:1。
另一方面,本申请提供制备所述式(i)化合物的马来酸盐的a型结晶的方法:
(1)将式(i)化合物溶于乙酸乙酯与醇的混合溶剂中;
(2)将马来酸溶于醇中,并与得自步骤(1)的式(i)化合物的溶液接触;
(3)析晶。
在本申请的一些实施方案中,本申请提供制备所述式(i)化合物的马来酸盐的a型结晶的方法:
(1)将式(i)化合物溶于乙酸乙酯与醇的混合溶剂中;
(2)将马来酸溶于醇中,加入得自步骤(1)的式(i)化合物的溶液;
(3)析晶。
在本申请的一些实施方案中,在所述制备a型结晶的方法中,步骤(1)中的醇和步骤(2)中的醇独立地选自甲醇、乙醇、异丙醇中的一种或几种的混合物。在本申请的一些实施方案中,在所述制备a型结晶的方法中,步骤(1)中的醇和步骤(2)中的醇均为乙醇。
在本申请的一些实施方案中,在所述制备a型结晶的方法中,步骤(1)中的醇与乙酸乙酯的体积比为15~1:1,优选8~1∶1,最优选2:1。
在本申请的一些实施方案中,在所述制备a型结晶的方法中,所述式(i)化合物与马来酸的摩尔比为1:1~10,更优选1:2~8,最优选1:5。
在本申请的一些实施方案中,在所述制备a型结晶的方法中,步骤(3)中的析晶在10℃~40℃下进行,优选在20℃~30℃下进行。
在本申请的一些实施方案中,本申请的式(i)化合物的马来酸盐的结晶为式(i)化合物的马来酸盐的b型结晶,其在x-射线粉末衍射图谱中在2θ=6.39°、7.35°、16.00°、21.21°、22.65°和27.03°±0.2°处有衍射峰,优选地,在2θ=6.39°、7.35°、13.37°、14.97°、16.00°、18.58°、21.21°、22.65°、23.98°、26.12°、26.50°、27.03°和27.45°±0.2°处有衍射峰,更优选地,在2θ=6.39°、7.35°、13.37°、14.49°、14.97°、16.00°、17.71°、18.58°、19.13°、21.21°、22.65°、23.98°、24.42°、26.12°、26.50°、27.03°、27.45°和28.05°±0.2°处有衍射峰。
在本申请一些实施方案中,本申请的式(i)化合物的马来酸盐的b型结晶具有如图2所示的x-射线粉末衍射图谱。
在本申请一些实施方案中,本申请的式(i)化合物的马来酸盐的b型结晶中,式(i)化合物与马来酸的摩尔比为1:1。
另一方面,本申请提供制备式(i)化合物的马来酸盐的b型结晶的方法:将式(i)化合物的马来酸盐的a型结晶溶解于有机溶剂中,冷却析晶。
在本申请一些实施方案中,在制备所述b型结晶的方法中,所述有机溶剂选自二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)和n,n-二甲基乙酰胺;优选地,所述有机溶剂为n,n-二甲基甲酰胺。
附图说明
图1显示式(i)化合物的马来酸盐的a型结晶的x-射线粉末衍射(xrpd)图谱
图2显示式(i)化合物的马来酸盐的b型结晶的xrpd图谱
实施例
下面通过(但不限于)以下实施例和试验对本申请作更加详细的描述。实施例中所用的式(i)化合物根据cn104513229a中的实施例2制备。
xrpd采用phaserbrukerd2x-射线粉末衍射仪检测,波长为
实施例1:式(i)化合物的马来酸盐的a型结晶的制备
在60℃下将83.1g式(i)化合物溶解于910ml无水乙醇和455ml乙酸乙酯的混合溶剂中。在3l反应瓶中加入105.8g马来酸和910ml无水乙醇,搅拌至完全溶解,室温下加入上述式(i)化合物的溶液,在20~30℃下反应20~24h,有大量黄色固体析出,过滤,滤饼用200ml无水乙醇洗涤,并于45~55℃真空干燥24h,得到亮黄色的式(i)化合物的马来酸盐的a型结晶固体102.5g,熔点为196~198℃。
1h-nmr(500mhz,dmso-d6):δ15.39(s,2h),10.26(s,1h),8.63(s,1h),8.01(dd,1h,j=2.4,6.75hz),7.69-7.72(m,1h),7.52(t,1h,j=9hz),7.38(s,1h),7.14(s,1h),6.86(dd,1h,j=10.45,16.65hz),6.15(s,2h),6.12(d,1h,j=2.35hz),5.75(s,1h),5.70(dd,1h,j=2.15,10.4hz),4.47(d,1h,j=11.2hz),4.14(d,1h,j=11.65hz),4.02(s,3h),3.81(s,1h),3.25(t,1h,j=11.5hz),2.89(t,1h,j=11.2hz),2.06(s,2h),1.50(s,2h).
实施例2:式(i)化合物的马来酸盐的b型结晶的制备
称取实施例1中制备的a型结晶10g,加入n,n-二甲基甲酰胺中,升温至80℃搅拌溶解,趁热过滤,滤液缓慢降温析晶7h,过滤,滤饼用10mldmf洗涤,并于55℃真空干燥24h,得到6.5g黄色的式(i)化合物的马来酸盐的b型结晶固体。
实施例3:结晶稳定性试验
结晶稳定性试验的条件和方法根据中国药典(2010版)二部附录ⅺⅹc原料药与药物制剂稳定性试验指导原则的要求进行,以实施例1中制得的a型结晶为试验样品,利用药用低密度聚乙烯袋作为样品内包装,聚酯/铝/聚乙烯药品包装用复合袋为样品外包装材料,具体结果如下所示。
表1加速试验(40℃±2℃,相对湿度75%±5%)
表2长期试验(25℃±2℃,相对湿度60%±10%)
- 还没有人留言评论。精彩留言会获得点赞!