两亲性寡肽结构物质的制作方法
本发明属于生物医药领域中的一种提高药物分子生物学活性的技术。
背景技术:
双(2,4-二硝基苯)-l-组氨酸是一种化学物质,化学式是c18h13n7o10。
实现多肽、蛋白质、核酸或化合物等药物分子对细胞内靶标有疗效的前提,是合适的给药系统携带这些药物分子首先依赖于内吞途径作为主要摄取机制进入细胞内,然后在细胞内从内含体(endosome,或称内体)转运至溶酶体降解前的过程中释放至胞浆中,作用于靶点才能发挥疗效;否则,这些药物或降解或外排出细胞外失去疗效。反之,如果要提高这些药物分子的疗效,除了使用合适的给药系统将药物带入靶组织细胞内,提高药物分子从内含体逃逸出来进入胞浆内的数量,是提高药物疗效的重要和难度最大的选择(peid,buyanovam.overcomingendosomalentrapmentindrugdelivery[j].bioconjugchem,2019,30(2):273-283.)。
小干扰rna(sirna)可特异性沉默靶标mrna表达水平(2006年诺贝尔生理医学奖),因此sirna分子可以通过特异性沉默引起或促进疾病发生或发展的基因,具有治疗基因过表达及基因突变引起的疾病的广泛应用前景(science,2016,352(6292):1417-1420;natchembiol,2006,2(12):689-700.)。将sirna分子药物输送到靶细胞中治疗疾病,所有的给药方式最终都会出现内含体内sirna分子逃逸进入胞浆内的困难深渊,是目前实现sirna广泛治疗组织疾病(肝脏靶向除外)而疗效欠缺的最关键因素(dowdysf.overcomingcellularbarriersforrnatherapeutics.natbiotechnol.2017mar;35(3):222-229.)。
目前国内外研究用两大类方式增加内含体内sirna分子的逃逸:
1)破坏内体膜结构增加药物释放[huet-calderwoodc,rivera-molinaf,iwamotodv,kromanneb,toomred,calderwoodda.novelecto-taggedintegrinsrevealtheirtraffickinginlivecells[j].natcommun,2017,8(1):570.]。使用小分子来破坏或溶解内体的脂质双层膜,如氯喹或溶酶肽等,让内体中有更多的sirna释放进入胞浆中;但目前使用的这些小分子在细胞内产生了不可接受的毒性,或还不能使内体膜足够去稳定达到临床疗效逃逸所需的sirna数量(相差1-2个数量级)。
2)抑制循环,增加内体药物逃逸的机会,抑制内体转运外排,延长其在胞浆内的循环时间,使得内体中的sirna有更长的时间和更多的机会逃逸进入胞浆中,如缺少人源胆固醇转运蛋白(npc1)时,脂质纳米粒(lnps)滞留在增大的内体/溶酶体内,不能外排出细胞,增加了内体sirna逃逸的机会,提高了基因沉默效率。总之,目前还没有特别有效且适合临床使用提高内体药物逃逸的方法(dowdysf.overcomingcellularbarriersforrnatherapeutics.natbiotechnol.2017mar;35(3):222-229.)。
申请号:2015101297927一种手性双l-亮氨酸盐酸盐的制备,该手性双l-亮氨酸盐酸盐的合成方法是称取0.03moll-亮氨酸(3.9354g)放入100ml的圆底烧瓶中,加入40ml无水甲醇并搅拌使其溶解,称取0.01molcucl2·2h2o(1.7048g)加入上述溶液,加热回流反应48h。反应结束后趁热过滤反应溶液,得到饱和溶液,滤液自然挥发,两天后析出绿色晶体。该化合物没有组氨酸的结构成分。
申请号:2017110762931发明公开了一种从血粉中分离提取亮氨酸和组氨酸的方法,血粉用酸水解,除渣,加入邻二甲苯磺酸沉淀亮氨酸,过滤分离得亮氨酸复合物沉淀和母液a,亮氨酸复合物沉淀经脱除沉淀剂、精制制得亮氨酸纯品;母液a脱除邻二甲苯磺酸后,加入二氯苯磺酸沉淀组氨酸,过滤分离得组氨酸复合物沉淀和母液b,组氨酸复合物沉淀经脱除沉淀剂、精制制得组氨酸纯品。该发明是分别提取两种成分,但不能获得两种成分的化合物或聚合物。
补充对两亲性的解释:
两亲性(amphipathy)是指分子同时具有亲水性和亲油性,亲水性和亲油性是特定基团的性质,物质的两亲性通常与它的化学结构有关。如构成细胞膜的磷脂双分子层中,单个磷脂的顶部由磷的官能团和甘油构成,呈亲水性;而尾部含饱和及不饱和脂肪酸,呈疏水性或亲油性,故磷脂分子整体呈两亲性。
技术实现要素:
发明目的:
提供一种含寡肽结构、能提高进入胞浆内的药物数量和生物学活性的两亲性寡肽结构物质。
技术方案:
本发明的两亲性寡肽结构物质,采用下列工艺合成获得:
1、合成(llhh)n结构:
在本发明中,根据细胞内含体的结构特征和对药物逃逸内含体机制的理解,设计并采用fmoc多肽固相合成技术筛选获得了一种以亮氨酸-亮氨酸-组氨酸-组氨酸(llhh)基本序列为母核序列的两性寡肽结构,以母核序列为基础,可以合成多聚体亮氨酸-亮氨酸-组氨酸-组氨酸寡肽结构((llhh)n,其中n为1、2、3、4、5、6、7、8或9(n=1的结构比较简单,不是多聚结构,可舍去),该多聚体寡肽呈α螺旋结构,利于细胞摄取和生物活性分子从内含体逃逸进入胞浆内。
该两性寡肽结构与其它成分通过化学键形成偶联物后,可用作给药系统;含(llhh)1-9两性寡肽结构的给药系统,可提高给药系统所载药物分子进入细胞的摄取量,促进所载药物分子从内含体逃逸进入胞浆,从而提高药物分子的疗效。
2、构建肿瘤靶向的核酸给药系统crgd-r9-(llhh)n:
整合素αvβ3受体仅表达于肿瘤新生血管内皮细胞膜及部分肿瘤细胞膜,是研究小核酸(sirna)等药物靶向治疗肿瘤的常用递送靶点;寡肽crgd是αvβ3受体的特异性配体,研究发现crgd可以将以非化学键方式囊化或化学键方式偶联携带的小核酸(sirna)等药物分子靶向递送进入αvβ3受体表达的肿瘤细胞,实现药物杀死肿瘤细胞的目的(parkj,singhak,sons,kimj,namgungr,yunco,kimwj.areviewofrgd-functionalizednonviralgenedeliveryvectorsforcancertherapy[j].cancergenether,2012,19(11):741-748.)。
3、为了增加crgd介导的给药系统中药物逃逸进入胞浆中的数量,提高药物治疗效果,本发明将(llhh)n结构嵌合进入crgd分子,获得了crgd-r9-(llhh)n结构,其中的r9为9个精氨酸的线性寡肽,含正电荷,可吸附含负电荷的小核酸(sirna)分子,自组装形成纳米粒;n为1,2,3,4,5,6,7,8或9,得到肿瘤靶向的核酸给药系统crgd-r9-(llhh)n/sirna,实现sirna治疗肿瘤的目的。
crgd-r9-(llhh)n/sirna肿瘤靶向核酸给药系统的功能:
1)获得sirna序列。
本发明所用的肿瘤靶向核酸给药系统功能测试的sirna能特异性沉默人表皮生长因子受体(egfr)mrna的表达,可通过生物信息学理论和分子生物学技术筛选获得。
2)制备crgd-r9-(llhh)n/sirna纳米粒及结构表征。
将crgd-r9-(llhh)n寡肽材料与sirna混合物,根据重量比1:1--40:1,优选1:1、5:1、10:1、20:1、40:1混合,获得不同比例制备的crgd-r9-(llhh)n/siegfr自组装形成纳米给药系统;对该给药系统进行结构表征,粒径大小、电位(粒径约100nm,电位约15mv)符合细胞摄取要求的最低配伍比的纳米粒用于后续的功能测试。
3)crgd-r9-(llhh)n/siegfr纳米粒对靶基因的沉默效率及其机制。
将制备的crgd-r9-(llhh)n/siegfr纳米粒,在体外转染αvβ3受体表达的胶质母细胞瘤细胞(u87mg细胞),用rt-pcr方法检测对靶基因egfrmrna的沉默效率,比较(llhh)n结构对靶基因沉默效率的影响。
检测肿瘤细胞对纳米粒的摄取量。将制备的crgd-r9-(llhh)n/siegfr纳米粒,在体外转染αvβ3受体表达的胶质母细胞瘤细胞(u87mg细胞),流式细胞术检测u87mg细胞对纳米粒的摄取量,研究(llhh)n结构对靶基因沉默效率的影响及其是否与增加细胞摄取量有关的机制。
共聚焦显微镜观察(llhh)n促内体逃逸sirna。将制备的crgd-r9-
(llhh)n/siegfr纳米粒,在体外转染αvβ3受体表达的胶质母细胞瘤细胞(u87细胞),用共聚焦显微镜观察纳米粒中sirna在胞浆中的分布情况,研究(llhh)n结构对靶基因沉默效率影响的机制是否与增加内含体逃逸量有关。
有益效果:
本发明的两性寡肽结构物质,由两性寡肽结构与其它成分通过化学键形成偶联物后用作给药系统,可提高给药系统所载药物分子进入细胞的摄取量,促进所载药物分子从内含体逃逸进入胞浆,从而提高药物分子的生物学活性。
附图说明
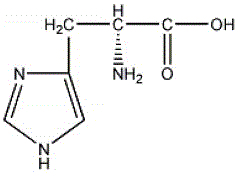
图1.组氨酸的结构式;
图2.亮氨酸的结构式;
图3.(llhh)1的结构式;
图4.(llhh)3分子的结构;
图5.(llhh)3呈两亲性α螺旋结构;
图6.crgd-r9-(llhh)1的结构;
图7.crgd-r9-(llhh)1的两亲性α螺旋结构;
图8.crgd-r9-(llhh)3的两亲性α螺旋结构;
图9.crgd-r9-(llhh)3分子的纯度(hplc);
图10.crgd-r9-(llhh)3分子的分子量(ms);
图11.a:琼脂糖凝胶电泳检测纳米递释系统的组装情况;b和c:不同重量比的纳米递释系统的粒径及电位;d:重量比为20/1的纳米递释系统的透射电镜图,bar=100nm;
图12.流式细胞术检测u87mg细胞对纳米递释系统的摄取量;
图13.(llhh)结构增加sirna从内含体逃逸后进入胞浆内。
具体实施方式
实施例1、合成(llhh)n寡肽:
在本发明中,根据细胞内含体的结构特征和对药物逃逸内含体机制的理解,设计并采用fmoc多肽固相合成技术筛选获得了一种以亮氨酸-亮氨酸-组氨酸-组氨酸(llhh)基本序列为母核序列的两亲性寡肽结构,其中亮氨酸(leucine,leu,l)的分子结构式为图1;组氨酸(histidine,his,h)的分子结构式为图2;亮氨酸-亮氨酸-组氨酸-组氨酸(llhh)基本序列组成的母核序列为图3;以母核序列为基础,可以合成多聚体亮氨酸-亮氨酸-组氨酸-组氨酸寡肽结构((llhh)n,其中n为1、2、3、4、5、6、7、8或9;以3个母核序列合成得到的3聚体亮氨酸-亮氨酸-组氨酸-组氨酸((llhh)3)结构为图4,且表征分析呈α螺旋结构为图5。
实施例2、构建肿瘤靶向的核酸给药系统crgd-r9-(llhh)n/sirna:
整合素αvβ3受体仅表达于肿瘤新生血管内皮细胞膜及部分肿瘤细胞膜,是研究小核酸(sirna)等药物靶向治疗肿瘤的常用递送靶点;寡肽crgd是αvβ3受体的特异性配体,研究发现crgd可以将以非化学键方式囊化或化学键方式偶联携带的小核酸(sirna)等药物分子靶向递送进入αvβ3受体表达的肿瘤细胞,实现药物杀死肿瘤细胞的目的(parkj,singhak,sons,kimj,namgungr,yunco,kimwj.areviewofrgd-functionalizednonviralgenedeliveryvectorsforcancertherapy[j].cancergenether,2012,19(11):741-748.)。
为了增加crgd介导的给药系统中药物逃逸进入胞浆中的数量,提高药物治疗效果,本发明将(llhh)n结构嵌合进入crgd分子,获得了crgd-r9-(llhh)n结构,其中的r9为9个精氨酸的线性寡肽,含正电荷,可吸附含负电荷的小核酸(sirna)分子,自组装形成纳米粒,得到肿瘤靶向的核酸给药系统crgd-r9-(llhh)n/sirna,实现sirna治疗肿瘤的目的。其中一种crgd-r9-(llhh)1的典型结构见图6,且分析呈两亲性α螺旋结构见图7;crgd-r9-(llhh)3呈两亲性α螺旋结构见图8。采用高效液相色谱-质谱法检测纯度及验证分子量;crgd-r9-(llhh)n的寡肽纳米材料的两个功能团和母核互不干扰,提示其母核能够顺利与sirna形成纳米递释系统,且其两个功能团(crgd及r9)可以在纳米粒外围发挥作用。典型结构crgd-r9-(llhh)3的寡肽纳米材料纯度高达95%,见图9;理论分子量为4379.96,测定分子量为4378.50,见图10,两者在误差允许范围内相一致。
实施例3、获得sirna序列:
利用生物信息学技术设计获得了sirnaegfr序列(siegfr),以胶质母细胞瘤细胞系u87mg为模式细胞,利用rt-qpcr方法检测候选sirna序列沉默靶基因egfrmrna的表达,获得了活性最佳的siegfr序列。脂质体转染100nm的siegfr,48小时候后在u87细胞中沉默egfrmrna的效率高达85%以上,被用作本发明的模型分子用于测试含(llhh)n结构crgd-r9-(llhh)n/sirna的基因沉默效率。
阴性对照sinc正义链序列(5'-3')为:cgugauugcgagacucugadtdt;
反义链(5'-3')序列为:ucagagucucgcaaucacgdtdt。
实施例4、制备crgd-r9-(llhh)n/sirna肿瘤靶向核酸给药系统:
将crgd-r9-(llhh)1、crgd-r9-(llhh)2、crgd-r9-(llhh)3、crgd-r9-(llhh)4、crgd-r9-(llhh)5、crgd-r9-(llhh)6、crgd-r9-(llhh)7、crgd-r9-(llhh)8及crgd-r9-(llhh)9等寡肽材料与sirna混合物(siegfr或sinc),重量比为20/1,37℃(正常体温附近)孵育30分钟,即可形成crgd与(llhh)n功能团在外围,sirna与r9为中心母核的crgd-r9-(llhh)n/sirna自组装纳米递释系统。一种典型的crgd-r9-(llhh)3/sirna纳米复合物的粒径大小、电位(粒径约100nm,电位约15mv)均符合细胞摄取要求的最低配伍比,电子显微镜拍照显示其可形成致密的纳米粒颗粒,见图11。因为当粒径过大,体内应用时容易被内皮网状系统摄取;粒径过小,则容易被肾脏滤过排泄。电位过低,纳米复合物与细胞结合减少而影响摄取且纳米颗粒容易发生聚集;电位过高,则会容易发生细胞非特异性结合而引起毒性过大。
实施例5、crgd-r9-(llhh)n/siegfr纳米粒对靶基因的沉默效率:
将crgd-r9-(llhh)1、crgd-r9-(llhh)2、crgd-r9-(llhh)3、crgd-r9-(llhh)4、crgd-r9-(llhh)5、crgd-r9-(llhh)6、crgd-r9-(llhh)7、crgd-r9-(llhh)8及crgd-r9-(llhh)9等寡肽材料与分别与siegfr或sinc混合,重量比为20/1,37℃孵育30分钟,形成crgd与(llhh)n功能团在外围,sirna与r9为中心母核的crgd-r9-(llhh)n/sirna自组装纳米递释系统,经表征的结构符合实施例4的标准,即可用于基因沉默效率测试。
u87mg细胞传代培养24小时后,除去完全培养基,用pbs洗一次,更换opti-mem培养基,分别加入不同的以下样品,按sirna终浓度为200nm加入给药系统。继续培养48小时,利用常规rt-qpcr技术检测纳米给药系统对靶基因egfrmrna表达水平。试验分组及对egfrmrna的沉默效率见表1,结果表明,(llhh)n结构普遍能增加crgd-r9/sirna肿瘤靶向给药系统介导的sirna对靶基因的沉默效率。
表1.crgd-r9-(llhh)n/siegfr对靶基因的沉默效率(n=3):
实施例6、u87mg细胞对纳米给药系统的摄取量:
根据实施例4的方法制备crgd-r9-(llhh)3/siegfr-cy5纳米粒,经表征符合质量要求后,按实施例5的方案转染u87mg细胞,给药浓度分别为12.5nm组、25nm组、50nm组、100nm组及200nm组。加样6小时后,收集细胞于流式细胞仪中检测细胞对cy5荧光染料的摄取量,以获得细胞摄取纳米粒的最佳浓度。与control组及siegfr-cy5单纯混合物组相比,crgd-r9-(llhh)3/siegfr-cy5纳米给药系统可被u87mg细胞摄取,且在浓度为200nm时,摄取率超过95%,具体结果见图12。因此,后续体外实验采用浓度为200nm进行研究。
另外,根据实施例4的方法制备crgd-r9-(llhh)3/siegfr-cy5纳米粒,及crgd-r9/siegfr-cy5纳米粒,经表征符合质量要求后,按实施例5的方案转染u87mg细胞,给药浓度为200nm(按sirna计算)。加样6小时后,收集细胞于流式细胞仪中检测细胞对cy5荧光染料的摄取量,比较细胞摄取二种纳米粒的差异,结果发现u87mg细胞摄取crgd-r9-(llhh)3/siegfr-cy5介导的sirna量比crgd-r9/siegfr-cy5介导的多25.4%,具体结果见表2。结合实施例5中二种给药系统基因沉默效率差异的结果,说明crgd-r9-(llhh)3/siegfr比crgd-r9/siegfr能提高对siegfrmrna基因沉默效率的原因之一,可能是(llhh)3结构增加了细胞对整个crgd-r9-(llhh)3/siegfr给药系统摄取量所致。
表2.细胞对不同纳米粒的摄取量(n=3):
实施例7、共聚焦显微技术观察纳米粒在u87mg细胞内分布及内体逃逸;
根据实施例4的方法制备crgd-r9-(llhh)3/siegfr-cy5纳米粒,及crgd-r9/siegfr-cy5纳米粒,经表征符合质量要求后,按实施例5的方案转染u87mg细胞,给药浓度为200nm(按sirna计算)。37℃分别孵育3小时;去除转染培养基,pbs洗一次,加入lysotrackergreendnd-26(溶酶体绿色荧光探针)工作液(50nm,用opti-mem培养基按1:20000稀释),37℃孵育5min;随之去除探针液,pbs洗两次,加入hoechest3342染色液(细胞核蓝色染色剂)37℃染色20min,去除染液,用1ml的pbs在摇床上轻轻洗涤三次,每次3分钟,在激光共聚焦显微镜中拍照观察,见图13。
由图13可知,与crgd-r9/siegfr-cy5纳米粒相比,含(llhh)3结构的crgd-r9-(llhh)3/siegfr-cy5纳米粒进入细胞后,有更多的sirna-cy5从内含体逃逸出来进入胞浆内,促进了sirna在胞浆内的广泛分布,尤其在溶酶体周围近细胞核位置,显现更多的sirna分布(cy5标记的红色)。结合实施例5中二种给药系统基因沉默效率差异的结果,说明除了提高了细胞摄取量外,crgd-r9-(llhh)3/siegfr比crgd-r9/siegfr能提高对siegfrmrna基因沉默效率的另外原因,可能是(llhh)3结构增加了细胞内含体逃逸sirna的数量所致。
结合实施例5,实施例6及实施例7的结果,可以得出两亲性ɑ螺旋结构(llhh)n,适合制备为给药系统,可增加给药系统内所载药物分子的靶细胞摄取量,同时增加了内含体逃逸机会,增加了药物分子的生物学功能。
- 还没有人留言评论。精彩留言会获得点赞!