鲤Toll样受体2多克隆抗体的制备方法及应用
鲤toll样受体2多克隆抗体的制备方法及应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种鲤toll样受体2(toll
‑
like receptor 2,tlr2)多克隆抗体的制备方法及应用。
背景技术:
2.toll基因由nusslein
‑
volhard及其团队于1980年在进行果蝇相关研究的过程中被发现,并为其命名。研究显示,该受体在抗细菌、真菌等病原体中发挥着不可替代的作用,并且参与转导了抗菌感染易感性信号。toll样受体2(toll
‑
like receptor 2,tlr2是tlr家族中不可或缺的一份子,在先天性免疫中具有无可替代的地位。目前已探明的tlr2介导的生物学效应主要为参与细胞活化、吞噬作用等方面,此外tlr2也能够促进树突状细胞成熟,在多种组织中均有表达。
3.在哺乳类中,tlr2能够同众多配体广泛结合。tlr2通过识别配体的方式激活myd88依赖型信号路径,从而分泌多种细胞因子。此外,有实验表明tlr2能够与tlr1和tlr6形成异二聚体,该二聚体能对菌体成分进行识别,从而激活信号转导,发挥免疫应答作用。
4.鲤是我国主要的经济淡水鱼类,在我国具有较大的养殖规模。然而,在养殖过程中细菌性疾病已成为制约鲤养殖业进一步发展的限制因素。因此,深入研究鲤的免疫机制,有助于建立提高鲤机体免疫的方法,对鲤养殖业的健康发展具有重要意义。哺乳动物的研究中,关于toll样受体大多是蛋白水平的检测。由于水产上缺少相应的抗体,致使在目前的探究实验中水产动物在toll样受体的检测大部分局限于mrna水平,限制了进一步的深入研究。
5.为了解决这一技术问题,从鲤中克隆获得tlr2基因,通过原核表达和免疫小鼠的方法制备鲤tlr2多克隆抗体,通过免疫组化实验,对该多克隆抗体的特异性进行检验,并分析其在肠道中的表达情况,对进一步研究tlr2在宿主肠道中的免疫功能具有重要意义。
技术实现要素:
6.本发明解决的技术问题是提供了一种鲤toll样受体2多克隆抗体的制备方法及应用,该方法制备的鲤tlr2多克隆抗体能够用于(荧光)免疫组化、蛋白印迹和酶联免疫吸附等实验要求,建立体外免疫分析、研究鲤tlr2的功能以及鲤免疫荧光染色激光共聚焦显微观察,还可用于其他鲤科鱼类tlr2的免疫检测。
7.本发明为解决上述技术问题采用如下技术方案,鲤toll样受体2多克隆抗体的制备方法,其特征在于包括以下步骤:步骤s1:鲤tlr2基因开放阅读框的克隆提取鲤肠组织总rna,经1.0wt%琼脂糖凝胶电泳检测其完整性,并在260 nm和280nm处分别用吸光度法测定其纯度和含量,吸收比接近2.0的样品随后用m
‑
mlv反转录酶合成cdna第一链,于
‑
80℃保存备用,再根据genbank数据库中已报道的tlr2基因序列设计第一对特异性引物tlr2
‑
orf
‑
f和tlr2
‑
orf
‑
r,进行pcr扩增获得鲤tlr2基因开放阅读框片
段;步骤s2:鲤tlr2基因重组表达载体的构建根据鲤tlr2基因全长cdna序列设计第二对特异性引物tlr2
‑
yhbd
‑
f和tlr2
‑
yhbd
‑
r,分别在上、下游引物添加了bamh i和hind iii酶切位点,再以鲤cdna为模板,tlr2
‑
yhbd
‑
f和tlr2
‑
yhbd
‑
r分别为上、下游引物,进行pcr扩增,将pcr产物经胶回收后和pet
‑
32a(+)表达载体进行双酶切,胶回收纯化,经t4酶连接后转入克隆感受态dh5α,获得重组表达载体pet
‑
32a(+)
‑
tlr2;步骤s3:鲤tlr2重组蛋白的诱导表达、纯化及western blot特异性分析将步骤s2得到的重组表达载体pet
‑
32a(+)
‑
tlr2转入表达感受态bl21(de3),在含有氨苄抗性的lb培养液中于37℃培养至od值为0.5
‑
0.6时,加入iptg进行诱导培养,经离心收集菌体、pbs重悬后加入5
×
上样缓冲液沸水浴10 min,经12wt% sds
‑
page电泳检测目的蛋白的表达情况,并做相应的对照组;以1wt%的接种量将能表达重组蛋白的菌液添加到含有氨苄抗性的lb培养基中,扩大培养,于37℃培养至od值为0.5
‑
0.6时,加入iptg进行诱导培养,将诱导培养好的菌液离心,收集菌体用变性结合缓冲液冲悬浮后采用超声波破碎的方法获得融合蛋白的包涵体,借助变性洗脱缓冲液通过his trap hp柱对融合蛋白进行纯化,并用透析方法去除融合蛋白溶液中的ch4n2o和c3h4n2等盐离子,获得纯化的鲤tlr2重组蛋白;步骤s4:鲤tlr2多克隆抗体的制备将步骤s3纯化的鲤tlr2重组蛋白作为抗原,蛋白质浓度用0.85wt%的生理盐水调整为500 μg/ml后对小鼠进行5次免疫,按体积比1:1的比例加入弗氏完全佐剂,采用腹部皮下多点注射,每隔1周加强免疫1次,共免疫5次,加强免疫选用弗氏不完全佐剂,末次免疫10天后进行全血分离,收集鼠抗血清,纯化得到鲤toll样受体2多克隆抗体。
8.进一步限定,步骤s1中所述第一对特异性引物为:上游引物名称为tlr2
‑
orf
‑
f;引物序列为5
´
‑
atgcaattcttgggaagag
‑3´
;下游引物名称为tlr2
‑
orf
‑
r;引物序列为5
´
‑
tcaacattcatctctctgtagag
‑3´
。
9.进一步限定,步骤s1中所述第一对特异性引物进行pcr扩增时,每25 μl的pcr扩增的反应体系包括ddh2o 9.5 μl、premix taqtm 12.5 μl、tlr2
‑
orf
‑
f 1.0 μl、tlr2
‑
orf
‑
r 1.0 μl和cdna 1.0 μl;所述第一对特异性引物进行pcr扩增时的反应条件为:95℃预变性5 min;35次循环中包括94℃变性30 s,52℃退火30 s,72℃延伸3 min;最后72℃延伸10 min。
10.进一步限定,步骤s2中所述第二对特异性引物为:上游引物名称为:tlr2
‑
yhbd
‑
f;引物序列为5
´
‑
cgggatcctcaaatcatctccaacaggt
‑3´
;下游引物名称为tlr2
‑
yhbd
‑
r;引物序列为5
´
‑
ccaagcttgttcgttctgagtgcaaca
‑3´
;其中下划线部分为酶切位点。
11.进一步限定,步骤s1中所述第二对特异性引物进行pcr扩增时,每25 μl的pcr扩增的反应体系为包括ddh2o 9.5 μl、premix taqtm 12.5 μl、tlr2
‑
yhbd
‑
f 1.0 μl、tlr2
‑
yhbd
‑
r 1.0 μl和cdna 1.0 μl;所述第二对特异性引物进行pcr扩增时的反应条件为:95℃预变性5 min;35次循环中包括94℃变性30 s,52℃退火30 s,72℃延伸1 min;最后72℃延伸10 min。
12.进一步限定,步骤s3中加入iptg进行诱导培养时,iptg的添加时间点为大肠杆菌bl21(de3)进入指数生长期时及菌液的od
600nm
达到0.5
‑
0.6时;iptg的终浓度为1 mmol/l,iptg的诱导时间为6 h;所述变性结合缓冲液的成分为20 mmol/l na3po4、15 mmol/l c3h4n2、500 mmol/l nacl和6 mol/l ch4n2o,ph调整为7.4,超声波破碎的条件为破3s、停3s,功率50%,破碎时间60 min;所述变性洗脱缓冲液的成分为20 mmol/l na3po4、500 mmol/l c3h4n2、500 mmol/l nacl和6 mol/l ch4n2o,ph调整为7.4。
13.进一步限定,步骤s3中所述鲤tlr2重组蛋白的分子量为41.8 ku,步骤s4中免疫过程的免疫量为0.2 mg/次。
14.本发明所述的鲤toll样受体2多克隆抗体在制备免疫组化、蛋白印迹和酶联免疫吸附实验试剂中的应用。
15.本发明与现有技术相比具有如下有益效果:1)本发明采用分子生物学和基因工程的方法构建了鲤tlr2基因的重组表达载体,诱导表达,亲和层析获得纯化的重组表达蛋白。
16.2)本发明的方法制备的鲤tlr2多克隆抗体具有很强的特异性,可用于(荧光)免疫组化、蛋白印迹和酶联免疫吸附等实验要求,建立体外免疫分析,为深入研究鲤tlr2的功能的功能提供一个重要工具。
17.3)本发明制备的鲤tlr2多克隆抗体可用于鲤免疫荧光染色激光共聚焦显微观察。
18.4)本发明制备的鲤tlr2多克隆抗体可能在其他鲤科鱼类tlr2的免疫检测中发挥作用。
附图说明
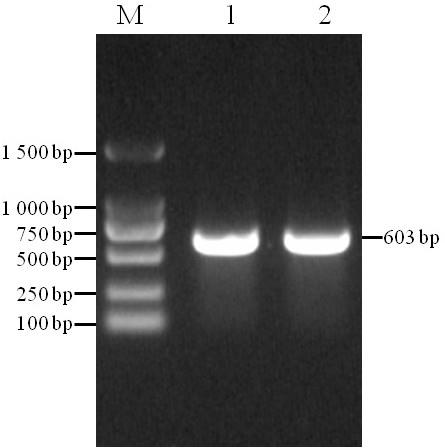
19.图1是鲤tlr2抗原决定簇区域pcr克隆产物的电泳分析(m. d2000 bp dna ladder;1, 2. pcr产物);图2是鲤tlr2 pet
‑
32a(+)
‑
tlr2重组表达质粒的单双酶切验证(m. d2000 plus dna ladder;1.重组质粒;2.重组质粒单酶切;3.重组质粒双酶切);图3是鲤tlr2 pet
‑
32a(+)
‑
tlr2重组表达质粒的测序验证;图4是鲤tlr2融合蛋白的原核表达及纯化(m. 蛋白marker;(a)tlr2在bl21(de3)细菌中的表达。泳道1
‑
2:未经iptg诱导的合成组;泳道3
‑
4:经iptg诱导的合成组;(b)用不同浓度的咪唑溶液对重组蛋白进行洗脱纯化;泳道1
‑
9分别代表50、75、100、125、150、175、200、225、500 mmol/l咪唑浓度的洗脱缓冲液对应的洗脱样品;(c)融合蛋白的纯化结果);图5是鲤tlr2蛋白特异性检测图;图6是鲤tlr2多克隆抗体的免疫组化分析((a)为阴性对照组,(b)为阳性组)。
具体实施方式
20.以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发
明的范围。
21.实施例1本实施例提供一种鲤tlr2多克隆抗体的制备方法,包括以下步骤:步骤s1:鲤tlr2基因开放阅读框的克隆:按照trizol试剂说明书提取鲤肠组织总rna,利用m
‑
mlv反转录酶合成cdna,cdna第一链的合成根据smart race试剂盒说明书进行,于
‑
80℃低温保存。根据genbank数据库已报道的tlr2基因序列进行同源比对,设计一对特异性引物tlr2
‑
orf
‑
f(5
´
‑
atgcaattcttgggaagag
‑3´
)和tlr2
‑
orf
‑
r(5
´
‑
tcaacattcatctctctgtagag
‑3´
)。以鲤cdna第一链为模板,进行pcr扩增,获得鲤tlr2基因cdna片段。
22.pcr反应体系(25 μl):pcr反应程序:步骤s2:鲤tlr2基因重组表达载体的构建:根据鲤tlr2基因的cdna序列,设计一对特异性引物tlr2
‑
yhbd
‑
f(5
´
‑
cgggatcctcaaatcatctccaacaggt
‑3´
)和tlr2
‑
yhbd
‑
r(5
´
‑
ccaagcttgttcgttctgagtgcaaca
‑3´
),分别在上、下游引物添加了bamh i和hind iii酶切位点。以鲤tlr2 cdna为模板,采用上游引物tlr2
‑
yhbd
‑
f和下游引物tlr2
‑
yhbd
‑
r扩增鲤tlr2基因的抗原决定簇集中片段。
23.pcr反应体系(25 μl):反应条件为:
将pcr产物经胶回收后与重组表达载体pet
‑
32a(+)同时进行bamh i和hind iii双酶切,分别用dna凝胶回收试剂盒纯化酶切产物,经t4 dna连接酶连接后转入克隆感受态dh5α,在含有氨苄抗性(100 mg/ml)的平板上进行抗性筛选。挑取阳性克隆接种到lb液体培养基中进行培养,37℃、180 rpm,培养8 h后用质粒提取试剂盒提取质粒,采用质粒pcr和双酶切的方法验证重组质粒,并将重组质粒送至生物公司进行测序验证。检测结果见图2和图3,其中m. d2000 plus dna ladder;1.重组质粒;2.重组质粒单酶切;3.重组质粒双酶切。已成功构建重组表达载体,命名为pet
‑
32a(+)
‑
tlr2。
24.步骤s3:鲤tlr2重组蛋白的表达和纯化:鲤tlr2重组蛋白的诱导表达:取5 μl重组表达载体pet
‑
32a(+)
‑
tlr2转入表达感受态bl21(de3)涂布于含100 mg/ml的氨苄抗性平板上进行抗性筛选,培养温度为37℃,培养时间为过夜培养。筛选结束后转至有氨苄(100 mg/ml)抗性的lb液体培养基中培养,培养条件为37℃,180 rpm。菌体进入指数生长期后添加iptg至终浓度1 mmol/l,进行iptg诱导培养6 h后离心收集菌体沉淀,pbs重悬后,加入5
×
上扬缓冲液沸水浴10 min后经12wt% sds
‑
page电泳检测目的蛋白的表达情况,重组蛋白分子量为41.8 ku。
25.鲤tlr2重组蛋白的纯化:将上述能够表达融合蛋白的菌液按照体积比1:100的比例接种到500 ml有氨苄抗性的lb培养基中进行扩大培养,培养条件为37℃,180 rpm至od值为0.5
‑
0.6时,加入iptg进行诱导,诱导培养6 h。诱导培养结束后,离心收集菌体沉淀,用变性结合缓冲液悬浮菌液,进行超声波破碎并收集上清部分。对上清液进行过滤;滤液用1 ml的亲和层析镍柱his
‑
bing
‑
resin进行纯化;纯化后的蛋白用pbs缓冲液进行透析复性,蛋白用bca法测蛋白浓度,并用常规sds
‑
page法检测重组蛋白的条带大小,检测结果如图4所示。结果表明鲤tlr2重组蛋白为单一条带,分子量为41.8 ku,其中m为低质量蛋白mark;(a)tlr2在bl21(de3)细菌中的表达。泳道1
‑
2:未经iptg诱导的合成组;泳道3
‑
4:经iptg诱导的合成组;(b)用不同浓度的咪唑溶液对重组蛋白进行洗脱纯化;泳道1
‑
9分别代表50、75、100、125、150、175、200、225、500 mmol/l咪唑浓度的洗脱缓冲液对应的洗脱样品;(c)融合蛋白的纯化结果。
26.鲤tlr2重组蛋白的特异性检测:取纯化后的重组蛋白30 μg,进行sds
‑
page电泳,然后将蛋白转至pvdf膜上。以带his标签的鼠抗作为一抗,以hrp标记的羊抗鼠igg为二抗进行蛋白特异性检测。检测结果如图5所示,条带单一且分子量大小一致,为41.8 ku。
27.步骤s4:鲤tlr2重组蛋白多克隆抗体的制备:将纯化的鲤tlr2重组蛋白和等体积的弗氏完全佐剂进行充分乳化;用腹部皮下多点注射法,按0.2 mg/次的免疫量对小鼠进行免疫,采集保存第一次免疫前小鼠血清。用经弗氏不完全佐剂充分乳化的抗原进行加强免疫,每次间隔7天,共注射5次。末次免疫10天
后,进行全血分离,收集鼠抗鲤tlr2血清,加入30wt%甘油,于
‑
80℃分装保存。
28.步骤s5:鲤tlr2蛋白的免疫组化分析:采用冰冻切片的方法将鲤肠组织以6 μm厚度进行切片;经50 μl的h2o2(3wt%)于37℃避光孵育10 min,阻断内源过氧化物酶后,将切片放入磷酸缓冲液(pbs)洗涤;随后山羊血清(体积比1:10稀释)室温封闭30 min,加入tlr2抗血清(体积比1:100)4℃孵育过夜;pbs洗涤3次后加入hrp标记的山羊抗鼠igg为二抗,37℃孵育1 h,pbs洗涤3次后dab显色。苏木精复染、脱水透明及树胶封片。阴性对照以实施例中多克隆抗体的制备步骤中的第一次免疫前鼠血清代替一抗。分析结果如图6所示,(a)为阴性对照结果、(b)为免疫组化结果。由免疫组化分析结果可知,鲤tlr2蛋白在肠上皮细胞处有表达。
29.步骤s6:鲤tlr2多克隆抗体的效价测定:为了对所获得的多克隆抗体的效价进行测定,具体过程如下:以实施例中多克隆抗体的制备步骤中的第一次免疫前鼠血清为隐性对照,以最后一次免疫后收集的鼠抗鲤tlr2血清在体积比1:100至1:2430000倍之间稀释作为一抗,以hrp标记的羊抗鼠igg为二抗,以tmb作为显色液,以鼠抗中鲤tlr2血清样品od450 nm值与阴性对照血清od450 nm值的比值≥2时作为判定标准,以制备的鼠抗鲤tlr2血清最大稀释度作为该抗体的有效效价。检测结果如表1所示,阳性血清的最高稀释度为1:810000,比较对象为鼠抗血清与阴性血清。
30.表1 elisa测定多克隆抗体tlr2效价上述结果表明,本发明与现有技术相比具有如下有益效果:1)本发明采用分子生物学和基因工程的方法构建了鲤tlr2基因的重组表达载体,诱导表达,亲和层析获得纯化的重组表达蛋白。
31.2)本发明的方法制备的鲤tlr2多克隆抗体具有很强的特异性,可用于(荧光)免疫组化、蛋白印迹和酶联免疫吸附等实验要求,建立体外免疫分析,为深入研究鲤tlr2的功能提供一个重要工具。
32.3)本发明制备的鲤tlr2多克隆抗体可用于鲤免疫应该染色激光共聚焦显微观察。
33.以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入
本发明保护的范围内。
34.序列表<110>
ꢀꢀ
河南师范大学<120>
ꢀꢀ
鲤toll样受体2多克隆抗体的制备方法及应用<130>
ꢀꢀ
2021<160>
ꢀꢀ
4<170>
ꢀꢀ
patentin version 3.3<210>
ꢀꢀ
1<211>
ꢀꢀ
19<212>
ꢀꢀ
dna<213>
ꢀꢀ
人工序列(artificial sequence)<400>
ꢀꢀ
1atgcaattct tgggaagag
ꢀꢀ
19<210>
ꢀꢀ
2<211>
ꢀꢀ
23<212>
ꢀꢀ
dna<213>
ꢀꢀ
人工序列(artificial sequence)<400>
ꢀꢀ
2tcaacattca tctctctgta gag
ꢀꢀ
23<210>
ꢀꢀ
3<211>
ꢀꢀ
28<212>
ꢀꢀ
dna<213>
ꢀꢀ
人工序列(artificial sequence)<400>
ꢀꢀ
3cgggatcctc aaatcatctc caacaggt
ꢀꢀ
28<210>
ꢀꢀ
4<211>
ꢀꢀ
27<212>
ꢀꢀ
dna<213>
ꢀꢀ
人工序列(artificial sequence)<400>
ꢀꢀ
4ccaagcttgt tcgttctgag tgcaaca
ꢀꢀ
27
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1