一株高效生物合成葡萄糖醛酸的工程菌株及其应用
本发明涉及代谢工程技术领域,具体为一株高效生物合成葡萄糖醛酸的工程菌株及其应用。
背景技术:
葡萄糖醛酸(d-glucuronicacid),简称葡醛酸(glcua),分子式c6h10o7,分子量为194.14。葡萄糖醛酸作为一种生物解毒剂,在动物肝脏中能与含有羟基、氨基、羧基、巯基等基团的内源性和外源性有毒物质结合,提高有毒物质的水溶性,最终以葡萄糖醛酸酯、葡萄糖醛酸盐或配合物的形式排出体外,起到解毒作用。此外,葡醛酸已被证明具有防治皮肤炎症、降低血液中胆固醇及甘油三酯浓度的功能,使其被广泛应用于饮料、食品及化妆品行业。葡萄糖醛酸衍生物葡萄糖醛酸内酯俗称肝泰乐,是一种肝脏解毒剂和免疫调节剂,可用于肝脏疾病治疗、食物药物解毒以及风湿类风湿性关节炎的辅助治疗。上述的应用,使葡萄糖醛酸每年的需求量递进式增长。
传统的葡萄糖醛酸的生产方法主要为多糖水解法和化学氧化催化法。其中,多糖水解法是指通过水解含糖醛酸的多糖得到葡萄糖醛酸的过程,例如,从太阳花膜半纤维素的水溶性部分得到葡萄糖醛酸;用碱水解棉花和纤维素、用热水萃取全纤维素、氯水溶液氧化纤维素等方法来制备醛酸;但在多糖水解法中,连接糖醛酸的苷键一般稳定性高,水解困难,因此,水解过程需要用强酸碱,而在强酸碱条件下,产物葡萄糖醛酸往往被分解,产生氧化选择性差、副产物多且产品收率低等缺陷,不能满足生产需要。化学氧化法是指用无机试剂氧化糖类及其衍生物来生产葡醛酸,以硝酸氧化法生产葡萄糖醛酸的应用最为广泛,该方法的过程是:首先用浓硝酸氧化淀粉得到粗淀粉氧化液,之后在酸性条件下加热加压水解粗淀粉氧化液,将所得的水解液进行减压浓缩,同时加入醋酸酯化,最后冷冻结晶制备得到葡萄糖醛酸内酯,然而该方法的总收率较低(约10%)且存在能耗高、选择性差、环境污染严重等缺陷,使得该方法仍不能满足生产需求。随着人们对微生物认识的提高,生物催化法生产葡萄糖醛酸的研究日益增多,相较于多糖水解法和化学氧化法,生物催化法具有高效性、反应条件温、安全性高及废物排放少的优点。
在生物体内,葡醛酸可由肌醇氧化酶氧化肌醇直接获得,该反应在哺乳动物肾脏中进行,肌醇转化率可以达到84%,反应过程只需要氧分子而不需要其他辅助因子,为生物法生产提供了一条值得借鉴的的合成途径。
在大肠杆菌高密度发酵生产过程中,菌体生物量和异源蛋白表达量往往受到溶解氧不足的限制而难以达到较高的水平。因此,改进大肠杆菌异源表达方法、提高大肠杆菌对低溶氧环境的适应能力,对于提高葡醛酸的产量、加快推进其工业化生产应用具有重要意义。
技术实现要素:
鉴于此,本发明提供了一株高效生物合成葡萄糖醛酸的工程菌株及其应用,该工程菌株是一株含有肌醇氧化酶(miox)与透明颤菌血红蛋白(vgb)共表达体系的重组菌株;将该工程菌株用于glcua的生物法制备中,可降低发酵过程中的需氧量,提高肌醇的转化率。
为解决上述技术问题,本发明的技术方案如下:
一株高效生物合成葡萄糖醛酸的工程菌株,该工程菌株通过将petduet-miox-vgb质粒转入宿主菌种中获得;该工程菌株同时表达肌醇氧化酶(miox)及透明颤菌血红蛋白(vgb)。
优选的,所述petduet-miox-vgb质粒包括seqidno.1所示氨基酸序列的肌醇氧化酶和seqidno.2所示氨基酸序列的透明颤菌血红蛋白,其中,该肌醇氧化酶(thermothelomycesthermophilusatcc42464),来自ncbireferencesequence:xp_003661059.1;透明颤菌血红蛋白(vitreoscillavgb)来自ncbireferencesequence:wp_019959060.1;将seqidno.1所示氨基酸序列和seqidno.2所示氨基酸序列针对大肠杆菌进行密码子优化后,送武汉普健生物进行合成后酶切接入petduet-1质粒中,获得petduet-miox-vgb质粒。
上述质粒,同时包含肌醇氧化酶基因(miox)与透明颤菌血红蛋白基因(vgb)的序列。miox基因产物为肌醇氧化酶,可以在氧分子存在条件下,催化肌醇生成葡萄糖醛酸和水;vgb基因合成的透明颤菌血红蛋白具有在限氧条件下促进细胞生长,提高蛋白质合成能力,增加目的产物产量的作用,使生产菌在氧限制条件下能够正常生长和合成目的产物。
优选的,上述菌种具体为e.colibl21(de3)。
将上述工程菌株在葡萄糖醛酸(glcua)发酵中进行应用,过程如下:
(1)种子培养:使用lb培养基对工程菌株进行培养,获得种子液;
(2)高密度培养:以1-2%的接种量将种子液接种至tb培养基内进行高密度培养,然后向其中加入诱导剂,继续培养,获得发酵液;
(3)收集细胞:将步骤(2)的发酵液离心,收集得到菌泥ⅰ,将菌泥ⅰ用tris-hcl进行洗涤、重悬后,再次离心,得到菌泥ⅱ;菌泥ⅱ为湿菌体;
(4)向步骤(3)的湿菌体中加入反应液,进行全细胞转化,生成葡萄糖醛酸。
优选的,在步骤(1)中,工程菌株的培养温度为37℃,培养时间为12h,转速200rpm。
优选的,在步骤(2)中,对工程菌株的培养温度为37℃,当发酵液od600达到0.6~1.0时,添加iptg至浓度为0.2mm,调节温度为26℃,诱导12h,转速200rpm。
优选的,在步骤(3)中,洗涤过程中使用的洗涤液为ph为7.5的25mmtris-hcl;离心条件为:12000rpm条件下,离心5min,得到湿菌体。
优选的,在步骤(4)中,全细胞转化的具体过程如下:
s1,通透化处理:将步骤(3)的湿菌体进行反复冻融处理后,即可,经处理后,可得到通透性良好的重组大肠杆菌细胞;
s2,取经步骤(1)处理后的湿菌体1g,加入10ml反应液中,反应液成分为2g/l肌醇,2.0mml-半胱氨酸,1.0mm硫酸亚铁铵,50mmmops、ph值为7.5;
s3,取适量反应后溶液,于100℃沸水中水浴加热5min,使葡萄糖醛酸溶出,终止反应,然后快速冷却到室温,离心,将上清液过膜,进行含量检测。
在全细胞反应过程中,将工程菌株进行通透化处理,然后以肌醇为底物,获得葡萄糖醛酸;在经过通透化处理后,可提高工程菌株细胞膜通透性;该方法与在培养基中直接添加肌醇的传统发酵方法相比,具有葡萄糖醛酸产量显著提高,转化率明显提高的优点。
优选的,在步骤s1中,反复冻融的过程为:将湿菌体在液氮中冷冻10s或将湿菌体在-20℃条件下冷冻24h以上,然后,在37℃条件下解冻,反复冻融三次。
优选的,在步骤s3中,葡萄糖醛酸的检测方法采用高效液相色谱法,加热离心后反应体系上清经0.22μm滤膜过滤,流动相为5mmol·l-1的稀硫酸,色谱柱为aminexhpx-87h(bio-rad,usa),流速0.5ml·min-1,柱温40℃,进样量20μl,检测器为示差检测器(rid-10a)。
本发明中所用到的载体必须能够在宿主内独立复制,且插入的两种片段要都能够随着载体的复制而复制。
与现有技术相比,本申请的有益效果为:
(1)本发明与化学催化生产葡萄糖醛酸相比,生产过程温和、环保、生产成本低、转化途径短,将肌醇转化成葡萄糖醛酸只需要一步氧化还原反应。
(2)本发明将vgb引入,有效地促进了细胞的生长,使得工程菌株在限氧条件下依旧能够维持高水平的细胞生长,提高了需氧通路中摄取氧气量和能量利用的效率,从而在降低碳源消耗和产酸量的前提下,提高葡萄糖醛酸的产量。
(3)本发明采用重组大肠杆菌,在经过通透化处理之后,以肌醇为底物,生产葡萄糖醛酸,相比于在培养基中直接添加肌醇生产葡萄糖醛酸相比,其产物的浓度和反应的转化率都有明显的提高,详见具体实施方式中的实施例。
附图说明
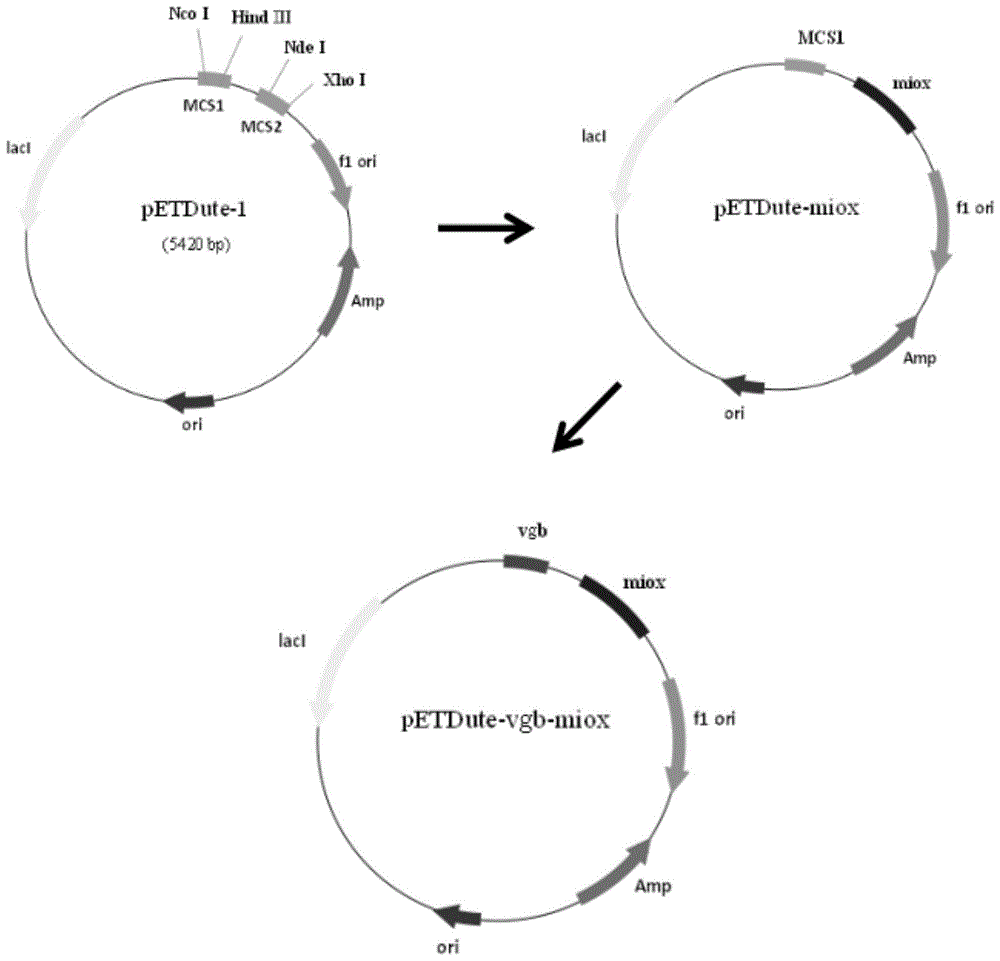
图1:petduet-miox-vgb质粒的构建流程;
图2:工程菌株e.colibl21/petduet-miox-vgb可溶性蛋白sds-page图;
图3:浓度为10g/l的葡萄糖醛酸标样hplc图谱;
图4:浓度为10g/l的肌醇标样hplc图谱;
图5:检测实施例2酵液获得的hplc图谱。
具体实施方式
实施例1:工程菌株的构建
如图1所示,本发明提供了petduet-miox-vgb质粒的构建过程,具体为:
将seqidno.1所示序列的肌醇氧化酶(thermothelomycesthermophilusatcc42464)及seqidno.2所示序列的透明颤菌血红蛋白(vitreoscillavgb),由已知氨基酸序列针对大肠杆菌优化后,得到核苷酸序列seqidno.3和seqidno.4,对petduet-1质粒进行酶切位点分析,选定单酶切位点ndei/xhoi,将miox基因连接到载体petduet-1中,构建质粒载体petduet-miox;再将vgb基因通过ncoi/hindiii酶切位点连接到petduet-miox中,得到共表达载体petduet-miox-vgb;
其中,肌醇氧化酶(thermothelomycesthermophilusatcc42464)来自ncbireferencesequence:xp_003661059.1;透明颤菌血红蛋白(vitreoscillavgb),来自ncbireferencesequence:wp_019959060.1。
miox基因产物为肌醇氧化酶,可以在氧分子存在条件下,催化肌醇生成葡萄糖醛酸和水;vgb基因合成的透明颤菌血红蛋白具有在限氧条件下促进细胞生长,提高蛋白质合成能力,增加目的产物产量的作用,使生产菌在氧限制条件下能够正常生长和合成目的产物。
如图2所示,将petduet-miox-vgb质粒通过化学转化法转化到宿主菌e.colibl21(de3)中;涂布/划线在氨苄卡那霉素抗性平板中,挑选阳性菌株提取质粒,酶切电泳进行验证,验证正确,送去上海闪晶分子生物科技有限公司进行测序,构建的工程菌株命名为e.colibl21(de3)/petduet-t-miox-vgb。
实施例2:工程菌株全细胞转化生产葡萄糖醛酸
使用工程菌株生产葡萄糖醛酸的过程如下:
(1)种子培养:接种环挑取实施例1单菌落接种于装有5mllb液体培养基的25ml试管中,于37℃、220rpm,摇床培养12h,获得种子液;
(2)按1%的接种量将步骤(1)的种子液接种于装有50mltb培养基的250ml摇瓶中,氨苄青霉素的浓度为100μg/ml,ph为7.0,于37℃、220rpm的摇床震荡培养,至od600值达到0.6,加入iptg至浓度为0.2mm,于26℃、220rpm条件下,摇床震荡培养12h,获得发酵液;
(3)收集细胞:将步骤(2)的发酵液离心,收集得到菌泥ⅰ,将菌泥ⅰ用ph为7.5的25mmtris-hcl进行洗涤、重悬后,在12000rpm条件下,离心5min,得到菌泥ⅱ;菌泥ⅱ即为湿菌体;
(4)全细胞转化:将湿菌体在-20℃条件下冷冻24小时,然后在37℃条件下解冻,反复冻融3次,取1g湿菌体加入10ml反应液中,反应液成分为2g/l肌醇,2.0mml-半胱氨酸,1.0mm硫酸亚铁铵,50mmmops,ph值为7.5。反应5h,得到的葡萄糖醛酸浓度为(1182.3±0.15)mg/l。
对葡萄糖醛酸采用高效液相色谱法进行检测,将全细胞转化后的溶液离心后,取上清液,经0.22μm滤膜过滤,按照下述hplc检测方法进行检测,结果见图5。
hplc检测方法如下:
流动相:5mmol·l-1的稀硫酸,流速0.5ml·min-1;
色谱柱:aminexhpx-87h(bio-rad,usa),柱温40℃;
检测器:示差检测器(rid-10a);
进样量:20μl。
如图3-图5所示,图3和图4分别为葡萄糖醛酸标准品及肌醇标准品的液相色谱图,由标样可以看出,葡萄糖醛酸的出峰时间在9.9s,肌醇出峰时间为11.6s;从图5可以看出,重组大肠杆菌e.colibl21(de3)petduet-miox-vgb全细胞反应液中检测出具有相同出峰时间的葡萄糖醛酸,证明重组菌构建成功。
尽管通过参考优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明涵盖的保护范围之内。因此,本发明的保护范围应所述以权利要求的保护范围为准。
在本申请中,涉及到的序列如下:
seqidno.1:
seqidno.2:
seqidno.3:
seqidno.4:
- 还没有人留言评论。精彩留言会获得点赞!