一种H3N2与H9N2亚型禽流感二价嵌合型病毒样颗粒的制备
一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备
技术领域
1.本发明涉及禽病预防疫苗制备技术领域,具体为一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备。
背景技术:
2.禽流感是由正黏病毒科a型流感病毒引起的一种禽类急性传染病,其病原禽流感病毒的主要宿主为禽类,也可以感染哺乳动物以及人类。该病自从1878年首次在意大利暴发后,在世界各地广泛传播,给养殖业带来巨大的危害。接种疫苗是预防流感病毒感染的最有效手段。目前商品化的禽流感疫苗均为灭活疫苗或病毒载体疫苗,在禽流感防控上起到了较好的作用。但是,这些疫苗依赖于鸡胚进行生产,具有诸如疫病暴发期间鸡胚供应不足、产生大量的废物引起环境污染、内源病毒污染等缺点。此外,灭活疫苗只能诱导体液免疫,而不能诱导细胞免疫。因此,需要利用新的技术研发一种安全高效的禽流感疫苗,以满足现代化家禽养殖业疫病防控的需求。
3.病毒样颗粒(virus
‑
like particles,vlps)是由某种病毒的一个或多个结构蛋白自行装配而成的高度结构化的空心蛋白颗粒,不含病毒核酸,无法自主复制,不存在基因重组或重配和毒力恢复的可能,安全性高,在形态上与天然病毒粒子相似,能够通过与病毒感染相同的途径,以接近真实构象的形式递呈给免疫细胞,更容易被机体免疫系统识别,从而有效诱导机体产生免疫保护反应。
4.vlp技术是构建新型疫苗、诊断工具和基因治疗载体的一种有前景的方法。对zeltins(2013)公布的数据进行的分析显示,目前至少存在由35个不同家族的病毒构建而成的110个vlps。vlp的制备可基于大肠杆菌、酵母、哺乳动物细胞、植物细胞以及昆虫杆状病毒等五种表达系统,其中昆虫杆状病毒表达系统因其表达水平高、真核处理特性和适宜大规模生产等诸多优势,而被广泛应用于多种病毒的vlp生产中,利用昆虫杆状病毒表达系统制备的vlp种类已占到了30%以上。作为一种很有前景的候选疫苗,流感vlps已被证明既能够诱导细胞免疫和体液免疫,又可以激活先天免疫。
技术实现要素:
5.本部分的目的在于概述本发明的实施方式的一些方面以及简要介绍一些较佳实施方式。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
6.本发明目的在于提供一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备,利用该方法制备的vlps表面同时展示h3n2亚型禽流感病毒的ha蛋白以及h9n2亚型禽流感病毒的ha和na蛋白,因此制备的禽流感vlps既可以预防h3n2亚型禽流感,又能够预防h9n2亚型禽流感,从而为h3n2和h9n2亚型禽流感的防控需求提供技术保障。此外,该嵌合型禽流感vlps可为相关新型禽流感疫苗的开发奠定良好基础。
7.为解决上述技术问题,根据本发明的一个方面,本发明提供了如下技术方案:
8.一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备,其包括如下步骤:
9.步骤一:由小鼠白血病病毒(mlv)gag蛋白、h3n2亚型禽流感病毒的ha蛋白以及h9n2亚型禽流感病毒的ha和na蛋白自行组装形成的空心化结构的蛋白颗粒;
10.步骤二:编码h3n2亚型禽流感病毒ha蛋白的核苷酸;编码h9n2亚型禽流感病毒ha蛋白的核苷酸;编码小鼠白血病病毒(mlv)gag蛋白和h9n2亚型禽流感病毒的na蛋白的核苷酸;
11.步骤三:利用核糖体内部进入位点将小鼠白血病病毒(mlv)gag蛋白基因与h9n2亚型禽流感病毒的na基因串联后进行基因合成,并将这段串联基因命名为mgagn2;
12.步骤四:构建表达禽流感病毒结构蛋白的重组杆状病毒,具体为:
13.根据h3n2亚型禽流感病毒的ha基因设计引物;以同样的方法设计h9n2亚型禽流感病毒的ha基因的引物,利用ha基因的上游和下游引物序列进行rt
‑
pcr扩增,将扩增后的ha基因与杆状病毒载体经酶切、连接、转化,获得ha基因重组杆状病毒穿梭质粒;同样,将人工合成的mgagn2基因与杆状病毒载体经酶切、连接、转化,获得mgagn2基因重组杆状病毒穿梭质粒;将穿梭质粒分别转化大肠杆菌dh10bac感受态细胞,筛选获得重组杆粒;利用脂质体介导转染法,将重组杆粒分别转染sf9昆虫细胞,获得三种重组杆状病毒,分别命名为:rbv
‑
h3、rbv
‑
h9、rbv
‑
mgagn2;
14.步骤五:禽流感vlps的制备和纯化,具体为:
15.将三种重组杆状病毒rbv
‑
h3、rbv
‑
h9、rbv
‑
mgagn2共接种感染sf9昆虫细胞,四种结构蛋白在表达并自行组装后,所形成的vlps会分泌到细胞培养上清中,经低速离心去除细胞碎片后,采用不连续的40%
‑
60%蔗糖密度梯度离心方法得到纯化的vlps。
16.作为本发明所述的一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备的一种优选方案,其中:步骤五中,三种重组杆状病毒共接种感染sf9昆虫细胞时,含有重组杆病毒的溶液体积比为:rbv
‑
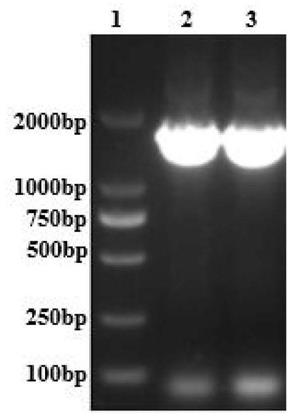
h3:rbv
‑
h9:rbv
‑
mgagn2=1:1:3。
17.作为本发明所述的一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备的一种优选方案,其中:ha蛋白分别来自h3n2和h9n2亚型禽流感病毒;基质蛋白为小鼠白血病病毒(mlv)gag蛋白。
18.作为本发明所述的一种h3n2与h9n2亚型禽流感二价嵌合型病毒样颗粒的制备的一种优选方案,其中:h3n2亚型禽流感病毒ha蛋白的核苷酸序列为seqidno.1:
19.>seqidno.1
20.atgaggaccgttattgcattgagctacattctctgcttggcttttggacagaaccttccagggaatgacaacagtacagcaacactatgcctgggacatcatgcagtgccgaatggaacaatagtgaaaacaatcaccgacgatcagattgaggtgaccaatgctactgagctggtccaaagttcctcaacagggaaaatatgcaacaatccccacaagatccttgatggaagagattgcacattaatagatgccatgcttggagatcctcattgtgatgtttttcaagatgagacatgggatctcttcgttgagcgaagcaatgctttcagcaattgttatccttatgatgtaccggattatgcctcccttcgatccttagttgcttcatcaggcacactagaattcattactgaaggtttcacctggacaggagtgagccagaatggaggaagcggtgcctgcaaaaggggacctgccaacggtttcttcggtagattgaactggttgactaagtcagggaactcatacccactgttaaacgtgactatgccaaacaatgataattttgacaagctatacatctggggtgttcaccacccgagtacaaaccaagaacagactaacctgtatgttcaggcctcaggaagagtcacagtctctaccaggagaagtc
aacagaccatagtcccgaacattggatctagaccttgggtaaggggtcaatctggaagaataagcatctactggacaatagtcaaacctggagatgtaccggtaatcaatagtaacggaaacctgattgcgcctcggggatacttcaagatccgaactgggaaaagctcaataatgagatcagatgcacctatagagacttgcatctcagaatgcatcactccaaatggaagcatccctaatgacaagccttttcaaaatgtaaacaaaatcacatacggggcatgtcccaaatatgtaaagcaaaataccctaaaattggctacaggaatgaggaatgtgcctgagaagcaaaccagaggtctattcggtgcaatagcagggttcatagagaatggatgggaaggaatgatagatggctggtatggcttcagacaccaaaattctgaaggcacaggacaagcagcagatcttaaaagcacccaagcggccattgaccaaatcaatgggaaattgaacagagtgattgaaaagacgaatgaaaaattccatcagatcgaaaaagaattctccgaggttgaaggaaggattcaagatcttgagaaatatgtcgaagacacaaaggtggacctctggtcttataatgcagagcttcttgttgctctagagaatcagcatacaattgatttgaccgattctgagatgaacaagttatttgaaaaaaccagaaggcaactgagagagaatgctgaagacatgggcaatggttgcttcaaaatatatcacaaatgtgacaatgcctgcatagaatcaattaggaatggaacttatgaccatgacatatatcgagatgaggcactgaacaatcggttccagatcagaggtgtagaactaaaatctggatacaaagactggatcctgtggatttcctttgccatatcatgctttttgctttgtgttgtgttgttggggttcattatgtgggcttgccagcgaggcaacattaggtgcaacatttgcatttga;
21.h9n2亚型禽流感病毒ha蛋白的核苷酸序列为seqidno.2:
22.>seqidno.2
23.atgggagccgtatcattgataactatgctactagtagcaacagtaagcaatgcagacaaaatctgcatcggataccaatcaacaaactccacagaaactgtagacacactaacagaaaacaatgtccctgtgacacatgccaaagaattgctccacacagagcacaatgggatgctatgtgcaacaaacttgggacatcctcttattctagacacctgtaccattgcaggactaatctatggcaatccttcttgtgatctattgctgggaggaagagaatggtcttacatcgtcgagagaccatcggctgtcaatggattgtgctaccccgggaatgtagaaaatctagaagaactaaggtcacttttcagttctgctagttcttatcaaagaatccagatttttccggacacaatatggaatgtgtcttacagtggaacaagcaaagcatgttcagattcattctacagaagcatgagatggttgacccaaaagaacaacgcttaccctattcaagacgcccaatacacaaataatcgagaaaagaacattcttttcatgtggggtataaatcacccacccaccgagactacacagacagatctgtacacaagaaccgacacaacaacaagtgtggcaacagaagaaataaataggaccttcaaaccattgataggaccaaggcctcttgtcaatggtttgcagggaagaattgattattattggtcggtattgaaaccaggtcaaacactgcgagtaagatccaatgggaatctaatagctccatggtatggacacattctttcaggagagagccacggaagaatcctgaagactgatttgaaaaggggtagctgtacagtgcaatgtcagacagaaaaaggtggcttaaacacaacattgccattccaaaatgtaagtaagtatgcatttggaaactgctcgaaatatgttggagtaaagagtctcaaacttgcagttggtctgaggaatgtgccttctaaatctagtagaggactatttggggccatagctggattcatagagggaggttggtcaggactagttgctggttggtatggattccagcattcaaatgaccaaggggttggtatggcagcagatagagactcaacccaaaaggcaattgataaaataacatccaaagtgaataacatagtcgataaaatgaacaaacagtatgaaattattgatcatgaattcagcgaggttgaaaatagacttaacatgatcaataataagattgatgatcaaattcaagacatatgggcatataacgcagaactgctagtgctacttgaaaaccagaaaacactcgatgagcatgatgcaaatgtaaataatctatataataaagtgaagagggcattgggttccaatgcagtggaagatgggaaaggatgtttcgagctatatcacagatgtgattaccagtgcatggagacaattcggaacgggacctacaacaggaggaaatatcaagaggaatcaaaattagaaaggcagagaatagagggggtcaagctggagtctgaaggaacttacaaaattctcaccatttattcgactgtcgcctcatctcttgtgattgcaatggggtttgctgccttcttgttctgggccatgtccaatgggtcttgcagatgcaacatttgtatataa;
24.小鼠白血病病毒(mlv)gag蛋白和h9n2亚型禽流感病毒的na蛋白的核苷酸序列为seqidno.3:
25.>seqidno.3
26.atgggccagactgttaccactcccttaagtttgaccttaggtcactggaaagatgtcgagcggatcgctcacaaccagtcggtagatgtcaagaagagacgttgggttaccttctgctctgcagaatggccaacctttaacgtcggatggccgcgagacggcacctttaaccgagacctcatcacccaggttaagatcaaggtcttttcacctggcccgcatggacacccagaccaggtcccctacatcgtgacctgggaagccttggcttttgacccccctccctgggtcaagccctttgtacaccctaagcctccgcctcctcttcctccatccgccccgtctctcccccttgaacctcctcgttcgaccccgcctcgatcctccctttatccagccctcactccttctctaggcgccaaacctaaacctcaagttctttctgacagtggggggccgctcatcgacctacttacagaagaccccccgccttatagggacccaagaccacccccttccgacagggacggaaatggtggagaagcgacccctgcgggagaggcaccggacccctccccaatggcatctcgcctacgtgggagacgggagccccctgtggccgactccactacctcgcaggcattccccctccgcgcaggaggaaacggacagcttcaatactggccgttctcctcttctgacctttacaactggaaaaataataacccttctttttctgaagatccaggtaaactgacagctctgatcgagtctgttctcatcacccatcagcccacctgggacgactgtcagcagctgttggggactctgctgaccggagaagaaaaacaacgggtgctcttagaggctagaaaggcggtgcggggcgatgatgggcgccccactcaactgcccaatgaagtcgatgccgcttttcccctcgagcgcccagactgggattacaccacccaggcaggtaggaaccacctagtccactatcgccagttgctcctagcgggtctccaaaacgcgggcagaagccccaccaatttggccaaggtaaaaggaataacacaagggcccaatgagtctccctcggccttcctagagagacttaaggaagcctatcgcaggtacactccttatgaccctgaggacccagggcaagaaactaatgtgtctatgtctttcatttggcagtctgccccagacattgggagaaagttagagaggttagaagatttaaaaaacaagacgcttggagatttggttagagaggcagaaaagatctttaataaacgagaaaccccggaagaaagagaggaacgtatcaggagagaaacagaggaaaaagaagaacgccgtaggacagaggatgagcagaaagagaaagaaagagatcgtaggagacatagagagatgagcaagctattggccactgtcgttagtggacagaaacaggatagacagggaggagaacgaaggaggtcccaactcgatcgcgaccagtgtgcctactgcaaagaaaaggggcactgggctaaagattgtcccaagaaaccacgaggacctcggggaccaagaccccagacctccctcctgaccctagatgactag;
27.h3n2亚型禽流感病毒的ha基因上、下游引物序列为seqidno.4和seqidno.5:
28.>seqidno.4
29.cggatccatgagtcttctgacc;
30.>seqidno.5
31.gctctagatcacttgaaccgctg;
32.h9n2亚型禽流感病毒的ha基因的引物,上、下游引物序列分别为seqidno.6和seqidno.7:
33.>seqidno.6
34.cggatccatgaagacaaccatt;
35.>seqidno.7
36.ccaagcttctatcagtttactcaaatg。
37.与现有技术相比,本发明的有益效果是:以杆状病毒作为表达载体,以sf9细胞作为生物反应器,制备的禽流感vlps具有产量高,免疫原性好,便于大规模生产等优点,且动物实验证明对h3n2亚型禽流感和h9n2亚型禽流感具有良好的免疫保护效果,为h3n2和h9n2
亚型禽流感新型疫苗的研制奠定了基础。
附图说明
38.为了更清楚地说明本发明实施方式的技术方案,下面将结合附图和详细实施方式对本发明进行详细说明,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
39.图1为mgagn2的基因串联示意图,即利用核糖体内部进入位点(ires)将小鼠白血病病毒(mlv)gag蛋白基因与h9n2亚型禽流感病毒的na基因进行串联;
40.图2为禽流感病毒ha基因的rt
‑
pcr扩增电泳图。泳道1为trans2k dna分子量标准;泳道2为h9n2亚型禽流感病毒的ha基因的pcr结果(1683bp);泳道3为h3n2亚型禽流感病毒的ha基因的pcr结果(1701bp);
41.图3为穿梭质粒的酶切鉴定电泳图。泳道1为trans2k plus dna分子量标准;泳道2为穿梭质粒pfastbac1
‑
mgagn2酶切结果(3500bp);泳道3为穿梭质粒pfastbac1
‑
h9酶切结果(1683bp);泳道4为穿梭质粒pfastbac1
‑
h3酶切结果(1701bp);
42.图4为重组杆粒的pcr鉴定结果。泳道1为trans2k plus dna分子量标准;泳道2为rbacmid
‑
mgagn2的pcr鉴定结果;泳道3为rbacmid
‑
h9的pcr鉴定结果;泳道4为rbacmid
‑
h3的pcr鉴定结果;
43.图5为正常sf9细胞与重组杆粒转染后出现病变的sf9细胞示意图。(a)正常sf9细胞;(b)rbacmid
‑
mgagn2重组杆粒转染后出现病变的sf9细胞;(c)rbacmid
‑
h9重组杆粒转染后出现病变的sf9细胞;(d)rbacmid
‑
h3重组杆粒转染后出现病变的sf9细胞;
44.图6为杆状病毒基因组pcr鉴定结果。泳道1为trans2k plus dna分子量标准;泳道2为rbv
‑
mgagn2的pcr鉴定结果;泳道3为rbv
‑
h9的pcr鉴定结果;泳道4为rbv
‑
h3的pcr鉴定结果;
45.图7为重组杆状病毒蛋白表达的western blot鉴定结果。泳道m为蛋白标准分子质量;泳道1为gag蛋白鉴定结果;泳道2为h9n2亚型禽流感病毒的ha蛋白鉴定结果;泳道3为h9n2亚型禽流感病毒的na蛋白鉴定结果;泳道4为h3n2亚型禽流感病毒的ha蛋白鉴定结果;
46.图8为二价嵌合型禽流感vlps的血凝结果图;
47.图9为二价嵌合型禽流感vlps的western blot鉴定结果。泳道1为蛋白标准分子质量;泳道2即为h9n2亚型禽流感病毒的ha蛋白(63.4kda)和h3n2亚型禽流感病毒的ha蛋白(63kda)以及gag和na串联表达蛋白(54kda)鉴定结果;
48.图10为二价嵌合型禽流感vlps的透射电镜图;
49.图11为二价嵌合型禽流感vlps免疫鸡血清hi抗体效价消长规律结果;(a)为免疫后h9n2亚型禽流感hi结果;(b)为免疫后h3n2亚型禽流感hi结果;
50.图12为淋巴细胞增殖结果。(a)为免疫后h9n2亚型禽流感病毒刺激淋巴细胞增殖结果;(b)为免疫后h3n2亚型禽流感病毒刺激淋巴细胞增殖结果;
51.图13为二价嵌合型禽流感vlps免疫攻毒后鸡体重增长率。(a)为h9n2亚型禽流感病毒攻毒后鸡体重增长率;(b)为h3n2亚型禽流感病毒攻毒后鸡体重增长率;
52.图14为实验动物分组;
53.图15为二价嵌合型禽流感vlps免疫攻毒后h9n2亚型禽流感病毒体外排毒检测;
54.图16为二价嵌合型禽流感vlps免疫攻毒后h3n2亚型禽流感病毒体外排毒检测;
55.图17为二价嵌合型禽流感vlps免疫攻毒后h9n2亚型禽流感病毒在体内的分布;
56.图18为二价嵌合型禽流感vlps免疫攻毒后h3n2亚型禽流感病毒在体内的分布。
具体实施方式
57.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。
58.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施方式的限制。
59.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的实施方式作进一步地详细描述。
60.实施例1
61.(1)构建穿梭质粒
62.第一,提取禽流感病毒的基因组rna,反转录为cdna;
63.第二,设计引物,并以第一步中所制备的cdna为模板进行pcr扩增获得h3n2亚型禽流感病毒的ha基因和h9n2亚型禽流感病毒的ha基因,pcr扩增结果如图2所示,其中引物序列具体为:
64.h3f(seqidno.4):5
’‑
cggatccatgaggaccgttattgcattgagc
‑3’
65.h3r(seqidno.5):5
’‑
aaagctttcaaatgcaaatgttgcacct
‑3’
66.h9f(seqidno.6):5
’‑
cggatcccatgggagccgtatcattgataac
‑3’
67.h9r(seqidno.7):5
’‑
cctctagattatatacaaatgttgcatctgc
‑3’
68.其中:下划线部分为酶切位点。其中ggatcc为bamh i酶切位点,tctaga为xba i酶切位点,aagctt为hind iii酶切位点。
69.第三,目的基因酶切、连接与转化
70.胶回收目的片段h3n2亚型禽流感病毒的ha基因和h9n2亚型禽流感病毒的ha基因,h3n2亚型禽流感病毒的ha基因两端的酶切位点为bamh i和xba i,h9n2亚型禽流感病毒的ha基因两端的酶切位点为bamh i和hind iii。酶切后克隆至杆状病毒穿梭质粒pfastbac1中,转化感受态大肠杆菌dh5α,挑取单个菌落过夜摇菌,提取质粒并对其进行双酶切鉴定,双酶切鉴定结果如图3所示,将鉴定正确的质粒命名为pfastbac1
‑
h3、pfastbac1
‑
h9。
71.第四,将人工合成的mgagn2序列经sal i和hind iii酶切后克隆至经相同酶切开的杆状病毒穿梭质粒pfastbac1中,转化至大肠杆菌dh5α感受态,挑取阳性克隆,经pcr及酶切鉴定,将鉴定正确的质粒命名为pfastbac1
‑
mgagn2。
72.(2)构建重组杆粒
73.将步骤(1)中构建的穿梭质粒pfastbac1
‑
h3、pfastbac1
‑
h9和pfastbac1
‑
mgagn2转化至大肠杆菌dh10bac感受态细胞,并进行抗性筛选,最终构建获得重组杆粒rbacmid
‑
h3、rbacmid
‑
h9和rbacmid
‑
mgagn2,具体过程如下:
74.将步骤(1)中构建的穿梭质粒pfastbac1
‑
h3、pfastbac1
‑
h9和pfastbac1
‑
mgagn2
转化至大肠杆菌dh10bac感受态细胞中,轻轻混匀;在冰上放置30分钟,接着42℃热浴90秒,然后立即加入无抗性培养基;30℃培养箱内震荡培养3h,取100μl转化液涂布于含有卡那霉素(100μg/ml)、庆大霉素(50μg/ml)、四环素(70μg/ml)、iptg(24mg/ml)和x
‑
gal溶液(20mg/ml)的固体培养基上,37℃培养48h,挑取白色单菌落过夜培养,提取杆粒并对其进行pcr鉴定,pcr鉴定结果如图4所示。将pcr鉴定获得重组正确的重组杆粒rbacmid
‑
h3、rbacmid
‑
h9和rbacmid
‑
mgagn2。
75.(3)制备重组杆状病毒
76.采用脂质体介导转染法,将步骤(2)中所得重组杆粒rbacmid
‑
h3、rbacmid
‑
h9和rbacmid
‑
mgagn2进行转染,具体过程如下:
77.将转染试剂恢复至室温,吸取4μl转染试剂与2μl重组杆粒(用无血清sf9细胞培养基稀释至2μg/100μl)轻轻混合,室温孵育30分钟;
78.将混合物加入已准备好的昆虫sf9细胞六孔板;
79.28℃培养96h,sf9病变结果如图5所示。待细胞病变后,收集细胞上清液即为第一代重组杆状病毒rbv
‑
h3、rbv
‑
h9和rbv
‑
mgagn2;
80.将第一代重组杆状病毒接种昆虫sf9细胞,同样条件培养下,收集第二代重组杆状病毒;以此类推,收集至第四代重组杆状病毒;
81.为便于检测分析,可将每一代重组杆状病毒于
‑
80℃保存备用。
82.对所收集的含有第四代重组杆状病毒的上清液,提取病毒基因组dna,同时进行pcr检测验证,以确保重组杆状病毒构建正确。pcr检测鉴定时,设计一对通用性引物序列如下:
83.m13上游引物:5
’‑
gttttcccagtcacgac
‑3’
,
84.m13下游引物:5
’‑
caggaaacagctatgac
‑3’
。
85.pcr验证结果如图6所示。对图6分析可以看出,各重组杆状病毒的pcr验证的分子量结果与理论值相符,其中泳道2为mgagn2基因的pcr鉴定结果,约为4000bp;泳道3为h9n2亚型禽流感病毒ha基因的pcr鉴定结果,约3983bp;泳道4为h3n2亚型禽流感病毒ha基因的pcr鉴定结果,约为4001bp。同时对第四代杆状病毒表达的外源蛋白进行western blot鉴定,鉴定结果如图7所示。
86.(4)制备并纯化获得禽流感vlps
87.将步骤(3)中所收集的第四代重组杆状病毒rbv
‑
h3、rbv
‑
h9和rbv
‑
mgagn2同时感染悬浮培养的昆虫sf9细胞,28℃120rpm摇床培养,感染复数为5,感染时间为96h;
88.培养过程中,病毒结构蛋白在表达后会自行组装,最终所形成的vlps会分泌到细胞培养上清中;
89.培养结束后,取培养上清,8,000rpm离心30分钟,初步去除大的细胞碎片;
90.然后采用不连续40%
‑
60%蔗糖密度梯度离心,浓缩样品在40%和60%蔗糖层的中间会形成白色条带,而杆状病毒则沉淀于底部,其他小的杂蛋白会停留在顶层,收集白色条带层,即为vlps。
91.对所制备的禽流感vlps进行血凝滴度滴度检测,如图8检测结果显示,未纯化的禽流感vlps血凝滴度为5log2,纯化后的禽流感vlps血凝滴度为8log2,表明纯化步骤可明显提高样品纯度以及血凝滴度。用同时含有鸡抗h9n2亚型禽流感阳性血清、鸡抗h3n2亚型禽
流感阳性血清和鼠抗mgag蛋白阳性血清的pbs溶液对所制备的禽流感vlps进行western blot分析,分析结果如图9所示。对所制备的禽流感vlps进行透射电子显微镜观察,结果如图10所示,可见病毒粒子具有完整的结构,其表面有明显的囊膜突起,直径大小约为180nm左右。
92.实施例2
93.本实施例就实施例1所制备的vlps作为疫苗使用时的免疫效果进行评价。
94.(1)免疫原制备
95.vlps疫苗的制备:用pbs溶液将纯化后的vlps调整为每150μl pbs溶液含有15μg、30μg、40μg蛋白,按照1:1比例将其缓慢滴入imjecttm明矾佐剂中乳化,在磁力搅拌器中匀速搅拌30分钟左右,4℃保存备用。
96.h3n2自制灭活疫苗的制备:根据病毒液体积,加入终浓度为1
‰
的4%多聚甲醛溶液,充分混匀后于4℃放置48h。然后按照1:1比例将其缓慢滴入imject
tm
明矾佐剂中进行乳化,4℃保存备用。
97.(2)动物免疫及攻毒方案
98.长春本地某鸡场购买320只白羽肉鸡,将其分为空白对照组、免疫非攻毒组、免疫攻毒组、攻毒对照组四组。其中空白对照组继续分为2组、免疫非攻毒组继续分为5组、免疫攻毒组继续分为8组、攻毒对照组继续分为2组。具体分组见表1。
99.免疫方式:禽流感vlps疫苗、h9n2商品化灭活疫苗和h3n2自制灭活疫苗均使用300μl进行肌肉注射。
100.免疫程序:10日龄进行免疫。
101.攻毒方式及时间:免疫三周后用106eid
50
的h9n2和h3n2亚型禽流感病毒进行滴鼻攻毒。
102.(3)hi抗体效价测定
103.分别于免疫后第7、14、21、28、35天对各剂量免疫组鸡进行静脉采血,室温放置3
‑
6h分离血清,利用血凝抑制试验检测免疫后鸡血清中的hi抗体效价,检测结果如图11。hi抗体效价测定结果表明,免疫后三周内各剂量禽流感vlps免疫组和疫苗免疫组的hi抗体效价呈上升趋势,即使免疫后第35天,各剂量禽流感vlps免疫组和疫苗免疫组的hi抗体效价仍高于2log2,并且各剂量禽流感vlps免疫组与疫苗免疫组对比显示,高剂量(40μg/300μl)禽流感vlps免疫组各时间点的hi与疫苗免疫组无显著差异(p>0.05)。由此表明,禽流感vlps具有较强的免疫原性,免疫后能诱导机体产生与灭活疫苗相当水平的特异性抗体。
104.(4)淋巴细胞增殖试验
105.在免疫后第7、14、21、28天无菌取鸡的脾脏,进行淋巴细胞增殖试验。首先进行鸡脾脏淋巴细胞的分离,具体步骤如下:
106.1)无菌取免疫非攻毒组每组三只鸡的脾脏研磨;
107.2)过200目筛网,后用淋巴细胞分离液重悬,1,000g离心10分钟;
108.3)取淋巴细胞层,加入红细胞裂解液作用2分钟,1,000g离心10分钟,弃上清;
109.4)pbs洗涤两次。
110.获得鸡脾淋巴细胞后进行淋巴细胞增殖试验,步骤如下:
111.1)将细胞浓度调整至1
×
106个/ml;
112.2)将100μl淋巴细胞悬液加入96孔细胞培养板中,放入37℃5%co2细胞培养箱中培养2h;
113.3)分别加入灭活的h9n2亚型禽流感病毒、h3n2亚型禽流感病毒和pbs作为刺激物;另设两组对照,一组只加1640培养基,一组只加淋巴细胞悬液。每组设三个复孔;
114.4)放入37℃5%co2细胞培养箱中孵育;
115.5)24h后每孔加入10μl cck
‑
8溶液;
116.6)放入37℃5%co2细胞培养箱中孵育2h;
117.7)酶标仪检测490nm处的od值。
118.结果判定:si=(样本od值
‑
空白od值)/(阴性od值
‑
空白od值)。si结果如图12所示。淋巴细胞增殖能力检测结果表明,各剂量禽流感vlps免疫组和疫苗免疫组的si随着时间延长而增长,到免疫后第3周达到高峰,并且高剂量禽流感vlps免疫组与疫苗免疫组对比显示,高剂量(40μg/300μl)禽流感vlps免疫组各时间点的si与疫苗免疫组无显著差异(p>0.05)。由此表明,禽流感vlps能诱导机体产生与灭活疫苗相当水平的细胞免疫。
119.(5)体重增长率监测
120.于攻毒后3、5、7、10、14天早晨喂食前称量鸡的体重。体重增长变化率如图13。结果发现,将不同剂量vlps免疫攻毒组、pbs攻毒对照组与商品或自制疫苗攻毒组对比发现,不同剂量vlps免疫攻毒组与商品或自制疫苗攻毒组在两种禽流感病毒攻击下体重呈增长趋势,并且高剂量vlps免疫攻毒组的增长率与商品或自制疫苗攻毒组无显著差异(p>0.05)
121.(6)体外排毒时间检测
122.攻毒后第3天起,每隔一天利用棉拭子对口咽及泄殖腔进行取样。将采取的样品放入含有1%双抗(青霉素和链霉素)的pbs中过夜杀菌,2,000g离心10分钟,吸取200μl样品液接种9日龄的spf鸡胚,弃掉24h内死亡的鸡胚。对72h后收取的鸡胚尿囊液进行血凝试验,检测攻毒后鸡的排毒情况,结果见表2和表3。高剂量和中剂量禽流感vlps免疫组攻毒后,病毒的体外排毒时间短于疫苗免疫攻毒组,而低剂量禽流感vlps免疫攻毒后的体外排毒时间短于疫苗免疫攻毒组或与疫苗免疫攻毒组的时间相当。由此表明,相比于商品化或自制灭活疫苗,本研究制备的禽流感vlps疫苗能有效缩短鸡只口咽和泄殖腔途径的排毒时间。
123.(7)体内病毒分布检测
124.攻毒后第1天起,每隔一天处死实验鸡,取其脑、气管、肺、肠、胰腺、脾、肾、肌肉等组织脏器。将等重的组织放入含有1%双抗(青霉素和链霉素)的pbs溶液中,利用研磨器对样品进行研磨,2,000g离心10分钟。提取研磨液中病毒rna并进行反转录获得病毒的cdna。利用禽流感病毒m片段的霍夫曼引物进行qpcr检测。h9n2亚型禽流感病毒攻毒后,体内病毒分布检测结果见表4。检测结果表明,高剂量和中剂量禽流感vlps免疫组攻毒后,体内载毒时间短于疫苗免疫攻毒组,而低剂量禽流感vlps免疫攻毒后的体内载毒时间短于疫苗免疫攻毒组或与疫苗免疫攻毒组的时间相当。由此表明,相比于商品化或自制灭活疫苗,本研究制备的禽流感vlps疫苗能降低动物体内的病毒载量。
125.总之,本研究制备的h3n2和h9n2二价嵌合禽流感vlps能够诱导鸡只产生与疫苗组水平相当的体液免疫和细胞免疫应答,可以有效保护鸡只免受同源病毒的攻击,为新型二价禽流感疫苗的研制提供了新的疫苗制备策略。
126.虽然在上文中已经参考实施方式对本发明进行了描述,然而在不脱离本发明的范
围的情况下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存在结构冲突,本发明所披露的实施方式中的各项特征均可通过任意方式相互结合起来使用,在本说明书中未对这些组合的情况进行穷举性的描述仅仅是出于省略篇幅和节约资源的考虑。因此,本发明并不局限于文中公开的特定实施方式,而是包括落入权利要求的范围内的所有技术方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1