PVA膜固定化酶及其制备方法与流程
pva膜固定化酶及其制备方法
1.本申请是基于申请日为2020年7月16日、申请号为202010683476.5、发明创造名称为
ꢀ“
pva膜固定化酶及其制备方法”的专利申请的分案申请。
技术领域
2.本发明涉及酶固定化技术领域,具体而言,涉及一种pva膜固定化酶及其制备方法。
背景技术:
3.生物催化正在成为化学品、中间体、精细化学品和最终药物分子制造计划的组成部分。 然而,随着工艺需求的不断扩大,酶应用的效率和经济性变得不可避免。因此,这不仅需要 增强酶活性、特异性和生产力,还需要提高保质期和可回收性,特别是为了促进商业规模应 用的经济可行性。
4.酶固定平台为生产过程中适宜地整合酶提供了一种优秀的工具。多年来,已经评估了几 种天然和合成载体对的酶固定效率,比如每个平台都根据其应用、经济和优势进行了专门评 估。固定化生物催化剂在有机合成、污染控制和以诊断为目的等领域具有广泛的应用(enzymemicrob technol,31,171
‑
8;j pharm sci,89,979
‑
90)。
5.通过将酶固定到固体载体上或固体载体内来实现固定化,由此获得非均相固定化酶系统。 酶可以通过多种方法固定,包括物理方式(载体和酶之间存在微弱的相互作用)以及化学方 式(载体与酶形成共价键)(analyst,133,697
‑
701;chem soc rev,40,2567
‑
92;柏林海德堡: springer,95
‑
126。)或两者的组合,从而包含各种功能活性的载体。
6.酶的物理固定方法包括在膜或膜反应器内、在水不溶性基质上的吸附(物理,离子)比 如在中孔材料上吸附、包含(或凝胶包埋)、用固体膜微囊化、用液膜微囊化、酶促 langmuir
‑
blodgett膜的形成(anal chem,1994;66,1120a
‑
7a)等。在膜包埋或包封的情况下, 所得的酶催化剂取决于膜支持物的性质,例如亲水性、疏水性、反应性官能团密度、孔隙率、 孔径分布、膜厚度、反应器配置等。固定化的固定方法基于酶在膜内的定位,其目的是除了 在操作条件下高度稳定之外还实现酶的更高表达。
7.目前,采用多孔膜固定化酶的研究有很多,但是,由于不同酶的结构和活性位点的不同, 导致其固定化方法也有不同,比如在采用pva膜(聚乙烯醇膜)固定脂肪酶时需要采用戊二 醛进行交联,才能达到利用固定化改善脂肪酶稳定性和活性的目的。另外,在利用多孔膜固 定化木聚糖酶、过氧化氢酶、纤维素酶、β
‑
半乳糖苷酶和抗坏血酸氧化酶等酶类时,通常也利 用氨基、羧基、巯基、羟基、咪唑或酚基等基团将多孔膜和酶通过共价键进行结合。由此可 见,现有技术中采用交联剂固定化酶时需要采用高纯度酶,导致固定化方法复杂、酶的负载 量受限。
技术实现要素:
8.本发明的主要目的在于提供一种pva膜固定化酶及其制备方法,以解决现有技术
胺,或者转氨酶的突变体的氨基酸序列具有发生突变得到的氨基酸序列中的突变位点,且与 发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列。
14.进一步地,上述来源于acetobacter sp.cctcc m209061的酮还原酶具有seq id no.3所 示的氨基酸序列,酮还原酶的突变体的氨基酸序列是由seq id no.3所示的氨基酸序列发生 突变得到的氨基酸序列,其中突变至少包括以下突变位点之一:第94位、第144位和第156 位,且第94位的丙氨酸突变为天冬酰胺,第144位的谷氨酸突变为丝氨酸,第156位的天冬 酰胺突变为苏氨酸或缬氨酸,或者酮还原酶的突变体的氨基酸序列具有发生突变得到的氨基 酸序列中的突变位点,且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列。
15.进一步地,上述来源于rhodococcus sp.phi1的环己酮单加氧酶具有seq id no.4所示的 氨基酸序列,上述环己酮单加氧酶的突变体的氨基酸序列是由seq id no.4所示的氨基酸序 列发生突变得到的氨基酸序列,其中突变至少包括以下突变位点之一:第280位、第435位、 第436位、第438位、第441位、第508位和第510位,且第280位的苯丙氨酸突变为酪氨 酸,第435位的苯丙氨酸突变为天冬酰胺,第436位的苯丙氨酸突变为丝氨酸,第438位的 亮氨酸突变为丙氨酸,第441位的丝氨酸突变为缬氨酸,第510位的亮氨酸突变为缬氨酸, 或者环己酮单加氧酶的突变体的氨基酸序列具有发生突变得到的氨基酸序列中的突变位点, 且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列。
16.进一步地,上述来源于rhodococcus ruber
‑
sd1的环己酮单加氧酶具有seq id no.5所示 的氨基酸序列,环己酮单加氧酶的突变体的氨基酸序列是由seq id no.5所示的氨基酸序列 发生突变得到的氨基酸序列,其中突变至少包括以下突变位点之一:第45位、第190位、第 249位、第257位、第393位、第504位和第559位,且第45位的甲硫氨酸突变为苏氨酸, 第190位的脯氨酸突变为亮氨酸,第249位的半胱氨酸突变为缬氨酸,第257位的半胱氨酸 突变为丙氨酸,第393位的半胱氨酸突变为缬氨酸,第504位的脯氨酸突变为缬氨酸,第559 位的酪氨酸突变为甲硫氨酸,或者环己酮单加氧酶的突变体的氨基酸序列具有发生突变得到 的氨基酸序列中的突变位点,且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸 序列。
17.进一步地,上述pva膜固定化酶还包括每种酶的辅酶和辅因子,辅酶和辅因子包埋在pva 多孔膜上。
18.进一步地,上述pva多孔膜上还具有聚乙二醇和/或聚乙烯亚胺,聚乙二醇的分子量为 peg400~peg 6000,聚乙烯亚胺的分子量为3kda~70kda。
19.进一步地,上述聚乙二醇与pva多孔膜的质量比为5:4~75:4,聚乙烯亚胺与pva多孔膜 的质量比为1:12~1:240。
20.进一步地,上述酶为粗酶。
21.进一步地,上述酶的负载量为0.05~0.4g游离酶/cm2膜或0.03~0.06g干燥的交联酶聚集 体/cm2膜。
22.根据本发明的又一方面,提供了一种上述任一种的pva膜固定化酶的制备方法,制备方 法包括:步骤s1,将包含酶与pva溶液的原料混合预定时间,得到混合体系;步骤s2,将 混合体系加入到模具中并对混合体系进行干燥处理,得到膜包埋的酶,模具为三维结构化模 具以形成三维结构化pva多孔膜;以及步骤s3,利用磷酸缓冲液对膜包埋的酶进行浸泡
处理 和洗涤后,得到pva膜固定化酶。
23.进一步地,上述混合体系的ph值为6.0~6.5。
24.进一步地,上述步骤s1包括:配制酶的悬浮液或酶溶液,悬浮液中的酶为交联酶聚集体, 酶溶液中的酶为去除细胞的游离酶;将悬浮液或酶溶液与pva溶液混合预定时间,得到混合 体系。
25.进一步地,上述预定时间为10~60分钟;pva溶液的pva分子量为20kda~200kda。
26.进一步地,上述pva溶液中pva的含量为10~50g/100ml。
27.进一步地,上述pva溶液中分散有乙酸、甲醇及硫酸。
28.进一步地,上述pva溶液的ph值在5.5~6.5之间。
29.进一步地,上述酶与pva溶液的比例为1~50g/100ml。
30.进一步地,上述悬浮液或酶溶液还包含磷酸缓冲液、可选的辅因子和可选的辅酶。
31.进一步地,上述辅酶与酶的重量比例为10:1~1:10。
32.进一步地,上述步骤s1包括:将pva水溶液、交联酶颗粒进行混合,形成混合体系。
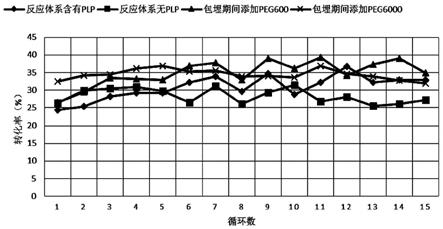
33.进一步地,上述交联酶颗粒与pva水溶液的比例为1~50g/100ml。
34.进一步地,上述预定时间为10~60分钟。
35.进一步地,上述交联酶颗粒包括酶、可选的辅因子和可选的辅酶。
36.进一步地,上述步骤s1包括:将pva水溶液、修饰剂溶液进行混合第一预定时间,形成 第二混合体系;将第二混合体系与酶体系混合第二预定时间,形成混合体系。
37.进一步地,上述pva水溶液的浓度为5~30g/100ml,优选修饰剂溶液包括分散有辅因子 的聚乙二醇水溶液和/或分散有辅因子的聚乙烯亚胺水溶液。
38.进一步地,上述聚乙二醇的分子量为peg400~peg 6000、混合体系中聚乙二醇的浓度为 3~10g/100ml。
39.进一步地,上述聚乙烯亚胺的分子量为3kda~70kda,更优选为3kda~50kda。
40.进一步地,上述混合体系中聚乙烯亚胺的浓度为0.1~1g/100ml,更优选为0.1~0.3g/100ml。
41.进一步地,上述酶体系包括酶、可选的辅因子、可选的辅酶和磷酸缓冲液。
42.进一步地,上述酶为去除细胞的游离酶或交联酶聚集体聚集体。
43.进一步地,上述酶体系中辅因子浓度为1~20mg/ml。
44.进一步地,上述酶体系中辅酶与酶的重量比例为10:1~1:10。
45.进一步地,上述酶与pva溶液的比例为1~50g/100ml。
46.进一步地,上述步骤s2包括:将混合体系置于模具中静置第三预定时间后向模具中加入 脱水促进剂进行干燥处理,其中脱水促进剂选自乙腈、乙醇和丙酮组成的组中的任意一种或 多种。
47.进一步地,上述脱水促进剂与混合体系的体积比例为1:10~5:1。
48.进一步地,上述第三预定时间为2~4小时。
49.进一步地,上述模具为三维结构化模具,三维结构化模具具有突起或凹槽。
50.进一步地,上述步骤s3包括:将膜包埋的酶在磷酸缓冲液中浸泡2~16小时后利用新鲜 的磷酸缓冲液洗涤膜包埋的酶,得到pva膜固定化酶。
51.应用本发明的技术方案,采用pva多孔膜作为载体将酶以包埋的方式固定化,包埋
固定 化的流程简单、条件温和,对纯化酶或粗酶均具有良好的固定化效果,且酶被包埋固定化在 pva多孔膜中后比较稳定,不容易在使用过程中浸出;所采用的pva多孔膜的多孔结构能够 更好地传递反应物和产物,适用于连续流动生化催化中使用。由于上述包埋固定为机械固定, 因此对酶具有广适性。将pva多孔膜进行三维结构化,使其具有立体结构,进而具有更多的 表面积,提供更多的包埋位点,进而在保证了酶的高活性和稳定性的基础上,提高了酶的负 载量。
附图说明
52.构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实 施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
53.图1示出了根据本发明实施例2的pva膜固定化酶在添加plp和没有添加plp时的稳定 性曲线;
54.图2示出了根据本发明实施例3的两种pva膜固定化酶的稳定性曲线;
55.图3示出了根据本发明实施例5的pva膜固定化酶在添加plp和没有添加plp时的稳定 性曲线;
56.图4示出了根据本发明实施例6的pva膜固定化酶在添加plp和没有添加plp时的稳定 性曲线;
57.图5示出了根据本发明实施例8的pva膜固定化酶在添加plp和添加nad
+
时的稳定性 曲线;
58.图6示出了根据本发明实施例8的pva膜固定化酶在添加plp和添加nad
+
时的稳定性 曲线;
59.图7示出了根据本发明实施例9的pva膜固定化酶在添加plp和没有添加plp时的稳定 性曲线。
具体实施方式
60.需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。 下面将参考附图并结合实施例来详细说明本发明。
61.如本申请背景技术所分析的,现有技术中采用多孔膜固定化酶的工艺复杂,为了解决该 问题,本申请提供了一种pva膜固定化酶及其制备方法。
62.在本申请一种典型的实施方式中,提供了一种pva膜固定化酶,该pva膜固定化酶包括 pva多孔膜和包埋在pva多孔膜上的酶,pva多孔膜为三维结构化pva多孔膜,酶选自转 氨酶(比如ω
‑
转氨酶)、d
‑
乳酸脱氢酶、甲酸脱氢酶、羰基还原酶、环己酮单加氧酶、烯酮还原 酶、腈水解酶、氨裂解酶、氨基酸脱氢酶、亚胺还原酶及它们的突变体中的任意一种。
63.本申请采用pva多孔膜作为载体将酶以包埋的方式固定化,包埋固定化的流程简单、条 件温和,对纯化酶或粗酶均具有良好的固定化效果,且酶被包埋固定化在pva多孔膜中后, 相对于在平面pva膜中的固定,更为稳定,不容易在使用过程中浸出;所采用的pva多孔膜 的多孔结构能够更好地传递反应物和产物,适用于连续流动生化催化中使用。由于上述包埋 固定为机械固定,因此对酶具有广适性。将pva多孔膜进行三维结构化,使其具有立体结构, 进而具有更多的表面积,提供更多的包埋位点,进而在保证了酶的高活性和稳定
性的基础上, 提高了酶的负载量。
64.本申请的pva膜固定化酶所包埋的酶可以为游离酶也可以为交联酶聚集体,无论是游离 酶还是交联酶聚集体在包埋后其催化效果均可以有效发挥。
65.所谓的交联酶聚集体与现有技术中相似,都是为:游离酶用硫酸铵或乙醇,乙腈,丙酮, 丙醇、peg等沉淀剂沉淀后,加入戊二醛,乙二醛或醛基化右旋糖苷等双功能试剂进行共价 交联,得到的不溶性酶聚集体。
66.如前,本申请的pva膜固定化酶对酶具有广适性,其中对以下酶类更为适用,转氨酶为 来源于chromobacterium violaceum dsm30191的转氨酶或者来源于arthrobacter citreus的转氨 酶,或来源于b.thuringiensis的转氨酶,酮还原酶为来源于acetobacter sp.cctcc m209061 的酮还原酶,或者来源于candida macedoniensis aku4588的酮还原酶;环己酮单加氧酶为来 源于rhodococcus sp.phi1的环己酮单加氧酶,或者来源于brachymonas petroleovorans的环己 酮单加氧酶,或者来源于rhodococcus ruber
‑
sd1的环己酮单加氧酶;氨裂解酶为来源于 aspergillus niger cbs 513.88的氨裂解酶和来源于solenostemon scutellarioides的氨裂解酶;烯 还原酶为来源于saccharomyces cerevisiae的烯还原酶和来源于chryseobacterium sp.ca49的烯 还原酶;亚胺还原酶为来源于streptomyces sp的亚胺还原酶和bacillus cereus的亚胺还原酶; 氨基酸脱氢酶为来源于bacillus cereus的亮氨酸脱氢酶和来源于bacillus sphaericus的苯丙氨酸 脱氢酶;腈水解酶为来源于aspergillus niger cbs 513.88的腈水解酶和来源于neurospora crassaor74a的腈水解酶,优选地,来源于chromobacterium violaceum dsm30191的转氨酶具有seqid no.1所示的氨基酸序列,转氨酶的突变体的氨基酸序列是由seq id no.1所示的氨基酸序 列发生突变得到的氨基酸序列,其中突变至少包括以下突变位点之一:第7位、第47位、第 90位、第95位、第297位、第304位、第380位、第405位和第416位,且第7位的苏氨酸 突变为半胱氨酸,第47位的丝氨酸突变为半胱氨酸,第90位的赖氨酸突变为甘氨酸,第95 位的丙氨酸突变为脯氨酸,第297位的异亮氨酸突变为亮氨酸,第304位的赖氨酸突变为天 冬氨酸,第380位的谷氨酰胺突变为亮氨酸,第405位的精氨酸突变为谷氨酸,第416位的 精氨酸突变为苏氨酸,或者转氨酶的突变体的氨基酸序列具有发生突变得到的氨基酸序列中 的突变位点,且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列;优选地, 来源于arthrobacter citreus的转氨酶具有seq id no.2所示的氨基酸序列,转氨酶的突变体的 氨基酸序列是由seq id no.2所示的氨基酸序列发生突变得到的氨基酸序列,其中突变至少 包括以下突变位点之一:第3位、第5位、第60位、第164位、第171位、第178位、第180 位、第186位、第187位、第252位、第370位、第384位、第389位、第404位、第411 位、第423位和第424位,且第3位的亮氨酸突变为丝氨酸,第5位的缬氨酸突变为丝氨酸, 第60位的半胱氨酸突变为酪氨酸,第164位的苯丙氨酸突变为亮氨酸,第171位的谷氨酸突 变为天冬氨酸,第178位的丙氨酸突变为亮氨酸,第180位的异亮氨酸突变为缬氨酸,第186 位的丝氨酸突变为甘氨酸,第187位的丝氨酸突变为丙氨酸,第252位的缬氨酸突变为异亮 氨酸,第370位的亮氨酸突变为丙氨酸,第384位的酪氨酸突变为苯丙氨酸,第389位的异 亮氨酸突变为苯丙氨酸,第404位的亮氨酸突变为谷氨酰胺,第411位的甘氨酸突变为天冬氨 酸,第423位的甲硫氨酸突变为赖氨酸,第424位的谷氨酸突变为谷氨酰胺,或者转氨酶的 突变体的氨基酸序列具有发生突变得到的氨基酸序列中的突变位点,且与发生突变得到的
氨 基酸序列具有80%以上同源性的氨基酸序列;优选地,来源于acetobacter sp.cctcc m209061 的酮还原酶具有seq id no.3所示的氨基酸序列,酮还原酶的突变体的氨基酸序列是由seqid no.3所示的氨基酸序列发生突变得到的氨基酸序列,其中突变至少包括以下突变位点之 一:第94位、第144位和第156位,且第94位的丙氨酸突变为天冬酰胺,第144位的谷氨 酸突变为丝氨酸,第156位的天冬酰胺突变为苏氨酸或缬氨酸,或者酮还原酶的突变体的氨 基酸序列具有发生突变得到的氨基酸序列中的突变位点,且与发生突变得到的氨基酸序列具 有80%以上同源性的氨基酸序列;优选地,来源于rhodococcus sp.phi1的环己酮单加氧酶具 有seq id no.4所示的氨基酸序列,环己酮单加氧酶的突变体的氨基酸序列是由seq id no.4 所示的氨基酸序列发生突变得到的氨基酸序列,其中突变至少包括以下突变位点之一:第280 位、第435位、第436位、第438位、第441位、第508位和第510位,且第280位的苯丙 氨酸突变为酪氨酸,第435位的苯丙氨酸突变为天冬酰胺,第436位的苯丙氨酸突变为丝氨 酸,第438位的亮氨酸突变为丙氨酸,第441位的丝氨酸突变为缬氨酸,第510位的亮氨酸 突变为缬氨酸,或者环己酮单加氧酶的突变体的氨基酸序列具有发生突变得到的氨基酸序列 中的突变位点,且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列;优选地, 来源于rhodococcus ruber
‑
sd1的环己酮单加氧酶具有seq id no.5所示的氨基酸序列,环己 酮单加氧酶的突变体的氨基酸序列是由seq id no.5所示的氨基酸序列发生突变得到的氨基 酸序列,其中突变至少包括以下突变位点之一:第45位、第190位、第249位、第257位、 第393位、第504位和第559位,且第45位的甲硫氨酸突变为苏氨酸,第190位的脯氨酸突 变为亮氨酸,第249位的半胱氨酸突变为缬氨酸,第257位的半胱氨酸突变为丙氨酸,第393 位的半胱氨酸突变为缬氨酸,第504位的脯氨酸突变为缬氨酸,第559位的酪氨酸突变为甲 硫氨酸,或者环己酮单加氧酶的突变体的氨基酸序列具有发生突变得到的氨基酸序列中的突 变位点,且与发生突变得到的氨基酸序列具有80%以上同源性的氨基酸序列。
67.为了提高pva膜固定化酶的催化效率,优选上述pva膜固定化酶还包括每种酶的辅酶和 辅因子。上述每种酶的辅酶和辅因子表示,如果该酶具有相应的辅酶和辅因子,则pva膜固 定化酶中还包埋有该酶的辅酶和辅因子;如果该酶没有辅酶或辅因子,则pva膜固定化酶中 不设置多余的辅酶或辅因子。
68.本申请的pva膜固定化酶不仅可以适用于纯化酶,而且还适用于粗酶,为了节约程序, 优选该酶为粗酶。同时,由于本申请的固定化方式为包埋,因此能够负载的酶量较多,优选 酶的负载量为0.05~0.4g游离酶/cm2膜或0.03~0.06g干燥的交联酶聚集体/cm2膜。
69.在另一种实施例中,上述pva多孔膜上还具有聚乙二醇和/或聚乙烯亚胺,聚乙二醇的分 子量为peg400~peg 6000,聚乙烯亚胺的分子量为3kda~70kda,优选为3kda~50kda。 进一步地,优选上述聚乙二醇与pva多孔膜的质量比为5:4~75:4,聚乙烯亚胺与pva多孔膜 的质量比为1:12~1:240。上述聚乙二醇、聚乙烯亚胺使得pva多孔膜中的孔结构更为丰富。
70.在本申请另一种典型的实施方式中,提供了上述任一种pva膜固定化酶的制备方法,该 制备方法包括:步骤s1,将包含酶与pva溶液的原料混合预定时间,得到混合体系;步骤 s2,将混合体系加入到模具中并对混合体系进行干燥处理,得到膜包埋的酶,模具为三维结 构化模具以形成三维结构化pva多孔膜;以及步骤s3,利用磷酸缓冲液对膜包埋的酶
进行浸 泡处理和洗涤后,得到pva膜固定化酶,优选混合体系的ph值为6.0~6.5。
71.本申请的制备方法采用混合、干燥和后处理工艺即可形成pva膜固定化酶,过程简单、 易于操作,不需要采用戊二醛、氨基、羧基等进行交联或共价固定,所形成的pva膜固定化 酶中的pva多孔膜作为载体将酶以包埋的方式固定化,对纯化酶或粗酶均具有良好的固定化 效果;且酶被包埋固定化在pva多孔膜中后比较稳定,不容易在使用过程中浸出;所采用的 pva多孔膜的多孔结构能够更好地传递反应物和产物,适用于连续流动生化催化中使用。由 于上述包埋固定为机械固定,因此对酶具有广适性。采用三维结构化模具以将pva多孔膜进 行三维结构化,使其具有立体结构,进而具有更多的表面积,提供更多的包埋位点,进而在 保证了酶的高活性和稳定性的基础上,提高了酶的负载量。
72.上述形成混合体系的方式可以根据提供酶的形式不同而有所变化,以下提供几种优选的 混合体系的形成方式,以下对步骤s1的描述不能作为对步骤s1的范围限定。
73.在本申请一种实施例中,上述步骤s1包括:配制酶的悬浮液或酶溶液,悬浮液中的酶为 交联酶聚集体,酶溶液中的酶为去除细胞的游离酶;将悬浮液或酶溶液与pva溶液混合预定 时间,得到混合体系。无论是酶溶液还是酶的悬浮液,均可与pva溶液进行混合,其中混合 过程中可以进行机械搅拌或磁力搅拌。
74.上述pva溶液为包括pva、水、乙酸、甲醇和硫酸的混合溶液,优选混合溶液的ph值 在5.5~6.5之间,乙酸,甲醇和硫酸组合起来使得制得的膜具有更多的微孔。
75.为了提高酶在pva溶液中分散的均匀性,优选上述预定时间为2~4小时。
76.为了形成机械强度更可靠的凝胶薄膜,pva溶液的pva分子量为20kda~200kda,另 外为了进一步形成丰富孔隙率的pva多孔膜并且有利于酶在其中的分散,优选pva溶液的中 pva的含量为5~30g/100ml,优选为10~50g/100ml。
77.基于pva膜包埋酶这一机械固定化方式,酶负载量可以较大,优选上述悬浮液或酶溶液 中酶的浓度为0.1~0.5g/ml,优选酶与pva溶液的比例为1~50g/100ml,更优选为5~40 g/100ml。
78.在混合过程中,为了保持酶的高活性,优选悬浮液或酶溶液还包含磷酸缓冲液、可选的 辅因子和可选的辅酶,优选辅因子浓度为1~20mg/ml,优选辅酶与酶的重量比例为10:1~1:10。
79.在本申请另一种实施例中,上述步骤s1包括:将pva水溶液、交联酶颗粒进行混合,形 成混合体系。在该实施例中,交联酶以干颗粒的形式与pva水溶液混合,易于交联酶颗粒的 分散。为了保证酶的负载量,优选交联酶颗粒与pva水溶液的比例为1~50g/100ml。同样地, 为了提高交联酶颗粒在pva水溶液中分散的均匀性,优选预定时间为10~60分钟。此外,需 要时,优选交联酶颗粒包括酶、可选的辅因子和可选的辅酶。
80.在本申请又一种实施例中,上述步骤s1包括:将pva水溶液、修饰剂溶液进行混合第一 预定时间,形成第二混合体系;将第二混合体系与酶体系混合第二预定时间,形成混合体系。 通过使用修饰剂促进pva的成膜并丰富其中的孔结构。
81.为了进一步形成丰富孔隙率的pva多孔膜并且有利于酶在其中的分散,优选pva水溶液 的浓度为5~30g/100ml。用于本申请的修饰剂可以从pva成膜时常用的修饰剂中进行选择, 为了避免修饰剂对酶的影响,优选修饰剂溶液包括分散有乙酸、甲醇及硫酸的混合液和/或分 散有辅因子的聚乙二醇水溶液和/或分散有辅因子的聚乙烯亚胺水溶液,其中,
优选混合液中 乙酸的含量为2~4g/100ml、甲醇的含量为5~9g/100ml、硫酸的含量为0.5~1g/100ml;优 选聚乙二醇的分子量为peg400~peg 6000,优选混合体系中聚乙二醇的浓度为 3~10g/100ml;优选聚乙烯亚胺的分子量为3kda~70kda,更优选为3kda~50kda,优选 混合体系中聚乙烯亚胺的浓度为0.1~1g/100ml,更优选为0.1~0.3g/100ml。
82.上述添加了修饰剂溶液时,对于酶体系与第二混合体系的混合并不会产生明显影响,因 此,上述酶体系可以为目前供应酶的常用体系形式,优选酶体系包括酶、可选的辅因子、可 选的辅酶和磷酸缓冲液,优选酶为去除细胞的游离酶或交联酶聚集体聚集体。为了提高酶的 负载量,当需要使用辅因子和辅酶时,辅因子浓度为1~20mg/ml,优选酶体系中辅酶与酶的 重量比例为10:1~1:10,酶与pva溶液的比例为1~50g/100ml。
83.在形成混合体系后,可以将混合体系静置干燥,为了加快成膜进程,优选上述步骤s2包 括:将混合体系置于模具中静置第三预定时间后向模具中加入脱水促进剂进行干燥处理,其 中脱水促进剂选自乙腈、乙醇和丙酮组成的组中的任意一种或多种,优选脱水促进剂与混合 体系的体积比例为1:10~5:1。在成膜过程中,酶被所形成的pva多孔膜包埋,形成稳定的 固定化酶结构。为了避免成膜过快,导致酶不能被完全包覆,优选第三预定时间为2~4小时。 另外,为了简化三维结构化模具结构,优选三维结构化模具具有突起或凹槽。
84.在成膜后,为了使酶的固定化更加牢固,优选上述步骤s3包括:将膜包埋的酶在磷酸缓 冲液中浸泡2~16小时后利用新鲜的磷酸缓冲液洗涤膜包埋的酶,得到pva膜固定化酶。
85.本申请上述制备方法中,所采用的酶可以为纯化酶,也可以为粗酶,为了节约成本,优 选上述酶为粗酶。
86.本申请所得到的pva膜固定化酶可进一步用缓冲液重悬,并加入戊二醛修饰,以使酶分 子间通过氨基与戊二醛的醛基共价结合而相互交联形成更大的聚集体,不会从pva膜中漏出, 同时附着在pva膜表层的酶也可以通过戊二醛的手臂作用与pva共价连接,从而更稳固地被 固定化,提高使用次数。优选地,戊二醛的用量为1~2g/100ml悬浮液。
87.以下将结合实施例和对比例进一步说明本申请的有益效果。
88.以下实施例中用到的酶及其来源见下表1。
89.表1
[0090][0091]
其中,ta
‑
cv转氨酶的氨基酸序列是seq id no.1:
[0092]
mqkqrttsqwreldaahhlhpftdtaslnqagarvmtrgegvylwdsegnkiidgm aglwcvnvgygrkdfaeaarrqmeelpfyntffktthpavvelssllaevtpagfdrvfyt nsgsesvdtmirmvrrywdvqgkpekktligrwngyhgstiggaslggmkymheqgdlpi pgmahieqpwwykhgkdmtpdefgvvaarwleekileigadkvaafvgepiqgaggvivpp atywpeiericrkydvllvadevicgfgrtgewfghqhfgfqpdlftaakglssgylpigavf vgkrvaegliaggdfnhgftysghpvcaavahanvaalrdegivqrvkddigpymqkrwr etfsrfehvddvrgvgmvqaftlvknkakrelfpdfgeigtlcrdiffrnnlimracgdhiv sapplvmtraevdemlavaercleefeqtlkargla。
[0093]
其突变体1(ta
‑
cv
‑
v1)的突变位点和氨基酸突变情况为:r416t+t7c+s47c+q380l; 突变体2(ta
‑
cv
‑
v2)的突变位点和氨基酸突变情况为: r416t+t7c+s47c+r405e+k90g+a95p+k304d+q380l+i297l。
[0094]
其中,ta
‑
ac转氨酶的氨基酸序列是seq id no.2:
[0095]
mgltvqkinweqvkewdrkylmrtfstqneyqpvpiestegdylitpggtrlldffnq lccvnlgqknqkvnaaikealdrygfvwdtyatdykakaakiiiedilgdedwpgkvrfvs tgseavetalniarlytnrplvvtrehdyhgwtggaatvtrlrsfrsglvgensesfsaqipg sscssavlmapssntfqdsngnylkdengellsvkytrrmienygpeqvaavitevsqgvgs tmppyeyvpqirkmtkelgvlwisdevltgfgrtgkwfgyqhygvqpd
iitmgkglsssslp agavvvskeiaafmdkhrwesvstyaghpvamaavcanlevmmeenlveqaknsgeyirs klellqekhksignfdgygllwivdivnaktktpyvkldrnfrhgmnpnqiptqiimekale kgvliggampntmrigaslnvsrgdidkamdaldyaldylesgewqqs。
[0096]
其突变体1(ta
‑
ac
‑
v1)的突变位点和氨基酸突变情况为: l3s+v5s+c60y+f164l+a178l+s187a+i180v+l370a+g411d+s186g+y384f+i389f+v252i+ l404q+e171d;突变体2(ta
‑
ac
–
v2)的突变位点和氨基酸突变情况为: l3s+v5s+c60y+f164l+a178l+s187a+i180v+l370a+g411d+s186g+y384f+i389f+v252i+ e424q+m423k。
[0097]
其中,kred
‑
ac酮还原酶的氨基酸序列是seq id no.3:
[0098]
marvagkvaivsgaangigkataqllakegakvvigdlkeedgqkavaeikaaggea afvklnvtdeaawkaaigqtlklygrldiavnnaginysgsvestsledwrrvqsinldgv flgtqvaieamkksgggsivnlssisgligdpmlaayvaskggvrlftksaalhcaksgykir vnsvhpgyiwtpmvagltkedaaarqklvdlhpighlgepndiaygilylasdeskfvtgse lvidggytaq。
[0099]
其突变体1(kred
‑
ac
‑
v1)的突变位点和氨基酸突变情况为:e144s+a94n+n156v;突 变体2(kred
‑
ac
‑
v2)的突变位点和氨基酸突变情况为:e144s+a94t+n156t。
[0100]
其中,chmo
‑
rs环己酮单加氧酶的氨基酸序列是seq id no.4:
[0101]
mtaqisptvvdavvigagfggiyavhklhneqgltvvgfdk adgpggtwywnrypgalsdteshlyrfsfdrdllqdgtwkttyitqpeileylesvvdrfd lrrhfrfgtevtsaiyledenlwevstdkgevyrakyvvnavgllsainfpdlpgldtfege tihtaawpegknlagkrvgvigtgstgqqvitalapevehltvfvrtpqysvpvgnrpvtke qidaikadydgiwdsvkksavafgfeestlpamsvseeernrifqeawdhgggfrfmfgtfg diatdeaaneaaasfirskiaeiiedpetarklmptglyakrplcdngyyevynrpnveavai kenpirevtakgvvtedgvlheldvlvfatgfdavdgnyrrieirgrnglhindhwdgqpts ylgvttanfpnwfmvlgpngpftnlppsietqvewisdtvayaerneiraieptpeaeeewtq tctdianatlftrgdswifganvpgkkpsvlfylgglgnyrnvlagvvadsyrgfelksav pvta。
[0102]
其突变体1(chmo
‑
rs
‑
cv
‑
v1)的突变位点和氨基酸突变情况为: f508y+f435n+l438a+t436s+f280v+s441v;突变体2(chmo
‑
rs
‑
cv
‑
v2)的突变位点和氨 基酸突变情况为:f508y+f435n+l438a+t436s+f280v+s441v+l510v。
[0103]
其中,chmo
‑
rr环己酮单加氧酶的氨基酸序列是seq id no.5:
[0104]
mttsidrealrrkyaeerdkrirpdgndqyirldhvdgwshdpympitprepkldhvtf afigggfsglvtaarlresgvesvriidkagdfggvwywnrypgamcdtaamvympllee tgymptekyahgpeilehcqrigkhydlyddalfhtevtdlvwqehdqrwristnrgdhft aqfvgmgtgplhvaqlpgipgiesfrgksfhtsrwdydytggdalgapmdkladkrvavig tgatavqcvpelakycrelyvvqrtpsavdergnhpidekwfaqiatpgwqkrwldsftai wdgvltdpselaiehedlvqdgwtalgqrmraavgsvpieqyspenvqraleeaddeqme rirarvdeivtdpataaqlkawfrqmckrpcfhddylpafnrpnthlvdtggkgveriten gvvvagveyevdcivyasgfeflgtgytdragfdptgrdgvklsehwaqgtrtlhgmhty gfpnlfvlqlmqgaalgsniphnfveaarvvaaivdhvlstgtssvettkeaeqawvqlll dhgrplgnpectpgyynnegkpaelkdrlnvgypagsaaffrmmdhwlaagsfdgltfr
[0105]
其突变体1(chmo
‑
rr
‑
v1)的突变位点和氨基酸突变情况为:p190l+y559m+c249v+ c393v+c257a+m45t;突变体2(chmo
‑
rr
‑
v2)的突变位点和氨基酸突变情况为:y559m +p190l+p504v。
[0106]
以下实施例所采用的磷酸盐缓冲液(pb)为磷酸氢二钠
‑
磷酸二氢纳缓冲液。
[0107]
实施例1
[0108]
通过pva膜包埋固定转氨酶ta
‑
cv clea(交联酶):
[0109]
pva i溶液的制备:50ml 10%(w/v)pva(200kda)与30ml 10%(w/v)乙酸、50% (v/v)甲醇、10%(w/v)硫酸混合。
[0110]
pva膜包封:将pva i溶液的ph调节至6.0,并取出20ml溶液,与ta
‑
cv交联酶聚集 体(clea)的悬浮液混合(ta
‑
cv交联酶聚集体clea的悬浮液的组成为0.5g的ta
‑
cv的 交连酶在2ml的0.1m磷酸盐缓冲液(pb)ph7.0中,且每毫升含2mg plp(磷酸吡咯醛)) 搅拌20min,形成混合体系。将其倒入3d多孔硅胶模板中,每个模板中弹孔为正方形,容积 约为0.1~0.2立方厘米,弹孔表面积约为2~5平方厘米,在37℃下干燥,得到膜包埋的酶。将 膜包埋的酶浸泡在0.1m pb(ph 7.0)+0.5m nacl的缓冲液中3小时,将膜包埋的酶从缓冲液 中取出,然后用0.1m pb(ph 7.0)洗涤该膜包埋的酶3次,得到实施例1的pva膜固定化酶。
[0111]
对比例1
[0112]
将上述实施例1中的3d多孔硅胶模板替换为耐高温硅胶盘以形成平面pva膜包埋的酶, 硅胶盘的底面积为80平方厘米。
[0113]
同时,考察不同分子量大小的pva,pva浓度,酶与pva的比例等参数对pva固定化 酶活性和稳定性的影响。
[0114]
转换和稳定性测试:
[0115]
转化研究中使用的模型反应:
[0116][0117]
上述反应式中的r1和r2可以各自独立地选自h、取代或未取代的烷基、取代或未取代 的环烷基、取代或未取代的芳烷基、取代或未取代的杂环基、取代或未取代的杂环烷基,r1和r2可连接成环。
[0118][0119]
取0.1g酮基质1,溶解在0.35ml甲醇中,加入3.0摩尔当量异丙胺盐酸盐作为氨基供体, 在反应体系中加入5mg plp,然后用0.3ml 0.1m pb 7.0稀释形成待反应体系。将3mg ta
‑
cvclea或包含3mgta
‑
cv clea的实施例1的三维结构化pva膜固定化酶或者3mgta
‑
cvclea的对比例1的平面pva膜固定化酶用作催化剂。在30℃下反应20小时后,通过hplc 方法检测转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重 复使用次数,并测试循环11次的转化率,记录在表2中。
[0120]
表2
[0121][0122]
此外,pva分子量、pva浓度、酶与pva溶液的比例对pva固定化酶的活性和稳定性 影响结果见表3。
[0123]
表3
[0124][0125]
混合体系的ph值对酶活性和稳定性的影响见表4。
[0126]
表4
[0127][0128]
实施例2
[0129]
通过pva膜包埋固定转氨酶ta
‑
cv clea
[0130]
pva ii溶液的制备:12%~15%(w/v)pva水溶液。
[0131]
pva膜包埋:取30ml pva溶液,加入3克clea湿颗粒,以及50mg plp,搅拌均匀形 成混合体系,倒入3d多孔硅胶模板中,每个模板中弹孔为圆形,容积约为0.15~0.2立方厘 米,弹孔表面积约为3~5平方厘米,37℃干燥,得到膜包埋的酶。将膜包埋的酶浸泡在0.1mpb 7.0缓冲液中过夜,从缓冲液取出膜包埋的酶,然后用0.1m pb7.0缓冲液对该膜包埋的 酶进行2次洗涤,得到实施例2的pva膜固定化酶。
[0132]
在添加clea之前,将一定量的peg 400~peg6000分别溶解在pva ii溶液中进行平行 实验。
[0133]
按照实施例1的底物类型进行转换和稳定性测试:
[0134]
取出0.1g酮基质1,溶解在0.35ml甲醇中,加入3.0摩尔当量异丙胺盐酸盐作为氨基供 体,在反应体系中加入5mg plp,然后用0.3ml 0.1m pb 7.0稀释形成待反应体系。剪取具有 约6平方厘米比表面积的包埋6mg ta
‑
cv clea的实施例2的各pva膜固定化酶用作催化剂, 在不添加plp的情况下进行平行反应。在30℃下反应4小时后,通过hplc方法检测转化率, 每一轮反应20h,结束一轮反应后将固定化酶分离出来,下一轮反应中重复使用,考察重复 使用次数,测试结果见图1。
[0135]
根据图1可以看出,实施例2的pva膜固定化酶的活性和稳定性非常好,使用14个周期 后没有活性减少。当没有添加plp时活性略低,但稳定性与添加plp的稳定性一样好,且根 据图1可以看出,添加peg400或peg6000可提高反应速度。
[0136]
此外,考察peg分子量和混合体系中peg浓度对酶活性和稳定性的影响,结果见表5。
[0137]
表5
[0138][0139]
实施例3
[0140]
pva
‑
有机溶剂膜包埋固定ta
‑
cv湿细胞游离酶或ta
‑
cv clea:
[0141]
取7.0ml 10%(w/v)pva溶液,并与5ml ta
‑
cv游离酶溶液(其中含有5mg/ml plp) 或1克ta
‑
cv clea混合,搅拌30min形成混合体系,将混合体系倒入玻璃或耐高温盘中, 并在室温下静置3小时,然后将15ml有机溶剂乙腈轻轻倒入倒入3d多孔硅胶模板中,每个 模板中弹孔为圆形,容积约为0.15~0.2立方厘米,弹孔表面积约为3~5平方厘米,在37℃下 干燥,形成膜包埋的酶。将膜包埋的酶浸泡在0.1m pb 7.0+0.5m nacl的缓冲液中2~3小时, 将膜包埋的酶从缓冲液中取出,然后用0.1m pb(ph 7.0)洗涤该膜包埋的酶3次,得到实施例 3的两种pva膜固定化酶。
[0142]
按照实施例1的底物类型进行转换和稳定性测试:
[0143]
取出0.1g酮基质1,溶解在0.35ml甲醇中,加入3.0摩尔当量异丙胺作为氨基供体,在 反应体系中加入5mg plp,然后用0.3ml 0.1m pb 7.0稀释形成待反应体系。剪取具有约6平 方厘米比表面积的包埋ta
‑
cv湿细胞或clea制成的pva膜固定化酶用作催化剂。在30℃ 下反应20小时后,通过hplc方法检测转化率,每一轮反应结束后将固定化酶分离出来,下 一轮反应中重复使用,考察重复使用次数,测试结果见表6和图2。
[0144]
表6
[0145][0146]
反应20小时后转化率仍然可达98%,并且在使用10个循环后稳定而不会失去活性。
[0147]
实施例4
[0148]
通过pva
‑
有机溶剂ta
‑
cv包埋制备高比表面积固定化ta
‑
cv:
[0149]
取出5.0ml 10%(w/v)pva溶液,并与5ml ta
‑
cv游离酶溶液(酶浓度0.1g/ml,含 有5mg/ml plp)混合,搅拌20min形成混合体系,赶走气泡,并将0.1ml混合体系滴入3d 多孔硅胶模板中,每个模板中单孔为圆形或方形,容积约0.15~0.2立方厘米,单孔表面积约 3~5平方厘米。在室温下静置3小时,然后将0.06ml有机溶剂丙酮或乙腈轻轻滴入孔中,在 37℃下干燥,在各孔中形成中空块状的成膜包埋的酶。将这些中空块状的成膜包埋的酶浸泡 在0.1m pb 7.0+0.5m nacl缓冲液中2
‑
3小时。然后除去缓冲液,再用0.1m pb7.0 3次洗涤 中空块状成膜包埋的酶得到实施例4的各pva膜固定化酶。
[0150]
取部分成膜包埋的酶通过戊二醛进一步修饰:用0.1m pb 7.0重新悬浮成膜包埋的酶,并 滴加戊二醛,每100ml悬浮液中滴加1~2g戊二醛,在室温下温和搅拌2小时,去除缓冲液, 用0.1m pb 7.0
×
3次洗涤戊二醛修饰后的中空块状的成膜包埋的酶,得到戊二醛修饰的pva 膜固定化酶。
[0151]
按照实施例1的底物类型进行反应活性和稳定性测试:
[0152]
取出0.1g酮基质,溶解在0.35ml甲醇中,加入3.0摩尔当量异丙胺盐酸盐作为氨基供体, 在反应体系中加入5mg辅因子plp,然后用0.3ml 0.1m pb 7.0稀释形成待反应体系。剪取具 有约6平方厘米比表面积的包埋ta
‑
cv游离酶(经丙酮干燥)的pva膜固定化酶、具有约6 平方厘米比表面积的包埋ta
‑
cv游离酶(经丙酮干燥且经戊二醛修饰)的pva膜固定化酶、 具有约6平方厘米比表面积的包埋ta
‑
cv游离酶(经乙腈干燥)的pva膜固定化酶、具有 约6平方厘米比表面积的包埋ta
‑
cv游离酶(经乙腈干燥且经戊二醛修饰)的pva膜固定 化酶用作催化剂。在30℃下反应20小时后并重复10个周期,通过hplc方法检测反应20h 转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次 数,测试结果见表7。
[0153]
表7
[0154][0155]
另外,考察脱水剂与pva
‑
酶混合体系的比例对酶活性和稳定性的影响,结果见表8。
[0156]
表8
[0157][0158]
根据表7中的数据可以看出使用实施例4的pva膜固定化酶作为催化剂时,10个周期后 没有活性减少。当通过ga修饰时,虽然酶活性略低,但稳定性与没有ga修改的稳定性一样 好。
[0159]
实施例5
[0160]
通过pva
‑
cfp膜包埋固定ta
‑
cv游离酶
[0161]
pva溶液:在水中制备12%(w/v)溶液;
[0162]
辅因子
‑
聚合物溶液(cfp溶液):溶解2%w/v pei(聚乙烯亚胺)(3kda~70kda), 加入5mg/ml辅因子(plp)并在室温下混合0.5~3小时。
[0163]
取35ml pva溶液和5ml cfp溶液,充分混合30分钟,然后加入5ml酶溶液(酶浓度 0.1g/ml)和3~5mg辅因子plp,在室温下混合30分钟形成混合体系。然后将混合体系倒入 3
‑
d结构化的多孔硅胶模板中并在37℃下干燥,得到膜包埋的酶,每个模板中单孔为圆形或 方形,容积约0.15~0.2立方厘米,单孔表面积约3~5平方厘米。将膜包埋的酶在0.1m pb 7.0 缓冲液中浸泡过夜。除去缓冲液后,用0.1m pb7.0洗涤2次膜包埋的酶得到实施例5的pva 膜固定化酶。
[0164]
按照实施例1的底物类型进行活性和稳定性测试:
[0165]
取出0.1g酮基质1,溶解在0.35ml甲醇中,加入3.0摩尔当量异丙胺作为氨基供体,在 反应体系中加入5mg plp,然后用0.3ml 0.1m pb 7.0稀释形成待反应体系。剪取具有约3
‑
4 平方厘米比表面积的包埋3mg ta
‑
cv游离酶的实施例4的pva膜固定化酶用作催化剂,在不 添加plp的情况下进行平行反应。在30℃下反应20小时后并重复14个周期,通过hplc方 法测试反应4h的转化率,测试结果见图3。
[0166]
由图3可以看出,所形成的pva膜固定化酶的活性和稳定性非常好,使用14个周期后没 有活动减少。当没有添加plp时活性略低,但稳定性与添加plp的稳定性一样好。
[0167]
此外,考察了pei分子量和混合体系中pei的浓度对酶活性和稳定性的影响,结果见表9。
[0168]
表9
[0169]
过夜。将膜包埋的酶从缓冲液中取出,用然后0.1m pb 7.0洗涤2次,得到实施例7的pva 膜包埋固定化酶。
[0184]
按照实施例1的底物类型进行活性和稳定性测试:
[0185]
具体的采用酮基质2替换实施例1中所采用的酮基质1。
[0186]
在水性缓冲体系中测试:取0.1g酮基质2并悬浮于1ml 0.1m pb 7.0缓冲液中,加入3.0 摩尔当量异丙胺盐酸盐作为氨基供体,在反应体系中加入5mg plp,将包含10mg ta
‑
ac游离 酶的实施例7的pva膜包埋固定化酶用作催化剂。在30℃下反应20小时后重复5个周期, 通过hplc方法检测转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使 用,考察重复使用次数,测试结果见表10。
[0187]
在双相系统中测试:取0.1g酮基质2并溶解在作为非水相的1ml mtbe中,加入1ml 0.1m pb 7.0作为水相,加入3.0摩尔当量的异丙胺作为氨基供体,在反应体系中加入5mgplp形成 待反应体系,将包含10mg ta
‑
ac游离酶的实施例7的pva膜固定化酶用作催化剂。在30℃ 下反应20小时后重复5个周期,通过hplc方法检测转化率,每一轮反应结束后将固定化酶 分离出来,下一轮反应中重复使用,考察重复使用次数,测试结果见表10。
[0188]
表10
[0189][0190]
根据表10中的数据可以看出,实施例7的pva膜固定化酶的活性和稳定性非常好,使用 5个周期后没有活性减少。
[0191]
考察pva分子量、pva浓度、酶与pva溶液的比例对酶的活性和稳定性的影响,结果见 表11。
[0192]
表11
[0193][0194]
实施例8
[0195]
通过pva
‑
cfp膜包埋固定酮还原酶
[0196]
pva溶液:在水中制备12%(w/v)溶液
[0197]
cfp溶液:制备溶解在水中的2%(w/v)pei(3kda~70kda),视情况加入5mg/ml 辅因子(nad+或plp),在室温下混合0.5~3小时。
[0198]
取35ml pva溶液和5ml cfp溶液,充分混合30分钟,然后加入5ml kred
‑
ac或 kred
‑
cm的酶溶液(酶浓度0.1g/ml)和4mg辅助因子nad
+
,在室温下混合30分钟形成 混合体系。然后将混合体系倒入3
‑
d硅氧烷模板中,每个模板中单孔为圆形或方形,容积约 0.15~0.2立方厘米,单孔表面积约3~5平方厘米。并在37℃下干燥形成膜包埋的酶。将膜包 埋的酶在0.1m pb 7.0中浸泡过夜。将膜包埋的酶从缓冲液中取出,用然后0.1m pb 7.0洗涤 2次,得到实施例8的含有nad
+
的pva膜固定化酶。
[0199]
采用plp替换辅助因子nad
+
重复上述过程,得到实施例8的含有plp的pva膜固定化 酶。
[0200]
活性和稳定性测试:
[0201]
转化研究中使用的模型反应:
[0202]
上述反应式中的r1和r2可以各自独立的选自h、取代或未取代的烷基、取代或未取
代 的环烷基、取代或未取代的芳烷基、取代或未取代的杂环基、取代或未取代的杂环烷基,或 r1与r2可连接成环。
[0203]
酮基质:
[0204]
取出0.1g酮基质3或4,并溶解在0.5ml异丙醇中,在反应体系中加入0.5ml含有5mg 辅因子nad
+
的0.1m pb 7.0形成待反应体系,向待反应体系中施加包埋30mg酮还原酶 kred
‑
ac(使用酮基质3验活)或酮还原酶kred
‑
cm(使用酮基质4验活)的实施例8的 pva膜包埋固定化酶作为催化剂。在30℃下反应20小时后并重复11个周期,用gc法检测 转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次 数,结果见图5,图6,其中图5对应的底物是酮基质3,图6对应的底物是酮基质4。
[0205]
由图5可以看出,实施例8的pva膜固定化酶kred
‑
ac针对酮基质3的活性和稳定性 非常好,转化率达到99%,重复使用11个循环后没有活性损失。当plp制备cfp溶液时, 活性比nad
+
好得多。
[0206]
由图6可以看出,实施例8所得到的pva膜包埋固定化酶kred
‑
cm的活性和稳定性非 常好,转化率达到99%,重复使用10个循环后没有活性损失。当plp制备cfp溶液时,活 性比nad
+
好得多。
[0207]
考察辅因子在酶体系中的浓度,结果见表12。
[0208]
表12
[0209]
[0210][0211]
实施例9
[0212]
pva膜包埋固定化转氨酶ta
‑
bt及其辅酶ldh、fdh的共交联酶,转氨酶ta
‑
bt及其辅 酶ldh、fdh的共交联酶以下简称共交联酶。
[0213]
pva i溶液的制备:50ml 10%(w/v)pva(200kda)与30ml 10%(w/v)乙酸、50% (v/v)甲醇、10%(w/v)硫酸混合。
[0214]
pva膜包封:将pva i溶液的ph调节至4~6.5,并取出20ml溶液,与共交联酶的悬浮 液混合(共交联酶的悬浮液的组成为0.5g的ta
‑
bt与ldh及fdh的共交联酶在2ml的0.1m 磷酸盐缓冲液(pb)ph7.0中,且每毫升含2mg plp(磷酸吡咯醛))搅拌20min,形成混合 体系。将其倒入3d多孔硅胶模板中,每个模板中弹孔为正方形,容积约为0.1~0.2立方厘米, 弹孔表面积约为2~5平方厘米,在37℃下干燥,得到膜包埋的酶。将膜包埋的酶浸泡在0.1m pb(ph 7.0)+0.5m nacl的缓冲液中3小时,将膜包埋的酶从缓冲液中取出,然后用0.1m pb (ph 7.0)洗涤该膜包埋的酶3次,得到实施例1的pva膜固定化酶。
[0215]
活性和稳定性测试。
[0216]
转化研究中使用的反应模型:
[0217][0218]
上述反应式中的r可以选自h、取代或未取代的烷基、取代或未取代的环烷基、取代或 未取代的芳烷基、取代或未取代的杂环基、取代或未取代的杂环烷基、卤素。
[0219][0220]
5ml的0.1m pb(ph 8.0)装入10ml的反应瓶中,随后加入100毫克上述底物5、80mg 甲酸铵及5mg plp,调节ph至ph 7.5~8.0,然后加入5mg nad
+
和10mg膜固定化酶(湿的, 含有50~80%的水)。在30℃下反应20小时,检测转化率,每一轮反应结束后将固定化酶分 离出来,下一轮反应中重复使用,考察重复使用次数。具体地考察了ta
‑
bt与辅酶共固定化 酶中主酶与辅酶的比例对酶活性和稳定性的影响,结果见表13。
[0221]
表13
[0222][0223]
实施例10
[0224]
通过pva
‑
cfp膜包埋将ta
‑
bt和辅酶d
‑
ldh,fdh共同固定化
[0225]
pva(200kda)溶液:在水中制备12%(w/v)溶液
[0226]
cfp溶液:制备2%(w/v)pei(3kda~70kda)水溶液,加入5mg/ml辅助因子(plp), 室温下混合0.5~3小时。
[0227]
取35ml pva溶液和5ml cfp溶液,充分混合30分钟,然后加入5mlta
‑
bt酶溶液(酶 浓度0.08g/ml)、0.08g辅酶d
‑
ldh、0.1g辅酶fdh及和4mg辅助因子nad
+
,在室温下 混合30分钟,形成混合体系。然后将混合体系倒入3
‑
d硅氧烷模板中,每个模板中单孔为圆 形或方形,容积约0.15~0.2立方厘米,单孔表面积约3~5平方厘米。并在37℃下干燥形成膜 包埋的酶。将膜包埋的酶在0.1m pb 7.0中浸泡过夜。将膜包埋的酶从缓冲液中取出,用然后 0.1m pb 7.0洗涤2次,得到实施例10的含有plp和nad
+
的pva
‑
cfp膜固定化酶。
[0228]
采用实施例9的模型进行活性和稳定性测试:
[0229]
将5ml的0.1m pb(ph 8.0)装入10ml的反应瓶中,随后加入100毫克上述底物5、80mg 甲酸铵及5mg plp,调节ph至ph 7.5~8.0,然后加入5mg nad
+
和10mg含有plp和nad
+
的
pva
‑
cfp膜固定化酶(湿的,含有50~80%的水)。在30℃下反应20小时,检测转化率, 每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数,在不 添加plp的情况下进行平行反应。
[0230]
在30℃下反应4小时后重复9个周期,通过hplc方法检测转化率,每一轮反应结束后 将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数,测试结果图7。
[0231]
根据图7可以看出,所得到的pva膜固定化酶的活性和稳定性非常好,在使用9个循环 后没有明显的活性丧失,且反应体系不加plp与添加plp的活性和稳定性一样好。
[0232]
实施例11
[0233]
pva
‑
cfp膜固定化环己酮单加氧酶:
[0234]
固定化方法同实施例10,只是将pva包封的酶变为环己酮单加氧酶chmo
‑
rs或 chmo
‑
bp,也可以是环己酮单加氧酶chmo与其辅酶醇脱氢酶adh
‑
tb或葡萄糖脱氢酶gdh 混和酶,具体酶组成见表14。
[0235]
活性和稳定性测试:
[0236]
转化研究中使用的反应模型:
[0237][0238]
上述反应式中的r可以选自h、取代或未取代的烷基、取代或未取代的环烷基、取代或 未取代的芳基、取代或未取代的芳烷基、取代或未取代的杂环基、取代或未取代的杂环烷基, 或r与其所连接的杂环形成稠环体系。
[0239]
chmo的pva
‑
cfp膜膜固定化酶的活性通过利用以下底物6进行反应来检测:
[0240][0241]
3ml的0.1m pb(ph 8.0)装入10ml的反应瓶中,随后通过加入50毫克底物6、100mg 葡萄糖及5mg nadp+、50mg醇脱氢酶adh
‑
tb、5mg葡萄糖脱氢酶gdh,然后加入含有 20mg环己酮单加氧酶的pva
‑
cfp膜固定化酶。在30℃下反应20小时,检测转化率,每一 轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数。
[0242]
chmo与辅酶gdh的pva
‑
cfp膜固定化酶的活性检测通过以下反应条件进行:
[0243]
3ml的0.1m pb(ph 8.0)装入10ml的反应瓶中,随后通过加入50毫克底物6、100mg 葡萄糖及5mg nadp+,然后加入30mg的chmo与gdh混和酶的共固定化酶。在30℃下 反应20小时,检测转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用, 考察重复使用次数。
[0244]
chmo与辅酶adh
‑
tb的pva
‑
cfp膜固定化酶的活性检测通过以下反应条件进行:
[0245]
3ml的0.1m pb(ph 8.0)装入10ml的反应瓶中,随后通过加入50毫克底物6、200ul的 异丙醇及5mg nadp+,然后加入30mg的chmo与adh混和酶的共固定化酶。在30℃下 反应20小时,检测转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用, 考
察重复使用次数。
[0246]
测试结果见表14。
[0247]
表14
[0248]
[0249][0250]
实施例12
[0251]
pva
‑
cfp膜固定化烯还原酶:
[0252]
固定化方法同实施例10,只是将pva包封的酶变为烯还原酶ered
‑
sc或ered
‑
chr,也 可以是烯还原酶与其辅酶葡萄糖脱氢酶gdh或甲酸铵脱氢酶fdh的混和酶,两种酶的重量 比例为ered:gdh(或fdh)=5:1。
[0253]
活性和稳定性测试。
[0254]
转化研究中使用的反应模型:
[0255][0256]
上述反应式中的r1和r2可以各自独立的选自h、取代或未取代的烷基、取代或未取代 的环烷基、取代或未取代的芳烷基、取代或未取代的杂环基、取代或未取代的杂环烷基,或 r1与r2成环。
[0257]
ered的pva
‑
cfp膜固定化酶的活性通过以下底物7的反应进行检测:
[0258][0259]
3ml的0.1m pb(ph7.0
‑
8.0)装入10ml的反应瓶中,随后通过加入100mg的底物7、接 着加入20mg nad(p)
+
、80mg甲酸铵、5mg fdh及含有30mg烯还原酶的pva
‑
cfp膜固定 化酶。在30℃下反应16小时,检测转化率,每一轮反应结束后将固定化酶分离出来,下一 轮反应中重复使用,考察重复使用次数。
[0260]
ered与fdh的pva
‑
cfp膜固定化酶的活性通过以下底物7的反应进行检测:
[0261]
3ml的0.1m pb(ph7.0
‑
8.0)装入10ml的反应瓶中,随后通过加入100mg的底物7、接 着加入20mg nad(p)
+
、80mg甲酸铵及含有40mg烯还原酶与fdh混和酶的pva
‑
cfp膜固 定化酶。在30℃下反应16小时,检测转化率,每一轮反应结束后将固定化酶分离出来,下 一轮反应中重复使用,考察重复使用次数。
[0262]
ered与gdh的pva
‑
cfp膜固定化酶的活性通过以下反应来检测:
[0263]
3ml的0.1m pb(ph7.0
‑
8.0)装入10ml的反应瓶中,随后通过加入100mg的底物7、接 着加入20mg nad(p)
+
、120mg葡萄糖及含有40mg烯还原酶与gdh混和酶的pva
‑
cfp膜 固定化酶。在30℃下反应16小时,检测转化率,每一轮反应结束后将固定化酶分离出来, 下一轮反应中重复使用,考察重复使用次数。测试结果见表15。
[0264]
表15
[0265]
[0266][0267]
实施例13
[0268]
pva
‑
cfp膜固定化亚胺还原酶
[0269]
固定化方法同实施例10,只是将pva包封的酶变为亚胺还原酶ired
‑
str或ired
‑
bc,也 可以是烯还原酶与其辅酶葡萄糖脱氢酶gdh或甲酸铵脱氢酶fdh的混和酶,两种酶的比例 为ered:gdh(或fdh)=4:1。
[0270]
活性和稳定性测试。
[0271]
转化研究中使用的反应模型:
[0272][0273]
上述反应式中的r1和r2可以各自独立的选自h、取代或未取代的烷基、取代或未取代 的环烷基、取代或未取代的芳基、取代或未取代的芳烷基、取代或未取代的杂环基、取代或 未取代的杂环烷基,或r1和r2与其所连接的杂环或芳环形成稠环体系。
[0274]
ired的pva
‑
cfp膜膜固定化酶的活性采用以下底物8,并按以下方法测试:
[0275]
[0276]
将2ml 0.1m pb缓冲液(ph 7.0
‑
8.0)加入10ml反应瓶中,然后加入100mg上述底物 8、10mg nad(p)
+
、60mg甲酸铵、10mg fdh和含有40mg ired的pva
‑
cfp膜固定化 酶。在30℃下反应16小时后,检测转化率,每一轮反应结束后将固定化酶分离出来,下一 轮反应中重复使用,考察重复使用次数。
[0277]
ired和fdh的pva
‑
cfp膜固定化酶的活性采用底物8,并按以下方法测试:
[0278]
将2ml 0.1m pb缓冲液(ph 7.0
‑
8.0)加入10ml反应瓶中,并加入100mg上述底物8、 然后加入10mg nad(p)
+
、60mg甲酸铵,然后加入含有50mg ired和fdh混和酶的pva
‑
cfp 膜固定化酶。在30℃下反应16小时后,检测转化率,每一轮反应结束后将固定化酶分离出 来,下一轮反应中重复使用,考察重复使用次数。
[0279]
ired和gdh的pva
‑
cfp膜固定化酶的活性以下方法测试:
[0280]
3ml的0.1m pb缓冲液(ph 7.0
‑
8.0)加入10ml反应瓶中,随后加入100mg底物8, 再加入10mg nad(p)
+
、100mg葡萄糖和含有50mg ired和gdh混和酶的pva
‑
cfp膜固 定化酶。在30℃下反应16小时后,进行转化率测试。测试结果见表16。
[0281]
表16
[0282][0283]
实施例14
[0284]
pva
‑
cfp膜固定化腈水解酶
[0285]
固定化方法同实施例10,只是将pva包封的酶变为腈水解酶nit
‑
an或nit
‑
nc的酶溶液 (酶浓度0.1g/ml)或nit
‑
an或nit
‑
nc的交联酶聚集体悬浮液(0.5g/ml)。
[0286]
活性和稳定性测试。
[0287]
转化研究中使用的反应模型:
[0288][0289]
腈水解酶的pva
‑
cfp膜固定化酶的活性采用以下底物9,并按以下方法测试:
[0290][0291]
将2ml 0.1m pb缓冲液(ph 7.0
‑
8.0)加入10ml反应瓶中,并加入100mg上述底物9, 然后加入含有20mg nit的pva
‑
cfp膜固定化酶。在30℃下反应16小时后,检测转化率, 每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数。
[0292]
测试结果见表17。
[0293]
表17
[0294]
cfp
‑
pva包封的酶转换率(%)循环次数nit
‑
an>98%5nit
‑
nc>98%4nit
‑
an交联酶聚集体交联酶聚集体>98%8nit
‑
nc交联酶聚集体交联酶聚集体>98%8
[0295]
实施例15
[0296]
pva
‑
cfp膜固定化氨裂解酶
[0297]
固定化方法同实施例10,只是将pva包封的酶变为氨裂解酶pal
‑
an或pal
‑
ss。
[0298]
活性和稳定性测试。
[0299]
转化研究中使用的反应模型:
[0300][0301]
氨裂解酶pal的pva
‑
cfp膜固定化酶的活性采用以下底物10,并按以下方法测试:
[0302][0303]
将8ml 4m氨基甲酸铵水溶液(ph 9.0~9.5)加入10ml反应瓶中,并加入100mg上述底物 10,然后加入含有40mg nit的pva
‑
cfp膜固定化酶。在30℃下反应16小时后,检测转化率, 每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数。。
[0304]
测试结果见表18。
[0305]
表18
[0306]
cfp
‑
pva包封的酌转换率(%)循环次数pal
‑
an>98%18pal
‑
ss>98%17
[0307]
实施例16
[0308]
pva
‑
cfp膜固定化氨基酸脱氢酶
[0309]
固定化方法同实施例10,只是将pva包封的酶变为氨基酸脱氢酶aadh
‑
bc或aadh
‑
bs, 也可以是氨基酸脱氢酶与其辅酶葡萄糖脱氢酶gdh或甲酸铵脱氢酶fdh的混和酶,两种
酶 的比例为aadh∶gdh(或fdh)=4∶1。
[0310]
活性和稳定性测试。
[0311]
转化研究中使用的反应模型:
[0312][0313]
r为取代或未取代的芳基。
[0314]
aadh的pva
‑
cfp膜固定化酶的活性采用以下底物11或12,并按以下方法测试:
[0315][0316]
将5ml 0.1m tris
‑
cl缓冲液(ph 8.0~9.0)加入10ml反应瓶中,然后加入100mg底物 11或12、108mg氯化铵,调节ph至7.5~8.0,然后加入10mg nad
+
、150mg葡萄糖和10mggdh,最后加入包埋20mg aadh的pva
‑
cfp膜固定化酶。在30℃下反应16小时后,检测 转化率,每一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次 数。
[0317]
aadh及fdh共固定化酶的活性检测方法如下:
[0318]
将5ml 0.1m tris
‑
cl缓冲液(ph 8.0~9.0)加入10ml反应瓶中,然后加入100mg底物 11或12、108mg氯化铵,调节ph 7.5~8.0,然后加入10mg nad
+
、80mg甲酸铵和包埋50mgaadh与fdh混和酶的pva
‑
cfp膜固定化酶。在30℃下反应16小时后,检测转化率,每一 轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数。
[0319]
aadh及gdh的pva
‑
cfp膜固定化酶的活性检测方法如下:
[0320]
将5ml 0.1m tris
‑
c1缓冲液(ph 8.0~9.0)加入10ml反应瓶中,然后加入100mg底物 11或12、108mg氯化铵,调节ph 7.5~8.0,然后加入10mg nad
+
、150mg葡萄糖和包埋50mgaadh与gdh混和酶的pva
‑
cfp膜固定化酶。在30℃下反应16小时后,检测转化率,每 一轮反应结束后将固定化酶分离出来,下一轮反应中重复使用,考察重复使用次数。测试结 果见表19。
[0321]
表19
[0322]
cfp
‑
pva包封的酶转换率(%)循环次数aaddh
‑
bc>95%7aadh
‑
bs>95%9aadh
‑
bc+fdh>95%6aadh
‑
bc+gdh>95%8aadh
‑
bs+fdh>95%8aadh
‑
bs+gdh>95%7
[0323]
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:
[0324]
本申请采用pva多孔膜作为载体将酶以包埋的方式固定化,包埋固定化的流程简单、条 件温和,对纯化酶或粗酶均具有良好的固定化效果,且酶被包埋固定化在pva多孔膜中后比 较稳定,不容易在使用过程中浸出;所采用的pva多孔膜的多孔结构能够更好地传递反应物 和产物,适用于连续流动生化催化中使用。由于上述包埋固定为机械固定,因此对酶具有广 适性。将pva多孔膜进行三维结构化,使其具有立体结构,进而具有更多的表面积,提供更 多的包埋位点,进而在保证了酶的高活性和稳定性的基础上,提高了酶的负载量。
[0325]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员 来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等 同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1