吲哚苯醌类化合物、其制备方法及其应用
本发明涉及化学合成药物技术领域,具体而言,涉及吲哚苯醌类化合物、其制备方法及其应用。
背景技术:
耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcusaureus,mrsa)是医院感染重要的革兰阳性细菌,治疗棘手,死亡率高。自1961年首次发现以来,其分离率逐年增加,已成为严重的临床医学及公共卫生问题。目前,mrsa感染不再局限于医疗机构,呈进一步扩散趋势,世界各地相继发现了致病力极强的社区获得性耐甲氧西林金黄色葡萄球菌(community-acquiredmrsa,ca-mrsa),流行范围不断扩大,我国也有相关报道。
mrsa多重耐药现象日益严重,耐药机制主要包括:表达特殊耐药蛋白—青霉素结合蛋白2a(pbp2a),补充或代偿被抗菌药物抑制的pbp2的转肽酶功能;产生β-内酰胺酶,促进β-内酰胺酶类抗生素的水解;减少药物积聚;改变抗生素作用靶位,表达修饰酶等。以上机制导致除了甲氧西林外,mrsa对β-内酰胺类、氨基糖苷类、大环内酯类、四环素类、氟喹喏酮类和磺胺类等多种抗生素均能产生不同程度的耐药。现有临床抗mrsa药物极为有限,仅万古霉素、利奈唑胺等少数几种,而相对的耐药菌株也开始检出。为了应对mrsa多药耐药和扩散现状,研究开发新型抗mrsa药物迫在眉睫。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供吲哚苯醌类化合物、其制备方法及其应用。本发明提供一种吲哚苯醌类化合物,对包括耐甲氧西林金黄色葡萄球菌(mrsa)在内的金黄色葡萄球菌具有良好的抑制效果,可以有效抑制体内外mrsa的生长,而且具有较好的体内安全性,可以作为mrsa的抑菌剂或者杀菌剂使用,可以作为治疗mrsa引起的局部及全身性感染的候选药物。
本发明是这样实现的:
第一方面,本发明提供一种吲哚苯醌类化合物,其选自下述结构式所示化合物中的任意一种或其同分异构体,
第二方面,本发明提供一种前述实施方式所述的吲哚苯醌类化合物的制备方法,包括:参照下述合成路径合成所述吲哚苯醌类化合物:
第三方面,本发明提供前述实施方式任一项所述的吲哚苯醌类化合物在制备抗菌剂中的应用;
优选地,所述抗菌剂为抗金黄色葡萄球菌的试剂;
优选地,所述抗菌剂为抗mrsa的试剂。
第四方面,本发明提供前述实施方式任一项所述的吲哚苯醌类化合物在制备治疗mrsa引起的脓毒症、菌血症、肺炎和皮肤软组织感染的药物中的应用,
优选地,所述药物为抑制mrsa生物膜形成的药物。
本发明具有以下有益效果:本发明实施例提供一种吲哚苯醌类化合物,其对mrsa有良好的抑制效果,可以有效抑制mrsa的生长,可以作为mrsa的抑菌剂或者杀菌剂使用,同时,可以降低感染mrsa导致的死亡率,并对mrsa感染导致的各种疾病均有良好的治疗作用。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例3提供的c4诱导mrsa252耐药实验的结果图;
图2为本发明实验例4提供的c4对mrsa脓毒血症致死小鼠模型体内药效学评价的结果图;
图3为本发明实验例4提供的c4对mrsa体内亚致死感染小鼠动物模型体内药效学评价的结果图;
图4为本发明实验例4提供的c4对mrsa皮肤感染模型小鼠创面细菌定植的影响的结果图;
图5为本发明实验例4提供的c4治疗mrsa皮肤感染模型小鼠皮肤愈合情况的结果图;
图6为本发明实验例5提供的结晶紫染色法观察c4对mrsa生物膜形成量的影响的结果图;
图7为本发明实验例5提供的扫描电镜观察c4对影响mrsa生物膜形成表面结构的影响的结果图;
图8为本发明实验例5提供的激光共聚焦观察c4对mrsa生物膜形成三维结构的影响的结果图;
图9为本发明实验例6提供的c4溶血实验结果的结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提供一种吲哚苯醌类化合物,其选自下述结构式所示化合物中的任意一种或其同分异构体,
其中,r1选自氢、取代或未取代烷基和取代或未取代芳基形成的官能团组中的任意一种,r2选自取代或未取代烷基、取代或未取代烷氧基、取代或未取代芳香氧基、氨基、酯基、羟基、醛基和卤素形成的官能团组中的任意一种,r3选自氢或卤素,r4选自取代或未取代烷基、取代或未取代脂肪环基、取代或未取代烯基、取代或未取代炔基、取代或未取代杂芳基和取代或未取代芳基形成的官能团组中的任意一种,当x为o时,无r5,当x=n或c时,r5选自取代或未取代烷基、醛基、取代或未取代芳基和取代或未取代杂芳基形成的官能团组中的任意一种。且r2表示吲哚环中的苯环的任意位置可以被取代。
进一步地,r1选自氢、c1-c10取代或未取代烷基、取代或未取代苯基形成的官能团组中的任意一种,例如,r1选自氢、甲基、乙基、羟甲基、苯基、对苯甲基形成的官能团组中的任意一种。
进一步地,r2选自c1-c8未取代烷基、c1-c5未取代烷氧基、c7-c12未取代芳香氧基、氨基、c2-c10酯基、羟基、醛基和卤素形成的官能团组中的任意一种,例如,r2选自甲基、甲氧基、羟基、氨基、苄氧基、甲酸甲酯基、醛基、氟、氯、溴和碘形成的官能团组中的任意一种。
进一步地,r4选自氨基取代烷基、氨基取代脂肪环基、氨基取代烯基、氨基取代炔基、取代噻吩环、取代呋喃环、取代吡啶环、取代吲哚环、取代咪唑环和取代苯基形成的官能团组中的任意一种。优选地,r4选自c1-c6烷基氨基、c2-c6烷基氨基c3-c6环烷基氨基、c2-c6烯基氨基、c3-c6烯基氨基、氨基取代噻吩环、氨基取代呋喃环、氨基取代吡啶环、氨基取代苯基、烷氧基取代苯基、氨基取代吲哚环和氨基取代咪唑环形成的官能团组中的任意一种;例如r4选自c1-c6烷基氨基、c2-c6烷基氨基c3-c6环烷基氨基、c2-c6烯基氨基、c3-c6烯基氨基、噻吩甲氨基、噻吩乙氨基、呋喃甲氨基、呋喃乙氨基、吡啶乙氨基,苯基氨基、苄胺基氨基、苯乙基氨基、苯乙基氨基、苯氧乙氨基、乙醇基氨基、1h-吲哚-3-乙基氨基、咪唑-4-乙基氨基和n-boc乙二氨基形成的官能团组中的任意一种。
进一步地,当x=n或c时,r5选自c1-c6取代或未取代烷基、取代或未取代基、醛基、取代或未取代吡啶环、取代或未取代嘧啶环形成的官能团组中的任意一种;例如,当x=n或c时,r5选自c1-6未取代烷基、羟乙基、羟丙基、醛基,苯基、苄基、取代苄基、苯乙基、取代苯乙基、吡啶基、取代吡啶基以及嘧啶基形成的官能团组中的任意一种。
需要说明的是,上述未取代烷基、c1-c10未取代烷基、c1-c8未取代烷基和c1-6未取代烷基除了选择上述对应记载的未取代烷基,还可以选择乙基、正丙基、异丙基、正丁基、叔丁基、正戊基等未取代烷基或对应碳数的烷基。
上述未取代烷氧基、c1-c5未取代烷氧基除了上述烷氧基还可以是乙氧基、丙氧基、丁氧基等未取代烷氧基。
上述未取代芳香氧基除了上述苄氧基、还可以是苯乙氧基、苯丙氧基等芳香氧基团。
上述酯基、c2-c10酯基除了上述甲酸甲酯基,还可以甲酸乙酯基、甲酸丙酯基、乙酸乙酯基、乙酸丙酯基等酯基。
上述卤素指的是氟、氯、溴和碘等。
上述杂芳基不仅仅包括噻吩环、呋喃环、吡啶环、吲哚环和咪唑环,还可以包括嘧啶、苯并呋喃、苯并咪唑等含有杂原子的具有芳香性质的基团。
而芳基不仅仅包括苯基、还可以包括萘基、联苯以及三联苯等基团。
取代烷基、取代芳香基、取代苯基、取代烷氧基、取代脂肪环、取代烯基、取代炔基、取代噻吩环、取代呋喃环、取代吡啶环、取代吲哚环、取代咪唑环、取代嘧啶环和取代苯基等记载的含有取代基的基团的取代基可以选自烷基、氨基、羟基、酯基、卤素、烷氧基、等基团。且上述取代可以不仅仅是一个碳原子的一个h被取代,也可以是一个碳原子上的多个h被取代,或者是多个碳原子上的h被取代。
进一步地,吲哚苯醌类化合物选自下述结构式所示化合物中的任意一种:
本发明实施例还提供吲哚苯醌类化合物的制备方法,包括:
参照下述合成路径合成所述吲哚苯醌类化合物:
具体地,步骤c的操作为:2-取代吲哚,取代苯醌,苄基三乙基氯化铵(teba)和无水碳酸钾于n2保护下加入干燥圆底烧瓶中,加入乙腈,tlc监测反应,待原料反应完全,用饱和食盐水洗涤,乙酸乙酯萃取,收集有机层,无水硫酸钠干燥,过滤,减压浓缩并经硅胶柱纯化,得到蓝色固体。
步骤a和b的操作为:步骤c所得的产物与各种胺类化合物发生反应,减压除去溶剂,硅胶柱纯化,得到深棕色和深紫色固体。
本发明实施例还提供上述吲哚苯醌类化合物的应用,其可以作为抗菌剂,例如作为抑制或者杀灭mrsa的试剂。进一步,该化合物对mrsa所导致的感染或疾病都有良好的治疗效果,例如脓毒症、菌血症、肺炎和皮肤软组织感染等。同时,吲哚苯醌类化合物可以抑制丙酮酸激酶活性、抑制mrsa生物膜形成,提升感染mrsa的患者的存活率,因此,可以作为治疗上述疾病的药物。而该药物的可以为经口服给药的药剂、经肌肉注射给药的药剂、经静注给药的药剂、经喷雾吸入给药的药剂或者经皮给药的药剂;例如采用的剂型可以是颗粒剂、片剂、丸剂、注射剂、汤剂、软膏剂、滴鼻剂和气雾剂中的任意一种,或者采用现有技术中的其他剂型也可以。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
合成2,3,5-三氯-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物3)
参照下述合成路径:
具体地,称2-甲基吲哚(500mg,3.812mmol)四氯苯醌(780mg,3.176mmol),苄基三乙基氯化铵teba(760mg,3.17mmol)和无水k2co3(525mg,3.812mmol)于n2保护下加入干燥的圆底烧瓶中,加入无水乙腈(20ml),室温搅拌6小时,待原料四氯苯醌反应完全,减压浓缩,再将剩余物溶于乙酸乙酯,用饱和食盐水(20ml)洗涤,乙酸乙酯(20×3ml)萃取,收集有机层,无水硫酸钠干燥,过滤,减压浓缩并经硅胶柱纯化(石油醚:乙酸乙酯=5:1),得到蓝色的固体2,5-二氯-3-(呋喃-2-甲基)氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮939mg,产率:86.9%。
实施例2
合成2,5-二氯-3-(呋喃-2-甲基)氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物4)和2,6-二氯-3-(呋喃-2-甲基)氨基)-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物5)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入2-呋喃甲胺(28mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物4)34mg,产率:29%;深紫色固体(化合物5)57mg,产率48%。
化合物4的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.31(s,1h),7.50-7.36(m,1h),7.28(d,j=7.9hz,1h),7.24-7.20(m,1h),7.17-7.08(m,2h),6.46–6.28(m,2h),6.08(s,1h),5.03(d,j=6.1hz,2h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ176.2,176.1,150.5,142.9,141.9,141.2,137.6,135.3,134.7,127.2,122.0,120.6,120.3,110.7,110.6,109.0,108.4,106.1,41.9,14.1;esi-tof-hrms:m/zcalcdfor[m+h]+c20h15n2o3cl2,401.0454;found,401.0439.
化合物5的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.28(s,1h),7.41(d,j=1.8hz,1h),7.35-7.29(m,1h),7.18-7.15(m,2h),7.13-7.06(m,1h),6.44-6.28(m,2h),6.09(s,1h),5.11-4.94(m,2h),2.31(s,3h);13cnmr(101mhz,chloroform-d)δ179.5,172.6,150.2,143.2,142.9,142.3,135.9,135.5,135.2,127.1,121.9,120.5,119.5,110.8,110.6,108.5,107.9,104.6,41.8,13.8;esi-tof-hrms:m/zcalcdfor[m+h]+c20h15n2o3cl2,401.0454;found,401.0467.
实施例3
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(噻吩-2-甲基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物6)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(噻吩-2-甲基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物7)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入2-噻吩甲胺(33mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物6)30mg,产率:24%;深紫色固体(化合物7)60mg,产率49%。
化合物6的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.33(s,1h),7.34-7.27(m,2h),7.25-7.21(m,1h),7.18-7.07(m,3h),7.02(m,1h),6.06(s,1h),5.20(d,j=5.8hz,2h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ176.3,176.2,141.8,141.3,139.9,137.9,135.3,134.5,127.3,127.2,126.7,126.1,122.0,120.6,120.3,110.9,108.7,106.0,43.7,14.1;esi-tof-hrms:m/zcalcdfor[m+h]+c20h15n2o2scl2,417.0226;found,417.0230.
化合物7的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.27(s,1h),7.36-7.26(m,2h),7.20-7.13(m,2h),7.12-7.07(m,1h),7.05(d,j=2.7hz,1h),7.03–6.97(m,1h),6.07(s,1h),5.18(d,j=5.6hz,2h),2.30(s,3h);13cnmr(151mhz,chloroform-d)δ179.5,172.6,143.2,142.1,139.8,135.9,135.4,135.2,127.2,127.0,126.6,125.9,121.9,120.4,119.5,110.8,107.9,104.5,43.6,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c20h15n2o2scl2,417.0226;found,417.0234.
实施例4
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(2-噻吩-2-基)乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物8)2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(2-噻吩-2-基)乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物9)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入2-噻吩乙胺(37mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物8)37mg,产率:29%;深紫色固体(化合物9)41mg,产率32%。
化合物8的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.28(s,1h),7.30(d,j=7.5hz,1h),7.25-7.19(m,2h),7.18-7.13(m,1h),7.13-7.08(m,1h),6.99-6.97(m,1h),6.94-6.89(m,1h),6.03(s,1h),4.11(q,j=6.7hz,2h),3.23(t,j=6.8hz,2h),2.35(s,3h);13cnmr(100mhz,chloroform-d)δ176.6,176.5,142.6,141.8,140.1,138.2,135.7,134.7,127.6,127.5,126.4,124.9,122.3,120.9,120.6,111.2,108.2,106.4,46.4,31.8,14.4;esi-tof-hrms:m/zcalcdfor[m+h]+c21h17n2o2scl2,431.0382;found,431.0393.
化合物9的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.20(s,1h),7.36-7.30(m,1h),7.21-7.13(m,3h),7.13-7.07(m,1h),6.96-6.94(m,1h),6.91-6.85(m,1h),6.06(s,1h),4.10(q,j=6.7hz,2h),3.20(t,j=6.7hz,2h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ179.6,172.6,143.6,142.6,139.6,135.9,135.4,135.3,127.3,127.0,126.0,124.6,121.9,120.4,119.5,110.9,106.9,104.5,46.0,31.3,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c21h17n2o2scl2,431.0382;found,431.0362.
实施例5
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(2-吡啶-2-基)乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物10)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(2-吡啶-2-基)乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物11)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入2-吡啶乙胺(35mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:乙酸乙酯=1:1),得到棕红色固体(化合物10)31mg,产率:25%;深紫色固体(化合物11)48mg,产率39%。
化合物10的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.54(s,1h),8.63-8.45(m,1h),7.75(td,j=7.7,1.8hz,1h),7.58(t,j=6.4hz,1h),7.37-7.30(m,2h),7.29-7.23(m,1h),7.14(d,j=7.8hz,1h),7.10-7.02(m,1h),7.02-6.95(m,1h),4.10(q,j=6.9hz,2h),3.12(t,j=7.2hz,2h),2.26(s,3h);13cnmr(100mhz,dmso-d6)δ176.1,175.5,159.1,149.5,144.2,140.7,138.2,137.2,135.8,134.6,127.6,123.9,122.2,121.2,120.2,119.8,111.4,105.9,105.6,44.3,38.8,13.9;esi-tof-hrms:m/zcalcdfor[m+h]+c22h18n3o2cl2,426.0771;found,426.0781.
化合物11的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.44(s,1h),8.55–8.46(m,1h),7.78–7.70(m,1h),7.64(t,j=6.5hz,1h),7.32(dd,j=7.9,3.0hz,2h),7.28–7.22(m,1h),7.18(d,j=7.8hz,1h),7.09–7.02(m,1h),7.00–6.92(m,1h),4.08(q,j=6.8hz,2h),3.10(t,j=7.2hz,2h),2.26(s,3h);13cnmr(100mhz,dmso-d6)δ179.8,171.8,158.9,149.5,144.7,141.9,137.2,137.0,135.9,135.8,127.4,123.9,122.2,121.2,119.8,119.6,111.3,107.4,104.2,44.2,38.7,13.6;esi-tof-hrms:m/zcalcdfor[m+h]+c22h18n3o2cl2,426.0771;found,426.0778.
实施例6
合成2,5-二氯-3-(4-甲氧基苯基)氨基-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物12)和2,6-二氯-3-(4-甲氧基苯基)氨基-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物13)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙醇中,再加入对甲氧基苯胺(28mg,0.293mmol),90℃反应3h,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到紫红色固体(化合物12)27mg,产率:22%;紫色固体(化合物13)51mg,产率41%。
化合物12的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.35(s,1h),7.52(s,1h),7.34(d,j=7.9hz,1h),7.23(d,j=7.8hz,1h),7.18(t,j=7.0hz,1h),7.12(t,j=7.3hz,1h),7.06(d,j=8.8hz,2h),6.88(d,j=8.8hz,2h),3.83(s,3h),2.35(s,3h);13cnmr(101mhz,chloroform-d)δ176.7,176.6,157.9,141.6,140.0,137.9,135.3,134.7,130.1,127.1,126.5,122.0,120.6,120.3,113.7,110.8,110.2,106.1,55.5,14.2;esi-tof-hrms:m/zcalcdfor[m+h]+c22h17n2o3cl2,427.0611;found,427.0602.
化合物13的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.39(s,1h),7.52(s,1h),7.27-7.24(m,2h),7.19-7.04(m,4h),6.89(d,j=8.8hz,2h),3.83(s,3h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ179.9,173.1,158.0,143.4,140.3,136.1,135.6,135.3,129.9,127.1,126.4,122.0,120.5,119.6,113.7,110.9,109.3,104.6,55.5,13.8;esi-tof-hrms:m/zcalcdfor(m+h)c22h17n2o3cl2,427.0611;found,427.0601.
实施例7
合成2,5-二氯-3-(4-甲氧基苄基)氨基-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物14)和2,6-二氯-3-(4-甲氧基苄基)氨基-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物15)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入对甲氧基苄胺(40mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到紫红色固体(化合物14)27mg,产率:26%;紫色固体(化合物15)53mg,产率43%。
化合物14的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.39(s,1h),7.29-7.26(m,2h),7.26-7.20(m,2h),7.15-7.08(m,2h),6.97-6.89(m,2h),6.02(s,1h),4.96(s,2h),3.83(s,3h),2.29(s,3h);13cnmr(100mhz,chloroform-d)δ176.3,176.2,159.5,142.2,141.5,137.8,135.3,134.4,129.6,129.2,127.2,121.9,120.6,120.3,114.5,110.8,107.9,106.1,55.4,48.7,14.2;esi-tof-hrms:m/zcalcdfor[m+h]+c23h19n2o3cl2,441.0767;found,441.0763.
化合物15的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.30(s,1h),7.32(d,j=7.8hz,1h),7.24(d,j=8.3hz,2h),7.19-7.12(m,2h),7.12-7.06(m,1h),6.95-6.86(m,2h),6.04(s,1h),4.94(s,2h),3.81(s,3h),2.29(s,3h);13cnmr(100mhz,chloroform-d)δ179.6,172.6,159.5,143.6,142.6,135.9,135.3,135.2,129.4,129.2,127.1,121.9,120.4,119.5,114.5,110.8,107.0,104.6,55.4,48.6,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c23h19n2o3cl2,441.0767;found,441.0764.
实施例8
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(2-苯氧乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物16)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(2-苯氧乙基)氨基)环己烷-2,5-二烯-1,4-二酮(化合物17)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入苄氧乙胺(40mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到紫红色固体(化合物16)30mg,产率:24%;紫色固体(化合物17)55mg,产率43%。
化合物16的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.32(s,1h),7.37-7.27(m,3h),7.23(d,j=7.4hz,1h),7.18-7.13(m,1h),7.13-7.07(m,1h),7.01(t,j=7.4hz,1h),6.97-6.92(m,2h),6.32(s,1h),4.27-4.21(m,4h),2.33(s,3h);13cnmr(100mhz,chloroform-d)δ176.2,176.1,158.2,142.4,141.3,137.7,135.3,134.6,129.7,127.2,122.0,121.6,120.6,120.3,114.7,110.7,106.1,66.9,44.2,14.2;esi-tof-hrms:m/zcalcdfor(m+h)c23h19n2o3cl2,441.0767;found,441.0788.
化合物17的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.22(s,1h),7.36-7.27(m,3h),7.21-7.13(m,2h),7.13-7.07(m,1h),7.01-6.97(m,1h),6.95-6.88(m,2h),6.35(s,1h),4.25-4.19(m,4h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ179.6,172.6,158.1,143.4,142.8,136.0,135.5,135.3,129.7,127.1,121.9,121.6,120.4,119.5,114.6,110.9,107.2,104.5,66.8,44.1,13.7;esi-tof-hrms:m/zcalcdfor(m+h)c23h19n2o3cl2,441.0767;found,441.0775.
实施例9
合成2,5-二氯-3-(3,4-二甲氧基苯乙基)氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物18)和2,5-二氯-3-(3,4-二甲氧基苯乙基)氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物19)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入3,4-二甲氧基苯乙胺(53mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:10),得到紫红色固体(化合物18)30mg,产率:24%;紫色固体(化合物19)55mg,产率43%。
化合物18的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.41(s,1h),7.28(s,1h),7.22(d,j=7.5hz,1h),7.12(m,2h),6.85(d,j=8.1hz,1h),6.82-6.73(m,2h),5.98(s,1h),4.08(q,j=6.8hz,2h),3.90(s,3h),3.87(s,3h),2.94(t,j=7.0hz,2h),2.31(s,3h);13cnmr(100mhz,chloroform-d)δ176.3,176.0,149.3,148.1,142.4,141.5,137.7,135.3,134.4,130.1,127.2,122.0,120.9,120.5,120.3,112.0,111.6,110.7,106.2,55.9,55.9,46.2,36.8,14.1;esi-tof-hrms:m/zcalcdfor(m+h)c25h23n2o4cl2,485.1029;found,485.1048.
化合物19的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.21(s,1h),7.33(d,j=7.9hz,1h),7.19-7.16(m,1h),7.14(d,j=2.2hz,1h),7.13-7.07(m,1h),6.82(d,j=8.1hz,1h),6.76(dd,j=8.1,1.9hz,1h),6.73(d,j=1.8hz,1h),6.00(s,1h),4.13-4.00(m,2h),3.86(d,j=2.7hz,6h),2.92(t,j=7.0hz,2h),2.31(s,3h);13cnmr(100mhz,chloroform-d)δ179.6,172.5,149.3,148.1,143.7,142.7,135.9,135.3,130.0,127.1,121.9,120.9,120.4,119.4,111.9,111.6,110.9,106.6,104.5,55.9,55.9,36.7,13.7;esi-tof-hrms:m/zcalcdfor(m+h)c25h23n2o4cl2,485.1029;found,485.1021.
实施例10
合成2-(2-(1h-吲哚-2-乙基)氨基)-3,6-二氯-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物20)和2-(2-(1h-吲哚-2-乙基)氨基)-3,5-二氯-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物21)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入色胺(47mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(二氯甲烷),得到橙红色固体(20)48mg,产率:36%;深紫色固体(21)68mg,产率51%。
化合物20的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.31(s,1h),8.11(s,1h),7.63(d,j=7.8hz,1h),7.41-7.37(m,1h),7.28(s,1h),7.25-7.19(m,2h),7.19-7.07(m,4h),6.04(s,1h),4.16(t,j=5.7hz,2h),3.17(t,j=6.7hz,2h),2.30(s,3h);13cnmr(100mhz,chloroform-d)δ176.3,176.1,142.6,141.6,137.8,136.6,135.3,134.2,127.2,126.9,122.7,122.6,121.9,120.5,120.3,119.7,118.6,111.6,111.5,110.8,106.1,44.9,26.7,14.1;esi-tof-hrms:m/zcalcdfor(m+h)c25h20n3o2cl2,464.0927;found,464.0916.
化合物21的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.20(s,1h),8.04(s,1h),7.61(d,j=7.9hz,1h),7.37(d,j=8.1hz,1h),7.31(d,j=8.0hz,1h),7.24-7.19(m,1h),7.18-7.13(m,2h),7.13-7.04(m,3h),6.08(s,1h),4.21-4.07(m,2h),3.15(t,j=6.7hz,2h),2.27(s,3h);13cnmr(100mhz,chloroform-d)δ179.7,172.6,143.8,142.8,136.5,135.9,135.3,135.2,127.1,126.9,122.7,122.4,121.9,120.4,119.7,119.5,118.5,111.5,111.4,110.9,104.5,44.7,26.6,13.6;esi-tof-hrms:m/zcalcdfor(m+h)c25h20n3o2cl2,464.0927;found,464.0929.
实施例11
合成叔丁基(2-(2,5-二氯-4-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己基-1,4-二烯-1-基氨基)乙基氨基甲酸酯(化合物22)和叔丁基(2-(2,4-二氯-5-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己基-1,4-二烯-1-基氨基)乙基氨基甲酸酯(化合物23)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入n-boc乙二胺(47mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:乙酸乙酯=3:1),得到橙红色固体(化合物22)32mg,产率:24%;深紫色固体(化合物23)57mg,产率42%。
化合物22的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.47(s,1h),7.27-7.20(m,2h),7.17-7.06(m,2h),6.44(s,1h),4.85(s,1h),3.93(q,j=5.9hz,2h),3.44(q,j=5.9hz,2h),2.29(s,3h),1.47(s,9h);13cnmr(100mhz,chloroform-d)δ176.2,176.1,156.7,142.9,141.2,137.8,135.3,134.5,127.2,121.9,120.5,120.3,110.8,108.0,106.1,80.2,45.9,40.9,28.4,14.1;esi-tof-hrms:m/zcalcdfor[m+h]+c22h24n3o4cl2,464.1138;found,464.1141.
化合物23的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.21(s,1h),7.33(d,j=8.0hz,1h),7.20-7.14(m,2h),7.13-7.07(m,1h),6.47(s,1h),4.79(s,1h),3.94(q,j=5.6hz,2h),3.43(q,j=6.0hz,2h),2.32(s,3h),1.43(s,9h);13cnmr(100mhz,chloroform-d)δ179.6,172.4,156.7,143.5,143.3,135.8,135.3,135.2,127.1,121.9,120.4,119.5,110.8,106.9,104.6,80.2,45.9,40.8,28.3,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c22h24n3o4cl2,464.1138;found,464.1142.
实施例12
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-吗啉环己烷-2,5-二烯-1,4-二酮(化合物24)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-吗啉环己烷-2,5-二烯-1,4-二酮(化合物25)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入吗啉(25mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:乙酸乙酯=3:1),得到红色固体(化合物24)38mg,产率:34%;紫色固体(化合物25)51mg,产率45%。
化合物24的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.33(s,1h),7.28(d,j=7.7hz,1h),7.21(d,j=7.7hz,1h),7.18-7.07(m,2h),3.93-3.82(m,4h),3.66-3.56(m,4h),2.31(s,3h);13cnmr(100mhz,dmso-d6)δ177.1,176.5,148.7,138.8,137.8,137.5,135.8,127.5,121.2,119.9,119.7,118.6,111.4,104.9,67.4,51.7,13.8;esi-tof-hrms:m/zcalcdfor[m+h]+c19h17n2o3cl2,391.0611;found,391.0626.
化合物25的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.46(s,1h),7.31(d,j=8.0hz,1h),7.24(d,j=7.9hz,1h),7.04(t,j=7.5hz,1h),6.95(t,j=7.5hz,1h),3.71-3.70(m,4h),3.51-3.50(m,4h),2.27(s,3h);13cnmr(100mhz,dmso-d6)δ180.3,173.4,149.6,139.1,138.3,137.4,135.8,127.5,121.2,120.1,119.7,116.9,111.3,104.7,67.4,51.9,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c19h17n2o3cl2,391.0611;found,391.0612.
实施例13
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(炔基-2-氨基-1-氨基)环己烷-2,5-二烯-1,4-二酮(化合物26)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(炔基-2-氨基-1-氨基)环己烷-2,5-二烯-1,4-二酮(化合物27)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入炔丙胺(16mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物26)27mg,产率:26%;深紫色固体(化合物27)42mg,产率40%。
化合物26的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.54(s,1h),7.66-7.63(m,1h),7.32(d,j=7.7hz,1h),7.15(d,j=7.4hz,1h),7.05(t,j=7.1hz,1h),6.97(t,j=7.1hz,1h),4.43(d,j=4.5hz,2h),3.29(s,1h),2.26(s,3h);13cnmr(101mhz,dmso-d6)δ175.93,175.92,143.4,140.4,138.3,135.8,134.9,127.5,121.3,120.2,119.8,111.4,107.7,105.4,81.8,75.1,34.2,13.9;esi-tof-hrms:m/zcalcdfor[m+h]+c18h13n2o2cl2,359.0349;found,359.0344.
化合物27的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.33(s,1h),7.33(d,j=7.8hz,1h),7.19-7.09(m,3h),5.92(s,1h),4.58(dd,j=6.0,2.3hz,2h),2.41(t,j=2.3hz,1h),2.31(s,3h);13cnmr(151mhz,chloroform-d)δ179.3,172.6,143.0,142.1,135.9,135.6,135.3,127.1,122.0,120.5,119.5,110.8,109.0,104.5,79.0,73.6,34.9,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c18h13n2o2cl2,359.0349;found,359.0343.
实施例14
合成4-(2,5-二氯-4-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己烷-1,4-二烯-1-基)哌嗪-1-甲醛(化合物28)和4-(2,4-二氯-5-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己烷-1,4-二烯-1-基)哌嗪-1-甲醛(化合物29)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入哌嗪-1-甲醛(34mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:乙酸乙酯=1:1),得到深红色固体(化合物28)19mg,产率:16%;深紫色固体(化合物29)39mg,产率32%。
化合物28的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.52(s,1h),8.09(s,1h),7.32(d,j=8.0hz,1h),7.12(d,j=7.9hz,1h),7.05(t,j=7.5hz,1h),6.97(t,j=7.5hz,1h),3.63-3.40(m,8h),2.25(s,3h);13cnmr(100mhz,dmso-d6)δ177.2,176.5,161.6,148.9,138.7,137.7,137.6,135.8,127.5,121.2,119.9,119.8,119.7,111.4,104.9,51.8,50.7,46.1,40.7,13.7;esi-tof-hrms:m/zcalcdfor([m+h]+c20h18n3o3cl2,418.0720;found,418.0717.
化合物29的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.47(s,1h),8.06(s,1h),7.31(d,j=8.1hz,1h),7.25(d,j=8.0hz,1h),7.05(t,j=7.6hz,1h),6.96(t,j=7.5hz,1h),3.57–3.39(m,8h),2.27(s,3h);13cnmr(101mhz,dmso-d6)δ180.3,173.6,161.6,149.8,138.9,138.4,137.5,135.8,127.5,121.2,120.1,119.7,118.3,111.3,104.6,52.0,50.9,46.1,40.6,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c20h18n3o3cl2,418.0720;found,418.0716.
实施例15
合成2-(丁基)-3,6-二氯-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物30)和2-(丁基)-3,5-二氯-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物31)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入正丁胺(21mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物30)27mg,产率:25%;深紫色固体(化合物31)33mg,产率30%。
化合物30的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.52(s,1h),7.48(t,j=6.5hz,1h),7.31(d,j=8.0hz,1h),7.14(d,j=7.8hz,1h),7.05(t,j=7.4hz,1h),6.96(t,j=7.2hz,1h),3.68(q,j=7.0hz,2h),2.25(s,3h),1.64-1.57(m,2h),1.39-1.30(m,2h),0.92(t,j=7.3hz,3h);13cnmr(100mhz,dmso-d6)δ176.2,175.5,143.9,140.9,138.3,135.8,134.5,127.6,121.2,120.2,119.8,111.4,105.7,105.0,44.1,33.5,19.8,14.2,13.9.esi-tof-hrms:m/zcalcdfor[m+h]+c19h19n2o2cl2,377.0818;found,377.0811.
化合物31的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.39(s,1h),7.32(d,j=7.9hz,1h),7.24-7.01(m,3h),5.97(s,1h),3.81(q,j=6.9hz,2h),2.31(s,3h),1.69-1.62(m,2h),1.47-1.37(m,2h),0.97(t,j=7.3hz,3h);13cnmr(101mhz,chloroform-d)δ179.8,172.5,143.9,142.8,135.8,135.3,135.2,127.1,121.9,120.4,119.4,110.8,106.1,104.6,44.7,32.9,19.8,13.7,13.6;esi-tof-hrms:m/zcalcdfor[m+h]+c19h19n2o2cl2,377.0818;found,377.0812.
实施例16
合成2,5-二氯-3-(异丙氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物32)和2,6-二氯-3-(异丙氨基)-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物33)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于甲苯中,再加入异丙胺(17mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物32)25mg,产率:24%;深紫色固体(化合物33)34mg,产率32%。
化合物32的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.45(s,1h),7.30-7.19(m,2h),7.12-7.07(m,2h),5.95-5.69(m,1h),4.81-4.72(m,1h),2.24(s,3h),1.34(d,j=6.3hz,6h);13cnmr(100mhz,chloroform-d)δ176.5,176.3,141.7,141.6,137.9,135.3,134.2,127.2,121.9,120.5,120.3,110.8,106.6,106.2,46.0,24.37,24.35,14.1;esi-tof-hrms:m/zcalcdfor[m+h]+c18h17n2o2cl2,363.0662;found,363.0662.
化合物33的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.42(s,1h),7.32(d,j=7.9hz,1h),7.19-7.08(m,3h),5.85(d,j=7.4hz,1h),4.81-4.70(m,1h),2.31(s,3h),1.31(d,j=6.2hz,6h);13cnmr(100mhz,chloroform-d)δ179.8,172.6,143.9,141.9,135.9,135.3,135.2,127.1,121.9,120.4,119.4,110.9,105.7,104.6,45.9,24.34,24.32,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c18h17n2o2cl2,363.0662;found,363.0657.
实施例17
合成2,5-二氯-3-(乙基氨基)-6-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物34)和2,6-二氯-3-(乙基氨基)-5-(2-甲基-1h-吲哚-3-基)环己烷-2,5-二烯-1,4-二酮(化合物35)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于甲苯中,再加入乙胺(13mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:3),得到深棕色固体(化合物34)28mg,产率:28%;深紫色固体(化合物35)30mg,产率30%。
化合物34的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.37(s,1h),7.33-7.20(m,2h),7.12(t,j=7.9hz,2h),5.89(s,1h),4.00-3.71(m,2h),2.30(s,3h),1.35(t,j=7.0hz,3h);13cnmr(100mhz,chloroform-d)δ176.4,176.2,142.4,141.7,137.8,135.4,134.3,127.2,121.9,120.5,120.3,110.8,107.1,106.2,40.0,16.3,14.0;esi-tof-hrms:m/zcalcdfor[m+h]+c17h15n2o2cl2,349.0505;found,349.0501.
化合物35的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.38(s,1h),7.32(d,j=7.9hz,1h),7.22–7.00(m,3h),5.92(s,1h),3.92-3.83(m,2h),2.31(s,3h),1.32(t,j=7.2hz,3h);13cnmr(100mhz,chloroform-d)δ179.7,172.6,143.9,142.7,135.9,135.3,135.1,127.1,121.9,120.4,119.4,110.9,106.0,104.6,39.9,16.3,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c17h15n2o2cl2,349.0505;found,349.0500.
实施例18
合成2,5-二氯-3-(2-甲基-1h-吲哚-3-基)-6-(甲胺基)环己烷-2,5-二烯-1,4-二酮(化合物36)和2,6-二氯-3-(2-甲基-1h-吲哚-3-基)-5-(甲胺基)环己烷-2,5-二烯-1,4-二酮(化合物37)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于甲苯中,再加入乙胺(9mg,0.293mmol),室温搅拌过夜,减压除去溶剂,硅胶柱纯化(石油醚:二氯甲烷=1:10),得到深棕色固体(化合物36)26mg,产率:27%;深紫色固体(化合物37)31mg,产率32%。
化合物36的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,dmso-d6)δ11.51(s,1h),7.65-7.41(m,1h),7.31(d,j=7.4hz,1h),7.13(d,j=7.1hz,1h),7.08-7.01(m,1h),7.00-6.90(m,1h),3.26(d,j=4.3hz,3h),2.25(s,3h);13cnmr(100mhz,dmso-d6)δ176.2,175.3,144.9,140.8,138.1,135.8,134.4,127.6,121.2,120.2,119.8,111.3,105.7,105.3,32.7,13.9;esi-tof-hrms:m/zcalcdfor[m+h]+c16h13n2o2cl2,355.0349;found,355.0342.
化合物37的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.33(s,1h),7.32(d,j=7.7hz,1h),7.16(t,j=7.5hz,2h),7.13–7.05(m,1h),6.01(s,1h),3.41(d,j=5.4hz,3h),2.30(s,3h);13cnmr(100mhz,chloroform-d)δ179.7,172.6,143.9,143.4,135.8,135.3,135.1,127.1,121.9,120.4,119.4,110.9,106.3,104.6,32.5,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c16h13n2o2cl2,355.0349;found,355.0343.
实施例19
合成2-(2,5-二氯-4-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己基-1,4-二烯-1-基)氨基)富马酸乙酯(化合物38)和2-(2,4-二氯-5-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己基-1,4-二烯-1-基)氨基)富马酸乙酯的合成(化合物39)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入乙醇胺(18mg,0.293mmol),室温搅拌过夜,减压除去溶剂,抽干,n2保护下加入富马酸单甲酯(45mg,0.352mmol),edci(84mg,0.439mmol),hobt(59mg,0.439mmol),tea(88mg,0.897mmol),最后加入无水dcm,室温搅拌18h,盐水洗涤,dcm萃取,无水硫酸钠干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=1:2),得到深棕色固体(化合物38)26mg,产率:29%;深紫色固体(化合物39)33mg,产率32%。
化合物38的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.32(s,1h),7.30(d,j=7.9hz,1h),7.22(d,j=7.7hz,1h),7.17-7.09(m,2h),6.91(s,2h),6.09(s,1h),4.48(t,j=5.2hz,2h),4.17(q,j=5.7hz,2h),3.82(s,3h),2.34(s,3h);13cnmr(100mhz,chloroform-d)δ176.2,176.1,165.1,164.8,142.1,141.3,137.8,135.3,134.7,134.4,132.8,127.1,122.0,120.6,120.3,110.8,108.3,106.1,64.4,52.5,43.7,14.2;esi-tof-hrms:m/zcalcdfor[m+h]+c22h19n2o6cl2,477.0615;found,477.0613.
化合物39的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.31(s,1h),7.33(d,j=7.8hz,1h),7.18-7.08(m,3h),6.87(s,2h),6.12(s,1h),4.45(t,j=5.1hz,2h),4.14(q,j=5.6hz,2h),3.80(s,3h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ179.5,172.6,165.1,164.8,143.3,142.5,135.9,135.5,135.3,134.3,132.7,127.0,122.0,120.5,119.5,110.8,107.8,104.5,64.2,52.5,43.6,13.7;esi-tof-hrms:m/zcalcdfor[m+h]+c22h19n2o6cl2,477.0615;found,477.0606.
实施例20
合成2-(4-(2,5-二氯-4-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己烷-1,4-二烯-1-基)哌嗪-1-基)富马酸乙酯(化合物40)和2-(4-(2,5-二氯-4-(2-甲基-1h-吲哚-3-基)-3,6-二氧环己烷-1,4-二烯-1-基)哌嗪-1-基)富马酸乙酯的合成(化合物41)
参照下述合成路径:
具体地,化合物3(100mg,0.293mmol)溶于乙腈中,再加入哌嗪乙醇(38mg,0.293mmol),室温搅拌过夜,减压除去溶剂,抽干,n2保护下加入富马酸单甲酯(45mg,0.352mmol),edci(84mg,0.439mmol),hobt(59mg,0.439mmol),tea(88mg,0.897mmol),最后加入无水dcm,室温搅拌18h,盐水洗涤,dcm萃取,无水硫酸钠干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=1:1),得到紫红色固体(化合物40)40mg,产率:28%;深紫色固体(化合物41)56mg,产率35%。
化合物40的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.38(s,1h),7.29(dt,j=8.1,0.9hz,1h),7.23-7.18(m,1h),7.17-7.07(m,2h),6.90(d,j=1.4hz,2h),4.38(t,j=5.7hz,2h),3.83(s,3h),3.61(t,j=4.8hz,4h),2.76(t,j=5.7hz,2h),2.72(t,j=4.8hz,4h),2.32(s,3h);13cnmr(100mhz,chloroform-d)δ177.10,177.08,165.4,164.9,147.7,139.4,137.2,137.1,135.3,133.6,127.1,121.9,120.5,120.1,120.1,110.8,108.2,105.6,62.4,56.5,53.9,52.4,51.2,14.0;esi-tof-hrms:m/zcalcdfor[m+h]+c26h26n3o6cl2,546.1193;found,546.1170.
化合物41的结构经核磁共振氢谱碳谱及质谱确证:1hnmr(400mhz,chloroform-d)δ8.31(s,1h),7.33(dt,j=8.0,1.0hz,1h),7.22-7.14(m,2h),7.13-7.08(m,1h),6.87(d,j=1.1hz,2h),4.35(t,j=5.7hz,2h),3.81(s,3h),3.58(dd,j=6.1,4.0hz,4h),2.74(d,j=5.6hz,2h),2.72–2.60(m,4h),2.35(s,3h);13cnmr(100mhz,chloroform-d)δ180.9,173.6,165.4,164.8,148.5,141.2,137.4,135.8,135.3,133.6,132.3,127.1,122.0,120.5,119.5,118.6,110.8,105.3,62.4,56.5,53.9,52.4,51.4,13.8;esi-tof-hrms:m/zcalcdfor[m+h]+c26h26n3o6cl2,546.1193;found,546.1206.
实验例1
本发明实施例制备得到的化合物4-化合物41进行体外抗菌活性研究
以mrsa252标准株为考察对象,采用微孔二倍稀释法,调整细菌浓度为105cfu/ml,接种于96孔无菌培养板内。化合物4-41分别以dmso溶解,配制成适宜浓度溶液。分别吸取各化合物dmso溶液4μl加入至含196μl菌液培养孔内,后面微孔各加入100μl菌液,依次倍比稀释8个浓度,置37℃培养箱孵育24h。药物对细菌的最低抑菌浓度(mic)为24h后抑制细菌肉眼可见生长的最低药物浓度;在读取mic结果后,分别移取各组药物阴性孔(清亮)液体50μl,以曲玻棒均匀涂布于mha琼脂平板表面,然后将琼脂平板置于恒温培养箱于37℃孵育24小时;取出平板读取菌落个数,分别计算对应孔内细菌数量,根据2019年clsi药敏实验规定,能够杀死>99.9%初始细菌含量(<100cfu/ml)的最低药物浓度为最低杀菌浓度(mbc)。结果参加表1。
表1目标化合物对mrsa252标准株的mic和mbc
根据上表可知,化合物4,5,6,24,26,28,29和35显示出较好的抗mrsa体外活性,其中抗菌活性最好的化合物4对mrsa252标准株mic为2mg/l,mbc为4mg/l。
实验例2
进一步地本发明实施例制备得到的化合物4(下文即为c4)对不同地区mrsa临床菌株的抗菌活性,mic、mbc方法同上,结果见表2。
表2化合物4对不同地区mrsa临床株的mic、mbc
结果表明,c4对来源于北京、广州、济南、重庆及石家庄等9株mrsa临床株mic范围为2-8mg/l,mbc范围为4-32mg/l
实验例3
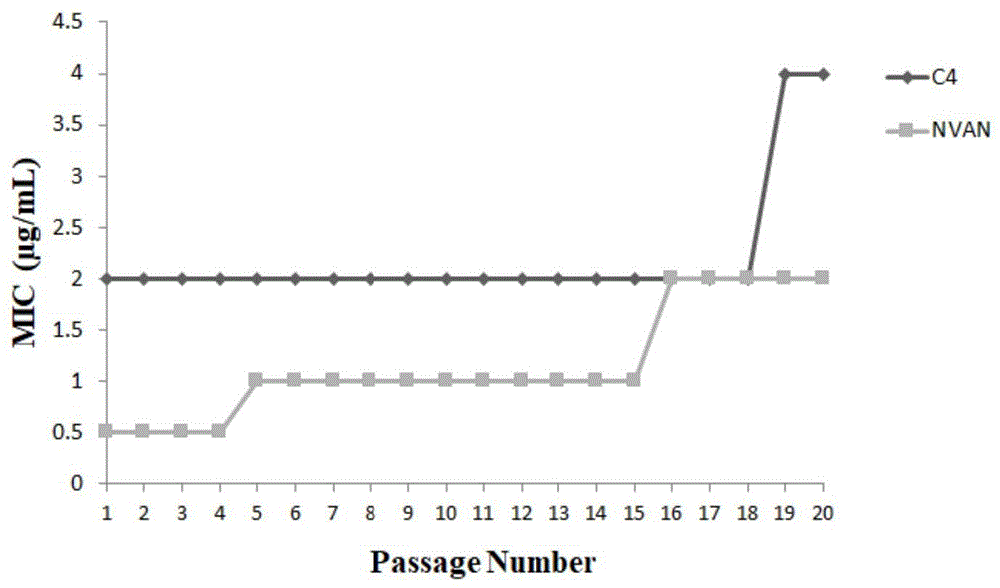
c4诱导mrsa252耐药实验
以去甲万古霉素为对照,考察c4对mrsa耐药性的诱导作用。采用微孔稀释法,调整细菌浓度为105cfu/ml,接种于96孔无菌培养板内。c4以dmso溶解,配制成1.6mg/ml溶液,去甲万古霉素以mh溶解,配制成1.6mg/ml溶液,分别以菌液稀释至96孔板,依次倍比稀释8个浓度,均为32、16、8、4、2、1、0.5、0.25mg/l,置37℃培养箱孵育24h,读取mic值,取最高浓度阳性孔中(亚mic浓度孔板)中菌液继续培养,重复上述mic测定步骤,共重复20次,观察两种药物mic增加情况。
检测结果参见图1,根据图1可知,c4在18次实验中mic并未增加,保持在2mg/l,说明c4不易诱导mrsa产生耐药性;而去甲万古霉素(nvan)在16次实验中mic由0.5mg/l升至2mg/l,增加了4倍,代表细菌产生耐药性。
实验例4c4抗mrsa活性体内研究
(1)c4对mrsa脓毒血症致死小鼠模型体内药效学评价
将mrsa252标准株以三线法接种于mha固体培养基,37℃培养过夜。挑取mrsa252单菌落接种于20mlmhb液体培养基中,37℃、80rpm振荡培养过夜,再按1﹕100比例,37℃、220rpm二次活化6h。将培养后的细菌离心(3000rpm,5min),弃上清,以生理盐水洗涤3次,再用适量生理盐水混悬,以紫外分光光度计测定悬液od600,生理盐水调节使细菌悬浮液浓度为6×109cfu/ml,每只小鼠攻毒时给予静脉注射0.1ml细菌悬液。
选择6-8周龄雌性balb/c小鼠(18-22g),随机分为4组,每组10只,分别为空白对照、溶剂对照、5mg/kg及10mg/kg给药组。c4以5%蓖麻油溶解,溶剂对照组及各给药组小鼠给药方式为0.1ml腹腔注射,给药方案为攻毒前一天开始给药,每天两次,攻毒后3天停止给药,观察各组小鼠攻毒后7天存活情况,绘制生存率曲线。
结果参见图2,根据图2可知,空白组小鼠攻毒三天内全部死亡,溶剂对照组攻毒7天生存率为10%,5mg/kg给药组生存率为60%,而10mg/kg给药组生存率则达到了100%,表明c4对mrsa脓毒症模型小鼠具有显著的保护作用,且存在剂量依赖关系,证明了c4具有极佳的体内抗mrsa活性。
(2)c4对mrsa体内亚致死感染小鼠动物模型体内药效学评价
将mrsa252标准株以三线法接种于mha固体培养基,37℃培养过夜。挑取mrsa252单菌落接种于20mlmhb液体培养基中,37℃、80rpm振荡培养过夜,再按1﹕100比例,37℃、220rpm二次活化6h。将培养后的细菌离心(3000rpm,5min),弃上清,以生理盐水洗涤3次,再用适量生理盐水混悬,以紫外分光光度计测定悬液od600,生理盐水调节使细菌悬浮液浓度为1×109cfu/ml,每只小鼠攻毒时给予静脉注射0.1ml细菌悬液。
选择6-8周龄雌性balb/c小鼠(18-22g),随机分为4组,每组8只,分别为空白对照、溶剂对照、5mg/kg及10mg/kg给药组。c4以5%蓖麻油溶解,溶剂对照组及各给药组小鼠给药方式为0.1ml腹腔注射,给药方案为攻毒前一天开始给药,每天两次,攻毒后给药3天。感染72小时后将小鼠全部处死,取眼球血、脾脏和肾脏。眼球血加入pbs稀释,肾脏、脾脏各加入1mlpbs研磨后,按不同比例稀释。分别取各稀释浓度2μl点于mha固体培养基平板,于37℃,培养24h后计数,以最低稀释倍数为准。
结果参见图3,根据图3可知,c4在10mg/kg给药剂量时可以显著减少亚致死模型小鼠肾脏、脾脏的细菌定植量,说明c4可以有效缓解体内mrsa感染。
(3)c4对mrsa皮肤感染小鼠模型药效学评价
将mrsa252标准株以三线法接种于mha固体培养基,37℃培养过夜。挑取mrsa252单菌落接种于20mlmhb液体培养基中,37℃、80rpm振荡培养过夜,再按1﹕100比例,37℃、220rpm二次活化6h。将培养后的细菌离心(3000rpm,5min),弃上清,以生理盐水洗涤3次,再用适量生理盐水混悬,以紫外分光光度计测定悬液od600,生理盐水调节使细菌悬浮液浓度为2×109cfu/ml。
选择6-8周龄雌性balb/c小鼠(18-22g),随机分为4组,每组6只,分别为空白组(1-剥皮后不处理)、溶剂对照组(2-剥皮后给予溶剂处理)、感染组(3-剥皮后给予菌液感染+溶剂处理)及感染给药组(4-剥皮后给予菌液感染+药物处理),c4以20%蓖麻油为溶剂配置成5mg/ml药液。各组小鼠麻醉后切去1×1cm2背部皮肤形成创面,感染组及感染给药组剥皮后立即给予20μl菌液,给菌2h后溶剂对照组、感染组给予20μl溶剂(20%蓖麻油),感染组给予20μl药液。之后每天给予溶剂或药液处理一次,观察创面愈合情况,并在感染1、3、5、7天以棉签刮取小鼠创面粘液于1ml生理盐水,稀释成不同倍数。分别取不同稀释倍数溶液2μl点于mha平板,37℃培养过夜,进行菌落计数,以最低稀释倍数菌落数为准计算含菌量。
检测结果参见图4-图5,c4处理小鼠愈合较好,创面感染情况明显好转(图4),给药组小鼠创面含菌量明显低于感染组(图5),说明c4能够对mrsa皮肤感染小鼠起到治疗作用。
实验例5c4对mrsa生物膜形成的影响研究
(1)用结晶紫染色法观察c4对mrsa生物膜形成量的影响
调整mrsa菌液浓度为105cfu/ml,接种于96孔无菌培养板内,将1mg/mlc4dmso溶液以mh培养液稀释十倍,得到100mg/lc4溶液,移取该溶液20μl加入96孔板内180μl菌液中,得到1mg/l(0.5×mic)浓度c4菌液,以不加c4菌液作为对照,设置6复孔,于37℃条件下培养24h。吸出菌液,分别以ddh2o轻柔洗涤各孔2次,自然风干。每孔加入0.1%的结晶紫200μl,染色30min,吸出结晶紫,以生理盐水清洗各孔,至上清液无色,自然风干。各孔加入200μl33%醋酸溶液,于酶标仪上振荡混匀,590nm波长测定od值。
检测结果参见图6,根据图6可知,c4处理组od590值显著低于对照组,初步说明c4可以抑制mrsa生物膜形成量。
(2)扫描电镜观察c4对影响mrsa生物膜形成表面结构的影响
调整mrsa菌液浓度为107cfu/ml,接种于放入环氧乙烷灭菌的聚苯乙烯塑料片(1cm×1cm)的24孔细胞培养皿内。分别配制0.5mg/ml与1mg/mlc4dmso溶液,分别以mh培养液稀释十倍,得到50mg/l与1mg/mlc4溶液。分别移取0.2ml两个浓度c4溶液于24孔板中1.8ml菌液内,得到0.5mg/l(0.25×mic)与1mg/l(0.5×mic)浓度c4菌液,以不加c4菌液作为对照,放入37℃恒温箱培养24h。将各组塑料片小心取出,以生理盐水轻柔洗涤,之后依次用梯度乙醇、正丁醇脱水,将塑料片固定于载体表面,co2冷冻干燥5h,载体表面在真空条件下镀金粉。将载体置于扫描电镜下观察,每个标本均分四个象限观察,每个象限随机观察3个视野。
检测结果参见图7,结果表明,细菌对照组(mhbroth)细菌生物膜生长良好,而0.5mg/l(0.25×mic)c4处理组细菌生物膜被破坏,细菌间隙增多,1mg/l(0.5×mic)c4处理组细菌生物膜进一步遭到破坏,菌量明显减少。
(3)用激光共聚焦观察c4对mrsa生物膜形成三维结构的影响
荧光染液的配制:l-7012live/deadbaclightbacterialviabilitykit试剂盒含有两种荧光染液syto9和pi,syto9可使活菌发出绿色荧光,pi则可使死菌发出红色荧光,可以在镜下区分活菌和死菌。荧光染液的配制按syto9:pi:蒸馏水=4μl:4μl:1ml的比例将3种试剂加入同一离心管,振荡混匀备用。
生物膜样本的制备:c4处理组与菌液对照组菌液培养及处理方法同上(扫描电镜实验)。将培养过后各组塑料片小心取出,用生理盐水轻柔洗去除黏附松散细菌,重复两次,吸干水分后分别加入100μl上述荧光染液,于室温、黑暗环境中孵育15min,吸出荧光染料,以生理盐水轻柔洗涤两次,黑暗环境中自然风干。
封片:黑暗环境下,在载玻片上滴加10μlp-苯二胺抗淬灭剂(90%甘油,10%pbs液,ph为8.5-9.0,其中p-苯二胺浓度为2.7mm),盖上风干的生物膜塑料片,4℃避光存放并立即镜检。
激光共聚焦扫描显微镜观察:将上述标本倒置于激光共聚焦扫描显微镜下观察。其中死菌为红色,活菌为绿色。每个生物膜标本由外(生物膜游离的一面)向内(生物膜和聚苯乙烯塑料片相贴的一面)逐层沿z轴扫描,步距(z轴)为1μm。得到断层扫描图像。每个标本均分四个象限观察,每个象限随机观察3个视野。
图像分析:通过专业软件处理得到生物膜的厚度,将各断层扫描图像应用软件进行组合,得到变链菌生物膜的三维图像。并应用image图像分析软件分别计算死菌和活菌连续扫描图像最内层、中间层及最外层红光和绿光面积,其分别代表生物膜内层、中间层及外层的情况,对死菌和活菌进行计数,计算细菌密度、死活菌百分比。计算公式分别为:
每层细菌密度=(每层红光+绿光面积的总和)变链菌/每层生物膜面积
每层活菌百分比=[每层绿光面积/(每层红光+绿光面积的总和)]×100%
检测结果参见图8,结果表明c4处理组细菌密度较低,死细胞百分比明显高于对照组(mhbroth)。
实验例6c4安全性评价研
(1)c4急性毒性试验研究
选择6-8周龄昆明小鼠,分为5组,每组6只,雌雄各半。c4以5%蓖麻油+4%dmso的生理盐水混合溶液为溶剂溶解、稀释成不同浓度。五组小鼠分别按照750、600、476、378、300mg/kg剂量腹腔注射给予c4溶液,给药体积为0.2ml,观察记录给药后小鼠14天内存活情况,结果见表3。
表3c4急性毒性实验结果
结果表明,300mg/kg剂量组小鼠在14天内全部存活,而实施例3中10mg/kg剂量c4即可对脓毒症感染小鼠达到100%保护率,说明c4具有较高的安全性。
(2)c4溶血研究
将balb/c小鼠眼球取血,以肝素钠抗凝管收集。于冷冻离心机中3000rpm,4℃离心5min,弃上层血清及表面白细胞,留沉淀的红细胞用生理盐水洗涤2次,3000rpm,4℃离心至上清不显红色,取适量红细胞加入生理盐水制得2%红细胞悬液。
c4以0.8%dmso生理盐水溶液溶解,配制得到64、32与16μg/ml溶液。分别将生理盐水(阴性对照)、蒸馏水(阳性对照)、64、32与16μg/mlc4溶液与等体积2%红细胞悬液混匀,则c4混匀后浓度为32、16和8μg/ml。将各组混合溶液置于37℃恒温箱孵育3h,取出后1000rpm离心10min,分别取上清液100μl于96孔板,设置3复孔,于酶标仪检测od570。
检测结果参见图9,根据图9可知,32μg/ml(16倍mic)浓度条件下c4溶血效应较弱,说明c4具有较好的生物安全性。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!